Книга: Введение в трансплантологию
Введение в трансплантологию
Compilated by Virus
Настоящий обзор основных вопросов трансплантологии в первую очередь предназначен для студентов-медиков, при этом подразумевается владение понятийными аппаратами патофизиологии, патологической анатомии, фармакологии, а также знание основ микробиологии и иммунологии с иммуногенетикой. Так как лечение трансплантацией стало возможным в результате широкой междисциплинарной кооперации, то представлялось рациональным дать общее представление об этой интенсивно развивающейся области медицины, иначе пришлось бы готовить «многотомную» серию методических материалов по одной теме - трансплантация с точки зрения иммунологии, хирургии, фармакологии и т.д.
Тем не менее, проблематика излагается на современном уровне, поэтому данное пособие может представлять интерес и для дипломированных специалистов. Последнее имеет актуальность еще и потому, что современные иммунодепрессанты широко применяются в клинической практике не только в трансплантологии (например, в ревматологии) и осложнения инфекционного характера (в первую очередь, связанные с иммунокомпрометацией пациента и активацией латентных вирусов) в этом смысле являются типовыми.
В рамках учебного пособия невозможно охватить все аспекты пересадок (например, не рассматривается пересадка костного мозга), однако кратко освещены морально-этические и юридические аспекты трансплантологии, так как специальное ознакомление с ними в процессе обучения не предполагается, а осведомленность в этих вопросах важна для студентов не только как будущих специалистов-медиков, но и просто образованных людей, граждан правового государства.
Современное состояние трансплантологии позволяет говорить о лечении трансплантацией, которое является единственно возможным лечением в терминальных стадиях хронических заболеваний. Иными словами, совершился переход от уникальных, но лишенных практического смысла хирургических операций - к технологии лечения. Эта технология к началу 90-х годов в Европе и Северной Америке уже могла гарантировать с вероятностью более 0,8 пятилетнее выживание трансплантата (в 60-х годах - годичное). К концу 90-х годов по британским данным полупериод жизни трупной почки составил в среднем 11-12 лет, а от живого донора - 26 лет. В структуре процесса лечения трансплантацией главное место занимают этапы, связанные, во-первых, с HLA-типированием и другими иммунологическими вопросами, и, во-вторых, - связанные собственно с операцией трансплантации и последующим ведением больного. Однако оба этих этапа могут осуществляться с заданной эффективностью результата при выполнении двух важных условий:
1) наличия юридической базы, регламентирующей лечение трансплантацией;
2) решения организационных задач, обеспечиваемых специальной службой.
Последняя должна быть представлена взаимодействующими региональными единицами (например, городской или областной центры) и их сеть должна охватывать достаточно большую территорию - в Европе это осуществляется в рамках национальных границ (например, «Франстрансплант») и далее - в межнациональном масштабе, например Евротрансплант (объединение трансплантационных служб Германии, Австрии, Нидерландов, Бельгии, Люксембурга, а с 2000 г. - и Словении). В Австралии и Новой Зеландии во взаимодействующую сеть объединены 23 трансплантационных центра. Главное, что наличие центра подразумевает работоспособную инфраструктуру трансплантационной службы, в деятельности которой счет времени идет порой буквально на секунды.
Бригада по изъятию донорских органов со своим оснащением должна быть готовой в любой момент суток выехать в клинику, где есть потенциальный донор, а врачи-реаниматологи любой клиники в радиусе действия центра должны работать с учетом потребностей Центра.
Вместе с бригадой по изъятию приступают к работе специалисты, осуществляющие тканевое типирование донора и проведение индивидуальных проб с сыворотками потенциальных реципиентов на наличие «лимфоцитотоксических» антител (т.н. cross-match) с одновременной диагностикой его возможной инфицированности ВИЧ, гепатитами и т.д.). Каждый донор в настоящее время, как правило, должен рассматриваться как мультиорганный и только в виде исключения - как донор только одного органа, например, почки или сердца. Это важно еще и потому, что постоянно растет количество полиорганных пересадок - как правило, это комплексы сердце-легкие, почки-поджелудочная железа, хотя есть пример пересадки одновременно шести органов - в 1993 г. в Великобритании больному Stephen Hyatt были пересажены желудок, 12-перстная кишка, печень, тонкий кишечник, поджелудочная железа и почки. По состоянию на январь 2000 г., ни один орган не отторгся.
Лист ожидания (waiting list) содержит сведения о людях, для которых трансплантация является единственной возможностью продлить жизнь. Так, по данным Евротранспланта, среди больных, ожидающих трансплантации почки и получающих периодически сеансы гемодиализа, в течение пяти лет умирает 66%. Занесение в лист ожидания подразумевает полное клинико-иммунологическое обследование, а также готовность больного в любое время подвергнуться операции трансплантации. При этом необходим оперативный и постоянно действующий (в любой момент суток) канал обмена информацией с другими Центрами. Для корректного подбора пары донор-реципиент уже не обойтись без специализированного программного обемпечения, позволяющего анализировать данные листов ожидания нескольких центров и выбирать из них наиболее подходящих реципиентов для имеющихся органов.
Следует отметить, что частота встречаемости приемлемого сочетания HLA-специфичностей у донора и реципиента в достаточно ограниченной популяции (такой как крупный город) невелика и необходим оперативный обмен органами между регионами (в Европе - между странами, в США - штатами). По данным почечных трансплантаций 1991 г., внутри страны было найдено подходящее сочетание: в Германии - в 81 %, в Австрии - в 55 %, в Бельгии - 52 %, в Голландии - в 43 %; до 100 % доля пересадок дополнялась за счет обмена между странами.
Даже без специального анализа видно, что возможности самообеспечения находятся в прямой зависимости от размера региона или государства (точнее, численности населения). «Опора на собственные силы» в трансплантологии однозначно приводит к меньшей степени иммуногенетической совместимости, что закономерно снижает срок выживания трансплантата и также закономерно повышает частоту различных осложнений.
Соответственно и транспортировка органов должна осуществляться регулярно и без проблем, а не как разовое действо героического оттенка. Евротрансплант, например, может использовать для этого ВВС НАТО.
Бригада хирургов-трансплантологов должна в любой момент суток встретить в Центре доставленный орган уже будучи готовой к операции и с подготовленным к ней реципиентом. После операции реципиент, в течение всей своей последующей жизни, должен регулярно наблюдаться и обследоваться соответствующими специалистами и получать индивидуально подобранную поддерживающую иммуносупрессивную и по необходимости другую терапию. Индивидуальный подбор, в частности, означает, что лечение проводится под контролем уровня препаратов в крови; кроме того, все шире начинает использоваться назначение препаратов с учетом носительства аллельных вариантов генов цитохрома р450.
Приведенные выше сведения должны дать только общее представление об инфраструктуре трансплантологии и не являются исчерпывающими. Изложение специальных вопросов автоматически создаст представления о сущности и других организационных задач.
Технология лечения трансплантацией сложилась не сразу и необходимость того или иного ее компонента будет понятной, если рассмотреть динамику развития трансплантологии. Однако начать стоит с современного состояния вопроса о правовом регулировании самой возможности пересадок органов.
За исключением трансплантации парного органа (как правило, почки) от живого донора, во всех остальных случаях возможность изъятия органов с целью их трансплантации появляется только после официального признания донора мертвым, т.е. должна быть констатирована биологическая смерть. Она наступает после необратимой остановки сердца или возникновения смерти мозга (СМ, см. раздел III.1).
Концепция СМ была впервые сформулирована французскими невропатологами в 1959 г. Ими был предложен термин «запредельная кома» для описания состояния организма, когда головной мозг, несмотря на реанимационные меры, полностью погибает, но вегетативные функции могут некоторое время поддерживаться искусственно. В дальнейшем этот термин был трансформирован в понятие СМ. В начале 80-х годов концепция СМ как биологической смерти индивидуума применительно к задачам трансплантации была законодательно закреплена во многих странах.
После остановки сердца можно использовать в качестве донорских органов только почки в короткий промежуток времени (15-20 мин). Остальные же органы пригодны для пересадки при условии изъятия их от людей с диагнозом смерти мозга.
В цивилизованных странах с высокоразвитым здравоохранением диагноз смерти мозга стал общепринятой нормой, а критерии СМ общепризнан. Необходимость ранней констатации СМ потенциального донора, сохраняющего при помощи технических систем жизнеобеспечения дыхание и кровообращение, во многом определяет эффективность последующей клинической трансплантации.
Констатацию смерти потенциального донора выполняют лечащие врачи и специалисты, никогда не являющиеся членами трансплантационной бригады, которая обеспечивает последующее изъятие донорских органов. Решение о наступлении СМ принимают независимые специалисты, исходя из интересов умирающего (донора), а не реципиента.
Эта процедура получила повсеместную практику, должным образом протоколируется в истории болезни больного и является обязательной и необходимой предпосылкой для подготовки потенциального донора к изъятию органов. Мировая практика показала, что при клиниках общего профиля целесообразно создавать «донорские центры», т.е. специализированные отделения, выполняющие комплекс лечебных мероприятий по поддержанию необходимого уровня функционирования организма неживого донора до прибытия бригады трансплантологов (non living donor, этот термин применяется для доноров после СМ, хотя используются и термины на основе «трупный» или «кадаверный»).
С 22 декабря 1992 года в России действует закон Российской Федерации «О трансплантации органов и (или) тканей человека», подписанный Президентом России Б.Н. Ельциным. (см. «Приложение»). До этого момента в России, а раньше в СССР диагноз СМ не признавался, т.е. трансплантология могла потенциально рассчитывать не на неживого донора, а на труп. Действовала принятая в 1977 г. МЗ СССР «Временная инструкция для определения биологической смерти и условий, допускающих изъятие почки для трансплантации», базирующаяся на специальном Постановлении Совета Народных Комиссаров «О порядке проведения медицинских операций» от 1937 г.
Биологическая смерть могла констатироваться только после проведения полного комплекса безрезультатных реанимационных мероприятий, а затем оформляться специальной комиссией с обязательным участием приглашаемого судмедэксперта. Считалось, что такое решение вопроса «…диктуется подлинно гуманной идеологией советского общества» («Пересадка…». БМЭ, 3-е изд., Т.19, М.: «Сов. Энциклопедия», 1982). По сути антигуманными признавались все пересадки, кроме трупных почек (и трупных роговиц). АкадемикБ.В. Петровский (как отмечено в его («визитке») - «инициатор развития в стране трансплантации почки (1965)» - в 1988 году поясняет: в пересадках таких органов как сердце, печень, легкие слишком много нерешенных вопросов и потому трансплантировать их «…пока преждевременно и вряд ли гуманно» (Петровский Б.В. Основные достижения современной хирургии. БМЭ, 3-е изд., Т.29 дополнит., М.: «Сов. Энциклопедия», 1988.
Однако мировая трансплантология придерживалась другого мнения и в том же 1988 г. «Евротрансплант», за исключением роговиц, сделал 3527 пересадок органов (в том числе 2736 почек, 400 сердец, 300 печеней, 18 легких, 5 комплексов сердце-легкие).
Мы не имеем возможности узнать, сколько пересадок почки было сделано в 1988 году в СССР (то есть в г. Москве, единичные операции honoris causa на периферии не в счет), но чтобы сделать столько же пересадок, как «Евротрансплант», пришлось бы делать по 15 трансплантаций каждые 2 дня без выходных и праздников. Однако даже без учета трансплантаций почки, с большим огрублением в пользу СССР, чья численность населения была примерно в 2,5 раза выше, чем в странах, входящих в «Евротрансплант», приблизительный подсчет показывает, что советский гуманизм только за один 1988 год лишил шансов на жизнь не менее 2000 больных.
Стоит отметить, что в 1999 г. «Евротрансплант» пересадил 12131 почек и 608 сердец.
Если же говорить о гуманизме по существу, то в цивилизованном мире одним из ярких его проявлений явилось пресечение коммерческих устремлений в трансплантологии. Первой страной, законодательно запретившей выплату любых вознаграждений или компенсаций за предоставление живыми донорами почек, была Италия (1967 г.). ВОЗ неоднократно рассматривала вопрос о недопустимости купли-продажи органов для трансплантации и в 1991 г. на 44-й сессии был утверждены «Основополагающие принципы трансплантации человеческих органов», которыми рекомендовано пользоваться странам-членам ВОЗ в своих национальных законодательствах. В настоящее время в законодательствах по меньшей мере 44-х государств в национальных законах содержатся положения, запрещающие куплю-продажу человеческих органов.
ОСНОВОПОЛАГАЮЩИЕ ПРИНЦИПЫТРАНСПЛАНТАЦИИ ЧЕЛОВЕЧЕСКИХ ОРГАНОВ
Органы и ткани (в дальнейшем именуемые в тексте «органы») могут извлекаться из тела умершего или живого человека в целях трансплантации только в соответствии со следующими основополагающими принципами.
Органы могут быть изъяты из тела умершего человека в целях трансплантации, если:
а) получено согласие всех лиц в соответствии с законом;
б) нет оснований полагать, что покойный возражал бы против удаления органов даже в случае отсутствия его официального согласия, данного при жизни.
Врачи, удостоверяющие факт смерти потенциального донора, не должны непосредственно участвовать в изъятии органа у донора или иметь отношение к лечению потенциальных реципиентов.
Органы для трансплантации следует извлекать предпочтительно из тела умерших людей. Однако возможно получение органов и от живых людей, причем, как правило, последние должны быть генетически родственны реципиенту. Исключения допускаются при трансплантации костного мозга и других приемлемых регенерирующих тканей.
Орган может быть изъят из тела взрослого живого донора в целях трансплантации только при добровольном согласии последнего. Донор должен быть свободен от какого-либо влияния и давления, он должен быть достаточно информирован, чтобы сознавать и оценивать риск, выгоду и последствия своего согласия.
В целях трансплантации нельзя изымать органы из тела живых несовершеннолетних лиц. Исключения допускаются только в рамках национального законодательства в случае пересадки регенерирующих тканей.
Тело или части тела человека не могут служить объектом коммерческих сделок. В соответствии с этим следует запретить любое предоставление или получение платы (а также другую компенсацию или вознаграждение) за органы.
Следует запретить любые объявления о спросе на органы или об их предоставлении за плату.
Врачам и другим медицинским работникам следует запретить любое участие в операциях по пересадке органов, если у них есть основания полагать, что используемые органы явились объектом коммерческой сделки.
Всем лицам и учреждениям здравоохранения, причастным к трансплантации органов, необходимо запретить взимать какую-либо плату, превышающую разумное вознаграждение за предоставленные услуги.
В свете принципов справедливого и равноправного распределения органов-трансплантатов следует обеспечить их доступность для пациентов только по медицинским показаниям, а не по финансовым и прочимсоображениям.
Не все национальные законодательства строго придерживаются этих принципов. Так, в Индии практикуется изъятие органов (одного из парных) от живых неродственных доноров за финансовое вознаграждение, а в Китае (КНР) используется, с согласия родственников, изъятие органов у лиц, приговоренных за преступления к смертной казни. В некоторых (но не всех) странах исламской ориентации запрещено изъятие органов у умерших доноров. С одной стороны, это повышает приживаемость трансплантата (почки), забираемого от здорового родственного донора и незамедлительно имплантируемого реципиенту, а с другой - увеличивает дефицит донорских органов и вынуждает часть населения этих стран обращаться в заграничные центры.
В последнее время в ряде стран (например, в США, Норвегии - см. раздел V.2) наметилась тенденция к росту числа пересадок от живых неродственных доноров - это является наглядным подтверждением того, что понятие альтруизма не является чисто абстрактным.
Закон РФ «О трансплантации органов и (или) тканей» был одобрен в Отделе законодательства в области здравоохранения ВОЗ. Данный закон является правовой базой для дальнейшего развития клинической трансплантологии в России (см. «Приложение»).
Каждый человек должен иметь право самостоятельно решать вопрос о возможности изъятия органов из его тела после смерти для трансплантации. Традиционно общество дает право личности или его ближайшим родственникам распорядиться телом. Непозволительно никакое принуждение или давление с целью заставить людей при жизни либо членов их семьи после смерти избрать пожертвование органом. Предпочтительной мотивационной силой в обеспечении доступности органов остается альтруистическое стремление помочь другим. Тем не менее, попытки обеспечить достаточное для трансплантации количество органов или тканей на основе добровольности и альтруизма успешны лишь отчасти.
Существуют две основные юридические модели (системы), законодательно регулирующие процедуру получения согласия на изъятие. Наиболее полно и четко они изложены в комментариях к первому руководящему принципу ВОЗ, согласно которым имеются две системы, предполагающие получение органов от умерших. К ним относится:
а) «система согласия (договора)», или «испрошенное согласие», т. е. явно выраженное согласие на изъятие органов от умерших post mortem, в соответствии с которым до своей кончины умерший явным образом заявлял, что он не возражает против изъятия органа, либо соответствующий член семьи выражает согласие в том случае, когда умерший не оставил никакого заявления или иного свидетельства противоположного мнения, а также
б) «система отсутствия согласия (отсутствие договора, презумпция согласия)», или «неиспрошенное согласие», при котором предполагается, что органы для пересадки могут удаляться из тела умершего, если он, будучи живым, не высказал возражений или иные лица, близкие к нему, не заявляли в соответствующее время, что он имел бы возражения против того, чтобы с его телом после смерти обращались подобным образом. Как в случае «системы согласия», так и в случае «системы отсутствия согласия» изъятию органа воспрепятствуют любые заявления и свидетельства об отрицательной позиции умершего или близких ему лиц по вопросу изъятия органов.
Если после смерти какого-либо лица не остается никакого подтверждения его отрицательного отношения к изъятию органа, то по «системе согласия» на изъятие органа обычно требуется согласие соответствующего члена семьи. По «системе отсутствия согласия» никакого согласия не требуется, однако члены семьи могут по своей инициативе заявить об отрицательной позиции умершего либо своей. При системе отсутствия согласия (большинство стран Европы) количество использованных для получения органов доноров, соотнесенное к числу жителей выше, чем в странах с системой согласия (например, в США).
При системе отсутствия согласия, тем не менее, гражданам предлагается заполнить специальный бланк-карточку, подтверждающую их согласие на использование органов после смерти - такую карточку рекомендуется всегда носить с собой вместе с другими документами, но она нигде не регистрируется и ни к чему не обязывает человека, ее заполнившего; в любой момент он может передумать и просто выбросить такую карточку.
В рамках Евротранспланта действует постоянная программа, The European Donor Hospital Education Programme, выпускающая специальные информационные издания и видеофильмы, организующая публичные лекции известных специалистов-трансплантологов, причем ее информационные издания выпускаются на различных языках и с учетом национального менталитета населения разных стран Европы. Вдобавок к этому разъяснительная работа ведется адресно - одни издания предназначены для практикующих врачей, другие для среднего медперсонала, и третьи - для разных слоев населения. Эффективность работы оценивается по выборочным опросам общественного мнения и, естественно, по приросту доноров.
Веб- сайты почти всех трансплантологических организаций обращаются к потенциальным донорам, а также содержат различную информацию для больных -реципиентов аллографтов и готовящихся к трансплантации (рекомендации по питанию, образу жизни и т.д.).
В законе РФ «О трансплантации органов и (или) тканей человека» (раздел 2, статья 8) принята вторая система законодательного регулирования донорства в целях клинической трансплантации - предполагаемое согласие («презумпция согласия»), что было сочтено наиболее приемлемым для социальной структуры российского общества.
В отношении живых доноров, родственников, находящихся в генетической связи с реципиентом, или неродственников, жертвующих парный орган для трансплантации, «право отдать» является этической проблемой. Общепризнанно, что подобный альтруизм благороден и имеет право на существование. ВОЗ по этому вопросу определяет, что в целом подобные доноры должны иметь генетическую связь с реципиентом. Закон РФ «О трансплантации органов и (или) тканей человека» однозначно трактует этот принцип в пользу только родственной трансплантации от живого донора, находящегося с реципиентом в генетической связи, за исключением случаев пересадки костного мозга (раздел III, статья 11).
Что же касается «разумного вознаграждения за предоставленные услуги», т.е. размера суммы, которую больной в России должен заплатить за лечение трансплантацией, равно как и национальных особенностей качества такого лечения - то эти вопросы не входят в круг задач настоящего пособия.
Первые надежно документированные сведения о невозможности аллогенных пересадок относятся к эпохе Ренессанса - а это было время, когда был распространен сифилис и почти каждый мужчина носил при себе шпагу и был готов использовать ее при малейшем поводе. Gaspare Tagliacozzi, анатом и хирург из Болоньи, пользовался всемирной репутацией хирурга, который мог восстанавливать почти до нормы нос у человека, используя при этом лоскут верхней конечности. Эта методика применяется иногда и по сей день и известна как лоскут Tagliacozzi, или итальянский метод. Описана она в его трактате «De Curtorum Chirurgia per Insitionem», опубликованном в 1596 г. Безуспешно попытавшись годом позже использовать для этих целей кожно-мышечный лоскут другого человека, Tagliacozzi от этой идеи отказался:
« Исключительный характер индивида полностью отклоняет нас от попытки осуществления этой работы на другом человеке. Поскольку сила и мощь индивидуальности такова, что если кто-то думает, что он может…достигнуть [успеха] в даже минимальной части операции, мы считаем его человеком суеверным и плохо обученным физическим наукам».
Впоследствии предпринимались неоднократные попытки пересадки кожно-мышечных лоскутов для целей пластики кожи как метода лечения ожогов - как аутологичные, так и аллогенные и ксеногенные. Появилась пресса и занялась распространением восторженных сообщений о врачах-чудотворцах, но исследователи, пытавшиеся добиться воспроизведения таких пересадок в эксперименте, приходили к тем же выводам, что и Tagliacozzi: это и Bert, ученик и преемник C. Bernard, разработавший метод парабиоза, «La greffe siamoise» (1863), и Schoene в Германии, предложивший для феномена отторжения термин «Transplantatiosimmitaet» (1912) и знаменитый хирург Lexer из Иенского университета, показавший истинную природу «приживления» аллотрансплантатов кожи, использовавшихся для пластики (1914).
Почти в это же время появляется методика сосудистого шва: J. Murphy, хирург из Чикаго, описал в 1897 г. применение при ранениях сосудов пристеночного бокового шва (рис. 1, А). Использование им такого шва для сшивания сосудов (по аналогии с кишечным анастомозом - «конец в бок») при пересадке почки в 1903 г. в Чикаго, как и использование Ulmann в Австрии трубочек из магнезии для соединения сосудов для тех же целей (1902, 1914) в случае аллогенной или ксеногенной трансплантации почки приживления не давали, что расценивалось авторами как результат несовершенства техники сшивания сосудов. Казалось совершенно очевидным, что гибель трансплантата происходит из-за отсутствия адекватного кровотока, что приводит к гипоксии и затем к разрушению клеток органа.
Молодой выпускник медицинского факультета Лионского университета Alexis Carrell взялся за эту проблему и создал простую, но использующуюся иногда и по сей день технику сосудистого шва, носящую его имя (рис. II.1, Б). В течение 1905 - 1906 гг. он проводит в Чикаго серию блестящих экспериментов по хирургии сосудов наряду с трансплантациями (аутологичными и аллогенными) органов и даже конечностей. Вместе со своим коллегой Guthrie он был за эту работу удостоен Нобелевской премии в области физиологии и медицины (1912).
В 1910 году Carrell заявляет, что технические проблемы трансплантации органов решены,
« но с биологической точки зрения проблема пересадки осталась нерешенной, так как механизм взаимодействия организма реципиента и пересаженного органа практически неизвестен».
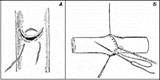
Рис. II.1. А - пристеночный боковой шов по Murphy - после наложения фиксирующей лигатуры, показанной на рисунке, дефект может зашиваться непрерывно линейным швом, как показано в Б (из: Краткий курс оперативной хирургии /под ред. В.Н. Шевкуненко. М.: Медгиз, 1947).
Б - круговой сосудистый шов по Carrell: при помощи трех узловых швов просвет сосуда превращается в равносторонний треугольник, все три стороны которого сшиваются линейно непрерывным швом (из: Шмиден В., Фишер А. Курс хирургических операций. Пер. с нем. М.-Л., Гос. мед. изд-во, 1931).
В настоящее время используются и автоматические сосудосшивающие устройства, и сама xирургическая технология в целом значительно усовершенствована. Тем не менее создание метода сосудистого шва явилось важнейшей предпосылкой хирургической техники трансплантации органов.
Однако следует подчеркнуть, что создание техники сосудистого шва и первые пересадки органов одновременно явились и повторением (после Tagliacozzi) вывода о невозможности несингенных пересадок. Восемь-девять дней - и орган необратимо разрушен, а если повторить пересадку органа или ткани в прежнем сочетании (то есть этому же реципиенту от прежнего донора), то отторжение происходит за 3 - 4 дня. В зависимости от конкретных условий и величины органа получались и несколько другие данные по длительности выживания впервые пересаженного органа, но принципиально иных сроков получено не было.
Такие же временные интервалы были продемонстрированы в 1906 г. P. Ehrlich в экспериментах при изучении прививки крысам мышиных опухолей, которые он объяснил гипотезой «атрепсии» - в организме реципиента истощается необходимый клеткам конкретного донора трофический (т.е. триптический) компонент - ведь при обратной прививке опухоли мыши она восстанавливается и через несколько дней ее снова можно привить интактной крысе, где она снова погибает через 8 дней; эти циклы можно было повторять очень долго (их назвали «зигзагообразной трансплантацией опухолей»).
Правильную трактовку этих экспериментов в Европе дали Bashford, Murray, Haaland (1908) и Russel (1912), работавшие с такой же моделью - при первой трансплантации у крысы развивается иммунитет к мышиным тканям, в силу чего повторный трансплантат разрушается быстрее.
Эта теория («теория иммунитета») была поддержана в США опытами James B. Murphy, который от хирургии перешел к экспериментальной работе и в течение 1912 - 1914 гг. показал, что деструкция трансплантата обусловлена клетками лимфоидной ткани реципиента, а именно малыми лимфоцитами. Опыты проводились с куриными эмбрионами, аллогенными (клетки взрослых кур) и ксеногенными трансплантатами (крысиные перевиваемые опухоли): опухоль длительно выживает в эмбрионе с еще недостаточно развившейся лимфоидной тканью, но за определенный срок до рождения эмбрион приобретает способность отторгать опухолевые клетки так же, как и взрослый организм. С одной стороны, это показывало, что если нет лимфоидных клеток (или их еще мало), то нет и реакции отторжения, а с другой - этим были заложены основы того направления, которое впоследствии назвали иммунологической толерантностью.
Поскольку, как совершенно верно полагал J.B. Murphy, отторжение трансплантата обусловлено иммунной реакцией, а клетками-эффекторами являются малые лимфоциты, то для продления жизни трансплантата он еще в 1914 году пытался воздействовать на организм реципиента бензолом или облучением для подавления функциональной активности его лимфоцитов!
К сожалению, эти совершенно правильно задуманные эксперименты не увенчались успехом, что не отменяет их пионерский характер и заслуг самого исследователя. Однако направление, предложенное Мэрфи, в то время развития не получило: история науки знает немало примеров, когда научное сообщество не способно воспринимать идеи, если его уровень в среднем ниже, чем у отдельного исследователя - в публицистике это называется более компромиссно - «опередить свое время».
Второй важный вывод, которым ознаменовался это период развития трансплантологии, заключается в том, что отторжение аллогенного трансплантата связано с клеточной иммунной реакцией реципиента и продление жизни трансплантированного органа должно достигаться путем воздействия на эту реакцию.
Однако эта точка зрения далеко не сразу нашла признание в мировом научном сообществе. Иммунная природа отторжения трансплантата оспаривалась вплоть до конца 40-х годов, пока
P. Medawar, впоследствии Нобелевский лауреат (1960, совместно с F. Burnet), в 1944 - 1947 г.г. не привел снова убедительные доказательства ускоренного отторжения повторного трансплантата от того же донора. В иммунологию, кстати, только с этого периода вошли понятия «first set» и «second set», а представления об иммунной толерантности стали в основном связываться с работами Burnet, Billingham, Brent и Medawar, а также с работами 50-х годов чешского исследователя Mилана Гашека.
Начало 20-го века вообще было богато открытиями, значение которых было осмыслено много позже. Например, отмеченный фронтовыми медиками I мировой войны факт, что пораженные азотистым ипритом умирают при явлениях аплазии костного мозга, через десятилетия послужил отправной точкой для создания цитостатиков.
Касаясь первых десятилетий 20-го века, следует также отметить, что открытие эритроцитарных антигенов (систем АВ0, Rh и других) вызвало к жизни новую волну неудачных пересадок: попытки учесть совместимость по изоантигенам в трансплантологии также не внесли принципиальных корректив в сроки отторжения трансплантатов. Наконец, начавшая развиваться в начале 20 века иммуногенетика к концу 30-х годов уже накопила фактический материал, оформленный позднее в виде «пяти законов трансплантации» - как известно, второй закон гласит: «аллотрансплантаты отторгаются» (Снелл Дж., Доссе Ж., Нэтэнсон С. Совместимость тканей. Пер. с англ., М.: «Мир», 1979)
На этом фоне заслуживает глубокого уважения полная оптимизма исследовательская деятельность хирургов-экспериментаторов, отрабатывавших в экспериментах на животных приемы операций трансплантации, изучавших особенности функционирования пересаженных органов, изменения в них при гипоксии, отработки методов временной консервации и т.д. Сюда же можно отнести, казалось бы, заранее обреченные на неудачу и пересадки, проведенные больным людям, как правило, находящимся в терминальной стадии сердечной недостаточности (пересадки сердца) или опухолевого процесса (пересадки легких и печени): трудно оценивать целесообразность таких операций с точки зрения продления жизни на несколько дней или десятков дней, но приобретенный в них опыт позволил затем продлять жизнь таких больных на годы. Заранее, до решения проблемы отторжения хотя бы на каком-то минимально приемлемом уровне, хирургическая часть трансплантологии была уже во многом разработана.
В этой связи нельзя не отметить заслуг В.П. Демихова. Судьба этого выдающегося исследователя достаточно типична для советского времени и, учитывая специфику последнего, было бы неверно проводить аналогии с Мэрфи - мировое научное сообщество его идеи восприняло адекватно. Начав еще до войны исследовательскую работу, базирующуюся в основном только на личном энтузиазме, в течение ряда лет Демихов детально разработал важнейшие вопросы ортотопической(т.е. анатомически на прежнее место) и гетеротопической (см. пояснение далее) трансплантации сердца; ему также удалось доказать, что возможна пересадка не только отдельных органов, но и сложных органокомплексов с восстановлением тонких физиологических функций. В этом смысле пересадка второй головы собаке вовсе не курьез, а подсадка собакам второго сердца - экспериментальная модель гетеротопической трансплантации.
Разработка техники операции гетеротопической трансплантации сердца намного опередила мировой уровень: Демихов предвидел, что пересадки будут осуществляться больным с выраженными явлениями легочно-сердечной недостаточности, а в этих условиях, при выраженной гипертензии малого круга, правый желудочек трансплантированного сердца может не справиться с нагрузкой давлением. Поэтому он экспериментально обосновал технику подсадки донорского сердца в полость перикарда, «усиливая» им сердце реципиента: верхняя полая вена трансплантата анастомозируется с верхней полой веной реципиента, а легочная артерия трансплантата - с легочной артерией реципиента.
В.П. Демихову посчастливилось доложить свои данные на международном конгрессе трансплантологов в 1958 г., проходившем в бывшем ГДР. Его доклад, а также снятый им любительский фильм и проведенная показательная операция гетеротопической пересадки на собаке явились настоящей сенсацией, а статья, опубликованная после конгресса, цитируется и по сей день.
Хирург из ЮАР Christian N. Barnard, осуществивший впоследствии первую ортотопическую пересадку сердца человеку (1967), а учтя ее опыт, в 1974- 1975 г.г. две гетеротопические пересадки - отмечал, что этой идеей он увлекся, прочитав работы Демихова.
Заслуги Демихова в разработке хирургических проблем трансплантации сердца неоспоримо высоки, но и в других областях трансплантологии он был первопроходцем. В уже цитировавшейся книге под ред. Раппапорта и Доссе в разделе о трансплантации легкого авторы с уважением ссылаются на обзорную статью Демихова, одним из первых получившего новые данные и в этой области - первыми были эксперименты Guthrie и Carrel в 1905, а начало опытов Демихова по пересадке легкого датируются 1947 годом (Demikhov V.P. Experimental transplantation of vital organs. New York, Consultation Bureau Enterprises, Inc., 1962).
В книге Г. Глязера (с. 96) приводится цитата из У. Коллфа, одного из исследователей проблемы искусственного сердца в США: «Первым экспериментатором, который пытался поставить механическое сердце внутрь организма, несомненно, был советский исследователь В.П. Демихов. В 1937 году он сделал три таких опыта, вставив животным нагнетательное приспособление, которое приводилось в движение вращающейся осью. Энергию подавали снаружи через вставленную в грудную клетку трубку». Вспомните эту цитату, когда будете рассматривать рис. III.5.
Однако по существу на родине талант В.П. Демихова и его разработки вплоть до его кончины в 1998 году оказались невостребованными.
В конце 50-х годов начинается экспериментальное исследование и появляются первые клинические наблюдения о применении цитостатиков для подавления трансплантационного иммунитета - основанием этому послужили наблюдения угнетения иммунитета при лечении злокачественных опухолей.
В 1990 г. Нобелевскую премию по медицине получили E.D. Thomas и J.T. Murrey (США) за введение фармакологической иммунодепресссии в клиническую практику трансплантации костного мозга и органов. Первый успех датируется 1960 г., когда в экспериментах на собаках было получено длительное выживание трансплантата при использовании общего облучения в низких дозах в комбинации с 6-меркаптопурином. В том же году при использовании комбинации 6-меркаптопурина и кортизона вместе с общим облучением, было впервые достигнуто выживание аллотрансплантатов почки (16 и 17 месяцев) при неродственной трансплантации.
Успехом операции по трансплантации органа стало считаться функционирование трансплантата в течение одного года.
Это было значительным этапом, так как показало, что неродственные трансплантации возможны. К 1965 году был накоплен уже значительный материал по пересадкам почки у человека (рис. II.2), но, несмотря на отдельные успехи (впрочем, относительные по сегодняшним меркам), в целом данные были неутешительны: среди 627 первичных трансплантатов годичная выживаемость от сибсов колебалась между 50 и 60 %, к ней была близка выживаемость трансплантатов от других родственников,
и совсем уж неудовлетворительные показатели были при трансплантациях от живых неродственных доноров и в случае пересадки трупной почки. И это, за исключением последнего случая - пересадки от живых доноров, т.е. операции «с одного стола на другой», при минимальном риске ишемического повреждения органа.
С позиций сегодняшнего дня это объясняется несовершенством и разнородностью применяемых схем иммунодепрессии - разные препараты, разные дозы, сроки введения и т.д. Обращает на себя внимание кривая выживаемости трансплантатов от однояйцевых близнецов - она не составляет 100%! В первые полгода теряется 10 % трансплантатов и далее до 7 лет этот показатель практически не изменяется. Если снижение выживаемости в течение первого года можно связать с погрешностями хирургической техники (кровотечения, тромбозы, несостоятельность швов, нагноение и т.д.), но резкое и закономерное падение выживаемости к девятому году говорит о другом - о поражении трансплантированной почки в результате основного заболевания, которое не исчезло вместе с удаленной почкой (например, хронический гломерулонефрит).
Эти данные является очень наглядной иллюстрацией тезиса о системном характере заболеваний, о том, что болен весь организм, а не только пораженный орган. Кроме того, стоит сравнить характер этой кривой с кривой «Б» (там, где донорами были сибсы): в последнем случае не наблюдается такого снижения и вообще характер кривой иной. Наиболее вероятной причиной является то, что генетическая предрасположенность к развитию заболевания должна обязательно проявляться у однояйцевых близнецов и необязательно - у сибсов.
За исключением очень редких случаев пересадок между однояйцевыми близнецами все остальные трансплантации являются аллогенными. Совместимость пары донор - реципиент оценивалась в то время по эритроцитарным антигенам (АВ0 и Rh). Несоблюдение правил АВ0-совместимости обычно (хотя и не всегда) приводило к реакциям немедленного типа с повреждением сосудистого эндотелия, диссеминированным тромбообразованием и быстрым необратимым повреждением трансплантата, но и при полной совместимости по эритроцитарным антигенам впоследствии все равно наступало неизбежное иммунное отторжение.
Именно этим в наибольшей мере объясняются достаточно большие потери трансплантатов при аллогенных пересадках в этот период - цитостатическая терапия того времени одна, сама по себе, не могла полностью купировать реакцию отторжения без риска для жизни больного
– далее весь период выживания трансплантата проходил либо на фоне хронического отторжения, либо цитостатики вызывали резкое угнетение иммунитета и гибель больных от инфекционных осложнений.
Представления о главном комплексе гистосовместимости только еще начинали формироваться, к 1965 году еще не было даже общепринятого его названия - G.D. Snell, J. Dausset и B. Benacerraf - будущие Нобелевские лауреаты (1980) писали в своих исследованиях о лейкоцитарных антигенах, которые предлагалось назвать системой HL-A или Hu-1. Было известно только 12 «специфичностей», из них только часть определялась серологически, а остальные - по семейному анализу и интенсивности пролиферации в смешанной культуре лимфоцитов. Понятно, что время практического применения тканевого типирования еще не наступило. В силу этого иммунодепрессивная терапия была основным фактором, позволявшим продлить жизнь больного.
Однако исследования HLA-системы развивались очень интенсивно и через 20 лет, в 1984 году, серологическое типирование проводилось уже по 80 антигенам I класса (локусы A+B+C) и 25-ти - II класса (локусы DR+DQ+DP). В 1984 году на очередном воркшопе Международной программы по изучению эффективности аллогенных трансплантаций почки были обобщены данные о значении HLA-типирования в выживании почечных трансплантатов, точнее - о значении типирования по II классу, в первую очередь, по специфичностям HLA-DR. Было выборочно проанализировано свыше 20000 трансплантаций в Европе, Северной Америке, Азии, Африке и Австралии за 5 лет. Были проанализированы данные по годичной и пятилетней выживаемости почечных трансплантатов зависимости от числа несовместимостей по локусам HLA-DR+B между реципиентом и донором (эти несовпадения (mismatches) в среде русскоязычных иммуногенетиков так стали и называться - мисматчи.): 0 - полное совпадение, 1 - есть одна несовпадающая специфичность, аналогично 2, 3, 4 - 2,3, или 4 несовпадающие специфичности. Так, в Европе при нулевом мисматче HLA-DR+B годичная выживаемость составляла примерно 85 %, при 1 - 70 %, при 2-х - 65 %, при 3-х и 4-х - около 60 % (Данные из книги: Зарецкая Ю.М., Абрамов В.Ю. Новые антигены тканевой совместимосчти человека. М.: «Медицина», 1986).
Вообще практика трансплантологии показала, что даже при прекрасной организации и налаженном обмене донорскими органами часто бывает трудно найти сочетание с нулевой несовместимостью, поэтому разработаны различные шкалы оценки сочетаемости пары донор - реципиент, опирающаяся на число несовпадающих специфичностей. При этом ключевое значение имеет отсутствие мисматчей по HLA-DR. Мировой опыт в дальнейшем показал, что это определяет длительность успешного функционирования трансплантата - частота пятилетнего выживания трансплантатов с нулевым мисматчем по HLA-DR значительно выше, чем при наличии одного мисматча. Уже в 90-х годах во многих центрах абсолютным правилом подбора стал нулевой мисматч по HLA-DR (конечно, есть исключения, но сейчас речь о правилах). В результате в 90-х годах годичная выживаемость стала приближаться к 100 %, да и сама она перестала быть главным критерием - значительно более важными стали меры по повышению пятилетней и десятилетней выживаемости.
Следует отметить, что упоминаемая в тексте выживаемость почечного трансплантата, не равная 100 % и, соответственно, его гибель/отторжение не означают смерти реципиента: в большинстве случаев осуществляется повторная трансплантация (ретрансплантация). В противоположность сердцу или печени почка, как правило, трансплантируется эктопически в брюшную полость, поэтому повторная трансплантация осуществляется сравнительно легко. Однако и другие органы пересаживаются повторно. К началу 90-х годов, когда серологическое HLA-типирование осуществлялось достаточно полно, необходимость в повторных пересадках все равно наблюдалась (данные по всем органам): если среднее количество ожидающих первой пересадки в листе ожидания Евротранспланта за 1989 - 1991 гг. (8313 человек,) принять за 100 %, то доля ожидающих второй пересадки составляла 17 %, третьей - 3 %, четвертой - 0,4 %, пятой - 0,06 % (в 1989 и 1990 гг. было по 1 человеку, ожидающих шестой трансплантации!).
Даже сравнительная полнота серологического типирования вовсе не означают достижения сингенности. По мере накопления и обработки большого массива данных международные рабочие совещания (воркшопы) постоянно определяют негомогенность отдельных специфичностей и таким образом «широкая» специфичность распадается на «узкие» (сплиты). Например, специфичность HLA-DR5 в 1984 г. была разделена на DR11 и DR12. Впоследствии (по состоянию на 1998 г.) внутри DR11 было выделено еще 13 специфичностей, связанных с полиморфизмом бэта-цепи, причем 4 из них выявлялись только с помощью генотипирования. И при этом не следует забывать, что главный комплекс гистосовместимости не является единственным.
Таким образом, даже самый точный подбор пары донор-реципиент все равно не снимает проблемы отторжения. Иммуносупрессивная терапия в том или ином объеме необходима во всех случаях аллогенных пересадок.
Стероиды и азатиоприн (т.н. двухкомпонентная терапия) были основой борьбы с отторжением примерно в течение 20 лет. Однако большое число побочных эффектов (снижение резистентности к инфекциям, подавление гемопоэза, торможение роста и т. д.) стимулировало поиск новых препаратов.
В 1972 г. благодаря швейцарской фирме «Sandoz» появился циклоспорин А (CsА, циклический пептид с м.М. 1202 Да). С 1979 г. циклоспорин используется в клинической практике, что разрешило многие проблемы, связанные с использованием двухкомпонентной терапии. Совершенно оправданно говорят о двух эпохах в трансплантологии - до и после CsА.
К классическим иммуносупрессивным препаратам в настоящее время относятся кортикостероиды, азатиоприн, циклофосфамид, метотрексат и циклоспорин А (син.: Sandimmune, Neoral). Все эти препараты зарегистрированы в России, однако, по состоянию на январь 2000 г., в РФ пока не зарегистрирован ряд упоминаемых далее новых высокоэффективных иммунодепрессантов, вошедших В 1995-1998 гг. в мировую клиническую практику (перевод tacrolimus как такролимус используется ввиду явно латинского именования, названия остальных препаратов даются в английском варианте).
Несмотря на то, что в отношении современных иммунодепрессантов выделяются основные, ключевые точки их воздействия на клетку, исследованы не все молекулярные механизм действия этих препаратов (как, впрочем и относительно старого циклоспорина).
Циклоспорин связывается с внутриклеточным белком циклофиллином, одним из регуляторных белков кальций-зависимой фосфатазы кальцийнеурина и образующийся комплекс циклоспорин-циклофиллин ингибирует ее активность, что в конечном счете предотвращает активацию и экспрессию генов цитокинов преимущественно в Т-лимфоцитах. Механизм действия такролимуса (tacrolimus, син.: FK506, Prograf) аналогичен, но он связывается с другим регуляторным белком кальцийнеурина, FKBP-12. По своей эффективности такролимус оценивается как препарат, близкий к циклоспорину. Оба они метаболизируются преимущественно в печени ферментами системы цитохрома Р 450 (см. раздел IV.4).
Отторжению аллографта должна, естественно, предшествовать фаза иммунного распознавания. Как показано на рисунке, непосредственно после взаимодействия комплекса CD3 -TCR (Т-клеточный рецептор) с антиген-представляющими клетками происходит цепь событий, приводящих к активации тирозиновых киназ (TK), которые «по цепочке» фосфорилируют ряд белков и в том числе фосфолипазу С-гамма, это переводит ее в активированное состояние и она выщепляет из мембранных липидов инозитолтрифосфат (IP3). Последний связывается с рецепторными белками в эндоплазматиченском ретикулуме (ER), что приводит к высвобождению ионов кальция, которые, в свою очередь, активируют кальций-зависимые энзимы. Одним из них и является кальцинейнеурин, сериновая фосфатаза. Этот фермент играет ключевую роль в активации находящихся в цитоплазме факторов транскрипции цитокинов - после отделения блокирующего белка активированный фактор транскрипции транслоцируется в ядро. В результате, уже в течение первого часа после антигенной стимуляции Т-лимфоцит начинает продуцировать лимфокины (например, как показано на рисунке - IL-2 и/или IFN-гамма), необходимые для пролиферации Т-клеток. Однако благодаря циклоспорину или такролимусу (на рис. - красная полурамка вокруг кальцийнеурина) эти события блокируется.
Препарат rapamycin (син. sirolimus) образует комплексы с фосфокиназами (известно, что, по крайней мере, с двумя) и с этим связывается блокирование трансдукции активационного сигнала от рецепторов ростовых факторов, таких как рецептор для ИЛ-2.
Deoxyspergualin каким-то образом нарушает деятельность Hsp70, одного из представителей семейства белков теплового шока, имеющего отношение к активации фактора транскрипции NF-kB, причем этот эффект отмечен преимущественно в моноцитах и других антиген-представляющих клетках.
MMF (mycophenolate mofetil, син.: RS61443, CellCept) является неконкурентным обратимым ингибитором пуринового синтеза, блокируя инозитолмонофосфат дегидрогеназу (ключевой фермент в синтезе de novo гуаниновых нуклеотидов), в силу чего в клетке повышается содержание адениновых нуклеотидов, что блокирует ее продвижение по клеточному циклу. Этот механизм проявляется преимущественно в Т- и В- лимфоцитах, начинающих пролиферировать при развитии иммунного ответа, но к нему резистентны быстро пролиферирующие клетки, использующие преимущественно пуриновый путь синтеза (в частности, предшественники нейтрофилов и эритроцитов). Последнее очень важно, т.к. реже возникает анемия и остаются относительно сохранными функции нейтрофилов. У MMF оказался также очень полезный побочный эффект - он оказывает угнетающее действие на P. carinii (см. раздел IV).
Близким по точке приложения в клетке является препарат mizoribine, конкурентный ингибитор инозитолмонофосфат дегидрогеназы. Другими ингибиторами синтеза пиримидиновых нуклеотидов являются препараты brequinar и leflunomide, ингибирующие активность дегидрооротат дегидрогеназы.
По основным внутриклеточным эффектам на иммунокомпетентные клетки современные иммуносупрессивные препараты классифицируются следующим образом (Таблица II.2):
Иммуносупрессивные препараты
Ингибиторы транскрипции: циклоспорин, такролимус.
Ингибиторы синтеза нуклеотидов: азатиоприн, mycophenolate mofetil, mizoribine, brequinar, leflunomide.
Ингибиторы трансдукции активационного сигнала от
ростовых факторов: sirolimus, leflunomide.
Ингибиторы дифференцировки: 15-deoxyspergualin
Интересно, что отторжение клинически часто проявляется как волнообразный процесс с периодическим нарастанием активности до максимума (криз отторжения), однако закономерности этого явления изучены мало, сложно предсказать будущий криз и поэтому ведется регулярное клинико-лабораторное наблюдение за реципиентом - мониторинг (кризов) отторжения.
Следует отметить, что подбор новых сочетаний препаратов, хотя и опирается на экспериментальные исследования, все равно во многом осуществляется чисто эмпирически, например, сравнивали эффективность двух доз MMF: 1 г 2 раза в день и 1,5 г 2 раза в день. 166 реципиентов почечных аллографтов получали плацебо + 1 г MMF 2 раза в день, а 165 реципиентов - по 1,5 г MMF 2 раза в день. После года наблюдения, и сбора данных результаты были расшифрованы и оценены. Вторая схема оказалась лучше и такие данные являются убедительными, сводя всякую неопределенность до минимума (в терминах научной или, как сейчас подчеркивается, доказательной медицины - являются фактом).
Наряду с химиопрепаратами как иммунодепрессоры используются и антитела. В первое время достаточно широко использовались антилимфоцитарный глобулин (АЛГ) и антитимоцитарный глобулин (АТГ), представлявшие собой гамма-глобулиновую фракцию сыворотки иммунизированных лимфоцитами (или тимоцитами) человека животных, например, лошадей. Более эффективны моноклональные антитела (мАТ). Как терапевтическое средство они применяются с 1981 г. Наибольший опыт накоплен при использовании анти-CD3-мАТ, то есть элиминирующих или угнетающих активность всех зрелых Т-лимфоцитов.
Побочные эффекты, связанные с введением мАТ, наблюдаются после первого и второго введения препарата и проявляются в виде лихорадки, диспноэ, гастроинтестинальных расстройств. Причиной развития таких реакций является продукция активированными моноцитами и лимфоцитами большого количества цитокинов, в первую очередь, ТНФ и интерферонов. Реакции могут иметь разную степень тяжести и предупреждаются специальной премедикацией. Сначала считалось, что главным недостатков мышиных (реже крысиных) мАТ при их длительном введении является развитие антительного ответа к этим ксеногенным белкам, образование иммунных комплексов, блокирование активности мАТ и соответственно, снижение терапевтического эффекта. Стали разрабатываться и производиться гуманизированные гибридные антитела, когда осуществляется трансплантация гипервариабельной области генов мышиных (или крысиных) антител в область генов нормального иммуноглобулина человека. Опыт показал, что при лечении такими антителами у больных антиглобулиновый ответ наблюдается очень редко.
Однако с накоплением клинического опыта применения различных мАТ к детерминантам Т-лимфоцитов оказалось, что их использование целесообразно только в относительно короткое время - для купирования криза отторжения (иногда говорят о фазе индукции иммунодепрессии), так как применение их в меньших дозах, но длительно вызывает системную иммунодепрессию и возникновение инфекционных осложнений (см. раздел IV). Поэтому в работах по клинической трансплантологии в последнее время в основном опираются на применение химиопрепаратов, а анти-CD3 мАТ являются резервным средством.
Очевидно, самые многообещающие перспективы сулит изучение и практическое использование механизмов индукции иммунной толерантности. Накоплено достаточно много данных, когда при длительного выживающих аллогенных трансплантатах (обычно близкородственных) проводилась минимальная иммуносупрессии и в последствии даже полностью отменялась. В ряде случаев показано «мирное сосуществование» аллогенных клеток в организме реципиента - формирование клеточного химеризма. Это явление получило название периферической толерантности и в настоящее время активно изучается иммунологами.
Эти случаи периферической толерантности нисколько не отменяют законов трансплантации и не противоречат им. Толерантность не является случайной удачей, а возникает в процессе индукции. Даже «простой» прием цитостатиков со временем избирательно элиминирует аллореактивные клоны. Несомненно, что в будущем приемы индукции периферической толерантности займут ведущее место в технологии лечения трансплантацией.
Пока же по степени важности среди биомедицинских предпосылок успешной трансплантации на первое место следует поместить три одновременно:
а) HLA- типирование -наиболее полное, насколько это возможно;
б) применение иммунодепрессивных препаратов;
в) минимизацию повреждения трансплантата за счет ишемии/реперфузии.
О последнем условии речь пойдет в следующих разделах, а в заключение следует отметить такое дополнительное условие хорошей выживаемости трансплантата, как уровень общей культуры в обществе. В настоящее время специалисты отмечают необходимость перехода в развитых странах от санитарного просвещения к санитарному воспитанию: дело в том, что люди уже знают, что вредно и что полезно, но отнюдь не всегда соответственно поступают. В данном контексте имеется в виду то, что в подавляющем большинстве случаев реципиенты аллографтов должны принимать иммунодепрессоры под врачебным контролем в течение всей последующей жизни. Очень демонстративны данные американских медиков конца 80-х годов: результаты 10-летних наблюдений более 600 пациентов показали, что у тех из них, кто следовал предписаниям врачей, 10-летняя выживаемость трансплантата составила 83 %, а у тех, кто не следовал - 28 %.
Биологическая смерть, т. е. состояние необратимой гибели организма как целого с тотальной гибелью головного мозга, может быть констатирована:
1) на основании традиционных критериев прекращения сердечной деятельности и дыхания и
2) на основании смерти мозга (СМ), т. е. необратимого прекращения функций головного мозга, включая и функции его стволовых отделов.
При этом в обоих случаях решающим критерием для констатации биологической смерти является сочетание факта прекращения функций головного мозга с доказательствами необратимости этого прекращения.
Так как СМ означает смерть индивидуума, ее своевременная констатация является гуманным актом. После установления СМ изъятие органов для трансплантации является обычным медицинским мероприятием, в то время как оставление жизнеспособных органов и их гибель - медицинской ошибкой.
На основании «Закона о трансплантации» в РФ принят ряд нормативных документов, утвержденными Приказом МЗ РФ № 189 от 10 августа 1993 г. «О дальнейшем развитии и совершенствовании трансплантологической помощи населению Российской Федерации», в том числе и по констатации смерти человека на основании диагноза смерти мозга.
В соответствии с «Инструкцией» диагноз СМ не рассматривается до тех пор, пока не исключены следующие воздействия: интоксикация, включая лекарственную; первичная гипотермия; гиповолемический шок; метаболические эндокринные комы; применение наркотизирующих средств и миорелаксантов.
Поэтому первое и непременное условие установления диагноза СМ заключается в доказательстве отсутствия воздействия лекарственных препаратов, угнетающих центральную нервную систему и нервно-мышечную передачу, интоксикаций, метаболических нарушений и инфекционных поражений мозга.
Во время клинического обследования больного ректальная температура должна быть стабильно выше 32° С, систолическое АД не ниже 90 мм рт. ст. (при более низком АД оно должно быть поднято внутривенным введением вазопрессорных препаратов). При наличии интоксикации, установленной в результате токсикологического исследования, диагноз СМ до исчезновения ее признаков не рассматривают.
Ниже представлен комплекс клинических критериев, наличие которых обязательно для установления диагноза СМ.
Полное и устойчивое отсутствие сознания (кома).
Атония всех мышц.
Отсутствие реакции на сильные болевые раздражения в области тригеминальных точек и любых других рефлексов, замыкающихся выше шейного отдела спинного мозга.
Отсутствие реакции зрачков на прямой яркий свет. При этом должно быть известно, что никаких препаратов, расширяющих зрачки, не применялось. Глазные яблоки неподвижны.
Отсутствие корнеальных рефлексов.
Отсутствие окулоцефалических рефлексов (движения глаз при повороте головы).
Отсутствие окуловестибулярных рефлексов (используется т.н. двусторонняя калорическая проба - при сохранении функций ствола мозга при введении в наружный слуховой проход холодной воды (20° С) появляется нистагм или отклонение глазных яблок).
Отсутствие фарингеальных и трахеальных рефлексов, которые определяют путем движения эндотрахеальной трубки в трахее и верхних дыхательных путях, а также при продвижении катетера в бронхах для аспирации секрета.
Отсутствие самостоятельного дыхания.
Упоминаемая инструкция недействительна в отношении установления СМ у детей, для которых соответствующая диагностика еще не разработана.
В качестве дополнительных критериев СМ рекомендованы ЭЭГ и двукратная ангиография четырех магистральных сосудов головы (общие сонные и позвоночные артерии). Если ни одна из внутримозговых артерий не заполняется контрастным веществом, это свидетельствует о прекпащении мозгового кровообращения).
Далеко не во всех случаях констатация СМ дает возможнсть использования органов для трансплантации. Изъятие органов следует считать невозможным при наличии:
доказанной системной инфекции (сепсис, септицемия);
любых злокачественных опухолей, кроме опухолей головного мозга;
инфекционных заболеваний;
известных анамнестических и клинических сведений о наличии сахарного диабета, гипертонической болезни и других сердечно-сосудистых заболеваний тяжелого течения;
длительного периода гипотензии или асистолии, влекущих за собой ишемические повреждения органов.
Общие критерии первичной оценки донора представлены в табл. III.1. Наряду с изложенными общими требованиями, существуют также и органоспецифические критерии, в соответствии с которыми оценивается пригодность для трансплантации отдельных органов мультиорганного донора - важно именно состояние органа, в этом смысле в настоящее время сняты существовавшие одно время возрастные ограничения для доноров. Кроме этого, при необратимом повреждении сердца, печени и других органов почки являются относительно более устойчивыми, поэтому их изъятие в таких ситуациях возможно.
Учитывая постоянно растущий дефицит донорских органов, необходимо максимально стремиться к совершенствованию организационной работы, чтобы увеличить число мультиорганных доноров.
При лечении трансплантацией многих инфекционных осложнений можно избежать, выпоняя тщательное обследование донора (а также и реципиента) - подробнее об этом см. в разделе IV.
Таблица III.1. Общие критерии первичной оценки мультиорганного донора
Гемодинамика
Оптимальная: систолическое давление» 100 мм рт. ст. без инотропной поддержки. Центральное венозное давление» 5 см. вод. ст.
Допустимая: использование низких и умеренных доз катехоламинов (допамин 10 мкг/кг/мин)
Недопустимая: асистолия продолжительностью более 15 мин. Длительная неуправляемая гипотония в комбинации с признаками ишемического повреждения жизненно важных органов (почки, печень, легкие)
Почечная функция
Оптимальная: диурез» 100 мл/ч Нормальный уровень азотемии
Допустимая: олигурия и/или повышение креатинина плазмы до 0,25 ммоль/л Положительный ответ на водную нагрузку и стимуляцию диуреза салуретиками
Недопустимая: олигоанурия в сочетании с длительной гипотонией, не купируемой введением жидкости
Из всех негативных факторов, влияющих на функциональную полноценность донорских органов, наиболее важным является прекращение кровообращения. Накопленный многолетний опыт работы трансплантационных центров показал решающую роль ишемических/реперфузионных повреждений трансплантатов.
Известно, что снижение температуры вызывает понижение активности метаболических процессов и позволяет несколько увеличить время от момента прекращения адекватного снабжения органа кровью до наступления грубых ишемических повреждений. Пока концепция СМ не была законодательно утверждена, изъятие донорских органов можно было производить только после констатации биологический смерти по традиционным критериям. На практике, в максимально благоприятной ситуации, изъятие можно было начинать только после остановки сердца. Для снижения последствий ишемии были разработаны методы перфузии органов холодными растворами (см. далее). В связи с этим возникло понятие тепловой ишемии - исчисляемое от остановки кровообращения до начала холодовой перфузии. Снижение до минимума величины этого показателя приобретает первостепенное значение для получения жизнеспособных трансплантатов.
Вопрос о допустимом времени тепловой ишемии до сих пор остается предметом дискуссий. Кроме того, умирание потенциального донора, как правило, происходит длительно, иногда в течение нескольких суток, все это время органы подвергаются воздействию ишемии, поэтому время истинно измеряемой тепловой ишемии от момента остановки сердца до начала охлаждения имеет относительное значение. Полностью избежать ишемического повреждения органов можно только при изъятии их у доноров с констатированной СМ с сохраненным кровотоком, применяя при этом противоишемическую защиту и перфузию холодным раствором.
При изъятии почек у доноров с бьющимся сердцем время тепловой ишемии составляет 3 - 5 мин, после остановки сердца оно зависит от оперативной техники удаления почек и слаженности работы бригады. Максимально допустимым временем тепловой ишемии для почек можно считать 15 - 20 минут. Еще большее значение имеет длительность тепловой ишемии при получении трансплантатов печени, поджелудочной железы и сердца - она практически должна отсутствовать. Соблюдение этого условия стало возможным с официальным признанием правомочности получения органов для целей трансплантации от доноров с сохраненным кровотоком, находящихся в состоянии СМ.
С момента принятия решения о выполнении операции изъятия органов до завершения операции на доноре проводят его кондиционирование, т. е. интенсивную терапию, направленную на компенсацию грубых патологических нарушений, вызванных церебральной дисрегуляцией основных витальных функций. Цель длительной интенсивной терапии донора - сохранение оптимальной функции жизненно важных органов до момента их изъятия. Этого достигают путем фармакологической поддержки, обеспечивающей максимальную перфузию и поставку кислорода органам наряду со снижением вероятности развития осложнений, которые могли бы снизить жизнеспособность донорского органа. Использование фармакологических средств помогает приспособить метаболизм клеток к неблагоприятным для них условиям. Эта задача частично решается в период интенсивного лечения потенциального донора. Однако целенаправленная фармакологическая защита органов от ишемических повреждений начинается после констатации СМ.
Следует отметить, что если пранируется изъятие только почек, то все равно проводится кондиционирование донора, но оно непродолжительно и носит в прямом смысле реанимационный характер, преследуя одну цель - обеспечить максимальную степень изолированной противоишемической защиты почек в условиях крайне нестабильной гемодинамики. При кондиционировании донора с мозговой смертью защитные мероприятия носят разнонаправленный комплексный характер и проводятся достаточно продолжительное время, зачастую в течение нескольких часов и даже суток, вплоть до момента изъятия органов.
Используемые при этом лекарственные средства делят на две группы: препараты, улучшающие энергетическое состояние клеток во время ишемии, и препараты, повышающие резистентность мембранных образований клеток к ишемии (табл. III.2). Такое разделение является условным, но оно дает возможность дифференцировать значение каждой группы фармакологических средств для защиты органов от ишемии.
Таблица III.2 Лекарственных средства фармакологической зашиты донорских органов в организме донора
I Препараты преимущественного действияна энергозависимые процессы
Экзогенные макроэрги и субстраты окисления: АТФ, глюкоза, поляризующая смесь (калий, глюкоза, инсулин)
Предшественники и регуляторы синтеза нуклеотидов и белка: Инозин, дипиридамол, аллопуринол, пентоксил, метилурацил, эпигин
Препараты с сосудорасширяющим действием: Феноксибензамин, новокаин, аминазин, дроперидол, фентоламин
Диуретики: Маннитол, фуросемид
Регуляторы окислительно-восстановительного равновесия: Метиленовая синь, цитохром С, хиноны, витамин С, глутатион, витамин РР
II. Препараты преимущественного действия на клеточные мембранны
Стероидные гормоны: Метилпреднизолон, преднизолон. гидрокортизон
Нестероидные препараты, стабилизирующие клеточные мембраны, ингибирующие активность ферментов, в т.ч. мембранных фосфолипаз: Хлороквин, трасилол, альбумин, совкаин, лидокаин
Препараты антиоксидантного действия: Витамин Е, глутатион, глутамин, гамма-оксимасляная кислота (ГОМК), пентоксифиллин
Регуляторы внутриклеточной активности цАМФ: Допамин, пентоксифиллин
В целом схема интенсивной терапии по защите донорских органов должна удовлетворять следующим требованиям:
обеспечивать соответствующий объем циркулирующей жидкости;
обеспечивать достаточное снабжение кислородом органов и тканей;
предупреждать вазоконстрикцию;
защищать клетки, предупреждая их отек и ионный дисбаланс;
снижать уровень клеточного метаболизма;
подавлять (тормозить) токсический метаболизм и выброс ферментов.
В обощенном виде патологические проявления при СМ выделяют в ряд патологических синдромов, (таблица III.3) которые требуют патогенетически оправданного лечения.
Таблица III.3. Общие принципы этиопатогенетического кондиционирования донора
Гипотензия
Причины: Нейрогенный шок, гиповолемия
Лечение: Поддержание внутрисосудистого объема: инотропная поддержка в порядке препочтения: Дофамин «10 мкг/кг/мин добутамин (15 мкг/кг/мин адреналин «0,1 мкг/кг/мин норадреналин и дофамин 2-4 мкг/кг/мин
Аритмия, брадикардия
Причины: Повреждения центральной нервной системы, гипотермия, нарушения электролитного и газового состава крови, ишемия миокарда
Лечение: Новодрин, антиаритмики, коррекция электролитов и кислотно-щелочного состояния, согревание, метаболическая терапия
Гипоксемия
Причины: Центральные или легочные
Лечение: Проведение искусственной вентиляции легких для достижения: РаО2 = 100- 150 мм. рт. ст. РаСО2 = 35- 45 мм рт. ст. рН = 7,35-7,45
Несахарный диабет
Причины: Гипоталамо-гипофизарная дисфункция: снижение или прекращение секреции АДГ
Лечение: Возмещение потерь жидкости: адиуретин интраназально, коррекция электролитов; инотропная поддержка
Гипотермия
Причины: Утрата терморегулирующей функции гипоталамуса
Лечение: Раннее активное согревание для поддержания t тела выше 34° С: наружное согревание тела, подогретые растворы, подогретая дыхательная смесь, постоянный контроль температуры
Анемия
Причины: Кровотечение, гемодилюция
Лечение: Гемотрансфузия при Нt «30 %; трансфузия перфторана
Эндокринные нарушения
Причины: Гипоталамо-гипофизарные расстройства, гипотиреоидизм, надпочечниковая недостаточность
Лечение: Заместительная гормональная терапия: инсулин, преднизолон, метилпреднизолон, тироксин
После завершения лечебных меропрятий по кондиционированию донора можно переходить к изъятию органов, которому предшествует их гипотермическая перфузия in situ. При ее проведении решаются две задачи - 1) удаление форменных элементов крови донора, которые являются источником дополнительной антигенной стимуляции рецепиента и
2) повысить устойчивость органа к ишемии при последующей холодовой консервации.
Техника гипотермической перфузии начала применяться при заборах почек, а затем и для других органов. Гипотермическая перфузия донорских органов in situ позволяет существенно сократить время тепловой ишемии. Кроме того, под прикрытием гипотермической защиты появляется возможность выполнения операции в более спокойной обстановке, что уменьшает механическую травматизацию органа и предупреждает его хирургическое повреждение. Например быстрое (в течение 5 -10 мин) охлаждение почечной паренхимы до t = 15° С перфузией охлажденного до 4 - 6° С раствором Евроколлинз (серия рецептур, названная по имени автора - Collins) снижает потребность почечной ткани в кислороде более чем на 50 %. В результате можно эффективно предупредить ишемическое повреждение почки и повысить ее устойчивость к ишемии при последующей холодовой консервации.
Однако при снижении температуры в органе до 0 - 4° С обменные процессы замедляются, но не отменяются полностью. При длительной гипотермии в клетках продолжают развиваться ишемические повреждения. Поэтому в литературе является общепринятым понятие холодовой ишемии, которое фактически равно времени от начала гипотермической перфузии и до подключения органа к кровотоку реципиента.
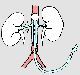
Рисунок III.1. Перфузия почек in situ.
Трансаортально вводится катетер, снабженный надувным баллончиком, обтурирующим аорту выше отхождения почечных артерий; ниже их аорта лигируется, таким образом нагнетаемый раствор (показан голубым) попадает в почки. Направление его движения в a. renalis показано стрелкой с цифрой «1», а стрелкой с цифрой «2» показан выход перфузата в v. renalis. Из: Трансплантология / Под ред. В.И. Шумакова. М.: «Медицина», 1995 с изменениями
В виду необходимости минимизации гипоксического повреждения органов разработаны и продолжают совершенствоваться методы гипотермической консервации, принципиально делящиеся на два вида - перфузионные и бесперфузионные.
Метод гипотермическской перфузии был разработан раньше, но он дороже, так как требует специальный аппарат, перфузатор, с помощью которого во время транспортировки осуществляется артерио-венозная перфузия охлажденного оксигенированного раствора с удалением продуктов окисления при 8 - 12° С. В качестве перфузатов использовали криопреципитированную плазму и бесклеточные солевые растворы, близкие по ионному составу к плазме крови с добавлением альбумина, плазмы, очищенной на селикагеле, или других онкоактивных препаратов, а также метаболитов, пролонгирующих клеточный метаболизм в условиях гипотермии.
Возникновение бесперфузионных методов гипотермической консервации (или, иначе, методов фармакохолодовой консервации) датируется 1969 г., когда было предложено проводить первоначальную отмывку органов от крови и охлаждение их не физиологическими растворами, которые по ионному составу эквивалентны плазме крови, а специальными консервирующими составами, близкими по ионному составу внутриклеточной жидкости. Оказалось, что такие растворы позволяют достигать также хороших результатов при хрании (т.е. транспортировке) органов. Известно несколько модификаций таких растворов (например, «Евроколлинз» - от имени автора первой прописи - Collins'а).
В конце 80-х годов были предложены растворы серии «UW» (от Висконсинский Университет), в которых электролиты низкой молекулярной массы заменены на электролиты и углеводы с высокой молекулярной массой - они не проникают через клеточную мембрану и препятствуют отеку клеток, снижают энерготраты клеток и ингибируют в них активацию патологических метаболических циклов, поддерживая сохранность клеточных отсеков и барьерных свойств мембран.
Технически метод бесперфузионной гипотермической консервации прост, не требует использования какого-либо специального оборудования. Он основан на кратковременной отмывке и быстром заполнении сосудистого русла органа холодным (температура 6 - 10° С) консервирующим раствором и дальнейшем бесперфузионном хранении органа при температуре 2 - 4° С.
Следует отметить, что хотя в основном время холодовой ишемии составляет время транспортировки органа, по возможности его следует минимизировать, так как удлиннение этого периода существенно сказывается на последующем выживании трансплантата, причем более не на годичном, а на длительном выживании трансплантата. Правда, следует по этому поводу отметить, что представленный график относится к ретроспективно анализируемым данным - это сразу заметно по относительно низкой как годичной, так и пятилетней выживаемости почечных трансплнтатов.
Продление сроков гипотермической консервации может быть увеличено за счет более интенсивной терапии донора перед изъятием органов. Для профилактики ишемического повреждения почек уже в организме донора проводится терапия противоишемическими препаратами. Показано, что защитное действие противоишемических препаратов реализуется лишь в условиях адекватной оксигенации тканей - ведь на молекулярном уровне задача противоишемической профилактики, в сущности, одна - создать в клетках донора максимальный резервный пул АТФ.
Для компенсации гипоксии в последние годы предложено на фоне вентиляции легких воздухом с повышенным содержанием О2 вводить внутривенно перфторуглеродные эмульсии (отечественный препарат «Перфторан»), улучшающие не только газотранспортную функцию крови донора и микроциркуляцию в его органах, но и одновременно оказвывающие мембраностабилизирующее действие при контакте с клетками донорских органов.
Несмотря на то, что в эксперименте новые подходы к гипотермической консервации позволяют достичь достаточно больших сроков хранения органов, отечественный клинический опыт не рекомендует превышать:
для почек - 72 час.,
для сердца - 2 - 3 часа,
для печени - 6 - 8 часов.
В чем же, собственно, заключается сущность патологических изменений в донорских органах, для минимизации которых используются все вышеперечисленные мероприятия?
Обычно в ВУЗовских курсах патологической физиологии и анатомии ишемия рассматривается как самостоятельный типовой патологической процесс. Может быть, это оправдано с точки зрения педагогики, однако, в реальной жизни об изолированных ишемических поражениях можно говорить тогда, когда временное ухудшение или прекращение кровоснабжения в каком-либо органе или его части достаточно быстро заканчивается либо ампутацией (в случае конечностей), либо смертью больного. Обычно же через какое-то время перфузия ишемизированной области восстанавливается, пусть даже не в прежнем объеме. Использующееся в современной литературе двойное словосочетание ишемия-реперфузия (или ишемия/реперфузия) отражает не только последовательность событий - повреждения, возникшие в гипо- или аноксический период продолжают закономерно развиваться в период восстановления кровоснабжения.
Конспективно коснемся сценария развития событий при ишемии/реперфузии. В норме (т.е. при нормоксии) около 1-2% процентов поступающего в клетку кислорода превращается в активные формы кислорода (т.е. свободнорадикальные формы). Они образуются как при работе ферментных систем - например,окислительного фосфорилирования, монооксигеназной системы, при метаболизме арахидоновой кислоты в циклооксигеназном и липоксигеназном путях - так и при автокаталитических процессах окисления-восстановления мембранных липидов.
При ишемии нарушается работа ферментных систем и образуется избыток неметаболизированных активных форм кислорода. Также нарушается равновесие в автокаталитических процессах окисления в клеточных мембранных липидах: в то время как при нормоксии существует равновесие между формированием окисленных форм липидов и их декомпозицией, то при дефиците кислорода начинает преобладать декомпозиция. Однако, если если при формировании окисленного продукта участвует молекулярный кислород, то при декомпозиции он оказывается в виде свободных радикалов в составе липопероксидов - запускается каскад неуправляемых цепных реакций перекисного окисления липидов, приводящих к повреждению клеточных структур. Таким образом, хотя это на первый взгляд кажется и парадоксальным, но ишемия индуцирует в клетке окислительный стресс.
Его последствия могут быть незначительны, абортивны и никак клинически не проявляться - такой самый благоприятный вариант развития событий будет при минимальном времени ишемии, например, при пересадке от живого донора.
Более наблагоприятным является второй вариант развития последствий окислительного стресса - выраженное повреждение ионных насосов цитоплазматической мембраны (в том числе кальциевых АТФаз) и мебран митохондрий, приводящее к опасному для клетки повышению содержания внутриклеточного кальция. Если ряд специализированных кальций-связывающих белков (т.н. стресс-белков) эндоплазматического ретикулума с ним не справляется, то происходит активация цитоплазматических кальций-зависимых протеаз, фосфолипаз и в результате - некроз клетки. Если при структурных нарушениях митохондрий происходит повреждение их ДНК, «оцениваемое» системами репарации как не подлежащее восстановлению, то это индуцирует апоптоз. Несмотря на то, что апоптоз рассматривается как управляемый («физиологический») способ смерти клетки, при его массовой индукции последствия в принципе те же, что и при некрозе.
Ясно, что доведение клеток трансплантата до массового некроза абсолютно неприемлемо и избежать этого, собственно и позволяют сложившиеся правила по изъятию и временному хранению органов. Очевидно, что какая-то часть клеток трансплантата все равно погибает в результате апоптоза, но главную опасность для трансплантологии представляет третий вариант развития событий при окислительном стрессе - собственно явления реперфузионного (иначе реоксигенационного) повреждения.
Этот, наиболее распространенный вариант развития окислительного стресса связан с активацией в эндотелиальных клетках ядерного фактора транскрипции каппа В - NFkB. Он присутствует в цитоплазме нестимулированных клеток в латентной форме - это транскрипционально активный димер, связанный с ингибиторным белком. По недостаточно еще изученным механизмам, избыток активных форм кислорода «нештатно» активирует этот фактор - в результате цепи событий происходит диссоциация фактора и ингибиторного белка, сам NF-kB транслоцируется в ядро и активирует гены путем связывания с высоким аффинитетом с каппаB-элементом их промоторов. В эндотелиальных клетках активации NF-kB принадлежит центральная роль в регуляции генов IL-1 и TNF, молекул васкулярной адгезии VCAM1 (CD106), молекул межклеточной адгезии ICAM1 (CD54), селектинов (Е-селектин - CD62E - эндотелиальная молекула адгезии лейкоцитов), тромбопластина (CD142), фактора фон Виллебранда. По сходным механизмам происходит также активация и тканевых макрофагов.
Однако в условиях гипоксии, гипоперфузии и, тем более, искусственно сниженной температуры затормаживается как белковый синтез, так и энергозависимые процессы вывода на поверхность клетки уже имевшихся белков из резервного цитоплазматического пула. Спусковой механизм взведен, но «приморожен».
Как только орган возвращается в условия нормотермии и подключается к кровотоку донора (реоксигенируется), происходит резкий выброс макрофагами и эндотелиальными клетками провоспалительных цитокинов, которые дополнительно активируют те же клетки, их синтезирующие(аутокринно) и клетки в ближайшем микроокружении (паракринно); в активированных эндотелиоцитах увеличивается вывод на поверхностную мембрану белков адгезии и активируется синтез их новых порций. С фиксации сегментоядерных лейкоцитов на эндотелиальных клетках и начинается, собственно, фаза реперфузионного повреждения. Связывание рецепторов адгезии циркулирующих нейтрофилов и моноцитов на эндотелии одновременно вызывает и активацию этих клеток - индукцию дыхательного взрыва, секрецию других цитокинов (в том числе фактора активации тромбоцитов), протеиназ и т.д. Дальнейшее развитие событий и их последствия очевидны: повреждение паренхимы за счет активации тканевых макрофагов и мигрировавших из сосудистого русла нейтрофилов, фиксация тромбоцитов на эндотелии (как за счет активации эндотелиоцитов, так и за счет их повреждения), развитие диссеминированного тромбообразования в сосудистом русле трансплантата и в результате - усугубление ишемических повреждений его паренхимы.
С наиболее выраженными процессами реперфузионного повреждения трансплантологи сталкиваются при пересадках печени, так как этот орган содержит огромное количество эндотелиоцитов и тканевых макрофагов (купферовских клеток), хотя в той или иной степени такое повреждение характерно для любого трансплантата.
Следует отметить, что с точки зрения патогенетических механизмов выделяются собственно две основные формы нарушения структуры и функции трансплантата, которые могут быть острыми или хроническими: отторжение и повреждение. Под отторжением понимается развитие изменений в органе под влиянием эффекторных механизмов специфического иммунитета (в первую очередь, HLA-рестриктированных клеток-эффекторов), а под повреждением - все остальные формы, включающие и повреждение вследствие инфекции.
Тем не менее, с точки зрения клиники, выделяются формы сверхострого и/или острого сосудистого отторжения, характеризующиеся отеком органа, нарушениями микроциркуляции, тромбированием сосудистой сети - они могут быть обусловлены повреждением эндотелия за счет «предсуществующих» комплемент-фиксирующих антител (к HLA- и другим белкам вследствие многократных предшествовавших гемотрансфузий), изоатител при AB0-несовместимости, активацией/повреждением эндотелия за счет реоксигенационного повреждения и сочетанием этих менизмов. Однако надо иметь в виду, что какие бы ни сложились названия для этих форм повреждения трансплантата, их патогенез не обусловлен клетками-эффекторами трансплантационного иммунитета. Соответственными должны быть и меры их профилактики и лечения.
Патоморфологическая картина острого повреждения показывает инфильтрацию органа полиморфноядерными лейкоцитами (рис. III.3).
Рисунок III. 3. А - биопсия почки через 30 минут после подключения трансплантата. Видно большое количество полиморфоядерных лейкоцитов в капиллярах клубочка. Б - биопсия почки через 60 минут после подключения трансплантата. Электронная микроскомия. В центре - полинуклеарный лейкоцит, прикрепившийся к двум эндотелтальным клеткам. Заимствовано из Хьюма (Пересадка органов и тканей у человека / Под ред. Ф. Раппапорта и Ж. Доссе. Пер. с англ. М.: "Медицина", 1973).
В организме реципиента после включения трансплантата в кровоток его полноценное функционирование начинается спустя некоторое время, необходимое на репарацию повреждений вследствие ишемии/реперфузии, выстраивание регуляторных связей с организмом донора, отсутствующих на первых порах из-за нервно-лимфатической децентрализации - и все это на фоне постоянного риска кризов отторжения. Рассмотрим эти процессы на наиболее изученных примерах почки и сердца.
Трансплантация почки Наиболее ясен патогенез дисфункций трансплантата непосредственно после включения его в кровоток реципиента: несмотря на все меропроятия по противоишемической защите до трансплантации, возникает его реперфузионное повреждение. В случае трансплантации почки это проявляется картиной острой почечной недостаточности (ОПН) разной степени выраженности, которая лечится по общим для этого синдрома принципам; для функциональной разгрузки трансплантированной почки с успехом применяются сеансы гемодиализа. В среднем явления ОПН купируются за 1 - 3 недели. Следует отметить, что это относится к трупной почке - пересадка почки от живого донора практически не дает осложнений, связанных с ее ишемией.
Известно, что одна здоровая почка полностью обеспечивает потребности организма. Так же и трансплантированная - в дальнейшем она начинает постепенно восстанавливать свои функции и к году после пересадки практически полностью восстанавливает функцию двух почек. В этом процессе отмечается такая особенность, как неравномерность восстановления отдельных почечных показателей: в течение первого месяца осмотическое концентрирование мочи снижено, а способность к осмотическому разведению почти отсутствует.
В течение второго месяца обе эти функции начинают достоверно возрастать, но динамика «отставания» осмотического разведения сохраняется и в дальнейшем (к году и далее) в полном объеме не восстанавливается, что, впрочем, не принципиально в плане поддержания гомеостаза функционирующим трансплантатом.
Такой благоприятный сценарий наблюдается при адекватной иммуносупресии и адеватном подборе органа по иммуногенетическим параметрам, то есть при минимально выраженной нефропатии отторжения, а также в случае отсутствия у рецепинта анти-HLA-антител - в противном случае могло бы возникнуть сверхострое отторжение после подключения почки к кровотоку реципиента. При наличии таких антител в дооперационную подготовку реципиента включаются сеансы гемосорбции, позволяющие убрать или снизить содержание таких антител.
В целом, по данным ведущих мировых центров трансплантации в 90-х годах, к году выживаемость больных составляет 90%, а число функционирующих трансплантатов составляет 90 - 95% (разница между этими показателями обусловлена ретрансплантациями. Как уже отмечалось выше, в настоящее время пятилетняя выживаемость достигла 80 - 85% и продолжает возрастать. С самого начала клинических пересадок было отмечено, что после 5 лет, в последующие 15 - 20 лет, число функционирующих трансплантатов существенно не снижается.
Касаясь «чисто» неинфекционных осложнений собственно лечения трансплантацией почки, следует отметить, что несмотря на все их многообразие, ведущим патогенетическим звеном является хроническое отторжение, т.е. их причиной является недостаточная степень гистосовместимости. При хорошем подборе постепенно снижается выраженность патологических изменений в организме реципиента, связанных с конечными стадиями почечной недостаточности и длительным лечением гемодиализом до трансплантации - гиперплазии паращитовидных желез, уремической остеодистрофии, кальцификации мягких тканей, сосудов, сухожилий, нарушений связывания кальция сывороточными белками.
При наличии же реакции хронического отторжения не только страдают все функции почек, но и развивается ряд осложнений в других органах и системах. Так, при хроническом отторжении ускоренно развивается атеросклероз почечных сосудов, а затем - коронарный атеросклероз и ишемическая болезнь сердца, которые наблюдаются у реципиентов аллогенной почки в 7 - 10 раз чаще, чем в общей популяции. Последнее связывается с развитием почечной гипертонии (гиперсекреция ренина трансплантатом и/или собственными почками реципиента, если они не удалены).
Вообще в патогенезе атеросклероза существенную роль играет активация эндотелия, стромальных, гладкомышечных и макрофагальных клеток - хотя не совсем ясно, индуцируется она за счет продукции лимфокинов инфильтрирующими лимфоцитами или лимфоцитарная инфильтрация является вторичной, возникая вследствие экспрессии адгезивных и других белков на клетках сосуда и фиксации к ним комплементарных белков-рецепторов лимфоцитов. Однако в любом случае при аллотрансплантации сосудистый эндотелий и сосудистая стенка являются «передним краем» воспалительного конфликта и если он не приводит к отторжению, то завершается быстрым развитием атеросклероза. Рис. III.4 показывает развитие артериита при аллотрансплантации в 60-е годы, то есть в условиях несовершенной иммуносупрессии и отсутствия иммуногенетического подбора.

Рисунок III.4. А - биопсия аллотрансплантата на 19-й день после пересадки: диффузная интерстициальная инфильтрация малыми лимфоцитами; интима артерии утолщена, отмечается пролиферация фибробластов и гладкомышечных клеток. Б - аутопсия (8 месяцев после трансплантации): явления интерстициального отека и фиброза, атрофические изменения клубочков; просвет артерии значительно сужен за счет выраженного эндартериита, вакуолизация клеток в стенке артерии. Из Амбурже и Дормона (Пересадка органов и тканей у человека / Под ред. Ф. Раппапорта и Ж. Доссе. Пер. с англ. М.: "Медицина", 1973).
Следует добавить, что недостаточный иммуногенетический подбор вызывает необходимость усиления иммуносупрессивной терапии циклоспорином или такролимусом, а оба эти препарата обладают побочным нефротоксическим действием, что может потенцировать «неинфекционные» нарушения почечных функций.
Касаясь собственно диагностики отторжения трансплантата, следует отметить, что в настоящее время существует международная классификация отторжения почечного трансплантата, основанная на морфологических критериях - Banff-критерии - по имени города в Канаде, где работала международная комиссия по стандартизации и номенклатуре критериев гистологического диагноза отторжения почечного трансплантата (Kidney Int., 1993, 44(2), 411). Были выделены главные диагностические категории:
норма;
сверхострое отторжение;
пограничные изменения;
острое отторжение;
хроническая нефропатия аллографта (хроническое отторжение);
прочая патология.
Предлагающиеся другие методы диагностики обязательно сравниваются с этими морфологическими критериями.
Трансплантация сердца При пересадке сердца требуется немедленное восстановление функции трансплантата и в полном объеме. Между тем непосредственно после операции в 50% случаях возникают дисфункции сердечного трансплантата различной степени выраженности, что замедляет его адаптацию в организме реципиента. Главными причинами медленной функциональной адаптации трансплантируемого сердца считаются: неадекватная подготовка донора с констатированной смертью мозга перед забором трансплантата, плохая противоишемическая зашита донорского сердца во время консервации и пересадки, неоптимальная медикаментозная поддержка после пересадки.
Наибольшая гемодинамическая нестабильность наблюдается в первые три-пять суток после трансплантации, когда продолжается введение инотропных препаратов (допамин, изопротеренол, добутамин), вазодилататоров (нитроглицерин, простагландин Е1, натрия нитропруссид) и применяется временная электрокардиостимуляция. Развитие тяжелой дисфункции трансплантата в этот период нельзя считать фатальной, так как при правильной и своевременной оценке степени повреждения пересаженного сердца можно достичь эффективной функциональной адаптации, используя методы механической подержки миокарда.
Наибольшую эффективность в настоящее время показывают способы моно- и бивентрикулярного шунтирования с помощью осевых насосов отечественной конструкции. Они представляют собой эластичную полую канюлю, в основании которой находится микронасос-турбинка, питаемый от внешего источника. Провода питания конструктивно совмещены с тросиком для внутрисосудистого введения насоса в полости сердца. Разработаны различные схемы введения насосов - чрезсосудистые, трансмиокардиальные и комбинированные.
Схема моновентрикулярной поддержки правого желудочка: осевой насос через верхнюю полую вену вводится в полость сердца и осуществляет перекачивание крови из правого желудочка в легочную артерию. При бивентрикулярной поддержке такой насос вводится через стенку правого желудочка с аналогичным его положением в полости сердца и направлением кровотока, а второй насос - через стенку левого и осуществляет перекачивание крови из полости левого желудочка в аорту.
По отчественным данным, механическая поддержка пересаженного сердца дает положительный эффект в 80 % случаях, а годичная выживаемость пациентов превышает 70 %. Неудовлетворительная функциональная адаптация при механической поддержке пересаженного сердца связана с необратимостью его повреждений, развитием мультиорганной патологии, инфекционными осложнениями.
Таким образом, современные методы реанимационного пособия, включая механическую поддержку, могут обеспечить адекватную функциональную адаптацию пересаженного сердца у большинства реципиентов. Однако удельный вес тяжелых дисфункций трансплантата все еще остается значительным (до 10 %).
Чаще всего проявляется в той или иной степени недостаточность правого желудочка сердца. В норме правый желудочек хорошо адаптирован к нагрузке объемом и плохо - к нагрузке давлением; левый желудочек, напротив, хорошо переносит нагрузку давлением и плохо - объемом. Эти особенности правого и левого желудочков обусловлены прежде всего разным сосудистым сопротивлением большого и малого кругов кровообращения. В норме сосудистое сопротивление малого круга кровообращения в 5 раз меньше, чем большого. У больных с хронической сердечной недостаточностью из-за вторичной легочной гипертензии повышается легочно-сосудистое сопротивление и давление в малом круге кровообращения.
По сути, это - компенсаторная реакция в ответ на рост конечно-диастолического давления в левом желудочке, в легочных венах и капиллярах. После ортотопической трансплантации донорского сердца неадаптированный правый желудочек должен прокачивать кровь через сосуды со значительно большим сопротивлением, чем в организме донора. В результате резко возрастает перегрузка правого желудочка, что может вызвать его декомпенсацию.
Хирургическая травма, консервация и аноксия донорского сердца приводят к временной депрессии сократительной функции сердца, продолжающейся в первые пять-семь дней после трансплантации. Большое значение имеет истощение запасов эндогенного норадреналина, который поддерживает адекватную функцию сердца.
Помимо сократительной, страдают и остальные функции сердца: автоматизм, возбудимость и проводимость. Это неизбежно влечет за собой брадикардию и нарушения гемодинамики в сердце.
Систолическая функция левого желудочка пересаженного сердца, так же как и интактного, зависит от преднагрузки (конечно-диастолический объем и давление и др.), постнагрузки (периферическая резистентность), сократимости миокарда, частоты сокращения, уровня циркулирующих катехоламинов, электрофизиологических нарушений, а также от побочных эффектов иммуносупрессивной терапии и других факторов, которые требуют дальнейшего изучения.
Гемодинамические показатели и сократимость донорского сердца в покое после короткого периода гемодинамической нестабильности в посттрансплантационном периоде достигают нормальных или субнормальных значений у большинства больных после трансплантации.
Оптимальными средствами, помогающими донорскому сердцу быстрее адаптироваться к новым для него условиям в раннем посттрансплантационном периоде, являются катехоламины, преимущественно бэта-адреностимуляторы (изопротеренол, добутамин и др.). Эти препараты повышают автоматизм, возбудимость и сократимость сердца. Одновременно они служат мощными дилятаторами сосудов малого круга кровообращения, значительно уменьшающими перегрузку давлением правого желудочка.
В первые двое суток после трансплантации, когда ударный индекс снижен, дозы вводимых катехоламинов обычно больше, чем в последующие дни. По мере возрастания ударного индекса и восстановления функции трансплантата необходимость в экзогенных катехоламинах уменьшается.
Производительность сердца компенсируется за счет тахикардии. Она регистрируется в первые двое суток после операции, а через четыре-пять дней частота сокращений сердца снижается до нормальных значений.
Пересаженное сердце, как и здоровое, во время физических нагрузок увеличивает сердечный выброс. Это связано с повышением венозного возврата, что приводит к росту конечно-диастолического объема и конечно-диастолического давления (механизм Франка-Старлинга), а также с увеличением частоты сердечных сокращений и ударного объема вследствие повышения уровня циркулирующих катехоламинов.
Следует обратить внимание на то, что денервированное катехоламин-истощенное пересаженное сердце сверхчувствительно к действию циркулирующих катехоламинов, которые способствуют максимальному повышению частоты сердечных сокращений и сердечного выброса. По отечественным данным, гуморальный адренергический механизм лежит в основе функциональной адаптации пересаженного сердца к умеренным и большим физическим нагрузкам. Поскольку бэта-адренергическая блокада снижает работу желудочков, ухудшается переносимость физических нагрузок трансплантированным сердцем.
При велоэргометрических исследованиях регистрируются замедленная реакция частоты сердечных сокращений, уменьшение скорости изменения этой частоты в период нагрузки и после ее прекращения, снижение хронотропного и инотропного резервов. Через год и более у больных показатели реакции системы кровообращения на максимальную физическую нагрузку улучшаются, однако все еще отличаются от нормы.
Относительное снижение переносимости реципиентом физических нагрузок объясняется воздействием комплекса факторов: длительной предтрансплантационной гипокинезией, миопатией скелетных мышц, вызванной длительной стероидной терапией, а также прогрессированием болезни коронарных артерий трансплантата. Однако функциональное состояние миокарда в последнем случае мало изучено.
По отчественным данным, летальность реципиентов в течение первого послеоперационного месяца составляет около 12 %. В ее структуре выделяют летальность от тотальной сердечной недостаточности - до 35 % наблюдений, от правожелудочковой недостаточности - до 13 % и от инфекционных осложнений - до 16 %.
Одной из важных причин ранней летальности является удлиннение ишемии трансплантата. При продолжительности ишемического периода более 4 часов месячная летальность увеличивается до 33 %.
В структуре летальности после года главное место занимают инфекционные осложнения - 41 %, отторжение - 14% и прогрессирующий атеросклероз венечных сосудов - 13 %.
По мировым и отечественны данным на середину 90-х гг. годичная выживаемость после ортотопических трансплантаций сердца достигает 85 - 90 %, пятилетняя - 75 %. Максимальный срок жизни с пересаженным сердцем достигает 26 лет (по состоянию на 1998 г.). При двухэтапных операциях, когда на первом этапе выполняют временное механическое замещение функции сердца или имплантируют искусственное сердце, выживаемость практически такая же. При гетеротопических трансплантациях годичная выживаемость составляет 60 %, пятилетняя - 40 %.
Отдаленные результаты операций не зависят от возраста реципиентов и характера предоперационной патологии сердца. Главным фактором, лимитирующим длительное выживание пациентов после трансплантации органов, остается тканевая несовместимость между реципиентом и донором.
При адекватном иммуногенетическом подборе экспериментальные и клинические исследования функций трансплантированных органов убеждают в том, что трансплантат за счет собственных резервов и медикаментозных средств способен адаптироваться в организме реципиента. В процессе адаптации трансплантат запускает комплекс компенсаторно-приспособительных реакций, обеспечивая гомеостаз организма в течение длительного времени. Больные становятся клинически и социально реабилитированными.
Однако многочисленные технические трудности, которые создает терминальная стадия легочно-сердечной недостаточности и соответственно, вызываемое ею снижение ранней и поздней выживаемости сердечного трансплантата, одновременно является и аргументом за своевременное принятие решения об операции пересадки.
Важнейшей задачей послеоперационного ведения больных является профилактика и эффективная борьба с инфекцией, которая является наиболее серьезным, угрожающим жизни осложнением длительной иммуносупрессивной терапии. Эта задача является непростой, так как источники инфекции широки - от латентных вирусов до патогенной флоры общего и госпитального происхождения (т.н. нозокомиальная флора), а иммуносупрессия повреждает воспалительный ответ и поэтому смазывает симптомы проникновения инфекции. У таких больных также следует учитывать взаимодействие препаратов антиинфекционной профилактики и терапии с иммуносупрессорами - в первую очередь, с циклоспорином и такролимусом, так как в этом случае возможны серьезные последствия.
Риск инфекции у реципиентов трансплантатов обусловлен двумя факторами: интенсивностью экспозиции потенциального патогена (эпидемиологическая обстановка) и сочетанным эффектом всех тех факторов, которые формируют чувствительность пациента к инфекции (плата за состояние иммунодепрессии).
Если для пациента, чей иммунный статус близок к нормальному, контакт с большим количеством патогенных возбудителей проходит незамеченным, то для пациента с максимальной степенью иммуносупрессии микроорганизмы с низкой природной вирулентностью становятся причиной агрессивной инфекции.
Эпидемиологическая обстановка может быть общей и госпитальной. К воздействию общей можно отнести недавние или отдаленные контакты с респираторными вирусами или такими ассоциированными с пищей патогенами как сальмонеллы, Listeria monocytogenes, Campilobacter jejuni. Сюда также относятся возбудители географически рестриктированных системных микозов - Blastomyces dermatitidis, Coccidioides immunitis, Histoplasma capsulatum, а также такие возбудители как Mycobacterium tuberculosis и Strongiloideus stercoralis. Иммуносупрессия амплифицирует эффекты этих инфекций, повышает риск глубокого поражения тканей и суперинфекции (дополнительного заражения новым возбудителем).
В отношении системных микозов и туберкулеза наблюдаются три характерных пути возникновения заболевания:
прогрессия первичной инфекции;
реактивация инфекции;
реинфекция (повторное заражение тем же возбудителем).
Системная диссеминация характерна для всех трех. Эти инфекции начинаются с лихорадки неясного происхождения, прогрессирующего пневмонита (т.е. атипичной пневмонии) или метастазирования в печень, кожно-эпителиальные покровы, кости и суставы, мочеполовой тракт и центральную нервную систему.
Внутри госпитальной единицы, где находится пациент, эпидемиологическая обстановка может быть домицилиарной и недомицилиарной (от лат. domus - дом и англ. domicillary - домашний, по месту жительства).
Домицилиарная эпидемиологическая обстановка формируется в результате контаминации воздуха или питьевой воды такими патогенами как аспергиллы, легионелла или грам-негативные бациллы, например, Pseudomonas auruginosa. В последние годы домицилиарные вспышки инфекций часто обусловлены ванкомицин-резистентными Enterococcus faecium, метициллин-резистентными Staphilicoccus aureus и Clostridium difficile; осуществляются передачей от человека человеку через руки персонала или через контаминированное оборудование в палате больного. Отличительным признаком домицилиарной вспышки является локализованность инфекции во времени и пространстве.
Недомицилиарная эпидемиологическая обстановка может сказываться при контаминировании воздуха внутри госпиталя - при транспортировке пациента в другие подразделения, например, в диагностические. В этом случае микрофлора имеет более общий характер, но такие вспышки труднее диагностируются, так как отсутствует их локализация. Наибольшую проблему у реципиентов представляет оппортунистическая инфекция, которая возникает у иммунодепрессированных пациентов - в этом случае инфекция возникает в отсутствие экспозиции с возбудителями. В английском языке opportunity - удобный случай, своевременность, благоприятная возможность - в отношении инфекционных возбудителей употребление этого термина стало широко использоваться в связи с вторичным иммунодефицитом при ВИЧ-инфекции - подразумевается, что удобный случай при таком состоянии иммунитета используют своеобразные, мало- или непатогенные в норме возбудители.
Состояние системной иммуносупрессии облегчает возникновение инфекционных осложнений. Это состояние возникает не только как результат иммуносупрессивной терапии. Последняя является важным фактором, но не единственным. Свой вклад вносят наличествующие у пациента аутоиммунные заболевания или функциональные дефекты иммунной системы; нарушения целостности барьерных эпителиев (кожи и слизистых - катетеры, зонды); наличие нежизнеспособных или поврежденных тканей, затеков жидкости как следствий операции. Особый вклад вносят инфекции иммуномодулирующими вирусами - в первую очередь, это цитомегаловирус (CMV), но также и вирус Епштейн-Барр (EBV), возбудители гепатитов (в первую очередь, В и С, соотв. HBV и HCV) и вирус иммунодефицита человека (HIV).
Иммуносупрессивная терапия в подавляющем большинстве органных пересадок базируется на использовании циклоспорина или такролимуса. В результате во всех случаях наблюдается настолько закономерное чередование инфекций, что можно составить «расписание посттрансплантационных инфекций». Наиболее важными в нем являются первый месяц, затем первый из следующих шести месяцев и период после шести месяцев.
IV.2.1. Инфекции первого месяца после трансплантации
В отдельных случаях инфекция заносится с трансплантатом. За исключением редких случаев диссеминированного токсоплазмоза или простого герпеса, обычно речь идет о бактериемии или фунгемии. В этих случаях инфекционный процесс возникает в области сосудистых швов и приводит к возникновению микотической аневризмы или несостоятельности швов.
Нелеченая инфекция у реципиента после трансплантации получает мощный толчок к манифестации. В частности, пересадка органа пациенту с пневмонией или повреждением легких в результате аспирации или инфаркта гарантирует суперинфекцию нозокомиальными грам-негативными бактериями или грибами или их сочетанием. Культуры микроорганизмов, полученные от донора и/или реципиента, должны использоваться как ориентир для периоперативной антимикробной терапии. Необходимо соблюдать главное условие - все инфекции должны быть элиминированы до трансплантации.
Четыре типа инфекции являются типичными для первого месяца (см. рис. IV.1), хотя более чем в 90% случаев наблюдаются нозокомиальные бактериальные или грибковые инфекции операционной раны, легких, мочевого тракта или гематогенная диссеминация флоры у хирургических больных, которые до трансплантации не были в состоянии иммуносупрессии.
Ключевым фактором в возникновении таких инфекций является объем оперативного вмешательства и уровень совершенства его технического исполнения. В любом случае риск постоперативной инфекции повышается с увеличением продолжительности инфузионной терапии, длительности использования интубации, катетеров, дренажей, расширителей и прочих чужеродных предметов; при наличии нежизнеспособных тканей и затеков жидкости. В этих случаях профилактическая антимикробная терапия может только отсрочить манифестацию инфекции - в комплексе с антимикробной терапией необходимо решить все технические и анатомические проблемы.
Примечательно отсутствие в течение первого месяца после трансплантации таких оппортунистических патогенов как Pneumocystis carinii и Nocardia asteroides. Наличие инфекции, обусловленной этими патогенами в течение первого месяца свидетельствует об очень высокой нозокомиальной опасности, или наличии у пациента иммуносупрессии до трансплантации, или предсуществовавшей инфекции у донора или реципиента.
В течение первого месяца проводится нарастающее введение иммуносупрессивных препаратов, главных детерминантов состояния системной иммуносупрессии. В ее возникновении решающим является именно длительное введение таких препаратов, а не кратковременные эффекты, наблюдаемые при режимах частичной иммуносупрессии.
После первого месяца от трансплантации изменяется природа инфекционных заболеваний реципиента. Присоединяются новые типы возбудителей, наряду с остаточными явлениями прежних. Иммуномодулирующие вирусы (в первую очередь, CMV, но также EBV и другие человеческие герпес-вирусы, HBV, HCV и HIV, если последний присутствует) начинают давать клинически проявляющиеся эффекты. В комбинации с длительной иммуносупрессией вирусная инфекция делает возможной оппортунистические инфекции, вызываемые Pneu. carinii, aspergillus, L. monocytogenes при отсутствии неблагоприятной эпидемиологической обстановки.
По прошествии шести месяцев после трансплантации в отношении инфекционных заболеваний пациенты делятся на три категории.
Первая - более 80% пациентов имеют хороший результат от трансплантации и переводятся на длительную иммуносупрессивную терапию с минимальными дозами при хорошей функции аллотрансплантата. Их проблемы в связи с инфекционными заболеваниями не отличаются от больных общего профиля и в основном связаны с респираторным трактом. Оппортунистические инфекции редки и в этих случаях обусловлены интенсивностью воздействия окружающей среды - например, случаи нокардиозов после работы в саду.
Вторая - примерно 10% пациентов имеют хронические или прогрессирующие инфекции, связанные с HBV, HCV, CMV, EBV или вирусом папилломатоза. Эти вирусные инфекции могут повреждать инфицированный орган (печень в случае вирусов гепатита, сетчатку в случае CMV) или содействовать развитию рака (гепатоцеллюлярная карцинома после HBV или HCV, лимфома, обусловленная EBV и плоскоклеточный рак, обусловленный вирусом папилломатоза).
Третья - у 5 - 10% реципиентов необходимо введение иммуносупрессоров в прежних высоких дозах, так как у них возникают повторяющиеся кризы отторжения (хроническое отторжение) - это приводит к хронизации вирусных инфекций. Для этих пациентов значительно возрастает риск возникновения оппортунистических инфекций, обусловленных Pneu. carinii, L. monocytogenes, N. asteroides, Cryptococcus neoformans, а также возбудителями из рода aspergillus. Продолжительная профилактика триметопримом - сульфометоксазолом достаточно успешно снижает средовые воздействия и рассматривается как профилактика грибковых инфекций.
Претрансплантационный скрининг должен исключать риск серьезных инфекционных осложнений и определять специфичность антимикробной терапии после трансплантации. Важное значение имеет тестирование донора на HIV, HBV, HCV. Если донор позитивен на наличие поверхностного антигена HBsAg или HIV, то перенос инфекции реципиенту гарантирован в 100% случаев. В ряде случаев показана предварительная иммунизация реципиента HBV-вакциной. Серьезную проблему представляет распространенность HCV. В США порядка 5% неживых доноров позитивны на наличие HCV-РНК в крови. В случае трансплантации печени это приводит к развитию гепатита С в 100% случаев, а не-печени (обычно почки) - в 50% в течение первых пяти лет. Учитывая дефицит донорских органов, такие пересадки считаются в некоторых конкретных случаях допустимыми, но ни в коем случае не молодым реципиентам.
Тестирование на HIV лучше предварять исключением из числа доноров лиц из группы риска. И донор и реципиент должны тестироваться на выявление антител к CMV, EBV, Toxoplasma gondii и Treponema pallida. Реципиенту до трансплантации следует проводить кожную туберкулиновую пробу и серологическое тестирование на гистоплазму, кокцидиоидоз, стронгилоидоз и трипаносомоз. Пациенты, серонегативные в отношении вируса Varicella-zoster имеют повышенный риск опасной первичной инфекции и должны вакцинироваться до трансплантации.
Мировой опыт показывает риск развития туберкулеза после трансплантации около 0,8% - но это не относится к представителям групп риска или «развивающимся странам», где этот риск существенно выше. Положительные туберкулиновые пробы указывают на риск развития активного туберкулеза после иммуносупрессии, потенциальной или клинически выраженной гепатотоксичности противотуберкулезных препаратов изониазида и рифампицина, а также изменения ими метаболизма циклоспорина или такролимуса - эти осложнения противотуберкулезных препаратов встречаются в 10 - 15%.
В стратегическом плане есть три тактики использования антимикробной терапии у реципиентов трансплантированных органов:
лечение клинически проявившейся инфекции;
профилактическое назначение антимикробных препаратов всем пациентам с целью
предотвращения микробной интервенции;
профилактическое назначение таких препаратов отдельным подгруппам пациентам, определяемым по клиническим или эпидемиологическим характеристикам или по результатам лабораторных тестов.
Профилактика для всех пациентов. В качестве надежного профилактического средства в течение 4 - 12 месяцев после трансплантации используется триметоприм - сульфометаксазол (80+400 мг в 1 таблетке 1 раз в день). Это элиминирует Pneu. carinii и снижает риск респираторных заболеваний, обусловленных L. monocytogenes, N. asteroides и T. gondii. У реципиентов почечных трансплантатов этот препарат снижает риск инфекций мочевого тракта в первые 6 месяцев с 30 - 60% до 5%.
Профилактика для отдельных групп пациентов. Данный вид профилактики базируется на лабораторных показателях, показывающих доклинические, асимптомные формы инфекционных осложнений. В качестве примера можно привести назначение ганцикловира больным, серопозитивным в отношении CMV, которым проводится лечение антилимфоцитарными антителами острого криза отторжения - в этом случае частота манифестирования CMV-инфекции снижается с 65% до 20%. Токсичность лекарственных препаратов у реципиентов трансплантатов связана с их взаимодействием. Лекарства, изменяющие метаболизм циклоспорина и такролимуса являются индукторами, ингибиторами или субстратами для экспрессированных в печени изоформ ферментов системы цитохрома Р-450 (Р-450-IIIA): CYP3A4 и CYP3A5. Оба этих фермента в основном ответственны за метаболизм циклоспорина и такролимуса (последний метаболизируется также CYP1A). Наблюдается три основных эффекта:
1) Up- регуляция метаболизма циклоспорина и такролимуса, выражающаяся в снижение их концентрации в крови с повышением риска отторжения трансплантата (рифампицин, изониазид, нафциллин);
2) Down- регуляция метаболизма циклоспорина и такролимуса, приводящая к повышению их концентрации в крови с развитием нефротоксичности, чрезмерному подавлению иммунитета с риском развития опасных для жизни инфекций. К таковым относятся два основных класса фармакологических препаратов -антибиотики-макролиды (эритромицин, кларитромицин, азитромицин) и противогрибковые препараты из группы азолов (кетоконазол, итраконазол, флюконазол);
3) Нефротоксичность, развивающаяся при использовании терапевтических доз (и нормального уровня в крови) иммуносупрессивных и антимикробных препаратов. Она может быть двух типов.
Первый: основные антимикробные препараты (фторхинолоны и триметоприм-сульфометаксазол) в низких дозах совместимы с циклоспорином или такролимусом, но при повышении дозы вызывают обусловленную последними нефротоксичность.
Второй: многие антимикробные препараты, такие как амфотерицин и аминогликозиды вызывают нефротоксичность уже при первом введении, прогрессирующую при каждом последующем.
С учетом таких взаимодействий краеугольным камнем антимикробной терапии у реципиентов трансплантатов являются бэта-лактамные антибиотики и низкие дозы фторхинолинов и азолов. Кроме того, клиницистам следует по возможности модифицировать иммуносупрессивный режим - во время антимикробной терапии и по ее завершении.
Все вышесказанное подчеркивает важность профилактики инфекций, поскольку их лечение неизбежно ассоциировано с токсическими эффектами.
Основным патогеном для реципиентов трансплантатов является CMV, который вызывает как прямые эффекты, связанные с повреждением тканей и клинически проявляющимся заболеванием, так и множество косвенных эффектов (см. рис. IV.2). Как представитель семейства герпес-вирусов CMV выступает в двух качествах - как латентный вирус и как клеточно-ассоциированный. Однажды инфицированный пациент (что проявляется лабораторным признаком, серопозитивностью), дает прибежище вирусу на всю жизнь. Активация латентной формы у реципиента трансплантата обусловлена многими факторами: лечением антилимфоцитарными антителами и цитостатиками, аллогенной реакцией, системной инфекцией и воспалением.
Системная воспалительная реакция сопровождается выбросом ТНФ и других провоспалительных цитокинов, которые, в свою очередь, инициируют выброс множества внутриклеточных вторичных мессенджеров (в частности, ядерного фактора транскрипции NF-kB), которые приводят к активации латентной формы вируса и его репликации. Реплицирующийся CMV является в высокой степени клеточно-ассоциированным, его пептиды представляются HLA-белками I класса и главной защитой от него организма-хозяина является генерация HLA-I рестриктированных вирус-специфичных цитотоксических Т-лимфоцитов.
Различные формы иммуносупрессии, применяющиеся при трансплантации, влияют на разные стадии вирусной инфекции: антилимфоцитарные антитела и цитотоксические препараты облегчают активацию латентных форм вируса, а циклоспорин, такролимус и кортикостероиды промотируют персистенцию и распространение вируса, подавляя противовирусный иммунитет хозяина. Серологические тесты являются главным средством для предупреждения инфицирования при трансплантации - пересадка органа от серопозитивного донора серонегативному реципиенту более чем на 50% увеличивает риск заболевания. Однако серологические тесты (определение титра антител или определение специфического IgM) малоинформативны при уже возникшей CMV-инфекции. Этот диагноз может ставиться после доказанной виремии или инвазии тканей. В настоящее время для этого используется определение вирусных антигенов в крови (антигенемия) или количественная полимеразная цепная реакция, либо демонстрация наличия вируса в биоптате инфицированной ткани.
Прямой эффект CMV-инфекции у реципиентов трансплантатов проявляется лихорадкой неясного генеза с общими симптомами (недомоганием, миалгией) и отклонениями в общелабораторных тестах - лимфопенией, тромбоцитопенией с нерезко выраженным относительным лимфоцитозом, слабо выраженными признаками повреждения печени и др. У реципиентов трансплантатов CMV-инфекция может давать буквально миллионы косвенных эффектов, так как вирус может реплицироваться в различных типах паренхиматозных клеток, а также эпителиальных, эндотелиальных клетках, лимфоцитах и моноцитах.
CMV активирует клеточную ДНК, синтез мРНК, синтез и экспрессию белков - Fc-рецепторов, широкого спектра молекул межклеточной адгезии, продуктов онкогенов myc и fos, гомологов HLA-белков I класса и провоспалительных цитокинов. Последние усиливают экспрессию продуктов HLA-II на клетках трансплантата. Кроме того, CMV нарушает в клетке процессинг, что блокирует представление HLA-I т.н. ранних CMV-специфичных антигенов, что рассматривается как один из факторов ускользания инфицированных клеток от специфических Т-эффекторов. К тому же, в условиях трансплантации, в MHC-несовместимом (mismatched) микроокружении, MHC-рестриктированный анти-CMV клеточный ответ недостаточно эффективен. В результате возникает CMV-индуцированный иммунодефицит и пациент становится более восприимчив к оппортунистическим инфекциям.
Все отмеченные косвенные последствия, инициируемые CMV, являются очень важными непосредственно для трансплантированного органа. Трансплантированный орган, как и любой другой в организме реципиента, становится более восприимчивым к прямым эффектам CMV. Инфекция аллографта ведет к его повреждению. В результате возникает одновременно сосуществующие дисфункция трансплантированного органа и его отторжение на фоне CMV-инфекции, но при этом отсутствуют специфические признаки, характерные для повреждения тканей, вызываемые самим CMV.
Можно выделить известную закономерность, называемую «порочным кругом»: CMV и воспалительная реакция усиливают отторжение, а лечение, подавляющие отторжение, усиливает репликацию CMV. Таким образом, реакции острого и хронического отторжения (проявляющиеся у реципиентов легких облитерирующим бронхиолитом, у реципиентов сердца ускоренным атеросклерозом коронарных артерий, у реципиентов печени синдромом облитерирующего холангита) - очень часто оказываются ассоциированными с CMV-инфекцией.
Этот вывод подтверждается тем, что у 80% реципиентов почечных трансплантатов с поздней, подтвержденной биопсией реакцией отторжения, оказалось эффективным лечение только ганцикловиром без усиления иммунодепрессивной терапии. В дополнение к этому, CMV-инфекция оказалась ассоциированной в 70% случаев с посттрансплантационными лимфопролиферативными синдромами, что объясняется индуцированной CMV иммунодепрессией, продукцией цитокинов и ростовых факторов.
Лечение клинически проявляющейся CMV-инфекции (ганцикловир внутривенно в течение 2 - 4 недель с контролем его уровня в крови) может начинаться только при документированной виремии. Менее интенсивная терапия приводит к рецидивам (50 - 75% больных с первичной инфекцией и 10 - 20% серопозитивных больных) и развитием резистентности к ганцикловиру (ганцикловир - синтетический аналог гуанина, ингибирует репликацию CMV, Herp. simplex 1 и 2 вида, EBV, Varicella-zoster. Конкурентно ингибирует встраивание в вирусную ДНК гуанозин трифосфата; встроившись в вирусную ДНК, нарушает или блокирует ее элонгацию). В этих случаях многие центры используют дополнительное введение глобулинов из гипериммунных анти-CMV-сывороток. Недостаточно интенсивное лечение ганцикловиром (пероральное назначение или низкий уровень в сыворотке) индуцирует устойчивость CMV к этому препарату.
Ясно, что все это подчеркивает значение профилактика CMV-инфекции. Здесь следует выделить три
момента.
Во- первых, интенсивность профилактики должна быть пропорциональна интенсивности иммуносупрессии и риску реактивации вируса (например, ганцикловир должен вводиться внутривенно при применении антилимфоцитарных антител).
Во- вторых, профилактика должна начинаться до реактивации вируса.
В третьих, для предотвращения рецидивов вследствие несвоевременного завершения профилактики, последняя должна быть достаточно длительной - в случаях трансплантаций с неважным прогнозом выживания трансплантата - не меньше трех месяцев.
Активная репликация EBV наблюдается в 20 - 30% случаев, когда иммуносупрессивная терапия осуществляется с помощью фармакологических препаратов и более чем в 80% случаев при применении антилимфоцитарных антител. Поскольку мононуклеозоподобный синдром (при допущении, что пациенты не были серопозитивны в отношении инф. мононуклеоза) очень похож по клинике и общелабораторным тестам на таковой, обусловленный CMV, возникает необходимость точной идентификации EBV. В случае обусловленности им PLPD речь идет о В-клеточной пролиферации, по степени тяжести ранжирующейся от легкой поликлональной пролиферации, которая исчезает со снижением интенсивности иммуносупрессивной терапии (эта форма часто встречается у детей), до высокозлокачественной моноклональной лимфомы, резистентной ко всем формам лечения.
PLPD часто начинается экстранодально (т.е. вне лимфоузлов) с инвазией ЦНС, костного мозга, пересаженного органа, гастроинтестинального тракта и нередко печени. Роль антилимфоцитарных антител и циклоспорина с такролимусом в патогенезе PLPD сводится к активации латентной EBV-инфекции, но более - к подавлению иммунной защиты в отношении иммортализованных EBV В-лимфоцитов. В качестве других факторов риска отмечаются наличие первичной EBV-инфекции до трансплантации, высокий уровень вирусной репликации в ЛОР-органах и предшествующее заболевание, обусловленное CMV. С началом EBV-инфекции любая иммуносупрессивная терапия снижается или отменяется полностью.
Среди инфекций, приводящих к инвазии тканей у реципиентов трансплантатов, легочные инфекции являются наиболее частыми. Главный принцип в лечении этих больных заключается в полной реабилитации при условии выполнения микробиологических требований: при ранней диагностике терапия должна быть безусловно специфической, т.е. учитывать чувствительность микроорганизмов. Поэтому эта цель оправдывает использование инвазивной диагностическая техники у таких больных.
Подавленный воспалительный ответ у иммунокомпромитированных реципиентов модифицирует или замедляет появление рентгенологических признаков проявлений легочных процессов. Однако именно такие признаки являются ключевыми в дифференциальном диагнозе легочных инфекций у реципиентов трансплантатов. Применение компьютерной томографии грудной клетки у таких больных революционизировало диагностический процесс. Она позволяет выявить признаки тогда, когда обычная рентгенография дает отрицательный результат или расценивает выявленные изменения как очень слабые или неспецифические. Томография также позволяет выбрать оптимальное время для инвазивных исследований с целью постановки микробиологического диагноза - например, для пункции локального плеврального очага или трансбронхиальной или торакоспической биопсии при диффузном поражении паренхимы.
В частности, выполнение всех перечисленных требований при оппортунистической грибковой или нокардиальной инфекции позволяет достичь хороших результатов в лечении. Терапия должна продолжаться до полной элиминации инфекционного агента из всех мест его локализации. Атипичная картина при компьютерной томографии означает наличие смешанной инфекции или последовательно сменяющих друг друга возбудителей, что в целом типично для посттрансплантационных состояний.
Инфекции ЦНС у реципиентов трансплантатов имеют четыре характерных признака.
1) Острый менингит обычно вызывается L. monocytogenes.
2) Подострый или хронический менингит - Crypt. neoformans, хотя системные инфекции, вызванные
M. tuberculosis, L. monocytogenes, H. capsulatum, N. asteroides, S. stercoralis, Cocc. immunitis или EBV-ассоциированное PTLD могут давать идентичные клинические синдромы (лихорадка и головная боль, продолжающаяся от нескольких дней до недели, изменение способности к умозаключениям).
3) Фокальная мозговая инфекция, проявляющаяся эпилептиформными приступами или локальными неврологическими нарушениями может быть вызвана L. monocytogenes, T. gondii, N. asteroides, редко EBV-ассоциированным PTLD, но, как правило, она бывает обусловлена метастатической инфекцией аспергиллюсами.
4) Кроме этого, прогрессирующая деменция, сопровождающаяся или не сопровождающаяся эпилептиформными приступами и неврологической симптоматикой может быть обусловлена мультифокальной лейкоэнцефалопатией вследствие инфекции паповавирусами (JC-вирус) или другими вирусами - вирусом простого герпеса, CMV, EBV и редко - демиелинизирущим процессом вследствие токсического эффекта циклоспорина или такролимуса.
За всем тем, L. monocytogenes, Crypt. neoformans и Aspergillus fumigatus являются наиболее частыми возбудителями инфекций ЦНС у реципиентов трансплантированных органов.
Проявления инфекций ЦНС у этих больных во многом отличаются от обычных пациентов. В частности, противовоспалительный эффект иммуносупрессивной терапии может затушевывать признаки менингеального воспаления при менингитах, изменения психической сферы могут быть минимальны. Наиболее надежным комплексом признаков является лихорадка неясного происхождения и головная боль, которые требуют немедленного и полного обследования головы на компьютерном томографе и люмбальной пункции.
Инфекция и отторжение неразрывно связаны и являются главными препятствиями в успехе трансплантации органов. Оптимальное лечение реципиентов трансплантированных органов имеет два основных компонента: иммуносупрессивный режим для предотвращения и лечения отторжения трансплантата и тесно с ним связанная антиинфекционная стратегия, конкретная у каждого больного.
Создание новых иммуносупрессивных программ требует создания и новых антимикробных программ. Дальнейшее повышение эффективности трансплантации органов связано с созданием новых усовершенствованных диагностических тестов для быстрого определения инфекции и мониторинга иммунных функций, а также новых средств для преодолении микробной резистентности.
В настоящее время одной из актуальнейших проблем трансплантологии стал дефицит донорских органов. Это является как бы оборотной стороной успехов пересадок - как только появилась реальная возможность продлять жизнь больных в конечных стадиях хронических заболеваний - так возник все возрастающий год от года дефицит донорских органов. Нельзя сказать, что все возможности его снижения исчерпаны, но одной из серьезно рассматриваемых возможностей является ксенотрансплантация, т.е. пересадка органов животных.
Формально ксенотрансплантация имеет давнюю историю - в истории медицины зафиксированы такие попытки, так же как и попытки переливания крови от животных. По мере становления научной медицины в экспериментальных исследованиях было выяснено, что у некоторых сочетаний видов трансплантаты разрушаются очень быстро за счет механизмов неспецифической резистентности, без необходимости включения механизмов иммунитета, связанных с распознаванием продуктов гистосовместимости - такие виды получили название дискордантных. Соответственно конкордантными стали называть сочетания видов, где не происходит немедленной активации неспецифических механизмов защиты. Однако серьезно возможности ксенопересадок стали рассматриваться только после создания поголовья трансгенных животных (свиней), чьи клетки экспрессируют человеческие белки, предотвращающие дискордантный конфликт.
Следует отметить, что в настоящее время мировое научное сообщество настороженно относится к возможностям ксенопересадок не только из-за нерешенных проблем физиологической совместимости органов человека и животных, но, в основном, из-за риска переноса человеку заболеваний животных - ксенозов и возможности запуска пандемий с непредсказуемыми последствиями. При этом отмечается, что биотехнологические фирмы уже вложили в исследования по ксенотрансплантации многие миллионы долларов, что не может не стимулировать чересчур оптимистичный тон некоторых публикаций. В целом же проблема еще далека от решения и поэтому мы предлагаем познакомиться с очень взвешенным и осторожным взглядом на ксенотрансплантацию, высказанным онкологом и вирусологом профессором R.A. Weiss’ом из Великобритании. За два c небольшим года с момента публикации статья нимало не утратила актуальности.
***
Дисбаланс между спросом и предложением на человеческие органы увеличивается. С одной стороны, растет число больных и расширяются показания для лечения трансплантацией, с другой - межнациональная кооперация уже не может обеспечивать возросшие потребности в органах, особенно почки. В этой связи исследователи начинают всерьез заниматься проработкой возможности использовать органы животных - ксенотрансплантаты.
Фактически ксеногенные пересадки не являются принципиально новыми, так как свиные сердечные клапаны пересаживаются уже много лет, поскольку являются относительно инертными тканями и не вызывают выраженного отторжения. Однако в настоящее время практическая трансплантология стоит на пороге широкого использования клеток, тканей и органов от генетически модифицированных свиней. Наряду с проблемами отторжения ксенотканей, важным моментом в этой области является риск переноса реципиентам новых зоонозов.
Главными областями применения ксенотрансплантатов и главными проблемами, ограничивающими их широкое использование, являются:
1) трансплантация свиных клеток и тканей для лечения диабета и дегенеративных заболеваний нервной системы (болезнь Паркинсона, хорея Гентингтона);
2) органные трансплантации от генетически модифицированных свиней после решения проблем преодоления иммунных и физиологических барьеров;
3) временное использование ксенографтов при отсутствии подходящего человеческого органа;
В связи с этим
а) нельзя игнорировать риска развития у реципиентов ксенографтов зоонозов и их распространения среди людей - ВИЧ и новые штаммы гриппа также были зоонозами, пока не вызвали пандемий в человеческой популяции;
б) необходима разработка руководящих принципов в области этики, безопасности и текущего контроля за использованием ксенотрансплантатов.
С точки зрения физиологии и иммунологии, высшие и человекообразные обезьяны могли бы быть наиболее подходящим источником тканей и органов. Для получения неконтаминированных детенышей можно было бы использовать кесарево сечение и для предотвращения контаминации разводить их изолированно от прочих обезьян. Наряду с этическими проблемами такого использования «ближайших родственников», обезьян слишком сложно выращивать без родителей.
В настоящее время свиньи являются единственными животными, серьезно рассматриваемыми как будущий источник органов для трансплантации, хотя также есть предположения об использовании жвачных и кенгуру. Свиньи относительно быстро растут, производят большое потомство и могут разводиться в беспатогенных условиях. Свиньи могут быть генетически модифицированы для снижения степени отторгаемости органов людьми и в настоящее время многие биотехнологические компании вкладывают в такие разработки миллионы долларов.
Этические проблемы в таком использовании свиней кажутся меньшими в сравнении с использованием приматов. В конце концов свиньи были доместицированы тысячи лет назад, они разводятся и забиваются для употребления человеком в пищу, а медицинское использование их клапанов не встретило серьезных возражений тех религий, которые не одобряют употребление свинины. Трансгенные мыши стали общеупотребительным инструментом в медицинских исследованиях и в принципе нет особой разницы в использовании трансгенных свиней. Однако в использовании свиных тканей и органов для трансплантации человеку есть нерешенные вопросы, относящиеся к областям физиологии, иммунологии и микробиологии.
Могут ли функционировать свиные ткани у человека?
Физиологические проблемы решены еще не полностью. Свиной инсулин используется уже много лет и если бы клетки Лангерганса могли бы быть успешно имплантированы, они, очевидно, могли бы правильно функционировать у больных с инсулин-зависимым диабетом. Аналогично свиное сердце могло бы адекватно функционировать, несмотря на «непривычную» для него нагрузку, связанную с необходимостью качать кровь вверх, к мозгу. Однако будут ли свиные почки адекватно отвечать на диуретические сигналы, имея от человеческих существенные отличия в структуре и функции?
Наряду с продукцией мочи, почки вырабатывают эритропоэтин, необходимый для регуляции наработки и созревания красных клеток крови. Свиной эритропоэтин не эффективен в организме человека, так как его структура не распознается эритропоэтиновыми рецепторами клеток костного мозга, значит реципиенты свиных почек должны постоянно получать экзогенный рекомбинантный эритропоэтин. Есть и другие отличия в физиологических связях почек, костного мозга, печени у человека и свиньи, поэтому сложно предсказать все последствия ксенопересадки. Эти вопросы могут быть разрешены в наиболее близкой к человеку экспериментальной системе - в пересадках свиных почек обезьянам.
Проблема продления выживания ксенографта и механизмы его отторжения
Иммунологические проблемы, которые необходимо снять для продления выживания ксенографта больше, чем при несовместимой аллотрансплантации, поскольку ксенографт отторгается тремя механизмами: сверхострым, острым и клеточно-опосредованным.
Сверхострое отторжение
Комплемент обусловливает лизис клеток, выстилающих сосуды ксенографта. Естественные человеческие антитела, взаимодействующие с остатками a-галактозы на свином эндотелии, связывают комплемент и разрушают сосудистую систему органа в течение минут после контакта с человеческой кровью. Это тот же механизм, что и при гемолизе перелитой AB0- или Rh-несовместимой крови. Сверхострое отторжение может быть супрессировано при экспрессии в организме трансгенной свиньи человеческих комплемент-регулирующих белков. В процессе сверхострого отторжения не задействованы Т-лимфоциты и оно не возникает при пересадке бессосудистых ксенографтов или человеческих аллографтов.
Острое сосудистое отторжение
Локальная активация воспалительного ответа ведет к агрегации тромбоцитов, экстравазации лейкоцитов через капилляры в паренхиму органа. В результате возникает процесс повреждения, разрушающий сосудистую сеть ксенотрансплантата за 3-5 дней. Так же как и сверхострое отторжение, острое сосудистое отторжение в основном инициируется связыванием естественными антителами остатков a-галактозы, может быть подавлено аналогичным образом и также не составляет главной проблемы для бессосудистых ксенографтов и человеческих аллографтов.
Клеточно-опосредованное отторжение
Антигены на поверхности трансплантированных ксеноклеток воспринимаются как чужеродные и впоследствии атакуются специфическими цитотоксическими Т-лимфоцитами. Поскольку это - иммунный ответ, возникающий de novo, отторжение начинается через 1 - 2 недели после трансплантации. Так же как и в случае аллографта, клеточно-опосредованное отторжение может быть подавлено иммуносупрессивными препаратами, такими как стероиды или циклоспорин А.
Предотвращение острого отторжения
У людей, также как у человекообразных обезьян и других видов обезьян Восточного полушария, в структуре углеводной части гликопротеинов отсутствует углевод галактоза-альфа(1-3)галактоза (aGal). Поскольку многие кишечные бактерии экспрессируют aGal, у всех людей есть анти-aGal антитела. Так как гликопротеины свиней содержат aGal, то эти антитела взаимодействуют с несущими их эндотелиальными клетками. Одним из путей предотвращения сверхострого отторжения является выведение «совместимых» с человеком свиней, у которых отсутствует фермент aльфа(1-3)галактозилтрансфераза и соответственно, не синтезируется aGal. Однако технология «нокаута» специфических генов у свиней пока не создана.
Альтернативной возможностью является выведение трансгенных свиней, с высоким уровнем aльфа-фукозы в гликопротеинах, которая конкурирует с aGal, а также создание трансгенных свиней, чьи клетки экспрессируют мембранные белки CD55 (DAF), CD46 (MCP), или CD59, которые ингибируют каскад активации комплемента и таким образом предотвращают сверхострое отторжение. В норме эти белки являются важными регуляторами активности комплемента и препятствуют повреждению собственных клеток. В эксперименте сердце от такой свиньи выживает до 40 дней при пересадке обезьяне, что достоверно дольше, чем сердце от обычной свиньи у иммуносупрессированной обезьяны. Таким образом, доведение таких технологий до практики позволит использовать ксеноорганы для пересадки людям в ургентных ситуациях и переждать время, пока не будет подобран соответствующий человеческий трансплантат. Это, конечно, не снимает проблемы дефицита донорских органов.
Сверхострое и острое отторжение дают меньше проблем при трансплантации ксеноклеток, поэтому это направление развивается применительно к лечению заболеваний, которые раньше не лечились трансплантацией, например, дегенеративные заболевания головного мозга и диабет. Проведена первая фаза клинических испытаний с двумя свиными тканями: панкреатическими островками, содержащими клетки Лангерганса для лечения диабета и фетальными клетками головного мозга для лечения болезни Паркинсона и хореи Гентингтона, поскольку есть надежда, что фетальные клетки, секретирующие нейротрофические факторы, смогут приостанавливать дегенеративный процесс.
Клеточно-опосредованное отторжение
Это тот же самый механизм, что и при отторжении человеческих HLA-несовместимых трансплантатов. Однако он же во многом ответственен и за распознавание вирусных инфекций. Многие вирусы, такие как цитомегаловирус, длительное время персистируют в человеческих телах, но ущерб причиняют редко, поскольку находятся постоянно под контролем Т-клеточного иммунитета. Однако эти вирусы вызывают летальный исход у иммуносупрессированных больных - больных ВИЧ или реципиентов трансплантатов. Конечно, антивирусная терапия в принципе может держать инфекцию под контролем, но степень риска слишком высока - ведь реципиенты ксеноорганов должны в течение всего срока пребывания этих органов в их организме принимать иммуносупрессивные препараты.
Могут ли свиные вирусы угрожать здоровью людей?
Многие сторонники ксенотрансплантации заявляют, что поскольку свиньи живут с людьми так долго, человек сможет справиться с любым микробом, исходящим от них. Однако ксенотрансплантация дает очень удобный путь для распространения вирусов животных.
Во- первых, будут разрушены естественные барьеры, когда свиные ткани будут помещены в человеческое тело.
Во- вторых, иммуносупрессия, необходимая для предотвращения отторжения трансплантата, будет способствовать размножению вируса и его адаптации к новому хозяину.
В третьих, человеческие гены, введенные в организм трансгенных свиней-доноров, могут способствовать адаптации вирусов животных и развитию инфекции.
Свиные вирусы могут быть нераспознаны, поскольку они не вызывают заболевания животного-носителя. Например, свиной calicivirus, близкородственный человеческому вирусу гепатита Е, был обнаружен только недавно, в 1997 г. Этот вирус может не причинять вреда самим свиньям, но быть патогенным для людей, так же как вирус герпеса В макак вызывает у самих обезьян локальные язвочки после воздействия холода, а у человека - фатальный энцефалит.
Генетически модифицированные животные могут передавать свои вирусы еще более легким путем. Человеческие белки, экспрессирующиеся на их клетках, одновременно являются и рецепторами для вирусов. CD55 служит рецептором для человеческих вирусов Коксаки В и ECHO-вирусов (относящихся к полиовирусам), вызывающих миокардит. CD46 может выступать как рецептор для вируса кори, так что возможно, что родственные им болезнетворные вирусы животных (такие как вирусы собачьей чумы и чумы крупного рогатого скота), могут быть преадаптированы в организме трансгенных животных и послужить источником инфекции у человека. Болезнетворные вирусы могут менять хозяина при каждом удобном случае, примером чему является смерть ветеринара в Австралии от энцефалита (парамиксовирус), заразившегося при вскрытии трупа лошади, в свою очередь, получившей вирус от летучей мыши. Наблюдается постоянный переход родственных, но тем не менее отличающихся вирусов от летучих мышей к свиньям, что обеспечивает контакт этих вирусов с человеком. Таким образом, разведение животных с человеческими рецепторами одновременно протягивает вирусам руку помощи.
Другой момент высокого риска при использовании трансгенных свиней связан с тем, что в процессе отделения («отпочковывания») вируса от клетки-хозяина он будет покрыт фрагментом мембранных липидов, что защитит его от инактивации человеческим комплементом. Этот механизм естественной противовирусной резистентности человека может быть нарушен при попытках создания условий выживания ксенографта в его организме.
Все эти аргументы были бы чисто академическими, если бы была уверенность в отсутствии вирусов в стаде трансгенных животных, разводимых для ксенотрансплантации. Очевидно, что многие вирусы элиминируются при разведении свиней в безмикробных условиях, но нельзя поставить заслон неизвестным вирусам. Более того, в геноме нормальных свиней содержатся интегрированные эндогенные ретровирусы, которые являются просто определенными последовательностями ДНК, наследующимися как менделирующий признак и поэтому их нельзя элиминировать. Эти вирусные последовательности в ДНК могут быть активированы и приводить к продукции инфицирующих вирусов; у свиней показан аналог вирусов лейкоза мышей, кошек и гиббонов - все это троюродные братья (second cousins) вируса иммунодефицита человека (HIV). В 1997 г. сообщено, что два свиных ретровируса способны инфицировать человеческие клетки в культуре. Эти ретровирусы, как потенциально способные к распространению в организме хозяина (т.е. человека), были выделены из нормальных лимфоцитов и эндотелиальных клеток здоровых свиней. Эти данные послужили основанием ряду британских специалистов требовать моратория на трансплантации человеку жизнеспособных ксеногенных клеток, тканей и органов.
Балансирование между риском и выгодой
Исследование тех немногих больных, которым были трансплантированы свиные островковые клетки или клетки мозга, а также двух пациентов, которым во время сеанса гемодиализа временно экстракорпорально подключалась свиная почка, пока не показали признаков ретровирусной инфекции. Если в дальнейшем исследования подобных больных также дадут отрицательный результат, то это еще не значит, что не нужно запрещать ксенотрансплантации. Есть серьезные причины проявлять осторожность. Снижение риска смерти отдельного пациента в результате пересадки ксенооргана и риск развития новой эпидемии - явления несопоставимые. Решение о будущем ксенотрансплантации должно поэтому принимать во внимание возможное воздействие на человеческую популяцию в целом. Именно по этой причине при министерстве здравоохранения Великобритании создана специальная структура для изучения проблем ксенотрансплантации, без разрешения которой клинические испытания проводиться не могут. В США FDA также недавно заявила, что вопрос о применении ксенотрансплантаций не может решаться региональными комитетами по этике и необходима разработка новых правил.
Ясно, что за получателями ксенографтов должно будет осуществляться длительное наблюдение. Однако риск развития новой эпидемии ставит больше этических и практических проблем, чем может обеспечить предполагаемый контроль за контактами каждого реципиента ксенографта. Что может обеспечить полноту такой информации? Что нужно практически предпринимать при таких контактах? Как диагностировать новые заболевания, передающиеся половым путем?
Как медицинская процедура ксенотрансплантация может принести некоторую выгоду отдельному больному и создать угрозу для общества в целом. Этот парадокс не является новой этической проблемой. Временную выгоду, приносящую затем неразрешимые в течение длительного времени проблемы дает также порочная практика врачей к чрезмерному назначению антибиотиков. Состояние больного в конкретный момент обычно улучшается, но мир оказывается наводненным мультирезистентными микробами. Близорукость ксенотрансплантологов не должна быть безразличной для всех остальных.
Взгляд в будущее
В будущем следует ожидать углубления исследований по обработке культивируемых человеческих клеток «ex vivo», чтобы полностью отказаться от использования животных. Обсуждается вопрос о необходимости криоконсервации стволовых клеток, содержащихся в крови пупочного канатика у каждого новорожденного, чтобы впоследствии их можно было использовать у того же самого человека. Кроме того, возможно клонирование из соматических клеток взрослого организма, как показал пример овечки Долли, а оно может использоваться для выращивания функционирующих человеческих тканей и в конечном счете органов. С углублением представлений о репрограммировании клеточной дифференцировки, больные смогут получать органы как «аутографты», что сделает ксенотрансплантацию ненужной, хотя такие технологии лечения в настоящий момент еще не могут быть практически выполнимыми.
Примечание: сейчас, в 2001 году, в США и UK уже принимаются конкретные решения по юридическому оформлению процедуры клонирования человеческих эмбрионов с целью их использования для терапевтических целей.
Пересадки почки от живых доноров в настоящее время (т.е. при использовании современной иммуносупрессивной терапии и вообще высокого уровня ведения пострансплантационных больных) позволили оценить всю важность минимизации ишемии/реперфузии для длительного выживания аллографтов. Это нисколько не умаляет значение иммуногенетического подбора, однако, показывает, что снижение до минимума ишемических/реперфузионных повреждений позволяет достигать длительных сроков выживания органа даже при двух мисматчах по HLA-DR. Иными словами, стали возможны успешные пересадки между генетическими родственниками и не-родственниками (там, где это позволяет законодательство). Это хорошо иллюстрирует приводимое далее сообщение о состоянии почечных трансплантаций в Норвегии.
В Великобритании и Ирландии в настоящее время ежегодно ожидает пересадки почки свыше 4500 человек, но в течение года только треть из них сможет дождаться почки от неживого донора. Сократить этот разрыв смогло бы более широкое использование почек от живых доноров. Если на Британских островах они дают всего 5 - 10 % трансплантаций, то в США - 30 % и 45 % в Норвегии. Географические и демографические условия этой страны являются главным фактором, обусловливающим развитие программы пересадок от живых доноров. Климат, плотность населения, рельеф местности в Норвегии таковы, что больного, нуждающегося в диализе, можно доставить в соответствующих центр в среднем через несколько часов. В условиях этой страны пересадка от живого донора является единственной реальной альтернативой освобождения от хронического гемодиализа. Осуществлено более 1400 пересадок от живых доноров и идея донорства широко распространена в публике - практически каждый лично знает или слышал о ком-то, кто стал донором или реципиентом почки.
Результаты трансплантации от живых доноров лучше, чем от трупов или неживых доноров. Полупериод жизни полностью HLA-совместимой трупной почки составляет около 11 лет, в то время как от живых доноров, подобранных по одному или двум гаплотипам - соответственно 12 и 26 лет. В силу этого и британские трансплантологи начинают обращаться к неродственным трансплантациям от живых доноров, в основном среди супружеских пар, но доля таких пересадок пока невелика. Причины лучшего выживания и функционирования почек от живых доноров очевидны: во-первых, у них полностью сохранна гломерулярная фильтрация и нет условий, которые могли бы ее ухудшить; во-вторых, живые доноры не испытывают кардиоваскулярных, гормональных, метаболических и прочих потрясений, характерных для смерти мозга; в-третьих, при такой операции ишемизация минимальна, в то время как трупная почка хранится в среднем 24 часа.
Факторы риска для доноров оказались на удивление малы. Периоперативная смертность составляет 0,03 %, из серии в 1200 доноров, прооперированных в Осло, живы все. Указанная смертность связана с достаточно травматичной операцией нефрэктомии, однако в госпитале Джона Гопкинса в Балтиморе разработана минимально инвазивная лапароскопическая техника нефрэктомии; прооперировано 130 лиц без осложнений.
В настоящее время британские трансплантологи ведут длительное проспективное наблюдение за донорами почек, чтобы наконец разрешить старые сомнения - вредна ли в действительности для здорового человека унилатеральная нефрэктомия (по материалам публикации: Nicholson M.L., Bradley J.A. BMJ, 1999, V.318, p.409).
Примечание: эти данные нисколько не протеворечат излагавшемуся в предыдущих разделах принципу максимальной HLA-совместимости донора и реципиента. Они очень ярко показывают ключевую роль ишемических/реперфузионных повреждений - при их практическом отсутствии (но при условии современной и адекватной иммунодепрессии!) даже "половинная" совместимость лучше, чем нулевой мисматч при кадаверной почке.