Книга: Медицинская микробиология, иммунология и вирусология

Сергей Бабичев, Александр Коротяев
Медицинская микробиология, иммунология и вирусология
В учебник внесены существенные дополнения и уточнения на основании опубликованных за последние годы новых научных данных. В частности, в соответствии с новым Определителем бактерий Берги (George M. Garrity, Julia A. Bell, Timothy G. Lilburn. Taxonomic Outline of the Prokaryotes. Bergey's Manual of Systematic Bacteriology, Second Edition. Release 5.0, May 2004) уточнена классификация бактерий: их принадлежность к доменам, типам и классам, а для многих бактерий, которые чаще всего вызывают заболевания у людей и о которых идет речь в учебнике, к семействам, родам и видам. Приведены сведения о возбудителе так называемой атипичной пневмонии, уточнены сведения о хантавирусах, вирусе TTV, возможных механизмах возникновения нового пандемического варианта вируса гриппа A, новейших молекулярно-биологических методах диагностики инфекционных болезней (геномная дактилоскопия, варианты ПЦР и др.). Полнее описаны особенности генетического контроля синтеза факторов патогенности у бактерий, мобильные генетические элементы и «острова патогенности», роль конвертирующих фагов, плазмид вирулентности, IS-элементов и транспозонов в горизонтальной передаче генов патогенности у бактерий. Представлены данные о новых синтетических индукторах синтеза эндогенного интерферона, которые используют для лечения вирусных инфекций. Внесены также уточнения и дополнения во многие другие разделы учебника. Специальный раздел учебника посвящен руководителям кафедр микробиологии многих медицинских вузов России за всю историю этих кафедр. Авторы выражают глубокую благодарность нынешним руководителям кафедр микробиологии, любезно предоставившим необходимые сведения обо всех своих коллегах-предшественниках. 5-е издание учебника отличается от предыдущих тем, что в нем, помимо неизбежных уточнений и дополнений, связанных с накоплением новых научных данных, полностью переработана заключительная глава (глава 74). Она посвящена обсуждению той роли, которую сыграли две главные системы информации – генетическая, присущая всем живым существам, и умственная (интеллектуальная), свойственная исключительно человеку, в возникновении и развитии как биологической, так и общественной, социальной жизни.
Система умственной информации возникла в ходе эволюции предка человека в сторону Homo sapiens благодаря тем генетическим предпосылкам, которые привели к образованию двух новых аппаратов – мышления и голосового, а вместе с ними к возникновению главной кодовой единицы новой, умственной системы информации – слова. Слово (словесный код) и стало главным «орудием разума», как его определил Л. Н. Толстой.
Умственная информация, в отличие от генетической, не передается по наследству. Она формируется заново у каждого человека в течение всей его жизни. С помощью словесного кода эта информация материализуется и поэтому передается от поколения к поколению, определяя форму уклада общественной жизни.
Авторы заранее благодарят читателей за критические замечания, которые могут быть высказаны по обсуждаемым вопросам, отдавая себе полный отчет в том, что все эти вопросы будут еще долгое время занимать умы многих людей и окончательный ответ на них будет получен лишь в результате новых научных достижений. В подготовке к изданию учебника оказали неоценимую помощь наши дорогие жены Р. А. Коротяева и Н. В. Бабичева, сыновья А. И. Коротяева Борис и Михаил, а также Т. Л. Коротяева. Без их огромной поддержки и помощи мы вряд ли смогли бы осилить такую работу. Мы безгранично благодарны им за все.
Прежде чем приступить к изучению той или иной науки, будущий специалист должен убедиться в том, что эти знания действительно необходимы для его успешной деятельности. Для чего нужно будущему врачу изучать микробиологию, иммунологию и вирусологию? Во-первых, чтобы узнать о природе так называемых заразных (инфекционных) болезней, о том, какие микроорганизмы и каким образом их вызывают. Во-вторых, для овладения современными методами их диагностики, эффективными способами профилактики и лечения. Все эти вопросы, безусловно, имеют громадное прикладное значение. Наконец, изучение иммунологии дает возможность узнать, какими мощными естественными механизмами самозащиты и самоисцеления, с помощью которых, главным образом, поддерживается на протяжении всей жизни состояние здоровья и осуществляется противостояние болезням, обладает наш организм.
Природа многообразна и едина. Все, что ее составляет, взаимосвязано. В конечном счете между собою взаимодействуют все живые существа, и, вместе с тем, на них воздействуют различные абиотические факторы окружающей среды.
Здоровье человека – это бесценный дар природы, но оно постоянно подвергается атаке со стороны самых различных внешних сил, которые и вызывают болезни. Организм человека как бы постоянно балансирует между состоянием здоровья и болезнью, переход между которыми может быть незаметным, постепенным. Это хорошо понимали врачи древности. Гален (131 – 211): «Здоровье есть состояние, при котором тело человека по натуре и по сочетанию (частиц) таково, что все исходящие от него действия (совершаются) здраво и полностью. Болезнь есть состояние человеческого тела противоположное этому, а (третье) состояние не есть ни здоровье, ни болезнь».
Авиценна (XI в. н. э.): «Бывает тело, здоровое до предела, тело здоровое, но не до предела; тело не здоровое, но и не больное… затем тело в хорошем состоянии, быстро воспринимающее здоровье; затем – тело, больное легким недугом, затем – тело, больное до предела».
Существуют различные определения болезни, однако самое простое, лаконичное и понятное для всех определение дал Карл Маркс. По его мнению, болезнь – это «стесненная в своей свободе жизнь». Но из этого следует, что здоровье – это ничем не стесненное проявление жизни.
Наиболее полное определение здоровья дано специалистами Всемирной организации здравоохранения (ВОЗ): «Здоровье – это состояние полного физического, психического и социального благополучия, а не только отсутствие болезней или физических дефектов». Причин болезней, а стало быть самих болезней, очень много. Но факторы (причины), их вызывающие, можно свести к нескольким категориям:
– механические повреждения, являющиеся причиной многочисленных травматических заболеваний;
– физические факторы, среди которых наибольшую опасность представляет радиоактивное облучение;
– химические факторы. Загрязнение окружающей среды (воздуха, воды, почвы) вредными для здоровья живых существ химическими веществами уже привело к экологической катастрофе, выход из которой возможен только усилиями всех стран мира;
– биологические факторы, прежде всего микроорганизмы, являющиеся причиной инфекционных болезней;
– особую группу составляют наследственные заболевания, в основе которых лежат передача родителями по наследству поврежденных генов или нарушение механизмов обмена генами.
Инфекционных, т. е. вызываемых микроорганизмами, заболеваний очень много. Практически ими болеет в течение своей жизни хотя бы раз, а то и несколько каждый человек. К микроорганизмам относятся живые существа, размеры которых столь малы, что они не видны невооруженным глазом.
Медицинская микробиология изучает морфологию, физиологию обмена веществ, факторы патогенности, механизмы их реализации на клеточном и молекулярно-генетическом уровнях у возбудителей инфекционных заболеваний человека и разрабатывает специфические методы их диагностики, лечения и профилактики.
Медицинская вирусология – наука, изучающая молекулярно-генетическую структуру вирусов, их свойства, механизм взаимодействия с клеткой, их роль в жизни человека как возбудителей различных инфекционных заболеваний, а также разрабатывает методы специфической диагностики, лечения и профилактики этих болезней. В методическом отношении вирусология существенно отличается от микробиологии, поскольку вирусы, в отличие от других микробов, не размножаются на искусственных питательных средах, и для их культивирования используют другие приемы.
Иммунология – наука, изучающая биологические механизмы самозащиты организма, направленные на распознавание и уничтожение с помощью специальных иммунных систем любых чужеродных веществ и клеток, проникающих в него или образующихся в нем, и способствующие поддержанию его структурной и функциональной целостности и биологической индивидуальности. Основную роль в формировании и сохранении иммунитета играют системы интерферонов, макрофагов, комплемента, Т– и В-лимфоцитов; различные киллерные клетки, главная система гистосовместимости и антитела. Для изучения функций этих систем иммунология использует свои особые методы. Предметом иммунологии является также разработка специфических методов диагностики, лечения и профилактики различных болезней и изучение заболеваний самой иммунной системы.
Теоретическое значение изучения этих наук трудно переоценить. Достижения микробиологии, вирусологии, в особенности генетики микроорганизмов, а также иммунологии позволили понять фундаментальные процессы жизнедеятельности, протекающие на молекулярно-генетическом уровне. Они обусловливают современное понимание сущности механизмов развития заболеваний (патогенеза болезни) и намечают пути их наиболее эффективного предупреждения и лечения.
Практическое значение этих наук определяется тем, что инфекционные болезни по-прежнему представляют грозную опасность для здоровья и жизни людей. По данным ВОЗ, из 51 млн человек, ежегодно умирающих в мире в последнее время, более чем у 16 млн причиной смерти являются инфекционные болезни. В России ими ежегодно болеют от 30 до 50 млн человек. В ХХ в. мировому сообществу удалось ликвидировать только одну болезнь – натуральную оспу, а столкнулось человечество с 36 новыми и «возникающими» инфекциями, т. е. болезнями, которые либо неожиданно появляются, либо быстро распространяются среди людей (СПИД, болезнь Лайма, болезни Эбола, Марбурга, легионеров, вирусные гепатиты, геморрагические лихорадки и др.).
Впервые в истории человечества возникла реальная угроза использования международными террористами биологического оружия, в качестве которого могут быть применены возбудители особо опасных и некоторых других заболеваний и продуцируемые ими токсины.
Исторический опыт показал, что основным оружием в борьбе с инфекционными болезнями является создание у людей коллективного иммунитета к возбудителям соответствующих заболеваний. Именно благодаря иммунизации против оспы, осуществленной под эгидой ВОЗ, в октябре 1977 г. была полностью ликвидирована эта одна из самых опасных болезней. Этот опыт послужил основой для создания международной службы по ликвидации инфекционных заболеваний. Разработанная ВОЗ расширенная программа иммунизации предполагает создание у всех детей первого года жизни иммунитета против туберкулеза, гепатита В, дифтерии, коклюша, столбняка, полиомиелита и кори. Таковы впечатляющие успехи медицины в борьбе с этой категорией болезней человека. Однако здесь остается еще много сложных проблем, решение которых зависит от развития микробиологии, вирусологии и иммунологии. Активная иммунизация населения позволяет управлять этими заболеваниями, т. е. существенно снижать заболеваемость вплоть до полной их ликвидации.
Существует два пути решения этой проблемы: а) эрадикация инфекции, т. е. искоренение возбудителя как биологического вида; б) элиминация инфекции, т. е. практическое прекращение заболеваемости, когда циркуляция возбудителя сохраняется только в форме носительства. Именно благодаря иммунизации в октябре 1977 г. была полностью ликвидирована на всей Земле оспа – одна из самых опасных болезней. С помощью иммунизации был ликвидирован полиомиелит в 1994 г. в Американском регионе ВОЗ, в 2000 г. – в регионе Западной части Тихого океана. 21 июня 2002 г. зоной, свободной от полиомиелита, объявлены Россия и весь Европейский регион ВОЗ (25 стран). Близок день, когда вслед за оспой на Земле будет полностью ликвидирован полиомиелит.
Несмотря на ликвидацию полиомиелита в нашей стране, наблюдаются нередкие случаи так называемого вакцино-ассоциированного паралитического полиомиелита (ВАПП), причиной которого служит вакцинный штамм. В связи с этим для ликвидации случаев ВАПП предложено использовать либо инактивированную полиомиелитную вакцину (ИПВ), либо ее комбинацию с живой оральной поливакциной (ОПВ).
В 2008 г. исполнилось 25 лет со времени открытия возбудителя ВИЧ-инфекции французским ученым Л. Монтанье, который был награжден Нобелевской премией. За эти годы многое сделано в изучении ВИЧ-инфекции. К сожалению, пандемия ВИЧ-инфекции продолжает оставаться одной из самых сложных проблем мирового здравоохранения, так как до сих пор нет высокоэффективных вакцин для ее профилактики и препаратов для лечения.
ВОЗ разработана расширенная программа иммунизации (РПИ) не только против оспы и полиомиелита, но и против таких тяжелых заболеваний, как дифтерия, корь, коклюш, краснуха, эпидемический паротит, гепатиты B и A, столбняк, туберкулез. По этой программе предусмотрено создание к 2025 г. средств для иммунопрофилактики еще 25 – 30 инфекций. Ближайшими целями ВОЗ поставлены эрадикация полиомиелита во всем мире и ликвидация кори в Европе к 2007 г., а к 2010 г. – во всем мире.
Для успешного решения программы ВОЗ по иммунизации широко ведутся исследования по улучшению биотехнологии изготовления вакцин и повышения их иммуногенной активности. Ведется разработка около 350 вакцин – кандидатов против 100 различных заболеваний. Уже предложен целый ряд новых препаратов, таких как комбинированная вакцина против гепатитов А и B, цельнокультуральная пероральная поливалентная менингококковая ABC-вакцина, тетравакцина для предотвращения возможной пандемии гриппа, которая содержит антигены как вируса гриппа человека H1N1 и H3N2, так и вируса птичьего гриппа H5N1 и др. С 2007 г. в России вступили в силу разработанные ВОЗ особые международные медико-санитарные правила (ММСП), направленные на предотвращение распространения опасных заболеваний.
ОБЩАЯ МИКРОБИОЛОГИЯ
Краткий исторический очерк становления и развития микробиологии, иммунологии и вирусологии
Размеры микроорганизмов лежат за пределами разрешающей способности человеческого глаза, поэтому до изобретения микроскопа человек не знал о существовании столь мелких живых существ. Однако, не зная об этом, люди на протяжении тысячелетий научились широко использовать в своих целях процессы жизнедеятельности многих микробов, в частности, для приготовления кумыса и других молочнокислых продуктов, получения вина, уксуса, пива, силосования кормов, мочки льна и т. п. В течение многих веков природа процессов брожения оставалась неясной. Наряду с этим человек давно познал и другую сторону жизнедеятельности микроорганизмов: их способность вызывать повальные заразные («прилипчивые») болезни, от которых погибало множество людей. Происхождение и причины таких болезней также тысячелетиями были непонятны. Вместе с тем давно подмечено, что существует определенное сходство между процессами брожения и гниения, с одной стороны, и заразными болезнями, часто сопровождаемыми образованием гноя, с другой. Родство слов «гниль» и «гной» говорит о давности такого мнения. Поэтому много веков назад возникла мысль, что решение вопроса о природе брожения и гниения приведет к пониманию и природы заразных болезней. Особенно четко эту мысль выразил в XVII в. английский ученый Р. Бойль, который пророчески предсказал, что природу заразных болезней разгадает тот, кто отгадает тайну брожения.
О природе заразных болезней высказывались различные предположения, в том числе и такое, что их возбудителями являются какие-то мельчайшие живые существа – контагии. В наиболее законченной форме эта идея была сформулирована в XVI в. выдающимся итальянским ученым, поэтом и врачом Джироламо Фракасторо. В своем главном медицинском труде «О контагии, контагиозных болезнях и лечении» (1546) он четко сформулировал положение, что зараза – это материальное начало («контагий телесен»). По его мнению, заражение происходит тремя путями: через непосредственное соприкосновение, опосредованно через предметы и на расстоянии, но при обязательном участии мельчайших невидимых контагий («зародышей болезней»). Фракасторо же впервые использовал термин «инфекция» в медицинском смысле. Идея Фракасторо была правильной и плодотворной, но для ее научного доказательства не было еще необходимых научно-технических предпосылок – не было микроскопа.

Дж. Фракасторо (1478 – 1553)

А. Левенгук (1632 – 1723)
Открытие микробов смогло осуществиться лишь во второй половине XVII в., когда в связи с развитием торговли назрела потребность в усовершенствовании оптики для мореплавания (подзорные трубы, телескопы и т. п.). Впервые микроскоп был сконструирован в Голландии Гансом и Захарием Янсенами в 1590 г., но он давал еще очень слабое увеличение (всего в 32 раза) и не позволял увидеть бактерии. Открытие мира микробов связано с именем А. Левенгука. С помощью своего микроскопа, дающего увеличение до 300 раз, он в 1674 г. обнаружил и описал эритроциты человека, лягушек и рыб, в 1675 г. – простейших, в 1677 г. – сперматозоиды. А. Левенгук наблюдал клетки более чем 200 видов растений и животных. Свои наблюдения он описывал в письмах (всего их было около 300), направляя их в Лондонское Королевское Общество. Членом этого Общества он был избран в 1680 г. Первое из этих писем направил его друг, голландский ученый Р. Грааф, в 1673 г. В 1683 г. А. Левенгук подробно описал и зарисовал основные формы бактерий. С открытия Левенгука начинается период зарождения микробиологии как науки и ее становления. Этот период получил название «микрографического», так как изучение микроорганизмов сводилось лишь к описанию различных их форм, доступных исследованию при помощи далеко не совершенного микроскопа. Их биологические свойства и значение для человека долго еще оставались во многом непонятными.
Первые сведения о микроорганизмах были весьма скудными, поэтому К. Линней в XVIII в. выделил их в один род под названием Chaos и отнес к червям. В развитии микробиологии в этом периоде, продолжавшемся до середины XIX в., большое значение имели работы русских исследователей М. М. Тереховского (1740 – 1796) и Д. С. Самойловича (Сущинского). Большая заслуга М. М. Тереховского состоит в том, что он одним из первых использовал экспериментальный метод в микробиологии: он изучал влияние на микроорганизмы электрических разрядов разной силы, температуры, различных химических веществ; изучал их размножение, дыхание и т. п. К сожалению, его работы были мало известны в то время и не смогли оказать большого влияния на развитие микробиологии. Работы выдающегося русского врача Д. С. Самойловича получили самое широкое признание. Он был избран членом 12 зарубежных академий наук. Д. С. Самойлович вошел в историю микробиологии как один из первых (если не первый) «охотников» за возбудителем чумы. Впервые он принял участие в борьбе с чумой в 1771 г. во время вспышки ее в Москве, а затем с 1784 г. участвовал в ликвидации вспышек чумы в Херсоне, Кременчуге (1784), Тамани (1796), Одессе (1797), Феодосии (1799). С 1793 г. он был главным доктором карантинов юга России. Д. С. Самойлович был убежденным сторонником гипотезы о живой природе возбудителя чумы и за сто с лишним лет до открытия микроба пытался обнаружить его. Лишь несовершенство микроскопов того времени помешало ему сделать это. Он разработал и применил целый комплекс противочумных мероприятий. Наблюдая за чумой, он пришел к выводу, что после перенесения чумы к ней остается иммунитет. Одна из главных научных заслуг Д. С. Самойловича – идея о возможности создания искусственного иммунитета против чумы с помощью прививок. Своими идеями Д. С. Самойлович выступил как провозвестник зарождения новой науки – иммунологии. В это же время (конец XVIII – начало XIX вв.) английский врач Э. Дженнер впервые успешно осуществил древнюю мечту человечества: обуздать одну из самых страшных болезней человека – натуральную оспу – с помощью вакцинации (искусственных прививок возбудителя коровьей оспы).

Д. С. Самойлович (1744 – 1805)

Э. Дженнер (1749 – 1823)
По мере расширения методов изучения свойств микроорганизмов стала возможной и их систематика. В 1786 г. О. Мюллер выделил два рода бактерий – Monas и Vibrio – и отнес их к группе инфузорий. В 1838 г. К. Эренберг переименовал их в семейства Monadna с одним родом (Monas) и Vibrionia, в котором выделил четыре рода: Bacterium, Spirillum, Vibrio и Spirochaeta. Большой вклад в систематику микробов внес один из основоположников отечественной микробиологии Л. С. Ценковский (1822 – 1887). В своей работе «О низших водорослях и инфузориях» (1855) он установил место бактерий в системе живых существ, указав на близость их к растениям. Л. С. Ценковский описал 43 новых вида микроорганизмов, выяснил микробную природу клека (слизеподобная масса, образуемая на измельченной свекле). Впоследствии, независимо от Пастера, он получил сибиреязвенную вакцину, а будучи профессором Харьковского университета (1872 – 1887), способствовал организации Пастеровской станции в Харькове.
В 1857 г. П. Негели выделил все бактерии в одну самостоятельную группу Schizomycetes (грибы-дробянки). Вывод Л. С. Ценковского о природе бактерий поддержал в 1872 г. Ф. Кон, который отделил бактерии от простейших и отнес их к царству растений.
Второй период микробиологии – период ее подлинного рождения как самостоятельной биологической науки и стремительного развития – связан прежде всего с именами Л. Пастера, Р. Коха и их учеников. Любая наука рождается только тогда, когда для этого созреют необходимые научные и технические предпосылки, а также социально-экономические потребности в ней. Это общее правило. К середине XIX в. научно-технические условия для рождения такой науки, как микробиология, вполне созрели: были сконструированы микроскопы с высокой разрешающей способностью и обнаружено много различных видов микроорганизмов. Наступило время выяснить и доказать их важную роль для человека, в частности, в качестве виновников различных заболеваний людей, животных и растений, а также в процессах брожения и гниения.
В медицине в это время господствовала клеточная теория патологии Р. Вирхова (1821 – 1902), в соответствии с которой «все болезни в конце концов сводятся к активным или пассивным повреждениям большего или меньшего количества клеток», но она ничего не говорит о причинах, их вызывающих. В то же время у больных животных и людей в организме находили различные микроорганизмы. Нужно было решить вопрос: являются ли они следствием болезни или ее причиной?
К середине 50-х гг. XIX в. стало ясно, что пока не будет выяснена природа гнойных осложнений ран, дальнейший прогресс медицины вообще, и хирургии в особенности, не возможен. Наконец, незнание биологических основ технологических процессов, лежащих в основе производства вина и пива, наносило большой экономический ущерб. Таким образом, сама жизнь требовала решения этих проблем.
Окончив в 1847 г. Эколь Нормаль (одно из лучших высших учебных заведений Франции), Л. Пастер выполнил две докторские диссертации – по химии и физике. Последняя была посвящена изучению явлений, относящихся к вращательной поляризации жидкостей. В ходе изучения изомеров винной кислоты он впервые непосредственно столкнулся с деятельностью микроорганизмов. Добавляя плесневой гриб в оптически неактивную смесь двух изомеров винной кислоты, Л. Пастер обнаружил, что через некоторое время эта смесь начинает вращать плоскость поляризации влево вследствие разрушения правого изомера грибом. Это обстоятельство натолкнуло его на мысль о возможном участии микроорганизмов в процессах брожения. Действительно, после нескольких лет напряженных исследований Л. Пастер установил, что процессы брожения вызываются микроорганизмами, причем каждый вид брожения – определенным видом. Позднее он установил, что и гниение (разложение белковых продуктов) – результат жизнедеятельности микроорганизмов. Таким образом, природа процессов брожения и гниения была наконец выяснена. Трудно переоценить все значение этих открытий Л. Пастера. Благодаря им были заложены основы технической (промышленной) микробиологии, выяснена роль микробов в круговороте веществ в природе, открыты анаэробные организмы. На основе этих работ Л. Пастера Дж. Листером (1827 – 1912) были разработаны принципы антисептики, а затем Л. Пастер дополнил их принципами асептики, благодаря которым и стал возможен дальнейший прогресс в хирургии. Исходя из своих исследований, Л. Пастер смог установить природу болезней вина и пива, показав, что они также являются результатом жизнедеятельности микроорганизмов. Он предложил и метод их предупреждения, названный впоследствии пастеризацией, а затем (после решения проблемы самозарождения) были разработаны методы стерилизации (автоклавирование), столь необходимые для обеспечения принципов асептики в медицине и развития консервной промышленности. Выяснение природы процессов брожения и гниения вновь поставило на повестку дня вопрос о возможности самозарождения жизни, теперь уже на уровне микроорганизмов. Оппоненты Л. Пастера утверждали, что в субстратах, подвергающихся брожению или гниению, их возбудители самозарождаются. Безупречными экспериментами Л. Пастер доказал, что микроорганизмы проникают из окружающей среды, а не самозарождаются. Своими исследованиями Л. Пастер подготовил научную общественность к пониманию того непреложного положения, что главными виновниками заразных болезней человека и животных являются микроорганизмы. Однако это нужно было доказать на конкретных примерах. Не будучи врачом, Л. Пастер привлек к своим работам высоко талантливого врача Э. Ру (1853 – 1933) и приступил к изучению болезнетворных бактерий. Пастер выделил из крови больного сибирской язвой животного палочку, получил ее чистую культуру и, заражая ею здоровое животное, наблюдал его гибель от сибирской язвы. Аналогичные опыты он поставил с куриной холерой и получил такие же результаты. Этими безукоризненными опытами была бесспорно доказана микробная природа заразных болезней.

Л. Пастер (1822 – 1895)

Р. Кох (1843 – 1910)
В 1876 г. заявил о себе и другой исследователь, оказавший огромное влияние на становление и развитие медицинской микробиологии, – Роберт Кох. В своей работе Р. Кох подвел окончательную черту под многолетней дискуссией о природе бактерий, обнаруживаемых у больных сибирской язвой животных. Дискуссия шла по вопросу: являются ли обнаруживаемые бактерии случайными спутниками болезни или причиной ее? Р. Кох точными экспериментами доказал, что возбудителем сибирской язвы является микроорганизм Bacillus anthracis. «Благодаря французу Пастеру было верно понято значение сибиреязвенных палочек, а благодаря немцу Коху было доказано их значение как единственных возбудителей сибирской язвы» (И. И. Мечников). Р. Коху микробиология обязана прежде всего тем, что он усовершенствовал бактериологическую методику. Он предложил метод выделения чистых культур из изолированных колоний на плотных средах, способы окраски бактерий анилиновыми красителями и внес усовершенствования в технику микроскопирования – конденсор Аббе и иммерсионные объективы. Все это способствовало широкому распространению экспериментальных исследований микроорганизмов и разработке бактериологических методов диагностики инфекционных болезней. Кроме того, Р. Коху принадлежит огромная историческая заслуга в открытии возбудителей тяжелейших заболеваний человека – туберкулеза и холеры.
Так благодаря Л. Пастеру и Р. Коху возникла и начала быстро развиваться новая наука – микробиология. Такое название ей дал соратник Л. Пастера П. Дюкло, а Пастер назвал ее вначале «микробией». Все невидимые простым глазом живые существа Ч. Седийо в 1878 г. предложил называть микробами. Открытия возбудителей заразных заболеваний после работ Пастера следовали буквально одно за другим:
1874 г. – палочка проказы (Г. Хансен);
1879 г. – гонококк (А. Нейссер);
1880 г. – палочка брюшного тифа (К. Эберт);
1880 г. – малярийный плазмодий (А. Лаверан);
1880 – 1884 гг. – стафилококк (Л. Пастер, А. Огстон, А. Розенбах);
1882 г. – туберкулезная палочка (Р. Кох);
1883 г. – холерный вибрион (Р. Кох);
1884 г. – дифтерийная палочка (Ф. Леффлер);
1886 г. – пневмококк (А. Френкель).
С 1874 по 1900 г. были открыты возбудители более чем 35 заболеваний человека и животных; открытия продолжаются и в наше время.
Л. Пастер после обоснования микробной природы заразных болезней и открытия ряда их возбудителей поставил далее своей главной целью не поиски других патогенных бактерий, а разработку общего принципа борьбы с заразными болезнями. И эту задачу он также блестяще решил. Однажды Пастер обнаружил любопытный факт: хранившиеся долгое время в термостате возбудители куриной холеры утратили свою заразительность для кур. Нужны были наблюдательность и гений Пастера, чтобы на основании этого маленького факта сделать выводы, которые определили основные направления борьбы с заразными заболеваниями. Пастер предположил, что ослабленные бактерии могут сыграть роль, подобную осповакцине Дженнера, которая надежно предохраняет от натуральной оспы. Оставалось только найти способы ослабления (аттенуации) заразительности бактерий. Пастер решил добиться ослабления заразительности сибиреязвенной палочки и получить из нее вакцину (этот термин со времен Дженнера он сохранил, и ныне все препараты, используемые для создания искусственного активного иммунитета, называют «вакцинами») методом, сходным с получением вакцины из возбудителей куриной холеры. Он выращивал сибиреязвенную палочку не при 37 °C, а при более высокой температуре (42 – 43 °C) и получил два варианта вакцины – более и менее ослабленную.
5 мая 1881 г. на ферме Пуй ле Фор под Парижем начался невиданный в истории медицины публичный эксперимент: 27 животных (главным образом овцы) были привиты полученной Пастером сибиреязвенной вакциной. 17 мая им была сделана прививка повторно, но уже менее ослабленной вакциной, а 31 мая наступил решающий момент: всех вакцинированных животных и столько же невакцинированных заразили смертельной дозой сибиреязвенной палочки. Перед этим опытом Пастер уверенно заявил, что все вакцинированные животные устоят перед инфекцией, а невакцинированные – умрут. Так и получилось. Блестящий успех этого эксперимента показал, что человечество получило надежное оружие борьбы против инфекционных болезней. Так, начав с изучения природы брожения, решая одну за другой практические задачи общества, Пастер совершил одно из величайших открытий и заложил научные основы наиболее эффективной борьбы с заразными болезнями с помощью искусственной иммунизации. Завершая свою научную деятельность, Л. Пастер после долгих и упорных опытов получил вакцину против бешенства. Сложность решения этой задачи состояла в том, что возбудителем бешенства является вирус, которого Пастер не мог увидеть под микроскопом и который не размножался на искусственных питательных средах. Только благодаря гению Пастера удалось превратить уличный вирус бешенства в вакцину против бешенства, которая до сих пор является единственным средством защиты от этой страшной болезни. Высокая эффективность вакцины против бешенства быстро подтвердилась. Ее стали называть «пастеровской», и вскоре в различных странах мира (раньше всего в России, в Одессе, И. И. Мечников) стали открывать пастеровские станции, где людям, пострадавшим от нападения бешеных животных, спасали жизнь с помощью пастеровской вакцины. Успех идей Пастера был настолько велик, что для него в Париже на собранные по международной подписке деньги был построен и открыт 14 ноября 1888 г. специальный институт (Пастеровский институт), ставший мировым научным центром микробиологии. 22 декабря 1892 г. Пастеру исполнилось 70 лет, его чествование имело международный характер. Юбиляру была вручена специальная золотая медаль, на которой выгравированы такие слова: «Пастеру в день его семидесятилетия – благодарная наука и человечество». Скончался Л. Пастер 22 сентября 1895 г. Его тело погребено в гробнице Пастеровского института. Над аркой перед входом в усыпальницу выбито всего три слова: «Ici repose Pasteur» («Здесь покоится Пастер»). На мемориальной доске, установленной на здании Эколь Нормаль, так лаконично записана хронология научной жизни Пастера:
«Здесь была лаборатория Пастера.
1857 г. Брожение.
1860 г. Самопроизвольное зарождение.
1865 г. Болезни вина и пива.
1881 г. Зараза и вакцина.
1885 г. Предохранение от бешенства».
Пастер не только создал микробиологию как фундаментальную биологическую науку, но и определил ее основные разделы, которые затем выделились в качестве самостоятельных научных дисциплин со своими целями и задачами: общая микробиология (изучает фундаментальные закономерности биологии микроорганизмов); техническая (промышленная) микробиология (изучает различные типы процессов брожения, которые используются для получения спиртов, ацетона, глицерина и т. п., а также разрабатывает и организует производство с помощью микробов продуцентов антибиотиков, витаминов и других биологически активных соединений); сельскохозяйственная микробиология (изучает почвенную микрофлору, ее роль в круговороте веществ в природе и влияние на структуру и плодородие почв, а также болезни растений, методы предупреждения и борьбы с ними и т. п.); ветеринарная микробиология (изучает биологию возбудителей заразных болезней животных и разрабатывает методы специфической диагностики, профилактики и лечения их; она тесно связана с медицинской микробиологией, так как имеются болезни, общие для животных и человека и передающиеся от животных к человеку).
Из всех разделов микробиологии наибольшее значение для человечества имело развитие медицинской микробиологии – науки, которая занимается изучением биологии болезнетворных микробов и особенностей взаимодействия их с организмом человека. Задачей медицинской микробиологии является не только выяснение этиологии инфекционных заболеваний, но и разработка специфических методов их диагностики, профилактики и лечения. Как известно, здесь достигнуты громадные успехи, которыми мы в значительной степени обязаны тому, что в ходе исторического развития микробиологии возникли и стали бурно развиваться такие новые биологические науки, как иммунология, вирусология, учение об антибиотиках и плазмидах.
То, что человек, переболевший заразной болезнью, повторно ею, как правило, не болеет, было известно очень давно. Однако о механизмах, обеспечивающих такую приобретенную устойчивость (иммунитет), стало известно лишь в результате исследований И. И. Мечникова, П. Эрлиха и их многочисленных учеников.
Выдающийся русский ученый И. И. Мечников не только был одним из основоположников микробиологии, в том числе и отечественной, но по праву считается вместе с П. Эрлихом основоположником иммунологии. Он открыл явление фагоцитоза и впервые в истории медицины показал, что целебные силы организма связаны с особой группой клеток, названных им «фагоцитами». Идеи И. И. Мечникова горячо поддержал Л. Пастер, он пригласил его и предложил возглавить лабораторию в Пастеровском институте. Здесь и работал И. И. Мечников с 1887 г. до конца жизни. После того как было установлено, что против бактерий и их токсинов в организме вырабатываются различные антитела (антитоксины, бактериолизины, опсонины, агглютинины и т. п.), П. Эрлих предложил гуморальную теорию иммунитета. В многолетней и на редкость плодотворной научной дискуссии между сторонниками фагоцитарной теории иммунитета Мечникова и гуморальной – Эрлиха – фактически были раскрыты многие механизмы иммунитета и родилась иммунология. Обе теории оказались правомочными – И. И. Мечникову и П. Эрлиху за исследования по иммунитету в 1908 г. была присуждена Нобелевская премия.

И. И. Мечников (1845 – 1916)

П. Эрлих (1854 – 1915)
В развитие иммунологии большой вклад внесли ученики И. И. Мечникова – А. М. Безредка (1870 – 1940), Л. А. Тарасевич (1868 – 1927), И. Г. Савченко, В. И. Исаев – и такие ученые, как Э. Ру, А. Иерсен, Э. Беринг, Ш. Китазато, Ж. Борде, О. Жангу, Г. Рамон и др.
В результате последующих многочисленных исследований было установлено, что и наследственный, и приобретенный иммунитеты обеспечиваются согласованной деятельностью пяти основных систем: макрофагов; комплемента; Т– и В-лимфоцитов; интерферонов; главной системы гистосовместимости. Они и обеспечивают различные формы иммунного ответа.
12 февраля 1892 г. на заседании Российской академии наук Д. И. Ивановский сообщил о том, что возбудителем мозаичной болезни табака является фильтрующийся вирус. Эту дату можно считать днем рождения вирусологии, а Д. И. Ивановского – ее основоположником. Очень скоро выяснилось, что вирусы вызывают заболевания не только растений, но и человека, животных и бактерий. Они оказались столь же вездесущими, как и другие микроорганизмы. Развитие вирусологии, также ставшей фундаментальной биологической наукой, определялось совершенствованием методов исследования вирусов и их культивирования. Необычные свойства вирусов на многие годы затянули решение вопроса об их природе. Только после расшифровки природы гена и генетического кода вирусы были признаны живыми существами, хотя они по многим свойствам отличаются от всех других организмов. Л. Пастер, создавая вакцину против бешенства, вплотную подошел к открытию вирусов, во всяком случае, он предсказал их существование. Здесь прослеживается историческая связь микробиологии с вирусологией. Между созданием вакцины против бешенства и открытием вирусов Д. И. Ивановским прошло всего 8 лет.

Д. И. Ивановский (1864 – 1920)

А. Флеминг (1881 – 1955)
Следующим важным этапом в развитии микробиологии было открытие антибиотиков. В 1929 г. А. Флеминг открыл пенициллин, и началась новая эра – эра антибиотикотерапии, которой суждено было произвести подлинную революцию в медицине. А изучение природы лекарственной устойчивости, которая стала эпидемически распространяться среди бактерий, привело к очередному важному открытию. Оказалось, что у многих бактерий, устойчивых к антибиотикам и иным химиопрепаратам, существует два генома – хромосомный и плазмидный. Изучение плазмид привело к выводу о том, что они представляют собой еще более простые организмы, чем вирусы, и в отличие от последних не разрушают бактерии, а наделяют их дополнительными важными биологическими свойствами. Открытие плазмид и изучение их свойств расширили и углубили представление о формах существования жизни и путях ее эволюции.
Новый этап развития микробиологии, иммунологии и вирусологии начался во второй половине ХХ в. в связи с рождением молекулярной генетики и молекулярной биологии. В 1944 г. в опытах по трансформации пневмококков впервые было доказано, что носителем генов является ДНК. Использование бактерий, вирусов, а затем и плазмид в качестве объектов молекулярно-генетических и молекулярно-биологических исследований привело к более глубокому пониманию фундаментальных процессов, лежащих в основе жизни. В области иммунологии исследования на молекулярно-генетическом и молекулярно-биологическом уровне позволили раскрыть структуру антител; выяснить, как осуществляется генетический контроль их биосинтеза, каковы механизмы дифференцировки иммунокомпетентных клеток и их взаимодействия в выдаче различных вариантов иммунного ответа. Иммунология вплотную подошла к раскрытию основных принципов и закономерностей саморегуляции иммунной системы на всех ее уровнях. Открываются широкие перспективы использования иммунобиологических модуляторов для лечения различных форм иммунодефицитов, включая рак. За последние годы расшифрована молекулярно-генетическая организация многих вирусов, изучены механизмы их взаимодействия с клетками, особенности противовирусного иммунитета, открыты и изучены различные вирусы, в том числе относящиеся к семейству Retroviridae (ВИЧ), выяснены в общих чертах механизмы, с помощью которых онковирусы вызывают трансформацию нормальных клеток в опухолевые. Большие успехи достигнуты в изучении генетического, в том числе плазмидного, контроля факторов патогенности и механизма действия многих бактериальных экзотоксинов. Разработаны принципы получения и производства, в том числе генно-инженерными методами, новых поколений вакцин. Созданы реальные предпосылки для ликвидации ряда инфекционных заболеваний уже в ближайшее время с помощью массовой вакцинации. Успешный опыт по ликвидации на Земле оспы позволяет надеяться, что с помощью расширенной программы иммунизации, осуществляемой под эгидой ВОЗ, такие болезни, как полиомиелит, краснуха, корь, эпидемический паротит, также будут ликвидированы, а заболеваемость туберкулезом, дифтерией, столбняком, коклюшем и некоторыми другими болезнями будет значительно снижена.
За открытия в области микробиологии Нобелевских премий удостоены многие выдающиеся ученые: Э. Беринг (1901), Р. Кох (1905), И. И. Мечников, П. Эрлих (1906), Ш. Лаверан (1907), Ш. Рише (1913), Ж. Борде (1919), Ш. Николь (1928), К. Ландштейнер (1930), Г. Домагк (1939), А. Флеминг, Х. Флори, Э. Чейн (1945), М. Тейлер (1951), С. Ваксман (1952), Ф. Робинс, Д. Эндерс, Т. Веллер (1954), Д. Ледерберг (1958), А. Корнберг, С. Очоа (1959), Ф. Бернет, П. Медавар (1960), Ф. Крик, М. Х. Уилкинс, Д. Уотсон (1962), Ф. Жакоб, А. Львов, Ж. Моно (1965), Ф. Раус (1966), М. Ниренберг, Р. Холли, Х. Корана (1968), М. Дельбрюк, А. Херши, С. Лурия (1969), Д. Балтимор, Р. Дульбекко, Х. Темин (1970), Б. Блюмберг, К. Гайдушек (1976), В. Арбер, Д. Натанс, Х. Смит (1978), Ж. Доссе, Б. Бенасерраф, Д. Снелл (1980), Б. Мак-Клинток (1983), Г. Келлер, Ц. Мильштейн, Н. Ерне (1984), С. П. Прузинер (1997).
Российским ученым принадлежит большая заслуга в развитии микробиологии, иммунологии и вирусологии. Рядом с именами И. И. Мечникова, Д. И. Ивановского по праву можно поставить имена и многих других выдающихся ученых. С. Н. Виноградский является основоположником почвенной микробиологии и одним из организаторов Русского микробиологического общества (1903 г.). С 1932 г. и до конца жизни он руководил агробиологическим отделом Пастеровского института в Париже. П. Ф. Боровский (1863 – 1932) и Ф. А. Леш (1840 – 1903) – первооткрыватели патогенных простейших, лейшманий и дизентерийной амебы. И. Г. Савченко установил стрептококковую этиологию скарлатины, первым использовал антитоксическую сыворотку для ее лечения, предложил вакцину против нее, создал Казанскую школу микробиологов в России и вместе с И. И. Мечниковым изучал механизм фагоцитоза и проблемы специфической профилактики холеры. Д. К. Заболотный (1866 – 1929) – крупнейший организатор борьбы с чумой, установил и доказал ее природную очаговость. Он создал первую самостоятельную кафедру бактериологии в Петербургском женском медицинском институте в 1898 г.

С. Н. Виноградский (1856 – 1953)

И. Г. Савченко (1862 – 1932)

В. Д. Тимаков (1904 – 1977)
Большой вклад в развитие общей, технической и сельскохозяйственной микробиологии внесли академики В. Н. Шапошников (1884 – 1968), Н. Д. Иерусалимский (1901 – 1967), Б. Л. Исаченко (1871 – 1947), Н. А. Красильников (1896 – 1973), В. Л. Омелянский (1867 – 1928), С. П. Костычев (1877 – 1931), Е. И. Мишустин (1901 – 1983) и их многочисленные ученики. Медицинская микробиология, вирусология и иммунология во многом обязаны исследованиям таких широко известных отечественных ученых, как Н. Ф. Гамалея (1859 – 1949), П. Ф. Здродовский (1890 – 1976), Л. А. Зильбер (1894 – 1966), В. Д. Тимаков, Е. И. Марциновский (1874 – 1934), В. М. Жданов (1914 – 1987), З. В. Ермольева (1898 – 1979), А. А. Смородинцев (1901 – 1989), М. П. Чумаков (1909 – 1990), П. Н. Кашкин (1902 – 1991), Б. П. Первушин (1895 – 1961) и многих других. Трудами отечественных микробиологов, иммунологов и вирусологов внесен крупный вклад в развитие мировой науки, в теорию и практику здравоохранения.
Преподавание в России микробиологии было начато И. И. Мечниковым и Я. Ю. Бардахом в 1885 г. в Новороссийском университете (Одесса). В 1892 г. Г. Н. Габричевский (1860 – 1907) организовал в Московском университете самостоятельный курс бактериологии, на основе которого затем была создана кафедра.
Микроскопические методы исследования микроорганизмов
Размеры всех объектов, являющихся предметом изучения микробиологии и вирусологии, лежат далеко за пределами разрешающей способности человеческого глаза. Морфология микроорганизма (его форма, размеры, взаиморасположение клеток, поверхностные структуры, внутренняя организация) является чрезвычайно важной его характеристикой и лежит в основе таксономии. Поэтому одним из главных методов исследования в области микробиологии является микроскопия. Основу микроскопических методов исследования составляют световая микроскопия со всеми ее разновидностями (темнопольная, фазово-контрастная, аноптральная, люминесцентная и др.) и электронная микроскопия. Выбор метода определяется целями, стоящими перед исследователем.
В основе световой микроскопии лежат различные свойства света. Современные световые микроскопы представляют собой довольно сложные приборы, совершенствуемые в течение 400 лет с момента создания первого прототипа микроскопа. Современный биологический световой микроскоп состоит из следующих основных элементов: штатива, состоящего из массивного основания (башмака), и тубусодержателя, на котором смонтирована механическая система грубой и тонкой настройки, револьвер с 3 – 4 сменными объективами, предметный столик с конденсором и диафрагмой и под ним светонаправляющее зеркало, концентрирующее естественный или искусственный свет на объект исследования, находящийся на предметном столике. Тубусодержатель микроскопа заканчивается головкой, на которой крепится монокулярный или бинокулярный тубус с окуляром или окулярами. Предметный столик имеет приспособление для крепления предметного стекла с препаратом и механизма для его перемещения.
Иммерсионная световая микроскопия
Важнейшей характеристикой каждого объектива, как и любой оптической системы, является его разрешающая способность. Под разрешающей способностью понимают минимальное расстояние между двумя точками, при котором они еще видны раздельно, т. е. не сливаются в одну. Разрешающая способность объектива ограничивается такими недостатками оптической системы, как сферическая и хроматическая аберрация, дифракция и т. д. Если первые два явления устранимы, то явление дифракции наблюдается в любой оптической системе. Она ограничивает разрешающую способность оптических систем. Разрешающая способность объектива с учетом явлений дифракции описывается следующей формулой:
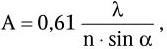
где А – разрешающая способность; n – показатель преломления среды между препаратом и фронтальной линзой объектива (в случае масляной иммерсии n = 1,51);
α – угол между оптической осью объектива и самым крайним лучом, попадающим в объектив из центра препарата; λ – длина световой волны; 0,61 – коэффициент учета геометрических факторов при вычислении освещенности первого дифракционного максимума от круглого отверстия.
Величина n · sin α постоянна для каждого объектива и называется числовой, или нумерической, апертурой. Она выгравирована на оправе объектива. В монобромнафталиновых иммерсионных объективах нумерическая апертура может варьировать в пределах от 1,25 до 1,60. При наличии воздуха между фронтальной линзой и покровным стеклом нумерическая апертура не превышает 0,95 (сухие объективы). Из приведенной выше формулы видно, что разрешающая способность объектива прямо пропорциональна его числовой апертуре и обратно пропорциональна длине волны света, используемого для микроскопии. При микроскопии в видимом свете с длиной волны 0,55 мкм (550 нм) и иммерсионным объективом с нумерической максимальной апертурой 1,60 разрешающая способность равна:

Таким образом, даже в идеальном световом микроскопе нельзя увидеть объекты размером менее 0,2 мкм.
Величина угла, при котором глаз способен различать раздельно две точки, называется углом резкого зрения. Для получения на сетчатке четкого раздельного изображения двух точек световые лучи должны попасть в глаз под углом зрения, который стягивает дугу от 2 до 4 минут.
Изображение структур, разрешенных объективом, может быть увеличено окуляром лишь настолько, чтобы было различимо под углом, стягивающим дугу величиной от 2 до 4 минут. Это полезное увеличение микроскопа. Полезное увеличение микроскопа не может превышать числовую апертуру более чем в 1000 раз. Поэтому максимальное полезное увеличение для микроскопов, имеющих иммерсионные объективы с апертурой 1,4 – 1,6, составляет 1400 – 1600. Применение в таких микроскопах более сильных окуляров не выявляет никаких дополнительных деталей в разрешаемой объективом структуре препарата.
Фазово-контрастная микроскопия
Обыкновенные окрашенные препараты поглощают часть проходящего через них света, в результате чего амплитуда световых волн снижается, и частицы препарата выглядят темнее фона. При прохождении света через неокрашенный препарат амплитуда световых волн не меняется, происходит лишь изменение фазы световых волн, прошедших через частицы препарата. Однако человеческий глаз улавливать это изменение фазы света не способен, поэтому неокрашенный препарат при правильной установке освещения в микроскопе будет невидим.
Фазово-контрастное устройство позволяет превратить изменение фазы лучей, прошедших через частицы неокрашенного препарата, в изменения амплитуды, воспринимаемые человеческим глазом, и, таким образом, позволяет сделать неокрашенные препараты отчетливо видимыми.
Приспособление для фазово-контрастной микроскопии включает в себя конденсор с набором кольцевых диафрагм, обеспечивающих освещение препарата полным конусом света, и фазово-контрастные объективы, которые отличаются от обычных тем, что в их главном фокусе располагается полупрозрачная фазовая пластинка в виде кольца, вызывающая сдвиг фазы проходящего через нее света. Установку освещения проводят так, чтобы весь свет, прошедший через кольцевидную диафрагму конденсора, в дальнейшем прошел через расположенное в объективе фазовое кольцо.
При рассмотрении препарата весь свет, прошедший через участки препарата, в которых нет каких-либо объектов, пройдет через фазовое кольцо и даст светлое изображение фона. Свет, прошедший через имеющиеся в препарате частицы, например бактериальные клетки, получит некоторое изменение фазы и, кроме того, разделится на два луча – недифрагированный и дифрагированный. Недифрагированные лучи, пройдя в дальнейшем через кольцевидную фазовую пластинку в объективе, получат дополнительный сдвиг фазы. Дифрагированные лучи пройдут мимо фазовой пластинки, и их фаза не изменится. В плоскости полевой диафрагмы окуляра произойдет интерференция (наложение) дифрагированного и недифрагированного лучей, а так как эти лучи идут в разных фазах, произойдет их взаимное частичное гашение и уменьшение амплитуды. Благодаря этому микробные клетки будут выглядеть темными на светлом фоне.
Существенными недостатками фазово-контрастной микроскопии являются слабая контрастность получаемых изображений и наличие светящихся ореолов вокруг объектов. Фазово-контрастная микроскопия не увеличивает разрешающей способности микроскопа, но помогает выявить детали структуры живых бактерий, стадии их развития, изменения в них под действием различных агентов (антибиотики, химические вещества и т. д.).
Аноптральная микроскопия (амплитудно-контрастная, фазово-темнопольная)
Аноптральная микроскопия – разновидность фазово-контрастной микроскопии, при которой применяют объективы со специальными пластинками, нанесенными на одну из линз в виде затемненного кольца.
Принцип аноптральной микроскопии тот же, что и фазово-контрастной, но первая обладает большей разрешающей способностью при микроскопировании объектов, вызывающих незначительный фазовый сдвиг, и открывает новые возможности использования обычного светового микроскопа для прижизненного исследования бактерий, простейших и т. д.
Широкое центральное отверстие в слое копоти или меди, нанесенном на линзу объектива, является как бы люком, выпускающим из объектива бwольшую часть дифрагированного света, в то время как широкий темный слой кольца, покрывающий остальную поверхность линзы, играет роль ловушки для нежелательного периферического дифрагированного света. За счет этого в значительной степени устраняется ореол вокруг исследуемого объекта, фон поля зрения имеет коричневато-серый цвет, а сами объекты имеют различные оттенки от светло-коричневого до белого.
Интерференционная микроскопия решает те же задачи, что и фазово-контрастная, но если последняя позволяет наблюдать лишь контуры объектов исследования, то с помощью интерференционной микроскопии можно изучать детали прозрачного объекта и проводить их количественный анализ. Это достигается благодаря раздвоению луча света в микроскопе: один из лучей проходит через частицу объекта, а другой мимо нее. В окуляре микроскопа оба луча соединяются и интерферируют между собой. Разность возникающих фаз можно измерить, определив таким образом массу различных клеточных структур. Последовательное измерение разности фаз света с известными показателями преломления дает возможность определять толщину живых объектов, концентрацию в них воды и сухого вещества и т. д. На основании данных интерференционной микроскопии можно косвенно судить о проницаемости мембран, активности ферментов, клеточном метаболизме объектов исследования.
Поляризационная микроскопия позволяет изучать объекты исследования в свете, образованном двумя лучами, поляризованными во взаимно перпендикулярных плоскостях, т. е. в поляризованном свете. Для этого используют пленчатые поляроиды или призмы Николя, которые помещают в микроскопе между источником света и препаратом. Поляризация меняется при прохождении лучей света через различные структурные компоненты клеток и тканей, свойства которых неоднородны, или при отражении от них. В оптически изотропных структурах скорость распространения поляризованного света не зависит от плоскости поляризации, в анизотропных структурах она меняется в зависимости от направления света по продольной или поперечной оси объекта. Если показатель преломления света вдоль структуры больше, чем в поперечном направлении, возникает положительное двойное лучепреломление, при обратных взаимоотношениях – отрицательное двойное лучепреломление. Многие биологические объекты имеют строгую молекулярную ориентацию, являются анизотропными и вызывают положительное двойное преломление света.
При микроскопии по методу темного поля препарат освещается сбоку косыми пучками лучей, не попадающими в объектив. В объектив попадают лишь лучи, которые отклоняются частицами препарата в результате отражения, преломления или дифракции. В силу этого микробные клетки и другие частицы представляются ярко светящимися на черном фоне (картина напоминает мерцающее звездное небо).
Для микроскопии в темном поле используют специальный конденсор (параболоид-конденсор или кардиоид-конденсор) и обычные объективы. Поскольку апертура иммерсионного объектива больше, чем апертура конденсора темного поля, внутрь иммерсионного объектива вставляется специальная трубчатая диафрагма, снижающая его апертуру.
Этот метод микроскопии удобен при изучении живых бактерий, спирохет и их подвижности.
Метод основан на способности некоторых веществ светиться под действием коротковолновых лучей света. При этом длина волны излучаемого при люминесценции света всегда будет больше, чем длина волны света, возбуждающего люминесценцию. Так, если освещать объект синим светом, он будет испускать лучи красного, оранжевого, желтого и зеленого цвета. Препараты для люминесцентной микроскопии окрашивают специальными светящимися красителями – флуорохромами (акридиновый оранжевый, изотиоцианат флуоресцеина и др.). Лучи света от сильного источника (обычно ртутной лампы сверхвысокого давления) пропускают через сине-фиолетовый светофильтр. Под действием этого коротковолнового излучения окрашенные флуорохромом клетки или бактерии начинают светиться красным или зеленым светом. Для того чтобы синий свет, вызвавший люминесценцию, не мешал наблюдению, над окуляром ставят запирающий желтый светофильтр, задерживающий синие, но пропускающий желтые, красные и зеленые лучи. В результате при наблюдении в люминесцентном микроскопе на темном фоне будут видны клетки или бактерии, светящиеся желтым, зеленым или красным светом. Например, при окраске акридиновым оранжевым ДНК клетки (ядерное вещество) будет светиться ярко-зеленым светом. Метод люминесцентной микроскопии позволяет изучать живые нефиксированные бактерии, окрашенные сильно разведенными флуорохромами, не причиняющими вреда микробным клеткам. По характеру свечения могут быть дифференцированы отдельные химические вещества, входящие в состав микробной клетки. Метод с успехом может быть использован для ускоренной диагностики ряда заболеваний (см. также раздел «Реакция иммунофлуоресценции» в гл. 42).
Для изучения структуры клеток на субклеточном и молекулярном уровнях, а также для изучения вирусов используют электронную микроскопию. Ценность электронной микроскопии заключается в ее способности разрешать объекты, не разрешаемые оптическим микроскопом в видимом или ультрафиолетовом свете. Малая длина волны электронов, которая уменьшается в прямой зависимости от подаваемого ускоряющего напряжения, позволяет разрешать, т. е. различать как отдельные объекты, отстоящие друг от друга всего на 2 2 (0,2 нм, или 0,0002 мкм) или даже меньше, в то время как предел разрешения световой оптики лежит вблизи 0,2 мкм (он зависит от длины волны используемого света). Электронная микроскопия, при которой изображение получают благодаря прохождению (просвечиванию) электронов через образец, называется просвечивающей (трансмиссионной). При сканирующей (растровой), или туннельной, электронной микроскопии пучок электронов быстро сканирует (просматривает) поверхность образца, вызывая излучение (отражение), которое посредством катодно-лучевой трубки формирует изображение на светящемся экране микроскопа по аналогии с формированием телевизионного изображения.
Принципиальная оптическая схема электронного микроскопа аналогична схеме светового, в котором все оптические элементы заменены соответствующими электрическими: источник света – источником электронов, стеклянные линзы – линзами электромагнитными. В электронных микроскопах просвечивающего типа различают три системы: электронно-оптическую, вакуумную, электропитания. Фотографирование изображений при всех видах исследований проводится на фотопластинки или фотопленку. Источником электронов является электронная пушка, состоящая из V-образного вольфрамового термокатода, который при нагревании до 2900 °C при подаче постоянного напряжения до 100 кВ в результате термоэмиссии испускает свободные электроны, ускоряемые затем электростатическим полем, создаваемым между фокусирующим электродом и анодом. Электронный пучок затем формируется с помощью конденсорных линз и направляется на исследуемый объект. Электроны, проходя сквозь объект, за счет его разной толщины и электроноплотности отклоняются под различными углами и попадают в объективную линзу, которая формирует первое полезное увеличение объекта.
После объективной линзы электроны попадают в промежуточную линзу, которая предназначена для плавного изменения увеличения микроскопа и получения дифракции с участков исследуемого образца. Проекционная линза создает конечное увеличенное изображение объекта, которое направляется на флуоресцирующий экран. Благодаря взаимодействию быстрых электронов с люминофором экрана на нем возникает видимое изображение объекта. После наведения резкости сразу проводят фотографирование. Увеличение конечного изображения на экране определяется как произведение увеличений, даваемых объективной, промежуточной и проекционной линзами.
Электронно-микроскопическому исследованию могут быть подвергнуты как ультратонкие срезы различных тканей, клеток, микроорганизмов, так и целые бактериальные клетки, вирусы, фаги, а также субклеточные структуры, выделяемые при разрушении клеток различными способами.
Современные модели электронных микроскопов устроены так, что сочетают в себе возможности как просвечивающего, так и сканирующего микроскопов, и их легко можно переоборудовать с одного типа на другой. При просвечивающей электронной микроскопии получают плоскостные изображения объекта, а при сканирующей – удается получить трехмерное объемное изображение (с помощью компьютера). В бактериологии сканирование наиболее эффективно для выявления отростков и других поверхностных структур, для определения формы и топографических отношений как в колониях, так и на поверхности инфицированных тканей.
Электронная микроскопия требует специальной подготовки объектов исследования, в частности: фиксации тканей или микроорганизмов, обезвоживания (так как вода сильно рассеивает электроны), заливки в твердые среды (эпоксидные смолы), приготовления ультратонких срезов. С целью повышения четкости наблюдаемой картины используют методы позитивного или негативного контрастирования, а также метод оттенения.
При сканирующей микроскопии образец фиксируют, высушивают на холоде и напыляют в вакууме золотом или другими тяжелыми металлами. Таким образом получают реплику (отпечаток), повторяющую контуры образца и впоследствии сканируемую.
Основные принципы классификации микроорганизмов. Происхождение и пути эволюции микроорганизмов
Мир микроорганизмов чрезвычайно разнообразен. По мере их открытия и изучения они были разделены на следующие группы:
1. Бактерии – Schizomycetes (грибы-дробянки; лат. schizo – расщепляю и mycetes – грибы).
2. Лучистые грибы – Actinomycetes (лат. actino – луч).
3. Нитчатые грибы – Trichomycetes (греч. trichos – волос).
4. Дрожжевые грибы – Blastomycetes (греч. blastos – почка, размножаются почкованием).
5. Сине-зеленые водоросли – Cyanophyta, они же цианобактерии (Cyanobacteria).
6. Спирохеты – Spirochaeta (греч. speira – спираль и chaite – волос).
7. Простейшие – Protozoa.
8. Риккетсии – Rickettsia.
9. Микоплазмы – Mycoplasma.
10. Вирусы.
11. Плазмиды.
Единственное, что их всех объединяет, – микроскопические размеры. Однако эти организмы существенным образом различаются по многим признакам и прежде всего по уровню организации геномов, наличию и составу белоксинтезирующих систем и клеточной стенки.
Все известные живые организмы в природе можно разделить на 4 существенно отличающиеся друг от друга царства: вирусы и плазмиды, архебактерии, эубактерии и эукариоты. Архебактерии и эубактерии по признаку отсутствия оформленного клеточного ядра объединяют в группу прокариот. К ним относятся бактерии, синезеленые водоросли, спирохеты, актиномицеты, риккетсии и подобные им бактерии, а также микоплазмы. Простейшие, дрожжи, нитчатые грибы и все другие группы живых существ с более высоким уровнем организации, имеющие оформленное клеточное ядро, называются эукариотами. В связи с таким разнообразием дать краткое и исчерпывающее определение понятия «микроорганизм» достаточно сложно, тем более, что к ним относятся вирусы и плазмиды, о природе которых шла продолжительная дискуссия. Нужно было определить главный критерий, который бы отличал живое от неживого. Современное представление о жизни связано с понятием гена. Ген является единственным носителем и хранителем жизни. Таким образом, главное отличие живого от неживого – наличие собственной генетической системы, которая обеспечивает наследственную непрерывность и эволюцию данного организма, т. е. его существование – жизнь. Все, кто имеет свою генетическую систему, должны рассматриваться как организмы. В свете всего сказанного и с учетом того, что уже известно о микроорганизмах, представляется возможным дать им такое определение.
Микроорганизмы – это невидимые простым глазом представители всех царств жизни: эукариоты, прокариоты (эубактерии и архебактерии), вирусы и плазмиды. Они занимают низшие ступени эволюции, но играют важную и разнообразную роль в общей экономике природы, в круговороте веществ, в патологии человека, животных и растений.
Отличительные особенности перечисленных царств жизни следующие.
К царству вирусов и плазмид относят организмы, у которых геном представлен либо ДНК, либо РНК; у них отсутствуют собственные системы биосинтеза белка и мобилизации энергии, поэтому они являются абсолютными внутриклеточными паразитами.
Прокариоты (эубактерии и архебактерии) – это организмы, у которых еще нет оформленного ядра, а есть лишь его предшественник – нуклеоид. Он представлен одной или несколькими хромосомами, которые состоят из ДНК и свободно располагаются в цитоплазме, не отграниченные от нее никакой мембраной. Прокариоты не имеют дифференцированного аппарата митоза, у них нет ядрышка. Кроме того, они имеют рибосомы 70S, и большинство их имеет клеточную стенку, содержащую пептидогликан, который отсутствует у эукариот. Размеры прокариот варьируют в пределах 1 – 20 мкм. У прокариот нет митохондрий и хлоропластов. Среди них есть аэробные и анаэробные организмы.
Архебактерии. В 70 – 80 гг. XX в. были использованы новые признаки при создании дендрограмм (древа жизни); сравнивали гены (или их продукты), выполняющие одну и ту же функцию, у разных классов организмов, например нуклеотидные последовательности 16S рРНК (18S рРНК) из 6 или большего числа остатков. Построенные по этим признакам дендрограммы выявили три высшие таксономические группы (домена): эубактерий, архебактерий и эукариот. При этом оказалось, что архебактерии отличаются от эубактерий и эукариот в такой же степени, в какой последние отличаются друг от друга. Основные отличия архебактерий от эубактерий: химический состав жесткой клеточной стенки различный, у архебактерий она не содержит пептидогликана; у архебактерий особая химическая структура липидов, иной компонентный состав РНК-полимераз; есть повторяющиеся последовательности в составе хромосомной ДНК; наличие интронов в генах тРНК и рРНК; различие в химическом составе и строении рибосом.
Сходство архебактерий с эукариотами: наличие интронов в генах тРНК и рРНК; наличие в хромосомных ДНК повторяющихся последовательностей; сходный компонентный состав РНК-полимераз; чувствительность белоксинтезирующих систем к дифтерийному токсину; сходство ферментных систем, участвующих в процессах репликации, транскрипции и трансляции. Рибосомы архебактерий имеют сходство с рибосомами 70S и 80S.
Таким образом, существуют четыре царства жизни: эукариоты; эубактерии; архебактерии; вирусы и плазмиды.
Среди архебактерий выделяют следующие группы:
1. Метаногены – организмы, являющиеся строгими анаэробами. Энергию для роста получают путем восстановления СО2 до метана по реакции: СО2 + 4Н2 = СН4 + + 2Н2О, ΔG° = – 31,3 ккал/моль (водород потребляется из атмосферы).
2. Экстремальные галофилы – аэробные бактерии, способные расти в насыщенном растворе NaCl (до 32 %), нижняя пороговая концентрация NaCl = 12 – 15 %. Обладают системой фотосинтеза, отличной от таковой у других фотосинтезирующих бактерий (в мембране галофильных бактерий присутствует не хлорофилл, а бактериородопсин).
3. Термоацидофилы – характеризуются высокими оптимальными температурами (от 75 до 90 °C) и низкими значениями рН (от 5 – 6 до 1 – 2), опимальными для своего роста. Сумма Г + Ц у архебактерий варьирует от 28 до 68 мол%. Экстремальные условия существования архебактерий, вероятнее всего, указывают на то, что их предки возникли тогда, когда физические условия существенно отличались от современных. Патогенных для человека видов среди архебактерий не обнаружено.
Эубактерии. Длина хромосомы Escherichia coli составляет 1,6 мм; хромосома организована в форме нуклеоида длиной в 1 мкм, т. е. в структуру в 1600 раз более короткую. Упаковка ДНК в пределах нуклеоида существует в двух вариантах: в виде длинных суперспирализованных доменов (по 1000 000 п. н. в каждом), у E. coli таких доменов 43; и в виде коротких доменов из нескольких сот пар нуклеотидов. Стабилизирующую роль в такой упаковке играют специфические белки. У энтеробактерий известно не менее 5 таких белков: H, H1, HU, IFN, HLP1, которые имеют сходство с гистонами.
Эукариоты имеют рибосомы 80S, митохондрии или хлоропласты (в этих структурах содержатся рибосомы 70S), не содержат пептидогликана; все они – аэробные организмы. К эукариотам относятся все высшие растения и животные. Жгутики у эукариот состоят из белка тубулина и представляют собой систему микротрубочек, распологающихся по типу 9 + 2 и связанных с базальным телом. Жгутики у прокариот не содержат систем микротрубочек и построены из белка флагеллина.
Принципы систематики и классификации микроорганизмов
Систематика занимается всесторонним описанием видов организмов, выяснением степени родственных отношений между ними и объединением их в различные по уровню родства классификационные единицы (таксоны). Классификация – составная часть систематики. Она сводится к распределению организмов в соответствии с их общими признаками по различным таксонам. Таксономия – наука о принципах и методах распределения (классификации) организмов в иерархическом плане. Основной таксономической единицей в биологии является вид (species). Виды объединяют в таксоны более высоких рангов: род (genus), триба (tribus), семейство (familia), порядок (ordo), класс (classis), тип (phylum). Помимо этих основных категорий, используются также дополнительные – подрод, подтриба, подсемейство, подпорядок, подкласс, подтип. Иногда употребляются также неформальные категории «отдел» и более общая – «группа».
Общее для всех живых существ определение понятия «вид» дать чрезвычайно трудно в связи с многообразием форм жизни. В микробиологии были предложены различные понятия вида. Н. А. Красильников, автор фундаментального труда «Определитель бактерий и актиномицетов» (1949), дал следующее определение вида: «Вид – группа или совокупность близких между собой организмов, которые имеют общий корень происхождения, на данном этапе эволюции характеризуются определенными морфологическими, биохимическими и физиологическими признаками, обособлены отбором от других видов и приспособлены к определенной среде обитания». Это определение подвергалось различными авторами модификациям. Сейчас, когда стало понятно, что степень родства бактерий, их свойства и признаки зависят от их собственных геномов, можно дать более краткое определение вида: Вид – совокупность микроорганизмов, имеющих общий корень происхождения, сходный генотип (степень гомологии ДНК 60 % и более, близкое суммарное содержание пар Г + Ц) и максимально близкие фенотипические признаки.
Специфические особенности микроорганизмов определили и набор тех признаков и свойств, которые используются для их систематики и классификации.
1. Морфологические признаки – величина, форма, характер взаиморасположения.
2. Тинкториальные свойства – способность окрашиваться различными красителями. Особенно важным признаком является отношение к окраске по Граму, которое зависит от структуры и химического состава клеточной стенки бактерий. По этому признаку все бактерии делятся на грамположительные и грамотрицательные. Морфологические свойства и отношение к окраске по Граму определяют принадлежность к крупным таксонам – роду, семейству и т. д.
3. Культуральные свойства – особенности роста бактерий на жидких (образование пленки, осадок, помутнение) и плотных (форма, размеры, консистенция, края, поверхность, прозрачность колоний, образование пигмента и другие свойства) питательных средах. В микробиологии широко используют такие специфические термины, как «колония», «культура», «штамм», «типы» или «варианты». Под колонией принято понимать видимую простым глазом изолированную структуру, образующуюся в результате размножения и накопления бактерий за определенный срок инкубации. Колония образуется обычно из одной родительской клетки или из нескольких идентичных клеток. Поэтому пересевом из изолированной колонии может быть получена чистая культура возбудителя. Под культурой понимают всю совокупность бактерий, выросших на плотной или жидкой питательной среде. Как колония, так и культура каждого вида характеризуются определенными признаками. Основной и главный принцип бактериологии – во избежание ошибок изучать свойства только чистых, однородных культур. Каждая выделенная культура данного вида бактерий называется также штаммом, т. е. конкретным образцом данного вида (нем. stammen – происходить). Штаммы одного и того же вида бактерий, различающиеся по антигенному строению, называют серотипами (сероварами, серовариантами), по чувствительности к фагу – фаготипами (фаговарами), по биохимическим или культуральным признакам – биотипами (биоварами) и т. п. Штамм можно считать низшей таксономической единицей бактерий.
4. Подвижность бактерий. Различают бактерии подвижные и неподвижные. Подвижные бактерии подразделяют на ползающие, или скользящие, они передвигаются за счет волнообразного сокращения клеток; и плавающие бактерии, у которых активная подвижность связана с наличием жгутиков.
5. Спорообразование – форма и характер расположения споры в клетке.
6. Физиологические свойства – способы углеродного (аутотрофы, гетеротрофы), азотного (аминоавтотрофы, аминогетеротрофы) питания; тип дыхания: аэробы, факультативные анаэробы, строгие анаэробы, микроаэрофилы.
7. Биохимические свойства – способность ферментировать различные углеводы, протеолитическая активность, образование индола, сероводорода, наличие уреазы и других ферментов и т. д.
8. Чувствительность к специфическим бактериофагам.
9. Антигенные свойства. Они зависят от химического состава клеточной стенки и жгутиков бактерий.
10. Химический состав клеточных стенок (содержание и состав основных сахаров и аминокислот).
11. Липидный и жирнокислотный состав. Изучение состава жирных кислот проводят с помощью газовой хроматографии, которая обладает высокой разделительной способностью и чувствительностью.
12. Белковые спектры. С помощью различных методов фракционирования, а главным образом двумерного электрофореза в полиакриламидном геле, разделяют сложные смеси рибосомных, мембранных или внутриклеточных белков и получают электрофореграммы, или белковые спектры, соответствующей фракции данного вида бактерий.
В связи с тем, что количество фенотипических признаков, используемых для классификации микроорганизмов, значительно возросло, в конце 50-х гг. ХХ в. возникла нумерическая (численная) таксономия. Ее возникновению способствовало появление более совершенных компьютерных систем, которые позволяют быстро и точно производить громоздкие математические расчеты. В основе нумерической таксономии лежит принцип сопоставления организмов по возможно большему количеству учитываемых признаков при допущении, что все они для систематики равноценны. Однако принцип равнозначности является основным недостатком этого метода.
В последние годы для классификации бактерий помимо изучения их фенотипических свойств все более широко используют методы геносистематики. В ее основе лежит изучение нуклеотидного состава ДНК и наиболее важных характеристик генома, в частности его размера (величина, объем, молекулярная масса) и других параметров. Наиболее точным методом установления генетического (геномного) родства между бактериями является определение степени гомологии ДНК. Чем больше идентичных генов, тем выше степень гомологии ДНК и ближе генетическое родство.
Метод молекулярной гибридизации ДНК – ДНК считается сейчас наиболее важным для систематики бактерий. Однако четких и твердо установленных критериев степени гомологии ДНК для таких рангов, как вид и род бактерий, еще нет. Допускают, что диапазон гомологии ДНК от 60 до 100 % говорит о принадлежности к одному и тому же виду, степень гомологии от 40 до 60 % – к разным родам одного семейства. Таким образом, подобно тому, как фенотип и генотип отражают сущность организма, феносистематика и геносистематика отражают сходство и различие организмов, степень их генетического родства. Признаки, используемые для систематики бактерий, используют и для их идентификации, т. е. для установления их таксономического положения и прежде всего видовой принадлежности, что является решающим моментом бактериологической диагностики инфекционных заболеваний. Чаще всего для идентификации патогенных бактерий изучают их морфологические, тинкториальные, культуральные, биохимические и антигенные свойства, а при необходимости и некоторые другие, например отношение к специфическим фагам, антибиотикам и т. д.
Современные методы микробиологической диагностики инфекционных заболеваний
Основные требования, предъявляемые к современным методам микробиологической диагностики инфекционных заболеваний, – высокая специфичность и чувствительность. Эти методы следующие.
Микроскопический. С помощью микроскопии нативного патологического материала, полученного от больного, определяют вид возбудителя по его форме, взаиморасположению клеток и способности окрашиваться определенными красителями.
Бактериологический. Метод основан на выделении чистой культуры возбудителя и его идентификации.
В настоящее время разработаны различные автоматические системы, позволяющие в течение нескольких часов определить вид возбудителя и изучить его антибиотикограмму (см. с. 184).
Серологический. Метод основан на определении в крови больных или переболевших специфических антител к соответствующим возбудителям с помощью различных реакций: агглютинации, преципитации, связывания комплемента, иммунной флуоресценции, иммуноферментного и радиоиммунного методов и др. Серологические реакции, кроме того, могут быть использованы и для непосредственного обнаружения антигенов возбудителя в исследуемом материале (реакции пассивной гемагглютинации, коагглютинации, латекс-агглютинации, агрегат-гемагглютинации, иммунофлуоресценции и т. д.).
Биологический. В основе метода лежит заражение лабораторных животных исследуемым материалом с целью воспроизведения у них инфекционного заболевания и (или) последующего выделения возбудителя.
Аллергические пробы. С помощью этих проб обнаруживают повышенную чувствительность макроорганизма к определенным возбудителям или продуктам их жизнедеятельности. Аллергические реакции характеризуются антигенной специфичностью, для их выявления применяют препараты, называемые аллергенами.
За последние годы самое широкое применение для идентификации и дифференциации микроорганизмов получили молекулярно-биологические методы: методы молекулярных, или генных, зондов, особенно в сочетании с полимеразной цепной реакцией; метод геномной дактилоскопии (ДНК-фингерпринт, англ. finger-print – отпечаток пальца) и др.
Метод генных зондов (ДНК– и РНК-зондов) – основан на реакции гибридизации между фрагментом нуклеотидной последовательности (зондом), несущим наиболее специфический для определенного вида бактерий или вирусов ген (гены), и ДНК (РНК) микроорганизма, находящегося в исследуемом субстрате. Точность метода зависит от качества зонда (его чистоты). Наилучшими ДНК– и РНК-зондами служат полученные путем химического синтеза олигонуклеотидные последовательности (о. п.), расположение нуклеотидов в которых полностью соответствует таковому участка гена (или всего гена), ответственного за определенную функцию микроорганизма. ДНК-зонды метят различными способами: изотопами, специальным белком биотином, флуорохромами и т. п.
Полимеразная цепная реакция (ПЦР, или ЦПР). Выдающуюся роль для создания новых типов ДНК-зондов (ДНК-маркеров) сыграло использование метода амплификации (англ. amplification – увеличение) in vitro определенного участка ДНК в процессе повторяющихся температурных циклов полимеразной реакции. Кэри Мюллису, предложившему в 1983 г. метод ПЦР, в 1993 г. была присуждена Нобелевская премия. Метод ПЦР позволяет быстро получить более 10 млн копий определенной о. п. ДНК, первоначально представленной одной или несколькими молекулами. Модификации метода ПЦР легли в основу создания различных типов ДНК-маркеров – праймеров (англ. primer – запал, средство воспламенения). ПЦР используют для обнаружения любого агента, если для него имеется соответствующий праймер. ПЦР незаменима в тех случаях, когда трудно или даже невозможно выделить чистую культуру возбудителя. Предложен метод генотипирования, который основан на количественном анализе многолокусных генотипов бактерий (MLVA – анализ многолокусных вариантов) бактерий. Один из его вариантов используют для генотипирования бактерий, содержащих вариабельное число тандемных повторов (variable number of tandem repeats – VNTR).
Геномная дактилоскопия (ДНК-фингерпринт) основана на рестрикционном анализе ДНК микроорганизмов с применением специфических зондов. Этот метод позволяет исследовать полиморфизм множества локусов повторяющихся о. п. (мультилокусный анализ) в ДНК различных организмов. С его помощью можно выявить в геноме млекопитающих более 30 высокополиморфных локусов, что достаточно для индивидуальной идентификации человека, животных и растений.
Современная классификация бактерий
В «Определителе бактерий-9» (1984 – 1989) прокариоты в зависимости от строения клеточной стенки разделены на 17 частей:
Часть 1. Спирохеты (5 родов).
Часть 2. Аэробные (микроаэрофильные), подвижные, вибрионоподобные грамот рицательные бактерии (7 родов).
Часть 3. Неподвижные (иногда подвижные) грамотрицательные изогнутые бакте рии (7 родов).
Часть 4. Грамотрицательные аэробные палочки и кокки (8 семейств, в том числе Pseudomonadaceae; 37 родов).
Часть 5. Факультативно анаэробные грамотрицательные палочки (3 семейства: Enterobacteriaceae, Vibrionaceae, Pasteurellaceae; 34 рода).
Часть 6. Анаэробные грамотрицательные, прямые и изогнутые палочки (семей ство Bacteroidaceae – 13 родов).
Часть 7. Сульфат или серувосстанавливающие бактерии (7 родов).
Часть 8. Анаэробные грамотрицательные кокки (семейство Veillonellaceae – 3 рода).
Часть 9. Риккетсии и хламидии (2 порядка, 4 семейства, 3 трибы, 15 родов).
Часть 10. Микоплазмы. Отдел Tenericutes. Класс Mollicutes (3 семейства, 6 родов).
Часть 11. Эндосимбионты простейших (реснитчатых, жгутиковых, амеб – 5 родов), грибов, насекомых и других беспозвоночных.
Часть 12. Грамположительные кокки (2 семейства, 15 родов, в том числе Stаphylococcus и Streptococcus).
Часть 13. Грамположительные палочки и кокки, образующие споры (6 родов, в том числе Bacillus и Clostridium).
Часть 14. Не образующие спор грамположительные правильные палочки (7 родов).
Часть 15. Грамположительные неправильные палочки, не образующие спор (21 род, в том числе Corynebacterium).
Часть 16. Микобактерии (семейство Mycobacteriaceae, род Mycobacterium).
Часть 17. Нокардиоподобные бактерии (9 родов).
Однако уже в 1993 г. в определитель Берги были внесены новые изменения. Все 4 отдела («главные категории») были разделены на группы, перечисленные ниже.
ОТДЕЛ I. Грамотрицательные эубактерии, имеющие клеточную стенку, или Gracilicutes
Группа 1. Спирохеты. Роды: Borrelia, Brachyspira, Cristispira, Leptonema, Leptospira, Serpulina, Spirochaeta, Treponema.
Группа 2. Аэробные (или микроаэрофильные), подвижные, вибриоидные грамотрицательные бактерии. Роды: Alteromonas, Aquaspirillum (кроме A. fasciculus), Azospirillum, Bdellovibrio, Campylobacter, Cellvibrio, Halovibrio, Helicobacter, Herbaspirillum, Marinomonas, Micavibrio, Oceanospirillum, Spirillum, Sporospirillum, Vampirovibrio, Wolinella.
Группа 3. Неподвижные (или редко подвижные) грамотрицательные изогнутые бактерии. Роды: Ancylobacter, «Brachyarcus», Cyclobacterium, Flectobacillus, Meniscus, «Pelosigma», Runella, Spirosoma.
Группа 4. Грамотрицательные аэробные (или микроаэрофильные) палочки и кокки.
Подгруппа 4а. (Аэробы, палочки и кокки, которые растут в атмосфере воздуха, содержащего 21 % кислорода). Роды: Acetobacter, Acidophilium, Acidomonas, Acidothermus, Acidovorax, Acinetobacter, Afipia, Agrobacterium, Agromonas, Alcaligenes, Alteromonas, Aminobacter, Aquaspirillum fasciculus, Azomonas, Azorhizobium, Azotobacter, Beijerinckia, Bordetella, Bradyrhizobium, Brucella, Chromohalobacter, Chryseomonas, Comamonas, Cupriavidus, Deleya, Derxia, Ensifer, Erythrobacter, Flavimonas, Flavobacterium, Francisella, Frateuria, Gluconobacter, Halomonas, Hydrogenophaga, Janthinobacterium, Kingella, Lampropedia, Legionella, Marinobacter, Marinomonas, Mesophilobacter, Methylobacillus, Methylobacterium, Methylococcus, Methylomonas, Methylophaga, Methylophilus, Methylovorus, Moraxella, Morococcus, Neisseria, Oceanospirillum, Ochrobacterium, Oligella, Paracoccus, Phenylobacterium, Phyllobacterium, Pseudomonas, Psychrobacter, Rhizobacter, Rhizobium, Rhizomonas, Rochalimaea henselae, Roseobacter, Rugamonas, Serpens, Sinorhizobium, Sphingobacterium, Thermoleophilum, Thermomicrobium, Thermus, Variovorax, Volcaniella, Weeksella, Xanthobacter, Xanthomonas, Xylella, Xylophilus, Zoogloea.
Подгруппа 4б. (Микроаэрофилы, не растут при концентрации кислорода в воздухе 21 %). Роды: Taylorella, Wolinella, Bacteroides (B. urealyticus и B. gracilis).
Группа 5. Факультативно-анаэробные грамотрицательные палочки.
Подгруппа 1. Семейство Enterobacteriaceae. Роды: Arsenophonus, Budvicia, Buttiauxella, Cedecea, Citrobacter, Edwardsiella, Enterobacter, Erwinia, Escherichia, Ewingella, Hafnia, Klebsiella, Kluyvera, Leclerica, Leminorella, Moellerella, Morganella, Obesumbacterium, Pantoea, Pragia, Proteus, Providencia, Rahnella, Salmonella, Serratia, Shigella, Tatumella, Xenorhabdus, Yersinia, Yokenella.
Подгруппа 2. Семейство Vibrionaceae. Роды: Aeromonas, Enhydrobacter, Photobacterium, Plesiomonas, Vibrio (14 видов).
Подгруппа 3. Семейство Pasteurellaceae. Роды: Actinobacillus, Haemophilus, Pasteurella.
Подгруппа 4. Другие роды: Callymatobacterium, Cardiobacterium, Chromobacterium, Eikenella, Gardnerella, Streptobacillus, Zymomonas.
Группа 6. Грамотрицательные, анаэробные прямые, изогнутые и спиральные палочки. Роды: Acetivibrio, Acetoanaerobium, Acetofilamentum, Acetogenium, Acetomicrobium, Acetothermus, Acidaminobacter, Anaerobiospirillum, Anaerorhabdus, Anaerovibrio, Bacteroides, Butyrivibrio, Centipeda, Fervidobacterium, Fibrobacter, Fusobacterium, Haloanaerobium, Halobacteroides, Llyobacter, Lachnospira (см. также группу 20), Leptotrichia, Malonomonas, Megamonas, Mitsuokella, Oxalobacter, Pectinatus, Pelobacter, Porphyromonas, Prevotella, Propionigenium, Propionispira, Rikenella, Roseburia, Ruminobacter, Sebaldella, Selenomonas, Sporomusa, Succinimonas, Succinivibrio, Syntrophobacter, Syntrophomonas, Thermobacteroides, Thermosipha, Thermotoga, Tissierella, Wolinella, Zymophilus.
Группа 7. Диссимилирующие сульфат или серуредуцирующие бактерии. Роды: Desulfuromonas, Desulfovibrio, Desulfomonas, Desulfococcus, Desulfobacter, Desulfosarcina, Desulfobulbus.
Группа 8. Анаэробные грамотрицательные кокки. Семейство Veillonellaceae. Роды: Acidaminococcus, Megasphaera, Syntrophococcus, Veillonella.
Группа 9. Риккетсии и хламидии.
Порядок I. Rickettsiales. Pиккетсии. Семейство Rickettsiaceae. Роды: Rickettsia,
Rochalimaea, Coxiella, Ehrlichia, Cowdria, Neorickettsia, Wolbachia, Rickettsiella. Семейство Bartonellaceae. Роды: Bartonella, Grahamella. Семейство Anaplasmataceae. Роды: Anaplasma, Aegyptianella, Haemobartonella, Eperythrozoon.
Порядок II. Chlamydiales. Хламидии. Семейство Chlamydiaceae, род Chlamydia.
Группа 10. Аноксигенные (не образующие кислорода) фототрофные бактерии. Содержат бактериохлорофилл и каротиноидные пигменты, но не содержат фикобилипротеинов. Могут использовать свет как источник энергии. Фотоаутотрофы или фотоорганотрофы в анаэробных или микроаэрофильных условиях, не образуют при фотосинтезе О2. В отличие от оксигенного фотосинтеза аноксигенный фотосинтез зависит от внешних доноров электронов (восстановленные серные соединения, молекулярный водород или органические соединения).
Группа 11. Оксигенные (образующие кислород) фототрофные бактерии.
Содержат хлорофилл а, могут использовать свет как источник энергии и образуют О2 по такому же способу, как и зеленые растения. Различают две подгруппы: 1. Cодержат хлорофилл а и имеют фикобилипротеины (аллофикоцианин, фикоцианин и иногда фикоэритрин). Эти организмы называют цианобактериями, или синезелеными водорослями. 2. Cодержат хлорофилл а и хлорофилл b, но не содержат фикобилипротеинов.
Группа 12. Аэробные хемолитотрофные бактерии и родственные организмы. Нефототрофные организмы. Различают следующие подгруппы: 1. Нитрифицирующие. Могут использовать в качестве источника энергии для своего роста восстановленные неорганические соединения азота (соли аммония и нитриты). 2. Серуокисляющие. Могут окислять восстановленные неорганические соединения серы, и большинство организмов использует их в качестве единственного источника энергии. 3. Облигатные окислители водорода. Используют газообразный водород (Н2) как источник энергии для роста, но не используют органических соединений углерода. 4. Бактерии, которые образуют или откладывают железо и/или оксиды марганца на клетках или внутри них. 5. Магнитоподвижные бактерии. Проявляют магнитотаксис в магнитных полях. Бактерии содержат богатые железом электронно-плотные внутриклеточные включения (магнитосомы).
Группа 13. Почкующиеся и/или образующие придатки бактерии. Нефототрофные бактерии, которые подразделяются на следующие подгруппы: 1. Бактерии, имеющие простеки (лат. prosteca) – полужесткое удлинение клеточной стенки, цитоплазматической мембраны и цитоплазмы, которое имеет диаметр меньший, чем сама клетка. А. Размножающиеся асимметрично путем почкования. Почки могут образовываться на кончике простека или на клеточной поверхности. Б. Размножающиеся путем бинарного поперечного деления. 2. Бактерии, не образующие простека. А. Почкующиеся бактерии. Б. Непочкующиеся бактерии, имеющие стебельки. В отличие от простека, стебелек представляет собой лентовидную или трубчатую структуру, образуемую из материала, секретируемого бактериальной клеткой. С помощью стебелька бактерии прикрепляются к поверхностям. В. Другие бактерии: а) бактерии, несущие тонкие нити, покрытые оксидами марганца; б) бактерии, несущие тонкие волокнистые структуры, не покрытые оксидами металлов; в) бактерии, имеющие стебельки (полые конические выросты, видимые с помощью световой микроскопии и имеющие поперечные полосы, которые обнаруживаются при электронной микроскопии).
Группа 14. Бактерии, образующие футляры. Нефототрофы. Аэробы. Не обладают скользящей подвижностью. Бактерии растут в виде цепочек клеток в нитях. Нити растут в трубках-футлярах из экзоклеточного материала. В типичных случаях футляр прозрачный; когда рассматривается во влажной среде с помощью фазово-контрастной микроскопии, очень похож на микроскопическую пластиковую трубочку или дудку. Иногда футляр настолько тонкий и тесно связан с клеткой, что он с трудом выявляется при фазовоконтрастной микроскопии. Добавление 95 %-ного этанола в «висячую» или «раздавленную» каплю облегчает выявление футляра. Другим способом футляр может быть обнаружен, если в нити имеются разрывы между клетками. Футляры могут иметь окраску от желтого до темно-коричневого цвета, созданную отложениями железа или оксидов марганца. Одиночные клетки могут быть неподвижными или подвижными, когда имеют жгутики с полярным или субполярным расположением. Роды: «Clonothrix», Crenothrix, Haliscomenobacter, Leptothrix, «Lieskella», «Phragmidiothrix», Sphaerotilus.
Группа 15. Нефотосинтезирующие, не образующие плодов скользящие бактерии. Нефототрофные палочки или нити, лишенные жгутиков, но обладающие скользящей подвижностью на твердых поверхностях.
Группа 16. Образующие плоды скользящие бактерии. Миксобактерии.
ОТДЕЛ II. Грамположительные эубактерии, имеющие клеточную стенку, или Firmicutes
Группа 17. Грамположительные кокки. Роды: Aerococcus, Coprococcus, Deinobacter, Deinococcus, Enterococcus, Gemella, Lactococcus, Leuconostoc, Marinococcus, Melissococcus, Micrococcus, Pediococcus, Peptostreptococcus, Planococcus, Ruminococcus, Saccharococcus, Salinicoccus, Sarcina, Staphylococcus, Stomatococcus, Streptococcus, Trichococcus, Vagococcus.
Группа 18. Эндоспорообразующие грамположительные палочки и кокки. Роды: Amphibacillus, Bacillus, Clostridium, Desulfotomaculum, Oscillospira, Sporohalobacter, Sporolactobacillus, Sporosarcina, Sulfidobacillus, Syntrophospora.
Группа 19. Правильные, неспорообразующие грамположительные палочки. Роды: Brochothrix, Carnobacterium, Caryophanon, Erysipelothrix, Kurthia, Lactobacillus, Listeria, Renibacterium.
Группа 20. Неправильные, неспорообразующие грамположительные палочки. Роды: Асеtobacterium, Acetogenium, Actinomyces, Aeromicrobium, Agromyces, Arachnia, Arcanobacterium, Arthrobacter, Aureobacterium, Bifidobacterium, Brachybacterium, Brevibacterium, Butyrivibrio (могут также окрашиваться по Граму отрицательно – см. группу 6, с. 29), Caseobacter, Cellulomonas, Clavibacter, Coriobacterium, Corynebacterium, Curtobacterium, Dermabacter, Eubacterium, Exiguobacterium, Falcivibrio, Gardnerella, Jonesia, Lachnospira, Microbacterium, Mobiluncus, Pimelobacter, Propionibacterium, Rarobacter, Rothia, Rubrobacter, Sphaerobacter, Terrabacter, Thermoanaerobacter, Thermoanaerobium.
Группа 21. Микобактерии. Семейство Mycobacteriaceae. Род Mycobacterium.
Группы 22 – 29. Актиномицеты. В зависимости от морфологических свойств, по хемотипу клеточной стенки и другим химическим признакам подразделяются на 8 групп.
Группа 22. Нокардиоформные актиномицеты, включает 19 родов, в том числе Nocardia, Oerscovia, Pseudonocardia.
Группа 23. Актиномицеты с множественно расположенными спорангиями. Роды: Dermatophilus, Frankia, Geodermatophilus.
Группа 24. Актинопланеты. Включает 6 родов.
Группа 25. Стрептомицеты и близкие к ним роды, всего 5 родов.
Группа 26. Мадуромицеты, всего 7 родов.
Группа 27. Актиномицеты, образующие термоустойчивые споры. Включает 5 родов.
Группа 28. Термоактиномицеты. Один род – Thermoactinomyces, все виды термофилы.
Группа 29. Роды, которые не могут быть отнесены к какой-либо группе (3 рода).
ОТДЕЛ III. Эубактерии, лишенные клеточной стенки, или Tenericutes
Группа 30. Микоплазмы. Класс Mollicutes. Порядок Mycoplasmatales. Разделен на две подгруппы:
Подгруппа 1. Факультативные анаэробы, или микроаэрофилы. Роды: Acholeplasma, Mycoplasma, Spiroplasma, Ureaplasma.
Подгруппа 2. Облигатные анаэробы. Роды: Anaeroplasma, Asteroleplasma.
ОТДЕЛ IV. Архебактерии, или Mendosicutes
Группа 31. Метаногены. Строгие анаэробы, образуют метан как основной конечный метаболический продукт. В качестве субстратов могут служить Н2– СО2, формиат, ацетат, метанол, метиламины или Н2-метанол. Серу восстанавливают до H2S. Клетки флуоресцируют при длине волны 420 нм голубовато-зеленым цветом; имеют коэнзим М, фактор 420, фактор 430 и метанопротеин. Тип РНК-полимеразы – AB'B''.
Группа 32. Сульфатвосстанавливающие архебактерии. Строгие анаэробы, образуют H2S из солей серной кислоты путем их восстановления. Образуют также очень немного метана. Проявляют голубовато-зеленую флуоресценцию при 420 нм. В клетках содержатся фактор 420 и метанопротеин, но отсутствуют коэнзим М и фактор 430. Тип РНК-полимеразы – (А+С)B'B''. Экстремальные термофилы – растут при температуре 92 °C.
Группа 33. Экстремальные галофильные архебактерии (галоархебактерии). Аэробы или факультативные анаэробы, хемоорганотрофы, клетки могут быть грамотрицательными или грамположительными, правильной или очень неправильной формы. Требуют для роста высокой концентрации NaCl (1,5 М или выше). Нейтрофилы или алкалифилы, мезофилы или слабые термофилы (растут при t выше 55 °C). Некоторые виды содержат пурпурно-красный фотоактивный пигмент бактериородопсин и способны использовать свет для синтеза АТФ. РНК-полимераза типа AB'B''C.
Группа 34. Архебактерии, лишенные клеточной стенки. Термоацидофилы, аэробы, клетки кокковидной формы, клеточная стенка отсутствует. Цитоплазматическая мембрана содержит богатый маннозой гликопротеин и липогликан. РНК-полимераза типа ВАС.
Группа 35. Экстремально термофильные и гипертермофильные архебактерии, метаболизирующие серу. Облигатные термофилы, оптимальная температура для роста – между 70 и 105 °C. Аэробы, или факультативные анаэробы, или строгие анаэробы. Ацидофилы и нейтрофилы. Аутотрофы или гетеротрофы. Большинство видов метаболизирует серу. РНК-полимераза типа ВАС.
В 2001 г. классификация бактерий Берги вновь претерпела большие изменения. Первые 3 отдела (Gracilicutes, Firmicutes и Tenericutes) были объединены в новую неформальную группу – домен эубактерий (Bacteria), а 4-й отдел (Mendosicutes) выделен как самостоятельный домен архебактерий (Archaea) с двумя типами – AI Crenarchaeota (1 класс, 25 родов) и AII Euryarchaeota (8 классов, 55 родов). Основные группы архебактерий перечислены на с. 23, 31.
Домен эубактерий поделен на 24 типа, которые разделены на 33 класса. Бактерии, описанные в учебнике и чаще всего вызывающие инфекционные заболевания людей, включены в следующие типы, классы и роды. Тип Proteobacteria. Класс Alphaproteobacteria [роды Rickettsia, Orientia (к которому теперь относят возбудителя лихорадки цуцугамуши Rickettsia orientalis (= R. tsutsugamushi), Ehrlichia, Bartonella, Brucella]. Класс Betaproteobacteria [роды Alcaligenus, Bordetella, Burkholderia (включающий возбудителей сапа и мелиоидоза, ранее называвшихся Pseudomonas mallei и P. pseudomallei), Neisseria, Kingella, Spirillum]. Класс Gammaproteobacteria (роды Francisella, Legionella, Coxiella, Pseudomonas, Moraxella, Acinetobacter, Vibrio, Enterobacter, Citrobacter, Edwardsiella, Erwinia, Escherichia, Hafnia, Klebsiella, Morganella, Proteus, Providencia, Salmonella, Serratia, Shigella, Yersinia, Pasteurella). Класс Epsilonproteobacteria (роды Campylobacter и Helicobacter). Тип Firmicutes. Класс Clostridia (роды Clostridium, Sarcina, Peptostreptococcus, Eubacterium, Peptococcus, Veilonella). Класс Mollicutes (роды Mycoplasma и Ureaplasma). Класс Bacilli (роды Bacillus, Listeria, Staphylococcus, Lactobacillus, Pediococcus, Leuconostoc, Streptococcus). Тип Actinobacteria (роды Actinomyces, Corynebacterium, Mycobacterium, Nocardia, Propionobacterium, Bifidobacterium). Тип Chlamidiae (род Chlamidia). Тип Spirochaetes (роды Spirochaeta, Borrelia, Treponema, Leptospira). Тип Bacteroidetes. Класс Bacteroidetes (роды Bacteroides и Prevotella). Тип Fusobacteria (род Fusobacterium).
Таким образом, в классификации Берги-2001 (George M. Garrity, Julia A. Bell, Timothy G. Lilburn. Taxonomic Outline of the Prokaryotes. Bergey’s Manual of Systematic Bacteriology, Second Edition. Release 5.0, May 2004) выделены и охарактеризованы 2 домена, 26 типов, 42 класса и большое количество семейств и родов бактерий.
В определителе Берги дано следующее определение бактерий (прокариот): «единичные клетки или простые скопления сходных клеток размером 0,2 × × 10,0 мкм, которые образуют своеобразные групповые структуры. Ядерный аппарат (нуклеоид, или генофор) никогда не отделен от цитоплазмы системой унитарных (элементарных) мембран. Клеточное деление не связано с циклическими изменениями строения клетки или изменением окрашиваемости ядерного аппарата или цитоплазмы; система микротрубочек (нитей веретена) не образуется. Цитоплазматическая мембрана обычно представляет собой топологический комплекс (элементарная мембрана) и образует ячеистые, ламеллярные (пластинчатые) или трубчатые впячивания в цитоплазму; вакуоли и репликативные цитоплазматические органеллы не связаны с системой плазматической мембраны, встречаются относительно редко (газовые вакуоли; хлоробиум-везикулы, т. е. пузырьки, окруженные однослойной мембраной и содержащие аппарат фотосинтеза у некоторых фотобактерий) и окружены неунитарными мембранами. Дыхательные и фотосинтетические функции связаны с системой плазматической мембраны у тех организмов, которые обладают этими физиологическими функциями, хотя у цианобактерий они могут быть и не связаны с плазматической и тилакоидными (тилакоиды – двойные ламеллы) мембранами. Рибосомы типа 70S, кроме одной группы бактерий – архебактерий, у которых они имеют более высокое значение S и распределены по цитоплазме; эндоплазматического ретикулума с прикрепленными рибосомами нет. Цитоплазма неподвижна, ее переливания, образования псевдоподий, эндо– и экзоцитоза не происходит. Питательные вещества потребляются в молекулярной форме. Клетки окружены ригидной стенкой, хотя она имеется не у всех бактерий (ее нет у микоплазм и некоторых архебактерий). Клетки могут быть неподвижными или могут обладать плавательной подвижностью, обеспечиваемой жгутиками бактериального типа, или скользящей подвижностью на плотной поверхности. Прокариоты – преимущественно одноклеточные организмы, однако образование нитевидных мицелиальных и колониальных форм также происходит. Они обладают механизмами переноса генов и рекомбинации, но эти процессы происходят без образования гамет (половых клеток) и зигот».
Основные признаки, по которым дифференцируют прокариот и эукариот, приведены в табл. 1.
Для обозначения видов бактерий используют бинарную номенклатуру, состоящую из названия рода (пишется с заглавной буквы) и вида (пишется всегда со строчной буквы и состоит из одного слова), например, Shigella flexneri (возбудитель дизентерии – род Shigella, вид flexneri). Когда название вида неоднократно повторяется, то первый раз название рода пишется полностью, а затем пишется только начальная буква его. Например, Shigella flexneri – S. flexneri. В связи со сложностью классификации бактерий названия внутривидовых форм (подвидов, серотипов и подсеротипов) часто используются как видовые, т. е. в качестве второго слова биномена – Salmonella enteritica (видовое), S. indica (подвидовое), S. typhimurium (серотип).
Таблица 1
Некоторые дифференциальные признаки прокариот и эукариот1 (Bergey’s Manual of Determinative Bacteriology–9)
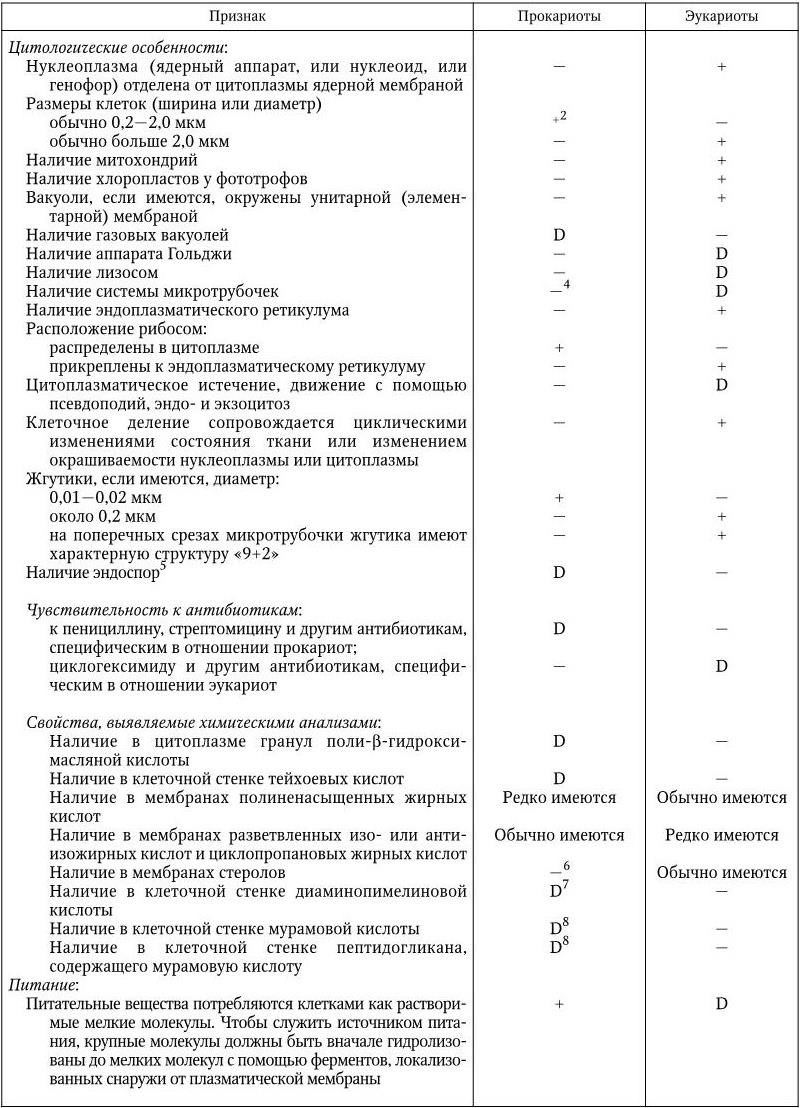
2 Некоторые бактерии (например, определенные трепонемы, микоплазмы, Haemobartonella) могут иметь ширину меньше 0,1 мкм, а другие бактерии (например, Achromatium, Macromonas) – больше 10 мкм.
3 Газовые вакуоли не ограничиваются элементарной мембраной. Везикулы, составляющие вакуоль, могут подвергаться коллапсу при внезапном гидростатическом воздействии – свойство, существенное для их идентификации.
4 Некоторые внутриклеточные фибриллы, которые могут быть микротрубочками, были описаны у Spiroplasma, цианобактерий Anabaena, некоторых спирохет и у L-форм бактерий.
5 Эндоспоры бактерий обычно устойчивы при температуре 80 °C или выше в течение 10 мин. Однако некоторые эндоспоры могут погибать при такой температурной обработке и должны быть испытаны при более низкой температуре.
6 Кроме мембран большинства микоплазм.
7 Имеются у всех грамотрицательных эубактерий и у многих грамположительных.
8 Имеются в клеточной стенке всех эубактерий, кроме хламидий; отсутствуют у архебактерий.
9 У цианобактерий они не связаны с цитоплазматической и тилакоидными мембранами.
10 За редкими исключениями, например у некоторых фотобактерий.
11 Кроме митохондрий, в которых встречается тип Mn.
12 Кроме митохондрий и хлоропластов, которые имеют 70S рибосомы.
Вопрос о самозарождении и развитии жизни на Земле
Вопрос о самозарождении и развитии жизни на Земле был и остается одним из самых главных и самых трудных вопросов науки. Теперь уже ни у кого нет сомнения в том, что самозарождение жизни могло происходить лишь после того, как возникнут чисто химическим путем важнейшие органические соединения, необходимые для того, чтобы произошел синтез прежде всего первородных генов, т. е. генов, образующихся без участия белков, до их возникновения; первородных белков, т. е. белков, которые образуются без участия генов, и генетического кода, так как без него ген не может реализовать свою задачу. В самом деле, синтез генов у всех живых организмов происходит только при участии сложной системы биосинтеза ДНК, а синтез белков происходит только по программе, заключенной в структуре гена: порядок расположения кодонов в гене определяет порядок расположения аминокислот в белке. Вот почему и возник вопрос: что возникло раньше – ген или белок? Образно говоря, что возникло раньше – курица или яйцо?
Выдающийся русский ученый А. И. Опарин, который внес большой вклад в развитие так называемой коацерватной теории происхождения жизни, получившей в XX в. общее признание, назвал этот вопрос чисто схоластическим. Однако он ошибся. Изучение структуры гена и генетического кода не оставляет никаких сомнений в том, что генетической системе принадлежит важнейшая роль в самозарождении и эволюции жизни на Земле. Нет более никакого сомнения в том, что именно ген служит основным носителем и хранителем жизни на Земле, а белок – ее творцом, поэтому вопрос о том, как возникли первородные гены, первородные белки и генетический код, приобрел основное значение для выяснения механизма зарождения жизни. Следует при этом иметь в виду, что структуры, состоящие только из первородных генов и первородных белков, сами по себе еще не способны к самостоятельному размножению, как это хорошо демонстрируют простейшие живые организмы – плазмиды и вирусы. Для того чтобы процесс самозарождения жизни состоялся, необходимо было возникновение специализированных систем жизнеобеспечения. К ним относятся следующие системы:
1. Система биологического самовоспроизводства генов, т. е. система биосинтеза ДНК.
2. Сложная биологическая система синтеза белков, которая включает в себя целый комплекс различных компонентов (мРНК, тРНК, рибосомы и комплекс особых рабочих белков).
3. Система мобилизации энергии, необходимой для синтеза всех компонентов формирующейся первородной клетки.
4. Система мембран, с помощью которых формирующаяся клетка отграничивается от внешней среды, сохраняя способность осуществлять активную и пассивную связь с ней.
5. Система, обеспечивающая саморегуляцию выражения генетической информации.
6. Система саморегуляции клеточного деления, т. е. размножения клетки.
Только после формирования всех этих систем жизнеобеспечения и возникновения уникальной структурной единицы живой материи – клетки – завершается этот первый и важнейший этап самозарождения и самоутверждения жизни на Земле. Эти вопросы более подробно рассматриваются в главе 74. Последующие этапы эволюции включали в себя появление многоклеточных организмов и их дальнейшую эволюцию в направлении растительного и животного царств. Изучением генетических механизмов эволюции занимается специальная наука – эволюционная генетика, или геномика. Однако нельзя не обратить особое внимание на предлагаемую представителями геномики гипотезу, получившую название пульсации генома. Суть ее состоит в том, что изменение генома может идти не только в сторону нарастания количества генов, но и в сторону его уменьшения. Предполагается, что это определяется не чем иным, как полинуклеотидным выбором (Пн-выбором) ДНК-реципиента. Из этого следует, что предметом естественного отбора служит не фенотипический признак, кодируемый донорной ДНК, а новые последовательности ДНК, независимо от того, какие признаки они кодируют. С этих позиций геномики естественный отбор складывается из двух этапов: Пн-выбора и фенотипического дарвиновского отбора. Такой вывод полностью совпадает с утверждением о том, что ген служит главным носителем и хранителем жизни, ее главным архитектором, т. е. именно ген играет важнейшую роль в эволюции самой живой материи.
Морфология бактерий
Всем бактериям присущи определенная форма и размеры, которые выражаются в микрометрах (мкм). Они варьируют в широких пределах – от 0,1 – 0,15 (Mycoplasma) до 10 – 15 мкм (Clostridium) в длине и от 0,1 мкм до 1,5 – 2,5 мкм в диаметре. Бо́льшая часть бактерий имеет размеры 0,5 – 0,8 мкм × 2 – 3 мкм.
Различают следующие основные формы бактерий: шаровидные (сферические), или кокковидные (греч. kokkos – зерно); палочковидные (цилиндрические); извитые (спиралевидные); нитевидные. Кроме того, существуют бактерии, имеющие треугольную, звездообразную, тарелкообразную форму (см. цв. вкл., рис. 1.1 – 1.8). Обнаружены так называемые квадратные бактерии, которые образуют скопления из 8 или 16 клеток в виде пласта (рис. 1.7).
Кокковидные патогенные бактерии обычно имеют форму правильного шара диаметром 1,0 – 1,5 мкм; некоторые – бобовидную, ланцетовидную, эллипсоидную форму. По характеру взаиморасположения образующихся после деления клеток кокки подразделяют на следующие группы:
1. Микрококки (греч. mikros – малый). Делятся в одной плоскости, располагаются одиночно и беспорядочно; сапрофиты; патогенных для человека нет (рис. 1.1).
2. Диплококки (греч. diplos – двойной). Деление происходит в одной плоскости с образованием пар клеток, имеющих либо бобовидную (Neisseria gonorrhoeae), либо ланцетовидную (Streptococcus pneumoniae) форму (рис. 1.2).
3. Стрептококки (греч. streptos – цепочка). Деление клеток происходит в одной плоскости, но размножающиеся клетки сохраняют между собой связь и образуют различной длины цепочки, напоминающие нити бус. Многие стрептококки являются патогенными для человека и вызывают различные заболевания: скарлатину, ангину, гнойные воспаления и др. (рис. 1.3).
4. Стафилококки (греч. staphyle – гроздь винограда). Деление происходит в нескольких плоскостях, а образующиеся клетки располагаются скоплениями, напоминающими гроздья винограда. Стафилококки вызывают более 100 различных заболеваний человека. Они наиболее частые возбудители гнойных воспалений (рис. 1.4).
5. Тетракокки (греч. tetra – четыре). Деление клеток происходит в двух взаимно перпендикулярных плоскостях с образованием тетрад. Патогенные для человека виды встречаются очень редко (рис. 1.5).
6. Сарцины (лат. sarcina – связка, тюк). Деление клеток происходит в трех взаимно перпендикулярных плоскостях с образованием пакетов (тюков) из 8, 16, 32 и большего числа особей. Особенно часто встречаются в воздухе. Имеются условнопатогенные представители (рис. 1.6).
Палочковидные (цилиндрические) формы бактерий. Термин «бактерия» (греч. bakterion – палочка) применяется как для названия всего царства прокариот (Eubacteria, Archebacteria), так и для названия палочек, не образующих спор. Палочки, образующие споры, подразделяют на бациллы (лат. bacillus – палочка) – аэробные спорообразующие бактерии, например Bacillus anthracis – возбудитель сибирской язвы, и клостридии (лат. clostridium – веретенообразный) – анаэробные спорообразующие бактерии, например Clostridium tetani – возбудитель столбняка. Палочки бывают длинными – более 3 мкм (Clostridium novyi – возбудитель газовой гангрены), короткими – 1,5 – 3,0 мкм (Escherichia coli и большинство возбудителей кишечных инфекций) и очень короткими – менее 1,0 мкм – в виде коккобактерий (Francisella tularensis – возбудитель туляремии, Brucella melitensis – бруцеллеза). Концы палочек могут быть закругленными (Escherichia coli и др.), заостренными (Fusobacterium), утолщенными (Corynebacterium), обрезанными (Bacillus anthracis);
палочка может иметь овоидную (яйцевидную) форму (Yersinia pestis – возбудитель чумы). По диаметру их делят на тонкие (Mycobacterium tuberculosis – возбудитель туберкулеза) и толстые (Clostridium perfringens – возбудитель газовой гангрены). По взаиморасположению бактерий их подразделяют на три группы (см. цв. вкл., рис. 2.1 – 2.6): 1) монобактерии – палочки располагаются одиночно и беспорядочно, сюда относится большинство палочковидных форм (рис. 2.1); 2) диплобактерии, располагающиеся попарно (Pseudomonas) (рис. 2.2); 3) стрептобактерии (Haemophilus ducreyi – возбудитель мягкого шанкра) или стрептобациллы (Bacillus anthracis) – бактерии, располагающиеся цепочкой (рис. 2.3 и 2.4).
Извитые (спиралевидные) бактерии по количеству и характеру завитков, а также по диаметру клеток подразделяют на две группы: 1) вибрионы (греч. vibrio – извиваюсь, изгибаюсь) имеют один изгиб, не превышающий четверти оборота спирали, однако могут иметь и форму прямой палочки, без изгиба (Vibrio cholerae – возбудитель холеры) (рис. 2.5); 2) спириллы (греч. speira – спираль) – клетки, имеющие большой диаметр и малое (2 – 3) число завитков (Spirillum minor – возбудитель содоку) (рис. 2.6). Особую группу спиралевидных бактерий представляют спирохеты, выделенные в порядок Spirochaetales. Их морфология подробно описана в гл. 69.
Нитевидные формы бактерий. Различают два типа нитевидных бактерий: образующие временные нити и постоянные.
Временные нити, иногда с ветвлениями, образуют палочковидные бактерии при нарушении условий их роста или регуляции клеточного деления (микобактерии, коринебактерии, а также риккетсии, микоплазмы, многие грамотрицательные и грамположительные бактерии). При восстановлении механизма регуляции деления и нормальных условий роста эти бактерии восстанавливают обычные для них размеры.
Рис. 2.7. Нитевидные бактерии.
Sphaerotilus natans, часть влагалища пустая
Постоянные нитевидные формы образуются из палочковидных клеток, соединяющихся в длинные цепочки либо с помощью слизи, либо чехлами (влагалищами, рис. 2.7), либо мостиками. Влагалищами, или футлярами, называют трубковидные чехлы гетерополисахаридной природы. Слизь может связывать отдельные клетки в длинные нити (Zoogloea) или пленки (Bacteriogloea). Нитевидные формы образуют серобактерии и железобактерии.
Следует особо отметить, что бактерии отличаются высоким полиморфизмом (индивидуальной изменчивостью формы, не передающейся по наследству), особенно при культивировании на искусственных питательных средах. Под действием различных факторов (антибиотиков, химических веществ) могут возникать необычные по форме и величине клетки, которые, однако, способны ревертировать в исходное состояние при снятии действия этих факторов.
Клетка – универсальная структурная единица живой материи. Подтверждением этому является сходство в химическом составе бактерии и клетки млекопитающего, которая в 2000 раз больше первой (табл. 2).
Таблица 2
Примерный химический состав типичной бактерии и типичной клетки
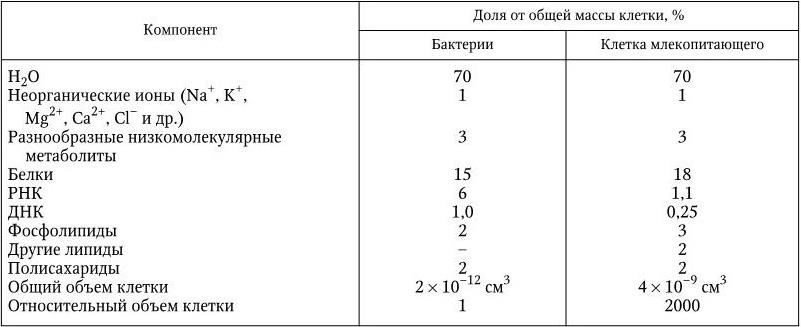
Организация бактериальной клетки позволяет ей координировать все процессы жизнедеятельности, за определенный срок удваивать свою биомассу и размножаться путем бинарного деления. В составе бактериальной клетки можно выделить различные структуры (рис. 3):
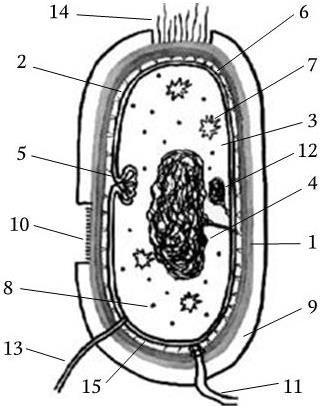
Рис. 3. Схема строения бактериальной клетки:
1 – клеточная стенка; 2 – цитоплазматическая мембрана; 3 – цитоплазма; 4 – нуклеоид; 5 – мезосома; 6 – периплазматическое пространство; 7 – включения; 8 – рибосома; 9 – капсула; 10 – микрокапсула; 11 – жгутик; 12 – плазмида; 13 – донорная ворсинка; 14 – фимбрии (реснички); 15 – перемычки в периплазматическом пространстве
Клеточная стенка – структурный компонент, присущий только бактериям (кроме микоплазм). Клеточная стенка выполняет следующие функции:
1. Определяет и сохраняет постоянную форму клетки.
2. Защищает внутреннюю часть клетки от действия механических и осмотических сил внешней среды.
3. Участвует в регуляции роста и деления клеток.
4. Обеспечивает коммуникацию с внешней средой через каналы и поры.
5. Несет на себе специфические рецепторы для бактериофагов.
6. Определяет во многом антигенную характеристику бактерий (природу и специфичность О– и К-антигенов).
7. Содержащийся в ее составе пептидогликан наделяет клетку важными иммунобиологическими свойствами (см. ниже).
8. Нарушение синтеза клеточной стенки бактерий является главной причиной их L-трансформации.
Строение клеточной стенки. В ее составе имеется два слоя: наружный – пластичный и внутренний – ригидный. Основу клеточной стенки составляет пептидогликан, который ранее называли муреином (лат. mureus – стенка). Он имеется только у эубактерий (кроме микоплазм). Пептидогликан (см. цв. вкл., рис. 4) включает в себя остов и два набора пептидных цепочек – боковых и поперечных. Остов пептидогликана одинаков у всех бактерий и состоит из чередующихся молекул аминосахаров – N-ацетилглюкозамина (N-АцГлю) и N-ацетилмураминовой кислоты (N-АцМур), связанных между собой β-гликозидными связями (рис. 5). Боковые цепочки в каждой молекуле пептидогликана представлены набором идентичных тетрапептидов. Поперечные цепочки также представлены набором из идентичных для данной молекулы пептидогликана пентапептидов, содержащих глицин, – пентаглицинов, однако у разных видов бактерий боковые и поперечные пептиды различны. В тетрапептидной боковой цепочке у большинства грамотрицательных бактерий имеется диаминопимелиновая (диаминопимеловая) кислота (ДАП) – уникальный компонент клеточной стенки, обнаруженный только у прокариот. Кроме того, в составе боковых цепочек пептидогликана обнаружены D-аминокислоты (D-аланин, D-глутамин). Боковые тетрапептиды связаны с N-ацетилмураминовой кислотой остова. Связывание боковых тетрапептидов между собой происходит путем образования поперечных пентаглициновых мостиков между D-аланином одной цепи и диаминопимелиновой кислотой (или иной аминокислотой) другого бокового пептида. Наличие двух типов связей (гликозидные и пептидные), которые соединяют субъединицы пептидогликанов, придает этому гетерополимеру структуру молекулярной сети (см. цв. вкл., рис. 4). Благодаря этим связям пептидогликановый слой клеточной стенки образует огромного размера ригидную мешковидную макромолекулу, которая окружает протопласт, уравновешивает его тургорное давление (у E. coli – до 15 атм.) и придает ему определенную постоянную форму. Пептидогликан может разрушаться под действием различных ферментов, а его синтез блокируют бета-лактамные антибиотики.
Связь между N-ацетилмураминовой кислотой и N-ацетилглюкозамином разрушается лизоцимом, связь между N-ацетилмураминовой кислотой и боковым пептидом (его L-аланином) расщепляют амидазы, а связи межпептидные – эндопептидазы. Пентаглициновый мостик стафилококкового пептидогликана разрушается лизостафином. Образование поперечных сшивок между боковыми цепочками тетрапептидов блокируется пенициллинами (бета-лактамными антибиотиками). Это приводит к разрыхлению пептидогликановой сети, следствием чего является осмотический лизис растущих клеток. Пептидогликан, помимо того что он определяет постоянную форму бактерий, обладает следующими важнейшими иммунобиологическими свойствами.
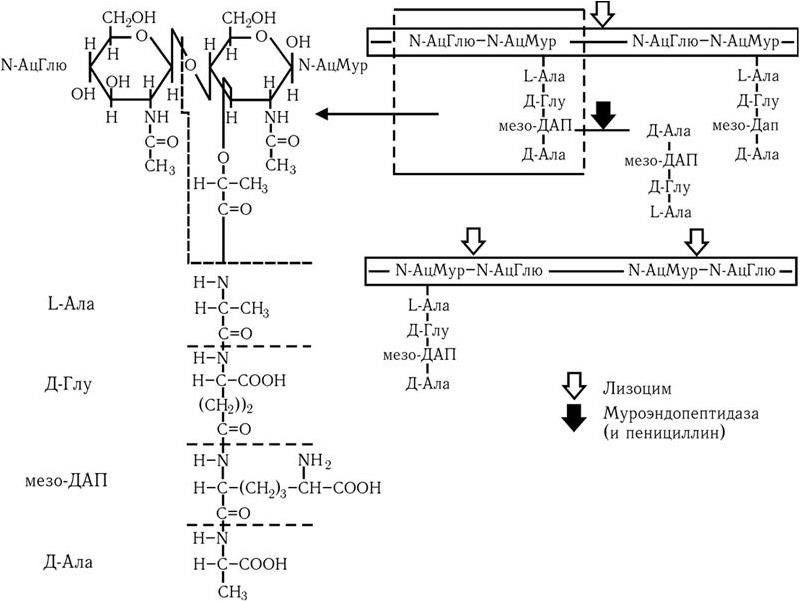
Рис. 5. Химическая структура пептидогликана.
Стрелками указаны участки молекулы, атакуемые лизоцимом, а также муроэндопептидазой и пенициллином. Объяснение в тексте
1. В его составе обнаружены родоспецифические антигенные детерминанты. Они содержатся в гликановом остове и в тетрапептидах. В межпептидных мостиках имеются видоспецифические антигенные детерминанты.
2. Пептидогликан запускает классический и альтернативный пути активации системы комплемента.
3. Он тормозит фагоцитарную активность макрофагов, т. е. защищает бактерии, особенно грамположительные, от фагоцитоза.
4. Угнетает миграцию макрофагов.
5. Способен индуцировать развитие гиперчувствительности замедленного действия.
6. Обладает противоопухолевым действием.
7. Оказывает пирогенное действие на организм человека и животных.
Таким образом, клеточная стенка является чрезвычайно важной биологической структурой бактерий, определяющей многие их специфические свойства. Как отмечалось выше, все бактерии, в зависимости от их отношения к окраске по Граму, делятся на грамположительные и грамотрицательные. Суть окраски по Граму заключается в том, что вначале бактерии окрашивают кристаллическим или генциановым фиолетовым, а затем – раствором Люголя, после чего мазок обрабатывают спиртом и докрашивают водным фуксином. Грамотрицательные бактерии обесцвечиваются спиртом и поэтому окрашиваются в красный цвет, а грамположительные не обесцвечиваются и сохраняют фиолетовую окраску. Это свойство грамположительных бактерий зависит исключительно от особенностей химического состава и структуры их клеточных стенок, так как при разрушении клеточных стенок или утрате их (в случае L-трансформации) они становятся грамотрицательными.
Причину различного отношения бактерий к окраске по Граму объясняют тем, что после обработки раствором Люголя образуется не растворимый в спирте комплекс йода с генциановым фиолетовым, который у грамположительных бактерий в связи со слабой проницаемостью их стенки не может диффундировать из клетки, в то время как у грамотрицательных легко удаляется при промывании их этанолом, а затем водой.
Особенности клеточной стенки грамположительных бактерий
Клеточная стенка грамположительных бактерий имеет однородную структуру, пластичный слой тонкий и ковалентно связан с ригидным слоем. Она значительно толще, чем у грамотрицательных – ее толщина 20 – 60 нм. Основную массу стенки составляет пептидогликан. Он представлен не 1 – 2 слоями, как у грамотрицательных бактерий, а 5 – 6, на его долю приходится до 90 % сухой массы клеточной стенки. Клеточная стенка содержит много тейхоевых кислот (до 50 % сухого веса ее). Тейхоевые кислоты (греч. teichos – стенка) – растворимые в воде линейные полимеры, содержащие остатки глицерина или рибитола, связанные между собой фосфодиэфирными связями. Тейхоевые кислоты – главные поверхностные антигены многих грамположительных бактерий. Они в значительном количестве располагаются между цитоплазматической мембраной и слоем пептидогликана и через поры в нем выступают наружу. Функция тейхоевых кислот полностью не выяснена. Клеточная стенка большинства грамположительных бактерий не содержит липидов, однако у микобактерий и коринебактерий в ней имеются токсические гликолипиды.
Особенность пептидогликанов грамположительных бактерий – частое отсутствие в них диаминопимелиновой кислоты. В клеточной стенке грамположительных бактерий отсутствуют липополисахариды; содержание белка в них сильно варьирует. Белки во многом определяют антигенную специфичность таких бактерий. Например, стрептококки серогруппы А по белкам М и Т подразделяют на несколько десятков серотипов.
Особенности клеточной стенки грамотрицательных бактерий
Клеточная стенка грамотрицательных бактерий значительно тоньше, и у большинства из них ее толщина составляет 14 – 18 нм. Четко выделяются два слоя – пластичный и ригидный, они связаны лабильно и отделяются друг от друга при обработке додецилсульфатом натрия. Основная особенность клеточной стенки грамотрицательных бактерий: ригидный слой тонкий, представлен одним или, редко, двумя слоями пептидогликана, на долю которого приходится до 5 – 10 % сухого веса стенки. Для пептидогликана характерно низкое содержание поперечных сшивок между пептидными цепочками, однако в нем почти всегда имеется диаминопимелиновая кислота.
В составе клеточной стенки содержится много липопротеинов, фосфолипидов, липополисахарид, больше белка и, как правило, отсутствуют тейхоевые кислоты. Пластичный слой клеточной стенки у грамотрицательных бактерий представляет собой сложную мозаику, образованную из липопротеинов, липополисахаридов и наружной мембраны.
Липопротеины связывают наружную мембрану с пептидогликаном (белок связан с диаминопимелиновой кислотой бокового тетрапептида, а липид – нековалентно с наружной мембраной).
Липополисахарид (ЛПС) состоит из комплекса липида А и связанного с ним полисахарида, состоящего из ядра, которое одинаково у всех грамотрицательных бактерий, и терминальной цепочки из повторяющихся сахаров (рис. 6). Последние у разных видов бактерий различаются по химической природе. Они обычно представлены линейными трисахаридами или разветвляющимися тетра– или пентасахаридами. Терминальные повторяющиеся единицы полисахарида ЛПС располагаются на поверхности клетки в виде микроворсинок и определяют ее антигенную специфичность. ЛПС синтезируется на цитоплазматической мембране, а затем транспортируется в наружную часть клетки, он прикреплен к наружной мембране с помощью гидрофобных связей. ЛПС выполняет две важнейшие функции у грамотрицательных бактерий: во-первых, он определяет их антигенную специфичность, а во-вторых, является одним из главных факторов их патогенности. ЛПС – это эндотоксин. Его токсичность определяется липидом А. Кроме того, ЛПС в организме запускает синтез около 20 различных биологически активных соединений, которые опосредуют патогенез эндотоксикоза, и обладает пирогенным действием.
Наружная мембрана, подобно любой биологической мембране, состоит из двух слоев липидов, но в ней значительная часть фосфолипидов наружного слоя замещена молекулами липополисахаридов и набором белков, локализованных мозаично (рис. 7). В состав этих белков, заключенных в фосфолипидную матрицу, входят 3 или 4 основных (major), которые составляют около 70 % суммарных белков наружной мембраны; липопротеины и второстепенные белки, числом более 10. Два из основных белков проходят через оба слоя мембраны и прочно связаны с пептидогликаном. Эти белки-порины располагаются в виде триплетов и образуют диффузионные поры, через которые в клетку проникают мелкие гидрофильные молекулы. Второстепенные белки выполняют разнообразные специфические функции: одни из них участвуют в облегченной диффузии, другие – в активном транспорте молекул через наружную мембрану и выступают в качестве специфических рецепторов для фагов и колицинов. Некоторые из этих белков участвуют в конъюгации (являются рецепторами для донорных ворсинок), в контроле репликации ДНК и регуляции клеточного деления. Наружная мембрана осуществляет также функцию барьера, через который в клетку не способны проникать крупные молекулы (один из механизмов неспецифической устойчивости грамотрицательных бактерий к антибиотикам). Если бактерии поместить в гипертонический раствор, наступает резкое обезвоживание клеток, цитоплазма съеживается, и протопласт отходит от клеточной стенки. Это явление называется плазмолизом. В результате плазмолиза клетки гибнут. Этим свойством широко пользуются для консервирования пищевых продуктов с помощью концентрированных растворов поваренной соли или сахара. Однако плазмолиз проявляется не в одинаковой степени у разных видов бактерий. К нему особенно устойчивы Bacillus subtilis, Staphylococcus aureus, которые являются частыми виновниками пищевых отравлений. В случае помещения бактерий в дистиллированную воду или гипотонические растворы солей происходит противоположное явление – плазмоптиз: вода устремляется в клетки, происходит их набухание и разрушение.
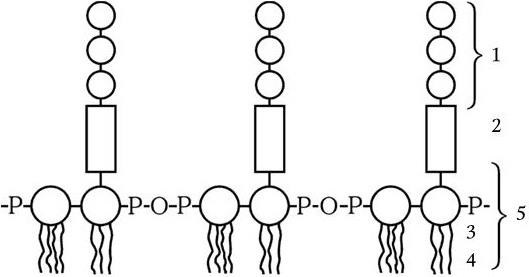
Рис. 6. Структура липополисахарида грамотрицательных бактерий:
1 – повторяющиеся единицы; 2 – ядро; 3 – полимер дисахарид-фосфата; 4 – жирные кислоты; 5 – липид
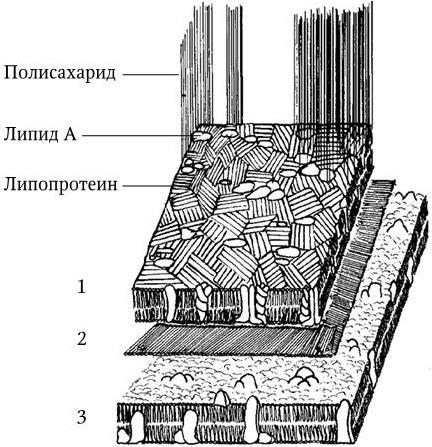
Рис. 7. Схематическое изображение структур наружной мембраны (1), пептидогликана (2) и плазматической мембраны (3) E. coli
При обработке грамположительных бактерий ферментами, разрушающими пептидогликан, возникают протопласты, т. е. структуры, полностью лишенные клеточной стенки. Обработка грамотрицательных бактерий лизоцимом разрушает только слой пептидогликана клеточной стенки, но наружная мембрана (или, по крайней мере, часть ее) сохраняется. Такие структуры получили название сферопластов. Протопласты и сферопласты имеют сферическую форму и в соответствующих осмотических условиях сохраняют жизнеспособность. Особенно чувствительны к изменению осмотического давления протопласты. При определенных условиях они способны к размножению подобно L-формам бактерий. Нарушение синтеза клеточной стенки лежит в основе L-трансформации бактерий.
Впервые эта форма изменчивости бактерий была описана в 1935 г. Е. Клинебергер. Она обнаружила и выделила из культуры Streptobacillus moniliformis необычные варианты, которые росли в виде маленьких характерных колоний с врастающей в агар центральной и фестончатой полупрозрачной периферической зонами. В этих колониях обнаруживались самые разнообразные по морфологии структуры: нитевидные, волокнистые, колбасовидные, шаровидные образования и мелкие гранулы размером 0,1 – 0,15 мкм (фильтрующиеся формы бактерий). Поскольку этот феномен был обнаружен в институте имени Листера, то таким необычным вариантам бактерий дали название L-форм, а такую изменчивость бактерий назвали L-трансформацией. Она может быть обратимой и необратимой. В случае если генетический контроль синтеза клеточной стенки сохраняется, L-формы при благоприятных условиях могут возвращаться в исходную бактериальную форму с восстановлением всех основных биологических свойств, включая патогенность. Если же генетический контроль синтеза клеточной стенки нарушен необратимо, L-трансформация приобретает необратимый характер, а такие L-трансформанты по своим морфологическим, культуральным и иным свойствам становятся неотличимыми от микоплазм. L-трансформации могут подвергаться, по-видимому, все бактерии, имеющие клеточную стенку, а все образующиеся L-формы, независимо от вида бактерий, из которого они возникли, обладают следующими общими для них особенностями:
1. Сходство морфологических изменений: образование нитевидных, волокнистых, колбасовидных, шаровидных и гранулярных форм.
2. Сходные культуральные свойства: анаэробные или микроаэрофильные условия роста, потребность в холестерине и сывороточном белке, рост на плотных средах в виде характерных колоний двух типов – А и В (рис. 8). Колонии типа А растут на поверхности агара, имеют очень мелкие размеры. Они состоят главным образом из гранулярных структур, лишенных клеточной стенки, и очень похожи на микоплазмы. Колонии типа В состоят из центральной зоны, врастающей в агар, и прозрачной фестончатой периферической зоны. Они похожи по внешнему виду на колонии типа «глазуньи», образуемые микоплазмами, но более крупные и грубые. В этих колониях обнаруживаются крупные тела, содержащие компоненты клеточной стенки, сходные со стенкой родительских бактерий, но лишенные ригидности. Многие бактерии образуют колонии А и В типов, однако грамположительные бактерии (Streptococcus, Staphylococcus) чаще образуют колонии только типа А. L-формы бактерий из колоний типа В легко ревертируют в исходные формы. Колонии типа А более стабильны и ревертируют в исходные формы значительно реже.
3. Постепенное (по мере нарушения синтеза клеточной стенки) превращение из грамположительных в грамотрицательные структуры.
4. Образование стабильных и нестабильных L-форм (в зависимости от степени полноты утраты способности синтезировать клеточную стенку).
5. Изменение антигенных свойств (утрата К– и О-антигенов как следствие нарушения синтеза клеточной стенки).
Рис. 8. L-формы бактерий:
1 – колонии L-форм типа 3А и 3В; 2 – пузыревидные, грушевидные и субмикроскопические элементы L-форм дифтерийной палочки
6. Снижение вирулентности по сравнению с исходными родительскими формами в связи с утратой различных факторов патогенности (адгезии, инвазии, эндотоксина и т. п.).
7. Способность длительно персистировать (переживать) в организме. Утрата клеточной стенки делает L-формы нечувствительными к различным химиопрепаратам и антителам.
8. Способность при неполной утрате синтеза клеточной стенки возвращаться в исходную бактериальную форму.
L-трансформация происходит как in vitro, так и in vivo (в организме человека и животных). Факторами, индуцирующими ее, являются различные антибиотики, угнетающие биосинтез клеточной стенки (пенициллин, цефалоспорины, циклосерин, ванкомицин и т. п.); ферменты (лизоцим, амидаза, эндопептидаза); антимикробные антитела; высокие концентрации некоторых аминокислот, особенно глицина и фенилаланина.
Исключительное значение L-трансформации патогенных бактерий заключается в том, что она является частой причиной перехода острых форм заболеваний в хронические и их обострений. L-трансформацию надо рассматривать не просто как одно из проявлений изменчивости бактерий, а как своеобразную, присущую всем бактериям форму приспособления к неблагоприятным условиям существования (подобно спорообразованию), которая способствует сохранению вида бактерий в природе. Клеточная стенка и ее синтез чувствительны к действию антител и различных химиопрепаратов. Освобождение от нее не лишает бактерии жизнеспособности, но позволяет переживать действие этих неблагоприятных для них факторов, а по их устранении – возвращаться в свое исходное состояние.
Принимая во внимание особую роль клеточной стенки в жизни бактерий, ей можно дать такое определение. Клеточная стенка – сложный структурный элемент, встречающийся только у эубактерий (кроме микоплазм) и характеризующийся наличием в его составе уникального химического соединения – пептидогликана, наделяющего клетку важными иммунобиологическими свойствами и определяющего ее постоянную форму; нарушение его синтеза приводит к превращению бактерий в L-формы, с помощью которых и обеспечивается, главным образом, длительное персистирование возбудителя в организме – одна из основных причин перехода заболевания из острой в хроническую форму. Соответственно L-трансформация, как и спорообразование, является важнейшей формой приспособления бактерий к неблагоприятным условиям существования.
Цитоплазматическая мембрана бактерий
Цитоплазматическая мембрана (ЦМ) является исключительно полифункциональной структурой.
1. ЦМ воспринимает всю химическую информацию, поступающую в клетку из внешней среды.
2. Она является основным осмотическим барьером, благодаря которому внутри клетки поддерживается определенное осмотическое давление.
3. ЦМ совместно с клеточной стенкой участвует в регуляции роста и клеточного деления бактерий.
4. ЦМ участвует в регуляции процессов репликации и сегрегации хромосом и плазмид (они связаны с ее рецепторами).
5. В ЦМ содержится значительное количество ферментов, в том числе системы переноса электронов (ЦМ – место генерации энергии у бактерий).
6. С ЦМ связаны жгутики и аппарат регуляции их движения.
7. ЦМ участвует в процессах транспорта (в том числе активного) питательных веществ в клетку и продуктов жизнедеятельности, включая ферменты и экзотоксины, из клетки в окружающую среду. В ней содержатся белки, участвующие в облегченной диффузии и активном транспорте.
8. ЦМ участвует в синтезе компонентов клеточной стенки и образовании мезосом (мезосомы возникают в результате инвагинации участка ЦМ в цитоплазму, они открыты в периплазматическое пространство).
9. ЦМ играет важную роль в компартментализации (англ. compartment – отсек, отделение), т. е. в разделении на «отсеки» рибосом и их стабилизации.
Каким образом мембрана осуществляет на молекулярном уровне свои многочисленные функции – один из актуальнейших вопросов современной биологии. На долю ЦМ приходится около 10 % сухого веса бактерий. Она содержит 25 – 40 % фосфолипидов, образующих два слоя, 20 – 75 % белков и до 6 % углеводов. Молекулы фосфолипидов асимметричны: головки, несущие электрический заряд, гидрофильны; хвостики – нейтральны и гидрофобны. Фосфолипиды упакованы в мембране следующим образом: их полярные гидрофильные головки обращены наружу и образуют два слоя ЦМ – внутренний и внешний, а неполярные гидрофобные хвостики скрыты в толще мембраны. На электронограммах ЦМ имеет вид трехслойной структуры, состоящей из двух параллельных темных слоев и разделяющего их светлого слоя. Этот слой более проницаем для электронов, чем слои, состоящие из полярных концов фосфолипидов, ассоциированных с белками. Специфичность функций ЦМ во многом зависит от набора содержащихся в них белков. Расположение их в ЦМ своеобразно (рис. 9): некоторые белки пронизывают весь двойной липидный слой, определенная часть белков связана или только с внутренней, или только с наружной поверхностью мембраны. Это вытекает из того, что взаимодействие между мембраной и цитоплазмой, с одной стороны, мембраной и внешней средой – с другой, определяет различные, хотя и взаимосвязанные, процессы ее жизнеобеспечения: облегченная диффузия, активный транспорт, перенос электронов, мобилизация энергии и т. п. Молекулы белков и других соединений, входящих в состав ЦМ, обладают значительной свободой перемещения.
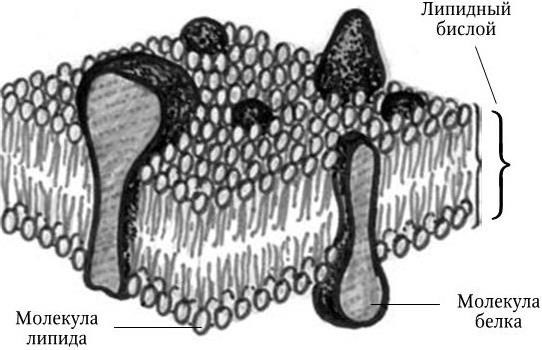
Рис. 9. Схематическая модель элементарной биологической мембраны
Структура, состоящая из клеточной стенки и ЦМ, получила название оболочки клетки.
Цитоплазма бактерий представляет собой сложную коллоидную систему, в ней нет эндоплазматического ретикулума и других цитоплазматических органелл, свойственных эукариотам; она неподвижна. Правда, в цитоплазме Mycobacterium, Streptococcus, Clostridium, Proteus обнаружены микротрубочки – рапидосомы, сходные с микротрубочками простейших. У некоторых прокариот имеются три типа органелл, окруженных белковыми мембранами: газовые пузырьки (у водных прокариот, например, пурпурных и серных бактерий, галобактерий и др.), хлоробиум-везикулы (в них у фотосинтезирующих бактерий размещается аппарат фотосинтеза) и карбоксисомы (в них содержится большая часть основного фермента процесса фиксации CO2 – карбоксидисмутазы). В цитоплазме располагается ядерный аппарат – генофор (нуклеоплазма), который не отделен от нее никакими мембранами. Кроме хромосомы (хромосом), в цитоплазме многих бактерий, в том числе патогенных, имеются плазмиды, иногда целый их комплекс. Как хромосома, так и плазмиды связаны со специфическими рецепторами на ЦМ. В цитоплазме располагаются бактериальные рибосомы 70S и все остальные компоненты белоксинтезирующей системы. Помимо этих основных структурных элементов, являющихся главными атрибутами живой клетки, в цитоплазме содержатся различные макромолекулы (тРНК, аминокислоты, нуклеотиды и т. п.); могут быть мезосомы, которые участвуют в энергетическом обмене, формировании межклеточной перегородки при делении, спорообразовании и, возможно, обладают другими функциями. Нередко в цитоплазме бактерий обнаруживаются различные включения, которые образуются в процессе жизнедеятельности: капельки нейтральных липидов; воска, серы, гранулезы (специфическое запасное углеводное вещество, накапливающееся у бактерий рода Clostridium); гранулы гликогена; волютина (метаполифосфата), особенно у Spirillum volutans и Corynebacterium diphtheriae – возбудителя дифтерии; поли-β-гидроксимасляной кислоты – ПОМ (особенно у рода Bacillus). Гранулеза, гликоген, ПОМ, зерна волютина служат для бактерий запасным источником энергии. У некоторых бактерий (Bacillus thuringiensis) в цитоплазме находятся кристаллы белковой природы, обладающие ядовитым действием для насекомых. У разных биологических групп бактерий могут быть и другие внутрицитоплазматические включения метаболического происхождения.
Периплазматическое пространство
Между ЦМ и внутренним слоем пептидогликана находится периплазматическое пространство, ширина его у грамположительных бактерий составляет около 10 нм. При электронной микроскопии обнаружено, что у грамположительных и, вероятно, у грамотрицательных бактерий между внутренней поверхностью пептидогликана и наружной поверхностью ЦМ имеются регулярно повторяющиеся перемычки. Поры, содержащиеся в клеточной стенке, открываются в периплазматическое пространство. В него всегда открыты и мезосомы. Периплазматическое пространство играет существенную роль во взаимодействии ЦМ и клеточной стенки, в нем содержатся различные ферменты, по преимуществу фосфатазы, связывающие белки, олигосахариды и другие вещества.
У бактерий различают микрокапсулу, капсулу и слизистый слой. Микрокапсула выявляется при электронной микроскопии в виде коротких мукополисахаридных фибрилл. Ее роль и значение не совсем ясны. Капсула представляет собой слизистый слой, который обычно сохраняет связь с клеточной стенкой. Капсула служит внешним покровом бактерий, толщина ее более 0,2 мкм, она четко обнаруживается под микроскопом после негативного окрашивания, например по способу Бурри – Гинса (см. цв. вкл., рис. 10). Капсулы, в связи с их гелеобразной консистенцией, плохо удерживают красители, поэтому для их обнаружения наиболее приемлем метод негативного контрастирования. Макромолекулы капсулы сильно гидратированы, расположены рыхло и не препятствуют поступлению веществ в клетку и выходу продуктов ее метаболизма наружу. В образовании капсулы принимает участие ЦМ. По химическому составу различают капсулы, состоящие из полисахаридов, не содержащих азота; полисахаридов, содержащих азот (аминосахара); капсулы полипептидной природы (табл. 3). Капсулу полипептидной природы образуют несколько видов Bacillus, она у них состоит из D-глутаминовой кислоты, и Y. pestis.
Таблица 3
Химический состав капсул некоторых бактерий
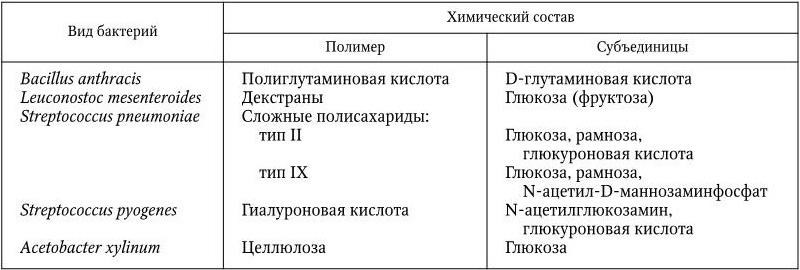
Некоторые виды патогенных бактерий (S. pneumoniae, B. anthracis, C. perfringens и др.) образуют капсулы лишь в организме человека или животного, другие – как в организме, так и на искусственных питательных (иногда специальных) средах (S. aureus, S. pyogenes, Klebsiella pneumoniae, K. rhinoscleromatis и др.). У патогенных бактерий капсула может окружать одну (Y. pestis), две (S. pneumoniae) или целую цепочку (B. anthracis, K. pneumoniae) клеток. Некоторые сапрофитные бактерии (Leuconostoc mesenteroides, Zoogloea) образуют зооглеи – скопления клеток, заключенные в одну общую капсулу. Хотя капсулы не являются для бактерий жизненно необходимыми, они наделяют их многими важными свойствами. Совместно с клеточной стенкой и ЦМ они образуют более мощную оболочку бактерий, предохраняют их от высыхания, несут для них запасные питательные вещества. Капсульные антигены патогенных бактерий определяют их антигенную специфичность и иммуногенные свойства. Например, наиболее эффективные вакцины против менингококковых и пневмококковых заболеваний готовят из капсульных полисахаридов возбудителей. У многих бактерий капсулы являются важными факторами патогенности: они либо маскируют их от фагоцитов, либо подавляют фагоцитоз. Утрата способности синтезировать капсулу у пневмококков, например, сопровождается полной утратой патогенности.
Слизистые слои. Нередко слизистые экзополимеры выделяются бактериальной клеткой в значительно большем количестве, частично отделяются от нее и образуют рыхлый слизистый слой.
По механизму движения бактерии подразделяют на плавающие и скользящие, или ползающие. Последние активно передвигаются по плотной поверхности благодаря волнообразным сокращениям тела (некоторые виды Mycoplasma, Myxococcus и др.). У плавающих бактерий органом движения являются жгутики, которые представляют собой тонкие длинные нитевидные белковые образования диаметром 12 – 30 нм и длиной от 6 – 9 до 80 мкм. Белок, из которого построены жгутики, получил название флагеллина. Он отличается от других белков, содержащихся в бактериальной клетке. Флагеллин обладает сократительной способностью, хотя механизм ее не совсем понятен.
Жгутик состоит из однотипных спиралевидно или продольно уложенных вокруг полой сердцевины белковых субъединиц, образующих цилиндрическую структуру, которая особым образом прикреплена к бактериальной клетке. По характеру расположения жгутиков и их количеству подвижные бактерии условно делят на четыре группы (рис. 11):
1) монотрихи – один полярно расположенный жгутик (Vibrio cholerae);
2) лофотрихи – пучок жгутиков на одном конце (Pseudomonas methanica);
3) амфитрихи – пучки жгутиков на обоих концах клетки (Spirillum volutans);
4) перитрихи – множество жгутиков, расположенных вокруг клетки (E. coli, Salmonella typhi).
Жгутик состоит из трех компонентов – спиральной жгутиковой нити постоянной толщины, крючка и базального тельца (рис. 12). Крючок, к которому присоединена жгутиковая нить, имеет длину 30 – 45 нм и состоит из отличающегося от флагеллина белка. Он соединен с базальным тельцем, которое располагается целиком в оболочке (в клеточной стенке и ЦМ).
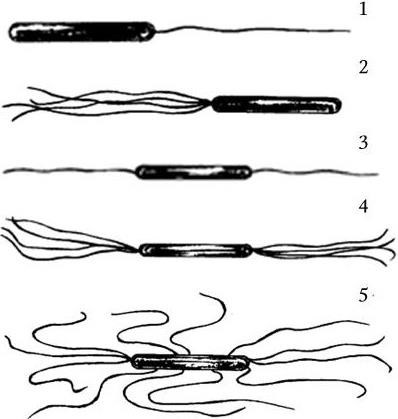
Рис. 11. Расположение жгутиков у бактерий:
1 – монотрихи; 2 – лофотрихи; 3, 4 – амфитрихи; 5 – перитрихи
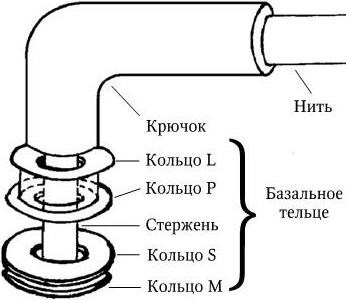
Рис. 12. Схематическая модель бактериального жгутика
Базальное тельце состоит из центрального стержня, заключенного в систему особых колец. У грамотрицательных бактерий их две пары: внешняя (кольца L и P) и внутренняя (кольца S и М). Кольца L и P расположены внутри клеточной стенки (кольцо L – в ЛПС, а кольцо P – в слое пептидогликана). Они выполняют, очевидно, роль втулки для стержня. Внутренняя пара (кольца S и M) фиксирована на ЦМ, причем кольцо S располагается в периплазматическом пространстве, а кольцо М – на ЦМ или в ней.
Жгутики у грамположительных бактерий, имеющих более толстую и гомогенную клеточную стенку, содержат только одну пару колец – S и M. Вращение жгутиков в клеточной стенке происходит из-за вращательного движения колец S и M относительно друг друга и обеспечивается за счет энергии трансмембранного градиента ионов водорода или натрия. Благодаря такому вращению происходит движение бактерий в наиболее благоприятном для них направлении. Жгутиковый аппарат обладает особым бинарным переключателем, который позволяет менять направление вращения жгутиков против часовой стрелки на противоположное. Таким способом бактерии, получив химический сигнал из окружающей среды, изменяют направление движения и выбирают оптимальные условия обитания. По всей вероятности, базальное тельце (его внутреннее кольцо М) непосредственно связано с какими-то дополнительными жгутиковыми белками, которые необходимы для сборки жгутиков и управления переключением направления их вращения и которые расположены либо в ЦМ, либо сразу под ней. Со жгутиковым аппаратом связана также и хемотаксическая активность таких бактерий. Генетический контроль синтеза жгутиковых белков, их сборки и активности осуществляется особым опероном. Установлено, что мутации в области mot-генов (англ. motility – подвижность) приводят к потере только подвижности, однако все структуры жгутиков сохраняются; мутации в cheгенах (англ. chemotaxis – хемо + подвижность) – к потере хемотаксической активности при сохранении структуры жгутиков и их подвижности. Подвижность бактерий определяют либо микроскопически (с помощью фазово-контрастной или обычной световой микроскопии «раздавленной» или «висячей» капли соответственно), либо бактериологически (при посеве уколом в столбик полужидкого агара: подвижные бактерии дают диффузный рост, а неподвижные – растут только по ходу укола). Жгутики хорошо выявляются при электронной микроскопии (рис. 13). Жгутиковые бактерии могут двигаться с большой скоростью, например Bacillus megaterium движется со скоростью 27 мкм/с, а Vibrio cholerae – 200 мкм/с.
Донорные ворсинки. У бактерий, являющихся носителями конъюгативных плазмид (F-плазмид, R-плазмид и др.), имеются длинные (0,5 – 10 мкм) нитевидные структуры белковой природы, получившие название донорных ворсинок, или донорных пилей (англ. pile – волосок). Как и жгутики, они имеют внутреннюю полость и построены из особого белка. Их синтез находится под контролем плазмидных генов. Они служат аппаратом конъюгации – с их помощью устанавливается непосредственный контакт между донорной и реципиентной клетками. Донорные пили обнаруживают с помощью донорспецифических фагов, которые на них адсорбируются и далее вызывают лизис клетки-хозяина. Донорные пили встречаются в количестве 1 – 2 на клетку.
Фимбрии, или реснички. Фимбрии (англ. fimbria – бахрома) – короткие нити, в большом количестве (до многих тысяч) окружающие бактериальную клетку (рис. 14). Подобно жгутикам и донорным ворсинкам, они прикреплены к клеточной стенке, но значительно короче и тоньше – их длина 0,1 – 12,0 мкм, диаметр 25 нм. Белок фимбрий отличается от белков жгутиков и донорных ворсинок. Биологическое значение фимбрий, по-видимому, состоит в том, что с их помощью бактерии прикрепляются к определенным поверхностям. Для многих патогенных бактерий фимбрии являются важными факторами патогенности, так как с их помощью бактерии прикрепляются к чувствительным клеткам и заселяют их, т. е. фимбрии служат для бактерий факторами адгезии и колонизации.
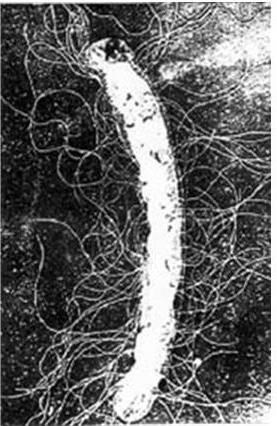
Рис. 13. Жгутики бактерий (электронограмма Proteus vulgaris)

Рис. 14. Реснички (фимбрии) бактерий (электронограмма Bordetella parapertussis)
Некоторые роды бактерий (Bacillus, Clostridium, Sporosarcina) при неблагоприятных для их существования условиях образуют защитные формы – эндоспоры. Споры представляют собой своеобразные покоящиеся клетки; у них чрезвычайно низкая метаболическая активность, но они обладают высокой устойчивостью к высушиванию, действию повышенной температуры и различных химических веществ. Высокую резистентность спор к действию указанных факторов связывают с присутствием в оболочке большого количества кальциевой соли дипиколиновой кислоты. Споры сильно преломляют свет, поэтому они хорошо заметны в неокрашенных препаратах. Для обнаружения спор предложены различные интенсивные способы окрашивания, поскольку они слабо воспринимают красители. Диаметр споры может не превышать диаметра вегетативной клетки (Bacillus) или превышает его. В последнем случае бактериальная клетка со спорой принимает форму веретена (Clostridium). Споры в клетке (рис. 15) могут располагаться центрально (B. megaterium), субтерминально (С. botulinum), терминально (C. tetani).
В процессе спорообразования (споруляции) бактериальная клетка подвергается сложной перестройке (рис. 16). Вначале на одном из ее полюсов происходит конденсация нуклеоида и отделение его за счет образования септы. Затем ЦМ начинает обрастать образовавшийся протопласт споры и возникает складка, состоящая из двух слоев ЦМ, позднее они сливаются, в результате образовавшаяся предспора оказывается окруженной двойной оболочкой. На следующей стадии между двумя мембранами, покрывающими предспору, формируется толстый слой кортекса (коры). Самый внутренний слой его представляет собой зародышевую стенку (из него образуется клеточная стенка прорастающей вегетативной клетки). По мере созревания споры обе ее мембраны участвуют в образовании специальных слоев споры. Таким образом между обращенными друг к другу мембранами образуются зародышевая стенка, кортекс, а также расположенные снаружи от мембран наружная и внутренняя оболочки и экзоспорий. Сформировавшаяся эндоспора состоит из протопласта с нуклеоидом, стенки споры, кортекса, оболочки и экзоспория.
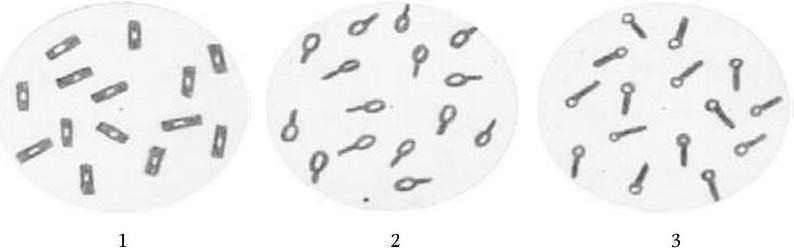
Рис. 15. Расположение спор у бактерий:
1 – центральное (Bacillus megaterium); 2 – субтерминальное (Clostridium botulinum); 3 – терминальное (Clostridium tetani)
Протопласт споры (ядро) содержит ЦМ, цитоплазму, хромосому, все компоненты белоксинтезирующей системы и анаэробной энергообразующей системы.
Стенка споры непосредственно окружает внутреннюю мембрану ее и представлена пептидогликаном, из которого формируется клеточная стенка прорастающей клетки.
Кортекс – самый толстый слой оболочки споры. Он состоит из пептидогликана, содержащего мало поперечных сшивок и поэтому очень чувствительного к лизоциму. Разрушение кортекса лизоцимом играет пусковую роль в процессе прорастания споры.
Оболочка споры построена из кератиноподобного белка. Плохая проницаемость ее определяет высокую устойчивость спор к действию различных химических веществ.
Рис. 16. Схема образования споры (по Г. Шлегелю):
А, Б – образование септы; В, Г – окружение протопласта споры мембраной материнской клетки; Д – формирование кортекса и оболочек споры; Е – схема строения зрелой споры: 1 – экзоспориум; 2 – наружная оболочка споры; 3 – внутренняя оболочка споры; 4 – кортекс; 5 – клеточная стенка споры; 6 – ЦМ споры; 7 – цитоплазма с нуклеоидом
Экзоспорий – липопротеиновая оболочка, содержащая немного углеводов.
После завершения спорообразования вегетативная часть клетки отмирает, спора высвобождается и длительное время сохраняется в окружающей среде, до тех пор, пока не возникнут условия, благоприятные для ее прорастания.
Генетический контроль спорообразования
Процесс спорообразования контролируется более чем 40 оперонами, которые представляют собой как бы дополнительный геном у спорообразующих бактерий. В составе этого генома насчитывается более 60 генов. Инициация споруляции связана с геном spoO, мутации в котором делают невозможным образование споры с самых начальных стадий. Транскрипция гена spoO запускает последовательную транскрипцию всех оперонов спорового генома. При этом их транскрипция носит строго регулируемый характер: выражение более поздних генов зависит от транскрипции более ранних генов. Это обусловливает четкую временнwую последовательность биохимических и морфологических процессов, лежащих в основе споруляции. Спорообразующие бактерии обладают механизмами, с помощью которых они распознают определенные изменения в окружающей среде, например, уменьшение содержания источников энергии, некоторых аминокислот и оснований. В ответ на это в клетке происходят метаболические изменения, которые и запускают споруляцию. Эти изменения приводят прежде всего к изменению субъединичного состава РНКполимераз. Индукция транскрипции спорового генома приводит к синтезу особых δ-единиц РНК-полимераз, которые и обеспечивают распознавание промоторов генов, контролирующих споруляцию. Вместе с тем наличие множественных промоторов у жизненно важных для клетки генов, распознаваемых разными δ-факторами, обеспечивает их выражение на всех этапах роста этих клеток, споруляции и прорастания спор. Одна из особенностей споруляции состоит в том, что на определенном ее этапе (приблизительно на 3-м часу) происходит синтез небольших кислоторастворимых белков. На их долю приходится около 10 – 12 % всех белков споры. В спорах они связываются с ДНК, обеспечивая устойчивость их к УФ-облучению. В момент прорастания споры эти белки гидролизуются и тем самым обеспечивают прорастающую спору необходимыми аминокислотами. У некоторых представителей рода Clostridium выявлена функциональная зависимость токсинообразования от споруляции: наиболее интенсивно экзотоксин вырабатывается во время активной споруляции; причинная связь этих процессов не ясна.
Прорастание споры происходит после получения соответствующего химического сигнала. Различные виды спорообразующих бактерий располагают рецепторами, распознающими наличие в среде источников энергии, L-аланина, аденозина и других веществ. Связывание с такими эффекторами активирует содержащийся в споре автолизин (лизоцим), который быстро разрушает пептидогликан кортекса.
Прорастание спор включает три стадии: активацию, начальную стадию и стадию роста.
Активация является обязательным условием прорастания спор. Она осуществляется различными воздействиями – кислой рН; веществами, содержащими свободные сульфгидрильные группы; повышением температуры; механическим повреждением спор.
Начальная стадия. Под влиянием внешних эффекторов происходит активация автолизина, последний разрушает пептидогликан кортекса, в спору поступает вода, спора высвобождается от дипиколината кальция, под воздействием гидролитических ферментов разрушаются другие ее компоненты.
Стадия роста. После разрушения кортекса и наружных слоев споры из нее появляется («выклевывается») растущая новая вегетативная клетка. Она состоит из протопласта споры и ее клеточной стенки. В ней активизируются биосинтетические процессы; в результате новая вегетативная клетка, при наличии необходимых питательных веществ, удваивает свою биомассу и делится на две дочерние клетки, которые далее активно размножаются, пока этому способствуют условия среды. Процесс прорастания споры контролируется генами как спорового, так и вегетативного геномов.
Некультивируемые формы бактерий
У многих видов грамотрицательных бактерий, в том числе у патогенных (шигеллы, сальмонеллы, холерный вибрион и др.) существует особое приспособительное, генетически регулируемое состояние, физиологически эквивалентное цистам, в которое они могут переходить под влиянием неблагоприятных условий и сохранять жизнеспособность до нескольких лет. Главная особенность этого состояния заключается в том, что такие бактерии не размножаются и поэтому не образуют колоний на плотной питательной среде. Такие не размножающиеся, но жизнеспособные клетки получили название некультивируемых форм бактерий (НФБ). Клетки НФБ, находящиеся в некультивируемом состоянии (НС), обладают активными метаболическими системами, в том числе системами переноса электронов, биосинтеза белка и нуклеиновых кислот, и сохраняют вирулентность. Их клеточная мембрана более вязкая, клетки обычно приобретают форму кокков, имеют значительно уменьшенные размеры. НФБ обладают более высокой устойчивостью во внешней среде и поэтому могут переживать в ней длительное время (например, холерный вибрион в грязном водоеме), поддерживая эндемическое состояние данного региона (водоема). Для обнаружения НФБ используют молекулярно-генетические методы (ДНК – ДНК-гибридизация, ЦПР), а также более простой метод прямого подсчета жизнеспособных клеток. С этой целью к исследуемому материалу добавляют в небольшом количестве питательные вещества (дрожжевой экстракт) и налидиксовую кислоту (для подавления синтеза ДНК) на несколько часов. Клетки усваивают питательные вещества и увеличиваются в размерах, но не делятся, поэтому такие увеличенные клетки четко видны в микроскоп и их легко подсчитать. Для этих целей можно использовать также методы цитохимические (образование формазана) или микроауторадиографии. Генетические механизмы, обусловливающие переход бактерий в НС и их реверсию из него, не ясны.
Глава 5 Физиология бактерий. Механизмы питания
Жизнь любого организма сводится к тому, чтобы в соответствии с имеющимся у него объемом генома полностью воспроизвести самого себя и реализовать свои функции, т. е. обусловить индивидуальное развитие (жизнь) и произвести потомство. Это оказывается возможным потому, что в основе жизни каждого организма лежит непрерывное взаимодействие трех потоков информации: одного – из внешней среды и еще двух потоков генетической информации: по горизонтали, он обеспечивает индивидуальное развитие организма и реализацию его жизненных функций, и другого – по вертикали, который обеспечивает передачу потомству всех признаков родителей, т. е. наследственную непрерывность вида и самой жизни. Из этого вытекает следующее положение, которое, по-видимому, имеет общебиологическую закономерность – поведение всех живых существ, как в интересах их индивидуального развития, так и ради сохранения вида, должно быть всегда адекватным имеющейся у них генетической информации и информации, воспринимаемой из внешней среды. Отступление от этого закона может привести к гибели организма и вида. Единство организма с внешней средой заключается не только в том, что он получает из среды необходимые для себя источники энергии, питания, а также другую информацию, но и в том, что, в свою очередь, он также воздействует на среду, изменяет ее и этим постоянно меняет условия своего существования. Поэтому взаимосвязь организма с внешней средой должна быть постоянной и взаимовыгодной.
Чем больше объем генома, тем сложнее устроен организм, тем разнообразнее его собственная генетическая информация и та информация, которую он может воспринимать из окружающей среды и перерабатывать. Тем разнообразнее, сложнее и богаче проявляется его индивидуальная жизнь.
Бактерии воспринимают информацию из внешней среды в виде механических, физических и, главным образом, химических сигналов, поступающих через клеточную мембрану. Химическими сигналами для бактерий служат различные источники энергии, аминокислоты, основания, другие сложные химические вещества, ионы, вода, от которых зависит общая интенсивность всех биосинтетических процессов в клетке.
Большинство бактерий живет в среде, мало подходящей для того, чтобы поддерживать строгое соотношение воды, солей и органических веществ, без которого невозможна жизнь. Это обусловливает необходимость постоянного и тщательного регулирования обмена различными веществами, который происходит между клеткой и внешней средой и контролируется клеточной мембраной. Она проницаема для многих веществ, поток их идет в обоих направлениях (из клетки и в клетку), но структура мембраны такова, что она обладает избирательной и неравномерной проницаемостью, определяющей механизмы питания бактерий.
Питательные вещества из внешней среды поступают в бактериальную клетку с помощью трех основных механизмов: пассивной диффузии, облегченной диффузии и активного транспорта (рис. 17).
Пассивная диффузия осуществляется за счет различного содержания питательных веществ в среде и в клетке и происходит в направлении от большей концентрации к меньшей, т. е. по градиенту концентрации. Когда концентрация вещества по ту и другую сторону мембраны уравнивается, пассивная диффузия прекращается. Ее скорость зависит от величины градиента, но она имеет определенный предел. Таким путем в клетку проникает (и покидает ее) вода вместе с растворенными в ней различными мелкими молекулами, способными проходить через мелкие поры мембраны. Для пассивной диффузии характерно отсутствие субстратной специфичности, и она не требует затраты энергии.
Облегченная диффузия характеризуется выраженной субстратной специфичностью и протекает при обязательном участии специфических белков, локализованных в мембране; синтез некоторых из них индуцируется соответствующими субстратами. Эти белки, получившие название пермеаз (англ. permeate – проникать, проходить сквозь), обладают субстратной специфичностью. Они распознают и связывают молекулу субстрата на внешней стороне мембраны и обеспечивают каким-то образом ее перенос через мембрану. На внутренней поверхности мембраны комплекс пермеаза – субстрат диссоциирует, освободившаяся молекула субстрата включается в общий метаболизм клетки, а пермеаза повторяет очередной цикл переноса своего субстрата, который не способен проникать через мембрану путем простой диффузии. Главное свойство пермеаз – способность проходить через мембрану как с присоединенной молекулой субстрата, так и без нее. Однако облегченная диффузия происходит только по градиенту концентрации, но не против него, поэтому она не требует затраты энергии. Пермеазы, присоединившись к субстрату, повышают его способность проникать через мембрану. Облегченная диффузия протекает со значительно более высокой скоростью, чем пассивная. Ее скорость подчиняется закону Михаэлиса – Ментен, и при достижении равновесия концентрация субстрата, доставляемого посредством облегченной диффузии, на внутренней и внешней поверхностях мембраны становится одинаковой.
Рис. 17. Бактериальные транспортные системы (Р. Стейнер [и др.]. Мир микробов. 1979, т. 2):
Разная длина стрелок указывает на сдвиг равновесия реакции в сторону более длинной стрелки. S и s означают соответственно высокую и низкую концентрации растворенных веществ; © – белок-переносчик (пермеаза); R – белок HРr; R-ф – фосфо-HРr; ф – фосфатная группа
Активный транспорт. С помощью механизмов активного транспорта растворенные вещества могут поступать в клетку против градиента концентрации, поэтому активный транспорт требует от клетки затраты энергии. У бактерий этот механизм питания является преобладающим. С его помощью они обеспечивают такие концентрации растворенных питательных веществ внутри клетки, которые могут во много раз превышать их концентрации во внешней среде и обеспечивают им высокие скорости метаболизма даже при низкой концентрации химических веществ в окружающей среде. У многих бактерий, в особенности грамотрицательных, в активном транспорте принимают участие особые связывающие белки, не идентичные пермеазам и не входящие в структуру мембраны, а локализованные в периплазматическом пространстве. У связывающих белков отсутствует каталитическая активность, но они обладают очень высоким сродством к определенным питательным веществам – к различным аминокислотам, сахарам, неорганическим ионам. Выделено и изучено более 100 различных связывающих белков, которые образуют прочные комплексы со своими субстратами и необходимы для их активного переноса через мембрану. Связывающие белки функционируют только в комплексе со специфическими пермеазами, осуществляющими активный перенос субстрата через мембрану. Метаболическая энергия, необходимая для этого, используется для снижения сродства пермеазы к своему субстрату на внутренней поверхности мембраны по сравнению с ее сродством к нему на внешней стороне мембраны. В результате этих превращений происходит изменение скорости выхода субстрата наружу, она становится во много раз меньше скорости его поступления в клетку. При этом механизме активного транспорта через мембрану в клетку поступают против градиента концентрации химически не измененные питательные вещества. У бактерий, вместе с тем, существуют и такие транспортные системы, которые переводят питательные вещества в химически измененную форму, не способную проникать через мембрану. К их числу относится фосфотрансферазная система, широко распространенная среди бактерий. С помощью этой системы транспортируются многие сахара и их производные, в процессе переноса они фосфорилируются и поступают в клетку в виде сахарофосфатов. Поскольку мембрана для последних непроницаема, сахарофосфаты остаются внутри клетки.
Фосфотрансферазная система состоит из двух неспецифических компонентов: ферментов I и HPr и набора субстрат-специфических белков, связанных с мембраной и обозначенных как ферменты II. Фермент I обеспечивает перенос богатой энергией фосфатной группы от фосфоенолпирувата на гистидиновый остаток фермента HPr, который превращается в фосфо-HPr. Последний является общим донором фосфорильной группы для всех субстратов, переносимых фосфотрансферазной системой. Фосфорилирование же их осуществляется субстрат-специфическими белками из группы ферментов II, которые выполняют также и функции пермеаз. У мутантных бактерий, лишенных фермента I или белка HPr, ферменты II осуществляют облегченную диффузию своих субстратов.
Транспортные системы в жизни клетки выполняют две основные функции:
1) поддерживают на высоком уровне внутриклеточные концентрации всех субстратов, необходимых для осуществления важнейших биохимических реакций с максимальными скоростями даже при низких концентрациях этих химических веществ во внешней среде;
2) регулируют внутриклеточное осмотическое давление, поддерживают оптимальную для метаболической активности концентрацию растворенных веществ (небольших молекул и ионов).
Секреция продуктов жизнедеятельности бактериальной клеткой
Бактерии синтезируют и секретируют во внешнюю среду различные продукты своей жизнедеятельности, в том числе белки, главным образом ферменты и токсины, с помощью которых они оптимизируют свое существование. Например, благодаря секреции ферментов они расщепляют сложные органические соединения и делают их более доступными для питания. Для патогенных бактерий секреция ферментов и токсинов служит мощным средством, благодаря которому они только и могут обеспечивать свое существование и размножение в организме животного и подавлять его защитные механизмы. Секреция белков бактериями осуществляется с помощью различных систем и механизмов. При этом следует различать секрецию белков в периплазматическое пространство через ЦМ и секрецию белков непосредственно в культуральную среду (экскрецию, или экспорт белков). У грамотрицательных бактерий большинство белков секретируется в периплазматическое пространство в виде белков-предшественников, содержащих в своей структуре особый сигнальный (лидерный) пептид из 15 – 40 аминокислотных остатков. Именно он обеспечивает перенос белка-предшественника через ЦМ, после чего и отрезается от него с помощью сигнальной (лидерной) пептидазы.
Существует несколько моделей, объясняющих механизм, посредством которого лидерный пептид обеспечивает секрецию белка-предшественника через ЦМ в периплазматическое пространство.
Модель прямого транспорта предполагает прямое вхождение лидерного пептида в липидный бислой мембраны с использованием свободной энергии мембраноассоциированных рибосом.
Сигнальная гипотеза предполагает, что в результате взаимодействия лидерного пептида непосредственно с особым рецептором мембраны образуется внутримембранный канал, через который и осуществляется секреция.
Существуют и другие, более сложные, модели механизма переноса секретируемого белка через ЦМ. Возможно, что применительно к разным белкам и у разных групп бактерий действуют различные механизмы. Детальнее всего механизмы секреции изучены у E. coli. У нее обнаружены два пути секреции: sec-зависимый и относительно sec-независимый. Для обеспечения секреции белков в случае sec-зависимого механизма требуется участие продуктов ряда sec-генов: secA, secY, secB, secD, secE и secF. Источниками энергии для переноса белков служат гидролиз АТФ и градиент концентрации протонов. Для осуществления посттранслокационного процессинга (англ. processing – обработка) белка после его перемещения (транслокации) достаточно, вероятно, активности только сигнальных пептидаз. У E. coli их обнаружено две: сигнальная пептидаза I (м. м. 36 кД, кодируется геном lepB) и сигнальная пептидаза II (м. м. 18 кД, кодируется геном lepA).
Большой интерес представляет так называемая система секреции 3-го типа (ССТ3). Она осуществляет секрецию эффекторных белков из цитоплазмы клетки через ЦМ и наружную мембрану непосредственно в клетки растения и животного, с которыми бактерия контактирует. ССТ3 обнаружена у бактерий родов Shigella, Salmonella, Yersinia и других и играет у них роль одного из факторов патогенности. Непосредственно в культуральную среду грамотрицательные бактерии экскретируют только некоторые белки, при этом в каждом случае используются различные механизмы, которые также еще недостаточно изучены. Например, бактериоцины, кодируемые различными плазмидами, не содержат в своей структуре сигнальных пептидов. Для их секреции через ЦМ и наружную мембрану требуется специальный вспомогательный белок – рилизинг-белок. Система транспорта гемолизина HlyA, кодируемого генами Hly-плазмиды, состоит как минимум из двух вспомогательных белков HlyB и HlyD, которые образуют канал для непосредственного выхода гемолизина (важного фактора патогенности E. coli) из цитоплазмы во внешнюю среду.
К числу важнейших химических элементов-органогенов, необходимых для синтеза органических соединений, относят: углерод, азот, водород и кислород. Свою потребность в водороде и кислороде бактерии удовлетворяют за счет воды. Сложнее обстоит дело с углеродным и азотным питанием. По способу углеродного питания бактерии делят на аутотрофы и гетеротрофы.
Аутотрофы (греч. autos – сам, trophe – питание) – организмы, которые полностью удовлетворяют свои потребности в углероде за счет CO2.
Гетеротрофы (греч. heteros – другой, trophe – питание, т. е. «питаемые другими») – организмы, которые не могут удовлетворить свои потребности в углероде только за счет CO2, а требуют для питания готовых органических соединений. В свою очередь, гетеротрофов подразделяют на сапрофитов (греч. sapros – гнилой, phyton – растение), т. е. гетеротрофов, источником питания которых служат мертвые органические субстраты; и паразитов (греч. para – при, sitos – пища), т. е. гетеротрофов, живущих за счет живых тканей животных и растений. Для превращения CO2 в органические соединения требуется энергия: чтобы восстановить CO2 в один моль гексозы требуется около 112 ккал. Существует два источника этой энергии – фотосинтез и хемосинтез.
Фотосинтез – это синтез за счет энергии солнечного света: свободная энергия фотона красного света (680 нм) ΔG = 41 ккал/моль, голубого (400 нм) – ΔG = = 65 ккал/моль. В результате фотосинтеза растительность земного шара ежегодно синтезирует более 100 млрд тонн органических веществ. На это используется около 200 млрд тонн CO2, и в атмосферу выделяется около 145 млрд тонн свободного O2. Общее количество солнечной энергии, используемой ежегодно для фотосинтеза, составляет не менее 3 ⋅ 1021 Дж.
У растений мобилизация солнечной энергии и превращение ее в энергию химических связей, главным образом в виде АТФ, осуществляется с помощью хлоропластов, содержащих хлорофилл (греч. chloros – зеленый, phyllon – лист) – зеленый пигмент, связанный с белками и липидами их мембран. Основу молекулы хлорофилла составляет магниевый комплекс порфиринового цикла, близкий к другим комплексам порфирина (с железом) – цитохромам, гему и т. п. Поглощая энергию фотона солнечного света, электрон в молекуле хлорофилла возбуждается и переходит с основного энергетического уровня на более высокий, а затем он стремится вновь возвратиться на свой основной, стабильный энергетический уровень, отдавая при этом поглощенную энергию. Если такое возвращение происходит в чистом препарате хлорофилла, поглощенная энергия испускается в виде света. Однако в клетке хлорофилл связан со специфическими молекулами, и поэтому возбужденный электрон отрывается от молекулы хлорофилла и транспортируется этими молекулами – переносчиками электронов. Они передают его по замкнутой цепи реакции вне молекулы хлорофилла. Возбужденный электрон постепенно отдает свою энергию, которая и используется для синтеза АТФ из АДФ и неорганического фосфора, а далее электрон возвращается на свое прежнее место в молекуле хлорофилла, способной после этого поглощать другой фотон. В ходе переноса возбужденного электрона по крайней мере два из его переносчиков способны мобилизовать часть переносимой им энергии для синтеза АТФ (рис. 18). В процессе фотосинтеза происходит не только связывание солнечной энергии, но и синтез углеводов, в частности глюкозы, путем восстановления CO2, т. е. добавления к ней электронов и водорода. Источником электронов служит хлорофилл, а источником протонов – вода.
Рис. 18. Процесс циклического фосфорилирования, посредством которого в молекуле хлорофилла электрон, перенесенный на более высокий энергетический уровень благодаря поглощению фотона света, обеспечивает энергию, необходимую для образования АТФ (по А. Ленингеру)
Реакция фотосинтеза осуществляется в две фазы. В первой (световые реакции) – под действием фотонов электрон хлорофилла переходит в возбужденное состояние;
затем, возвращаясь в свое обычное энергетическое состояние, он освобождает энергию, которая используется для синтеза таких молекул, как АТФ и НАДФН2. Во второй фазе (темновые реакции) АТФ и НАДФН2 используются для восстановления CO2 в глюкозу.
Суммарная реакция фотосинтеза такова:

Таким образом, молекула глюкозы, которая представляет собой конечный продукт фотосинтеза (наряду с кислородом), содержит большое количество солнечной энергии (около 690 ккал на 1 моль), заключенной в ее молекулярной структуре. Гетеротрофные организмы извлекают эту энергию путем последовательного расщепления молекулы глюкозы для того, чтобы «законсервировать» содержащуюся энергию в форме вновь образующихся молекул АТФ – универсальных хранителей и носителей энергии, необходимой для жизни всех клеток.
К фотосинтезирующим бактериям – фототрофам – относятся цианобактерии (сине-зеленые водоросли), пурпурные и зеленые бактерии, а также некоторые архебактерии.
Цианобактерии – различные многоклеточные нитчатые и одноклеточные организмы, среди них есть подвижные формы, которые передвигаются с помощью скольжения. У цианобактерий, как и у растений, фотосинтез осуществляется с помощью хлорофилла и сопровождается выделением свободного кислорода.
Архебактерии (экстремальные галофилы) осуществляют особую форму фотосинтеза. У них вместо хлорофилла в фотосинтезе участвует особый пигмент – бактериородопсин (комплекс каротиноида ретиналя с белком), который под влиянием света претерпевает фотохимические превращения, непосредственно сопряженные с синтезом АТФ.
Пурпурные и зеленые бактерии содержат различные по составу хлорофиллы (бактериохлорофиллы a, b, c, d и e) и каротиноиды. Большинство зеленых бактерий – мелкие, неподвижные грамотрицательные палочки. Пурпурные бактерии представлены грамотрицательными палочками, кокками или спириллами и часто имеют жгутики. У пурпурных бактерий хлорофилл замаскирован пурпурно-красным или коричневым пигментом, а фотосинтезирующий аппарат заключен в клеточную мембрану, у зеленых – в клеточную мембрану или в специальные органеллы – хлоробиум-везикулы, локализованные в цитоплазме или мембране. В отличие от растений, водорослей и цианобактерий при фотосинтезе пурпурные и зеленые бактерии не выделяют O2, так как для восстановления CO2 они используют в качестве доноров электронов не водород H2O, а водород H2S. При этом пурпурные бактерии окисляют H2S до H2SO4:
а зеленые серобактерии – до S2:

Некоторые пурпурные и зеленые бактерии в качестве донора электронов используют серу и другие ее неорганические соединения (тиосульфат, сульфит). Все они являются обитателями водоемов, где имеются наиболее благоприятные для них сочетания анаэробных условий, света и источников питания.
Русским ученым С. Н. Виноградским в 1880 – 1890 гг. было обнаружено, что некоторые грамотрицательные бактерии используют для своего роста энергию хемосинтеза, т. е. энергию, получаемую за счет окисления неорганических соединений. Такие организмы получили название хемоавтотрофов. Им было установлено, что хемоавтотрофы характеризуются двумя важнейшими особенностями:
1. Обладают высокой специфичностью в отношении неорганического источника энергии.
2. Очень часто они не только не способны использовать в качестве источников углерода и энергии органические вещества, но последние даже могут угнетать их рост.
К хемоавтотрофам относятся открытые С. Н. Виноградским нитрифицирующие бактерии, представленные двумя группами. Представители одной из них (роды Nitrosomonas, Nitrosospira, Nitrosococcus, Nitrosoglobus) окисляют NH3 до азотистой кислоты:

Представители другой (роды Nitrobacter, Nitrospira, Nitrococcus) окисляют азотистую кислоту до азотной:

Выделяемая при хемосинтезе энергия используется нитрифицирующими бактериями для ассимиляции CO2 и восстановления ее до глюкозы или других углеводов. Наиболее многочисленную и разнообразную группу хемосинтезирующих бактерий составляют водородные бактерии, осуществляющие реакцию:
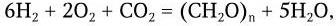
где (CH2O)n – условное обозначение синтезируемого углевода.
Но эти бактерии являются факультативными хемоавтотрофами, так как способны расти на средах, содержащих органические вещества. Некоторые строго анаэробные метанообразующие бактерии осуществляют хемосинтез по реакции:
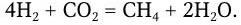
К хемоавтотрофам, как показал С. Н. Виноградский, относятся нитчатые скользящие бактерии Beggiatoa, Thiothrix и другие аэробы, способные окислять сероводород и тиосульфат до серы и сульфата. Внутри таких клеток часто обнаруживается сера.
К числу хемоавтотрофов относятся и некоторые виды железобактерий, в частности рода Gallionella, которые в качестве минерального источника восстановленного железа используют осадок сульфида железа.
У всех хемоавтотрофов ассимиляция CO2 происходит с помощью реакции, катализируемой рибулозодифосфаткарбоксилазой (реакция Кальвина):

Первичным продуктом фиксации CO2 является 3-фосфоглицериновая кислота, из которой синтезируются все остальные органические молекулы клетки.
Для осуществления ассимиляции CO2 хемоавтотрофы путем окислительной диссимиляции неорганического субстрата получают АТФ и восстановитель (восстановленный пиридиннуклеотид). Нитрифицирующие бактерии и многие тиобациллы имеют особые характерные для прокариот образования – карбоксисомы, содержащие рибулозодифосфаткарбоксилазу.
В зависимости от того, какими донорами электронов пользуются бактерии, их разделяют на литотрофы (используют неорганические доноры электронов H2, NH3, H2S, Fe и др.) и органотрофы (в качестве доноров электронов используют органические соединения).
Таким образом, по способу углеродного питания все организмы можно подразделить на три основные группы:
1. Фотолитотрофы (источник энергии – солнечный свет, доноры электронов – неорганические соединения).
2. Хемолитотрофы (источник энергии – окислительно-восстановительные реакции, доноры электронов – неорганические соединения).
3. Хемоорганотрофы (источник энергии – окислительно-восстановительные реакции, доноры электронов – органические соединения). Большинство патогенных бактерий относится к хемоорганотрофам.
По способу азотного питания бактерии подразделяют на аминоавтотрофов и аминогетеротрофов. Аминоавтотрофы способны полностью удовлетворять свои потребности в азоте, необходимом для синтеза главным образом белков и нуклеиновых кислот, с помощью атмосферного или минерального азота. Аминогетеротрофы нуждаются для своего питания в готовых органических азотистых соединениях: некоторых аминокислотах, основаниях, витаминах и др.
Рис. 19. Рисунок Мальпиги (XVII в.), изображающий корни бобового растения с корневыми клубеньками (1) и оболочкой семени (2), из которого развилось данное растение
К числу аминоавтотрофов относятся азотфиксирующие бактерии, свободно живущие в почве, и так называемые клубеньковые азотфиксирующие бактерии. Первый представитель азотфиксирующих бактерий – Clostridium pasteurianum (анаэроб) – был открыт в 1893 г. С. Н. Виноградским. В 1901 г. М. Бейеринк установил, что способностью усваивать атмосферный азот обладают также аэробные бактерии Azotobacter, занимающие по азотфиксирующей активности первое место (до 25 г азота на 1 кг использованного сахара), но менее распространенные в почве, чем C. pasteurianum. Азотфиксирующими свойствами обладают некоторые виды Pseudomonas, Bacillus, цианобактерий, а также пурпурные и зеленые серобактерии. Азотфиксирующие бактерии рода
Rhizobium получили название клубеньковых потому, что они, размножаясь на корнях ряда бобовых растений, образуют выросты-клубеньки (рис. 19). Размножаясь в них, они превращаются из мелких палочек в разветвленные формы – бактероиды, которые наиболее интенсивно связывают молекулярный азот. Симбиоз клубеньковых бактерий с растениями взаимовыгоден, так как Rhizobium продуцируют ряд физиологически активных соединений, которые благоприятно влияют на бобовые растения. После разрушения клубеньков клубеньковые бактерии живут в почве как сапрофиты.
Азотфиксирующие бактерии восстанавливают азот (N2) до NH3 с помощью сложной ферментной системы нитрогеназы, содержащей железо, молибден, магний. Эта система нуждается в источнике электронов, которые поступают через восстановитель с низким потенциалом, содержащий негеминовое железо – ферредоксин (переносчик электронов).
Цепь переноса электронов состоит из ферредоксина (Фд), азоферредоксина (АзоФд) и молибдоферредоксина (МоФд), и за один раз переносятся только два электрона. Для последнего переноса расходуется 1 молекула АТФ.
Поскольку для восстановления N2 до NH3 требуется шесть электронов, реакция, очевидно, протекает через три последовательные двухэлектронные стадии:
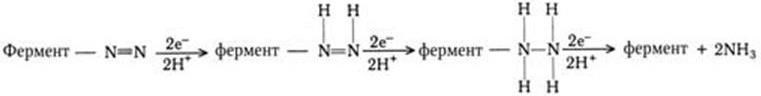
Подробное выяснение механизма генетического контроля азотфиксирующих систем бактерий может создать необходимые предпосылки для искусственного переноса оперонов этих систем в геном растений и конструирования трансгенных растительных организмов, обладающих азотфиксирующей активностью, что имело бы огромное значение для сельского хозяйства.
Вторая большая группа аминоавтотрофов представлена нитрифицирующими бактериями, которые используют для синтеза белков в качестве основных источников азота соли аммиака, азотистой и азотной кислот. Подсчитано, что на образование вновь вырастающих растений ежегодно требуется около 1,5 млрд тонн азота в форме, доступной растениям. Поэтому нельзя не отметить, что азотфиксирующим и нитрифицирующим бактериям принадлежит исключительно важная роль в обеспечении плодородия почвы (см. раздел «Роль микроорганизмов в круговороте веществ в природе», гл. 15).
Аминогетеротрофы для роста и размножения нуждаются в различных органических азотистых соединениях. Необходимо оговориться, что аминогетеротрофы представляют собой также неоднородную группу, так как многие из них нуждаются для роста лишь в определенных аминокислотах, как, например, Francisella tularensis. Для ее роста требуется добавление к среде по крайней мере 10 аминокислот. В то же время многие бактерии, синтезируя аминокислоты и основания из минеральных источников азота, нуждаются в тех витаминах (ростовых факторах), которые сами не способны синтезировать: биотин (Н), тиамин (В1), рибофлавин (В2), пантотеновая кислота (В3), холин (В4), никотинамид (В5), фолиевая кислота (В9) и ее производные (В11) и т. п. Наконец, есть патогенные бактерии, например группа гемоглобинофильных организмов (Haemophilus), которые для роста нуждаются в добавлении к питательной среде сложных веществ, содержащихся в крови: Х-факторов (гемин) и др. Кроме того, в результате различных мутаций аминогетеротрофные бактерии могут превращаться в мутанты, неспособные синтезировать тот или иной метаболит и поэтому нуждающиеся в нем. Такие мутанты получили название ауксотрофов (лат. auxilium – помощь и греч. trophe – питание). Они во многом способствовали изучению особенностей биохимии бактерий.
Для нормальной жизнедеятельности бактерии, как и другие организмы, обязательно нуждаются в ионах Na+, K+, Cl-, Ca2+, Mg2+, Mn2+, Fe2+, Cu2+, а также в фосфоре и сере, которые поступают в клетку путем диффузии и активного транспорта.
Все процессы обмена веществ представляют собой цепь взаимосвязанных во времени и пространстве саморегулируемых реакций. Каждая из них и их совокупные пути катализируются соответствующими ферментами.
Ферменты (греч. fermentum – закваска), или энзимы, – специфические белковые катализаторы, присутствующие во всех живых клетках. Их нет у плазмид, у некоторых вирусов. Ферменты снижают энергию активации, которая необходима для осуществления той или иной химической реакции. Они направляют ее обходным путем через промежуточные реакции, требующие значительно меньшей энергии активации. Под влиянием ферментов происходит перераспределение электронных плотностей и некоторая деформация молекул субстрата, наступающая при образовании промежуточного фермент-субстратного комплекса. Эта деформация приводит к ослаблению внутримолекулярных связей и, следовательно, к понижению необходимой энергии активации, в результате чего скорость реакции возрастает. Открытию различных ферментов и изучению путей биохимических реакций, катализируемых ими, во многом способствовали работы с использованием в качестве объектов исследования бактерий, особенно ауксотрофов. У бактерий обнаружены все шесть классов ферментов:
1) оксидоредуктазы (катализируют окислительно-восстановительные реакции);
2) трансферазы (катализируют реакции переноса групп атомов);
3) гидролазы (катализируют гидролитическое расщепление различных соединений);
4) лиазы (катализируют реакции отщепления от субстрата той или иной химической группы негидролитическими путями с образованием двойной связи или, наоборот, присоединение химической группы к двойным связям);
5) изомеразы (катализируют внутримолекулярные превращения);
6) лигазы, или синтетазы (катализируют соединение двух молекул, сопряженное с расщеплением пирофосфатной связи в молекуле АТФ или аналогичного трифосфата).
Изучение ферментов, обнаруживаемых у бактерий, представляет большой интерес для микробиологической промышленности. Изучение особенностей обмена веществ патогенных бактерий необходимо прежде всего для понимания механизмов, с помощью которых они реализуют свою патогенность, т. е. для выяснения сущности патогенеза инфекционных заболеваний. Изучение биохимических свойств бактерий широко используется как для их систематики и классификации, так и для идентификации, т. е. для диагностики.
У бактерий обнаружены уникальные генетические механизмы контроля биосинтеза ферментов, они проявляются в виде феноменов индукции и репрессии. Индукция заключается в том, что синтез ферментов наступает только в присутствии специфических химических веществ, которые являются субстратом для данного фермента или аналогом этого субстрата. Например, синтез ферментов, участвующих в потреблении лактозы у E. coli, начинается (индуцируется) и происходит только при наличии в среде лактозы. Как только она исчезает, синтез этих ферментов прекращается.
Под эффектом репрессии понимают явление, при котором синтез фермента подавляется (репрессируется) под влиянием специфических химических соединений, почти всегда являющихся непосредственными продуктами (или аналогами продуктов) реакции, катализируемой этим ферментом. Например, синтез ферментов, участвующих в образовании метионина у E. coli, прекращается, как только в среде накапливается избыток этой аминокислоты. Нетрудно видеть, насколько совершенен такой механизм саморегуляции биохимических процессов.
В соответствии с этими особенностями генетического контроля, у бактерий различают три основные группы ферментов: конститутивные, синтез которых происходит в течение всего клеточного цикла; индуцибельные, синтез которых индуцируется соответствующим субстратом; и репрессибельные, синтез которых подавляется в результате избыточного накопления продукта реакции, катализируемой данным ферментом (ферментами).
Биохимические процессы, протекающие в клетке, объединены одним словом – метаболизм (греч. metabole – превращение). Этот термин равнозначен понятию «обмен веществ и энергии». Различают две стороны метаболизма: анаболизм и катаболизм.
Анаболизм – совокупность биохимических реакций, осуществляющих синтез компонентов клетки, т. е. та сторона обмена веществ, которую называют конструктивным обменом.
Катаболизм – совокупность реакций, обеспечивающих клетку энергией, необходимой, в частности, и для реакций конструктивного обмена. Поэтому катаболизм определяют еще как энергетический обмен клетки.
В конструктивном обмене можно выделить две группы биосинтетических процессов: биосинтез мономеров (аминокислот, нуклеотидов, моносахаров, жирных кислот) и биосинтез полимеров (белков, нуклеиновых кислот, полисахаридов и липидов). Для их синтеза необходимо около 70 различных мономеров-предшественников. Помимо них, клетка должна синтезировать ряд соединений, играющих каталитическую роль. Синтез любого мономера происходит (при наличии источников углерода и энергии) через цепь последовательных биохимических реакций, катализируемых специфическими белками-ферментами. В свою очередь синтез всех биополимеров также требует участия специфических белков. Поэтому основу основ конструктивного обмена составляет биосинтез белков, который находится под контролем генетической системы организма.
Конструктивный обмен (анаболизм). Биосинтез белка
Состав белоксинтезирующей системы
Синтез белка осуществляется с помощью сложной белоксинтезирующей системы. В ее состав входят следующие компоненты.
1. Рибосомные субъединицы 30S и 50S, которые у прокариот и в митохондриях и хлоропластах эукариот образуют рибосому 70S; или субъединицы 40S и 60S, образующие у эукариот рибосому 80S.
2. Матричная РНК (мРНК).
3. Полный комплект двадцати аминоацил-тРНК, для образования которых необходимы соответствующие аминокислоты, аминоацил-тРНК-синтетазы, тРНК и АТФ. Аминоацил-тРНК (аа-тРНК) – это заряженная энергией и связанная с тРНК аминокислота, готовая для подвоза к рибосоме и включения в синтезирующийся на ней полипептид.
4. Белковые факторы инициации (у прокариот – IF-1, IF-2, IF-3).
5. Белковые факторы элонгации (у прокариот – EF-Tu, EF-Ts, EF-G).
6. Белковые факторы терминации (у прокариот – RF-1, RF-2, RF-3).
7. Некоторые другие белковые факторы (ассоциации, диссоциации субъединиц, высвобождения и пр.).
8. Гуанозинтрифосфат (ГТФ).
9. Неорганические катионы: двухвалентные – Mg2+ или Ca2+ – и одновалентные – K+ или HN4+ – в определенной концентрации.
Основным компонентом белоксинтезирующей системы является рибосома. Она объединяет все компоненты в единый комплекс. Рибосомы – «святая святых» клетки, так как именно на них совершается самое удивительное таинство живой материи – биологический синтез белка. Информация, содержащаяся в геноме, расшифровывается и материализуется в виде белков на рибосомах. Без них проявление жизнедеятельности невозможно.
Вирусы и плазмиды потому и являются облигатными внутриклеточными паразитами, что у них отсутствуют собственные рибосомы, и для реализации генетической информации (т. е. для проявления своей жизнедеятельности) они используют рибосомный аппарат клетки-хозяина.
Универсальности генетического кода соответствует универсальность механизма его расшифровки и реализации.
В природе существует только два класса рибосом – 70S и 80S. Они имеют сходную молекулярную структуру и механизм функционирования, хотя и различаются по размерам, составу и специфичности белков и белковых факторов. Схематический состав рибосом 70S и 80S показан на рис. 20.
Далее весь процесс биосинтеза белка будет рассматриваться на примере работы рибосом 70S.
Белковые факторы инициации (англ. initiation factors – IF) получили свое название потому, что они участвуют в организации активного комплекса (70S-комплекса) из субъединиц 30S и 50S, мРНК и инициаторной аминоацил-тРНК (у прокариот – формилметионил-тРНК), который «запускает» (инициирует) работу рибосом – трансляцию мРНК.
Белковые факторы элонгации (англ. elongation factors – EF) участвуют в удлинении (элонгации) синтезируемой полипептидной цепи (пептидила).
Белковые факторы терминации, или освобождения (англ. – release factors – RF) обеспечивают кодон-специфическое отделение полипептида от рибосомы и окончание синтеза белка.
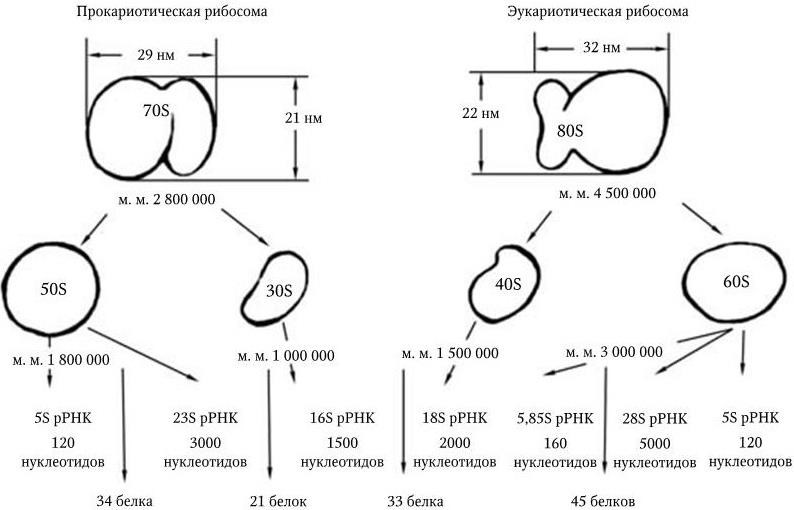
Рис. 20. Схематическое изображение структур прокариотических и эукариотических рибосом
Для осуществления трансляции необходимо участие ГТФ. Потребность белоксинтезирующей системы в ГТФ очень специфична: он не может быть заменен ни одним из других трифосфатов.
На биосинтез белка клетка затрачивает энергии больше, чем на синтез любого другого биополимера. Образование каждой новой пептидной связи требует расщепления четырех высокоэнергетических связей (АТФ и ГТФ): двух для того, чтобы нагрузить аминокислотой молекулу тРНК, и еще двух в ходе элонгации – одну при связывании аа-тРНК и другую при транслокации.
Рибосома выполняет следующие функции, необходимые для биосинтеза белка.
1. Функция динамического связывания и удержания всех компонентов белоксинтезирующей системы, благодаря чему создаются условия для встречи и взаимопрочитывания двух основных потоков информации, один из которых запрограммирован в мРНК, а другой – в антикодонах аа-тРНК; одновременно формируется биологическая машина, синтезирующая белок в строгом соответствии с последовательностью поступления в рибосому этой информации.
2. Каталитические функции, в частности образование пептидных связей между аминокислотами в синтезируемом полипептиде и гидролиз ГТФ.
3. Функция механического перемещения (транслокации): транслокация растущего пептида, связанного с тРНК, с одного участка рибосомы на другой и продвижение рибосомы вдоль мРНК. Выполнение этих функций обеспечивается наличием на рибосоме особых активных участков. Таких участков три (см. рис. 25). С одним из них связывается мРНК. Два других разных участка предназначены для связывания молекулы тРНК. В одном из них, получившем название пептидил-тРНК-связывающего участка, или Р-участка, прикрепляется тРНК, присоединенная к растущему концу полипептидной цепи – донорная тРНК. В другом – аминоацил-тРНК-связывающем участке, или А-участке, – связывается только что поступившая молекула тРНК, нагруженная аминокислотой – акцепторная тРНК. В обоих участках молекулы тРНК прочно прикрепляются лишь в том случае, если их антикодоны комплементарны кодонам мРНК и с ними спариваются. А– и Р-участки располагаются очень близко друг от друга, и поэтому связанные с ними молекулы тРНК связываются с двумя соседними кодонами в молекуле мРНК. Благодаря такому близкому расположению донорной тРНК, несущей пептидил, и акцепторной тРНК, несущей активированную аминокислоту, облегчается образование пептидных связей в синтезируемой полипептидной цепи. В процессе элонгации карбоксильный конец растущего пептидила отделяется в Р-участке от молекулы донорной тРНК и образует пептидную связь с аминокислотой, присоединенной к молекуле акцепторной аа-тРНК. Эта реакция катализируется не белковым ферментом, а особым фрагментом РНК большой субъединицы рибосомы (50S), который назвали рибозимом (по аналогии с «энзимом»).
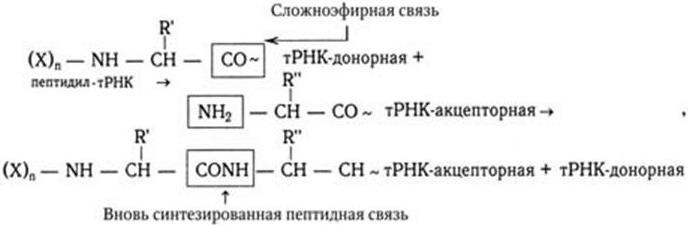
где (X)n – аминоацильные звенья пептидил-тРНК, R – радикалы.
Основные этапы биосинтеза белка
Процесс синтеза белка складывается из двух основных этапов: транскрипции и трансляции.
Первичная структура каждого белка (т. е. последовательность расположения в нем аминокислот), от которой зависит его специфичность, запрограммирована в соответствующем гене в виде последовательности расположения в нем кодонов. Перенос этой информации о структуре белка к рибосомам происходит с помощью мРНК. Процесс синтеза мРНК на генах и получил название транскрипции, или переписывания информации с ДНК-гена на мРНК-ген. Транскрипция осуществляется с помощью ДНК-зависимой РНК-полимеразы. Этот фермент представляет собой сложный белковый комплекс с м. м. около 480 кД. У бактерий он состоит по крайней мере из пяти белковых субъединиц: две α, β, β' и σ. Комплекс субъединиц α2, β, β' (core-энзим), хотя и обладает каталитической активностью, однако не может правильно выбирать точку начала транскрипции. Присоединение к этому комплексу σ-субъединицы превращает его в полноценный фермент РНК-полимеразу (холоэнзим). Сигма-субъединица РНК-полимеразы выполняет две основные функции: вопервых, она завершает формирование полноценной РНК-полимеразы, во-вторых, она наделяет ее способностью распознавать промотор на ДНК, с которого начинается транскрипция. Сигма-фактор освобождается от комплекса холоэнзим-ДНК немедленно после начала синтеза мРНК и может повторно использоваться для образования холоэнзима. Транскрипция является сложным многоступенчатым процессом, который включает в себя следующие основные стадии.
1. Инициация транскрипции, во время которой:
а) core-энзим взаимодействует с σ-фактором, образуя холоэнзим РНК-полимеразы;
б) РНК-полимераза связывается с промотором на ДНК и образует транскрипционный комплекс (ДНК-холоэнзим);
в) начинается синтез мРНК и высвобождается σ-фактор.
2. Собственно транскрипция (элонгация, или удлинение цепи мРНК).
3. Терминация транскрипции, сопровождающаяся диссоциацией транскрипционного комплекса и высвобождением core-энзима.
Процесс транскрипции у эукариот протекает сложнее. У них нет сигма-фактора. Работе РНК-полимеразы у эукариот помогают пять белковых комплексов.
Американский ученый Роджер Корнберг (Roger D. Kornberg) с помощью тонкого рентгеноструктурного анализа установил трехмерную организацию (конформацию) РНК-полимеразы II – сложнейшего комплекса, который состоит из многих белков, включающих в себя 30 000 атомов. Из кристаллографических снимков процесса транскрипции у эукариотной дрожжевой клетки он создал молекулярный портрет РНК-полимеразы в виде цветного рисунка, на котором копируемая нить ДНК, РНКполимераза и синтезируемая мРНК окрашены в разные цвета. Этот и серию поясняющих рисунков Р. Корнберг с соавторами опубликовал в журнале «Science» в 2001 г. (Vol. 292, 8 June 2001, pp. 1876–1882; published online 19 April 2001; 10.1126/science.1059495), а в 2006 г. он был удостоен за свои исследования Нобелевской премии (см. цв. вкл., рис. 119). Рисунки показывают, как РНК-полимераза распознает свой промотор (участок ДНК, с которого начинается транскрипция), вступает с ним в химическую связь, затем расплетает в этом участке нити ДНК и одновременно обеспечивает правильное присоединение рибонуклеотидов к комплементарным нуклеотидам копируемой нити ДНК. По мере того, как рабочий блок РНК-полимеразы сдвигает нить ДНК, открывая для копирования ее новые участки, растущая нить мРНК отходит в сторону от ДНК-матрицы, а ДНК восстанавливает двухцепочечную структуру. Конец синтеза мРНК наступает, когда РНК-полимераза достигает кодона копируемой цепи, определяющего завершение синтеза мРНК. В этом месте происходит отторжение РНК-полимеразы от ДНК. Вновь синтезированная мРНК также отделяется от ДНК и соединяется с особым белком, который и транспортирует ее из ядра клетки в цитоплазму для трансляции рибосомами в белок по той информации, которая заключена в данной мРНК. (У прокариот вновь синтезируемая мРНК подвергается трансляции уже с самого начала транскрипции.)
С помощью своих регуляторных систем бактериальная клетка «решает», какие белки ей необходимы в данных условиях, и запускает транскрипцию соответствующих оперонов. Поскольку многие из них состоят из нескольких структурных генов (цистронов), оперон прочитывается как одна транскрипционная единица. У бактерий существуют моноцистронные и полицистронные мРНК. В результате трансляции полицистронной мРНК синтезируется столько полипептидных цепей, сколько имеется цистронов в данном опероне. Область ДНК, с которой связывается РНК-полимераза, называется промотором. Он представляет собой начальную часть оперона длиной около 80 пар нуклеотидов. Промоторы содержат две характерные нуклеотидные последовательности, локализованные на расстоянии примерно 10 и 35 нуклеотидов перед первым транскрибируемым основанием. Они необходимы для распознавания РНК-полимеразой промотора и связывания с ним.
Расположение этих последовательностей в одной из цепей ДНК указывает РНКполимеразе, какую из нитей необходимо считывать. Матричная РНК представляет собой однонитевую полирибонуклеотидную цепь, комплементарную той нити ДНК, которая послужила матрицей для ее синтеза.
В составе бактериальной мРНК различают следующие участки (рис. 21):
1. 5'-нетранслируемая последовательность (5'-НТП). 5'-концевой нуклеотид содержит, как правило, одно из пуриновых оснований (А или Г), и, если после транскрипции мРНК не подвергалась никаким изменениям, этот нуклеотид несет трифосфатную группировку (5'фффГ…3').
На 5'-конце эукариотических мРНК располагается другая структура, образующаяся посттранскрипционно, – кэп (англ. cap – шапочка), которая необходима для узнавания мРНК эукариотическими рибосомами.
В составе 5'-НТП обнаружена особая последовательность из 3 – 5 нуклеотидов, комплементарная 3'-концу 16S рРНК. Эта последовательность облегчает инициацию трансляции мРНК рибосомами, так как она стабилизирует положение на рибосоме инициаторного кодона мРНК. Вместе с тем 5'-НТП придает этому участку мРНК определенную вторичную структуру, благодаря чему инициаторный кодон (АУГ) занимает положение, которое облегчает его узнавание и взаимодействие с рибосомой.
2. Инициаторный кодон, т. е. кодон, с которого начинается трансляция мРНК. Чаще всего у бактерий им является триплет АУГ, хотя в некоторых мРНК его функции выполняет кодон ГУГ. Однако триплеты АУГ и ГУГ узнаются рибосомами как инициаторные, только если они входят в состав особой вторичной структуры в мРНК. Во всех иных случаях (внутри структурных генов) они прочитываются как метионин (АУГ) и валин (ГУГ).

Рис. 21. Схематическое изображение гипотетической бактериальной мРНК Жирная линия – область, кодирующая полипептид. Объяснение в тексте
3. Область, кодирующая полипептидную цепь (в нее входит и инициаторный кодон). На ее 3'-конце располагаются один или сразу два терминирующих кодона. Узнавая эти кодоны, рибосома прекращает трансляцию, а в случае полицистронной мРНК рибосома приступает к трансляции следующего цистрона.
4. 3'-нетранслируемая последовательность (3'-НТП), длина ее невелика, а функция не известна.
Для обеспечения биосинтеза белка необходимы следующие условия:
1) наличие всех компонентов белоксинтезирующей системы, из которых формируется машина для синтеза белка;
2) наличие соответствующих физико-химических условий (рН, температура, ионы Mg2+, K+ и др.);
3) наличие энергии, уникальным поставщиком которой для синтеза белка является ГТФ;
4) наличие матрицы (мРНК);
5) наличие строительных блоков – аминокислот для синтеза белка в форме активированных и связанных с тРНК аминоацил-тРНК.
Аминокислоты в клетке, как правило, не существуют в свободном виде. Они взаимодействуют с тРНК и сохраняются в виде аминоацилированных тРНК (аа-тРНК). Биологический смысл такой «мобилизации» тРНК заключается в том, что аминокислоты при этом предохраняются от действия окислительных ферментов и не «сгорают» в клетке в качестве источника энергии, а используются для синтеза белка. Лишь при избытке какой-нибудь аминокислоты часть ее вовлекается в энергетический обмен.
Важная регулирующая роль в биосинтезе белка помимо мРНК принадлежит транспортной РНК (тРНК). Она выполняет следующие три функции.
1. С помощью специального фермента (аминоацил-тРНК-синтетазы) тРНК присоединяет на одном из своих концов соответствующую аминокислоту, в результате чего возникает лабильное соединение – аминоацил-тРНК (аа-тРНК) – акцепторная функция тРНК.
2. Транспортная РНК при участии специальных белковых факторов и ГТФ доставляет аминокислоту в форме аа-тРНК в рибосому для включения ее в синтезируемую полипептидную цепь – транспортная функция тРНК.
3. Транспортная РНК с помощью своего антикодона специфически взаимодействует с комплементарным ему кодоном мРНК и таким образом обеспечивает необходимую последовательность включения аминокислот в растущую полипептидную цепь в соответствии с программой, заданной в мРНК – адапторная функция тРНК.
С помощью своих антикодонов тРНК осуществляет дешифровку генетического кода в мРНК и перевод его в аминокислотный код белковой молекулы. Реализация этих функций осуществляется благодаря уникальной структуре молекулы тРНК.
В клетке содержится набор примерно из 60 различных типов тРНК, что соответствует количеству значащих кодонов.
Первичная структура (нуклеотидная последовательность) изучена почти у всех типов тРНК. Все они имеют константу седиментации около 48S, а длина их варьирует в зависимости от вида клеток и аминокислотной специфичности от 73 до 93 нуклеотидов.
Характерной особенностью всех типов тРНК является высокое содержание в них необычных оснований, например, инозина (И), дигидроуридина (дигидро-У), псевдоуридина (Ψ); всего в разных типах тРНК обнаружено более 50 вариантов модифицированных оснований. В зависимости от их специфичности к аминокислотам, которые они транспортируют к рибосомам, различают аланиновые тРНК (тРНКала), тирозиновые (тРНКтир), валиновые (тРНКвал) и т. д.
Изучение первичной структуры тРНК показало, что они представляют собой семейство сходных молекул (рис. 22). Все они без исключения имеют универсальный 3'-концевой тринуклеотид – ЦЦА-3'; фенилаланиновые и метиониновые тРНК у всех млекопитающих обладают идентичной структурой. Еще более консервативными являются инициаторные тРНК.
Все тРНК имеют сходную вторичную структуру, напоминающую лист клевера. При этом образуются характерные для молекул тРНК двунитевые (ветви) и однонитевые (петли) участки (см. рис. 22). У всех тРНК последовательности нуклеотидов, соответствующие антикодону, находятся в середине петли, расположенной напротив ЦЦА-ветви. Например, в тРНКала роль антикодона выполняет триплет ИГЦ, тРНКсер – ИГА, тРНКлей – ЦАГ и т. д. В процессе взаимодействия тРНК с мРНК первые два основных кодона по принципу комплементарности образуют водородные связи с двумя последними основаниями антикодона. Третий элемент антикодона может образовывать пары с тремя различными основаниями: У, Ц и А. Поэтому антикодон может распознавать несколько кодонов для одной и той же аминокислоты, например, антикодон тРНКала ИГЦ может распознавать все три триплета, которые кодируют аланин (ГЦУ, ГЦЦ и ГЦА). Обладая большим сходством структуры, различные тРНК вместе с тем характеризуются строгой индивидуальностью, которая определяется специфичностью набора минорных оснований, последовательностью нуклеотидов в варьирующих участках молекулы, содержанием оснований в антикодоне и другими особенностями.
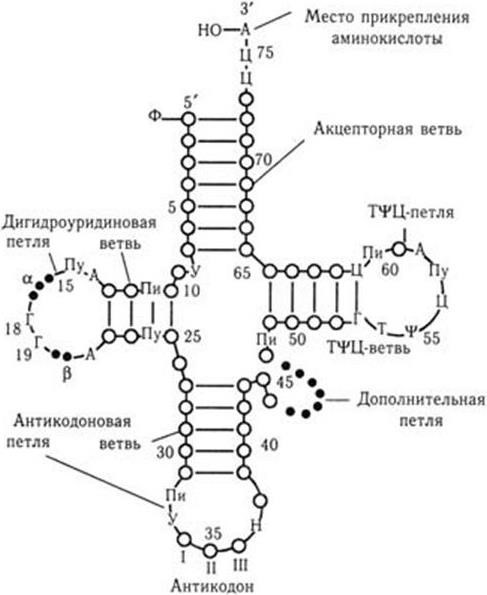
Рис. 22. Обобщенное изображение молекулы тРНК в виде клеверного листа, характерное для неинициаторных тРНК
Заглавными буквами обозначены нуклеотиды, постоянно или почти постоянно встречающиеся в данном месте цепи. Пу – пурин; Пи – пиримидин; Н – гипермодифицированный пурин.
Кружками обозначены основания, различающиеся у разных тРНК; линии между ними – водородные связи. I, II, III – нуклеотиды антикодона
Обладая сходной первичной структурой, все тРНК имеют и сходную пространственную структуру (рис. 23). Молекула тРНК содержит два сегмента двойных спиралей, закрученных по длине. Они ориентированы друг к другу почти под прямым углом, образуя структуру, напоминающую букву Г. Псевдоуридиновая ветвь (ТΨЦ) располагается в углу молекулы, близко к ней примыкает дигидроуридиновая ветвь (Н2У). На коротком конце молекулы располагается акцепторный участок – ЦЦА (место присоединения аминокислоты). Длинный конец молекулы заканчивается триплетом оснований, образующих антикодон.
Добавочная ветвь молекулы у разных тРНК содержит различное количество нуклеотидов (4 – 21).
Ветвь, содержащая акцепторный конец, свободна от контактов с остальной частью молекулы. Благодаря этому она может изменять свою ориентацию, что, возможно, существенно для выполнения функций тРНК, связанных с присоединением аминокислот или с их передачей на рибосомы.
Аминокислоты всегда присоединяются к акцепторному триплету ЦЦА. Присоединение происходит путем образования ковалентной связи между карбоксильной группой аминокислоты и гидроксильной группой третьего углеродного атома рибозы – 3'-OH. Связь между аминокислотой и тРНК получила название аминоацильной (рис. 24). Из факта образования аминоацильной связи вытекают два важных следствия. Во-первых, поскольку тРНК связывается с карбоксильной группой ( – COOH) аминокислоты, то прежде, чем карбоксил сможет образовать пептидную связь со следующей аминокислотой во время синтеза полипептидной цепи, тРНК должна отделиться от аминокислоты. Следовательно, эти два процесса – отделение тРНК от аминокислоты и образование пептидной связи (см. формулу на с. 69) – должны происходить согласованно (рис. 25).

Рис. 23. Структура дрожжевой фенилаланиновой тРНК
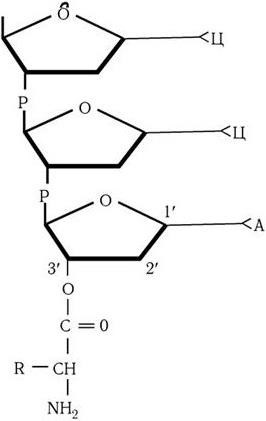
Рис. 24. Присоединение аминокислоты эфирной связью к 3'-гидроксилу аденозина тРНК
Во-вторых, аминоацильная связь относится к типу связей, богатых энергией. Следовательно, образование аминоацил-тРНК можно рассматривать как активирование аминокислоты. Источником энергии, необходимой для образования этой связи, является АТФ.
Процесс образования аминоацил-тРНК складывается из двух реакций. Вначале происходит взаимодействие свободной аминокислоты с АТФ. В результате этой реакции образуется аминоациладенилат (аминокислота, соединенная богатой энергией связью с АМФ). Затем сразу же происходит вторая реакция – присоединение активированного аминокислотного остатка к акцепторному триплету тРНК, в результате чего образуется аминоацил-тРНК, а АМФ высвобождается.
Обе эти реакции катализируются аминоацилтРНК-синтетазой. Этот фермент обладает строгой специфичностью. Для каждой аминокислоты существует своя специфическая аминоацил-тРНК-синтетаза, которая узнает только данную аминокислоту, активирует ее и затем перебрасывает на акцепторный конец тРНК. В клетке содержится 20 специфических аминоацил-тРНК-синтетаз. Ферменты обладают специфичностью не только в отношении аминокислоты, но и тРНК. Правда, у бактерий этот фермент не различает изоакцепторных тРНК, т. е. один фермент обслуживает все действующие для данной аминокислоты тРНК.
Благодаря высокой специфичности аминоацил-тРНК-синтетаз обеспечивается индивидуальный выбор соответствующей аминокислоты совершенно определенной тРНК.
Из факта специфичности аминоацил-тРНК-синтетаз по отношению к аминокислотам и тРНК следует, что фермент имеет два различных центра связывания: один – для взаимодействия с аминокислотой, а другой – со специфической тРНК. В свою очередь, каждая тРНК имеет также два специфических участка: один – для узнавания фермента, а другой – кодона мРНК. Таким образом, на уровне аминоацил-тРНКсинтетаз происходит переключение трехбуквенного генетического кода в двадцатибуквенный аминокислотный код белков и, наоборот, аминокислотного кода белков в триплетный генетический код.
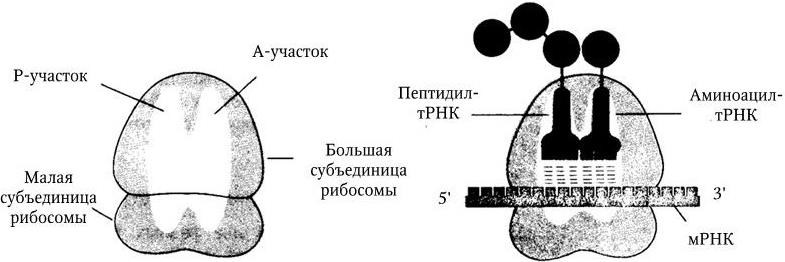
Рис. 25. Схематическое изображение трех главных участков связывания, в которых молекулы тРНК присоединяются к рибосоме
Слева – ненагруженная рибосома; справа – нагруженная (по Б. Альбертсу [и др.])
Трансляция – процесс расшифровки генетического кода в мРНК и овеществление его в виде полипептидной цепи, последовательность расположения аминокислот в которой определяется порядком расположения кодонов в данной мРНК. Трансляция, таким образом, – это процесс собственно биосинтеза белка на рибосомах. Он состоит из следующих основных этапов:
1. Инициации (начала) трансляции.
2. Элонгации, или удлинения полипептидной цепи (собственно трансляция).
3. Терминации (окончания) трансляции.
4. Модификации полипептидной цепи.
Каждый из этих этапов представляет собой сложный многоступенчатый процесс и находится под жестким контролем, осуществляемым прежде всего компонентами самой белоксинтезирующей системы.
Инициирующие кодоны и инициаторная транспортная РНК
Рост полипептидной цепи на рибосоме происходит таким образом, что каждая новая пептидная связь образуется между карбоксильной группой предшествующего и аминогруппой присоединяемого аминокислотных остатков, т. е. в направлении COOH→NH2. Поэтому у первой (начальной) аминокислоты полипептидной цепи свободной будет NH2-группа, ее обозначают как N-концевую аминокислоту, а у последней остается свободной COOH-группа (C-концевая аминокислота).
Биосинтез белка у прокариот и эукариот происходит таким образом, что N-концевое положение в полипептидной цепи всегда занимает метионин. Иначе говоря, синтез белка начинается с включения метионина – инициаторной аминокислоты. Для транспорта инициаторной аминокислоты, т. е. метионина, когда он занимает N-концевое положение, используется специальная строго специфическая инициаторная тРНК – тРНКф-мет. Она отличается от той тРНКмет, которая поставляет метионин в любое другое место полипептидной цепи, тем, что переносит его только в N-концевое положение. У бактерий после связывания метионина с инициаторной тРНК группа NH2 аминокислоты с помощью особого фермента формилируется, т. е. соединяется с формильным остатком ( – CHO), который ее блокирует. Причем фермент узнает не просто метионин, а особую структуру специфической инициаторной тРНК, с которой метионин уже связан. Таким образом, тРНКф-мет отличается от обычной тРНКмет, которая также акцептирует метионин, но без последующего его формилирования.
У эукариот инициаторной аминоацил-тРНК является особая метионил-тРНК с неблокированной NH2-группой.
Триплетами, кодирующими присоединение инициаторных аминокислот (формилметионил-тРНК и метионил-тРНК), являются АУГ и ГУГ, получившие название инициаторных кодонов. Однако они выполняют функцию инициирующего кодона лишь в том случае, когда являются начальными триплетами при считывании мРНК. Их роль как инициаторных кодонов определяется рибосомами благодаря особой вторичной структуре, которая образуется на мРНК в районе расположения этих триплетов. Если же эти кодоны располагаются внутри цепи мРНК, то каждый из них распознается как кодон для метионина (АУГ) или валина (ГУГ).
Под инициацией трансляции понимают процесс формирования функционально активного комплекса рибосома 70S – мРНК, постановки формилметионил-тРНК на Р-участок рибосомы и освобождения А-участка для очередной аминоацил-тРНК. В результате вся белоксинтезирующая система переводится в состояние, позволяющее соединять аминокислоты в полипептидную цепь в той последовательности, которая задается мРНК.
В образовании инициаторного комплекса принимают участие: мРНК с инициирующим кодоном АУГ (ГУГ); обе субъединицы (30S и 50S); белковые факторы инициации (IF-1, IF-2, IF-3), фактор ассоциации (AF); формилметионил-тРНК и ГТФ. Процесс инициации складывается из нескольких стадий, катализируемых белковыми факторами инициации. Каждая 70S рибосома собирается на мРНК из двух субъединиц 30S и 50S. Вначале присоединяется 30S субъединица, предварительно нагруженная инициаторной тРНК, узнающей инициаторный кодон АУГ и несущей метионин. Этот процесс катализируется IF-2. 30S субъединица присоединяется к инициаторному кодону путем спаривания антикодона соединенной с ней инициаторной тРНК с инициаторным кодоном АУГ мРНК. В молекуле мРНК обычно имеется много кодонов АУГ, и каждый из них кодирует метионин. Выбор инициаторного кодона АУГ облегчается особой структурой бактериальной мРНК (см. рис. 21). Инициаторным кодоном всегда служит АУГ, ближайший к 5'-НТП. После завершения этого процесса все факторы инициации, остававшиеся до этого момента связанными с 30S субъединицей, отделяются от нее, к ней присоединяется 50S субъединица, и формируется функционально активная рибосома 70S. Молекула инициаторной тРНК с метионином оказывается связанной с Р-участком рибосомы. Поэтому синтез полипептидной цепи может начинаться сразу же после присоединения к свободному А-участку рибосомы второй молекулы аа-тРНК, выбор которой определяется кодоном, расположенным в молекуле мРНК сразу же после инициаторного АУГ-кодона. Далее начинается стадия элонгации.
Элонгация представляет собой процесс удлинения растущей на рибосоме полипептидной цепи за счет включения в нее аминокислотных остатков в последовательности, соответствующей порядку расположения кодонов в мРНК.
После присоединения к формилметионину очередной аминоацил-тРНК растущая полипептидная цепь превращается в пептидил-тРНК.
Для осуществления элонгации, помимо уже сформировавшегося активного комплекса 70S-рибосома – мРНК – формилметионил-тРНК (пептидил-тРНК), необходимо участие белковых факторов элонгации (у прокариот – EF-Тu, EF-Ts, EF-G) иГТФ.
Элонгация протекает как многократно повторяющийся (по числу кодонов в мРНК) циклический процесс, складывающийся из трех отдельных этапов (рис. 26).
Первый этап – связывание молекулы аа-тРНК со свободным А-участком рибосомы. При этом Р-участок занят тРНК, несущей пептидил. Связывание происходит путем спаривания нуклеотидов антикодона аа-тРНК с кодоном мРНК, расположенным в А-участке.
Второй этап – образование очередной пептидной связи. Карбоксильный конец растущего пептидила отделяется в Р-участке от молекулы донорной тРНК (т. е. тРНК, несущей пептидил) и образует пептидную связь с аминокислотой, присоединенной к молекуле акцепторной тРНК (т. е. служащей акцептором для растущего пептидила) в А-участке (см. формулу на с. 69).
Третий этап – транслокация. Образовавшаяся новая пептидил-тРНК переносится из А-участка в Р-участок рибосомы, а сама рибосома продвигается вдоль мРНК ровно на один кодон (три нуклеотида). Это событие требует затраты энергии. Движущей силой транслокации служит ряд конформационных изменений, вызываемых в одном из белков рибосомы в результате гидролиза связанной с ним ГТФ. В момент транслокации происходит отделение освободившейся во время второго этапа от пептидила в Р-участке тРНК и возвращение ее в цитоплазму. По завершении третьего этапа рибосома возвращается в состояние, аналогичное исходному. Ее А-участок свободен и может принять новую молекулу аа-тРНК, отбираемую очередным кодоном мРНК, т. е. рибосома может снова повторить цикл элонгации.
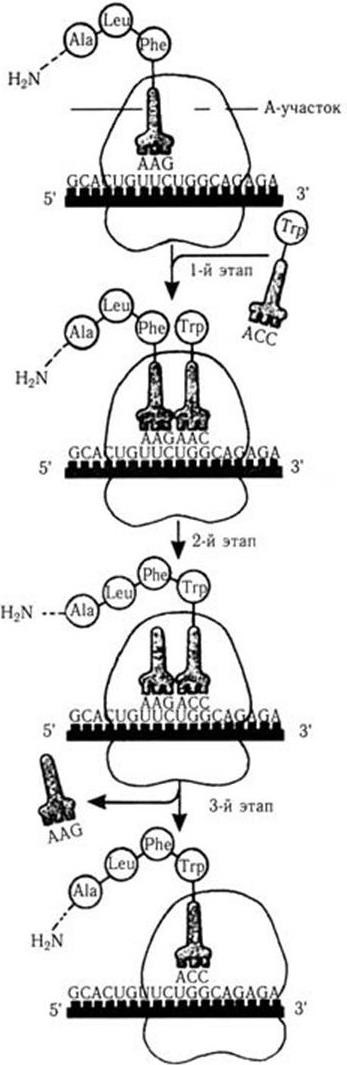
Рис. 26. Схематическое изображение основных фаз элонгации, протекающей на рибосомах
Объяснение в тексте (по Б. Альбертсу [и др.])
Таким образом, каждый цикл работы рибосомы означает присоединение одной аминокислоты (трансляцию одного кодона). В ходе элонгации рибосома совершает последовательно столько циклов, сколько кодонов она транслирует, т. е. сколько аминокислот она включает в полипептидную цепь.
Терминация трансляции – процесс завершения синтеза полипептидной цепи и освобождение ее из связи с последней донорной тРНК и с рибосомой. Функцию сигнала, означающего конец трансляции цистрона мРНК, выполняет один из 3 кодонов – УАА, УАГ и УГА. Эти триплеты не кодируют ни одной из 20 аминокислот («стоп-кодоны»). После завершения трансляции происходит отделение от рибосомы не только полипептидной цепи и тРНК, но и мРНК, и диссоциация 70S рибосомы на 50S и 30S субъединицы.
Помимо стоп-кодонов, в этих реакциях принимают участие различные белковые факторы освобождения, а также обе субъединицы рибосомы.
Вновь синтезированная полипептидная цепь отделяется от рибосомы, когда рибосома достигает одного из трех стоп-кодонов. Со стоп-кодоном, поступившим на А-участок, в этом случае связывается не антикодон аа-тРНК, а особый белок – фактор освобождения. В результате его присоединения происходит изменение активности расположенного по соседству фермента пептидилтрансферазы. Измененный фермент присоединяет к пептидил-тРНК не свободную аминогруппу аминокислоты, а молекулу H2O. Это приводит к гидролизу сложноэфирной связи между С-концевым карбоксилом пептидила и 3'-рибозы ЦЦА последней донорной тРНК. В результате гидролиза полипептид, удерживаемый на рибосоме только посредством его связи с молекулой тРНК, отделяется от рибосомы. Это влечет за собой отделение от рибосомы последней донорной тРНК, освобождение мРНК и диссоциацию 70S рибосомы на ее 30S и 50S субъединицы.
Модификация полипептидной цепи
Заключительным этапом биосинтеза белка является модификация полипептидной цепи, вслед за которой белковая молекула приобретает свою окончательную структуру и конформацию, определяющую ее функциональные свойства.
Реакция модификации чаще всего сводится либо к отделению только формильной группы метионина (у бактерий), и тогда N-концевой аминокислотой становится метионин; либо к отделению метионина (у животных) или формила и метионина (у бактерий), и тогда N-концевой становится аминокислота, располагающаяся вслед за метионином (формилметионином). В реакции модификации участвуют специальные ферментные системы – пептиддеформилаза (отделяет формильную группу от формилметионина), аминопептидаза (отщепляет метионин) или другие ферменты.
Реакции модификации осуществляются уже после освобождения полипептидной цепи из рибосомы.
В связи с тем что у бактерий хромосомы и плазмидные ДНК располагаются в цитоплазме и не отграничены от нее никакими мембранами, процессы транскрипции, трансляции и деградации мРНК протекают одновременно, т. е. трансляция мРНК может начинаться раньше, чем завершится транскрипция, а деградация мРНК начинается раньше, чем закончится ее полная трансляция.
Определение скорости биосинтеза белка у бактерий, проведенное с помощью различных методов, показало, что она соответствует включению рибосомой в полипептидную цепь в 1 с при температуре 37 °C 15 – 30 аминокислот.
Это означает, что рибосома продвигается вдоль мРНК со скоростью 45 – 90 нуклеотидов в 1 с. Следовательно, время для выбора каждой очередной аа-тРНК из среды и включения ее в полипептидную цепь, т. е. время полного рабочего цикла рибосомы, составляет около 0,03 – 0,06 с. За этот короткий срок на рибосоме осуществляется серия сложных и взаимообусловленных событий, обеспечивающих высокую точность процесса трансляции. Все это говорит о существовании специфических и надежных систем регуляции биосинтеза белка на уровне не только транскрипции, но и трансляции.
Синтез всех компонентов белоксинтезирующей системы, в том числе рибосом, контролируется соответствующими генами. Существенно, что у бактерий имеется по нескольку копий оперонов рибосомальных РНК, например, у E. coli их шесть. Это позволяет бактериям значительно изменять скорость биосинтеза рРНК, а следовательно и рибосом, в зависимости от условий среды. Поэтому содержание рибосом у них не является постоянным, а может варьировать, например, у E. coli от 10 тыс. до 100 тыс. и более на клетку. Чем богаче среда, тем больше в клетке синтезируется рибосом. Для бактерий характерна следующая фундаментальная закономерность: общая интенсивность биосинтетических процессов (а следовательно, и скорость роста) определяется суммарной скоростью биосинтеза белка, а она, в свою очередь, непосредственно зависит от содержания в клетке рибосом. Поэтому регуляция содержания рибосом является одним из важнейших механизмов, с помощью которых осуществляются адаптация бактерий к изменяющимся условиям среды и эволюционное сохранение видов бактерий в природе.
Таким образом, основными особенностями метаболизма бактерий являются: высокая интенсивность обмена веществ, разнообразие типов метаболизма, способность к саморегуляции активности биосинтетических процессов в зависимости от условий существования. Кроме того, гены бактерий, в отличие от генов вирусов и эукариот, не содержат интронов, поэтому у бактерий отсутствует процесс сплайсинга при синтезе мРНК.
Сплайсинг мРНК (англ. splice – сращивать) – сложный процесс, при котором происходит вырезание интронов (некодирующих последовательностей у генов, имеющих интрон-экзонную структуру) из первичных РНК-транскриптов и сшивание экзонов, в результате которого образуется и затем транслируется зрелая мРНК.
Размер интронов у эукариот варьирует приблизительно от 100 до 10 000 нуклеотидов. Основное отличие интронов от экзонов (кодирующих последовательностей) состоит в том, что большую часть нуклеотидов интрона можно искусственно изменить, не нарушая функции гена.
На каждом из концов интрона находятся короткие нуклеотидные последовательности (почти одинаковые у всех интронов), которые служат сигналами для сплайсинга РНК. Предполагается, что вырезание интронов и сращивание экзонов происходит с участием специфических последовательностей РНК, называемых донорными (5'-конец) и акцепторными (3'-конец) контактами (сайтами) сплайсинга. Процесс выщепления интрона должен происходить с большой точностью, так как ошибка, которая приведет к появлению хотя бы одного неправильного нуклеотида, вызовет изменение рамки считывания и, следовательно, структуры белка или прекращение трансляции из-за образования стоп-сигнала.
Сплайсинг в ядре протекает с участием особых малых ядерных рибонуклеопротеиновых частиц (мяРНП), или частиц U1. Эта частица содержит небольшую молекулу РНК длиной 165 нуклеотидов, в составе которой имеются последовательности, комплементарные нуклеотидным последовательностям пограничных экзон-интронных и интрон-экзонных сайтов молекулы первичного РНК-транскрипта. Благодаря комплементарному спариванию оснований РНК U1 и РНК-транскрипта происходят сближение донорного и акцепторного сайтов, затем их разрывы и воссоединение цепи в области донорного и акцепторного контактов, формирование единой молекулы зрелой РНК и выщепление интронных последовательностей.
Наличие аппарата сплайсинга наделяет эукариотные клетки дополнительной генетической гибкостью, связанной с тем, что сплайсинг одного и того же первичного транскрипта (особенно при наличии в гене нескольких интронов), осуществляемый разными способами, может привести к образованию нескольких молекул мРНК, кодирующих разные белки. Такая неоднозначность сплайсинга присуща и вирусам, например аденовирусам, ретровирусам, вирусу гепатита В и др. Геном аденовируса направляет синтез нескольких очень длинных РНК-транскриптов, каждый из которых содержит нуклеотидные последовательности, кодирующие целый ряд различных белков. У вируса иммунодефицита человека 9 генов кодируют 15 вирусспецифических белков. Таким образом, благодаря механизму сплайсинга обеспечивается повышение информационной емкости генома без увеличения его размера. Это особенно важно для вирусов, у которых размер генома жестко ограничен величиной вириона.
Глава 7 Особенности энергетического обмена (катаболизма)
Сущность энергетического обмена заключается в обеспечении организма энергией, необходимой для проявления жизни. Как уже было отмечено выше, основным источником энергии служит солнечный свет, его энергию улавливают с помощью фотосинтеза растения и фотосинтезирующие бактерии, преобразуя ее в энергию химических структур – глюкозы и других органических соединений. В последующем энергия этих соединений мобилизуется с помощью реакций окисления-восстановления и консервируется в форме АТФ. Молекулы АТФ синтезируются в результате переноса электрона от его первичного донора до конечного акцептора. В зависимости от того, что является конечным акцептором электронов, различают аэробное и анаэробное дыхание. При аэробном дыхании конечным акцептором электронов служит молекулярный кислород (О2), а при анаэробном – различные неорганические соединения: NO3–, SО42–, SO32–. Таким образом, энергия мобилизуется в реакциях окисления и восстановления. Окисление – отдача электронов, восстановление – присоединение электронов. Когда отнятие пары электронов или атомов водорода от органического субстрата сопряжено с восстановлением кислорода до воды, это сопровождается значительным изменением свободной энергии (ΔG0). Оно примерно равно изменению энергии при сжигании одной молекулы водорода (ΔG0 = – 57,04 ккал). Перенос электронов по цепи позволяет этой энергии выделяться порциями и превращать часть ее в богатые энергией связи АТФ. Чтобы такая цепь переноса действовала, в ней должен существовать градиент способности к окислению. Способность вещества отдавать электрон или присоединять его (т. е. окисляться или восстанавливаться) количественно выражается в виде его окислительно-восстановительного потенциала.
Переносчики электронов в цепи их переноса участвуют в последовательных реакциях с постепенно увеличивающимися значениями ΔE'0 (ΔE'0 – разность между потенциалами двух полуреакций) и увеличением окислительно-восстановительного потенциала.
Принципиальная схема цепи переноса электронов от первичного донора электронов (атома водорода) до конечного его акцептора О2 выглядит так:
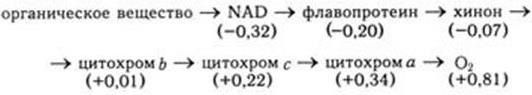
Окислительно-восстановительный потенциал указан в вольтах при стандартных условиях (25 °C, рН = 7,0, все реагенты в концентрации 1,0 М). Однако у бактерий встречаются самые разнообразные варианты этой общей схемы. В связи с этим они по типу дыхания подразделяются на следующие четыре группы:
1) строгие аэробы (размножаются только в присутствии кислорода);
2) микроаэрофилы (нуждаются в уменьшенной концентрации свободного кислорода);
3) факультативные анаэробы (могут потреблять глюкозу и размножаться как в аэробных, так и в анаэробных условиях);
4) строгие анаэробы (размножаются только в бескислородных условиях, т. е. не используют О2 в качестве конечного акцептора электронов).
Максимальная мобилизация энергии из глюкозы происходит при ее окислении через цикл лимонной кислоты (цикл Кребса). Один моль глюкозы С6Н12О6 содержит около 690 ккал (такое количество энергии выделяется при сжигании 180 г глюкозы). На первом этапе потребления глюкозы в отсутствие кислорода (при гликолизе) из одной ее молекулы образуются две молекулы молочной кислоты и синтезируются всего две молекулы АТФ. Каждая молекула АТФ имеет одну богатую энергией (10 ккал) пирофосфатную химическую связь. После расщепления глюкозы до молочной кислоты последняя в присутствии кислорода окисляется и превращается в пировиноградную кислоту, которая далее полностью окисляется через цикл Кребса до СО2 и Н2О. Каждая молекула лактата (пирувата) отдает 6 пар электронов. При переносе каждой пары электронов по цепи переноса часть их энергии используется для образования 3 молекул АТФ (рис. 27).
Таким образом, полное окисление одного моля глюкозы сопровождается синтезом 38 молекул АТФ с общим запасом энергии в 380 ккал, или около 55 % всей энергии моля глюкозы (690 ккал); остальная энергия подвергается диссипации, т. е. бесполезному рассеиванию в виде тепла. Однако и такой выход полезной энергии является достаточно высоким. Выход для многих бактерий известен, как и урожай клеток, который составляет около 10 г сухого вещества на 1 моль образовавшегося АТФ. Для объяснения механизма мобилизации энергии, т. е. синтеза АТФ при переносе электронов, предложен ряд гипотез, в том числе химио-осмотическая гипотеза Митчелла. Она исходит из того, что цепь переноса электронов, локализованная в мембране (у бактерий в ЦМ), ориентирована поперек нее, а электроны переносятся последовательно от одного носителя к другому в направлении возрастающего окислительно-восстановительного потенциала. Окисление переносчиков электронов сопровождается одновременным переносом протонов (Н+) с внутренней поверхности мембраны на ее внешнюю поверхность (рис. 28). Поскольку мембрана во всех других случаях непроницаема для протонов, возникает градиент концентрации протонов (рН+) между внутренним и внешним слоями мембраны, и она становится «энергизованной». Энергия градиента протонов используется клеткой для различных процессов, в том числе для активного транспорта питательных веществ, вращения жгутиков и синтеза АТФ. Протоны могут проникать обратно через мембрану лишь в определенных участках ее через особые каналы, с которыми связаны специфические ферменты АТФазы, катализирующие реакцию синтеза АТФ из АДФ и неорганического фосфора (Фн):
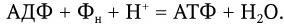
Перемещение протонов по их электрохимическому градиенту с помощью мембранной АТФ-азы служит источником энергии для образования АТФ. Реакция поддерживается градиентом протонов. Однако АТФаза может вызывать и гидролиз АТФ. Это также приведет к перемещению протонов из клетки и созданию их градиента, энергия которого может быть использована для процессов, требующих ее затраты. Некоторые энергообразующие реакции являются общими для аэробных и анаэробных механизмов дыхания. К ним относятся три пути превращения сахаров в основной энергетический метаболит – пировиноградную кислоту: путь Эмбдена – Мейергофа (гликолиз), пентозофосфатный путь (или гексозофосфатный шунт) и путь Энтнера – Дудорова, обнаруженный лишь у некоторых прокариот.
В первом случае (путь Эмбдена – Мейергофа, гликолиз, рис. 29) вначале затрачиваются две молекулы АТФ на образование фруктозо-1,6-дифосфата, который затем расщепляется на фосфоглицериновый альдегид и диоксиацетонофосфат. В результате окисления последних, сопряженного с восстановлением НАД, из каждой образуется по молекуле 1,3-дифосфоглицериновой кислоты. На последующих этапах превращения ее в пировиноградную кислоту происходит так называемое субстратное фосфорилирование, т. е. обе фосфатные группы переносятся на АТФ и, таким образом, на каждую молекулу глюкозы образуются 4 молекулы АТФ. Поскольку две из них затрачиваются на начальных этапах превращения глюкозы, общий выход энергии составляет 2 молекулы АТФ на моль глюкозы.
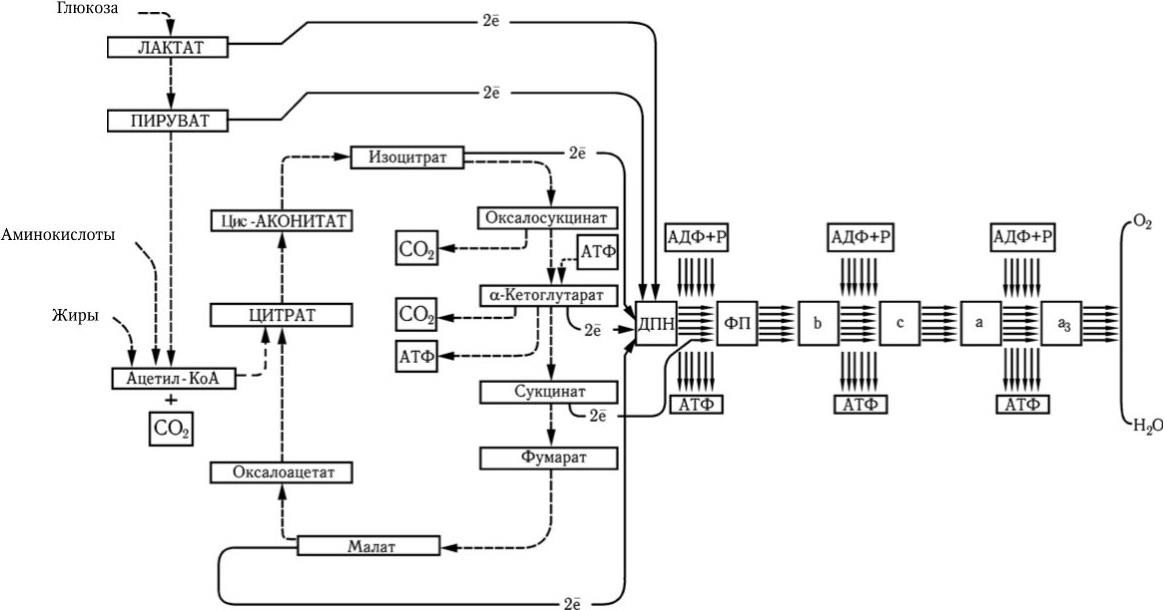
Рис. 27. Цикл Кребса, или цикл трикарбоновых кислот (ЦТК) (по А. Ленингеру)
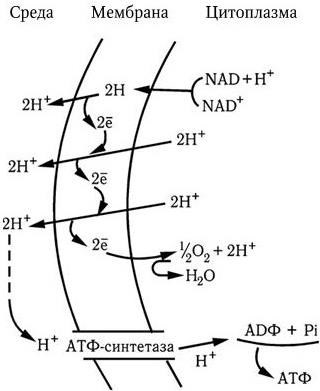
Рис. 28. Энергизация мембраны. Объяснение в тексте
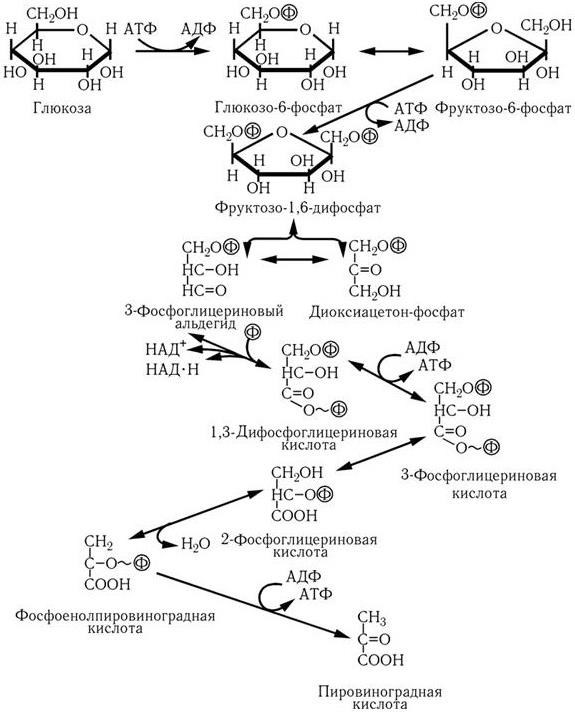
Рис. 29. Путь Эмбдена–Мейергофа: превращение глюкозы в пировиноградную кислоту
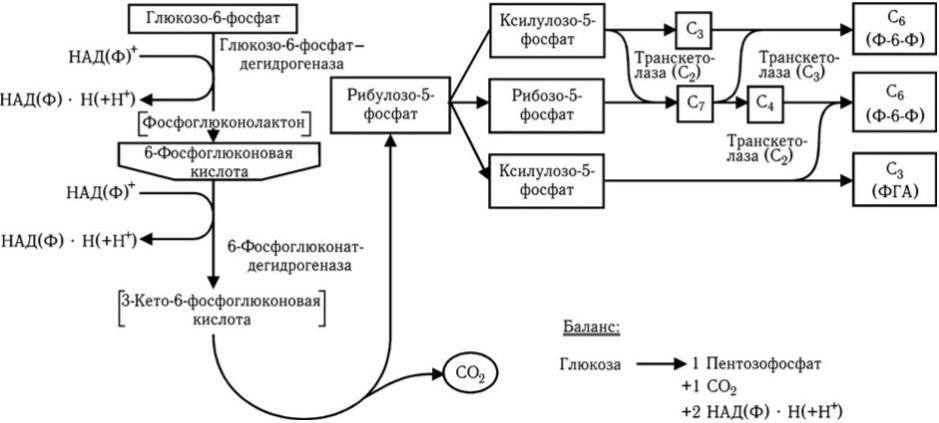
Рис. 30. Пентозофосфатный путь окисления глюкозы
Пентозофосфатный путь (рис. 30) обеспечивает окисление одного из углеродных атомов глюкозы и не приводит непосредственно к образованию пировиноградной кислоты. Он представляет сложный цикл, при прохождении через который шести молекул происходит полное окисление одной молекулы глюкозо-6-фосфата до СО2 и восстановление шести молекул НАДФ+ в НАДФ • Н. Значение этого пути потребления глюкозы заключается в том, что он обеспечивает образование рибозо5-фосфата, необходимого для синтеза нуклеиновых кислот, и большей части НАДФ • Н, нужного для многих биосинтетических реакций.
В случае превращения глюкозы по пути Энтнера – Дудорова (рис. 31) образуется промежуточный продукт, характерный только для этого пути, – 2-кето-3-дезокси-6-фосфоглюконовая кислота, которая далее расщепляется на молекулу пировиноградной кислоты и молекулу 3-фосфоглицеринового альдегида. Последний подвергается дальнейшему превращению по пути Эмбдена – Мейергофа в пировиноградную кислоту. В результате из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты, одна молекула АТФ и две молекулы НАДФ • Н.
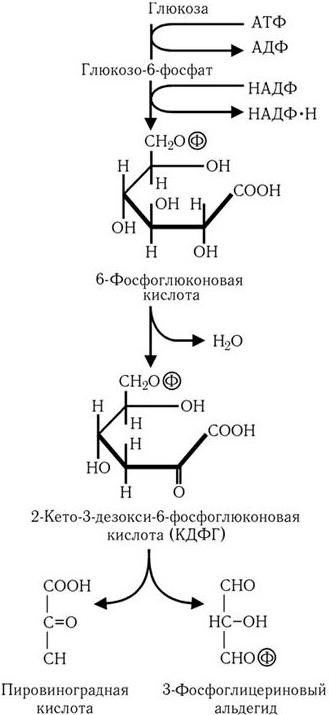
Рис. 31. Путь Энтнера–Дудорова: превращение глюкозы в пировиноградную кислоту и 3-фосфоглицериновый альдегид
Путь Эмбдена – Мейергофа наиболее широко используется различными бактериями при потреблении глюкозы. От образующегося при этом конечного продукта – пировиноградной кислоты, а также от таких промежуточных продуктов, как эритрозо-4-фосфат и рибозо-5-фосфат, идут различные метаболические пути синтеза двадцати аминокислот (рис. 32). Общая схема обмена веществ у микроорганизмов, обладающих аэробным дыханием и потребляющих гексозы, показана на рис. 33. Поскольку в аэробных условиях высвобождается гораздо больше энергии, чем при брожении, некоторые бактерии осуществляют такой тип дыхания, при котором акцептором водорода (электронов) является связанный кислород. Его носители – нитраты (нитратное дыхание) или сульфаты (сульфатное дыхание). При этом за счет водорода окисляемого субстрата нитраты восстанавливаются до молекулярного азота, а сульфаты – до H2S (рис. 34). Способность таких бактерий переносить электроны на нитраты и сульфаты связана с наличием у них цитохромов и системы переноса электронов. Это позволяет им осуществлять достаточно полное окисление субстрата и получать таким путем гораздо больше энергии, чем при брожении.
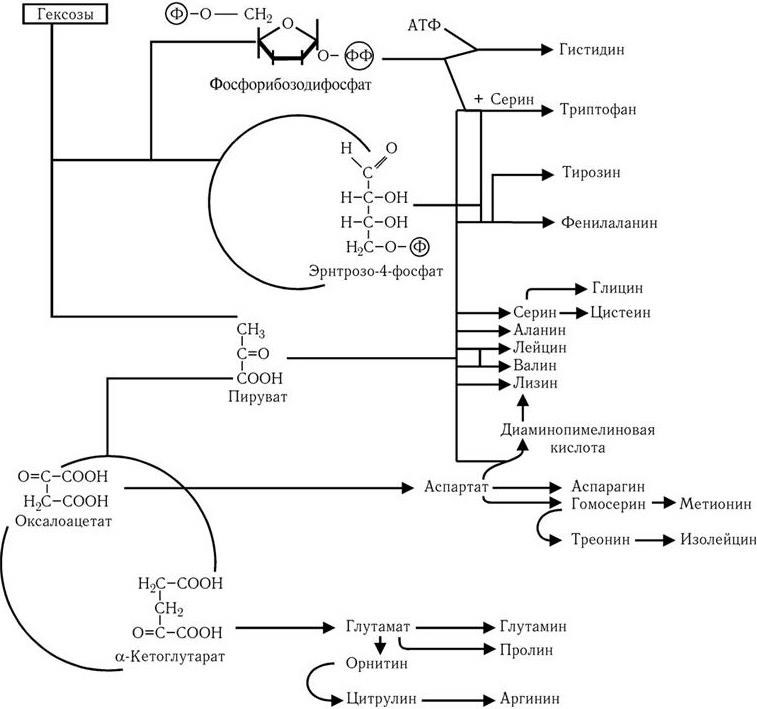
Рис. 32. Пути образования двадцати аминокислот, необходимых для синтеза белков, из промежуточных продуктов обмена (по Г. Шлегелю)
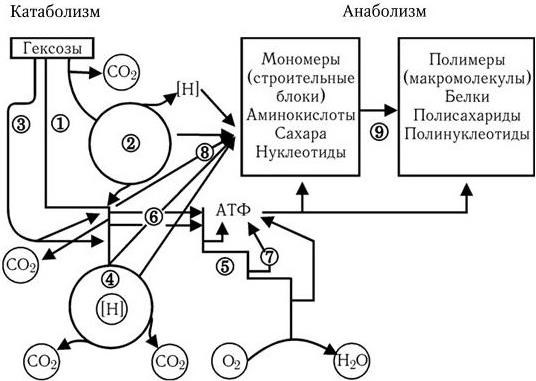
Рис. 33. Схема обмена веществ у микроорганизмов, потребляющих О2 и гексозы (по Г. Шлегелю):
1 – ФДФ-путь; 2 – ПФ-путь; 3 – КДФГ-путь; 4 – ЦТК; 5 – дыхательная цепь; 6 – фосфорилирование на уровне субстрата; 7 – окислительное фосфорилирование в дыхательной цепи; 8 – синтез мономеров; 9 – синтез полимеров
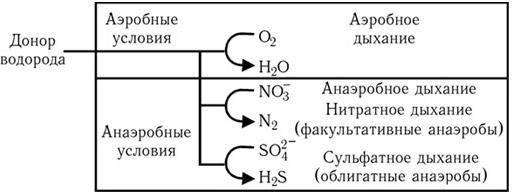
Рис. 34. Аэробные и анаэробные процессы дыхания (по Г. Шлегелю)
Главная особенность строгих анаэробов заключается в том, что их энергетический обмен происходит без участия свободного кислорода. Синтез АТФ при потреблении глюкозы в анаэробных условиях (гликолиз) происходит за счет фосфорилирования субстрата. Из одной молекулы глюкозы в этих условиях образуются две молекулы молочной кислоты, а выход энергии составляет всего 20 ккал (синтезируются две молекулы АТФ) на моль глюкозы, т. е. во много раз меньше, чем при полном окислении этого основного носителя энергии. Хотя анаэробы также мобилизуют энергию в результате окислительно-восстановительных процессов, т. е. в результате переноса водорода (электронов), но кислород для них не служит конечным акцептором электронов. Более того, молекулярный кислород оказывает на них токсическое действие, причины которого следующие:
1) у анаэробных бактерий кислород угнетает анаэробные энергообразующие реакции (эффект Пастера);
2) у строгих анаэробов отсутствует фермент каталаза, поэтому накапливающаяся в присутствии кислорода Н2О2 оказывает на них бактерицидное действие;
3) у строгих анаэробов отсутствует система регуляции окислительно-восстановительного потенциала (редокс-потенциала) – rH2. Окислительно-восстановительный потенциал представляет собой показатель окислительно-восстановительного равновесия всех компонентов системы, находящейся в равновесии с электродами; rH2 – отрицательный логарифм гипотетического давления водорода, когда данная окислительно-восстановительная система находится в состоянии равновесия:
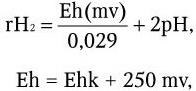
где Ehk – найденный потенциал среды; 250 mv – разница потенциалов между каломельным и нормальным водородным электродом (считается, что каломельный электрод при температуре 20 °C на 250 mv положительнее водородного).
Показатель rH2 может варьировать от минимума – 0 (среда насыщена водородом) до максимума 41 (среда насыщена кислородом); при rH2 = 28 оба процесса находятся в динамическом равновесии.
Направление и напряженность окислительно-восстановительных реакций, протекающих в бактериальной клетке, зависят от состава среды. Eh нормальной питательной среды, находящейся в контакте с воздухом, равен 0,2 – 0,4 В при рН = 7,0. Eh культуры бактерий определяется в результате конкуренции скоростей двух процессов – скорости образования восстановленных веществ и скорости образования компонентов, окисленных кислородом. Присутствие в среде окисляющих веществ повышает rH2, а наличие веществ, обладающих восстановительными свойствами (аскорбиновая кислота, цистеин и др.), снижает его. Существуют определенные границы rH2 и рН среды, внутри которых клетки способны осуществлять метаболические реакции с определенной скоростью.
Строгие аэробы, факультативные анаэробы и микроаэрофилы обладают системами, которые позволяют им при высоком содержании О2 снижать уровень rH2 до показателей, при которых они могут эффективно размножаться. Установлено, что у таких бактерий размножение совпадает с быстрым падением окислительно-восстановительного потенциала. Существуют предельные значения rH2 для роста бактерий и, в частности, анаэробов. Обычно рост их угнетается, если начальная Eh среды выше –0,2 В. Строгие анаэробы, у которых отсутствуют системы регуляции rH2, в присутствии О2 расти не могут. Зависимость их роста от уровня rH2 подтверждается тем, что если с помощью восстанавливающих веществ снизить уровень rH2, строгие анаэробы начинают расти и в присутствии кислорода. Строгий анаэроб Clostridium perfringens хорошо растет на аэрируемой среде, если Eh ее снижен аскорбиновой кислотой до –0,125 В.
По-видимому, у разных видов строгих анаэробов чувствительность к молекулярному кислороду опосредуется разными факторами. В связи с высокой чувствительностью строгих анаэробов к молекулярному кислороду для их культивирования с помощью различных способов создаются бескислородные условия. С этой целью используются механические, физические, химические и биологические способы удаления кислорода: посевы в глубокие столбики агара; кипячение (регенерация) жидкой питательной среды (Китта – Тароцци), содержащей глюкозу и кусочки печени (для связывания растворенного кислорода), и заливка ее стерильным вазелиновым маслом; добавление в атмосферу роста химических веществ, поглощающих кислород (например, щелочного пирогаллола); совместное культивирование строгих аэробов и анаэробов на кровяном агаре с глюкозой в запарафинированной чашке Петри (вначале растут строгие аэробы, а после снижения содержания кислорода – анаэробы) – способ Фортнера – и т. п. Наилучшим методом является применение специальных анаэростатов, из которых воздух откачивается и (или) замещается каким-либо инертным газом или смесью азота и углекислого газа.
Механизмы саморегуляции
Для своего роста (увеличения биомассы) и размножения бактериальная клетка должна получать из окружающей среды, как минимум, источники углерода, энергии и различные химические элементы. Источником углерода и энергии могут быть одна и та же молекула (чаще всего глюкоза) или же различные молекулы, например СО2 как источник углерода, а NH3 – источник энергии. Клетки, у которых отсутствуют какие-либо биосинтетические процессы, должны получать их конечные продукты, т. е. «факторы роста», из внешней среды. Если же клетка может получать некоторые конечные продукты извне, она будет их использовать преимущественно, «выключив» их эндогенный синтез. Для осуществления реакций окисления среда должна обеспечить клетку конечным акцептором водорода (электронов): для аэробов им является О2, а для анаэробов им могут быть или органические вещества, или органические субпродукты расщепления углеводов, или неорганические соединения (NO3–, SО42– и т. п.). Например, многие бактерии растут за счет расщепления глюкозы как источника углерода, энергии и акцептора водорода. Благодаря обмену источников углерода бактерии синтезируют промежуточные продукты, необходимые для образования основных биополимеров. Окисление источников энергии приводит к накоплению АТФ, что позволяет бактериям обеспечивать себя энергией, необходимой для биосинтеза субъединиц биополимеров и их активации. Активированные субъединицы полимеризуются и образуют макромолекулы, которые саморегулируются, формируя субклеточные и клеточные структуры. В результате биомасса клетки удваивается за определенный срок (клеточный цикл), и она размножается путем бинарного деления. В одно и то же время в бактериальной клетке совершается огромное количество биохимических процессов, завершающихся, в конечном счете, увеличением ее биомассы. Это предполагает наличие у нее совершенных механизмов саморегуляции, чутко реагирующих на все изменения условий ее жизни. В настоящее время представляется возможным условно разделить эти механизмы на две основные группы: а) группа неспецифических механизмов регуляции роста и размножения; б) группа специфических механизмов саморегуляции.
К неспецифическим механизмам относится совокупность действия различных физико-химических факторов, регулирующих общую скорость всех основных процессов жизнедеятельности. К ним относятся: температура, рН, rH2, концентрация ионов, степень обеспечения среды кислородом, давление и др. Неспецифический характер этой формы регуляции заключается в том, что она влияет прежде всего на общую кинетику биосинтетических процессов. Обеспечивая оптимальное соотношение всех указанных факторов, можно получить максимальную скорость размножения бактерий и максимальный выход биомассы в соответствующих производствах. Однако действие физико-химических факторов опосредуется через специфические механизмы клеточной саморегуляции. Она носит многоступенчатый характер и отличается выраженной универсальностью, вытекающей из того, что специфическая саморегуляция связана прежде всего с ферментами, катализирующими биохимические реакции, а все ферменты имеют одинаковую химическую природу. Взаимодействие на уровне фермент – субстрат является важнейшим пусковым моментом всей клеточной системы саморегуляции. Именно на этом уровне происходит интеграция неспецифических и специфических механизмов саморегуляции клетки. Специфичность взаимодействия фермента с субстратом детерминирована генетически – она обусловлена последовательностью расположения аминокислот в белковой молекуле и определяемой ею вторичной, третичной и четвертичной структурой молекулы фермента. В связи с этим никаких дополнительных механизмов регуляции на уровне фермент – субстрат не требуется. Синтезированный фермент готов в любой момент, если не изменена его аллостерическая структура, вступить в реакцию с соответствующим субстратом. Как известно, скорость ферментативной реакции можно выразить уравнением:
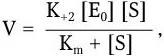
где E0 – начальная концентрация фермента; S – концентрация субстрата.
При увеличении концентрации [S], когда [S] > Km, скорость ферментативной реакции (V) будет стремиться к некоторой постоянной величине Vмакс– максимальной скорости реакции:
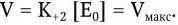
Поэтому зависимость между скоростью ферментативной реакции и концентрацией субстрата можно выразить следующим уравнением Михаэлиса – Ментен:
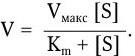
Из уравнения следует, что при малых величинах концентрации субстрата скорость реакции будет находиться в линейной зависимости от [S], а при очень высокой концентрации субстрата скорость реакции (V) будет стремиться к максимальной (Vмакс) и мало зависит от дальнейшего увеличения концентрации [S]. В свою очередь, при условии, когда [S] > (E), скорость реакции будет пропорциональна концентрации фермента. Основными кинетическими константами уравнения Михаэлиса являются максимальная скорость реакции (Vмакс) и константа Михаэлиса (Km). Величина последней определяется соотношением трех констант скорости. В случае, когда K+2 < K– 1, Km ≈ K– 1/K+1 = Ks.
Константа Ks получила название константы субстрата и служит мерой сродства фермента к субстрату. Поскольку скорость реакции, катализируемой ферментом, зависит от относительного сродства фермента к субстрату, константа (Ks) является важной характеристикой фермента. Поэтому уравнение Михаэлиса – Ментен может быть выражено следующим образом:
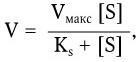
где Vмакс – предел, к которому стремится скорость реакции с повышением концентрации субстрата; Ks – константа, численно равная концентрации субстрата при V=Ммакс/2.
Колебание температурного режима оказывает на ферментативные реакции влияние таким же образом, как и на другие химические реакции. Отношение констант реакций при более высокой (Т2) и более низкой (Т1) температурах получило название температурного коэффициента: Q = K2/K1. Значение его обычно дается для интервала в 10 °C (Q10). Величину Q10 легко вычислить для любого температурного интервала ΔT по формуле:
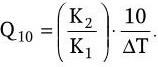
Скорость ферментативных реакций зависит также от концентрации водородных ионов. Величина оптимальной рН и ее границы варьируют в зависимости от типа и свойств ферментов. Даже изоферменты, имеющие одинаковую субстратную специфичность, могут различаться по оптимуму рН.
Отличаясь высокой специфичностью действия, ферменты, вместе с тем, обладают многими общими свойствами, вытекающими из их белковой природы. Благодаря последним создаются условия, которые позволяют использовать опять-таки универсальные механизмы для контроля активности ферментов.
В частности, существует специфический механизм саморегуляции скоростей отдельных биохимических реакций, вытекающий из аллостерической природы белков-ферментов: конечный продукт реакции (в случае накопления некоторого избытка его), взаимодействуя с молекулой фермента, так изменяет ее конформацию, что она временно утрачивает свою активность. Этот принцип саморегуляции, получивший название регуляции по типу отрицательной обратной связи, или торможения конечным продуктом, носит универсальный характер. С его помощью создаются идеальные условия для саморегуляции, так как он не требует никакой дополнительной затраты энергии и вещества. Запуск реакций, ведущих к превращению субстрата, осуществляется самим субстратом, а их остановка – конечным продуктом. Как только содержание конечного продукта достигает определенного уровня, дальнейший синтез его прекращается. Конечный продукт выступает в роли регулятора собственного синтеза. Так осуществляется саморегуляция многих биохимических процессов и, как следствие, координация их, так как многие из них взаимозависимы по участвующим в реакциях различным продуктам. Помимо этого уровня саморегуляции, определяющего кинетику единичных ферментативных реакций, а также общую скорость и координацию большинства биохимических процессов, существует высшая форма клеточной саморегуляции, осуществляемая на генетическом уровне. В соответствии с химическими сигналами, поступающими как из внешней среды, так и эндогенным путем, клетка автоматически запускает (индуцирует) или подавляет (репрессирует) синтез соответствующих ферментов. Нетрудно видеть, что, хотя эффекты индукции и репрессии противоположны по своим проявлениям, они представляют собой две стороны одного и того же процесса, а именно – регуляции образования ферментов. Благодаря механизмам индукции и репрессии, осуществляемым с помощью соответствующих генов (регуляторов, операторов, промоторов, аттенуаторов и т. п.) и белков (репрессоров, активаторов, апорепрессоров и т. п.), клетка, в соответствии с химическими сигналами, осуществляет автоматический контроль биосинтеза необходимых ей в данное время ферментов.
Одним из проявлений регуляции синтеза ферментов на уровне генома служит так называемая постоянная или временная катаболитная репрессия. Суть ее состоит в том, что некоторые источники углерода, принимающие участие в энергетическом обмене, например глюкоза, способны подавлять биосинтез определенных ферментов. Существует предположение, что синтез биосинтетических ферментов контролируется по механизму отрицательной обратной связи – репрессией конечным продуктом, а биосинтез ферментов, участвующих в катаболизме, контролируется механизмом индукции и катаболитной репрессии.
Бактерии, как и все живые организмы, не могут существовать в природе, не получая информации из внешней среды и от себе подобных. Обмен информацией (коммуникацию) они осуществляют разными способами, например путем непосредственого контакта при конъюгации (с помощью донорных ворсинок), при формировании колоний и при других процессах. Особое значение имеет способность бактерий вступать в контакт с клетками организма человека и животных. Распознавание клеток и присоединение к ним – важнейший начальный этап реализации бактериями патогенных свойств. Другой важной формой межклеточной коммуникации служат УФ (митогенетическое излучение), электромагнитные волны светового и инфракрасного диапазонов. Дистантное взаимодействие существенно важно в регуляции переходных процессов или в стрессовых ситуациях, когда клетке надо «решить», как вести себя в необычных условиях. Важную информацию бактерии получают через посредство физико-химических факторов внешней среды (температура, pH среды и т. п.), а также специальных химических сигналов. Установлено, что бактерии синтезируют и выделяют во внешнюю среду много биологически активных соединений, которые координируют их коллективное поведение, физиологическое состояние и т. п.
У бактерий обнаружены различные системы, способные воспринимать из внешней среды физические и химические сигналы. У многих патогенных бактерий (E. coli, Y. pestis, Y. pseudotuberculosis и др.) обнаружены термоиндуцибельные системы, контролирующие синтез факторов патогенности. Например, у E. coli при температуре 18 – 20 °C практически не происходит синтеза факторов адгезии (пилей). Повышение температуры до 37 °C индуцирует их образование. Такой же температурозависимый контроль синтеза факторов патогенности обнаружен у возбудителей чумы (Y. pestis), дизентерии (Shigella flexneri) и других заболеваний. Целесообразность действия этих систем очевидна: факторы патогенности необходимы бактериям для обеспечения их существования в организме человека или животных, т. е. при температуре 37 °C. В иных условиях эти системы бактериям не нужны. Другим примером того, как бактерии реагируют на физические сигналы, является феномен «теплового шока», описанный еще в 1952 г. Ф. Ритоссой. Он лучше всего изучен у E. coli. Суть его заключается в том, что нагревание среды до 42 °C активизирует работу ряда генов, вследствие чего в 5 – 20 раз увеличивается синтез почти 20 белков, играющих ключевую роль в жизни клеток. Главную роль в системе теплового шока играет ген (позитивный регулятор) htpR (англ. – heat temperature protein regulator), картированный на 76-й минуте хромосомной карты E. coli. Он является представителем особой группы генов, продукты которых необходимы для роста только при температуре выше 35 °C. Продукт гена htpR – σ-белок, который играет роль σ-субъединицы РНК-полимеразы. Последняя и определяет выбор промоторов тех генов, которые входят в систему теплового шока.
Интересно, что генетический контроль споруляции также реализуется через изменение σ-субъединицы РНК-полимеразы. Фактором, запускающим споруляцию у B. subtilis, служит аденозин-бис-трифосфат р3Ар3. Его синтез осуществляет фермент аденозин-бис-трифосфат-синтетаза. В нормальных условиях синтез этого фермента репрессирован. Когда же клетка получает соответствующий химический сигнал из внешней среды (например, об истощении источника энергии), репрессия синтеза фермента снимается, накапливается р3Ар3, и это каким-то образом приводит к замене σ-субъединицы РНК-полимеразы. В результате этого последняя начинает распознавать промоторы генов, продукты которых и обусловливают спорообразование.
Помимо системы теплового шока у бактерий обнаружена система и «холодового шока»: снижение температуры роста с 37 до 10 °C у E. coli вызывает увеличение в 3 – 300 раз синтеза 13 белков, изменяющих ход ее биосинтетических процессов в новых условиях роста. Обе эти системы связаны друг с другом и с другими системами, в том числе с системой, регулирующей клеточное деление, и через RecA белок с жизненно важной системой генов – SOS-системой (см. часть 2 «Генетика бактерий»).
Восприятие химических сигналов бактериями осуществляется с помощью так называемых сенсорно-регуляторных систем. Простейшая схема их такова (рис. 35). Вначале сигнал воспринимается рецептором клеточной мембраны и передается мембранным ферментам. Затем образуется вторичный посредник (мессенджер – англ. messenger – посыльный), который через системы киназ и фосфатаз взаимодействует с эффекторным аппаратом клетки, в том числе с ее генами. Этот процесс передачи сигнала обычно включает в себя обратимую посттрансляционную модификацию белков посредством их фосфорилирования. В простейшем случае сенсорно-регуляторная система состоит из белка-рецептора (сенсора), который располагается, как правило, но не всегда, в мембране, и белка-регулятора, локализованного в цитоплазме. Примером такой системы является система осмотической регуляции у E. coli: ее сенсором является белок EnvZ, а регулятором – белок OmpR (система EnvZ/OmpR). Белок EnvZ получает информацию из периплазмы, в которой располагается его N-концевой домен. С-концевой домен располагается в цитоплазме и обладает ауто– и протеинкиназной активностью. В присутствии АТФ С-домен аутофосфорилируется, а затем передает фосфорильную группу белку-регулятору – OmpR. В свою очередь белок OmpR контролирует работу двух генов – оmpC и оmpF, кодирующих синтез белков-поринов наружной мембраны – OmpC и OmpF. Белок OmpF имеет больший диаметр пор, чем белок OmpC. Регулятор ответа – белок OmpR – также состоит из двух доменов: N-концевой домен фосфорилируется белком-сенсором, а С-концевой домен взаимодействует с промоторами генов ompC и ompF с различной активностью в зависимости от того, фосфорилирован ли этот белок (OmpR). Таким образом, от активности транскрипции генов ompC и ompF будет зависеть соотношение белков-поринов OmpC и OmpF в наружной мембране, а следовательно, и степень проницаемости мембраны для воды и низкомолекулярных гидрофильных соединений. По такому же принципу устроены и работают и другие сенсорно-регуляторные системы. С-концевые домены разных сенсорных белков имеют сходное строение, а N-концевые домены регуляторных белков также оказались гомологичными. Поэтому механизмы взаимодействия между белками-сенсорами и соответствующими им белками-регуляторами, вероятно, одинаковы. У бактерий уже обнаружено около 30 таких сенсорно-регуляторных систем, воспринимающих различные химические сигналы и обеспечивающих на них адекватный ответ. Специфичность их зависит от передачи сигнала на соответствующий эффекторный аппарат (на гены). Функции, выполняемые регуляторами ответа, – получение сигнала от сенсора, взаимодействие с промоторами соответствующих генов и активация их транскрипции – разделены между доменами белка-регулятора. Сходство в механизме функционирования этих систем указывает на то, что их функции также должны быть скоординированы.
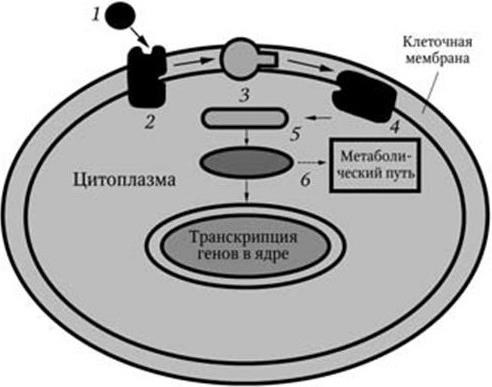
Рис. 35. Этапы внутриклеточной передачи сигналов (по Д. Эриксону. В мире науки. 1993, вып. 1):
1 – связывание внеклеточного сигнального агента; 2 – клеточный рецептор; 3 – белок-передатчик; 4 – мембранный фермент; 5 – вторичный мессенджер; 6 – киназы и фосфатазы
Важнейшим механизмом восприятия информации из внешней среды служит изменение топологического состояния ДНК, степени ее суперспирализации, от которой зависит работа генов бактерий, в том числе систем теплового и холодового шока. В отличие от сенсорных систем этот механизм реагирует не на специальные химические сигналы, а на разнообразные изменения физико-химического состояния внешней среды и поэтому выполняет роль общего регулятора экспрессии генов.
Таким образом, при большом количестве взаимодействующих систем для их согласованности, т. е. для саморегуляции жизненных процессов клетки, решающее значение имеет соблюдение трех основных условий: во-первых, согласованность скоростей реакций; во-вторых, строгое регулирование последовательностей их включения; в-третьих, регулирование количественного и качественного состава самих ферментов в строгом соответствии с сигналами, поступающими из окружающей среды. Приспособляемость, если под ней понимать корреляцию между степенью физиологической активности клетки и условиями среды, возникает как неизбежное следствие установления взаимосвязи между динамическими системами клетки. Внешние условия – наличие необходимых субстратов, температуры, рН, rН2 и других факторов – индуцируют одни системы и лимитируют активность других систем. Целесообразность поведения живой системы складывается из совокупности согласованно протекающих в ней саморегулируемых и взаимосвязанных реакций, т. е. она обусловлена самой организацией живой системы. Конечным результатом регуляции протекающих в клетке биосинтетических и катаболических процессов является произведение потомства, а показателем сбалансированности функционирующих систем служит скорость роста бактерий.
Различают рост индивидуальных клеток и рост популяции. Каждый из них характеризуется своими особенностями и закономерностями. Под ростом индивидуальной клетки понимают увеличение ее биомассы, наступающее в результате синтеза клеточного материала. Объем клетки можно вычислить, если известны ее продольные и поперечные размеры. Для шаровидных клеток он определяется по формуле:
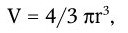
а для цилиндрических
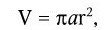
где r – радиус клетки; a – длина клетки.
Рост палочек происходит в длину, поэтому удельная поверхность (отношение поверхности к объему) остается примерно постоянной, и скорость роста в определенных условиях может быть постоянной.
У сферических клеток рост происходит во всех направлениях, поэтому удельная поверхность непрерывно уменьшается с ростом клетки, вследствие чего скорость роста у кокков постепенно замедляется. Удлинение клеток происходит благодаря удлинению клеточной стенки за счет включения в различные ее слои новообразованных структурных единиц. У стрептококков включение их происходит в области «экватора» клеточной стенки. У некоторых грамотрицательных бактерий этот процесс происходит без четкой локализации, т. е. в различных участках клеточной стенки. У E. coli рост наружной мембраны происходит исключительно в области ее полюсов, а рост пептидогликанового слоя – за счет включения новыхединиц в различных его участках. В условиях скоординированного роста деление клетки происходит, когда она удваивает свою биомассу, строго посередине. Процесс деления клетки сопряжен с процессом сегрегации (распределения) дочерних хромосом и дочерних плазмид в дочерние клетки. У бактерий обнаружены белкигомологи белков ParA и ParB (они осуществляют равномерное распределение плазмид между дочерними клетками) и белок MucB. Вместе с белками мембраны они образуют комплекс, растаскивающий хромосомы в дочерние клетки перед образованием межклеточной перегородки. Связь между вегетативной репликацией хромосомы и клеточным делением включает три следующих последовательных события:
1) подготовку к инициации репликации;
2) цикл репликации хромосомы (и плазмиды);
3) интервал времени между завершением репликации хромосомы и клеточным делением. Клеточный цикл бактерий можно выразить следующей формулой:
где T – время удвоения; С – время цикла репликации; D – время между завершением цикла репликации и клеточным делением.
При благоприятных условиях роста Т для E. coli и многих других бактерий составляет около 30 мин. Деление бактериальной клетки находится также под строгим генетическим контролем, нарушение которого приводит и к нарушению механизма клеточного деления.
Деление бактерий наступает в результате формирования межклеточной перегородки, которое происходит следующим образом. В том участке ЦМ, с которым связана с помощью особого рецептора молекула ДНК (хромосома, плазмида), происходят события, инициирующие процесс репликации, в результате которого вновь образующаяся дочерняя молекула ДНК прикрепляется также к рецептору на ЦМ. Область последней между двумя рецепторами, к одному из которых прикреплена родительская, а к другому – дочерняя ДНК, начинает удлиняться, в результате этого расстояние между ними все время увеличивается в течение времени С (рис. 36). По завершении процесса репликации строго по экватору между отделившимися друг от друга хромосомами начинает формироваться межклеточная перегородка путем встречной инвагинации (врастания навстречу друг к другу) ЦМ и связанной с ней области клеточной стенки (рис. 37).

Рис. 36. Модель К. Ларка, объясняющая механизм регулирования равномерности распределения хромосом (и плазмид) между дочерними клетками
Одна из нитей хромосомы прикреплена к особому рецептору мембраны (1). После инициации репликации вторая нить также разрывается (2) и прикрепляется к соседнему рецептору мембраны (3). Рост (удлинение) мембраны постепенно отделяет хромосомы друг от друга. Когда клетка удвоит свою длину, точно по ее экватору между дочерними хромосомами формируется межклеточная перегородка, и клетка делится
В результате слияния инвагинирующих участков ЦМ и КС образуется межклеточная перегородка, и родительская клетка разделяется на две дочерние клетки равной длины. Функцию аппарата митоза у бактерий выполняет ЦМ путем своего удлинения, которое раздвигает хромосомы (и плазмиды) таким образом, что они оказываются по ту и другую стороны формирующейся межклеточной перегородки в равных соотношениях.
Рис. 37. Модель участия ЦМ в регуляции репликации и равномерности распределения хромосом и плазмид между дочерними клетками
Результатов нарушения генетического контроля клеточного деления может быть по крайней мере два. Если формирования межклеточной перегородки не происходит, возникают длинные нитевидные формы. Однако при восстановлении нарушенного механизма такого контроля нити делятся на фрагменты, равные по длине нормальным клеткам. В некоторых случаях нарушение контрольных механизмов приводит к тому, что вместо одной межклеточной перегородки, формирующейся по экватору, происходит образование одной или двух перегородок, каждая из которых локализована ближе к своему полюсу. Поскольку в этом случае формирование перегородки не связано с сегрегацией хромосом, образуются так называемые мини-клетки, лишенные хромосом, которые остаются в родительской клетке. Мини-клетки могут осуществлять различные биохимические процессы, поскольку они содержат ферменты, но они не способны к размножению, так как лишены хромосом.
Помимо мини-клеток вследствие различных неблагоприятных воздействий из бактерий могут образовываться так называемые нанно-клетки, т. е. мельчайшие клетки размером 0,2 – 0,3 мкм. Их описывали под различными названиями: фильтрующиеся формы бактерий, элементарные тельца, ультрамикробактерии. Чаще всего они образуются при L-трансформации бактерий. Поскольку размеры таких клеток удобнее выражать в нанометрах, а не в долях микрометра, их стали называть нанно-клетками. Образование нанно-клеток – универсальная ответная реакция бактерий на неблагоприятные условия существования.
Для выращивания бактерий применяют различные питательные среды. Они могут быть жидкими, твердыми (лучше называть их плотными) или полужидкими. Жидкие среды готовят на основе водных растворов каких-либо веществ, чаще всего мясной воды, различных гидролизатов, иногда жидких естественных продуктов (молока, крови и др.). Для получения плотных сред к ним добавляют или агар, или желатин, или силикагель в соответствующих концентрациях. Агар представляет собой полисахарид сложного состава, получаемый из морских водорослей. Он имеет плотную волокнистую структуру. Агар плавится при температуре 100 °C, но при охлаждении сохраняет жидкую консистенцию до 45 °C. Для получения плотных сред его добавляют в концентрации 1,5 – 3,0 %. Полужидкие среды имеют вязкую консистенцию благодаря добавлению к ним небольшого количества агара (0,3 – 0,7 %). По происхождению среды делят на естественные (кровяные, молочные, картофельные, яичные) и искусственные, получившие особенно широкое распространение. Они представляют собой искусственные сбалансированные смеси питательных веществ в концентрациях и сочетаниях, необходимых для роста и размножения микроорганизмов. В них в качестве универсального источника азота и углерода для патогенных бактерий применяют пептоны – продукты неполного расщепления белков с помощью ферментов (пепсина), различные гидролизаты (рыбный, казеиновый, дрожжевой и т. п.). Питательные среды обязательно отвечают трем основным требованиям:
1) они должны содержать в достаточном количестве все необходимые питательные вещества (источники энергии, углерода, азота), соли и ростовые факторы;
2) должны иметь оптимальную для роста данного вида бактерий рН;
3) должны иметь достаточную влажность (при их усыхании повышается концентрация питательных веществ, особенно солей, до уровней, тормозящих рост бактерий). Кроме того, питательные среды для лучшего определения культуральных свойств бактерий должны быть по возможности прозрачными. Наконец, они должны быть стерильными, не содержать посторонней микрофлоры. По назначению питательные среды подразделяют на следующие основные категории.
Универсальные – среды, на которых хорошо растут многие виды патогенных и непатогенных бактерий. К ним относятся: мясо-пептонный бульон (МПБ = = мясная вода + 1 % пептона + 0,5 % NaCl), мясо-пептонный агар (МПА = МПБ + + 2 – 3 % агара).
Дифференциально-диагностические – среды, позволяющие отличать одни виды бактерий от других по их ферментативной активности или культуральным проявлениям. К ним относятся среды Эндо, Левина, Плоскирева, Гисса и многие др.
Селективные (син.: избирательные, элективные, обогатительные) – среды, содержащие вещества, используемые микроорганизмами определенных видов и не благоприятствующие или даже препятствующие росту других микроорганизмов. Селективные среды позволяют направленно отбирать из исследуемого материала определенные виды бактерий. Сюда относятся среды Мюллера, селенитовая, Рапопорт, 1 %-ная пептонная вода и др.
Дифференциально-селективные – среды, сочетающие в себе свойства дифференциально-диагностических и селективных сред. Они используются, в частности, для ускорения обнаружения и идентификации бактерий, относящихся к большому числу широко распространенных видов энтеробактерий и псевдомонад (среды Сиволодского).
Специальные – среды, специально приготовленные для получения роста тех бактерий, которые не растут или очень плохо растут на универсальных средах. К ним относятся среды Мак-Коя – Чепина (для получения роста возбудителя туляремии), кровяной МПА (для получения роста патогенных стрептококков), среда Левенштейна – Иенсена (для выделения возбудителя туберкулеза) и др.
Синтетические – среды строго определенного химического состава, представляющие собой растворы неорганических солей с добавлением химических соединений, которые служат источником углерода или азота. Примером такой синтетической среды является минимальная среда М-9, в которой источником энергии и углерода является глюкоза, а азота – NH4Cl. Синтетические среды могут быть и более сложного состава с включением различных аминокислот, оснований и витаминов.
Полусинтетические – синтетические среды, к которым добавляют какой-либо продукт природного происхождения, например сыворотку крови. Существует много различных вариантов питательных сред, сконструированных с учетом потребностей соответствующих видов бактерий и диагностических целей.
Для выращивания бактерий используют следующие способы их культивирования: стационарный, глубинный с аэрацией и с использованием проточных питательных сред.
Стационарный способ: питательные среды сохраняются постоянными, с ними никаких дополнительных манипуляций не производят. Однако при таком способе культивирования в жидких питательных средах, где преобладают анаэробные энергетические процессы, выход биомассы незначителен. Поэтому в связи с развитием микробиологической промышленности были разработаны принципиально новые способы культивирования, позволяющие получать гораздо больший выход биомассы или биологически активных соединений. К их числу относятся метод глубинного культивирования с аэрацией и метод использования проточных сред.
Метод глубинного культивирования с аэрацией. Для выращивания с помощью этого способа применяют специальные устройства – реакторы. Они представляют собой герметические котлы (приспособленные автоклавы), в которые заливается жидкая питательная среда. Реакторы снабжены автоматическими приспособлениями, позволяющими поддерживать постоянную температуру, оптимальные рН иrН, дозированное поступление необходимых дополнительных питательных вещест2в. Однако главная особенность таких реакторов в том, что они постоянно продуваются стерильным воздухом и в них установлены мешалки, с помощью которых среда постоянно перемешивается. Поэтому во всей питательной среде создается такая концентрация свободного кислорода, при которой энергетические процессы происходят в аэробных условиях, т. е. достигается максимальное использование энергии, заключенной в глюкозе, а следовательно, и максимальный выход биомассы. Для примера: выход биомассы при стационарном методе культивирования E. coli в МПБ через 18 – 20 ч составляет 1 – 2 млрд клеток на 1 мл среды, а при глубинном методе через 12 – 14 ч – 50 – 60 млрд клеток/мл среды.
Использование проточных питательных сред позволяет создать условия, при которых клетки имеют возможность длительное время находиться в определенной фазе роста (экспоненциальной) при постоянной концентрации питательных веществ и в одних и тех же условиях, обеспечивающих непрерывный рост культуры. Методы получения непрерывных культур основаны на том, что в аппарат, где растут клетки, непрерывно добавляют свежую питательную среду и одновременно из него удаляют соответствующее количество бактерий.
Различают два типа таких аппаратов: хемостаты и турбидостаты. Хемостат – аппарат, в который постоянно из особого резервуара добавляется свежая питательная среда. Благодаря механическому перемешиванию и аэрации среды в ней создаются оптимальные условия для снабжения бактерий кислородом и вновь добавляемыми питательными веществами, по мере поступления которых часть популяции бактерий из аппарата удаляется.
Принцип работы турбидостата основан на поддержании постоянной плотности (мутности) бактериальной популяции в аппарате. Степень мутности контролируется с помощью фотоэлементов, которые через систему реле регулируют поступление питательных веществ в аппарат. Все питательные вещества в ней содержатся в избытке, и скорость роста приближается к максимальной. В таких аппаратах непрерывного культивирования микроорганизмов (АНКМ) все необходимые параметры для роста соответствующего вида микроорганизма задаются и поддерживаются с помощью специальных автоматических приборов. Благодаря сохранению неизменных условий среды непрерывная культура постоянно находится в наиболее желательной фазе роста, при которой обеспечивается максимальный выход биологически важных соединений (антибиотики, витамины, аминокислоты и т. п.) либо биомассы. Таким образом, в соответствии со способами культивирования различают периодические (при стационарном и глубинном методах культивирования) и непрерывные (при проточном способе) культуры микроорганизмов. Кроме того, при определенных условиях получают синхронные культуры, т. е. культуры, в которых все клетки одновременно (синхронно) делятся. Однако такая синхронность сохраняется, как правило, в течение 2 – 3 циклов деления, а затем она нарушается. Синхронные культуры используют в основном для изучения тех или иных стадий клеточного цикла бактерий и роли отдельных генов (и их продуктов) в их осуществлении.
Особенности роста популяции бактерий
Кинетика роста бактериальной популяции не устанавливается кинетикой роста индивидуальной клетки, хотя между ними, несомненно, существует взаимосвязь. Скорость увеличения объема индивидуальной клетки можно рассматривать как функцию времени, которое позволяет объему клетки удвоиться к концу периода между делениями. Между скоростью роста и размером клеток существуют определенные математические отношения.
Для количественной характеристики ростовых процессов в микробной популяции пользуются двумя показателями: абсолютной (валовой) скоростью и относительной (удельной) скоростью роста. Среднюю валовую скорость роста (Vср) за отрезок времени (t1 – t0) можно определить по абсолютному приросту биомассы по формуле:
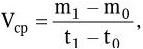
где m0 – величина биомассы в начале исследуемого отрезка времени; m1 – величина биомассы в конце исследуемого отрезка времени.
Под удельной скоростью роста (μ) понимают часовой прирост, пересчитанный на единицу растущей массы:
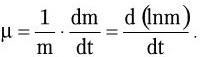
Скорость размножения бактерий ν (число удвоений за единицу времени) описывают уравнением:
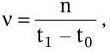
где n – число поколений.
Продолжительность жизни одного поколения (время генерации) g в среднем составляет:
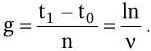
В результате логарифмирования приведенных формул и их сопоставления установлена связь удельной скорости роста с продолжительностью времени генерации и скоростью размножения клеток:
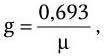
Как видно из последних формул, между временем генерации (продолжительностью жизни одного поколения) g и удельной скоростью роста μ существует обратно пропорциональная зависимость. Скорость роста микробной популяции не является величиной неизменной. В развитии микробной популяции различают следующие последовательные стадии (рис. 38): лаг-фаза; фаза положительного ускорения; фаза логарифмического роста; фаза отрицательного ускорения; стационарная фаза; фаза ускоренной гибели; фаза логарифмической гибели и фаза уменьшения скорости отмирания. Они отражают сложные процессы адаптации бактерий, привнесенных из одной среды обитания в другую, как правило, оптимальную для их размножения. Природа лаг-фазы во многом связана с тем, что в этот период происходит активный синтез всех компонентов белоксинтезирующей системы и прежде всего такого количества рибосом, которое позволило бы обеспечить максимальную активность всех биосинтетических процессов. Последующие стадии развития периодических культур отражают высокую скорость размножения бактерий. Затем, в силу постепенного истощения источника энергии и других жизненно важных метаболитов, скорость размножения бактерий уменьшается, и в стационарной фазе наступает период некоторого равновесия – количество вновь образующихся клеток становится сопоставимым с числом погибающих клеток. Вслед за этим наступает стадия, характеризующаяся постепенным уменьшением количества жизнеспособных бактерий. Это является следствием ряда причин – истощения источников энергии и других жизненно важных метаболитов, невозможности эффективно регулировать рН и rH2 среды, накопления продуктов метаболизма, тормозящих рост, и, возможно, каких-то других факторов. Очевидно, что популяция бактерий – это тоже саморегулирующаяся система, очень зависящая от среды, истощение которой оказывает на нее отрицательное действие. Жизнеспособные клетки, перенесенные из такой среды в новую питательную среду, вновь повторяют полностью весь цикл развития популяции.
Рис. 38. Стадии роста периодической культуры:
I – лаг-фаза; II – фаза положительного ускорения; III – фаза логарифмического роста; IV – фаза отрицательного ускорения; V – стационарная фаза; VI – фаза ускоренной гибели; VII – фаза логарифмической гибели; VIII – фаза уменьшения скорости гибели.
На оси ординат показаны скорость размножения бактерий в условных единицах (слева) и величина популяции бактерий, выраженная логарифмом от числа живых клеток на 1 мл среды
Некоторые культуральные свойства бактерий
При росте на жидких питательных средах бактерии чаще всего вызывают равномерное помутнение, иногда – выпадение осадка: крошковатого (стрептококки), хлопьевидного (стрептобациллы), бульон при этом остается прозрачным. Некоторые бактерии образуют пленку на поверхности жидкой среды: сухую чешуйчато-бородавчатую (туберкулезная палочка), тонкую, нежную (холерный вибрион), рыхлую, с отходящими вниз отростками – «сталактитами» (возбудитель чумы). Еще более разнообразен рост бактерий на плотных питательных средах. Образуемые при этом колонии различаются по многим признакам: размерам, форме, консистенции, структуре, прозрачности, цвету и др.
Колонии бывают очень мелкими (0,1 – 0,5 мм), мелкими (0,5 – 3,0 мм), средних размеров (3 – 5 мм) и крупными (более 5 мм в диаметре). Они могут быть круглыми (дисковидными); плоскими; иметь форму, напоминающую львиную гриву («голову Медузы»); ризоидными и т. п. (рис. 39). Края колонии могут быть гладкими, зазубренными, фестончатыми, изрезанными. Поверхность колонии бывает гладкая или шероховатая, влажная или сухая, ровная или складчатая, плоская или выпуклая, а ее консистенция – плотная, рыхлая, слизистая. Колонии могут быть прозрачными, полупрозрачными, непрозрачными и различаться по другим признакам, например у некоторых бактерий центр мутный, а периферическая зона полупрозрачна.
Рис. 39. Типы колоний различных видов бактерий:
1 – Bacillus pseudoanthracis; 2 – Clostridium novyi; 3 – Clostridium sporogenes; 4 – Escherichia coli; 5 – Corynebacterium diphtheriae; 6 – Fusobacterium; 7 – Brucella melitensis

Рис. 40. Колония Salmonella paratyphi B
Все эти признаки, как правило, видоспецифичны, поэтому они имеют важное диагностическое значение, т. е. их изучение используется для определения видовой принадлежности исследуемой культуры. Например, при определенных условиях роста колонии Salmonella paratyphi B имеют характерный слизистый валик по периферии, напоминая пуговицу с валиком (рис. 40).
Колонию бактерий можно рассматривать как своеобразный сложный организм. Изучение организации колонии выявило морфологическую и физиологическую гетерогенность входящих в нее клеток. В колониях сосуществуют популяции активно размножающихся, покоящихся клеток и клеток лизирующихся. Видовое своеобразие свойств колоний указывает на регулируемый характер процесса их формирования. Он управляется с помощью контактных, дистантных и, вероятно, иных сигналов и служит проявлением у бактерий апоптоза.
Апоптоз (греч. apoptosis – опадание лепестков цветов или листьев дерева) – форма запрограммированной клеточной гибели у эукариот, благодаря которой удаляются определенные клоны дифференцирующихся клеток или «излишки» биологического материала. Апоптоз у бактерий – аналог апоптоза эукариот – пример запрограммированного контроля над клетками на уровне популяции (колония, стационарная культура, популяции в других природных условиях). Суть его сводится к тому, что при исчерпании питательного субстрата голодающая популяция разделяется на две субпопуляции, одна из которых гибнет и подвергается автолизу, а клетки другой субпопуляции, используя продукты автолиза как субстрат, продолжают размножаться. Механизм генетического контроля апоптоза у E. coli установлен. Он осуществляется особым опероном из 2 генов: mazE и mazF. Продукт гена mazF – стабильный цитотоксический белок-киллер, а продукт гена mazE – нестабильный белок MazE, разрушающий белок-киллер. Истощение фонда аминокислот в питательной среде приводит к блокированию оперона maz, в результате этого синтез белка MazE прекращается, а белок-киллер вызывает гибель и автолиз части популяции. Фонд аминокислот в среде за счет этого пополняется, синтез белка MazE у оставшихся живых клеток активируется, и они продолжают размножаться. Таким образом, апоптоз регулирует формирование колоний и поведение клеток в стационарных культурах. Возможно, этот механизм причастен и к образованию НФБ.
Культуры некоторых видов бактерий обладают характерным запахом, иногда он связан с разложением органических веществ, которое сопровождается образованием скатола, индола, сероводорода, меркаптана, масляной кислоты, аммиака и т. п. Культуры дизентерийных бактерий при росте на МПА издают запах, напоминающий запах мужского семени. Продукты жизнедеятельности ряда других видов бактерий обладают приятным ароматным запахом, который связан с образованием различных эфиров: уксусно-этилового, уксусно-амилового или диацетила. Возбудитель мочки льна, например, издает запах ананаса. Особые расы молочнокислых бактерий придают аромат пищевым продуктам.
В природе существуют так называемые фосфоресцирующие бактерии, т. е. бактерии, культуры которых светятся в темноте зеленовато-голубоватым или желтоватым светом. Такие фосфоресцирующие бактерии встречаются, главным образом, в морской и речной воде. Фосфоресценция (люминесценция) продолжается иногда несколько часов и даже суток. Она представляет собой особую форму освобождения энергии возбужденных электронов. Такие бактерии нередко обнаруживаются на мясе, чешуе рыб и других объектах. К светящимся бактериям – фотобактериям – относятся физиологически сходные, но морфологически отличающиеся аэробные бактерии (вибрионы, палочки, кокки).
Способность образовывать пигмент присуща многим видам микроорганизмов. Как уже выше упоминалось, цианобактерии, некоторые виды архебактерий, а также серные и пурпурные бактерии имеют пигменты типа хлорофилла или бактериородопсина, с помощью которых они улавливают энергию Солнца. Различные виды других бактерий образуют пигменты желтого, оранжевого, красного, синего или черного цвета. Окраска колонии может быть связана как с пигментацией самих клеток, так и с выделением окрашенных веществ в питательную среду. Интенсивность образования пигментов зависит от состава питательной среды и условий культивирования микроорганизмов. Если пигмент не растворим в воде, окрашивается только культуральный налет; если же он водорастворим, окрашивается и питательная среда. Химическая природа пигментов разнообразна: каротиноиды относятся к ненасыщенным углеводородам, антоцианы и меланины – к ароматическим соединениям. Биологическая роль этих пигментов заключается, во-первых, в том, что они защищают бактерии от губительного действия солнечных лучей, поэтому в воздухе так много пигментных бактерий; а во-вторых, пигменты участвуют в обмене веществ этих бактерий.
ГЕНЕТИКА БАКТЕРИЙ
Некоторые общие понятия о генетической системе
Существование генов как дискретных единиц наследственности было установлено в 1865 г. Г. Менделем, а в 1869 г. Ф. Мишер впервые выделил ДНК. Однако прошло около 80 лет, прежде чем было установлено, что носителем генов является не белок, а ДНК. Это было сделано в опытах с пневмококками. В 1928 г. Ф. Гриффитс впервые осуществил трансформацию (превращение) невирулентных пневмококков в вирулентные. Он заразил белых мышей смесью живых, но не образующих капсул невирулентных пневмококков с убитыми капсульными вирулентными пневмококками. В организме мышей бескапсульные пневмококки превратились в капсульные, вызвали их заболевание и смерть. Механизм такой трансформации оставался неясным в течение 16 лет. В 1944 г. О. Эйвери, К. Мак-Леод и М. Мак-Карти осуществили трансформацию бескапсульных пневмококков в капсульные in vitro. Они добавили к культуре бескапсульных пневмококков ДНК, выделенную из капсульных пневмококков, в результате чего бескапсульные превратились в капсульные и стали вирулентными для мышей. Так впервые убедительно было доказано, что носителем единиц наследственности (генов) является ДНК. Через 9 лет после этого, в 1953 г., Ф. Крик и Дж. Уотсон определили структуру гена, основанную на двойной спирали ДНК. Это открытие позволило понять, каким образом ген выполняет свои три фундаментальные функции: 1) непрерывность наследственности – благодаря полуконсервативному механизму репликации ДНК; 2) управление структурами и функциями организма – с помощью генетического кода, использующего запас всего из четырех букв (оснований): А (аденин), Т (тимин), Г (гуанин) и Ц (цитозин); 3) эволюцию организмов – благодаря мутациям и генетическим рекомбинациям. Работами Ф. Крика, M. Ниренберга, С. Очоа и Х. Кораны к 1966 г. генетический код был полностью расшифрован. Он характеризуется следующими основными свойствами:
1. Код триплетный. Это означает, что кодон (функциональная единица, кодирующая аминокислоту) состоит из трех букв (оснований).
2. Код неперекрывающийся, т. е. соседние кодоны представлены отдельными самостоятельными триплетами.
3. Код вырожденный, т. е. каждая аминокислота кодируется более чем одним кодоном.
4. Число триплетов, которые не кодируют ни одной аминокислоты, т. е. «бессмысленных», мало – всего три из 64.
5. Последовательность расположения кодонов в гене определяет последовательность расположения аминокислотных остатков в полипептидной цепи, кодируемой данным геном.
6. Код универсален, т. е. все живые существа используют один и тот же код для записи генетической информации. Это служит прямым доказательством единства происхождения живой материи. Полный словарь РНК-аминокислотного кода представлен на рис. 41.
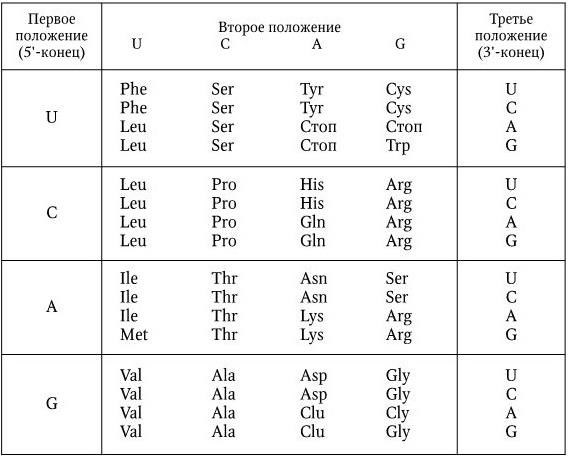
Рис. 41. Генетический код
Одновременно с расшифровкой генетического кода происходило и изучение механизмов, с помощью которых осуществляется реализация генетической информации, заключенной в генах. Было обнаружено, что биосинтез белка осуществляется на особых структурах – рибосомах, а информация к ним от генов поступает через особых посредников – матричные РНК (мРНК), расположение кодонов в которых и несет программу сборки аминокислот в полипептидную цепь. Было установлено также, что хромосома состоит из особых функциональных единиц – оперонов, и в общих чертах были выяснены механизмы, с помощью которых регулируется их работа. В результате всех этих исследований стало очевидным, что генетическая система обладает уникальными свойствами, во многом обусловленными двунитевой структурой молекулы ДНК. Эти свойства заключаются в способности генетической системы к: 1) самоудвоению с помощью механизма саморепликации; 2) самовыражению (экспрессии) с помощью регулируемого синтеза мРНК; 3) самообновлению с помощью мутаций, рекомбинаций и транспонируемых элементов; 4) самозащите (самоисправлению) с помощью механизмов ревизии, репарации, супрессии и др.
Примечательно, что все эти функции контролируются специальными собственными генами соответствующей генетической системы. Исключительное значение, которое принадлежит генам в происхождении и эволюции жизни, диктует необходимость дать этому понятию определение.
В узком и специальном понимании ген представляет собой структурную единицу ДНК, расположение кодонов в которой детерминирует первичную структуру соответствующей полипептидной цепи. Но это определение не очень точно, так как существуют гены не только ДНКовые, но и РНКовые. Кроме того, некоторые гены вирусов и эукариот состоят из экзонов (кодирующих участков) и интронов (нетранслируемых участков). Например, сборка полных генов иммуноглобулинов и рецепторов Т-лимфоцитов происходит в результате сложной внутригенной рекомбинации в эмбриональном периоде. Кроме того, в одном и том же фрагменте ДНК может быть по крайней мере два гена с разными рамками считывания. Следовательно, структура гена сложнее, чем ранее предполагалось. Он не всегда является строго ограниченным и пространственно фиксированным участком хромосомы. Так называемые транспонируемые генетические элементы способны в интактной форме перемещаться из одного генома в другой. Наконец, для функционирования структурных генов требуется участие особых регуляторных генетических элементов – регуляторов, операторов, промоторов и т. п. Однако гены – это структуры, свойственные только живой материи. Поэтому в определении понятия гена следует исходить из той фундаментальной роли, которую он играет в живой материи.
Ген представляет собой универсальную организующую структурную единицу живой материи, которая, благодаря содержащейся в ней закодированной информации, обеспечивает единство и многообразие всех форм существования жизни, ее непрерывность и эволюцию. Ген является единственным носителем и хранителем жизни, а его продукт – белок – определяет способ и форму существования жизни (А. И. Коротяев). Любой объект природы, имеющий набор собственных генов, следует рассматривать как живой организм. В связи с этим главным критерием, отличающим живое от неживого, является наличие у живого собственной генетической системы. Именно она обусловливает ту целесообразность поведения живых существ, которая отличает их от неживых систем. С этих позиций жизнь можно определить как форму существования всех объектов природы, обладающих собственными геномами, которые и определяют многообразие организмов, их наследственность и эволюцию (А. И. Коротяев). В основе единства и многообразия форм жизни лежит единство генетического кода и многообразие геномов живых существ. Под генетической системой понимают совокупность всех генов данного живого существа, характеризующуюся определенным уровнем структурной организации и особенностями экспрессии, т. е. реализации заложенной в генах информации. В соответствии с этим можно выделить следующие основные этапы эволюции генетической системы: кодон → ген → оперон → геном вирусов и плазмид → хромосома прокариот (нуклеоид) → хромосомы эукариот (ядро).
Очень часто, говоря о генетической системе, употребляют термин «геном». Под геномом понимают всю совокупность нуклеотидов, содержащихся в хромосоме или в наборе хромосом данного индивидуума. Объем генома у представителей различных царств жизни очень сильно варьирует. Именно от объема генома, который определяет возможное количество генов, и зависит степень сложности структурной организации данного индивидуума и, соответственно, уровень и характер проявления им своей жизни.
Под генотипом понимают всю совокупность имеющихся у данного существа индивидуальных генов. У плазмид, вирусов и бактерий бQольшая часть нуклеотидов ДНК входит в состав генов, поэтому размеры геномов у них выражают либо в молекулярной массе соответствующей геномной нуклеиновой кислоты, либо в количестве нуклеотидных пар, содержащихся в геномной нуклеиновой кислоте, либо в количестве имеющихся у них генов. Все эти значения сопоставимы, так как в среднем каждый ген состоит примерно из 1000 пар нуклеотидов, а вес одного нуклеотида ДНК составляет около 500 дальтон. Например, геном вируса гепатита В представлен двунитевой ДНК с м. м. 1,6 МД. Этот вирус имеет самое маленькое число генов среди возбудителей заболеваний человека. Его геном состоит всего из четырех генов (S, C, P и X). Геном вируса – возбудителя СПИДа представлен двумя идентичными молекулами РНК, которые состоят из 9213 нуклеотидов, образующих 9 генов. Геном бактериофага φХ174 состоит из 9 генов, у бактериофага Т4 – из 200 генов, у F-плазмиды – из 90 генов (94,5 тысяч пар нуклеотидов); у хламидий – из 400 – 600 генов, у риккетсий – из 1000 генов. Хромосома E. coli имеет молекулярную массу 2,8 ⋅ 109 дальтон и содержит около 4,3 тысяч генов.
ДНК большинства растений и животных состоит из нескольких миллиардов пар нуклеотидов. Отличительная черта их геномов состоит в наличии в составе хромосомной ДНК помимо кодирующих последовательностей структурных генов некодирующих последовательностей и большого объема так называемых повторяющихся последовательностей нуклеотидов. На долю повторяющихся последовательностей, функция которых не известна, приходится от 10 до 70 % всего генома; у млекопитающих эта доля составляет в среднем 30 – 50 %.
Общий объем ДНК (генома) варьирует у разных ветвей эукариот. Геном человека составляет около 3 ⋅ 109 нуклеотидных пар (н. п.). Этого количества достаточно для образования 3,0 ⋅ 106 генов. В действительности же, согласно последним данным, генотип человека содержит около 30 000 – 35 000 генов, многие их которых уже картированы. Следовательно, понятия «геном» и «генотип» не равнозначны.
Под фенотипом данного индивидуума понимают всю совокупность реализованных у него генетически детерминированных признаков, т. е. индивидуальное проявление генотипа. При изменении условий существования фенотип (например, у бактерий) изменяется при сохранении генотипа.
Генетическая система бактерий имеет по крайней мере четыре особенности, присущие только этим организмам:
1. Хромосомы бактерий (и соответственно плазмид) располагаются свободно в цитоплазме, не отграничены от нее никакими мембранами, но связаны с определенными рецепторами на цитоплазматической мембране. Поскольку длина хромосомы (у E. coli около 1,6 мм) во много раз превышает длину бактериальной клетки (1,5 – 3,0 мкм в среднем), хромосома особым компактным образом в ней упакована: молекула хромосомной ДНК находится в суперспирализованной форме и свернута в виде петель, число которых составляет 12 – 80 на хромосому. Петли в центре нуклеоида объединяются за счет связывания ДНК с сердцевинной структурой, представленной молекулами особого класса РНК – 4,5S РНК. Такая упорядоченная упаковка обеспечивает постоянную транскрипцию отдельных оперонов хромосомы и не препятствует ее репликации. Возможно, что петли упакованной хромосомы способствуют компартментализации рибосом.
2. Хотя бактерии являются гаплоидными организмами, т. е. имеют один набор генов, содержание ДНК у них непостоянно, оно может при благоприятных условиях достигать значений, эквивалентных по массе 2, 4, 6 и даже 8 хромосомам. У всех прочих живых существ содержание ДНК постоянное, и оно удваивается (кроме вирусов и плазмид) перед делением.
3. У бактерий в естественных условиях передача генетической информации происходит не только по вертикали, т. е. от родительской клетки дочерним, но и по горизонтали с помощью различных механизмов: конъюгации, сексдукции, трансдукции, трансформации.
4. У бактерий очень часто помимо хромосомного генома имеется дополнительный плазмидный геном, наделяющий их важными биологическими свойствами, нередко – специфическим (приобретенным) иммунитетом к различным антибиотикам и другим химиопрепаратам.
Содержание ДНК у бактерий зависит от условий их роста: при благоприятных условиях оно возрастает до величин, соответствующих массе нескольких хромосом. Это уникальное свойство бактериального генома. Биологическое значение его состоит в том, что, регулируя содержание копий своих генов (а оно будет определяться количеством копий синтезируемых хромосом), бактерии одновременно приспосабливают скорость своего размножения к условиям роста. Наряду с увеличением содержания ДНК у бактерий в этом случае существенно возрастает и количество рибосом. Благодаря этому создаются необходимые условия для транскрипции и трансляции (а у бактерий они происходят одновременно) нескольких копий генов одновременно, возрастает суммарная скорость биосинтеза всех субклеточных и клеточных структур и соответственно скорость размножения бактерий. Время клеточного цикла бактерий сокращается от нескольких часов до 20 – 30 мин. Скорость размножения определяет возможность накопления в окружающей среде большого запаса клеток данного вида. Это и является причиной существования бактерий в природе многие миллионы лет. Возможность регулировать скорость собственного размножения – одно из главных условий, обеспечивающих выживание бактерий в окружающей среде, а следовательно, и сохранение вида в природе.
Особенности репликации бактериальной ДНК
У бактерий различают следующие типы репликации ДНК: вегетативную, конъюгативную, репаративную и стабильную. Вегетативная репликация хромосомной и плазмидной ДНК обусловливает передачу генетической информации по вертикали, т. е. по наследству – от родительской клетки дочерним. Она контролируется соответственно хромосомными и плазмидными генами. Конъюгативная репликация осуществляется при конъюгативном способе обмена генетическим материалом и контролируется только плазмидными генами. При конъюгативной репликации происходит достройка нити ДНК, комплементарной нити, передаваемой от донора реципиенту. Репаративная репликация является механизмом, посредством которого осуществляется устранение из ДНК структурных повреждений или заключительный этап генетической рекомбинации. Эти процессы контролируются хромосомными и плазмидными генами. Стабильная репликация так названа потому, что происходит независимо от наличия или отсутствия синтеза белка.
Вегететивная репликация. Репликация ДНК у бактерий начинается со строго фиксированного сайта хромосомы – оriC. Он включает в себя участки с так называемыми ДНК-боксами и расположенными между ними короткими последовательностями. Оба элемента примыкают к гену dnaA. У B. sublilis на oriC расположено 15 ДНК-боксов, с которыми связывается продукт гена dnaA. Это и служит сигналом для действия ДНК-хеликазы. Репликация имеет полуконсервативный характер, идет одновременно в двух направлениях и заканчивается также в строго фиксированной точке – terminus. Поскольку цепи ДНК антипараллельны (если одна нить начинается с 5'-конца, другая – с 3'-конца), а ДНК-полимераза III осуществляет синтез ДНК только в направлении 5' → 3', репликация происходит своеобразно (рис. 42): на одной из расплетенных нитей – «прямой», или лидерной, или ведущей, – она идет непрерывно, а на другой – отстающей – ДНК-полимераза III должна возвращаться, чтобы наращивать нить тоже в направлении 5' → 3', прерывисто, через образование сегментов Оказаки, длиной у бактерий около 1000 нуклеотидов (у эукариот – около 200 – 300 нуклеотидов).
Синтез каждого сегмента Оказаки происходит последовательно через следующие стадии (рис. 43):
1. Раскручивание нитей ДНК.
2. Расплетение (разделение нитей).
3. Стабилизация однонитевых участков.

Рис. 42. Схематическое изображение репликации ДНК прерывистой (отстающей) и непрерывной (ведущей) цепей
4. Формирование праймосомы. Праймосома – мультиферментный комплекс, в который входят фермент ДНК-праймаза и ряд других белков.
5. Синтез с участием ДНК-праймазы (англ. prime – подготавливать) затравочной РНК. Затравочная РНК необходима для синтеза каждого сегмента Оказаки потому, что сама ДНК-полимераза не способна инициировать синтез ДНК, для этого ей нужна специальная затравка, роль которой и выполняют короткие, длиной не более 10 нуклеотидов, фрагменты РНК, комплементарные ДНК-матрице.
6. Синтез сегмента Оказаки.
7. Вырезание затравочной РНК и замещение ее дезоксирибонуклеотидами, комплементарными основаниям ДНК-матрицы.
8. Сшивание сегмента Оказаки с предсуществующей нитью ДНК с помощью лигазы.
9. Суперспирализация вновь синтезированных участков нитей ДНК.
10. Ревизия ДНК-полимеразой вновь синтезированного фрагмента ДНК – нет ли ошибочного включения нуклеотидов.
Если произошла ошибка, то ошибочно включенный нуклеотид с частью этой нити вырезается и образовавшаяся брешь заполняется правильными нуклеотидами. Благодаря такой ревизии процент ошибок при репликации ДНК не превышает 1 ⋅ 10– 9.
Скорость репликации ДНК у E. coli при температуре 37 °C соответствует включению 2 ⋅ 103 пар нуклеотидов в 1 с. Участок хромосомы, в котором происходит разделение нитей и начинается репликация, имеет форму вилки, последовательно продвигающейся вдоль хромосомы. При благоприятных для роста бактерий условиях, когда еще не закончился один цикл репликации, могут возникать вторичные и третичные репликативные вилки, благодаря чему в клетке и происходит увеличение массы ДНК и числа копий хромосом.
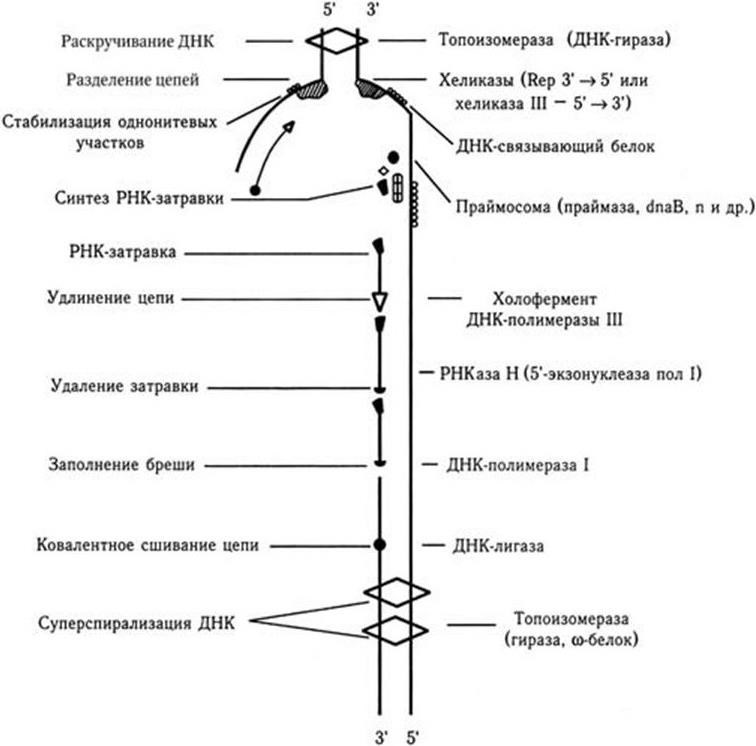
Рис. 43. Схематическое изображение состава и функционирования компонентов репликативного комплекса
В осуществлении процессов репликации ДНК участвует целый комплекс ферментов, образующих единую структуру – реплисому. Наиболее важные из них указаны на рис. 43. Генетический контроль репликации ДНК осуществляется большим количеством генов (у E. coli не менее 25), локализованных в самой ДНК; это процесс саморегулируемый. Комплекс генов обеспечивает строгую временну́ю и пространственную координацию функционирования ферментов, участвующих в репликации.
Особенности регуляции выражения генетической информации у бактерий
В отличие от вегетативной репликации, цель которой – обеспечить передачу по наследству всех генов и которая происходит последовательно от начала до конца хромосомы, выражение генетической информации, т. е. работа генов, подчиняется другой цели, а именно – осуществлению за короткий срок жизненного цикла клетки. Поскольку он включает в себя множество биохимических реакций, сопряженных между собой, это предполагает хорошо согласованную во времени работу генов. Такая их согласованность возможна лишь при определенном жестком и четком управлении ими. Действительно, как было давно установлено, основной структурнофункциональной единицей хромосомы является оперон. Он представляет собой группу структурных генов-цистронов, физически сцепленных друг с другом и с геном-оператором, который управляет их выражением. В состав оперона, как правило, входят структурные цистроны, определяющие синтез ферментов, которые участвуют в цикле связанных между собой биохимических реакций. Ген-оператор управляет одновременно всей группой структурных генов, которые образуют оперон, иначе говоря, оперон функционирует как самостоятельная единица. В свою очередь, оперон или их группа находится под управлением одного гена-регулятора. Так возникает более сложная структурно-функциональная единица – регулон. Регулон представляет собой систему, состоящую из гена-регулятора и одного или нескольких оперонов, находящихся под контролем одного гена-регулятора.
Важным структурным элементом оперона является промQотор – область, с которой взаимодействует РНК-полимераза. В составе оперонов могут быть и различные другие регуляторные элементы – энхансеры, аттенуаторы, терминаторы и т. п.
Энхансер (англ. enhance – усиливать) – генетический элемент, усиливающий транскрипцию оперона.
Аттенуатор (англ. attenuate – разрежать, разбавлять) – генетический элемент, ослабляющий работу оперона. Аттенуатор – последовательность нуклеотидов, расположенная между промоторным операторным участком оперона и его первым структурным опероном; она кодирует лидерную РНК, ее длина около 150 пар нуклеотидов.
Терминатор (англ. terminate – заканчивать) – особый участок в структуре аттенуатора (лидерной последовательности), от которого зависит образование участка мРНК, блокирующего синтез лидерной РНК перед началом первого структурного гена соответствующего оперона.
Очень важным для понимания того, как регулируется выражение генетической информации, содержащейся в хромосоме, является вопрос о том, в какой последовательности работает оперон. До 1960-х гг. предполагали, что транскрипция сопряжена с репликацией, поскольку для той и другой необходимо разделение нитей. В соответствии с этой моделью транскрипция начиналась из той же точки, что и репликация, и осуществлялась последовательно вдоль всей ДНК. В 1969 г. А. И. Коротяевым было постулировано и обосновано положение о том, что репликация и транскрипция идут независимо друг от друга, поскольку скорости их не сопоставимы, и поэтому каждый оперон имеет равную возможность для своего выражения в ходе жизненного цикла клетки – гипотеза равновероятностного выражения оперонов. Образно говоря, хромосому клетки можно сравнить с пианино. В хромосоме гены располагаются последовательно один за другим, контролируя разные реакции. У пианино клавиши располагаются также последовательно – в соответствии с нотами и октавами. Законченное музыкальное произведение создается не путем последовательного извлечения звуков вдоль клавиатуры, а путем их избирательной композиции. Выбор композиции – это и есть произведение. Точно так же для того, чтобы в клетке осуществлялось такое сочетание биохимических процессов, которое бы приводило к образованию законченных продуктов-белков, необходим правильный выбор соответствующих генов, ибо совокупность биохимических реакций, ведущих к синтезу необходимого продукта (продуктов), – это и есть законченное произведение «генетического пианино». Партитура этих произведений написана эволюцией живой материи.
Классическим примером организации и работы оперона служит модель лактозного оперона. Лактоза – дисахарид, она состоит из галактозы и глюкозы, соединенных β-галактозидной связью. Поэтому фермент, разрушающий эти связи, получил название β-галактозидазы. Лактозный оперон (рис. 44) содержит гены, которые контролируют синтез ферментов, участвующих в превращении лактозы: β-галактозидазу (z), галактозидпермеазу (y) и тиогалактозидтрансацетилазу (a). Ген-оператор (о) управляет одновременно выражением всей группы этих генов. В его составе содержится промотор (р), с которым взаимодействует РНК-полимераза. Лактозный оперон содержит 5500 нуклеотидных пар, в том числе: область о + р – 50 нуклеотидных пар; цистрон z – 3700 нуклеотидных пар; цистрон y – 900 нуклеотидных пар; цистрон a – 900 нуклеотидных пар.
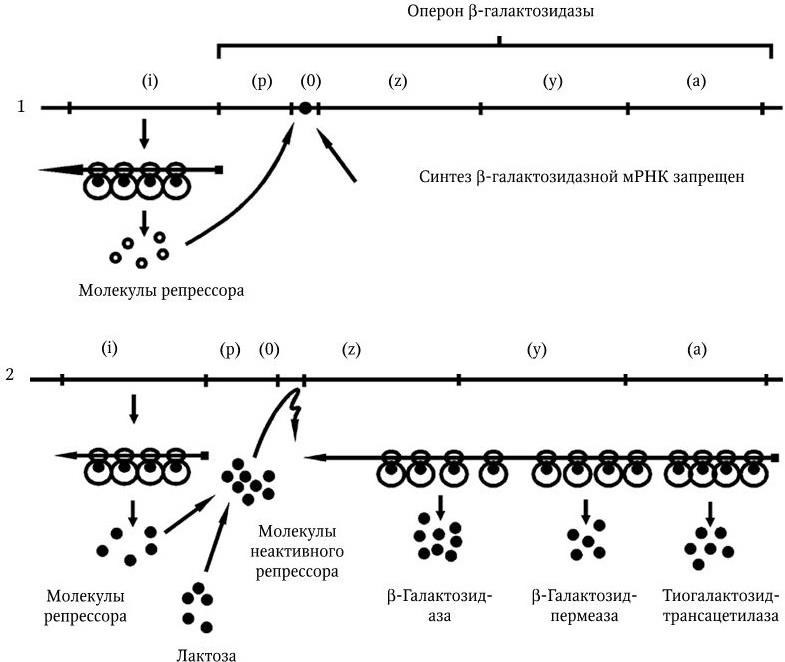
Рис. 44. Схема функционирования lac-оперона:
1 – работа оперона блокирована репрессором; 2 – оперон активно работает, молекулы репрессора инактивированы индуктором
Работа оперона находится под негативным контролем гена-регулятора (i), который контролирует синтез белка-репрессора. Белок-репрессор имеет м. м. около 150 – 200 кД. Он состоит из четырех субъединиц, имеющих м. м. 38 кД. Репрессор имеет два активных участка: с одним из них взаимодействует индуктор (лактоза или ее структурный аналог), а с помощью другого он прикрепляется к оператору. В отсутствие лактозы белок-репрессор связывается с оператором и блокирует выражение этого оперона. Когда в среде появляется лактоза, она связывается со вторым активным участком репрессора, это приводит к изменению его конформации по типу аллостерического эффекта, и он становится неактивным, репрессия оперона снимается, происходит активный синтез ферментов.
Негативный контроль работы лактозного оперона хорошо объясняет сущность феномена индукции: нет индуктора – оперон молчит, его работа заблокирована. Появился индуктор – оперон разблокирован и активно работает.
В основе другого феномена – феномена репрессии – лежит тот же принцип регуляции. Однако в репрессируемой системе ген-регулятор контролирует синтез апорепрессора, т. е. неактивного репрессора. Апорепрессор также имеет два активных центра: один – для взаимодействия с метаболитом (корепрессором), а другой – для специфического связывания с геном-оператором. Апорепрессор становится активным и подавляет работу оперона лишь после взаимодействия с соответствующим корепрессором (метаболитом).
Типичным примером репрессируемой системы является система синтеза ферментов пути образования триптофана у E. coli (рис. 45). В отсутствие триптофана апорепрессор неактивен и не блокирует работы триптофанового оперона. При избыточном содержании триптофана в среде, в которой размножается E. coli, он, выполняя роль корепрессора, связывается с апорепрессором и вызывает его аллостерическое превращение в активный репрессор. Последний связывается с геном-оператором, что и приводит к прекращению дальнейшей транскрипции структурных цистронов этого оперона и подавлению синтеза ферментов. Особенностью триптофанового оперона является наличие в нем между промоторно-операторным участком и его первым структурным цистроном особой последовательности приблизительно из 150 пар нуклеотидов, получившей название лидерной последовательности, или аттенуатора. Роль аттенуатора состоит в регуляции активности РНК-полимеразы. Суть феномена аттенуации заключается в том, что даже при незначительном избытке триптофана в клетке транскрипция оперона большинством молекул РНК-полимераз преждевременно обрывается в области аттенуатора (его терминатора). По мере же снижения концентрации триптофана все больше и больше молекул РНК-полимераз «проскакивают» этот участок и становятся способными транскрибировать весь оперон. Наоборот, при большом избытке триптофана его молекулы переводят апорепрессор в корепрессор, и транскрипция оперона подавляется. Следовательно, при наличии аттенуатора синтез ферментов может происходить как по правилу «все или ничего», так и по типу «больше – меньше». Аттенуаторы обнаружены и в других оперонах, осуществляя более экономичную их регуляцию.

Рис. 45. Функционирование триптофанового оперона:
а – аттенуатор; о – оператор; р – промотор
Помимо негативных, существуют и позитивные механизмы контроля выражения генетической информации. Они были обнаружены при изучении арабинозного оперона у E. coli (рис. 46). Этот оперон включает три гена – araA, araB, araD (1 мин), кодирующих синтез ферментов, и три гена – araE (61 мин), araF, araG (45 мин), кодирующих транспортные белки. Они расположены в разных участках хромосомы и образуют три самостоятельных оперона, один из которых состоит из трех сцепленных структурных генов (araBAD).
Выражение всех оперонов контролируется геном araC, расположенным рядом с проксимальным концом araBAD-оперона и отделенным от него общей регуляторной областью. Продукт гена araC – аллостерический белок, который может существовать в двух альтернативных конформациях: Р1 – сам белок; Р2 – белок в комплексе с арабинозой. Белок Р1 является репрессором для всех оперонов (araBAD, araE и araG). Белок Р2 в результате взаимодействия с арабинозой изменяет свою конформацию (аллостерический эффект) и выступает в качестве активатора araBAD-оперона. Следовательно, продукт гена araC осуществляет как негативную, так и позитивную регуляцию транскрипции.
В регуляторной области имеются следующие участки: промотор; инициатор (с ним связывается Р2); участок, с которым связывается белок-активатор катаболизма (БАК) в комплексе с цАМФ и оператор (место связывания Р1). При наличии в среде арабинозы Р1 связывается с ней и превращается в активатор Р2. Поэтому комплекс БАК – цАМФ присоединяется к соответствующему участку ДНК. В результате этого Р2 стабильно связывается с инициатором и стимулирует присоединение к промотору все новых молекул РНК-полимеразы, а последние осуществляют многократную транскрипцию araBAD-оперона и соответственно происходит многократная трансляция. При отсутствии арабинозы или при ее полном потреблении Р2 возвращается в репрессорную форму Р1 и блокирует оператор.
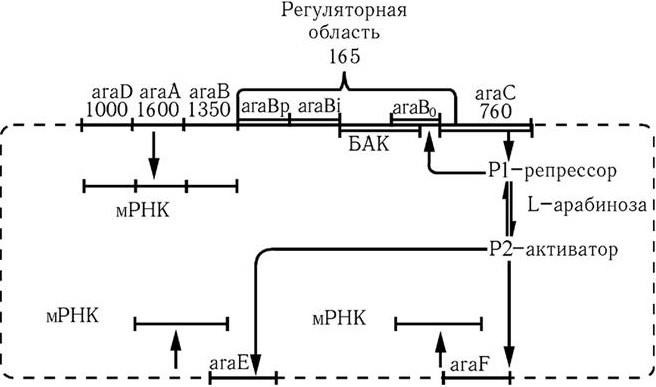
Рис. 46. Модель негативно-позитивного контроля выражения L-арабинозной системы.
Цифры обозначают число пар нуклеотидов в генах
Система позитивного контроля является необходимым атрибутом координированного управления различными оперонами. Так, например, в арабинозной системе пермеазный ген (araE) пространственно разобщен со всеми остальными генами. Если он является частью какого-то другого оперона (оперона Х), он требует позитивного контроля в форме активатора (Р2), чтобы вывести его из-под контроля, осуществляемого опероном Х.
Таким образом, благодаря сочетанию механизмов индукции и репрессии, негативного и позитивного контроля выражения генетической информации, обеспечивается определенная координация между различными функциональными группами оперонов.
В конце XX в. был обнаружен еще один механизм регуляции передачи генетической информации. Он получил название РНК-интерференция (RNA-interference), или РНК-и, а проще назвать этот процесс контролем, или цензурой потока генетической информации с помощью двухцепочечной РНК, поскольку именно такую, «цензорную» функцию выполняет двухцепочечная РНК.
Еще в начале 80-х гг. XX в. в опытах с E. coli было установлено, что введение в клетку синтетических фрагментов одноцепочечной РНК может приводить к блокированию некоторых генов. В 1997 г. американские ученые Эндрю Файер (Andrew Z. Fire) и Крэйг Мелло (Craig C. Mello) с группой соавторов в опытах с червем Caenorhabditis elegans установили, что такое блокирование генов происходит значительно эффективнее, если вводить короткие фрагменты не одно-, а двухцепочечной РНК. (Статья об этом открытии была опубликована в журнале «Nature», Vol. 391, 19 February 1998, pp. 806 – 811). К. Мелло дал этому феномену название «РНК-интерференция». Механизм РНК-интерференции пока полностью не изучен и заключается, по-видимому, в следующем. При попадании в клетку молекулы двухцепочечной РНК индуцируют работу группы ферментов, которые разрезают РНК на очень короткие фрагменты, затем расплетают их на отдельные нити и с помощью этих нитей удаляют из мРНК соответствующие участки. В результате этого содержащаяся в них информация утрачивается и не доходит до рибосом. Этот механизм оказался универсальным. Им владеют все живые существа от бактерий до млекопитающих. С помощью этого механизма прицельного блокирования (генной цензуры), осуществляемого РНК-и, разрушается попавшая в организм чужеродная генетическая информация (например, различных вирусов) и контролируется работа собственных генов, т. е. подавляется работа тех из них, в которых возникли опасные мутации, или вырезаются и уничтожаются транспозоны, которые могут вызвать опасные мутации. За открытие этого фундаментального механизма регуляции переноса генетической информации Э. Файер и К. Мелло в 2006 г. были удостоены Нобелевской премии в области физиологии и медицины. Эти исследования помогут разработке более эффективных способов профилактики и лечения тех заболеваний, от которых в настоящее время умирает больше всего людей, а именно: сердечно-сосудистых, онкологических и вирусных (в том числе ВИЧ-инфекции и гепатитов).
Формы обмена генетическим материалом у бактерий
Помимо основного механизма передачи генов – по наследству (по вертикали), у бактерий существуют следующие формы обмена генетическим материалом по горизонтали, т. е. между отдельными особями в популяции клеток: трансформация, трансфекция, трансдукция, конъюгация и сексдукция.
Трансформация – перенос генетического материала, заключающийся в том, что бактерия-реципиент захватывает (поглощает) из внешней среды фрагменты чужеродной ДНК. Трансформация может быть спонтанной или индуцированной. Индуцированная (искусственно получаемая) трансформация происходит при добавлении к культуре бактерий очищенной ДНК, полученной из культур тех бактерий, генетические признаки которых стремятся передать исследуемой культуре. Спонтанная трансформация происходит в естественных условиях и проявляется в возникновении рекомбинантов при смешивании генетически различающихся клеток. Она протекает за счет ДНК, выделяющейся клетками в окружающую среду вследствие их лизиса или в результате активного выделения ДНК жизнеспособными клетками-донорами. Как спонтанная, так и индуцированная трансформация сводится, по сути, к поглощению трансформирующей ДНК и образованию рекомбинантов, причем спонтанная трансформация может происходить в результате взаимного обмена ДНК. Эффективность индуцируемой трансформации во многом зависит от физиологического состояния клеток-реципиентов. Они должны находиться в состоянии своеобразной компетентности для этого процесса. Предполагается, что в фазе компетентности происходят значительные изменения поверхностных слоев клетки, которые способствуют поглощению ДНК. В частности, аутолитические ферменты клетки растворяют клеточную стенку в тех участках, где происходит ее синтез. При этом мезосомы через образовавшиеся отверстия соприкасаются с внешней средой, адсорбируют и втягивают внутрь клетки трансформирующую ДНК, где она и вступает в рекомбинацию с ДНК реципиента. В результате этого образуется мерозигота, клетка делится, и ее потомки наследуют признаки, полученные от донора и реципиента. Однако в других случаях поглощенные фрагменты ДНК разрушаются нуклеазами клетки-реципиента, и трансформации не происходит. Ее эффективность зависит также от размеров трансформирующей ДНК: высокомолекулярная ДНК поглощается труднее, чем менее крупные ее фрагменты. Способность к трансформации обнаружена у ряда родов бактерий, но, по-видимому, роль ее в обмене генетическим материалом среди бактерий в естественных условиях менее существенна, чем роль других механизмов. Дело в том, что у многих бактерий имеются особые системы рестрикции и модификации. Эти системы модифицируют свою ДНК (чаще всего путем ее метилирования) и разрушают чужеродную ДНК, если она подобным образом не модифицирована, с помощью особых ферментов – рестрикционных эндонуклеаз.
Эффективность метода генетической трансформации во много раз повышается в том случае, если смесь ДНК и трансформируемых клеток с помощью специального прибора подвергнуть обработке электрическим импульсом. Метод электротрансформации является универсальным, он применим к любым видам бактерий. С помощью этого метода осуществлена трансформация более 100 видов бактерий, и он может стать важным инструментом получения ценных рекомбинантных штаммов бактерий.
Трансфекция – вариант трансформации бактериальных клеток, лишенных клеточной стенки, осуществляемый вирусной (фаговой) нуклеиновой кислотой.
С помощью трансфекции удается вызвать у таких бактерий (без клеточной стенки)
вирусную инфекцию. Трансфекцию можно осуществить и с другими (не бактериальными) клетками, если ввести в них чужеродную ДНК, способную рекомбинировать с ДНК этих клеток, или воспроизводить вирионы, или самостоятельно реплицироваться.
Трансдукция – перенос генетического материала от клетки-донора клетке-реципиенту с помощью бактериофагов. Различают трансдукцию неспецифическую и специфическую.
Неспецифическая трансдукция – случайный перенос фрагментов ДНК от одной бактериальной клетки к другой.
Специфическая трансдукция осуществляется только умеренными фагами, обладающими способностью включаться в строго определенные участки хромосомы бактериальной клетки и трансдуцировать определенные гены.
Механизмы неспецифической и специфической трансдукции описаны в главе 47.
Конъюгация – это процесс обмена генетическим материалом (хромосомным и плазмидным), осуществляемый при непосредственном контакте клеток донора и реципиента. Процесс контролируется только конъюгативными плазмидами, имеющими совокупность генов, называемую tra-опероном (англ. transfer – перенос). Этот оперон контролирует синтез аппарата переноса, конъюгативную репликацию и явление поверхностного исключения. Аппаратом переноса являются специальные донорные ворсинки, с помощью которых устанавливается контакт между конъюгирующими клетками. Донорные ворсинки представляют собой длинные (1 – 20 мкм) тонкие трубчатые структуры белковой природы с внутренним диаметром около 3 нм. Число донорных пилей у каждой F+-клетки невелико и, очевидно, соответствует числу копий конъюгативной плазмиды в клетке. Донорные ворсинки обнаруживают с помощью донорспецифических фагов, которые, адсорбируясь на них, проникают в клетку и вызывают ее лизис. Для каждой группы конъюгативных плазмид существуют свои донорспецифические фаги. Ворсинки выполняют следующие функции: 1) с их помощью устанавливается контакт между донорной и реципиентной клетками; 2) они облегчают перенос нити ДНК (она, вероятно, протаскивается через ворсинку); 3) стягивают спаривающиеся клетки, что повышает эффективность конъюгации.
Процесс конъюгации протекает через следующие стадии: установление контакта между донором и реципиентом, протаскивание нити ДНК от донора к реципиенту, достройка перенесенной нити ДНК комплементарной ей нитью в реципиентной клетке и рекомбинация между переданной хромосомой (ее фрагментами) и хромосомой клетки-реципиента, размножение мерозиготы и образование клеток, несущих признаки донора и реципиента.
Сущность поверхностного исключения заключается в том, что под контролем traгенов синтезируются белки наружной мембраны, препятствующие (исключающие возможность) проникновению в клетку, несущую плазмиду, другой, но близкородственной ей плазмиды, или подавляющие конъюгативную репликацию ее ДНК.
Конъюгативная репликация переносимой нити хромосомной или плазмидной ДНК осуществляется также под контролем плазмидных генов. Классическим примером конъюгативной плазмиды является половой фактор, или F-плазмида (F – англ. fertility – плодовитость). Эта плазмида представляет собой двунитевую кольцевидную молекулу ДНК, состоящую из 94,5 тыс. п. н.
Главная функция этой плазмиды – контроль конъюгации у бактерий кишечной группы. Ее tra-оперон содержит больше тридцати генов, которые контролируют процесс конъюгации. Эта плазмида может как находиться в автономном состоянии, так и интегрироваться в хромосому клетки. Находясь в автономном состоянии, она контролирует только собственный перенос, при котором F--клетка (клетка, лишенная F-плазмиды) превращается в F+-клетку (клетку, содержащую F-плазмиду). F-плазмида может интегрироваться в определенные участки бактериальной хромосомы, в этом случае она станет контролировать конъюгативный перенос хромосомы клетки. При этом одна из нитей ДНК хромосомы в месте интеграции F-плазмиды разрезается, и ее 5'-конец через донорный мостик начинает протягиваться в клеткуреципиент. Репликация ДНК в этом случае протекает по принципу «крутящегося кольца» (рис. 47). Таким образом, конъюгация начинается с установления контакта между донором и реципиентом с помощью донорной ворсинки. Последняя смыкается с рецептором клеточной мембраны клетки-реципиента. Нередко такой контакт устанавливается не только между двумя клетками, а между многими клетками, образуя агрегаты спаривания. Предполагают, что нить ДНК в процессе конъюгации протаскивается через канал донорной ворсинки. Поскольку донорный мостик является непрочным, процесс конъюгации может в любой момент прерваться. Поэтому при конъюгации может переноситься или часть хромосомы, или, реже, полная хромосома. С помощью F-плазмид частота переноса генов между бактериями существенно возрастает. Поэтому клетки, у которых F-плазмида интегрирована в хромосому, обозначают как клетки Hfr (Hfr – англ. high frequency recombination – клетки, обеспечивающие высокую частоту рекомбинаций).
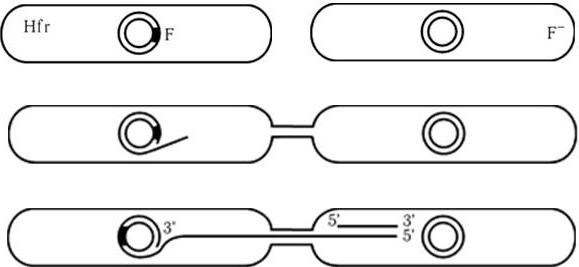
Рис. 47. Конъюгационный перенос бактериальной ДНК
В некоторых случаях интегрированная в хромосому F-плазмида может из нее исключаться и, подобно умеренному фагу, «выхватывать» из хромосомы ее ген или даже целую группу генов. Такая плазмида, содержащая в своей ДНК часть генов хромосомы клетки, называется F'-плазмидой.
Сексдукция – перенос генетического материала между бактериальными клетками, осуществляемый F'-плазмидой с помощью механизма, аналогичного специфической трансдукции.
Генетические рекомбинации у бактерий
Заключительным этапом при любой форме обмена генетическим материалом является рекомбинация между привнесенной ДНК и хромосомой клетки-реципиента. Если переносится одна нить ДНК, то она вначале достраивается комплементарной ей нитью; рекомбинируют между собой только двунитевые ДНК. Различают общую рекомбинацию, сайт-специфическую рекомбинацию и рекомбинацию, контролируемую транспонируемыми элементами. Общая рекомбинация происходит между гомологичными ДНК. Сайт-специфическая рекомбинация происходит за счет наличия специфических участков у рекомбинируемых молекул ДНК. Ее примером является специфическая рекомбинация между умеренным фагом λ и хромосомой E. coli. Как в бактериальной хромосоме, так и в ДНК фага λ имеются специфические участки (attB и attP соответственно), между которыми и происходит сайт-специфическая рекомбинация. Общая и сайт-специфическая рекомбинация контролируется геном recA.
Рекомбинации, осуществляемые транспонируемыми элементами, тоже являются сайт-специфическими, но специфичность этих сайтов связана с особыми нуклеотидными последовательностями, и эта форма рекомбинации не зависит от recA-гена.
Главным генетическим детерминантом всех путей рекомбинации является ген recA. Его повреждение полностью исключает возможность образования рекомбинантов. Основной способ recA-рекомбинации осуществляется с участием продуктов генов recB и recC (они кодируют синтез эндонуклеазы V). В случае мутации по recB и recC выход рекомбинантов составляет около 20 % от rec+. Однако эти мутации могут быть исправлены путем супрессии в двух генах: sbcA- и sbcB-. Супрессии sbcA– открывают дополнительный путь рекомбинации через ген recE (его продукт – экзонуклеаза VIII). Супрессии sbcB- реализуют рекомбинации через ген recF (структурный ген экзонуклеазы I). Таким образом, генетический контроль рекомбинаций носит сложный характер.
Изучение его механизма – одна из центральных задач молекулярной генетики. Особый интерес представляет изучение механизма гомологической рекомбинации. Это определяется перспективами развития молекулярной медицины. Одной из важнейших стратегических задач, поставленных перед программой «Геном человека», является обнаружение изменений первичной структуры ДНК, которые приводят к нарушению функции генов и, как следствие этого, к развитию наследственных заболеваний человека. Идеальным методом лечения их является генотерапия, основанная на замене поврежденного («больного») гена здоровым. Такая замена может быть осуществлена только с помощью гомологической рекомбинации, механизмы которой у бактерий и эукариот, очевидно, во многом сходны. У бактерий выявлены два способа такой рекомбинации, осуществляемых двумя типами рекомбиназ: АТФ-зависимым белком RecA и АТФ-независимой ренатуразой. Соответственно, и у эукариот обнаружены АТФ-зависимые и АТФ-независимые ДНК-трансферазы, среди которых найдены белки, функционально сходные с RecA-белком бактерий.
Решающая роль в гомологической рекомбинации у бактерии, как указано выше, принадлежит гену recA. Его продукт – белок RecA c м. м. 38 кД – выполняет ряд уникальных функций: 1) прочно связывается с одиночными нитями ДНК; 2) способствует высвобождению разорванной нити из двойной спирали ДНК; 3) одновременно может присоединяться и к двойной спирали ДНК, и к одиночной нити и удерживать их вместе; 4) обладает свойством ДНК-зависимой АТФазы. Благодаря этому свойству обеспечивается серия конформационных изменений, которые обусловливают превращение трехнитевого комплекса с неспаренными основаниями в трехнитевый комплекс со спаренными основаниями. С помощью этой реакции происходит прямое комплементарное взаимодействие между одиночной нитью ДНК и двойной спиралью – главное событие в процессе рекомбинации. Энергия гидролиза АТФ RecA-белком используется последним для продвижения одиночной нити вдоль двойной спирали ДНК с целью нахождения того ее участка, который имеет гомологичную последовательность нуклеотидов, необходимую для замыкания водородных связей, т. е. для спаривания.
Для объяснения механизма гомологической рекомбинации предложены разные модели. В соответствии с наиболее популярной моделью, рекомбинация инициируется с помощью однонитевого разрыва в одной из двух гомологичных молекул ДНК, вызываемого эндонуклеазой, которая кодируется генами recB и recC. Образующийся при этом конец (3'– или 5'-конец) однонитевой ДНК (онДНК) атакует двойную спираль другой молекулы ДНК, отыскивая в ней гомологичный участок, и образует временную трехнитевую структуру (рис. 48, 1). В результате спаривания атакующей молекулы онДНК с комплементарной нитью другой молекулы ДНК происходит выталкивание ее освобождающейся нити (рис. 48, 2), которая в свою очередь спаривается с комплементарной нитью другой молекулы ДНК. Во время этих событий часто наблюдается удаление некоторого количества нуклеотидов, репарация образующейся бреши и лигирование ДНК, но в конечном счете образуется (рис. 48, 3) предсказанная Р. Холидеем полухиазма (греч. chiasmos – расположение в виде греческой буквы Х – хи). Парными стрелками указаны места «разрешения» полухиазмы (см. рис. 48, 3). Разрешение в одном варианте (полые стрелки) приведет к обмену фрагментами онДНК между спаривающимися молекулами ДНК, в другом (черные стрелки) – к полному кроссинговеру на уровне двунитевых ДНК.
В случае обмена с перекрещиванием нитей обе гомологичные спирали ДНК после начального этапа спаривания удерживаются вместе благодаря перекрестному обмену нитями из имеющихся четырех – по одной нити от каждой спирали. Структура, образующаяся при этом, обладает двумя важными свойствами:
1. Точка обмена между двумя гомологичными спиралями, т. е. место, где скрещиваются две их нити, может быстро мигрировать по спирали. Этот процесс получил название миграции ветвей. Миграция может значительно увеличивать области спаривания между двумя взаимодействующими нитями, изначально принадлежавшими разным молекулам ДНК.
2. Эта структура, благодаря вращению составляющих ее элементов относительно друг друга, может находиться в различных изомерных формах. Изомеризация изменяет положение двух пар нитей: две ранее перекрещивающиеся нити становятся неперекрещивающимися, и наоборот. Для прекращения процесса спаривания в каждой из двух нитей должен произойти разрыв. Если он произойдет до изомеризации, то у каждой спирали будет заменена только одна из нитей и только на коротком отрезке. Если же разрыв произойдет после изомеризации, наступит полный кроссинговер.
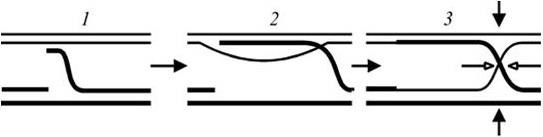
Рис. 48. Образование полухиазмы Холидея при асимметричном характере инициирования рекомбинации (по В. А. Ланцову):
1 – однонитевый разрыв в одной из двух гомологичных молекул ДНК; 2 – выталкивание высвобождающейся при спаривании нити ДНК и спаривание последней с комплементарной нитью другой молекулы ДНК; 3 – образование полухиазмы
Фермент ренатураза (33 кД) кодируется у E. coli геном recE. Он относится к классу «гомологических ДНК-синаптаз», которые, в отличие от RecA-белка, не обладают ДНК-трансферазной активностью и не зависят от АТФ. Эти белки участвуют в реакциях гомологической рекомбинации, индуцированных двунитевыми разрывами ДНК.
Ген recA участвует не только в процессе рекомбинации, его продукт необходим для пострепликативной репарации, индукции профага, клеточного деления и ряда других жизненно важных для бактерий функций. Рецессивные мутации в этом гене неизбежно отражаются на всех этих функциях, поэтому они получили название SOS-функций, а их совокупность объединена в единую SOS-систему (англ. SOS – сигнал бедствия: save our souls – спасите наши души или save our ship – спасите наш корабль).
Выражение любой SOS-функции зависит от активности продукта recA-гена. SOSсистема срабатывает после любых воздействий на ДНК агентами, которые повреждают ее структуру, или нарушают нормальный процесс ее репликации, или нарушают другие функции. Поэтому recA-гену принадлежит ведущая роль в обеспечении самозащиты генетической системы бактериальной клетки.
Молекулярные механизмы изменчивости бактерий. Организация геномов
Бактерии в силу относительной простоты их организации и короткого срока жизни подвергаются изменчивости быстрее, чем многие другие организмы. В основе их изменчивости лежат мутации и генетические рекомбинации, особенно протекающие с участием транспонируемых элементов.
Мутации – изменения в генотипе, которые стабильно наследуются. Мутации могут быть спонтанными или индуцированными. Спонтанные мутации возникают без каких-либо специальных воздействий, они происходят в результате ошибок при репликации и репарации. Средняя частота спонтанных мутаций составляет около 1 ⋅ 10-6 (одна мутантная клетка на 1 млн клеток).
Индуцированные мутации происходят с гораздо большей частотой, они возникают в результате воздействия различных мутагенов. К ним относятся физические и химические факторы, повреждающие ДНК (ионизирующая радиация, УФ-облучение, различные аналоги оснований ДНК, алкилирующие соединения, акридины, антибиотики и т. п.). Молекулярные механизмы спонтанных и индуцированных мутаций одинаковы. Точечные мутации могут быть обусловлены заменой оснований, выпадением (делецией) основания или появлением дополнительного основания (вставки). Различают простую замену оснований, или транзицию, при которой пурин заменяется на пурин, а пиримидин – на пиримидин, и сложную, или трансверсию, при которой происходит замена пурина на пиримидин или наоборот. Точечные мутации могут иметь три последствия: замена одного кодона на другой, а стало быть, одной аминокислоты на другую;
сдвиг рамки считывания, что приведет к изменению целой серии последовательностей аминокислотных остатков; возникновение «бессмысленного» кодона (УАГ, УГА, УАА), что приведет к прекращению трансляции в данной точке. В результате таких точечных мутаций синтез белка может быть полностью заблокирован за счет «бессмысленного» кодона, либо будет синтезироваться измененный (неактивный) белок, что приведет либо к утрате какого-то фенотипического признака у мутанта, либо, реже, к появлению у него нового признака. Получение индуцированных мутаций (мутантов) – один из основных способов изучения генетики микроорганизмов.
Эффекты мутаций могут быть устранены либо путем репарации поврежденного участка гена, либо с помощью супрессорных мутаций, т. е. мутаций в других генах, устраняющих или нейтрализующих эффект первичной мутации. Помимо точечных мутаций, нарушение генома может быть следствием протяженных делеций, инверсии (поворот сегмента хромосомы на 180°) или транслокации (перемещение участка хромосомы из одной позиции в другую). Все это также будет приводить к изменению и нарушению различных функций клетки (организма).
Судьба мутантных организмов зависит от степени сохранения их жизнеспособности. Мутации у микроорганизмов, связанные с приобретением лекарственной устойчивости, придают им важные селективные преимущества в условиях повсеместного применения антибиотиков и различных других химиопрепаратов.
Известно, что многие белки близки по своим функциям и аминокислотной последовательности. Поэтому вполне вероятно, что они могли возникнуть от какого-то единственного предкового гена в результате процессов его дупликации и дивергенции. Возникновение новых генов путем дивергенции также играло важную роль в эволюции организмов.
Большая роль в изменчивости бактерий и других организмов принадлежит так называемым транспонируемым генетическим элементам, т. е. генетическим структурам, способным в интактной форме перемещаться внутри данного генома или переходить от одного генома к другому, например от плазмидного генома к бактериальному и наоборот. Различают три класса транспонируемых элементов: IS-элементы, транспозоны и эписомы.
IS-элементы, или вставочные последовательности (англ. insertion sequence), имеют обычно размеры, не превышающие 2 тыс. пар оснований, или 2 кб (килобаза – тысяча пар оснований). IS-элементы несут только один ген, кодирующий белок транспозазу, с помощью которой IS-элементы встраиваются в различные участки хромосомы. Их обозначают цифрами: IS1, IS2, IS3 и т. д.
Транспозоны (Tn) представляют собой более крупные сегменты ДНК, фланкированные инвертированными IS-элементами. Транспозоны также способны встраиваться в различные участки хромосомы или переходить от одного генома в другой, т. е. ведут себя как IS-элементы, но помимо генов, обеспечивающих их транспозиции, они содержат и другие гены, например гены лекарственной устойчивости.
Очень часто транспозоны содержатся в составе R-плазмид. Транспозоны обнаружены в геномах плазмид, вирусов, прокариот и эукариот, поэтому с их способностью переносить гены из одного генома в другой связывается исключительно важная роль, которую играют транспозоны и вообще транспонируемые элементы в эволюции живой материи. Транспозоны, как и IS-элементы, обозначают порядковым номером: Tn1, Tn2, Tn3 и т. д.
Эписомы. К эписомам относятся еще более крупные и сложные саморегулирующиеся системы, содержащие IS-элементы и транспозоны и способные реплицироваться в любом из двух своих альтернативных состояний – автономном или интегрированном – в хромосому клетки-хозяина.
К эписомам относят различные умеренные лизогенные фаги; они отличаются от всех других транспонируемых элементов наличием собственной белковой оболочки и более сложным циклом репродукции. Собственно эписомы – это вирусы, обладающие, подобно другим транспонируемым элементам, способностью в интактной форме переходить из одного генома в другой.
Таким образом, природа использовала все возможности, вытекающие из особенностей структуры ДНК, для эволюции живой материи: мутации генов, их дупликации, генетические рекомбинации и мобильность некоторых генетических элементов.
Хромосомы бактерий, как правило, имеют кольцевидную структуру. Исключение составляют Borrelia burgdorferi и некоторые фитопатогенные бактерии – у них хромосомы линейные. Гены во всех хромосомах располагаются линейно, и их последовательность можно установить. Это позволит создать генетическую энциклопедию бактерий и других организмов, т. е. связать все жизненные процессы с конкретными генами. Хромосомную карту у E. coli начали составлять, изучая время переноса генов при конъюгации, которую прерывают через разные промежутки времени. Поэтому локализацию генов на хромосоме определяют в минутах их переноса от 0 до 100 мин (время полного переноса хромосомы у E. coli). За начало переноса условно принято положение гена thr (треонинового оперона). Определение локализации генов на хромосоме называется их картированием, а их расположение – хромосомной картой, масштаб которой выражается в минутах (рис. 49). К 1961 г. у E. coli было картировано 60 генов, а к 1988 г. – уже более 1000. Одновременно проводилось картирование генов и у других микроорганизмов.
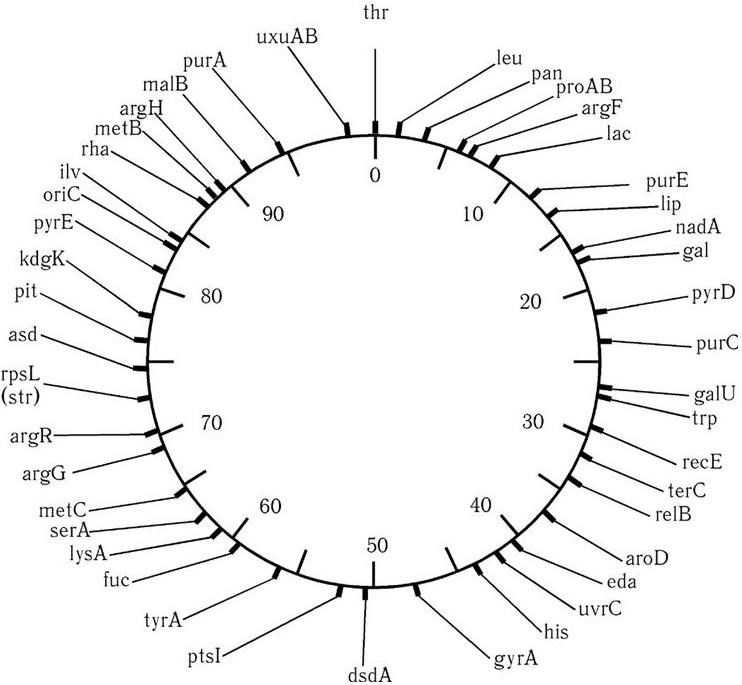
Рис. 49. Сокращенная хромосомная карта E. coli K-12
В настоящее время изучение геномов не ограничивается только картированием генов, стало возможным изучать последовательность расположения нуклеотидов в составе любого гена. Решающими шагами на пути к решению этой проблемы явились применение особых ферментов – рестрикционных эндонуклеаз – и разработка метода клонирования генов.
Рестрикционные эндонуклеазы (рестриктазы) – ферменты, расщепляющие ДНК в специфических участках нуклеотидных последовательностей, которые они распознают. Эти ферменты обнаружены у многих бактерий. Они распознают и разрушают чужеродные молекулы ДНК, попадающие в клетку, в том числе при инфицировании их фагами или при трансформации. Таких ферментов обнаружено более 100, и каждый из них распознает в ДНК специфическую последовательность из 4 – 6 нуклеотидов. Каждая рестриктаза способна разрезать двойную спираль ДНК любой длины. При этом образуется серия фрагментов, называемых рестрикционными фрагментами. Сравнение размеров этих фрагментов, полученных при обработке бактериальных или плазмидных геномов (а также ДНК хромосом эукариот), позволяет создавать рестрикционные карты, в которых отмечается локализация каждого разреза участка относительно соседних участков других таких разрезов (рестрикций). Существенно, что многие рестриктазы вносят разрывы в обе цепи ДНК со смещением на несколько нуклеотидов. Вследствие этого на конце нити одного фрагмента образуется участок, нуклеотидные последовательности которого оказываются комплементарными нуклеотидным последовательностям другой нити с другого конца фрагмента. Такие концевые последовательности, комплементарные друг другу, получили название липких концов. С их помощью образовавшиеся рестрикционные фрагменты будут вновь образовывать кольца в результате спаривания липких концов.
Способность рестрикционных нуклеаз разрезать ДНК с образованием липких концов широко используется в технологии создания рекомбинантных ДНК, так как при помощи липких концов можно соединить два любых фрагмента ДНК, если они получены с помощью одной и той же рестриктазы и, следовательно, имеют комплементарные липкие концы. После замыкания последних путем образования комплементарных пар оснований образовавшееся кольцо из фрагментов разных ДНК можно сшить ковалентными фосфодиэфирными связями между противоположными концами каждой нити ДНК с помощью ДНК-лигазы. В этом заключается суть технологии получения рекомбинантных молекул ДНК.
Метод клонирования состоит в том, что выделенный фрагмент ДНК (ген) с помощью технологии создания рекомбинантных молекул вводится в состав самореплицирующейся генетической структуры. Чаще всего для этого используются плазмиды или вирусы. При использовании плазмид в качестве векторов для клонирования молекулы плазмидной ДНК разрезают рестриктазой, а затем сшивают с фрагментом ДНК – геном, который подлежит клонированию, т. е. накоплению. Затем такие гибридные плазмиды выделяют из клеток и, обрабатывая той же рестриктазой, вырезают из них копии исходного гена. Таким способом можно получить большое количество любого гена. Уже разработаны технологии производства трансгенных растений и животных и даже клонирования животных. Однако использовать эти достижения, конечно, нужно, только если они не причинят ущерба здоровью человека и благополучию человечества.
Последовательность расположения нуклеотидов в клонированном фрагменте ДНК изучают с помощью особой технологии секвенирования, суть которой состоит в одновременном разрезании специфическими агентами четырех образцов одной и той же ДНК по каждому из четырех оснований (А, Т, Ц и Г) с последующим разделением образующихся фрагментов в геле. С помощью этой методики можно определить полную нуклеотидную последовательность (НП) любого гена, а на основе генетического кода – аминокислотную последовательность соответствующего белка. Разработка и совершенствование методов клонирования и секвенирования позволяют изучить геном любого организма, в том числе и человека. Ранее всего был изучен геном бактериального вируса φХ174. Он состоит из 5400 нуклеотидов и содержит 9 генов. Высочайшая эффективность созданного природой генетического кода видна из следующего сопоставления. Вирус φХ174 можно увидеть только с помощью электронного микроскопа, а запись его генетической информации, содержащейся в 9 генах, в виде линейной последовательности через буквы (А, Т, Г, Ц) занимает целую страницу текста. Запись в таком же виде информации, имеющейся в хромосоме животной клетки, составит книгу объемом более 500 000 страниц!
Уже полностью изучена н. п. хромосомных ДНК у более чем сотни микроорганизмов, включая Escherichia coli, Yersinia pestis, Mycobacterium tuberculosis и др. Хромосома E. coli К-12 состоит из 4 639 000 п. н. (4288 генов), из них на кодирующую часть генома приходится 88,6 %. У других бактерий доля кодирующей части генома варьирует от 85 до 91 %. Средний размер гена – 1 к. б., у E. coli – 0,951 к. б. Хотя на некодирующие НП приходится малая часть генома, роль их, в особенности IS-элементов, транспозонов и т. п., в некоторых генетических процессах очень велика. Есть в геноме бактерий и «серые дыры», т. е. НП с неизвестной функцией. Большая чать оперонов у E. coli состоит не более чем из 3 генов, лишь 6 % оперонов состоят из 4 и большего числа генов. В хромосомах разных видов бактерий обнаружены гены-гомологи, т. е. гены с идентичной последовательностью нуклеотидов. Идентичные (=гомологичные) гены у разных видов называют ортологами. Например, около 1000 генов Bacillus subtilis имеют ортологов в геноме E. coli. Наличие ортологов – доказательство общности происхождения видов.
Для изучения генома человека, которое началось в 80-х гг. ХХ в., была создана международная организация по изучению генома человека – HUGO (англ. Human Genome Organization – Организация генома человека). Ее основная задача – определить последовательное расположение всех нуклеотидов (а их около 3 ⋅ 109 пар) во всех 23 парах хромосом – была успешно решена к концу 2000 г. Предстоит теперь выяснить функции всех генов, молекулярные основы наследственных и иных болезней, связанных с нарушением работы генов, и определить пути лечения таких болезней, в том числе с использованием методов генной инженерии. Рано или поздно генотерапия станет вполне реальной. Полное осуществление программы «Геном человека» – новое блестящее достижение науки в области биологии и медицины.
Плазмиды бактерий как наипростейшие организмы
Впервые обнаруженные у E. coli генетические элементы, которые передавались у нее по наследству во внехромосомном состоянии, получили название просто генетических факторов. Раньше всего были обнаружены Col-фактор (фактор, контролирующий у E. coli синтез бактерицидных белков, А. Грациа, 1925) и F-фактор (фактор, контролирующий примитивный половой процесс у бактерий – конъюгацию, У. Хэйс, 1953). Интерес к этим факторам сильно возрос после того, как в 1963 г. японский ученый Т. Ватанабе сообщил, что передача множественной лекарственной устойчивости у дизентерийных бактерий происходит также при участии независимых от хромосомы генетических элементов, названных R-факторами (англ. resistance – устойчивость). В 1976 г. всем подобного рода генетическим элементам было дано название плазмид и следующее определение: «Плазмида (экстрахромосомный генетический элемент) представляет собой репликон, который стабильно наследуется в экстрахромосомном состоянии». Однако это определение обходит вопрос о том, являются ли плазмиды организмами или нет, оно оставляет открытым вопрос о месте плазмид в живой природе.
Поскольку плазмиды имеют собственные гены, которые наделяют их специфическими наследственными признаками и способностью к размножению, они должны быть несомненно отнесены к живым организмам. Плазмиды обладают большим сходством с вирусами, поэтому их следует объединить с ними в одно царство в качестве самостоятельного класса. С вирусами их объединяют следующие общие фундаментальные признаки: 1) подобно вирусам, плазмиды не имеют собственной белоксинтезирующей системы; 2) как и у вирусов, у них нет собственной системы мобилизации энергии; 3) плазмиды, как и вирусы, не способны к росту и бинарному делению, они размножаются путем воспроизведения себя из собственного генома (путем саморепликации его); 4) плазмиды, подобно вирусам, являются абсолютными внутриклеточными паразитами.
Вместе с тем плазмиды существенным образом отличаются от вирусов, и поэтому они должны рассматриваться как самостоятельная, обособленная от вирусов группа организмов. Главные отличия плазмид от вирусов следующие:
1. Геном плазмид представлен только двунитевой ДНК, у вирусов же имеется более 10 вариантов РНК– и ДНК-геномов. Правда, у некоторых грамположительных бактерий плазмиды существуют не только в виде двунитевых молекул ДНК, но и в виде однонитевых. Однако каждая из них соответствует одной из двух нитей плазмидной ДНК (на долю таких однонитевых молекул приходится не более 1/3 общего количества копий плазмиды), и в результате репликации, происходящей по типу «крутящегося кольца» (см. главу 11), однонитевая молекула превращается в двунитевую молекулу плазмидной ДНК.
2. Плазмиды, в отличие от вирусов и других микроорганизмов, вообще не имеют никакой оболочки. Они представляют собой «голые» геномы. Это их главная биологическая особенность.
3. В связи с отсутствием белковой оболочки размножение плазмид происходит только путем саморепликации их ДНК и не требует синтеза структурных белков и процессов самосборки.
4. Средой обитания вирусов являются клетки бактерий, растений и животных. Средой обитания плазмид – только бактерии.
5. Плазмиды обладают системами генов, которые наделяют их способностью к самопереносу или к мобилизации на перенос из клетки в клетку.
6. Плазмиды и вирусы отличаются друг от друга и по тем последствиям, к которым приводит инфицирование ими клеток. Заражение вирусами в большинстве случаев приводит к подавлению функционирования клеточного генома. Вирулентный вирус размножается в клетке и вызывает ее гибель или нарушает нормальное функционирование (при персистировании). Только умеренные фаги при лизогенизации бактерий наделяют их дополнительными свойствами.
В отличие от вирусов, плазмиды, проникая в бактериальную клетку, не размножаются в ней бесконтрольно и не подавляют функции бактериальной хромосомы, а сосуществуют с ней и сами контролируют образование числа возможных своих копий на хромосому клетки. В отличие от вирусов, плазмиды не только не вызывают гибели клеток, которые являются для них естественной средой обитания, а, наоборот, очень часто наделяют их важными дополнительными (селективными) свойствами. Это основное принципиально важное биологическое различие между плазмидами и вирусами. Зараженная вирусом клетка ценой собственной жизни способствует размножению вирусов. Плазмиды, наоборот, своим присутствием обеспечивают размножение бактерий в неблагоприятных для них условиях (например, в присутствии химиопрепаратов) и, спасая от гибели бактерии, обеспечивают собственное существование.
По уровню молекулярно-генетической организации плазмиды занимают еще более низкое, по сравнению с вирусами, место в иерархии живой материи. С учетом всех этих обстоятельств им можно дать следующее общебиологическое определение: плазмиды – наипростейшие организмы, лишенные оболочки, собственных систем синтеза белка и мобилизации энергии и представляющие собой особый класс абсолютных внутриклеточных паразитов, наделяющих своих бактерий-хозяев полезными для них свойствами (А. И. Коротяев).
В соответствии с теми свойствами, которыми плазмиды наделяют своих носителей, их подразделяют на различные группы (табл. 4).
У бактерий очень часто обнаруживают криптические плазмиды, т. е. плазмиды, функции которых еще не установлены. Поэтому классификация их, несомненно, будет уточняться. Уже сейчас известны плазмиды, контролирующие различные факторы патогенности бактерий (факторы адгезии, инвазии и т. п.).
Существуют два основных способа определения плазмид у бактерий:
1) биологический – по тем дополнительным признакам, которыми они наделяют своего хозяина;
2) биофизический – по выявлению плазмидных ДНК.
Для изучения биологии плазмид и их молекулярно-генетической организации широко используют различные генетические методы, методы клонирования, выделения чистых плазмидных ДНК, определения их молекулярных масс, составление рестриктограмм путем разрезания различными эндонуклеазами и определения размеров получаемых фрагментов, а также секвенирования. Сами по себе плазмиды, благодаря их относительно малым размерам и способности к саморепликации, часто используются в качестве векторов для клонирования различных генов и их последующего изучения.
Все известные плазмиды представляют собой кольцевидные суперспирализованные молекулы двунитевой ДНК, размеры которых варьируют от 1,5 до 200 МД и более (от 1500 до 400 000 пар нуклеотидов). Однако чаще всего встречаются плазмиды с м. м. 3 – 6 или 50 – 70 МД.
Таблица 4
Классификация плазмид по свойствам, которыми они наделяют своих носителей
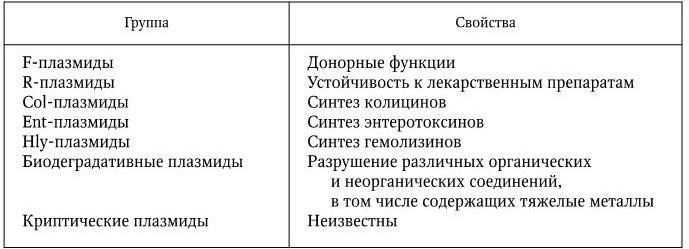
В соответствии с размерами плазмидной ДНК ее молекулярно-генетическая организация характеризуется определенным уровнем сложности. Чем больше молекулярная масса, тем больше и сложнее набор генов, тем многообразнее функции плазмид. Они несут гены саморепликации; гены, контролирующие самоперенос или мобилизацию на перенос; другие гены, определяющие специфические функции самой плазмиды.
Кроме того, в ДНК плазмид могут быть гены, которые наделяют клетку-хозяина многими другими свойствами. Очень часто эти гены интегрируются в плазмидную ДНК в виде транспозонов, поэтому молекулярно-генетическая организация плазмид, особенно высокомолекулярных, очень сложна. Часть генетической карты одной из наиболее часто используемых для изучения генетики плазмид – плазмиды рКМ101, представлена на рис. 50. Для плазмид как живых существ характерны следующие свойства, частью присущие только им и контролируемые их специфическими генами:
1. Саморегулируемая репликация. Эта функция свойственна всем живым организмам. В составе плазмидных ДНК имеются фиксированная точка ori (точка начала репликации) и соответствующие гены, контролирующие репликацию. Репликация мелких плазмид требует, очевидно, дополнительного участия генов клетки-хозяина.
2. Явление поверхностного исключения. Этот механизм не позволяет проникнуть в клетку, уже содержащую плазмиду, другой родственной ей плазмиде. Поверхностное исключение обеспечивается синтезом под контролем генов плазмиды особых белков наружной мембраны, которые препятствуют установлению контакта этой клетки с клеткой, несущей такую же плазмиду, или подавляют конъюгативный метаболизм ДНК этой плазмиды.
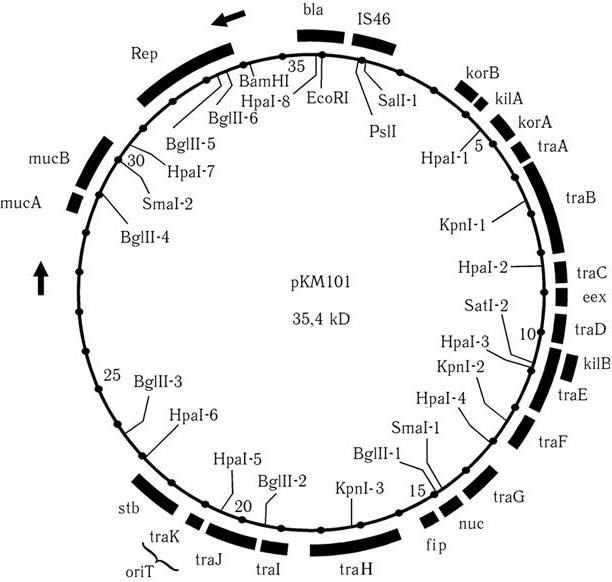
Рис. 50. Молекулярная организация плазмиды pKM101. Конъюгативная плазмида pKM101 IncN-группы является производной плазмиды R46, у которой утрачена область генов, контролирующая устойчивость к антибиотикам. Широко используется для изучения механизмов генетической регуляции плазмидных функций
3. Явление несовместимости. Суть его заключается в том, что две близкородственные плазмиды не могут стабильно сосуществовать в одной клетке, одна из них подвергается элиминации (удалению).
4. Контроль числа копий плазмиды на хромосому клетки. Различают малокопийные (1 – 4 копии) и многокопийные плазмиды (12 – 38 копий, например у плазмиды R6K). Наличие собственных генов репликации позволяет плазмиде осуществлять последнюю независимо от каких-либо событий хромосомной репликации или клеточного цикла клетки-хозяина.
Информация, необходимая для осуществления репликации плазмиды, обычно заключена в небольшой участок ее ДНК, получивший название основного, или базового, репликона. У малокопийных плазмид он состоит из 2,0 – 2,5 т. п. н., а у многокопийных – из 1 т. п. н. Система, которая регулирует репликацию, контролирует также и число копий, и явление несовместимости. Этот контроль осуществляется путем саморегуляции процессов транскрипции и трансляции генов репликации, опосредуемой продуктами их собственных генов: «антисмысловыми» РНК и особыми белками.
5. Контроль стабильного сохранения плазмид в клетке-хозяине (контроль стабильного поддержания).
6. Контроль равномерного распределения дочерних плазмид в дочерние бактериальные клетки. Последние две функции тесно взаимосвязаны. Природные бактериальные плазмиды стабильно сохраняются в клетке-хозяине. Это указывает на то, что их распределение между дочерними клетками происходит не рандомически, т. е. не по принципу случайности, а существует генетический механизм контроля не только репликации, но и равномерного распределения (сегрегации) вновь синтезированных плазмид при клеточном делении. Гены, осуществляющие этот контроль, независимы от системы контроля репликации. Более того, эти гены даже взаимозаменяемы у разных плазмид без утраты своих функций. Функции стабильного поддержания и равномерного распределения опосредуются различными механизмами. Взаимосвязь этих функций с жизнью клеткихозяина настолько важна для плазмид и клеток, что клетки, утратившие плазмиду, погибают. Плазмида «вынуждает» клетку-хозяина даже ценой собственной жизни обеспечивать ее воспроизводство и распространение по вертикали и горизонтали. У F-плазмиды обнаружены гены типа hok (англ. host killing – убивающие хозяина), продукты которых вызывают быструю гибель клетки, утратившей плазмиду (в содержащих плазмиды клетках действие этих продуктов репрессировано другим геном плазмиды). Следовательно, носительство плазмид для клетки-хозяина становится генетически необходимым, благодаря этому обеспечивается существование плазмид как организмов.
7. Способность к самопереносу (у конъюгативных плазмид).
8. Способность к мобилизации на перенос (у неконъюгативных плазмид).
9. Способность наделять клетку-хозяина дополнительными важными для него биологическими свойствами, способствующими выживанию бактерий, а следовательно, и плазмид в природе.
Жизненный цикл плазмид складывается из двух главных процессов: вегетативной (или конъюгативной) репликации и равномерного распределения между дочерними клетками. Оба эти процесса относительно независимы друг от друга и контролируются специфическими системами плазмид. Однако вегетативная репликация плазмид и распределение их между дочерними клетками скоординированы с клеточным делением так, что дочерняя клетка стабильно получает необходимое число копий данной плазмиды.
Плазмиды распространяются среди бактерий двумя способами: путем передачи от родительской клетки дочерним клеткам в процессе клеточного деления, т. е. по вертикали, и путем переноса между клетками в популяции бактерий независимо от клеточного деления, т. е. по горизонтали. Существует несколько генетических механизмов переноса плазмид между бактериальными клетками:
а) путем трансформации;
б) с помощью трансдуцирующих фагов;
в) путем мобилизации на перенос с помощью конъюгативных плазмид;
г) с помощью механизма самопереноса, контролируемого системой генов, объединенных в tra-оперон.
В зависимости от наличия или отсутствия этого оперона плазмиды делятся на конъюгативные и неконъюгативные. Основную роль в широком распространении плазмид играет механизм конъюгационной передачи.
Системы tra-оперонов у разных конъюгативных плазмид имеют определенное сходство, что свидетельствует о том, что они возникли, очевидно, из одного общего предшественника. Однако у разных конъюгативных плазмид они существенно различаются как по количеству tra-генов, так и по характеру их локализации (рис. 51; см. рис. 50). Наиболее подробно система tra-оперона изучена у F-плазмиды, которая является наиболее типичным представителем конъюгативных плазмид. Ее главное биологическое назначение у энтеробактерий – обеспечение их донорными функциями. Именно F-плазмиды контролируют у них конъюгативный обмен генетическим материалом. F-плазмида состоит из 94,5 тыс. пар нуклеотидов и имеет около 90 генов (см. рис. 51). Система tra-генов у F-плазмиды имеет следующий состав: oriT finO traO traM finP traJ traY traA traL traE traK traB traP traV traW traC traU traN traF traQ traH traG traS traT traD traI traZ.

Рис. 51. Генетическая карта F-плазмиды
Область oriТ – точка начала переноса F-плазмиды при конъюгации. Гены traY – traZ (21 ген) образуют оперон переноса. Область traJ finP traM traO finO участвует в регуляции транскрипции и конъюгативного метаболизма ДНК плазмиды; traО – оператор для гена traJ (белок TraJ участвует в позитивной, а белок FinP вместе с finO – в негативной регуляции tra-оперона). Продукты генов traT и traS опосредуют поверхностное исключение. В системе tra-генов F-плазмиды три самостоятельных оперона: traY – traZ, traJ finP и traM.
В основу современной классификации плазмид положено такое их уникальное генетическое свойство, как несовместимость – неспособность родственных плазмид стабильно сосуществовать в одной клетке. Она проявляется после проникновения плазмиды в клетку, уже содержащую близкородственную ей плазмиду.
Плазмиды, несовместимые друг с другом, но совместимые с другими, объединяются в одну Inc-группу (англ. incompatibility – несовместимость); Inc-группа соответствует биологическому виду в других группах организмов. Плазмиды энтеробактерий разделены на 39 Inc-групп (табл. 5).
Многочисленными наблюдениями установлено, что плазмиды, относящиеся к одной и той же Inc-группе, обладают многими общими признаками, в то время как плазмиды, принадлежащие к разным Inc-группам, существенно отличаются по свойствам. В частности, плазмиды одной и той же группы имеют сходную молекулярную массу, высокую степень гомологии ДНК, показывают одинаковые или очень сходные рестриктограммы при обработке их соответствующими рестриктазами. Плазмиды одной и той же группы наделяют клетку способностью синтезировать морфологически подобные и серологически родственные донорные ворсинки, которые не только служат аппаратом конъюгационного переноса плазмид, но и являются специфическими рецепторами для донорспецифических фагов. Такие фаги прикрепляются либо к кончикам ворсинок, либо по их сторонам и вызывают лизис плазмидсодержащих клеток. О близком родстве плазмид, принадлежащих к одной и той же Inc-группе, свидетельствует также изучение их физических и генетических карт. В частности, области репликации плазмид, относящихся к одной и той же Inc-группе, также очень сходны структурно и функционально. Поскольку внутри Inc-групп выявляется тесное филогенетическое родство между ее членами, группа несовместимости как таксономическая единица приравнивается к такой категории как вид. Принадлежность выявленных плазмид к той или иной Inc-группе определяется с помощью метода ДНК-зонда; донорспецифических фагов, а также путем конъюгации бактерий, несущих прототипные плазмиды, с бактериями, несущими исследуемую плазмиду, и последующего установления факта их сосуществования (совместимости) или вытеснения одной из них (несовместимости). Обязательным условием для последнего метода является наличие селективных признаков у каждой из скрещиваемых бактерий – хозяев этих плазмид. Селективными являются признаки, которыми плазмида специфически наделяет клетку-хозяина.
Таблица 5
Inc-группы, выявленные среди плазмид энтеробактерий
Медицинское и общебиологическое значение плазмид
Значение плазмид для медицины состоит в том, что они контролируют синтез различных факторов патогенности у многих видов бактерий, в том числе у возбудителей чумы, сибирской язвы, иерсиниозов, дизентерии, эшерихиозов и др. Не вызывает сомнения, что возникновение диареегенных кишечных палочек (энтеротоксигенных, энтеропатогенных, энтероинвазивных и др.) является следствием приобретения ими плазмид, которые наделяют их факторами адгезии, инвазии и способностью синтезировать термолабильные и термостабильные энтеротоксины. Наличие в природе таких плазмид (особенно с широким кругом хозяев) может стать причиной образования новых вариантов патогенных бактерий.
Не менее важную роль играют R-плазмиды. В условиях широкого применения антибиотиков и других химиопрепаратов происходит естественный отбор тех штаммов патогенных бактерий, которые являются носителями R-плазмид. Среди них формируются новые эпидемические клоны патогенных бактерий. В настоящее время они играют ведущую роль в эпидемиологии инфекционных болезней, и от их распространения во многом зависит эффективность антибиотико– и химиотерапии, а в итоге – здоровье и жизнь людей.
Общебиологическое значение плазмид заключается в том, что они выполняют по крайней мере три важнейшие функции для бактерий, обеспечивая одновременно существование как бактерий, так и собственное. Во-первых, они контролируют у бактерий обмен генетическим материалом. Во-вторых, контролируя синтез факторов патогенности, они обусловливают благоприятные возможности для размножения патогенных бактерий в естественных для них условиях (в организме животного и человека), а следовательно, для сохранения этих видов в природе. В-третьих, плазмиды являются уникальным биологическим средством самозащиты бактерий, так как они обеспечивают их приобретенным и наследуемым специфическим иммунитетом против различных химических (лекарственных и иных веществ) и других агентов.
Таким образом, представляя собой особую группу наиболее просто организованных живых существ, плазмиды сохраняются в природе благодаря взаимовыгодным отношениям, сложившимся между ними и бактериями. Бактерии для них – естественная среда обитания, а они для бактерий – дополнительные свободно циркулирующие между ними геномы с наборами таких генов, которые благоприятствуют сохранению бактерий в природе.
МИКРОФЛОРА БИОСФЕРЫ
Распространение микробов в природе и роль их в обеспечении динамического равновесия биосферы
«Мириады микробов населяют стихии и повсюду окружают нас. Незримо они сопутствуют человеку на всем его жизненном пути, властно вторгаясь в его жизнь то в качестве врагов, то как друзья. В громадном количестве они встречаются в пище, которую мы принимаем, в воде, которую пьем, и в воздухе, которым мы дышим. Окружающие нас предметы, наша одежда, поверхность нашего тела, все это буквально кишит микробами, среди которых встречаются и болезнетворные виды», – так образно охарактеризовал микрофлору, которая нас окружает, выдающийся русский микробиолог В. Л. Омелянский. По-видимому, в биосфере нет такой среды, в которой не встречались бы микроорганизмы. Всюду, где есть хотя бы какие-то источники энергии, углерода и азота, обязательно встречаются и микроорганизмы, различающиеся по своим физиологическим потребностям и свойствам. Именно это разнообразие, в основе которого лежит способность использовать любые, даже минимальные возможности для своего существования, исторически обусловило вездесущность микроорганизмов. С другой стороны, активная жизнедеятельность мириадов микроорганизмов, их гигантская роль в круговороте веществ в природе имеют исключительное значение для поддержания (сохранения) динамического равновесия всей биосферы, нарушение которого привело бы к катастрофическим последствиям.
Естественной средой обитания микроорганизмов служат в первую очередь почва, вода и воздух. Они заселяют также кожные покровы и сообщающиеся с внешней средой слизистые оболочки человека и животных.
Везде и всюду микроорганизмы сосуществуют в виде сложных ассоциаций – биоценозов, представленных многими и разнообразными видами, между которыми складываются своеобразные взаимоотношения. Особенности этих взаимоотношений таковы, что они обеспечивают существование всех многочисленных видов бактерий и в конечном счете всего царства прокариот, которое, в свою очередь, сосуществует с другими царствами жизни на Земле.
Почва – среда обитания многочисленных видов микроорганизмов и крупнейший резервуар их в природе. Количество микробов в 1 г почвы измеряется обычно сотнями и тысячами миллионов клеток. Оно варьирует от 200 млн в глинистой почве до 5 млрд в черноземной почве. В 1 г пахотного слоя почвы содержится 1 – 10 млрд бактерий, а в слое ее толщиной 15 см на площади в 1 га может содержаться от 1 до 5 – 6 тонн микробной массы. Даже в песках пустынь, где почти отсутствует влага, содержится до 100 000 микробов в 1 г. Численность и видовой состав их в почве зависят от содержания в ней органических веществ и влаги, структуры почвы, способа ее сельскохозяйственной обработки, климатических условий, характера растительного покрова, степени загрязнения почвы отходами хозяйственной деятельности человека и многих других факторов. Состав микрофлоры почвы складывается из различных комбинаций бактерий (сотни и тысячи видов), грибов, простейших и вирусов. Фактически она содержит представителей всех царств жизни – вирусов, архебактерий, эубактерий и эукариот во всем их многообразии, которое зависит от действия многих факторов.
Самый поверхностный слой почвы содержит ограниченное число микробов из-за действия солнечных лучей и высушивания. Главная масса микробов содержится на глубине 10 – 20 см, в нижележащих ее горизонтах количество микроорганизмов уменьшается, и на глубине 5 – 6 метров почва может быть уже стерильной, так как распространению микробов в глубину препятствует высокая поглотительная способность почвы.
Почва постоянно загрязняется различными отбросами, выделениями человека и животных, мертвыми растениями и животными. Огромная роль в процессах самоочищения почвы и в круговороте веществ в природе принадлежит микроорганизмам. В превращении органических веществ, поступающих в почву и образующихся в ней, принимают участие различные группы микробов: гнилостные, нитрифицирующие, азотфиксирующие, денитрифицирующие и др.
Патогенные микроорганизмы попадают в почву с испражнениями, мочой, гноем, мокротой, слюной и другими выделениями, с трупами людей и животных, погибших от инфекционных заболеваний. Попадая в почву, значительная часть патогенных микроорганизмов, не образующих спор, рано или поздно погибает. Сроки выживания в почве возбудителей кишечных инфекций (дизентерии, брюшного тифа, холеры), чумы, бруцеллеза, туляремии, туберкулеза широко варьируют и составляют от нескольких часов до нескольких месяцев. Отмирание патогенных бактерий в почве зависит от ряда причин: высушивания; отсутствия необходимых питательных субстратов; действия антибиотических веществ, вырабатываемых почвенными бактериями и грибами; солнечных лучей; бактериофагов и т. п. Значительно дольше в почве сохраняются спорообразующие патогенные бактерии – аэробные (споры B. anthracis сохраняются в почве свыше 15 лет) и анаэробные – возбудители столбняка, газовой гангрены, ботулизма (их споры также сохраняются в почве многие годы, а при благоприятных условиях прорастают и бактерии размножаются, поддерживая тем самым свое существование в почве). Поэтому почва играет основную роль в эпидемиологии столбняка, газовой гангрены (особенно в военных условиях) и ботулизма, она является основным резервуаром возбудителей этих заболеваний.
Вода, как и почва, является естественной средой обитания для многих видов микроорганизмов всех царств жизни. Разнообразные микроорганизмы обитают как в воде открытых водоемов, так и в грунтовых водах: палочки, кокки, вибрионы, спириллы, спирохеты, различные фотосинтезирующие бактерии, грибы, простейшие, вирусы и плазмиды. Многие виды галофильных бактерий обитают в морских водах. Численность микроорганизмов в воде определяется главным образом содержанием в ней органических веществ, которые под влиянием микроорганизмов подвергаются совершенно таким же превращениям, как и в почве. В 1 мл воды количество микробов может превышать несколько миллионов. Грунтовые подземные воды чище, так как, просачиваясь через почву, вода подвергается своеобразной фильтрации, в результате которой большинство микробов задерживается в фильтрующем слое. Численность микроорганизмов в воде открытых водоемов подвержена колебаниям и зависит от климатических условий, времени года, а главным образом, от степени загрязнения рек, озер и морей сточными и канализационными водами и отходами промышленных, агропромышленных и других предприятий. В реки, озера, моря из прибрежных городов и других населенных пунктов выбрасывается такое количество сточных вод, несущих мириады микробов и содержащих огромное количество органических веществ, что вода не успевает самоочищаться.
В результате возникла и сохраняется серьезная глобальная экологическая проблема.
По степени микробного загрязнения различают три категории воды (или зоны водоема):
1. Полисапробная зона – наиболее сильно загрязненная вода, бедная кислородом, богатая органическими веществами. В 1 мл воды содержание микроорганизмов достигает 1 млн и более, преобладают E. coli и анаэробные бактерии, вызывающие процессы гниения и брожения.
2. Мезосапробная зона – вода, загрязненная умеренно, в ней активно происходит минерализация органических веществ с интенсивными процессами окисления и нитрификации. Содержание микроорганизмов в 1 мл воды – сотни тысяч бактерий, количество E. coli значительно меньше.
3. Олигосапробная зона – зона чистой воды, количество микроорганизмов в 1 мл воды – десятки или сотни, не более; E. coli отсутствует или встречается в количестве нескольких клеток на 1 л воды.
Питьевая вода считается хорошей, если общее количество бактерий в 1 мл – не более 100; сомнительной – 100 – 150; загрязненной, – если содержание бактерий в 1 мл 500 и более. Количество микроорганизмов в придонном слое ила озер и рек варьирует в пределах от 100 до 400 млн на 1 г.
Вода играет исключительно важную роль в эпидемиологии многих инфекционных заболеваний, особенно кишечных (брюшного тифа, дизентерии, сальмонеллезов, холеры, вирусных гепатитов, полиомиелита и т. п.), возбудители которых выделяются вместе с испражнениями от больных и носителей и вместе со сточными водами поступают в воду открытых водоемов, а оттуда нередко и в питьевую воду. Хотя патогенные бактерии слабо приспособлены к существованию в воде, где на них оказывают неблагоприятное действие солнечный свет и различные другие факторы, включая конкурентную водную микрофлору, многие из них могут достаточно длительное время сохраняться в воде. Более того, в летнее время при наличии в воде органических веществ, щелочной рН и благоприятной температуры некоторые из них, в том числе холерный вибрион, могут даже размножаться. Заразиться можно и через лед, в котором патогенные бактерии могут сохраняться в течение нескольких недель и даже месяцев.
Загрязненная вода – главный источник заражения холерой, дизентерией, брюшным тифом и другими кишечными инфекциями, а также лептоспирозом и, нередко, туляремией.
Микробиологические методы исследования воды сводятся к определению общего количества микроорганизмов в 1 мл воды и выявлению тех или иных видов патогенных бактерий (особенно холерного вибриона). Кроме того, поскольку прямое выделение патогенных бактерий из воды требует специальных исследований, существуют косвенные методы, позволяющие дать количественную оценку степени фекального загрязнения воды (см. раздел «Санитарная микробиология и ее значение», гл. 16).
Воздух как среда обитания для микроорганизмов менее благоприятен, чем почва и вода, так как в нем не содержится или содержится очень мало питательных веществ, необходимых для размножения микроорганизмов. Кроме того, на них сильнее действуют такие неблагоприятные факторы, как высушивание и ультрафиолетовые лучи солнечного света. Тем не менее, попадая в воздух, многие микроорганизмы могут сохраняться в нем более или менее длительное время. Воздух особенно загрязнен вблизи земной поверхности, а с высотой он становится все более чистым. На степень загрязнения воздуха микробами влияют и климато-географические условия. Больше всего микробов в атмосфере содержится летом, меньше всего – зимой. Главным источником загрязнения воздуха является почва, в меньшей степени – вода.
В воздухе в естественных условиях обнаруживаются сотни видов сапрофитных микроорганизмов, представленных кокками (в том числе сарцинами), споровыми бактериями и грибами, отличающимися большой устойчивостью к высушиванию и к другим неблагоприятным воздействиям внешней среды, например действию солнечных лучей. Нужно различать воздух открытых пространств (он относительно чист, так как сказывается действие солнечных лучей, высушивания и других факторов) и воздух закрытых помещений. В последних факторы самоочищения действуют слабее, поэтому и загрязненность может быть значительно больше. В воздухе закрытых помещений, особенно если они плохо проветриваются, накапливается микрофлора, выделяемая через дыхательные пути человека. Патогенные микроорганизмы попадают в воздух из мокроты и слюны при кашле, разговоре и чихании. Даже здоровый человек при каждом акте чихания выделяет в воздух 10 000 – 20 000 микробных тел, а больной – иногда во много раз больше.
Заслуга выяснения механизма передачи возбудителей заболеваний через воздух принадлежит П. Н. Лащенкову. Он одним из первых установил, что при чихании, кашле и разговоре в воздух выбрасывается множество капелек жидкости, внутри которых содержатся микроорганизмы. Особенно важно, что эти мельчайшие капельки могут часами удерживаться в воздухе во взвешенном состоянии, т. е. образуют стойкие аэрозоли. В этих капельках за счет влаги микроорганизмы выживают дольше. Таким воздушно-капельным способом происходит заражение многими острыми респираторными заболеваниями, в том числе гриппом и корью, а также коклюшем, дифтерией, легочной чумой и т. д. Этот путь распространения возбудителей – одна из основных причин развития не только эпидемий, но и крупных пандемий гриппа, а в прошлом и легочной чумы.
Помимо капельного способа, распространение патогенных микробов через воздух может осуществляться «пылевым» путем. Находящиеся в выделениях больных (мокроте, слизи и т. п.) микроорганизмы окружены белковым субстратом, поэтому они более устойчивы к высыханию и другим факторам. Когда такие капли высыхают, они превращаются в своеобразную бактериальную пыль (внутри белкового субстрата сохраняются и выживают многие патогенные бактерии). Частички бактериальной пыли имеют обычно диаметр от 1 до 100 мкм. У частиц диаметром более 100 мкм сила тяжести превышает сопротивление воздуха, и они быстро оседают. Скорость переноса бактериальной пыли зависит от интенсивности сил воздушных перемещений. Пылевой путь играет особенно важную роль в эпидемиологии туберкулеза, дифтерии, туляремии и других заболеваний.
Количество микробов в воздухе варьирует в больших диапазонах – от нескольких бактерий до десятков тысяч их в 1 м3. В 1 г пыли может содержаться до 1 млн бактерий. Большое значение имеет чистота воздуха в операционных, реанимационных и перевязочных отделениях хирургических госпиталей. Общее количество микробов в операционной до операции не должно превышать 500 в 1 м3, а после операции – 1000 в 1 м3.
Для исследования микрофлоры воздуха используют различные методы: седиментационный (метод Коха), фильтрационный (воздух продувают через воду) и методы, основанные на принципе ударного действия воздушной струи с использованием специальных приборов (В. С. Киктенко, Л. М. Соколинского [и др.]). Последние методы наиболее надежны, так как позволяют точно определить количественное загрязнение воздуха микроорганизмами и изучить их видовой состав.
В настоящее время в биотехнологической промышленности широко используются различные микробы-продуценты, в том числе генетически модифицированные формы их. Поскольку эта технология связана с неизбежными периодическими выпусками (интродукциями) в открытую систему (воздух, вода, почва) генетически измененных форм микроорганизмов, возникает важный вопрос об их дальнейшей судьбе и о возможном влиянии на биосферу и человечество. Несомненно, этот вопрос как часть общего вопроса охраны окружающей среды должен решаться в глобальном плане.
Роль микроорганизмов в круговороте веществ в природе
Предполагается, что в предбиологический период атмосферные газы находились в восстановленном состоянии: азот – в форме аммиака (NH3); кислород – в составе воды (H2O); углерод – в форме метана (СН4). Современное их состояние в виде окисленных форм: азота и кислорода в форме простых газов (N2 и О2), а углерода в виде оксида углерода (СО2) – в значительной степени является следствием активности живых организмов, в том числе микробов. Количественное содержание в атмосфере N2, O2 и СО2, других химических элементов, обнаруженных на поверхности Земли и необходимых для жизни, отражает равновесие между их образованием и использованием в биологических и геологических процессах. Эти превращения происходят во всей биосфере, т. е. в той тонкой оболочке жизни на поверхности Земли, которая охватывает океаны, моря, пресные водоемы, почву континентов и нижнюю часть атмосферы и в которой только и содержатся живые организмы. Общего количества главных химических элементов, необходимых для жизни, в частности углерода и азота, имеющихся в атмосфере, при их одностороннем потреблении вряд ли хватило бы на миллионы лет.
Биосфера находится в более или менее устойчивом состоянии благодаря непрерывному притоку солнечной энергии и постоянному круговороту углерода, кислорода, азота, серы и фосфора. В целом эти процессы выглядят так. С помощью солнечной энергии фотосинтезирующие организмы превращают СО2 и другие неорганические вещества в глюкозу и другие органические соединения, которые прямо или косвенно служат источником энергии для всех других организмов. В свою очередь фотосинтезирующие организмы – одноклеточные водоросли (в основном, диатомовые и динофлагелляты), обитающие в океане, и высшие растения, растущие на суше, – служат источником питания для животных. Поэтому основные биологически важные элементы сохраняются в органическом состоянии в ходе превращений, которые приводят к включению этих элементов в клетки и ткани животных. Чтобы снова стать доступными для фотосинтезирующих организмов, органические вещества должны снова перейти в неорганическую форму, т. е. подвергнуться минерализации. Эти превращения происходят из-за разложения (гниения) растительных и животных остатков, осуществляемого главным образом микроорганизмами. Подсчитано, что минерализация 90 % органического углерода, т. е. превращение его в СО2, осуществляется микроорганизмами. Остальные 10 % СО2 образуются в результате дыхания других организмов, а также за счет сгорания топлива и других материалов. Микроорганизмы, благодаря легкости их расселения по воздуху и воде, распространены по всей биосфере, и вследствие их чрезвычайно высокой метаболической активности они играют главную роль в химических превращениях, которые происходят на поверхности Земли. Подсчитано, что метаболический потенциал микроорганизмов в верхнем 15-сантиметровом слое одного гектара хорошо удобренной почвы в любой момент времени эквивалентен метаболическому потенциалу нескольких десятков тысяч людей.
Другим важным фактором, определяющим роль микроорганизмов в природе, является высокая скорость их размножения при благоприятных условиях.
Под круговоротом веществ в природе понимают циклические превращения химических элементов, из которых построены живые существа, происходящие вследствие разнообразия и гибкости метаболизма микроорганизмов. По-видимому, в природе нет таких органических веществ, которые не разрушались бы теми или иными микроорганизмами.
Круговорот азота и микробы, участвующие в нем
Запасы азота в природе очень велики. Он входит в состав всех организмов на Земле. Общее содержание его в организмах составляет более 25 млрд тонн, большое количество азота находится также в почве. Но еще более грандиозен запас азота в атмосфере: над каждым гектаром почвы поднимается столб воздуха, содержащий около 80 000 тонн молекулярного азота. Ежегодно на образование вновь вырастающих растений требуется около 1,5 млрд тонн азота в форме, доступной для усвоения растениями. Имеющегося в воздухе и почве азота хватило бы для обеспечения урожая, даже при одностороннем использовании, на несколько миллионов лет. Однако растения часто дают низкие урожаи именно из-за недостатка азота в почве. Это объясняется тем, что только небольшая группа азотистых соединений может быть быстро усвоена растениями. Не только свободный азот, но и многие формы связанного азота не могут служить источником азотного питания для растений. Азот, поступающий в виде белковых веществ в почву вместе с остатками растений и животных, совсем не годится для этих целей, он должен быть подвергнут минерализации, а образующийся при этом аммиак должен быть окислен в соли азотистой и азотной кислот. В основе процессов круговорота азота лежат следующие биохимические процессы: гниение белков, разложение мочевины, нитрификация, денитрификация и фиксация атмосферного азота.
Гниение, или аммонификация белков, – микробиологический процесс, при котором под воздействием гнилостных микроорганизмов происходит гидролитическое расщепление белков, поступающих в почву с трупами животных и отмирающими растениями, с образованием промежуточных продуктов (альбумоз, пептонов, амино– и амидокислот), а также дурно пахнущих веществ – индола, сероводорода, меркаптана, летучих жирных кислот.
Конечным продуктом гидролиза белков и дезаминирования аминокислот является NH3, почему этот процесс и называется аммонификацией белка. Таким образом, при гниении происходит минерализация белковых веществ, которая в зависимости от химического состава белков субстрата, вида гнилостных бактерий и условий их жизнедеятельности может быть полной или не доведенной до конца. При полной минерализации белка образуются H2O, CO2, NH3, H2S и минеральные соли. При широком доступе кислорода продукты гидролиза белков подвергаются полному окислению, зловонных веществ образуется значительно меньше, чем при анаэробных условиях. Такой процесс называется тлением.
Гниение – преимущественно анаэробный процесс, при котором полного окисления некоторых продуктов, например жирных кислот, не происходит. Гнилостные микробы широко распространены в почве, воде, воздухе, в животных и растительных организмах. Поэтому любой продукт, не защищенный от них, быстро подвергается гниению. Его вызывают как анаэробные, так и аэробные микроорганизмы, причем они могут действовать и преемственно, и одновременно. Наиболее энергичными возбудителями гниения, сопровождающегося глубоким распадом белка и образованием азотистых и безазотистых соединений (индола, скатола, жирных кислот, NH3, H2, H2S и др.), являются Bacillus mycoides, B. subtilis, B. mesentericus, бактерии семейства Enterobacteriaceae (Proteus, Escherichia и др.), а также Clostridium putrificum, C. sporogenes. Последние два – анаэробы, содержатся в кишечнике и после смерти вызывают зловонное разложение трупов.
Процессы гниения протекают только при наличии условий, благоприятных для жизнедеятельности их возбудителей (влажность, температура и т. п.). В сухой песчаной почве трупы подвергаются мумификации (высушиванию без гниения). Гнилостные процессы происходят и в организме человека, в частности в кишечнике; причиной их являются E. coli и другие микробы. По мнению И. И. Мечникова, продукты гниения (скатол, индол и др.), постоянно образующиеся в организме, вызывают хроническую интоксикацию и являются одной из причин преждевременного старения.
Гнилостные процессы протекают также при газовой гангрене: ткани, омертвевшие под влиянием образуемых возбудителями этой болезни экзотоксинов, заселяются гнилостными аэробными и анаэробными бактериями и подвергаются распаду. Некоторые гнилостные процессы используются в промышленности с полезной целью, например при выработке кожи для отделения от нее шерсти – швицевании.
Исключительное значение процессов гниения заключается в том, что они играют важную роль в естественном самоочищении почвы и воды. Этим пользуются при строительстве специальных очистных сооружений (полей ассенизации, орошения и т. п.) для биологической переработки и обезвреживания фекальных нечистот и сточных вод, содержащих много мертвых белковых субстратов. Гниение ведет к обогащению почвы азотистыми продуктами.
Большое количество связанного азота поступает в почву также в виде мочевины (диамида угольной кислоты) – NH2– CO – NH2. Ежегодно люди и животные выделяют ее около 20 млн тонн. Но мочевина не может быть непосредственно использована в качестве азотного продукта для питания растений. Она подвергается также аммонификации, которую вызывают различные уробактерии. При этом вначале образуется нестойкая углеаммиачная соль, которая далее расщепляется с образованием NH3, CO2 и H2O.
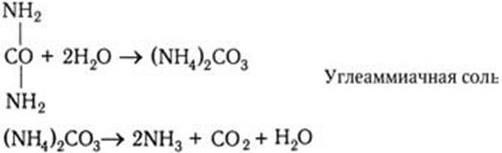
Мочевая кислота, выделяемая в почву птицами и рептилиями, также быстро минерализуется особыми группами микроорганизмов с образованием NH3 и CO2.
Следующим важным этапом круговорота азота вслед за образованием NH3 является процесс нитрификации, т. е. окисление NH3 вначале в азотистую, а затем в азотную кислоту, соли которых наиболее пригодны для азотного питания растений. Процесс нитрификации вызывается двумя группами открытых С. Н. Виноградским нитрифицирующих бактерий. Нитрозобактерии окисляют NH3 до азотистой кислоты:
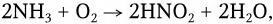
а нитробактерии окисляют азотистую кислоту в азотную:
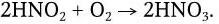
Нитрифицирующие бактерии – строгие аэробы, хемолитотрофы. Энергию окисления они используют для восстановления CO2 в гексозу. Благодаря нитрифицирующим бактериям в почве могут образовываться огромные скопления солей азотной кислоты в виде селитры (в Чили, Перу). Завершая процесс минерализации белковых веществ, нитрифицирующие бактерии играют исключительно важную роль и в процессах самоочищения почвы и воды, и в санитарно-гигиенических устройствах (поля орошения и т. п.). Таким образом, нитрифицирующие бактерии способствуют повышению урожайности почвы благодаря накоплению в ней азотнокислых солей.
Однако в почве происходят и противоположные процессы, т. е. денитрификации, или восстановления микроорганизмами солей азотной кислоты в соли азотистой кислоты и в другие простые азотистые соединения, вплоть до свободного азота, который уходит в атмосферу.
Способностью восстанавливать нитраты в нитриты обладает большое количество видов бактерий и грибов. Денитрификация протекает в три фазы:
1) 2HNO3 → 2HNO2 + O2;
2) 2HNO2 → промежуточные соединения + О2;
3) промежуточные соединения → N2 + H2O + O2.
Рис. 52. Круговорот азота (по Р. Стейнеру и [др.])
Окисление азота показано сплошными стрелками; восстановление – точечными стрелками; реакции без изменения валентности – пунктирными стрелками
Денитрифицирующие бактерии (в частности, некоторые виды Pseudomonas) в анаэробных условиях используют денитрификацию как основную форму дыхания. Для них соли азотной и азотистой кислот служат источниками азота. Энергию для своей специфической деятельности денитрифицирующие бактерии получают из органических веществ, которыми богата почва. Денитрифицирующие бактерии наносят вред сельскому хозяйству, так как способствуют обеднению почвы минеральным азотом и переходу свободного азота в атмосферу. Особенно энергично процессы денитрификации развиваются в слежавшейся, плохо аэрируемой почве. Однако убыль азота из почвы, вызванная активностью денитрифицирующих бактерий, компенсируется деятельностью свободноживущих аэробных и анаэробных и клубеньковых азотфиксирующих бактерий. Более 90 % азота связывают азотфиксирующие бактерии: на каждый гектар почвы ежегодно от 25 до 300 кг азота привносят только они.
Так, при самом активном участии многих видов микроорганизмов, происходит непрерывный круговорот азота, поддерживающий существование жизни на Земле (рис. 52).
Процессы распада безазотистых органических веществ обусловлены по преимуществу жизнедеятельностью микроорганизмов, а процессы созидательные – фотосинтезом зеленых растений, водорослей и фотосинтезирующих бактерий. Ежегодно зеленые растения потребляют около 60 млрд тонн углекислого газа (или 20 млрд тонн углерода), а в атмосфере содержится около 600 млрд тонн углерода. Таким образом, его при одностороннем использовании хватило бы всего на 30 лет. Только благодаря непрерывному круговороту сохраняется равновесие между потреблением углерода и его выделением в атмосферу. В основе процессов распада безазотистых органических веществ лежат различные формы брожения, которые постоянно происходят в природе. Брожение – анаэробное дыхание, при котором микроорганизмы используют выделяющуюся энергию для своей жизнедеятельности.
Спиртовое брожение углеводов вызывают дрожжи (Saccharomyces cerevisiae), некоторые виды бактерий (Sarcina ventriculi) и отдельные представители мукоровых грибов рода Mucor. При спиртовом брожении молекула гексозы распадается на этанол и углекислый газ:
Это уравнение отражает лишь конечный результат. В ходе брожения образуется много промежуточных продуктов – гексозомонофосфат, фруктозодифосфат, фосфотриозы, фосфоглицериновая кислота, фосфопировиноградная кислота, пировиноградная кислота, уксусный альдегид и, наконец, этиловый спирт.
Спиртовое брожение широко используется в промышленности для производства вина и пива, а также в хлебопечении. Для этих целей применяют определенные расы дрожжей в виде чистых культур. Дрожжи для заквашивания теста впервые были использованы около 6000 лет назад в Египте, а затем этот способ получения хлеба постепенно распространился по всему свету. Способ перегонки спирта был открыт, согласно литературным данным, в Китае или арабских странах. Винокуренные заводы в Европе появились в середине VII в. Вначале спирт использовали только для приготовления напитков, а затем в связи с развитием промышленности он стал широко применяться как растворитель и химическое сырье.
При содержании в сбраживаемом растворе более чем 30 % сахара часть его остается неиспользованной, так как при этих условиях образуется до 15 % спирта, а при такой концентрации спирт подавляет жизнедеятельность дрожжей. Поэтому натуральные вина содержат не более 15 % спирта. Главное преимущество чистых культур дрожжей заключается в том, что брожение виноградного сока протекает и заканчивается быстро, а отсутствие посторонней микрофлоры позволяет получать вина хорошего вкуса и аромата (с хорошим «букетом»).
По окончании брожения молодое вино стабилизируют и дают ему созреть. Эти процессы занимают несколько месяцев, а при изготовлении высококачественных красных вин – даже несколько лет.
В течение первого года во многих красных винах происходит второе, спонтанное брожение – яблочно-молочнокислое, которое вызывается рядом молочнокислых бактерий (Pediococcus, Leuconostoc, Lactobacillus). В результате этого яблочная кислота винограда превращается в молочную кислоту и СО2, т. е. дикарбоновая кислота превращается в монокарбоновую, и кислотность вина уменьшается, оно становится высококачественным. Игристые вина типа шампанского подвергают второму спиртовому брожению под давлением, добавляя в вино сахар. Образующийся СО2 газирует вино. Второе брожение вызывается различными винными дрожжами, которые после брожения образуют комки и легко удаляются. Вино типа «Херес» крепят добавлением спирта до 15 % и выдерживают на воздухе; на его поверхности интенсивно размножаются определенные дрожжи, что придает вину специфический вкус. В некоторых районах Франции для приготовления десертных вин виноград заражают грибом Botrytis cinerea, а к виноградному суслу добавляют глюкофильные дрожжи, которые сбраживают глюкозу, но не разрушают более сладкой фруктозы, и получается сладкое десертное вино.
Распространенные в природе дикие расы дрожжей рода Torula часто причиняют вред бродильной промышленности, вызывая помутнение и горький вкус напитков.
Уксуснокислое брожение – биологический окислительный процесс, при котором с помощью уксуснокислых бактерий спирт окисляется в уксусную кислоту. Если какуюлибо жидкость, содержащую небольшое количество спирта (вино, пиво), оставить открытой, то в ней постепенно появляются уксусная кислота и кожистая пленка (уксусная матка) на поверхности. Уксуснокислые бактерии объединены в род Acetobacter, содержащий ряд видов и подвидов. Этиловый спирт под влиянием уксуснокислых бактерий подвергается окислению, в результате которого вначале образуется уксусный альдегид, а затем – уксусная кислота. При использовании специальных рас уксуснокислых бактерий максимальный выход уксуса достигает 14,5 %. Уксуснокислые бактерии превращают ряд многоатомных спиртов в сахар. Одна из таких реакций используется для получения сорбозы из сорбитола. Сорбоза – промежуточный продукт синтеза аскорбиновой кислоты. Она применяется в качестве суспендирующего агента при изготовлении многих лекарственных препаратов. Уксуснокислые бактерии могут наносить вред в виноделии и пивоваренной промышленности, вызывая прокисание вина и пива.
Молочнокислое брожение – широко распространенное биохимическое явление, давно известное на примере скисания молока. Под влиянием молочнокислых бактерий (семейство Lactobacillaceae) лактоза расщепляется на составляющие ее гексозы – глюкозу и галактозу, которые затем специфическими ферментами превращаются в молочную кислоту. Свертывание молока происходит вследствие того, что молочная кислота отщепляет кальций от казеина, белок превращается в параказеин и выпадает в осадок. Молочнокислые бактерии широко распространены в природе. Они обнаруживаются в молоке, воздухе, на коже, шерсти, в тонком и толстом кишечнике и представлены большим количеством видов палочковидных и кокковидных бактерий, различающихся не только по морфологии, но и по физиологическим свойствам (по использованию различных источников углерода и азота). Различают две группы возбудителей молочнокислого брожения:
1) возбудители типичного молочнокислого брожения (гомоферментативного брожения):
2) возбудители нетипичного (гетероферментативного) молочнокислого брожения:
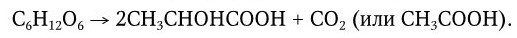
К первой группе относятся бактерии, которые образуют значительное количество молочной кислоты, превращение сахара в молочную кислоту происходит без образования побочных продуктов (или образуются только следы их). Образование молочной кислоты происходит быстро и интенсивно, а белки гидролизуются до аминокислот. Возбудители типичного молочнокислого брожения – Streptococcus lactis, Lactobacillus bulgaricus, Lactobacillus caucasicus, Lactobacillus acidophilus и другие виды. С помощью чистых культур истинных молочнокислых бактерий получают высококачественные сорта молочнокислых продуктов.
Наряду со спиртовым молочнокислое брожение имеет большое значение в пищевой промышленности. Целый ряд молочнокислых, спирто-молочнокислых и кислоовощных продуктов получают благодаря жизнедеятельности молочнокислых бактерий или их комбинации с дрожжами:
обыкновенная простокваша – S. lactis;
мечниковская простокваша – S. lactis + L. bulgaricus;
ацидофильное молоко – L. acidophilus;
кефир – L. caucasicus + S. lactis + дрожжи (Torula) (молочнокислое и спиртовое брожение, содержание спирта до 0,2 %);
кумыс – из сырого кобыльего молока – L. bulgaricus + S. lactis + Torula (молочнокислое и спиртовое брожение, содержание молочной кислоты около 1 %, спирта до 2,5 %);
йогу́рт – L. bulgaricus + Streptococcus thermophilus;
сыры – первичное молочнокислое брожение при температуре 35 °C – S. lactis или S. cremoris, при температуре 42 °C – различные термофильные молочнокислые бактерии, в основном Lactobacillus. Получение сливочного масла также связано с микробиологическим процессом, так как вначале происходит молочнокислое брожение молока, вызываемое L. bulgaricus, а затем для отделения жира в процессе сбивания необходимо предварительное скисание сливок, которое вызывают стрептококки молока. Они образуют небольшое количество ацетоина, который спонтанно окисляется до диацетила, обусловливающего вкус и запах масла.
Сметана, творог, квашеная капуста, хлебный квас и другие продукты получают при участии молочнокислых бактерий.
К возбудителям нетипичного (гетероферментативного) молочнокислого брожения относятся E. coli, Enterobacter aerogenes и другие бактерии. Наряду с молочной кислотой (она получается в небольших количествах и медленно) эти бактерии образуют и другие продукты брожения: углекислый газ, водород, уксусную, пропионовую кислоты и другие соединения. Эти бактерии осуществляют более глубокое расщепление белков, вплоть до органических соединений и аммиака. Гетеромолочнокислому брожению принадлежит большая роль при силосовании зеленых кормов. Маслянокислое брожение также широко встречается в природе. Возбудитель маслянокислого брожения был открыт Л. Пастером. На примере маслянокислого брожения Л. Пастер разработал учение об анаэробах. Типичный представитель бактерий маслянокислого брожения – азотфиксирующий Clostridium pasteurianum. Маслянокислые бактерии в больших количествах встречаются в почве, навозе, на растениях, в молоке, сыре. Многие из них являются анаэробами и относятся к роду Clostridium.
Маслянокислое брожение – сложный биохимический процесс расщепления углеводов, в ряде случаев жиров и белков, на масляную кислоту, углекислоту и воду:
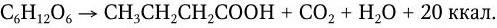
При этом образуется много побочных продуктов – уксусная, молочная, пропионовая и другие кислоты.
Из числа других форм брожения чрезвычайно важным является брожение целлюлозы (клетчатки), в которой заложены огромные запасы углерода. Разложение целлюлозы, которая в количественном отношении представляет собой один из основных компонентов растительных тканей, осуществляется главным образом высоко специализированными в отношении питания аэробными и анаэробными микроорганизмами. Среди аэробных бактерий, расщепляющих целлюлозу, наиболее важны скользящие бактерии рода Cytophaga. Целлюлоза – единственное вещество, которое они могут использовать в качестве источника углерода. Цитофаги быстро растворяют и окисляют целлюлозу.
Общая схема важнейших типов брожения представлена на рис. 53. Факультативные анаэробы, в том числе представители семейства Enterobacteriaceae, образуют при брожении в первую очередь органические кислоты: уксусную, муравьиную, янтарную и молочную, а также этанол, глицерин, ацетоин; 2,3-бутандиол, CO2 и H2. Основные продукты брожения углеводов, которые образуют строгие спорообразующие анаэробы, – масляная кислота, бутанол, ацетон, изопропанол, другие органические кислоты и спирт. Процессы брожения используют для промышленного производства некоторых из этих продуктов, например бутандиола.
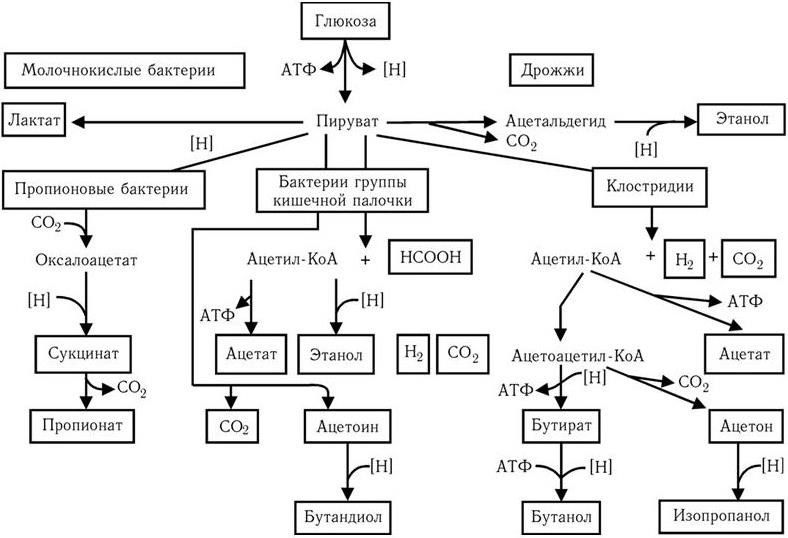
Рис. 53. Суммарная схема важнейших типов брожения (по Г. Шлегелю)
Участие микроорганизмов в круговороте серы, фосфора и железа
Сера – составная часть некоторых белков. Одним из конечных продуктов гниения белков является H2S. Сероводород не усваивается высшими растениями. Биохимические превращения серы восстановительного и окислительного порядка осуществляются серобактериями. Для них H2S является источником энергии. Серобактерии окисляют H2S с выделением свободной серы, которая отлагается у них в цитоплазме в виде капель:
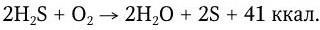
В клетках бактерий сера окисляется далее до серной кислоты:
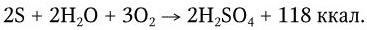
Образующиеся сульфаты (соли H2SO4) служат прекрасным питательным веществом для высших растений. H2S в серную кислоту окисляют различные виды пурпурных серобактерий:
Наряду с такими сульфурирующими бактериями в природе не менее широко распространены и десульфурирующие микробы (аналоги денитрифицирующих бактерий), они восстанавливают сульфаты, вызывая образование H2S. Выделение H2S десульфурирующими бактериями происходит в глубинах морей, поэтому в Черном море на глубине 2500 м содержание H2S доходит до 6,5 мл в 1 л воды. Значительное накопление H2S в результате биологического восстановления серы наблюдается в целебных грязях, в лиманах и других водоемах. В санитарном отношении серобактерии являются важными агентами начальной стадии биологического очищения сточных вод и разложения органических отбросов, содержащих серу. Большинство серобактерий принадлежит к родам Thiobacillus, Sulfolobus и Thiospira. Общая схема круговорота серы представлена на рис. 54. Кроме биологического круговорота серы в атмосфере происходят небиологические превращения ее газообразных форм. Согласно некоторым подсчетам, в атмосферу ежегодно выделяется около 90 млн тонн серы в виде H2S, образующегося биологическим путем. Кроме того, еще 50 млн тонн поступает в атмосферу в виде SO2, образующейся при сжигании топлива, и около 0,7 млн тонн в форме H2S и SO2, возникающих в результате действия вулканов. В атмосфере H2S быстро окисляется до SO2 атомарным (О) и молекулярным (О2) кислородом или озоном (О3). SO2 может растворяться в воде с образованием H2SO3 или окисляться медленно до SO3, которая при растворении в воде превращается в H2SO4. Основная масса H2SO4 вместе с неокисленной H2SO3 возвращается на землю в форме кислоты, которая становится причиной разрушения различных каменных строений, в том числе многих каменных скульптур.
С химической стороны круговорот фосфора достаточно прост, поскольку он встречается в живых организмах только в пятивалентном состоянии в виде свободных фосфатных ионов (РО43 —) или в составе органических фосфатных компонентов клетки. Бактерии не способны поглощать большинство органических фосфорсодержащих соединений, свои потребности в фосфоре они удовлетворяют путем поглощения фосфатных ионов, из которых затем синтезируют органические фосфатные соединения. При разложении гнилостными бактериями белковых веществ одновременно с минерализацией азота происходит превращение органического фосфора в фосфатные ионы. Поскольку большая часть фосфатов, несмотря на быстрый круговорот фосфора, находится в виде нерастворимых солей кальция, железа или алюминия, фосфаты также служат
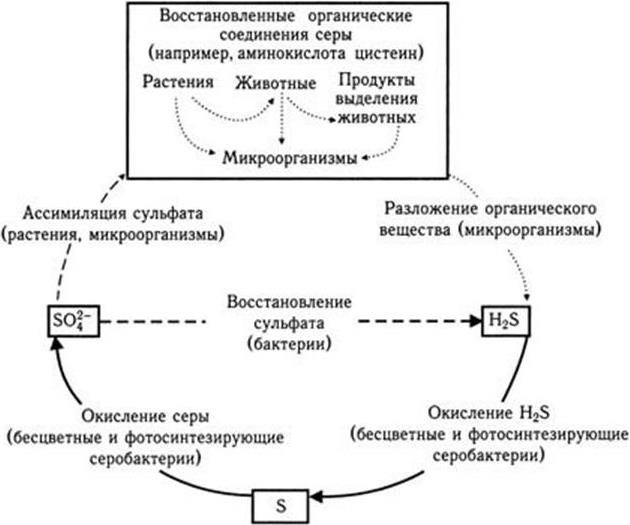
Рис. 54. Круговорот серы (по Р. Стейнеру [и др.])
Окисление атома серы показано сплошными стрелками; восстановление – точечными стрелками; реакции без изменения валентности – пунктирными стрелками
фактором, ограничивающим рост растений. Растворимые фосфаты постоянно переносятся из почвы в море вследствие выщелачивания. Этот перенос имеет однонаправленный характер. Лишь небольшая часть фосфатов возвращается на сушу, главным образом в виде отложений гуано морскими птицами. Поэтому доступность фосфатов для растений зависит от непрерывного перевода в раствор нерастворимых фосфатных отложений – процесса, в котором важную роль играют микроорганизмы. Образуемые ими кислые продукты метаболизма (органические кислоты, а также азотная и серная) растворяют фосфат кальция, а образуемый ими H2S способствует растворению фосфата железа. В круговороте в природе железа большую роль играют железобактерии, для которых железо служит источником окислительного дыхания (донором электронов). Железобактерии окисляют закисные соединения в окисные, а освобождающуюся энергию используют для усвоения углерода из СО2 или карбонатов. Окисление протекает по формуле:
Из железобактерий лучше других изучена не образующая спор подвижная палочка Thiobacillus ferroxidans, которая окисляет и серу. К железобактериям относятся некоторые нитчатые бактерии из рода Leptothrix, а также Gallionella, состоящая из спиральных, закрученных в виде пучков тонких (0,01 – 0,3 мкм) нитей, образующих стебелек, на поверхности которого откладывается гидрат окиси железа. Нитчатые железобактерии в водоемах прикрепляются к различным подводным предметам. Нити бактерий одеты слизистым влагалищем, которое пропитывается гидратом окиси железа. Размножаясь в некоторых озерах в огромных количествах, железобактерии образуют накопления железной руды (например, в Карелии). При размножении в водопроводах железобактерии могут вызывать закупорку просвета труб.
Этапы круговорота различных элементов осуществляются микроорганизмами разных групп. Непрерывное существование каждой отдельной их группы зависит от химических превращений элементов, осуществляемых другими группами микроорганизмов. Разрыв цикла в какой-либо одной точке привел бы к прекращению жизни на Земле. Жизнь непрерывна на Земле потому, что все основные элементы, необходимые для ее проявления (C, N, H, O, P, S), подвергаются циклическим превращениям, во многом благодаря деятельности микроорганизмов.
Микрофлора человека и ее значение
Ребенок развивается в полости матки в стерильных условиях и рождается стерильным. Но уже с первых минут после рождения он вступает в контакт с микрофлорой окружающей среды, и в течение короткого времени его кожные покровы и слизистые оболочки, сообщающиеся с внешней средой, заселяются разнообразными микроорганизмами из воздуха, а также в результате контакта с матерью, обслуживающим персоналом родильного дома и предметами ухода. В результате этого формируется новая экологическая система – организм человека + населяющая его микрофлора. Эта система очень динамична, так как взаимоотношения в ней – симбиоз микроорганизмов с макроорганизмом – могут носить характер мутуализма, комменсализма или паразитизма.
Под мутуализмом понимаются такие взаимоотношения, которые имеют взаимовыгодный характер, т. е. микроорганизмы питаются за счет своего хозяина, но не только не причиняют ему никакого вреда, а, напротив, приносят пользу, например синтезируют для него витамины.
Комменсализм – форма сосуществования, при которой микроорганизмы питаются за счет своего хозяина, не нанося ему особого ущерба. Но при известных условиях комменсалы, которыми обычно являются условно-патогенные бактерии, могут стать виновниками различных, чаще всего гнойно-воспалительных, заболеваний (стафилококки, стрептококки, грамотрицательные бактерии).
Паразитизм – существование микроорганизмов за счет хозяина, сопровождающееся нанесением ему серьезного ущерба в виде того или иного заболевания.
Нормальная, т. е. в условиях здорового организма, микрофлора в количественном и качественном отношении представлена на различных участках тела неодинаково. Причина этого – неодинаковые условия обитания на коже и слизистых оболочках разных органов. Заселение тела человека микроорганизмами происходит в результате оседания пыли и проникновения их вместе с вдыхаемым воздухом, принимаемой пищей и т. д. Общее количество микроорганизмов, обнаруживаемых у взрослого человека, достигает 1014, что почти на порядок больше числа клеток всех тканей человека. В разных участках человеческого тела в соответствии с условиями обитания формируются ассоциации (биотопы) микроорганизмов, состоящие из разнообразных видовых сочетаний. На слизистых оболочках, особенно желудочно-кишечного тракта, представители нормальной микрофлоры обитают в виде двух форм: часть из них располагается в просвете, другая часть заключена в высокогидратированный матрикс, который состоит из экзополисахаридномуциновых компонентов, образуя своеобразную биопленку. Заключенные в эту биопленку микроорганизмы обладают по сравнению с просветными более высокой устойчивостью к действию физических, химических и биологических факторов. В случае, когда эти факторы подавляют компенсаторные возможности экологической системы (хозяин и его микрофлора), могут возникать микроэкологические нарушения, результатом которых могут быть различные патологические состояния и другие неблагоприятные последствия (формирование антибиотикоустойчивых и атипичных штаммов, образование новых микробных биотопов и т. п.).
Микрофлора кожи. Кожные покровы обильно заселены микроорганизмами, особенно места, защищенные от действия света и высыхания (подмышечные впадины, межпальцевые и паховые складки, промежность). Количество бактерий на 1см2 варьирует от нескольких единиц до сотен тысяч особей. По расчетам П. Ремленже, общее число микробов на коже одного человека колеблется от 100 млн до 1 млрд клеток. Существенное значение имеет гигиеническое содержание кожных покровов. Наиболее постоянен состав микрофлоры не на поверхности кожи, где он нередко имеет случайный характер, а в глубоких слоях ее, в области устьев сально-волосяных фолликулов. Наиболее частыми представителями кожной микрофлоры являются Staphylococcus epidermidis, S. saprophyticus и грибы рода Candida, реже встречаются дифтероиды, микрококки. На кожных покровах условия для размножения бактерий не очень благоприятны, так как на них губительно действуют высыхание, десквамация эпителия, образующиеся перекиси, кислая рН и другие антимикробные факторы. При нормальном состоянии кожных покровов человек не ощущает присутствия на них микроорганизмов, но при травмах, потертостях, потливости, экзематозных поражениях они тотчас же дают о себе знать, вызывая процессы гнилостного разложения, отторжения эпидермиса, воспаление сальных и потовых желез и нагноительные процессы. Сдвиг пропорции микрофлоры кожи в сторону увеличения доли грамотрицательных бактерий служит указанием на нарушение ее нормального состава.
Микрофлора верхних дыхательных путей представлена стрептококками, дифтероидами, моракселлами, псевдомонадами. Основная масса микрофлоры ротои носоглотки приходится на долю зеленящего стрептококка (до 99 % всех микроорганизмов). Постоянно, но в меньшем количестве, встречаются нейссерии, коринебактерии (дифтероиды) и стафилококки. На состав микрофлоры оказывают влияние бактерицидные вещества слюны (лизоцим, ингибин), фагоцитарная активность лейкоцитов, адсорбционные свойства слизи и ресничек эпителиальных клеток. При спокойном дыхании человек с каждым вдохом поглощает от 1500 до 14 000 и более микробных клеток, но все они задерживаются в верхних отделах дыхательных путей (это было доказано исследованиями плеврального воздуха при естественном пневмотораксе). Слизистая оболочка гортани, трахеи, бронхов и альвеолы здорового человека не содержат микроорганизмов.
Микрофлора мочеполового тракта менее обильна, но по видовому составу разнообразна и представлена стафилококками, дифтероидами, стрептококками, микобактериями, бактероидами, фузобактериями. В наружных отделах половых органов и мочевыводящих путей чаще всего обнаруживаются микобактерии смегмы и фузобактерии. Во влагалище здоровых женщин преобладают молочнокислые палочки Додерлейна и дифтероиды, значительно реже встречаются стрептококки, стафилококки, пептострептококки, клостридии и грамотрицательные палочки. Число бактерий в мочеполовом тракте значительно уменьшается по мере удаления от его наружных отделов. Полость матки, фаллопиевы трубы и мочевой пузырь здоровых людей обычно микробов не содержат. На состав микрофлоры мочеполового тракта оказывают влияние бактерицидные свойства секретов половых путей, а у женщин – высокая кислотность влагалищного секрета (рН 4,0 – 4,6), которая регулируется молочнокислой палочкой Додерлейна (разные виды рода Lactobacillus) за счет образуемой ею молочной кислоты при расщеплении углеводного компонента слизи, прежде всего гликогена. Кислая среда угнетает рост стафилококков и грамотрицательных бактерий.
Микрофлора желудочно-кишечного тракта. Микрофлора полости рта представлена многочисленными видами аэробных и анаэробных микроорганизмов, так как для них здесь имеются вполне благоприятные условия – щелочная реакция слюны, наличие пищевых остатков, благоприятная для размножения температура (37 °C). Сразу после рождения ребенка в его ротовой полости формируется аэробная флора – кокки, палочки; с прорезыванием зубов появляются анаэробные бактерии, в том числе вибрионы, спириллы, спирохеты, клостридии. В полости рта происходит непрерывное загрязнение микробами и самоочищение под влиянием лизоцима, ингибина и других факторов, вследствие чего формируется более или менее постоянная микрофлора, наиболее частыми представителями которой являются стафилококки, стрептококки, грибы Candida, лактобактерии, нейссерии, спирохеты, вибрионы, постоянно присутствуют анаэробы – вейллонеллы, бактероиды, пептострептококки. Иногда из слюны здоровых людей выделяют простейших, аспергиллы, дрожжи и другие микроорганизмы (см. также гл. 73).
Пищевод у здоровых людей обычно свободен от микроорганизмов или заселен ими очень мало.
Желудок. В связи с кислой реакцией среды, неблагоприятной для развития микроорганизмов, в желудке прижилась специфическая микрофлора: дрожжи, сарцины, грибы, лактобактерии, стафилококки, стрептококки, кампилобактерии и др., но не гнилостные бактерии (всего до 30 видов). Изменение состава микрофлоры, в частности появление гнилостных бактерий, – признак нарушения нормальной функции желудочной секреции.
Тонкий кишечник. Микрофлора не обильная и довольно однообразная: лактобактерии, энтерококки, бифидумбактерии, E. coli и некоторые другие. Размножению бактерий препятствуют бактериостатическое действие желчи, секретов слизистой оболочки и секреторные иммуноглобулины класса IgAs. В ряде случаев, например в связи с нарушением желудочной секреции или с повреждением слизистой оболочки кишечника в результате радиационного облучения, или вследствие заболевания печени, желчных путей и поджелудочной железы, или иммунодефицита, у людей развивается синдром избыточной колонизации тонкого кишечника. Он заключается в том, что в тонкой кишке резко увеличивается концентрация бактериальной популяции, аналогичной по видовому и количественному составу микрофлоре толстого кишечника. Такое накопление в тонком кишечнике необычной для него микрофлоры может привести к различным нарушениям его функции и к явлениям энтеральной недостаточности.
Микрофлора толстого кишечника наиболее обильна и многообразна. Особенности условий обитания для микроорганизмов в толстом кишечнике состоят в том, что это орган не секреторный, а экскреторный, в нем отсутствует лизоцим, лимфоидная ткань представлена менее мощно, в то же время здесь благоприятные рН, температура, обилие питательных веществ и т. п. Формирование микрофлоры толстого кишечника начинается с первым вздохом ребенка, но в первые три дня, пока ребенок питается молозивом (молоко, обогащенное иммуноглобулинами матери), в толстом кишечнике размножаются разнообразные, в том числе гнилостные, бактерии. Как только он начинает питаться грудным молоком матери, гнилостные бактерии исчезают и формируется постоянная микрофлора, в которой преобладают бактерии, образующие при ферментации глюкозы молочную кислоту. В толстом кишечнике обнаружено более 260 видов бактерий, общая биомасса их составляет около 1,5 кг.
Микрофлору толстого кишечника можно разделить на четыре следующие группы:
• Основную массу микрофлоры составляют строгие анаэробы, не образующие спор: грамположительные бактерии рода Bifidobacterium и грамотрицательные бактерии семейства Bacteroidaceae. На долю бифидобактерий и бактероидов приходится до 96 – 99 % всей микрофлоры толстого кишечника. Они выделяются из испражнений даже при разведении 10– 12– 10– 10 степени.
• Вторую группу составляют факультативные анаэробы, представленные главным образом грамотрицательной E. coli и грамположительными энтерококками и молочнокислыми палочками рода Lactobacillus (спор не образуют). На их долю приходится 1 – 4 % всей микрофлоры.
• Третью группу составляет так называемая остаточная микрофлора, на которую приходится 0,001 – 0,01 % всех микроорганизмов толстого кишечника. К этой группе принадлежат: Staphylococcus, Proteus, Candida, Clostridium, Pseudomonas.
• К четвертой группе относятся различные другие представители семейства Enterobacteriaceae, которые могут временно или постоянно обнаруживаться в кишечнике и вызывать кишечные инфекции (Salmonella, Shigella, Enterobacter и другие роды).
Таким образом, кожные покровы и слизистая оболочка организма заселены различными видами микроорганизмов, которые образуют с макроорганизмом единую целостную экологическую систему. Состав и состояние микрофлоры зависят от макроорганизма, но, в свою очередь, и микрофлора, особенно толстого кишечника, оказывает существенное и многообразное влияние на макроорганизм. Ее воздействие на макроорганизм проявляется в следующем:
1. Она является одним из важных факторов естественной резистентности организма, так как проявляет высоко антагонистическое действие по отношению к другим, в том числе патогенным, бактериям, препятствуя их размножению в организме. На это обстоятельство давно указывал И. И. Мечников: «Природа пользуется конкуренцией безобидных микробов, чтобы помешать поселению патогенных микробов». И. И. Мечникову принадлежит идея употребления в пищу молочнокислых продуктов с целью подавления развития в кишечнике гнилостных бактерий и продления жизни человека.
2. Микрофлора своими антигенными факторами стимулирует развитие лимфоидной ткани организма и таким образом также способствует развитию неспецифической и опосредованной специфической резистентности.
3. Микрофлора, особенно толстого кишечника, участвует в процессах пищеварения, в том числе в обмене холестерина и желчных кислот.
4. Важная роль микрофлоры заключается также в том, что она обеспечивает организм человека различными витаминами, которые синтезируются ее представителями (витамины В1, В2, В6, В12, К, никотиновая, пантотеновая, фолиевая кислоты и др.). Эти витамины обеспечивают бZольшую часть потребностей в них организма. Однако представители нормальной микрофлоры не всегда приносят только пользу. При определенных условиях, в частности при воздействии факторов, снижающих естественную резистентность, особенно в результате ионизирующего облучения, практически все представители нормальной микрофлоры, за исключением бифидумбактерий, могут стать виновниками различных эндогенных инфекций, чаще всего гнойно-воспалительных заболеваний с различной локализацией: ангины, менингиты, циститы, отиты, сепсисы, нефриты, аппендициты, абсцессы, флегмоны и т. п. Нередко после перенесенных кишечных заболеваний и особенно после длительного и нерационального применения антибиотиков возникают дисбактериозы.
Дисбактериоз – изменение количественного соотношения и состава нормальной микрофлоры организма, главным образом кишечника, при котором происходит уменьшение количества или исчезновение обычно составляющих ее микроорганизмов и появление в большом количестве редко встречающихся или не свойственных ей микробов. Обычно это соотношение изменяется в сторону увеличения количества факультативно-анаэробной или остаточной микрофлоры, главным образом грамотрицательных палочек, стафилококков, дрожжеподобных грибов Candida или Clostridium. Причиной дисбактериоза очень часто бывает бесконтрольное применение антибиотиков, особенно с широким спектром действия. Подавляя жизнедеятельность нормальной микрофлоры кишечника, они способствуют колонизации его другими видами антибиотикоустойчивых бактерий, что и служит причиной диарей, а иногда и очень тяжелых форм дисбактериоза и заболеваний различной этиологии (стафилококковый сепсис, псевдомембранозный колит и др.). Для лечения и профилактики дисбактериоза и других диарей, улучшения функционирования желудочнокишечного тракта во многих странах мира все в большем количестве начинают применять в различных формах эубиотики, пробиотики, пребиотики, синбиотики и другие биологически активные вещества.
Эубиотики – микроорганизмы, участвующие в формировании естественного, исторически сложившегося микробиоценоза в кишечнике (главным образом в толстом). К ним относятся прежде всего лактобациллы и бифидумбактерии, метаболическая активность которых определяет положительное влияние микрофлоры кишечника на организм человека.
Пробиотики – эубиотики, добавляемые к молочным продуктам (йогурт, кефир, молоко и т. д.) или используемые в виде чистых культур, жидких или таблетированных (бифидумбактерин, лактобактерин, колибактерин и др.), или в виде различных комбинаций (бификол – смесь бифидумбактерин + E. coli М-17, обладающая выраженным антагонистическим действием в отношении ряда других бактерий). В качестве пробиотиков используют также и некоторые споровые бактерии (Bacillus cereus, B. subtilis).
Пребиотики – неперевариваемые ингредиенты продуктов питания, которые селективно стимулируют рост и метаболическую активность эубиотиков, способствуют улучшению здоровья человека (низкомолекулярные углеводы, лактулоза и др.). Пребиотики содержатся в артишоке, луке репчатом, цикории, чесноке, кукурузных хлопьях, горохе, фасоли, овсяной крупе и других продуктах.
Синбиотики – смеси пробиотиков и пребиотиков.
Дисбактериозы развиваются потому, что антибиотики, особенно с широким антимикробным спектром, действуют не только на возбудителя заболевания, но и на чувствительных к ним представителей нормальной микрофлоры, угнетая их размножение. В этих условиях те микроорганизмы, на которые антибиотики не действуют, начинают беспрепятственно размножаться, особенно если понижена и естественная резистентность организма. Чаще всего устойчивыми являются стафилококки, грибы Candida и различные грамотрицательные палочки (кишечная палочка, протей, псевдомонады). Это и приводит к развитию дисбактериозов. Наиболее тяжелыми формами дисбактериозов, представляющими уже самостоятельные заболевания, являются стафилококковые пневмонии, стафилококковые сепсисы, кандидомикозы (в том числе генерализованные) и антибиотико-ассоциированные колиты, особенно стафилококковый и псевдомембранозный колит, вызываемый Clostridium difficile. Для лечения дисбактериозов кишечника и колитов рекомендуется применение специальных бактерийных препаратов, способствующих восстановлению нормальной микрофлоры: колибактерин (высушенная взвесь живых бактерий антагонистически активного в отношении шигелл Флекснера и Зонне штамма E. coli M-17), бифидумбактерин (высушенная взвесь живых бифидобактерий), лактобактерин (высушенная взвесь антагонистически активных штаммов лактобактерий), бификол (высушенная взвесь живых антагонистически активных бифидобактерий и E. coli M-17), бактисубтил или других, сходных по назначению и составу биопрепаратов.
Санитарная микробиология и ее значение
Микрофлору окружающей среды и обусловливаемые ее жизнедеятельностью процессы, которые могут оказать влияние на здоровье человека, изучает санитарная микробиология. Это самостоятельная наука со своими целями, задачами и методами исследования. Она сформировалась на стыке трех дисциплин: микробиологии, эпидемиологии и гигиены. Санитарная микробиология призвана решать следующие задачи:
1. Разработка, совершенствование и оценка методов микробиологических исследований разнообразных объектов внешней среды (воды, воздуха, почвы, пищевых продуктов, предметов обихода и т. п.).
2. Оценка путей воздействия человека и животных на окружающую среду, которые могут стать причиной загрязнения ее опасными для здоровья микроорганизмами, включающая изучение: а) естественного взаимообмена микрофлорой между людьми, животными и средой их обитания; б) различных сторон общественной и индивидуальной деятельности людей, которые могут стать причиной накопления опасных микроорганизмов и загрязнения ими различных объектов; в) тех производственных и бытовых процессов, которые приводят к нарушению естественного самоочищения и обеззараживания окружающей среды.
3. Разработка государственных санитарных стандартов, а также других нормативов, определяющих соответствие микрофлоры объектов внешней среды гигиеническим требованиям, включая микробиологические показатели.
4. Разработка рекомендаций и мероприятий по оздоровлению объектов внешней среды путем воздействия на их микрофлору и проверка эффективности этих мероприятий.
5. Охрана окружающей среды. Эта задача является одной из главных задач санитарной микробиологии и гигиены. В ее основе лежат всестороннее изучение закономерностей взаимодействия человека с факторами внешней среды и разработка научно обоснованных рекомендаций по сохранению здоровья человека.
Санитарно-микробиологические исследования объектов внешней среды должны прежде всего решать вопрос о наличии или отсутствии в них патогенных для человека микроорганизмов (бактерий, вирусов и грибов). Однако непосредственное обнаружение их в объектах окружающей среды сопряжено с рядом трудностей. Поэтому санитарная микробиология использует свой особый, непрямой способ оценки санитарного благополучия объектов внешней среды. Способ основан на том, что главным источником возбудителей инфекционных болезней являются люди и теплокровные животные, выделяющие патогенные микроорганизмы в окружающую среду, главным образом фекальным и воздушно-капельным путем. Поэтому, чем обильнее загрязнены объекты внешней среды этими выделениями, тем вероятнее, что эти объекты заражены и соответствующими патогенами.
Для многих видов микроорганизмов кишечник – биотоп, т. е. единственная естественная среда их обитания. Следовательно, обнаружение в исследуемом материале представителей микрофлоры кишечника служит непосредственным доказательством фекального загрязнения объекта и указанием на возможное присутствие в нем возбудителей кишечных инфекций (брюшного тифа, холеры и т. п.). Полость рта – биотоп для многих других микроорганизмов. Обнаружение их в исследуемом материале служит указанием на возможное заражение объекта возбудителями капельных инфекций (дифтерии, скарлатины и т. п.). Выделяемые в этих случаях микроорганизмы выступают в роли показателей санитарного неблагополучия, т. е. потенциальной эпидемиологической опасности исследуемых объектов, поэтому они получили название «санитарно-показательных». Однако в качестве таковых выступают не все представители нормальной микрофлоры тела человека или животного, а только те из них, которые отвечают следующим требованиям (Кочемасова З. Н. [и др.], 1987):
1. Они должны постоянно содержаться в выделениях человека или теплокровных животных и выделяться в окружающую среду в больших количествах.
2. Они не должны иметь другого природного резервуара, кроме организма человека или животного.
3. После выделения в окружающую среду они должны сохранять жизнеспособность в течение сроков, близких к срокам выживания патогенных микробов, выводимых из организма теми же путями.
4. Они не должны активно размножаться в окружающей среде.
5. Они не должны сколько-нибудь значительно изменять свои биологические свойства в окружающей среде.
6. Они должны быть достаточно типичными, чтобы их дифференциальная диагностика осуществлялась без особого труда.
7. Обнаружение, идентификация и количественный учет должны производиться современными, простыми, легко доступными и экономичными микробиологическими методами.
8. Рост санитарно-показательных микроорганизмов на питательных средах должен быть свободен от влияния других присутствующих микробов.
9. В объекте внешней среды они должны быть распределены по возможности равномерно. В случае исследования плотных пищевых объектов последние подвергаются гомогенизации для равномерного распределения микробов.
10. Санитарно-показательные микроорганизмы должны встречаться как в организме своего хозяина, так и во внешней среде в количествах, значительно больших, чем соответствующие патогенные микроорганизмы.
Чем большему числу указанных требований удовлетворяет тот или иной представитель нормальной микрофлоры тела человека или животного, тем в большей степени он соответствует функции санитарно-показательного микроорганизма.
Наиболее важными показателями фекального загрязнения во всем мире признаются бактерии группы кишечной палочки (БГКП). Под этим общим понятием объединяют бактерии семейства Enterobacteriaceae, родов Citrobacter, Enterobacter, Klebsiella. К категории БГКП относят грамотрицательные, не образующие спор и не обладающие оксидазной активностью палочки, ферментирующие лактозу и глюкозу до кислоты и газа при температуре 37 °C в течение 24 ч. Эти бактерии выделяются в окружающую среду только с испражнениями человека и теплокровных животных.
Среди БГКП выделяют лактозоположительные палочки (колиформные по международной классификации), которые ферментируют лактозу при температуре 37 °C с образованием кислоты и газа, а из этой группы – фекальные кишечные палочки (ФКП), ферментирующие лактозу при температуре 44,5 °C. Из ФКП к E. coli относятся только бактерии, не способные расти на среде, содержащей в качестве единственного источника углерода и энергии цитрат. Эти бактерии являются показателями свежего фекального загрязнения. К показателям фекального загрязнения относят, помимо БГКП, энтерококки (разновидность S. faecalis), клостридии (C. perfringens), бактерии рода Proteus и колифаги. Перспективными для этих целей могут быть и бифидобактерии, но их трудно культивировать (строгие анаэробы) и идентифицировать. Поскольку энтерококки выживают во внешней среде относительно недолго, их обнаружение, как и обнаружение E. coli, служит показателем свежего фекального загрязнения.
Для оценки санитарно-гигиенических показателей безопасности питьевой воды, продовольственного сырья и пищевых продуктов, воды минеральной питьевой, лечебной и лечебно-столовой, вод поверхностных стоков, открытых водоемов и морей, всех категорий сточных вод, лечебных грязей и почвы используются унифицированные методы анализа, предусмотренные соответствующими нормативными документами, ГОСТами, методическими указаниями и другими актами санитарного законодательства страны.
Например, в соответствии с этими актами, нормативы микробиологических показателей питьевой воды таковы:
1. Общее микробное число (количество микроорганизмов в 1 мл воды) – не более 100.
2. Число бактерий группы кишечной палочки (коли-индекс) – количество БГКП в 1000 мл воды – не более 3.
3. Эшерихии (показатель свежего фекального загрязнения) – количество эшерихий в 1000 мл воды – отсутствие.
4. Колифаги – количество бляшкообразующих единиц (БОЕ) в 1000 мл воды – отсутствие.
Кроме того, в 25 л питьевой воды должны отсутствовать патогенные простейшие (цисты лямблий, дизентерийных амеб, балантидий) и яйца гельминтов.
Для оценки бактериального загрязнения почвы санитарно-показательными микроорганизмами служат БГКП, энтерококки, клостридии (C. perfringens), термофилы; воздуха – стафилококки и стрептококки; предметов обихода – БГКП, стафилококки, энтерококки; пищевых продуктов – БГКП, энтерококки, стафилококки, бактерии группы протея.
Микробиологические нормативы для стерилизованных продуктов детского питания: не допускается в массе 10 см3 продукта наличия БГКП, E. coli, S. aureus, и в массе 100 см3 – патогенных бактерий, в том числе сальмонелл. Допускается в1см3 продукта не более 100 КОЕ (колониеобразующих единиц) мезофильных аэробных и факультативно-анаэробных микроорганизмов.
Для кисломолочных продуктов детского питания не допускается в массе 3 см3 продукта БГКП, в 10 см3 – E. coli и S. aureus, в 50 см3 – патогенных бактерий, в том числе сальмонелл. В пастообразных продуктах (творог), готовых кашах и напитках не допускается в 1 г продукта содержания БГКП, E. coli и S. aureus; патогенных бактерий, в том числе сальмонелл – в 50 г.
С 1 сентября 2002 г. вступило в силу новое Постановление СанПиН 2.3.2.1078-01, утвержденное Главным государственным санитарным врачом РФ от 14.11.2001 г.
№ 36, дополненное и измененное в 2008 г. СанПиН 2.3.2.2401-08.
УЧЕНИЕ ОБ ИНФЕКЦИИ
Инфекция, факторы инфекционного процесса и основные формы инфекций
Слово «инфекция» происходит от латинского «inficio» – вношу что-либо вредное, заражаю, и позднелатинского «infectio» – заражение. Однако буквальный перевод слова не вполне отвечает вкладываемому в это понятие содержанию. В обиходе это слово употребляют, вкладывая в него три различных понятия. Очень часто термин «инфекция» отождествляется с понятием «инфекционное заболевание». В других случаях под инфекцией понимают заразное начало (т. е. инфект – возбудитель заболевания); наконец, под инфекцией понимают сам процесс заражения. В действительности, под термином «инфекция» правильнее понимать процесс взаимодействия между микро– и макроорганизмом, протекающий в конкретных условиях внешней среды (в том числе социальной). При таком самом широком понимании термина «инфекция» учитываются все три варианта его толкования.
Инфекционное заболевание есть одна из форм инфекции, самая крайняя (тяжелая), но не единственная форма ее проявления. Вместе с тем именно при таком подходе к понятию инфекция становится ясным, какие факторы обусловливают инфекцию и в чем заключается сущность инфекционного процесса.
На заре развития микробиологии господствовала так называемая триада Генле – Коха, которая подчеркивала главную, ведущую роль в развитии инфекционного процесса микроорганизма – возбудителя заболевания. В соответствии с ней: 1) микроорганизм всегда должен встречаться при данной болезни и не встречаться у здоровых людей и у больных другими болезнями; 2) микроорганизм должен быть выделен от больного в чистой культуре; 3) чистая культура микроорганизма должна вызвать то же самое заболевание. Однако многочисленные наблюдения со временем привели к пересмотру этой доктрины. Стало очевидным, что развитие болезни зависит не только от свойств возбудителя, но во многом и от состояния макроорганизма, которое, в свою очередь, зависит от условий его существования. Вместе с тем было бы ошибочно сущность инфекционного процесса рассматривать без учета роли микроорганизма – возбудителя данного заболевания. Задача науки в том и состоит, чтобы раскрыть и показать роль того и другого участника этого очень сложного процесса взаимодействия и обеспечить правильное воздействие на развитие и исход инфекционного заболевания. Врач должен эффективно влиять на возбудителя, назначая рациональное антибактериальное лечение, и на организм человека, мобилизуя его защитные механизмы.
Вот почему основным положением современного учения об инфекции является признание того непреложного факта, что возникновение, развитие и исход инфекции как процесса взаимодействия между микро– и макроорганизмом зависят от свойств того и другого участников этого конкурентного взаимодействия и от условий внешней среды, в которых оно происходит. Инфекции принято разделять на две основные группы: а) манифестная инфекция, т. е. инфекционная болезнь, которая может протекать типично, атипично, хронически и т. п.; б) бессимптомная инфекция (носительство, латентная, абортивная, дремлющая и т. п.).
В зависимости от свойств главных факторов инфекционного процесса (т. е. возбудителя и макроорганизма) различают следующие основные формы инфекции:
1. Абортивная. Возбудитель проникает в организм, но не размножается в нем или в связи с надежной естественной резистентностью, или с приобретенным специфическим иммунитетом, подавляющим возбудителя. Таким образом, инфекционный процесс обрывается, и возбудитель рано или поздно погибает или удаляется из организма.
2. Латентная (инаппарантная). Возбудитель проникает в организм, размножается в нем, макроорганизм отвечает на него соответствующими иммунобиологическими реакциями, ведущими к формированию приобретенного иммунитета и удалению возбудителя из организма. Однако никаких внешних клинических проявлений этой инфекции нет, она протекает скрыто (латентно). Нередко в такой латентной форме люди переносят полиомиелит, бруцеллез, некоторые вирусные гепатиты и другие болезни.
3. Дремлющая инфекция. Бессимптомное пребывание возбудителя в организме может сохраняться долгое время после латентной инфекции или после перенесенного заболевания, например легочного туберкулеза, закончившегося формированием первичного комплекса (см. главу 65). Под влиянием условий, понижающих сопротивляемость организма, сохраняющиеся в нем живые микроорганизмы активизируются и вызывают заболевание или его рецидив. Таким образом, патогенные микробы находятся некоторое время как бы в «дремлющем» состоянии. Такие «дремлющие» микробы могут проникать в организм из внешней среды или быть результатом перехода в «дремлющее» состояние микробавозбудителя, подавленного в своей активности, но сохранившего жизнеспособность и потенциальную готовность к активации при благоприятных для него условиях. Поэтому они получили название «микробов, готовых к выходу» (франц. «microbes de sortie»). В тех случаях, когда «дремлющие» в организме микробы сосредоточены в местном ограниченном очаге, откуда они могут распространяться и вызывать заболевание, применяют термин «фокальная» инфекция (например, заглохший воспалительный процесс в кариозном зубе, в котором его возбудитель – стрептококк – сохраняется в «дремлющем» состоянии до поры до времени).
4. Типичная для данного возбудителя форма инфекции. Возбудитель проникает в организм, активно в нем размножается, вызывая характерные (типичные) для данной болезни клинические проявления, которые также характеризуются определенной цикличностью.
5. Атипичная форма. Возбудитель проникает в организм, активно в нем размножается, организм отвечает соответствующими иммунобиологическими реакциями, которые приводят к формированию активного иммунитета, но клинические симптомы болезни носят невыраженный, стертый или атипичный характер. Чаще всего это связано либо со слабыми патогенными свойствами возбудителя, либо с высокой естественной резистентностью организма, либо с эффективным антибактериальным лечением, либо с действием всех этих трех факторов.
6. Персистентная (хроническая). Возбудитель проникает в организм, размножается в нем, вызывает активную форму болезни, но под влиянием иммунных систем организма и химиопрепаратов подвергается L-трансформации. Поскольку L-формы бактерий не чувствительны ко многим антибиотикам и химиопрепаратам, чей механизм действия связан с нарушением синтеза клеточной стенки, а также к антителам, они могут длительное время переживать (персистировать, англ. persistence – живучесть) в организме. Возвращаясь в свою исходную форму, возбудитель восстанавливает патогенные свойства, размножается и вызывает обострение (рецидив) болезни. Типичным примером такой хронической инфекции является туберкулез. Сохраняющиеся в организме больного L-формы туберкулезной палочки являются главной причиной хронического течения этой болезни, а превращение L-форм туберкулезных палочек в исходные Mycobacterium tuberculosis – главная причина обострения и рецидивов ее.
7. Медленные инфекции. Возбудитель проникает в организм и может долгое время – месяцы, годы – сохраняться в нем внутриклеточно в латентном состоянии. В силу ряда биологических особенностей возбудителей медленных инфекций организм не в состоянии от них избавиться, а при благоприятных для возбудителя условиях он начинает беспрепятственно размножаться, заболевание протекает все тяжелее и тяжелее и, как правило, заканчивается смертью больного. Медленные инфекции характеризуются длительным инкубационным периодом, длительным прогрессирующим развитием болезни, слабым иммунным ответом и тяжелым исходом. Типичным примером медленной инфекции является СПИД.
8. Бактерионосительство. Очень часто после либо латентной инфекции, либо перенесенного заболевания организм человека не в состоянии полностью освободиться от возбудителя. При этом человек, будучи практически здоровым, становится его носителем в течение многих месяцев или даже лет. Являясь источником заражения для других лиц, бактерионосители играют большую роль в эпидемиологии многих заболеваний (брюшного тифа, дифтерии и др.), поскольку они выделяют их возбудителей в окружающую среду, заражают воздух, воду, пищевые продукты. Около 5 – 8 % людей, переболевших брюшным тифом, становятся хроническими (на срок более 3 мес.) носителями S. typhi и служат основным их резервуаром в природе.
Существуют понятия реинфекции, суперинфекции, микст-инфекции, вторичной инфекции.
Реинфекция – повторное заражение и развитие инфекции, вызванной тем же возбудителем, обычно в форме клинически выраженной инфекционной болезни, так как после заболевания напряженный иммунитет не вырабатывается.
Суперинфекция – инфицирование организма болеющего тем же возбудителем до наступления выздоровления.
Микст-инфекция (коинфекция) – одновременное возникновение двух инфекционных процессов, вызванных различными микроорганизмами. Противоположное понятие – моноинфекция.
Вторичная инфекция – возникает как следствие ослабления иммунитета на фоне первичного инфекционного заболевания и может вызываться различными возбудителями (бактериями, вирусами, грибами). Вторичные инфекции, вызванные малопатогенными или непатогенными для здорового человека микроорганизмами, у страдающего иммунодефицитом человека принято называть оппортунистическими.
Аутоинфекция – развитие инфекционного процесса, вызванного собственной (как правило, условно-патогенной) микрофлорой, населяющей кожу и слизистые оболочки, при попадании ее в другие биотопы (например, в рану) в результате самозаражения.
Различают также инфекцию экзогенную и эндогенную (в том числе аутоинфекцию), очаговую (локальную) и генерализованную.
Динамика развития инфекционной болезни
Развитие инфекционной болезни характеризуется определенной цикличностью, сменой периодов. Различают инкубационный и продромальный периоды, периоды развития (расцвета) болезни и выздоровления (реконвалесценции).
Инкубационный период – период от момента заражения до появления первых признаков заболевания. В течение этого периода в организме происходит активное размножение и накопление возбудителя и его токсинов до определенного порогового количества, после которого организм начинает отвечать теми или иными клиническими проявлениями, т. е. наступает следующий, продромальный период. Продолжительность инкубационного периода варьирует в среднем от нескольких дней до нескольких недель, но он может быть равен и нескольким часам и длиться несколько месяцев, а при лепре – несколько лет. Это зависит от ряда причин – величины заражающей дозы и степени патогенности возбудителя, а также от состояния резистентности организма.
Продромальный период, или период предвестников. Он характеризуется обычно неспецифическими, общими проявлениями – слабость, разбитость, головная боль, общее недомогание, повышение температуры и т. п. Его продолжительность варьирует в пределах 24 – 48 ч.
Период развития (расцвета) болезни. Он также часто характеризуется известной цикличностью. Различают стадию нарастания симптомов (стадия incrementum), расцвета болезни (стадия acme) и период угасания симптомов (стадия decrementum). При типичной форме болезни этот период характеризуется проявлением специфических для данной болезни симптомов, а также и некоторыми общими симптомами, в частности, лихорадкой, интоксикацией, воспалением, иногда появлением сыпи.
Период выздоровления, или реконвалесценции. Клиническое выздоровление наступает обычно раньше патологоанатомического и бактериологического выздоровления. Человек практически здоров, но на месте локализации процесса еще остаются какие-либо патологоанатомические изменения (например, после перенесенной дизентерии на слизистой оболочке толстой кишки). Реконвалесценция может быть полной: все процессы заканчиваются полностью без каких-либо отягощающих последствий. Однако некоторые болезни оставляют тяжелые последствия, например паралич мышц после полиомиелита, энцефалита; цирроз печени после вирусного гепатита В и т. п. Особо следует принимать во внимание бактериологическое выздоровление после инфекционного заболевания, т. е. полное освобождение организма от возбудителя. При различных инфекционных заболеваниях срок бактериологического выздоровления варьирует, и это учитывается при выписке таких больных из больницы. Например, при брюшном тифе до 80 % реконвалесцентов в течение первых двух недель являются бактерионосителями. Бактериологическое выздоровление контролируют лабораторными бактериологическими анализами. Об эпидемиологическом значении бактерионосительства сказано выше.
Патогенность бактерий. Факторы патогенности и особенности их генетического контроля
Термин «патогенность» означает способность микроорганизмов вызывать заболевания. Он состоит из двух греческих слов: pathos – страдание, болезнь, и genes – рождающий. Патогенными, т. е. болезнетворными, являются далеко не все бактерии. Поэтому закономерным является вопрос, как они возникли или чем определяется их патогенность. Однозначного ответа на него дать невозможно, так как патогенность разных бактерий определяется их особыми свойствами. Одним из объяснений происхождения патогенных бактерий служит допущение того факта, что их появление связано с приспособлением к паразитическому существованию и приобретением в связи с этим таких биологических свойств, которые обеспечивают им способность противостоять защитным механизмам макроорганизма. Как уже отмечалось, между микро– и макроорганизмом существуют различные формы симбиоза: мутуализм, комменсализм и паразитизм. Переход от комменсализма к паразитизму вполне логичен. Это положение подтверждает наличие в природе так называемых микробов-двойников. Например, есть микобактерии, патогенные для человека и теплокровных животных, патогенные для холоднокровных и растений, и микобактерии непатогенные (например, Mycobacterium smegmatis – представитель микрофлоры слизистой оболочки мочеполовых путей человека). Вероятнее всего предположение, что патогенные микобактерии обособились в разные группы в результате адаптации к паразитизму за счет соответствующих организмов. Вместе с тем возбудители таких заболеваний, как ботулизм и столбняк, постоянно существуют во внешней среде: естественной средой обитания для них служит почва. Их патогенность для человека и теплокровных животных связана со способностью вырабатывать сильнейшие токсины. Однако не ясно, какую роль токсинообразование играет в жизни и экологии этих бактерий.
Другой механизм превращения непатогенных бактерий в патогенные связан с получением первыми дополнительных генов от бактериофагов либо плазмид. Например, дифтерию у человека вызывают только патогенные Corynebacterium diphtheriae, а способность синтезировать дифтерийный экзотоксин они приобретают в результате лизогенной конверсии (см. главу 47). Иначе говоря, болезнетворность этих бактерий зависит от передачи им генов токсигенности от особых токсигенных коринефагов. Интегрируясь в хромосому непатогенных коринебактерий, такие фаги привносят в них свои гены, которые и превращают непатогенные коринебактерии в возбудители дифтерии. В свою очередь, многие варианты диареегенных кишечных палочек возникли в результате приобретения ими плазмид, в составе которых имеются гены, превращающие непатогенную E. coli в патогенную, способную вызывать различные формы эшерихиозов.
Наконец, в природе существуют различные виды бактерий, способных с помощью сенсорно-регуляторных систем перестраивать свой метаболизм в зависимости от того, в каких условиях они существуют – во внешней среде или в организме теплокровных животных. Эти бактерии (легионеллы, иерсинии и др.) получили название сапронозных, так как естественной средой их обитания являются почва и растительные организмы. Однако, попадая в организм человека или животных, они изменяют свой метаболизм в сторону, способствующую их размножению и в этих условиях, т. е. при более высокой температуре в живом организме с его механизмами самозащиты.
Патогенность, или способность вызывать заболевание, не является абсолютной.
Ее обусловленность находит свое выражение в следующих фактах:
1. Патогенность микробов проявляется всегда по отношению к определенному виду (видам) животных. Есть бактерии, патогенные только для человека, есть патогенные только для животных, но есть патогенные и для человека, и для животных (возбудители чумы, бруцеллеза, туляремии и др.).
2. Непатогенный в одних условиях (естественных) для макроорганизма возбудитель может стать патогенным в других, измененных условиях. Например, в естественных условиях куры не болеют сибирской язвой, но если температуру их тела искусственно понизить, они ею заболевают.
3. Микроорганизмы, являющиеся непатогенными или условно-патогенными для физиологически здоровых организмов, могут стать патогенными при ослаблении их естественной резистентности, особенно под влиянием радиационного облучения.
Патогенность – способность вызывать заболевание – видовое свойство бактерий, присущее виду в целом, но она может проявляться в разной степени у разных представителей данного вида. Поэтому для оценки степени патогенности используют термин вирулентность. Патогенность и вирулентность (лат. virulentus – ядовитый) означают одно и то же – способность вызывать заболевание, но под вирулентностью понимают количественную оценку, т. е. меру, степень патогенности. Вирулентность может быть усилена (повышена) и ослаблена (понижена). Это достигается разными способами воздействия на соответствующего возбудителя. Но так как все признаки патогенности контролируются генами, то фактически получение авирулентных или высоковирулентных штаммов возбудителей сводится к селекции таких вариантов, всегда имеющихся в каждой популяции, т. е. к созданию благоприятных для их отбора условий. Л. Пастер получил вакцину против сибирской язвы путем выращивания ее возбудителей при высокой температуре (42 °C), которая способствовала утрате плазмид (плазмиды), определяющих патогенность этого возбудителя. Вакцину против бешенства он получил путем селекции штамма вируса бешенства, высоковирулентного для кроликов, но безвредного для человека. А. Себин получил живую вакцину против полиомиелита путем селекции невирулентных вариантов всех трех типов полиовируса.
Для количественного выражения вирулентности микроорганизмов используют три метода: определение Dlm, Dcl и Dl50. Dlm (Dosis letalis minima) – минимальная смертельная доза микроорганизмов или их токсинов, способная вызвать гибель животного за определенный срок, – величина относительная, зависит от вида животного. Dlm для кролика, собаки и морской свинки будет различной. Dcl (Dosis certа letalis) – безусловно смертельная доза, т. е. доза, вызывающая гибель любого животного; она также является относительной. Поэтому статистически наиболее достоверной летальной дозой принято считать дозу (количество микроорганизмов или их токсинов), вызывающую гибель 50 % зараженных животных, – Dl50. Она устанавливается на основании статистической обработки полученных результатов по методу Рида и Менча.
Факторы патогенности (вирулентности)
Патогенность как биологический признак бактерий реализуется через их три свойства: инфекциозность, инвазивность и токсигенность (или токсичность).
Под инфекциозностью (или инфективностью) понимают способность возбудителей проникать в организм и вызывать заболевание, а также «способность ми-кробов передаваться с помощью одного из механизмов передачи, сохраняя в этой фазе свои патогенные свойства и преодолевая поверхностные барьеры (кожу и слизистые)» (Королюк А. М., 1995). Она обусловлена наличием у возбудителей факторов, способствующих их прикреплению к клеткам организма и колонизации.
Под инвазивностью понимают способность возбудителей преодолевать защитные механизмы организма, размножаться, проникать в его клетки и распространяться в нем. Это свойство также связано с наличием у патогенных микроорганизмов большой группы факторов патогенности, которые наделяют их способностью к внедрению в клетки и размножению в них; факторов, подавляющих фагоцитоз и препятствующих ему; большой группы ферментов «агрессии и защиты».
Токсигенность бактерий обусловлена выработкой ими экзотоксинов. Токсичность обусловлена наличием эндотоксинов. Экзотоксины и эндотоксины обладают своеобразным действием и вызывают глубокие нарушения жизнедеятельности организма.
Инфекциозные, инвазивные (агрессивные) и токсигенные (токсические) свойства относительно слабо связаны друг с другом, они по-разному проявляются у разных микроорганизмов. Существуют микроорганизмы, у которых на первый план выходят агрессивные (инвазивные) свойства. К ним относится, например, возбудитель чумы. Хотя Y. pestis и образует экзотоксин («мышиный» токсин), однако основными факторами его патогенности служат те, которые подавляют защитные силы организма, обеспечивая быстрое внутриклеточное размножение возбудителя и распространение его по организму.
В то же время возбудители столбняка, дифтерии и ботулизма, обладая слабыми инфекциозными свойствами, продуцируют сильнейшие экзотоксины, которые и обусловливают развитие болезни, ее патогенез и клинику.
Следовательно, такое сложное биологическое свойство, как патогенность, обусловлено наличием у патогенных бактерий конкретных факторов патогенности, каждый из которых ответствен за проявление определеннных свойств. К ним относятся следующие факторы:
1. Хемотаксис и подвижность (у бактерий, имеющих жгутики). С помощью хемотаксиса бактерии ориентируются в отношении своих клеток-мишеней, а наличие жгутиков ускоряет их приближение к клеткам.
2. Ферменты, разрушающие субстраты слизи, которая покрывает эпителиальные клетки слизистых оболочек. Протеазы, нейраминидазы, лецитиназы и другие ферменты, разрушая слизь, способствуют высвобождению рецепторов, с которыми взаимодействуют микроорганизмы.
3. Факторы адгезии и колонизации, с помощью которых бактерии распознают рецепторы на мембранах клеток, прикрепляются к ним и колонизируют клетки. У бактерий функцию факторов адгезии выполняют различные структуры клеточной стенки: фимбрии, белки наружной мембраны, ЛПС и другие компоненты. Адгезия является пусковым механизмом реализации патогенности. Бактерии могут размножаться либо в клетках, либо на поверхности клеток слизистой (на их мембранах) либо проходить через них и далее распространяться по организму. Поэтому ни один возбудитель, в том числе и вирусы, не может реализовать свою патогенность, если он не способен прикрепиться к клетке (адсорбироваться на ней). В свою очередь и токсины, до тех пор, пока они не свяжутся с рецепторами мембран клеток-мишеней, также не смогут реализовать токсические функции. Поэтому адгезия и колонизация – начальные, пусковые механизмы развития болезни.
4. Факторы инвазии, т. е. факторы, с помощью которых бактерии проникают в клетку. Обычно они сопряжены с факторами, подавляющими клеточную активность и способствующими внутриклеточному размножению бактерий. Факторы инвазии у грамотрицательных бактерий обычно представлены белками наружной мембраны.
5. Факторы, препятствующие фагоцитозу, т. е. защищающие от фагоцитоза. Они также связаны с компонентами клеточной стенки и либо маскируют бактерии от фагоцитов, либо подавляют их активность. Такие факторы есть у многих бактерий. Они представлены либо капсулой из гиалуроновой кислоты, которая не распознается фагоцитами как чужеродная, так как химически не отличается от таковой организма, либо капсулами другой химической природы (у B. anthracis, Y. pestis и т. д.); различными белками, тормозящими фагоцитоз, – белок А (у стафилококков), М-белок (у стрептококков), антиген FraI у возбудителя чумы; пленка из фибрина, образующаяся у стафилококков, имеющих плазмокоагулазу; к их числу относятся также пептидогликан, тейхоевые кислоты и другие компоненты клеточной стенки.
6. Факторы, подавляющие фагоцитоз, например V-W-антигены у Y. pestis. Наличие таких факторов обусловливает незавершенный характер фагоцитоза. Чаще всего он связан с образованием бактериями веществ, которые подавляют «окислительный взрыв» фагоцитов. Незавершенный фагоцитоз – одна из важных причин хронизации течения болезни (хрониосепсис).
7. Ферменты «защиты и агрессии» бактерий. С помощью таких ферментов, как фибринолизин, лецитиназа, гиалуронидаза, протеазы и т. п., бактерии реализуют (наряду с факторами, подавляющими фагоцитоз и защищающими от него) свои агрессивные свойства. Эти ферменты способствуют их распространению в тканях организма. Одним из главных ферментов защиты (например, у стафилококков) является плазмокоагулаза. Превращая фибриноген в фибрин, этот фермент образует своеобразную белковую пленку вокруг клеток, которая и защищает их от фагоцитоза. Патогенность может быть связана и с другими ферментами бактерий, например с аминопептидазами, подавляющими хемотаксис фагоцитов, а также с продуктами жизнедеятельности бактерий, обладающими токсическими свойствами (птомаины и т. п.).
8. Токсины микробов. Различают эндотоксины и экзотоксины. Эндотоксины имеются только у грамотрицательных бактерий. Они представлены липополисахаридами и связанными с ними белками. Особенность эндотоксинов в том, что они термостабильны и высвобождаются из бактериальных клеток после их разрушения. Эндотоксины, в отличие от экзотоксинов, не обладают специфичностью действия. Их токсичность и пирогенность обусловлены липидом А, входящим в состав ЛПС и имеющим сходную структуру у разных грамотрицательных бактерий. Пирогенное действие эндотоксинов не связано с их непосредственным действием на терморегулирующие центры головного мозга. Они индуцируют выброс какого-то пирогенного вещества из полиморфно-ядерных лейкоцитов. Эндотоксины являются воспалительными агентами: они увеличивают проницаемость капилляров и оказывают разрушающее действие на клетки. Их воспалительное и пирогенное действие неспецифично. Многообразие проявлений отравления эндотоксином обусловлено не только самим ЛПС, но и высвобождением многочисленных биологически активных соединений, синтез которых он индуцирует в организме человека и животных (гистамин, серотонин, простагландины, лейкотриены и др., всего более 20). Эти вещества и обусловливают нарушения в различных органах и тканях.
Все три компонента ЛПС – липид А, ядро полисахарида и его боковая цепочка из повторяющихся сахаров – обладают выраженными антигенными свойствами. ЛПС стимулирует синтез интерферонов, активизирует систему комплемента по классическому пути, оказывает митогенное действие на лимфоциты, а также аллергенное действие. Его токсические свойства, в отличие от экзотоксинов, не снимаются при обработке формалином, и ЛПС не превращается в анатоксин.
Экзотоксины. Их продуцируют как грамположительные, так и грамотрицательные бактерии. У грамположительных бактерий экзотоксины активно секретируются через ЦМ и клеточную стенку в окружающую среду с использованием специальных секретирующих систем. У грамотрицательных бактерий (холерный вибрион, токсигенные кишечные палочки, сальмонеллы) некоторые экзотоксины (энтеротоксины) синтезируются только при определенных условиях непосредственно в инфицированном организме и нередко сохраняются в цитоплазме, освобождаясь из клетки только после ее разрушения.
Основные свойства экзотоксинов
Все известные бактериальные экзотоксины – белки, среди них есть термолабильные и термостабильные. С белковой природой экзотоксинов связаны их основные свойства: они обладают высокой силой действия (самые сильные токсины в природе – микробного происхождения), высокой избирательностью и связанной с ней специфичностью действия (картина столбняка у лабораторных животных одинакова, как при заражении их возбудителем, так и его экзотоксином), которое они проявляют после некоторого латентного периода. Экзотоксины являются сильными антигенами, а некоторые – даже суперантигенами. Они индуцируют образование в организме антител, т. е. антитоксинов, которые нейтрализуют их действие. При обработке формалином экзотоксины обезвреживаются и превращаются в анатоксины. Анатоксины лишены токсических свойств, но сохраняют свою способность индуцировать синтез антитоксинов, поэтому широко используются для создания искусственного иммунитета против дифтерии, столбняка, ботулизма и других заболеваний.
По молекулярной организации различают две основные группы экзотоксинов:
1. Экзотоксины, состоящие из двух фрагментов – А и В. Каждый фрагмент сам по себе не активен. Свойствами токсина они обладают, будучи связанными друг с другом. При этом фрагмент В выполняет две функции – акцепторную (распознает рецептор на мембране и связывается с ним) и формирования внутримембранного канала. Фрагмент А проникает через него в клетку и проявляет в ней токсическую активность, воздействуя на различные процессы метаболизма клетки. Такую структуру имеют, например, энтеротоксины холерного вибриона и патогенных грамотрицательных бактерий.
2. «Разрезанные» токсины. Эти экзотоксины синтезируются в бактериальных клетках в виде единой неактивной полипептидной цепи. В активную форму протоксин превращается в результате разрезания его протеазой. Образующийся при этом активный токсин состоит из двух связанных между собой дисульфидными связями пептидных цепей. Активация токсина (разрезание полипептидной цепи) может осуществляться либо собственной бактериальной протеазой, либо протеазами кишечного тракта макроорганизма. Такой тип экзотоксинов синтезируют Clostridium tetani и C. botulinum, причем в их токсинах содержатся дополнительные белки с иными, нетоксическими свойствами.
Вероятно, существуют микробные экзотоксины и с иной химической структурой. По характеру токсического действия экзотоксины также отличаются друг от друга. Например, экзотоксины с мембрано-повреждающим механизмом действия разрушают эритроциты, лейкоциты, тромбоциты, базофилы, мастоциты и другие клетки, а также клетки культур тканей, протопласты и сферопласты.
Механизм действия других экзотоксинов связан с нарушением жизненно важных процессов в клетке: подавлением биосинтеза белка (дифтерийный экзотоксин) и переноса электронов по цепи («мышиный» токсин Y. pestis).
Энтеротоксины холерного вибриона и патогенных грамотрицательных бактерий, воздействуя на аденилатциклазную систему энтероцитов, вызывают выход ионов и воды из тканей в кишечник, что и обусловливает патогенез холеры и других форм диареи. Экзотоксин C. botulinum подавляет выделение ацетилхолина в нервно-мышечном синапсе и блокирует передачу нервного импульса на мышечное волокно. Механизм действия экзотоксина C. tetani также связан с торможением передачи синаптических медиаторов (γ-аминомасляной кислоты, ацетилхолина, норадреналина и др.).
Особым образом проявляют свое действие энтеротоксины, продуцируемые стафилококками. Эти белки обладают свойствами суперантигенов, т. е. антигенов, которые стимулируют синтез излишнего количества Т-лимфоцитов. Последние начинают вырабатывать огромное количество интерлейкина-2, а это и приводит к токсическому эффекту. Таким образом, свое отравляющее действие на организм стафилококковые энтеротоксины реализуют через индуцируемый ими синтез интерлейкина-2.
Особенности генетического контроля синтеза факторов патогенности бактерий
У бактерий обнаружено два типа генов, контролирующих синтез факторов патогенности: гены собственной хромосомы клетки и гены, привнесенные в хромосому так называемыми мобильными генетическими элементами. Эта вторая группа включает в себя умеренные конвертирующие фаги, фаги-транспозоны, плазмиды и транспозоны. Мобильными их называют потому, что они содержат собственные генетические компоненты, кодирующие транспозазу, интегразу, а также сайт-специфические участки, которые взаимодействуют со специфическими сайтами хромосомы клетки и обеспечивают интеграцию в нее.
Включение генома (или части генома) профага приводит к образованию в составе хромосомы бактерий островов патогенности (англ. pathogenicity islands), которые содержат ген или кассету генов, контролирующих продукцию основных факторов патогенности. Например, в хромосоме холерного вибриона есть два острова патогенности. В одном из них расположены гены умеренного профага CTXϕ, а в другом – фага VPIϕ. Как правило, гены патогенности, содержащиеся в островах патогенности, регулируются координированно, т. е. функционируют как самостоятельный геном патогенности в составе хромосомы клетки. В результате рекомбинации умеренных фагов с хромосомой бактерий возникли многие патогенные бактерии (Vibrio cholerae, Corynebacterium diphtheriae, Clostridium botulinum, EHEC и др.), а в результате переноса генов патогенности плазмидами – Bacillus anthracis, Yersinia pestis, ETEC, EIEC, EPEC и др. Во всяком случае, острова патогенности в форме мобильных генетических элементов обнаружены у многих видов патогенных бактерий, но их нет у близкородственных непатогенных бактерий.
Основные источники инфекции. Пути и способы заражения человека
Существуют три основных возможных источника инфекции: человек (больной, реконвалесцент, бактерионоситель), животные и объекты внешней среды, служащие естественной средой обитания некоторых патогенных бактерий или контаминированные выделениями от больных людей или животных. В соответствии с этим различают болезни: антропонозные (ими болеют только люди, например, брюшной тиф, дизентерия, холера и др.); зоонозные (греч. zoon – животное и nosos – болезнь, ими болеют только животные, например, чума рогатого скота, чума свиней и др.); зооантропонозные (ими болеют и животные, и заражающиеся от них люди). Существует около 100 зооантропонозных болезней (чума, туляремия, бруцеллез, лептоспироз и др.), некоторые их них – в виде естественных природных очагов. Чаще всего это связано с тем, что переносчиками возбудителей заболеваний являются кровососущие членистоногие, в организме которых возбудитель может сохраняться продолжительное время, иногда пожизненно, и даже трансовариально передаваться потомству. Такие природные очаги, например некоторых риккетсиозов, туляремии, вирусных энцефалитов и других заболеваний, при которых переносчиками являются различные виды иксодовых, гамазовых, краснотелковых клещей и других кровососущих членистоногих, имеются в различных странах мира. Их длительное существование объясняется тем, что в дополнение к инфицированным позвоночным животным присутствует второй длительно действующий резервуар возбудителя – инфицированные членистоногие, для которых позвоночные являются прокормителями. В других случаях передача возбудителя в природных очагах от больного животного к здоровому может происходить при их совместном содержании с помощью прямого или непрямого контакта (например, в очагах лептоспирозов, Ку-лихорадки и т. п.). Таким образом, в природных очагах, благодаря постоянно действующей цепи передачи возбудителя: больное животное → кровососущие членистоногие (или различные факторы внешней среды) → здоровое животное – сложились естественные резервуары возбудителей многих заболеваний. Человек, включаясь в эту цепь, может заразиться либо через укусы кровососущих переносчиков, либо путем прямого или непрямого контакта с инфицированными животными. Особенно большая опасность заражения в постоянно действующих природных (эндемических) очагах существует для вновь прибывающих в эти очаги людей, так как лица, постоянно в них проживающие, нередко переносят эти заболевания в раннем возрасте и приобретают к ним иммунитет.
Третьим постоянным источником заражения человека является сама внешняя среда, главным образом, почва и вода. В почве постоянно находятся патогенные бактерии из рода Clostridium – возбудители раневых инфекций и ботулизма, может долго сохраняться возбудитель сибирской язвы. Кроме того, нормальными обитателями почвы и некоторых водоемов являются возбудители сапронозных заболеваний (греч. sapros – гнилой и nosos – болезнь, т. е. болезни, вызываемые возбудителями, средой обитания которых служат гниющие растения) – легионеллы, иерсинии и др. Обитателями прибрежной морской воды и разнообразных морских организмов являются некоторые виды вибрионов, способные вызывать заболевание человека. Особенно важную роль в эпидемиологии кишечных инфекций играют инфицированные вода и пищевые продукты.
Заражение человека патогенными микроорганизмами может произойти только через поврежденную кожу и слизистые оболочки глаза, дыхательных, пищеварительных и мочеполовых путей. Заражение через неповрежденную кожу если и возможно, то происходит исключительно редко, так как кожа для большинства микроорганизмов трудно проницаема. Однако даже самые ничтожные повреждения ее (укус насекомого, укол иглой, микротравмы и т. п.) могут стать причиной заражения. Место проникновения возбудителя в организм человека или животного называется входными воротами инфекции. В случае, если ими является слизистая оболочка, возможны три типа инфекции: размножение возбудителя на поверхности эпителиальных клеток; проникновение его в клетки с последующим внутриклеточным размножением; проникновение возбудителя через клетки и распространение его по организму.
Заражение человека происходит одним из следующих способов:
1. Воздушно-капельным или воздушно-пылевым.
2. Фекально-оральным. Возбудитель выделяется с испражнениями или мочой, заражение происходит через рот при употреблении инфицированных пищевых продуктов или воды.
3. Трансмиссивным, т. е. через укусы кровососущих членистоногих.
4. Контактным – прямой контакт с больным, реконвалесцентом, бактерионосителем или через загрязненные предметы обихода, т. е. непрямым контактом.
5. Половым путем.
6. При использовании нестерильных медицинских приборов, особенно шприцев и т. п.
7. Вертикальным, т. е. от матери ребенку через плаценту, во время родов или сразу после них.
Способ заражения, от которого зависит локализация входных ворот возбудителя, имеет немаловажное значение для развития болезни, так как некоторые возбудители могут проникать в организм разными способами. Например, в случае заражения Y. pestis через укусы насекомых (блох) чума протекает в относительно более легкой бубонной форме, а при заражении воздушно-капельным путем развивается наиболее тяжелая форма этой болезни – легочная чума. Точно так же, в зависимости от способа заражения, наблюдаются различные клинические формы туляремии: бубонная или язвенно-бубонная (при трансмиссивном заражении через укусы кровососущих членистоногих), глазо-бубонная (при заражении через слизистую глаза), легочная (при воздушно-пылевом заражении) и т. д.; сибирской язвы (кожная, легочная, кишечная).
Однако для других возбудителей, например ВИЧ, способ заражения не имеет значения: заболевание развивается в одинаковой степени тяжело. В то же время для многих возбудителей существуют преимущественные способы заражения макроорганизма, так, для возбудителей кишечных инфекций – фекально-оральный; возбудителей респираторных заболеваний – воздушно-капельный и др.
Распространение проникших в организм возбудителей может происходить по-разному, в зависимости от свойств возбудителя и имеющихся в клетках ткани рецепторов для них: контактным путем, т. е. от клетки к клетке, лимфогенным или гематогенным путем; некоторые возбудители распространяются по нервным путям.
Кровь здорового человека и животного стерильна, ибо она обладает сильным антимикробным свойством, обусловленным наличием в ней системы комплемента и различных иммунокомпетентных клеток. Однако почти при всех инфекционных процессах в крови появляются и циркулируют в течение различного срока возбудитель заболевания или его токсин, а также образующиеся при распаде возбудителя антигены. Через кровь очень часто происходит распространение возбудителя по организму, т. е. генерализация инфекционного процесса. Выход возбудителя или его антигенов в большом количестве в кровь, как правило, сопровождается лихорадкой, которая не только служит сигналом попадания возбудителя в кровь, но и имеет защитное значение.
Для характеристики явлений, связанных с проникновением в кровь возбудителя, его токсина и антигенов, введены следующие понятия: антигенемия, бактериемия, вирусемия, сепсис, септикопиемия, септицемия, токсемия, токсинемия.
Антигенемия (антиген + греч. haima – кровь) – циркуляция в крови чужеродных антигенов и аутоантигенов. При наличии в крови антител к данному антигену формируются циркулирующие иммунные комплексы – ЦИК (антиген + антитело), способствующие очищению организма от антигенов. С помощью ЦИК антигены выводятся из организма. Выявляют антигены и ЦИК в крови с помощью различных серологических реакций, например, при бруцеллезе – с помощью реакции агрегат-гемагглютинации.
Бактериемия – наличие в циркулирующей крови бактерий – возникает в результате проникновения возбудителя в кровь через естественные барьеры макроорганизма, а также при трансмиссивных инфекциях после укуса кровососущих членистоногих. При заболеваниях, которые передаются членистоногими (сыпной тиф, возвратный тиф, чума, туляремия, риккетсиозы и т. д.), бактериемия – главная и обязательная стадия патогенеза болезни. Она обеспечивает передачу возбудителя другому хозяину, т. е. сохраняет его как вид. Причиной бактериемии могут быть хирургические вмешательства, травмы, лучевая болезнь, злокачественные опухоли, различные тяжелые формы заболеваний, вызванные условно-патогенными бактериями, и т. п. В отличие от сепсиса и септикопиемии, бактерии в крови только циркулируют, но не размножаются. Таким образом, бактериемия – симптом болезни и одна из ее стадий. Диагноз бактериемии ставится путем выделения гемокультуры возбудителя или заражения кровью больного лабораторного животного.
Вирусемия – состояние организма, при котором в его крови циркулируют вирусы.
Сепсис, или гнилокровие (греч. sepsis – гниение) – тяжелое генерализованное острое или хроническое лихорадочное заболевание человека, обусловленное непрерывным или периодическим поступлением в кровь возбудителя из очага гнойного воспаления. Для сепсиса характерно несоответствие тяжелых общих расстройств местным изменениям и частое образование новых очагов гнойного воспаления в различных тканях и органах.
В отличие от бактериемии, при сепсисе из-за снижения бактерицидных свойств крови возбудитель размножается в кровеносной и лимфатической системах.
Чаще всего сепсис является следствием генерализации локализованных гнойных очагов. Этиология сепсиса разнообразна. Наиболее частые его возбудители – стафилококки, стрептококки, грамотрицательные бактерии из семейств Enterobacteriaceae и Pseudomonadaceae, менингококки, другие бактерии, в том числе условно– и слабопатогенные, и некоторые грибы. В зависимости от локализации первичного гнойного очага и места входных ворот возбудителя различают пуэрперальный (послеродовый), отогенный, одонтогенный, послеабортный, перитонеальный, раневой, ожоговый, пупочный, ротовой (стоматогенный), уросепсис и другие формы болезни. Может наблюдаться сепсис новорожденных (неонатальный сепсис), обусловленный инфицированием плода при родах или в период внутриутробного развития. Кроме того, бывает сепсис криптогенный, при котором первичный очаг гнойного воспаления остается нераспознанным.
Септикопиемия – форма сепсиса, при которой наряду с интоксикацией организма происходит образование гнойных метастатических очагов в различных тканях и органах, сочетающееся с присутствием и размножением возбудителя в лимфатической и кровеносной системах.
Септицемия – форма сепсиса, при которой не происходит образования метастатических очагов гнойного воспаления, а единственным местом обитания и размножения возбудителя в организме служат его кровеносная и лимфатическая системы.
Токсемия – состояние организма человека или животного, при котором в его крови циркулируют бактериальные эндотоксины. Наблюдается при тяжелых формах заболеваний, вызванных грамотрицательными бактериями, имеющими эндотоксин (ЛПС), например при сальмонеллезах, эшерихиозах, менингококковых и иных инфекциях. Нередко сочетается с бактериемией и сепсисом.
Токсинемия – состояние организма, при котором в кровеносной системе циркулирует бактериальный экзотоксин или другой токсин. Возбудитель при этом в крови, как правило, отсутствует, а токсин через кровеносную или нервную систему проникает в клетки-мишени. Наблюдается при заболеваниях, возбудители которых продуцируют экзотоксины (ботулизм, дифтерия, столбняк, анаэробная инфекция и др.; поэтому эти болезни называют токсинемическими).
Отдельные виды патогенных микроорганизмов могут поражать любые органы и ткани (возбудитель туберкулеза, патогенные стафилококки и др.). В то же время есть возбудители, для которых характерна органотропность, т. е. способность избирательно поражать определенные ткани. Так, возбудитель туберкулеза чаще всего поражает легочную ткань, гонококки – слизистую уретры и конъюнктиву глаза, вирусы гепатитов – клетки печени, вирус гриппа – слизистую верхних дыхательных путей и т. д. Избирательностью действия обладают и бактериальные экзотоксины. Такая органотропность возбудителей и их токсинов определяется, по-видимому, тремя обстоятельствами. Во-первых, наличием для возбудителей и их экзотоксинов соответствующих рецепторов на мембранах клеток. Во-вторых, особенностями метаболизма микроорганизмов, в соответствии с которыми они находят оптимальные условия для размножения в определенных клетках (или на определенных клетках). В-третьих, это зависит от наличия или отсутствия в данной ткани антимикробных веществ типа лизоцима, ингибина, интерферона и других, подавляющих размножение возбудителя. Локализацией возбудителя в организме определяются и пути его выделения – с испражнениями, мочой, гнойно-воспалительным материалом, мокротой, слюной, слизью и т. п. Эти выделения, а также кровь, спинномозговая жидкость, пунктат лимфоидной ткани и служат чаще всего материалом для бактериологической диагностики инфекционных заболеваний. Знание источников инфекции, свойств возбудителя, путей и способов заражения при инфекционных заболеваниях лежат в основе организации и проведения всех противоэпидемических мероприятий, а также в выборе методов микробиологической диагностики.
Места обитания в организме человека основных возбудителей бактериальных инфекций приведены в табл. 6 (Покровский В. И. [и др.], 1991).
Таблица 6
Преимущественные места обитания в организме человека основных возбудителей бактериальных инфекций и микозов
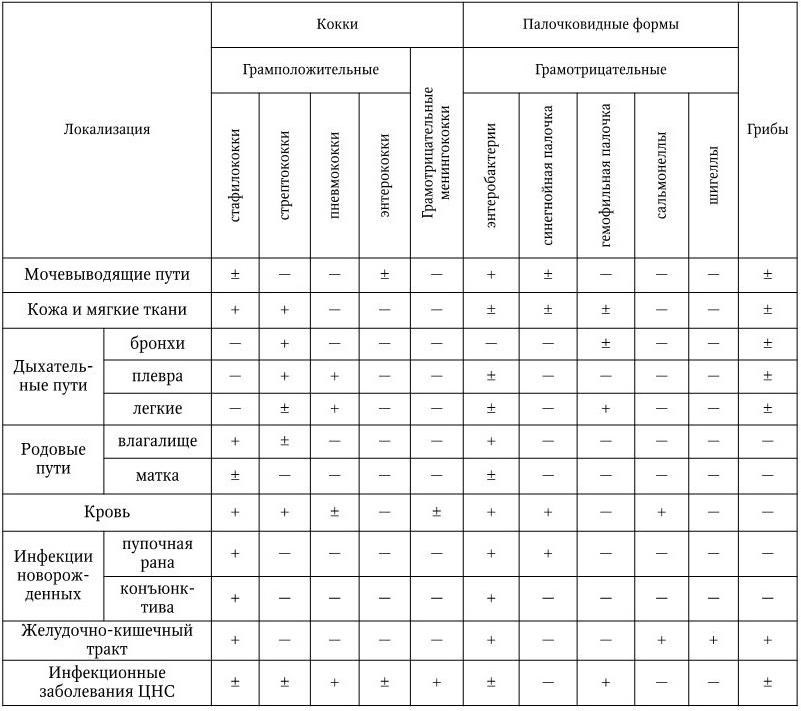
Примечание: +обнаруживаются часто; ± наличие возможно; – обнаруживаются редко.
Микробиологические основы химиотерапии инфекционных заболеваний
На современном этапе развития медицины антибиотики – наиболее эффективные препараты для лечения заболеваний, вызываемых микроорганизмами.
Понятие «антибиотики» предложено С. Ваксманом. Под антибиотиками он понимает такие «химические вещества, образуемые микроорганизмами, которые обладают способностью подавлять рост или даже разрушать бактерии и другие микроорганизмы».
Однако З. В. Ермольева дала более широкое толкование этому понятию: «Антибиотики – вещества природного происхождения, обладающие выраженной биологической активностью. Они могут быть получены из микробов, растений, животных тканей и синтетическим путем».
Каждый антибиотик обладает специфическим избирательным действием на определенные виды микробов. Благодаря такому избирательному действию многие антибиотики способны подавлять жизнедеятельность патогенных микробов в безвредных для организма концентрациях. Такие антибиотики широко используют для лечения различных инфекционных болезней.
Основными продуцентами антибиотиков служат микроорганизмы, обитающие в почве и воде, где они постоянно вступают между собой в самые разнообразные взаимоотношения. Последние могут быть нейтральными, взаимовыгодными (например, деятельность гнилостных бактерий создает условия для деятельности нитрифицирующих бактерий), но очень часто они являются антагонистическими. И это понятно. Только таким путем в природе могло сложиться сбалансированное сосуществование громадного числа видов живых существ. Антагонистические взаимоотношения между бактериями наблюдал еще Л. Пастер. И. И. Мечников предложил использовать антагонизм между бактериями на пользу человеку. Он, в частности, рекомендовал подавлять активность гнилостных бактерий в кишечнике человека, продукты жизнедеятельности которых, по его мнению, сокращают жизнь человека, молочнокислыми бактериями.
Механизмы микробного антагонизма различны. Они могут быть связаны с конкуренцией за кислород и питательные вещества, с изменением рН среды в сторону, неблагоприятную для конкурента, и т. д.
Одним из универсальных механизмов микробного антагонизма является синтез химических веществ-антибиотиков, которые либо подавляют рост и размножение других видов микроорганизмов (бактериостатическое действие), либо убивают их (бактерицидное действие).
Источники антибиотиков в природе неисчерпаемы. Их обнаружены тысячи, но далеко не все из них могут быть использованы в медицине. Чтобы быть хорошим лечебным средством, антибиотик должен иметь по крайней мере некоторые обязательные свойства.
1. При низкой концентрации (10 – 30 мкг/мл) он должен убивать возбудителя болезни или подавлять его рост и размножение.
2. Активность антибиотика не должна существенно снижаться под действием жидкостей организма.
3. Он должен быстро воздействовать на микроорганизм, чтобы за короткий срок прервать его жизненный цикл.
4. Антибиотик не должен вредить макроорганизму. Аллергенность и токсичность и после введения разовой дозы, и после многократного введения должны отсутствовать.
5. Антибиотик не должен препятствовать процессу выздоровления.
6. Антибиотик не должен снижать и тем более подавлять иммунологические реакции. Он не должен наносить никакого ущерба иммунной системе организма.
Правда, здесь есть исключения. Речь идет о поиске таких антибиотиков, которые бы подавляли трансплантационный иммунитет. К числу последних относится циклоспорин А, который обладает мощным иммуносупрессивным действием. Однако его широкому применению препятствует цитотоксическое действие на почки. Поэтому поиск иммуносупрессивных антибиотиков, лишенных токсических свойств, представляет большой интерес.
Наконец, исключительное значение представляет поиск таких антибиотиков, которые бы обладали способностью стимулировать противоопухолевый иммунитет. К сожалению, успехи в этом направлении пока очень скромны, хотя и не безнадежны.
Наступлению эры антибиотикотерапии предшествовал длительный период разработки эффективных методов химиотерапии. Медицину всегда привлекала идея таких химических препаратов, которые бы избирательно, не нанося вреда макроорганизму, воздействовали на возбудителя какой-либо болезни, а еще лучше – на многих возбудителей.
Датой зарождения научной химиотерапии следует считать 1891 г., когда русский врач Д. А. Романовский впервые доказал возможность воздействия лекарственного средства на возбудитель в организме человека (хинина на малярийный плазмодий) и впервые сформулировал основные принципы химиотерапии инфекционных болезней вообще.
Эти принципы получили дальнейшее использование и развитие в классических работах П. Эрлиха, который применил метод химической вариации исходных антибактериальных веществ и ввел понятие химиотерапевтического индекса для оценки качества лечебных препаратов. Индекс представляет собой отношение максимальной переносимой дозы к минимальной лечебной дозе и не должен быть менее 3.
В результате для лечения инфекционных болезней стали применять самые различные препараты, в том числе мышьяковистые – сальварсан, новарсенол и другие для лечения сифилиса, возвратного тифа и других болезней; висмута – для лечения энтероколитов, а сейчас и язвы желудка и двенадцатиперстной кишки; производные сурьмы, ртути, акридина, препараты нитрофуранового ряда (фуразолидон, фурадонин и др.); различные противомалярийные средства (акрихин, плазмоцид, бигумаль, хлоридин, хиноцид и др.); производные парааминосалициловой кислоты (ПАСК) и изоникотиновой кислоты, которые применяют для лечения туберкулеза, а также различные другие химические соединения.
Большую роль в развитии химиотерапии сыграли работы Г. Домагка, в результате которых в 1932 г. был открыт путь к созданию большого семейства сульфаниламидных препаратов (стрептоцид, норсульфазол, сульфазин, метилсульфазин, сульфадимезин, фталазол, сульгин и др.).
Сульфаниламидные препараты оказались весьма эффективным средством для лечения различных гнойно-воспалительных заболеваний, пневмонии, дизентерии и других болезней.
Однако поистине революционное значение для медицины имело открытие антибиотиков, которые по своей антибактериальной эффективности превзошли все применявшиеся ранее химиопрепараты.
История открытия антибиотиков связана с именами английского ученого А. Флеминга и американских ученых Г. Дюбо и С. Ваксмана. А. Флеминг в 1929 г. установил, что фильтрат культуры плесневого гриба Penicillium notatum содержит какое-то вещество, угнетающее рост стафилококка. Это вещество и получило название пенициллина. Однако в чистом виде препарат был получен лишь в 1940 г., после чего стало возможным установить его химическую природу, а затем и наладить промышленное производство этого препарата, оказавшегося истинным королем антибиотиков по силе воздействия на бактерии и относительной безвредности для человека. Г. Дюбо выделил из культуры Bacillus brevis два антибиотика – тироцидин и грамицидин, однако они не получили столь широкого применения, как пенициллин. Последний оказался очень эффективным для лечения гнойно-воспалительных заболеваний, вызываемых стафилококками, которые по своей частоте всегда занимали ведущее место среди прочих бактериальных инфекций. Вместе с тем пенициллин оказался эффективным средством и против других видов грамположительных бактерий.
С. Ваксман открыл ряд антибиотиков, продуцентами которых были различные виды актиномицетов, и в том числе в 1944 г. – стрептомицин; его продуцентом является Actinomyces griseus.
Значение открытия стрептомицина заключается в том, что он и его производные оказались очень эффективными препаратами для лечения туберкулеза и чумы. Кроме того, стрептомицин оказался гораздо более эффективным, чем пенициллин, против грамотрицательных бактерий.
В связи с открытием пенициллина и стрептомицина стало возможным успешно лечить б^ольшую часть бактериальных инфекций. Фактически в течение двух десятилетий (с 1940 по 1960 гг.) были открыты все наиболее часто применяемые антибиотики: стрептомицин (1944); хлорамфеникол, полимиксин (1947); хлортетрациклин (1948); бензилпенициллин, неомицин (1949); нистатин (1950); эритромицин, циклосерин (1952); новобиоцин (1953); олеандомицин (1954); канамицин (1955); леворин (1959). Темпы изыскания новых и совершенствования препаратов на основе старых антибиотиков не снижаются. Возникла и развивается быстрыми темпами промышленность, в том числе на основе биологической технологии, производящая антибиотики в огромном количестве. Если в 1943 г. было произведено всего 13 кг пенициллина, то сейчас ежегодно выпускаются десятки тысяч тонн антибиотиков все новых и новых поколений. Одних только антибиотиков пенициллинового ряда (бета-лактамные антибиотики) выпускается около 100 наименований препаратов. Они по-прежнему занимают доминирующее положение в клинике.
Результаты применения антибиотиков в медицине оказались исключительно впечатляющими. Они во много раз сократили смертность, особенно детскую, от инфекционных болезней, смягчили тяжесть их течения, уменьшили количество постинфекционных осложнений. В результате применения антибиотиков уже к концу 50-х гг. XX в. средняя продолжительность жизни людей на Земле, особенно в развивающихся странах, заметно выросла. Не менее важную роль сыграли и играют антибиотики и в сельском хозяйстве, особенно в животноводстве и птицеводстве, для лечения и профилактики инфекционных заболеваний среди поголовья скота и птиц.
Широкое применение сульфаниламидных препаратов и особенно антибиотиков породило новую сложную проблему – проблему лекарственной устойчивости микроорганизмов. Ее последствия и меры борьбы с ней лучше всего можно проследить на примере антибиотиков пенициллинового ряда.
Пенициллины – это сложные соединения, основу молекул которых составляет бета-лактамное кольцо, общая структура их представлена на рис. 55. Буквой R обозначен радикал, который может иметь различное строение, в соответствии с которым известно большое число природных типов пенициллинов. Наиболее активным из них оказался бензилпенициллин с радикалом С6Н5– СН2– .
До 1945 г. процент стафилококков, устойчивых к пенициллину, не превышал 5 – 10 %. Однако по мере все более широкого использования антибиотиков возрастало и количество устойчивых к нему штаммов, и к началу 1960-х гг. оно уже достигло 75 – 80 %. Это повлекло за собой и резкое снижение эффективности лечения пенициллином. Стали искать пути преодоления резистентности к нему. Решению этой проблемы помогло изучение путей биосинтеза пенициллина. В качестве продукта его биосинтеза в 1959 г. была выделена 6-аминопенициллановая кислота (рис. 56).
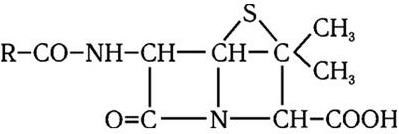
Рис. 55. Структура пенициллинов
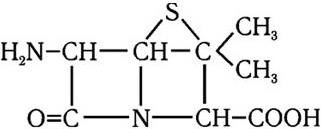
Рис. 56. 6-Аминопенициллановая кислота (6-АПК)
C открытием 6-АПК как основной бициклической системы, которая входит в состав молекулы антибиотика, появилась возможность синтеза путем ацилирования свободной аминной группы пенициллинов нового поколения – полусинтетических пенициллинов: метициллина, ампициллина, оксациллина, клоксациллина и т. д. Их преимущество перед бензилпенициллином заключается в том, что, обладая сходным с бензилпенициллином спектром антибактериального действия, они оказались активными в отношении пенициллинрезистентных штаммов, за исключением ампициллина, но зато последний оказался активным в отношении многих грамотрицательных бактерий. Однако постепенно и к этим новым пенициллинам появились резистентные штаммы стафилококков и других бактерий.
Их резистентность, как и резистентность к бензилпенициллину, оказалась связанной с образованием ферментов, разрушающих бета-лактамное кольцо, – бета-лактамаз. Следующим шагом на пути преодоления устойчивости к пенициллиновым антибиотикам стало получение антибиотиков цефалоспоринов, продуцентами которых служат грибы рода Cephalosporium. Цефалоспорины по биологическим свойствам и химическому строению принадлежат к пенициллинам, но несколько отличаются от них. Ядро молекулы цефалоспоринов составляет 7-аминоцефалоспорановая кислота, которая послужила основой для получения новых препаратов цефалоспоринов (рис. 57). Они, в отличие от пенициллинов, обладают значительно меньшей аллергической активностью и более широким спектром действия, подавляют развитие как грамположительных (в том числе устойчивых к пенициллинам), так и грамотрицательных бактерий.
Например, цефтриаксон – цефалоспорин третьего поколения – устойчив к беталактамазам, имеет широкий спектр действия – подавляет грамположительные и грамотрицательные бактерии, аэробные и некоторые анаэробные. Но и к цефалоспоринам появились резистентные штаммы бактерий, обладающие бета-лактамазами, способными разрушать молекулу цефалоспорина. Бета-лактамазы – один из главных факторов устойчивости к бета-лактамным антибиотикам большинства бактерий. Существуют различные классы бета-лактамаз, продуцируемых разными видами бактерий и отличающихся друг от друга по специфичности действия в отношении различных пенициллинов и цефалоспоринов. При этом инактивация последних происходит либо вне клетки, либо внутри ее. Бета-лактамазы гидролизуют пенициллины и цефалоспорины, в результате чего они не успевают проявить свое антимикробное действие. Гены, контролирующие синтез бета-лактамаз, могут быть хромосомными или плазмидными. Бета-лактамазы хромосомного происхождения могут быть конститутивными или индуцибельными.
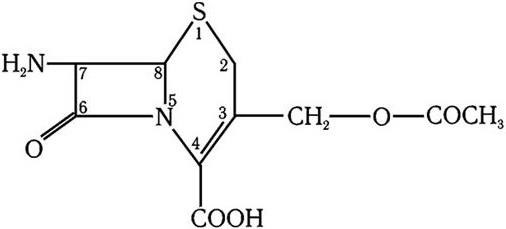
Рис. 57. 7-Аминоцефалоспорановая кислота (7-АЦК)
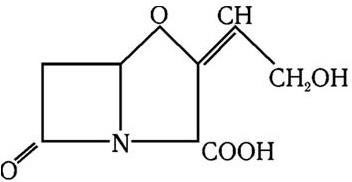
Рис. 58. Клавулановая кислота
Для преодоления устойчивости к бета-лактамным антибиотикам использован принципиально новый подход. Он заключается в поиске таких антибиотиков, которые бы разрушали бета-лактамазу. Наиболее мощным ингибитором бета-лактамаз 2 – 5-го классов оказалась клавулановая кислота (рис. 58).
Ее продуцентом является один из видов Streptomyces. Подобно пенициллинам и цефалоспоринам, клавулановая кислота содержит бета-лактамное кольцо, но сама по себе – слабый антибиотик. Зато ее молекула способна проникать в активный центр беталактамазы и вызывать реакции, в результате которых молекула бета-лактамазы ацилируется, и фермент утрачивает свою активность.
На основе амоксициллина – пенициллина широкого спектра действия – и клавулановой кислоты (ингибитора бета-лактамазы) синтезирован комбинированный антибиотик – аугментин. Использование амоксициллина, а не ампициллина, обусловлено тем, что амоксициллин обладает более сильным бактерицидным действием и лучше проникает в ткани и жидкости организма. Резистентные к амоксициллину бактерии также являются чувствительными к аугментину. По своей антибактериальной активности аугментин превосходит большинство антибиотиков широкого спектра. Он активен в отношении грамположительных и грамотрицательных, аэробных и анаэробных бактерий, в том числе и тех, которые вырабатывают беталактамазу. Поэтому он незаменим при инфекциях, где имеется ассоциация разных возбудителей, например при различных гнойно-воспалительных заболеваниях, септицемиях, в случае смешанных аэробно-анаэробных инфекций, а также для эмпирического лечения в тех случаях, когда возбудитель болезни еще не установлен.
Другим примером комбинированного препарата является сулациллин, который состоит из сульбактама – ингибитора бета-лактамаз грамположительных и грамотрицательных бактерий – и ампициллина.
Таким образом, арсенал бета-лактамных антибиотиков по мере появления резистентных к ним форм бактерий пополняется все новыми и новыми препаратами.
По направленности (или объекту) действия все антибиотики можно разделить на следующие основные группы:
1) противобактериальные препараты;
2) противогрибковые препараты;
3) противовирусные препараты;
4) противоопухолевые антибиотики.
Некоторые авторы относят к антибиотикам не только те химические вещества, которые синтезируются микроорганизмами, но и неприродные соединения, синтезируемые химическими способами, полагая, что дело не столько в происхождении препарата, сколько в его антимикробной активности и полезности для человека.
Противобактериальные антибиотики
Наиболее обширную группу составляют антибактериальные препараты. К ним относятся:
1. Бета-лактамные антибиотики, включающие природные пенициллины, несколько поколений полусинтетических пенициллинов (метициллин, оксациллин, ампициллин, аугментин, карбенициллин, амоксициллин, сулациллин и др.), несколько поколений цефалоспоринов (цефалоридин, цефаметин, цефиксим, цефетамин, цефтриаксон, цефоперазон и др.), нетрадиционные бета-лактамы (карба– и оксапенемы; карба– и оксацефемы и др.). Всего группа бета-лактамных антибиотиков включает в себя около 100 препаратов, активных против многих грамположительных и грамотрицательных, аэробных и анаэробных бактерий.
2. Стрептомицины и стрептомициноподобные антибиотики, активные против возбудителей туберкулеза, особо опасных инфекций и ряда грамотрицательных бактерий.
3. Макролиды – антибиотики, содержащие в своем составе макроциклическое лактонное кольцо, связанное с углеводными остатками. К этой группе относятся эритромицин, олеандомицин, карбомицин. Макролиды активны в отношении грамположительных бактерий (стафилококки, стрептококки и др.), а также в отношении некоторых грамотрицательных бактерий (бруцеллы, холерный вибрион, риккетсии и др.).
4. Аминогликозиды – антибиотики олигосахаридной или псевдоолигосахаридной природы: гентамицин, неомицин, канамицин, мономицин, а также тобрамицин, амикацин, сизомицин, нетилмицин. Гентамицин обладает широким спектром действия, подавляет рост многих грамположительных и грамотрицательных бактерий, высокоактивен против псевдомонад, протея. Антимикробные спектры мономицина, неомицина и канамицина близки к спектру гентамицина, но они уступают ему по активности.
5. Тетрациклины. Основой молекулы этих антибиотиков является полифункциональное соединение – тетрациклин. К этой группе относятся антибиотики с широким спектром действия, активные против многих грамположительных и грамотрицательных бактерий: хлортетрациклин, окситетрациклин, тетрациклин и их производные.
6. Гликопептиды – высокомолекулярные соединения, содержащие углеводы и аминокислоты: ванкомицин, ристомицин, линкомицин, клиндамицин, эремомицин и др. Действуют на многие грамположительные кокки и палочки, неактивны в отношении грамотрицательных бактерий. Ванкомицин применяют для лечения псевдомембранозного колита, вызванного Clostridium difficile. Этот колит часто возникает на фоне применения антибиотиков – антибиотикоассоциированный колит. Для его лечения хорош также эремомицин.
7. Хлорамфеникол (левомицетин) также является антибиотиком широкого спектра действия, активен в отношении многих видов грамотрицательных, включая риккетсии и спирохеты, и грамположительных бактерий. Большинство штаммов бактерий, устойчивых к пенициллинам, стрептомицинам и другим антибиотикам, сохраняет чувствительность к левомицетину.
8. Противотуберкулезные антибиотики. Как уже отмечалось, противотуберкулезной активностью обладают производные парааминосалициловой кислоты (препараты ПАСК), изоникотиновой кислоты (изониазиды), а также стрептомицин и его производные. Они составляют препараты первого ряда. К противотуберкулезным препаратам второго ряда относятся флоримицин, циклосерин и рифампицины. К рифампицинам высоко чувствительны также стафилококки, стрептококки, грамотрицательные кокки, многие не образующие спор анаэробы, сальмонеллы, возбудители особо опасных инфекций и другие бактерии – внутриклеточные паразиты.
9. Фосфомицины – антибиотики из группы фосфоновой кислоты. Фосфомицин обладает сильным бактерицидным действием на грамотрицательные бактерии (Escherichia, Proteus, Pseudomonas, Serratia, Salmonella, Shigella и другие роды).
10. Неприродные соединения – фторхинолоны. В клинике уже применяют около десяти фторхинолоновых препаратов (ципрофлоксацин, нефлоксацин, офлоксацин, ципробан и др.). Они обладают бактерицидным действием на многие грамотрицательные бактерии, в том числе на возбудителей самых тяжелых заболеваний. По своей эффективности фторхинолоны не уступают цефалоспоринам 3-го и 4-го поколений.
Пять групп антибиотиков обладают наиболее широким спектром антимикробного действия: бета-лактамы, фторхинолоны, аминогликозиды, тетрациклины и хлорамфеникол.
К препаратам, обладающим противогрибковым действием, относятся леворин, нистатин, амфотерицин В и некоторые другие полиеновые (содержащие сопряженные двойные связи) антибиотики, а также гризеофульвин, низорал, 5-фторцитозин (флуцитозин) – препараты группы имидазолов.
К этой группе относятся прежде всего интерфероны. Они активны против ДНКи РНК-содержащих вирусов. Других препаратов, которые бы обладали широким противовирусным действием, пока не найдено. В связи с этим все бo^льшая роль придается синтетическим индукторам эндогенных интерферонов. Наиболее активны два из них – амиксин и арбидол. Синтезированы также препараты, обладающие прямым антивирусным действием, – альгирем (римантадин), ацикловир, азидотимидин и др. Жизненный цикл вирусов настолько тесно связан с жизнью клетки, что найти или синтезировать такое химическое вещество, которое бы избирательно действовало только на вирус и не влияло на жизнь клетки-хозяина, оказалось значительно труднее. Однако поиски таких препаратов интенсивно ведутся.
Исследованы тысячи образцов антибиотиков для выявления таких, которые бы обладали высокой противоопухолевой эффективностью. Однако для клинического использования пока допущено всего лишь несколько антибиотиков: из группы антрациклинов – доксорубицин (адриамицин), акларубицин и рубомицин (даунорубицин); из группы актиномицинов – актиномицины С и Д; из группы ауреоловой кислоты – оливомицин; из группы стрептонигрина – брунеомицин.
Механизм действия антибиотиков
Всем антибиотикам свойственна избирательность действия. Их относительная безвредность для человека определяется прежде всего тем, что они специфически подавляют такие метаболические процессы в микробной клетке или у вируса, которые отсутствуют в эукариотной клетке или не доступны для них. В этом отношении уникален механизм действия бета-лактамных антибиотиков. Мишенями для них являются транспептидазы, которые завершают синтез пептидогликана клеточной стенки. Поскольку клеточная стенка есть только у прокариот, в эукариотной клетке нет мишеней для бета-лактамных антибиотиков. Транспептидазы представляют собой набор белков-ферментов, локализованных в цитоплазматической мембране бактериальной клетки. Отдельные бета-лактамы различаются по степени сродства к тому или иному ферменту, которые получили название пенициллинсвязывающих белков. Поэтому биологический эффект бета-лактамных антибиотиков различен – от бактериостатического до бактерицидного, литического.
Кроме бета-лактамных антибиотиков, синтез клеточной стенки нарушают такие антибиотики, как бацитрацин, фосфомицин, циклосерин, ванкомицин, ристомицин, однако иным путем, чем пенициллин. Все они, кроме циклосерина, вызывают бактерицидный эффект.
Механизм действия таких антибиотиков, как хлорамфеникол, тетрациклины, стрептомицин, аминогликозиды, эритромицин, олеандомицин, спирамицин и другие макролиды, линкозамиды, фузидиевая кислота, пуромицин, связан с угнетением синтеза белка на уровне рибосом 70S. Хотя бактериальные рибосомы 70S имеют такую же в принципе структуру, как рибосомы 80S эукариотных клеток, их белки и белковые факторы, участвующие в работе белоксинтезирующей системы, отличаются от таковых рибосом 80S. Этим и объясняется избирательность действия указанных антибиотиков на белковый синтез бактерий.
Антибиотики по-разному блокируют синтез белка. Тетрациклины блокируют связывание аа-тРНК на А-участке рибосомы 70S. Хлорамфеникол подавляет пептидилтрансферазную реакцию. Стрептомицины препятствуют превращению инициаторного комплекса в функционально активную рибосому. Эритромицин блокирует реакцию транслокации. Пуромицин, присоединяясь к растущему концу синтезируемой полипептидной цепи, вызывает преждевременное отделение ее от рибосомы. Механизм действия фторхинолонов связан с избирательным подавлением ими бактериальных ферментов ДНК-гираз, участвующих в репликации ДНК. Фторхинолоны связываются со специфическими участками ДНК, которые создаются под воздействием ДНК-гиразы, и подавляют ее активность.
Рифампицины угнетают активность ДНК-зависимых РНК-полимераз, вследствие чего у бактерий подавляются процессы транскрипции.
Активность противоопухолевых антибиотиков связана с тем, что они либо подавляют синтез ДНК (брунеомицин), либо подавляют активность ДНК в системе ДНК-зависимой РНК-полимеразы, т. е. блокируют транскрипцию (антрациклины, актиномицины, оливомицин).
Лекарственная устойчивость бактерий
Существуют два типа лекарственной устойчивости бактерий: естественная, или природная, и приобретенная.
Естественная лекарственная устойчивость является видовым признаком. Она присуща всем представителям данного вида и не зависит от первичного контакта (контактов) с данным антибиотиком, в ее основе нет никаких специфических механизмов. Чаще всего эта резистентность связана с недоступностью мишеней для данного антибиотика, обусловленной очень слабой проницаемостью клеточной стенки и цитоплазматической мембраны, или какими-либо другими причинами. Если низкая проницаемость свойственна нескольким антибиотикам, то она будет обусловливать полирезистентность таких бактерий.
Приобретенная лекарственная устойчивость возникает у отдельных представителей данного вида бактерий только в результате изменения их генома. Возможны два варианта генетических изменений. Один из них связан с мутациями в тех или иных генах бактериальной хромосомы, вследствие которых продукт атакуемого гена перестает быть мишенью для данного антибиотика. Это происходит либо вследствие изменения структуры белка, либо потому, что он становится недоступным для антибиотика.
В другом случае бактерии становятся устойчивыми к антибиотику или даже сразу к нескольким антибиотикам благодаря приобретению дополнительных генов, носителями которых являются R-плазмиды. Никаких других механизмов приобретенной лекарственной устойчивости не существует. Однако, приобретая устойчивость к антибиотику, а тем более сразу к нескольким антибиотикам, такие бактерии получают наивыгоднейшие преимущества: благодаря селективному давлению антибиотиков происходит вытеснение чувствительных к ним штаммов данного вида, а антибиотикоустойчивые варианты выживают и начинают играть главную роль в эпидемиологии данного заболевания. Именно они и становятся источниками формирования тех клонов бактерий, которые обеспечивают эпидемическое распространение возбудителя. Решающую роль в распространении лекарственной устойчивости, в том числе множественной, играют R-плазмиды благодаря способности их к самопереносу.
Биохимические основы антибиотикорезистентности
Можно выделить следующие пять биохимических механизмов формирования резистентности:
1. Разрушение молекулы антибиотика. Такой механизм лежит главным образом в основе формирования устойчивости к бета-лактамным антибиотикам. Бета-лактамазы, разрушая структуру пенициллинов и цефалоспоринов, обеспечивают устойчивость к ним бактерий.
2. Модификация структуры молекулы антибиотика, в результате которой утрачивается ее биологическая активность. Гены, содержащиеся в R-плазмидах, кодируют белки, которые вызывают различные модификации молекул антибиотика путем их ацетилирования, фосфорилирования или аденилирования. Именно таким путем инактивируются аминогликозиды, макролиды, хлорамфеникол, клиндамицин и другие антибиотики. Существуют целые семейства генов, определяющих инактивацию того или иного антибиотика даже по одному из указанных выше механизмов. Например, среди клинических штаммов грамположительных и грамотрицательных бактерий обнаружены различные изоферменты аминогликозидфосфо-, – ацетил– и – аденилтрансфераз, обеспечивающие устойчивость бактерий к различным спектрам аминогликозидных антибиотиков.
3. Изменение структуры чувствительных к действию антибиотиков мишеней. Изменение структуры белков рибосом 70S лежит в основе устойчивости к стрептомицину, аминогликозидам, макролидам, тетрациклинам и другим антибиотикам. Изменение структуры бактериальных гираз в результате мутации приводит к формированию устойчивости к хинолонам; РНК-полимераз – к рифампицину; пенициллинсвязывающих белков (транспептидаз) – к бета-лактамам и т. п.
4. Образование бактериями «обходного» пути метаболизма для биосинтеза белка-мишени, который оказывается нечувствительным к данному химиопрепарату, – механизм, который лежит в основе резистентности к сульфаниламидным препаратам. 5. Формирование механизма активного выведения из клетки антибиотика, в результате чего он не успевает достичь своей мишени (один из вариантов устойчивости к тетрациклинам).
Необычный механизм устойчивости к изониазиду обнаружен у Mycobacterium tuberculosis. Действие изониазида на туберкулезную палочку зависит от наличия у последней плазмиды, в составе которой имеется особый ген. Продукт этого гена превращает неактивный изониазид в активную форму, которая разрушает бактериальную клетку. Утрата этого гена обусловливает устойчивость M. tuberculosis к изониазиду.
В некоторых случаях инактивацию антибиотиков, которая лежит в основе резистентности к ним, бактерии могут осуществлять разными механизмами. Так, например, существует три механизма, ответственных за формирование устойчивости к бета-лактамным антибиотикам: слабая проницаемость наружной мембраны клеточной стенки грамотрицательных бактерий, обеспечивающая природную устойчивость; изменение структуры пенициллинсвязывающих белков в результате мутаций, которое приводит к утрате их сродства к антибиотику; продукция бета-лактамаз, разрушающих антибиотик. Существует три типа устойчивости и к тетрациклинам: 1) устойчивость, определяемая выносом тетрациклина из клетки белком цитоплазматической мембраны; 2) устойчивость, определяемая изменением структуры белка-мишени рибосом; 3) устойчивость, определяемая модификацией тетрациклина в неактивную форму.
Возможно, у бактерий существуют и другие механизмы формирования устойчивости к лекарственным препаратам.
Таким образом, в ответ на мощный натиск, который предпринял человек на бактерии с помощью антибиотиков, они ответили уникальными биологическими реакциями, сила которых не уступает силе атаки. На каждый новый антибиотик бактерии давали адекватный ответ: появлялись резистентные к нему штаммы, которые и сводили на нет биологическую активность этого препарата. Так было и так будет всегда. С этим нельзя не считаться и этого нельзя не учитывать. Поэтому следует постоянно искать пути преодоления этого препятствия, ибо пока существуют инфекционные болезни, их надо уметь эффективно лечить. Пути преодоления устойчивости к лекарственным препаратам будут рассмотрены ниже.
Возникает вопрос: каковы возможности и пути образования лекарственной устойчивости у бактерий? Поскольку они формируются только на генетическом уровне, то возникает и другой вопрос: откуда появляются новые гены лекарственной устойчивости? Устойчивость, возникающая как следствие мутации, объяснима и понятна, но не она играет основную роль. Основная роль принадлежит генам, которые содержатся в R-плазмидах, а они ведь не могут возникать сразу, de novo. Следовательно, в природе должен существовать своеобразный фонд генов лекарственной устойчивости, откуда бактерии могут постоянно «захватывать» те гены, которые необходимы для них в данной ситуации. Наиболее вероятно, что такой фонд образуется за счет генов, имеющихся у продуцентов антибиотиков. Каждый из них защищен от синтезируемого им антибиотика. Эта самозащита контролируется соответствующим геном. Следовательно, сколько бы ни было в природе антибиотиков, против каждого из них должен быть и ген самозащиты, ген устойчивости к этому антибиотику. В природе, особенно в почве, а также в кишечнике человека и животных, микроорганизмы сосуществуют в столь тесных взаимоотношениях, что это обеспечивает им постоянную возможность обмена генетическим материалом с помощью различных механизмов, в том числе с помощью конъюгации. Поскольку многие гены лекарственной устойчивости несут в себе транспонируемые элементы, это обеспечивает им высокую мобильность. Они могут перемещаться внутри хромосомы, переходить из хромосом в плазмиды, формировать новые варианты плазмид и подвергаться другим превращениям. Таким образом, обмен генами лекарственной устойчивости между микроорганизмами в естественных условиях, очевидно, вполне возможен. Решающую роль в их распространении среди возбудителей инфекционных заболеваний человека и животных начинает играть уже сам антибиотик. Опыт показывает, что раньше всего гены лекарственной устойчивости к каждому новому антибиотику появляются у клинических штаммов, а затем начинается их дальнейшая циркуляция в природе. Обладая определенной мобильностью, эти гены сами подвергаются модификации, мутациям, а в результате образуют группы, семейства генов, определяющих устойчивость к различным вариантам модифицированного антибиотика. Хотя многое еще придется изучить в этом плане, но общая тенденция и масштабы развития у бактерий лекарственной устойчивости уже вполне объяснимы.
Каковы же возможные перспективы поиска новых антибиотиков, иначе говоря, какими новыми свойствами должны обладать новые антибиотики, чтобы преодолеть известные у бактерий механизмы защиты от них?
Желателен поиск таких антибиотиков, которые бы:
1) имели иную молекулярную структуру и иные мишени в бактериальной клетке, отсутствующие (или, по крайней мере, хорошо защищенные от данного антибиотика) в эукариотной клетке;
2) обладали новым механизмом транспорта в бактериальную клетку;
3) были бы нечувствительны к защитным ферментам и не индуцировали бы их синтез;
4) отвечали бы всем остальным требованиям, предъявляемым к антибиотикам.
Способы определения чувствительности (резистентности) бактерий к химиопрепаратам
Чувствительными к антибиотикам и химиопрепаратам в клинической практике считаются те микроорганизмы, на которые препарат в концентрации, достигаемой в очаге инфекции, оказывает бактериостатическое или бактерицидное действие. Поэтому критерии чувствительности возбудителя зависят от концентрации лечебного препарата в очаге инфекции, величины максимальной терапевтической дозы химиопрепарата, его фармакокинетики и токсичности.
Существуют различные способы определения чувствительности бактерий к антибиотикам, но чаще всего используются два из них: метод диффузии в агар с применением стандартных дисков, пропитанных антибиотиком, и метод серийных разведений антибиотика.
Первый из них заключается в использовании заранее приготовленных из фильтровального картона дисков диаметром 6 ± 0,5 мм. В России выпускается более 20 стандартных дисков. Содержание антибиотика в диске указано на этикетке и соответствует рекомендациям ВОЗ. Содержание антибиотика в диске варьирует в зависимости от его терапевтической дозы и выражается в мкг/мл или в единицах действия (ЕД). Диски одного наименования содержат одну дозу антибиотика; она составляет: 5 мкг/мл (рифампицин), 6 мкг/мл или 10 мкг/мл (бензилпенициллин), 10 мкг/мл (ампициллин, метициллин, оксациллин, гентамицин, сизомицин, доксициклин, фузидин), 15 мкг/мл (эритромицин, линкомицин, олеандомицин), 25 мкг/мл (карбенициллин), 30 мкг/мл (цефалексин, цефалотин, неомицин, стрептомицин, канамицин, мономицин, тетрациклин, левомицетин, ристомицин), 300 ЕД (полимиксин). Диски с различными антибиотиками отличаются друг от друга по цвету (белые, зеленые, желтые и т. д.) или коду, который представляет собой первую букву названия антибиотика, вытисненную на диске.
Поскольку определяемая in vitro степень чувствительности микробов к антибиотикам зависит от условий опыта, для получения достоверных и воспроизводимых результатов необходимо точное соблюдение правил, регламентированных соответствующими методическими указаниями, а также использование стандартных питательных сред и дисков. Оценка результатов определения чувствительности основана на установлении зависимости между размером зон подавления роста исследуемых культур вокруг дисков с антибиотиками и значениями минимальных подавляющих концентраций (МПК) соответствующих антибиотиков в отношении тех или иных культур. Установление такой зависимости в соответствии с методическими указаниями позволяет придать оценке результатов полуколичественный характер и отнести исследуемые культуры бактерий к одной из трех категорий: устойчивые, умеренно устойчивые, чувствительные.
Для испытания чувствительности диски с антибиотиками наносят на поверхность агара, на который перед этим засевают исследуемую культуру. На одну чашку помещают не более 6 дисков. Чашки инкубируют в термостате в течение 18 – 20 часов при температуре 35 – 37 °C. После этого с помощью линейки измеряют диаметр зон задержки роста вокруг дисков (включая диаметр самих дисков) с точностью до 1 мм (рис. 59). Оценку результатов проводят с помощью специальной таблицы, имеющейся в «Методических указаниях по определению чувствительности микроорганизмов к антибиотикам методом диффузии в агар с использованием дисков» (1983). Эта таблица содержит пограничные значения диаметров зон задержки роста для устойчивых, умеренно устойчивых и чувствительных штаммов. Перечень основных микроорганизмов, подлежащих эпидемиологическому наблюдению, и их кодовые наименования приведены в табл. 7.
Более точным является количественный метод, позволяющий определить минимальную подавляющую концентрацию (МПК) антибиотика, выраженную в мкг/мл. С этой целью делают серийные разведения антибиотика и добавляют их в жидкую или плотную питательную среду, а затем определяют, при какой минимальной концентрации антибиотика произошло подавление роста исследуемого штамма возбудителя.
Рис. 59. Определение чувствительности бактерий к антибиотикам с помощью стандартных дисков
Таблица 7
Основные микроорганизмы – возбудители инфекционно-воспалительных заболеваний
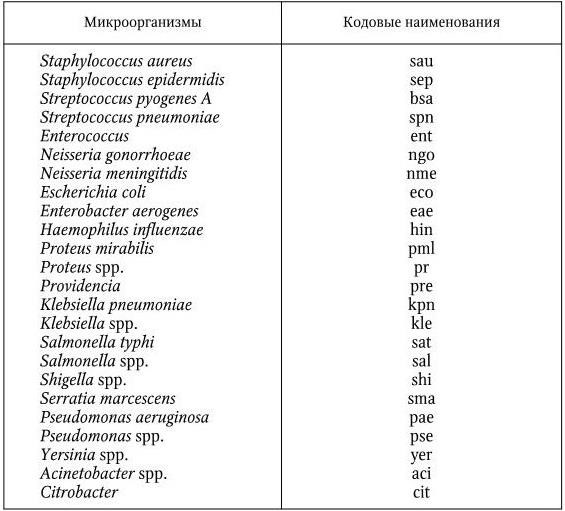
Примечание. Кодовые наименования соответствуют протоколу ВОЗ.
Бактериологические анализаторы. С целью совершенствования методов бактериологической диагностики инфекционных заболеваний и одновременного определения чувствительности возбудителя к антибиотикам разработаны и широко внедряются в практику различные автоматические и полуавтоматические бактериологические анализаторы, которые позволяют избавить бактериолога от значительной части рутинной работы, в широких пределах проводить идентификацию культуры и изучать ее чувствительность к антибактериальным препаратам, быстро получая достоверные результаты. В комплект автоматического бактериологического анализатора (например, серии WalkAway компании Dade AG) входят автоматический анализатор с поддержанием постоянной температуры и влажности, персональный компьютер с программным обеспечением, принтер для нанесения штриховых кодов и принтер для распечатки результатов, прибор для стандартизации мутности. С помощью инокулятора-регидратора суспензия первично выделенной культуры переносится в панели с ячейками, содержащими различные тест-субстраты (более 30), с помощью которых за короткий срок удается дифференцировать многие виды бактерий по их биохимическим свойствам. Кроме того, имеются панели с ячейками, содержащими антибиотики (более 40 препаратов в 30 различных комбинациях). Идентификация и проверка чувствительности к антибиотикам осуществляются за 2 – 3,5 ч спектрофотометрическим и флуоресцентным методами. Система позволяет идентифицировать более 300 видов микроорганизмов, в том числе грамположительные, грамотрицательные, грибы, анаэробы и др. Программное обеспечение позволяет выбирать наиболее эффективный лекарственный препарат с учетом путей его введения, контролировать проводимую антибиотикотерапию, осуществлять ее стоимостный анализ, а также решать вопросы эпидемиологического анализа и контроля, сохранять и обрабатывать полученную информацию.
Побочные реакции, наблюдаемые при антибиотикотерапии
Хотя к антибиотикам предъявляются жесткие требования в отношении их безвредности для человека, в некоторых случаях, особенно при неоднократном или длительном применении, наблюдаются нежелательные реакции, которые можно разделить на следующие 4 группы: аллергические, токсические, эндотоксические и дисбактериозы. Аллергические реакции наблюдаются в тех случаях, когда антибиотик выступает в качестве аллергена. Они не зависят от дозы введенного препарата, могут наступать за первым введением его, но обычно возникают в результате постепенной сенсибилизации при повторных применениях антибиотика. Могут носить характер крапивницы, дерматита, сыпи, ринита и т. п. Наибольшую опасность представляет пенициллиновый шок – реакция гиперчувствительности немедленного типа.
Токсические реакции возникают чаще всего в связи с органотропным фармакодинамическим действием антибиотика и при продолжительном лечении. Проявляются в виде поражения вестибулярного аппарата (неомицин, канамицин, стрептомицин, флоримицин и некоторые другие), почек (полимиксин, бацитрацин, неомицин, мономицин, канамицин, стрептомицин, амфотерицин В и некоторые другие), периферических нервов, различных поражений ЦНС (циклосерин, неомицин, полимиксин, гризеофульвин, пенициллин, стрептомицин и некоторые другие) и других нарушений.
Наиболее тяжелым бывает токсическое воздействие на кровь: агранулоцитоз, апластическая анемия (левомицетин).
Эндотоксические реакции развиваются в тех случаях, когда под влиянием антибиотика происходит массовое разрушение грамотрицательных бактерий, сопровождающееся выделением и поступлением в кровь их эндотоксина (липополисахарида).
Одним из самых частых осложнений, особенно при длительном применении антибиотиков с широким антимикробным спектром, являются дисбактериозы. Они развиваются в результате того, что применяемый антибиотик действует не только на возбудителя, но и на нормальную микрофлору, угнетая ее. Это ведет к тому, что беспрепятственно начинают размножаться те микроорганизмы, которые к этому антибиотику нечувствительны. Чаще всего это стафилококки, дрожжеподобные грибы Candida, клостридии, некоторые грамотрицательные палочки (псевдомонады, протей и др.). Наиболее тяжело протекают генерализованный кандидоз (кандидосепсис); стафилококковый энтероколит; псевдомембранозный колит, вызываемый Clostridium difficile; вторичные пневмонии, вызываемые стафилококком и грамотрицательными палочками.
Некоторые принципы рациональной антибиотикотерапии
Рациональное лечение антибиотиками должно строиться на основе знания индивидуальных особенностей пациента, течения заболевания, биологии возбудителя и его отношения к антибиотикам, а также свойств назначаемого препарата (препаратов). По мнению С. М. Навашина, необходимо придерживаться следующих основных принципов рациональной антибиотикотерапии:
1) выделение и идентификация возбудителя, изучение его антибиотикограммы;
2) выбор наиболее активного и наименее токсичного препарата;
3) определение оптимальных доз и методов введения на основе знания особенностей кинетики антибиотика в организме больного для создания в крови, жидкостях и тканях организма терапевтических концентраций, превышающих в 2 – 3 раза минимальную подавляющую концентрацию для данного возбудителя;
4) своевременное начало лечения и проведение курсов антибиотикотерапии необходимой продолжительности вплоть до полного закрепления терапевтического эффекта;
5) знание характера и частоты побочных явлений при назначении антибиотиков, особенно в условиях нарушения их распределения в организме больного при некоторых патологических состояниях, например почечно-печеночной недостаточности;
6) комбинирование антибиотиков между собой и с другими препаратами с целью усиления антибактериального эффекта, улучшения их фармакокинетики и снижения частоты побочных явлений.
Эффективность антибиотикотерапии может быть значительно повышена при комбинированном применении препаратов. При сочетании бактерицидных антибиотиков в большинстве случаев действие их усиливается. Комбинация антибиотиков с бактериостатическим действием вызывает суммирование эффекта или не оказывает дополнительного влияния на возбудителя. Сочетание же бактерицидных и бактериостатических антибиотиков нежелательно, так как может привести к их антагонизму (например, пенициллин + тетрациклины). Наиболее эффективными признаны сочетания антибиотиков, которые оказывают синергидный эффект – резкое усиление терапевтической активности:
пенициллины + аминогликозиды,
тетрациклины + макролиды,
пенициллины + сульфаниламиды.
Ни в коем случае нельзя комбинировать антибиотики с идентичным характером побочных реакций (например, ото-, нефро-, гепато-, гемотоксичность).
В тех случаях, когда необходимо прибегать к эмпирическому лечению антибиотиком (т. е. до выделения возбудителя и определения его антибиотикограммы), лучше всего применять тот препарат, который обладает широким антимикробным спектром и к которому еще нет резистентности, например аугментин.
УЧЕНИЕ ОБ ИММУНИТЕТЕ
Основные этапы развития учения об иммунитете
Давно было известно, что человек, перенесший опасную заразную болезнь, как правило, второй раз ею не болеет. Об этом писал в своей «Истории» древнегреческий историк Фукидид (около 460 – 400 лет до н. э.). Описывая Пелопоннесскую войну, он отмечал, что во время эпидемии никто не заболевал дважды и что уход за больными осуществляли переболевшие.
Не менее древними были и попытки использовать эти наблюдения с целью обезопасить себя от заразных заболеваний, в особенности от такой тяжелой болезни, как оспа. В Китае еще в XI в. до н. э. был разработан метод предупреждения заболевания оспой, получивший название вариоляции. Он заключался в том, что оспенные корочки (струпья) растирали в порошок и вносили в нос. В Индии натирали кожу до ссадин и прикладывали к ней ткань, пропитанную оспенным гноем. Все это делалось для того, чтобы вызвать легкую форму оспы и уберечься от тяжелой формы болезни. Метод вариоляции сохранился до XVIII в. н. э. Он был далеко не безопасен, так как при этом наблюдались и тяжелые формы оспы, а такие лица оставались источником заражения для других. Однако вариоляция наглядно доказала возможность искусственного воспроизведения иммунитета путем перенесения заболевания в легкой форме и подготовила общественную мысль к восприятию идеи вакцинации, предложенной в 1798 г. Э. Дженнером. Убедившись после многолетних наблюдений в том, что лица, перенесшие коровью оспу, не болеют натуральной оспой, Э. Дженнер в 1796 г. во время вспышки заболевания привил мальчику Джеймсу Фиббсу коровью оспу – вакцину (лат. vacca – корова) от молочницы С. Нельмс, а затем через 1,5 месяца заразил его содержимым из пустулы больного оспой, и ребенок оспой не заболел. Эти опыты Э. Дженнер повторил много раз и в 1798 г. опубликовал результаты своих наблюдений. Его метод, несмотря на многие препятствия, стал быстро распространяться. Уже через два года было привито более 100 тыс. человек. В России первая прививка против оспы по методу Дженнера была сделана в 1801 г. мальчику из сиротского дома Антону Петрову, получившему после этого фамилию Вакцинов.
Открытие Э. Дженнера было величайшим достижением в борьбе с оспой. Оспа на Земле была ликвидирована с помощью вакцинации в 1974 г. Однако это открытие в течение многих лет мало способствовало развитию иммунологии, для ее развития нужно было знать природу заразных заболеваний. Поэтому только после работ Л. Пастера, выяснившего природу этих болезней, открытие Дженнера предстало в новом свете и оказало несомненное влияние на последующее становление и развитие иммунологии и прежде всего на работы самого Л. Пастера в этой области. Его собственные опыты с возбудителями куриной холеры, сибирской язвы и бешенства доказали возможность искусственного получения вакцин (Л. Пастер сохранил этот термин и сделал его нарицательным) путем ослабления (аттенуации) патогенных свойств возбудителя. Поэтому с именем Л. Пастера связывается первый период в истории иммунологии.
Л. Пастер научно обосновал основной принцип борьбы с инфекционными болезнями – создание искусственного коллективного иммунитета против них. Однако сам Пастер не занимался изучением сущности явления иммунитета. Основными творцами учения об иммунитете стали русский ученый И. И. Мечников со своими многочисленными учениками и последователями и немецкий ученый П. Эрлих со своими последователями и сотрудниками. Именно их работами был заложен фундамент новой науки – иммунологии – и определены основные направления ее развития.
И. И. Мечников, изучая воспалительные процессы у различных групп животных, обратил внимание на то, что вводимое в их организм инородное тело всегда окружалось подвижными амебовидными клетками мезодермы, способными его заглатывать. Такие клетки являются непременными участниками воспалительных процессов как у животных, имеющих кровеносную систему, так и у организмов, лишенных ее. Процесс поглощения чужеродных элементов этими клетками И. И. Мечников назвал фагоцитозом (греч. phagein – пожирание), а сами клетки – фагоцитами. Изучив подробно фагоцитоз, И. И. Мечников показал, что у простейших он служит целям питания, а у многоклеточных – целям их защиты. Свои классические опыты для доказательства защитных функций фагоцитов И. И. Мечников произвел над маленькими пресноводными рачками (Daphnia), наблюдения над которыми облегчались их прозрачностью. Дафнии заражались грибами Monospora bicuspidata. Острые споры гриба проходили через кишечник в полость тела и здесь окружались, затем заглатывались и переваривались подвижными фагоцитами. Если спор было немного, то все они поглощались фагоцитами, и животное выздоравливало; в тех же случаях, когда споры проникали в полость тела в больших количествах, фагоциты не успевали их поглотить, споры прорастали, размножались, и животное погибало. В 1883 г. на VII съезде русских врачей в Одессе И. И. Мечников выступил с докладом «О целебных свойствах организма», в котором сообщил, что «подобные клетки (фагоциты) должны служить в организме для противодействия вредным деятелям». В последующем И. И. Мечников и его сотрудники обстоятельно изучили фагоцитарную реакцию у млекопитающих и, наконец, у человека. Так была создана фагоцитарная теория иммунитета, и целебные силы организма впервые были связаны с созданной самой природой для этих целей системой особых клеток – фагоцитов.
Одновременно с изучением фагоцитов началось и изучение антител, образующихся в организме больного против микробов и их токсинов. Работами Э. Беринга, Э. Ру, А. Иерсена и других ученых были заложены основы учения о гуморальном иммунитете. В 1888 г. Э. Ру и А. Иерсен обнаружили, что дифтерийная палочка вырабатывает экзотоксин, в 1890 – 1892 гг. Э. Беринг и С. Китазато, а в 1893 г. Я. Ю. Бардах и в 1894 г. Г. Н. Габричевский показали, что иммунитет к дифтерии и столбняку зависит от образования антитоксинов, циркулирующих в крови. Эффективность гуморальных факторов иммунитета подтверждалась тем, что введение антитоксических сывороток обеспечивало выздоровление больных. Этими исследованиями был открыт новый путь в области медицинской науки, который дал в руки врачей эффективное средство против ряда болезней.
В 1897 г. П. Эрлих внес крупный вклад в развитие иммунологии. Он разработал практический метод стандартизации препаратов дифтерийного токсина и антитоксина. В этой же работе он изложил основы своей концепции боковых цепей, которая объясняла происхождение специфических антител, т. е. создал гуморальную теорию иммунитета, которая в течение нескольких десятилетий, наряду с фагоцитарной теорией И. И. Мечникова, оказывала значительное влияние на развитие иммунологии. Между сторонниками фагоцитарной теории И. И. Мечникова и гуморальной теории П. Эрлиха развернулась и продолжалась в течение многих лет знаменитая дискуссия, обеспечившая быстрый прогресс иммунологии и закончившаяся присуждением в 1906 г. И. И. Мечникову и П. Эрлиху Нобелевской премии, так как обе теории оказались правильными.
За короткий срок учение о невосприимчивости к инфекционным болезням достигло расцвета. В это время И. И. Мечников дал следующее определение понятия иммунитета. «Под невосприимчивостью к заразным болезням надо понимать общую систему явлений, благодаря которым организм может выдерживать нападение болезнетворных микробов. В настоящее время невозможно дать более точное определение, так что бесполезно настаивать на этом». В начальном периоде развития науки иммунитет рассматривали только как невосприимчивость к инфекционным болезням. Но постепенно стали накапливаться данные о том, что иммунные реакции проявляются не только к микроорганизмам, но и к другим клеткам. Так, Ж. Борде в 1898 – 1899 гг. установил, что антитела образуются и к эритроцитам. В 1900 г. К. Ландштейнер разработал учение о группах крови человека, различающихся по изоантигенам эритроцитов (система АВ0) и антителам к ним. Эти и другие данные постепенно приводили к выводу, что иммунологическим механизмам принадлежит более весомая роль, чем участие их только в формировании невосприимчивости к инфекционным болезням. Становилось ясно, что наряду с инфекционным иммунитетом существует и неинфекционный иммунитет.
Решающий вклад в изменение представления об иммунитете только как о способе защиты от микробов внесли исследования английского ученого П. Медавара (1945). Он убедительно показал, что отторжение аллогенного (чужеродного) кожного трансплантата осуществляется с помощью обычных иммунологических реакций. «Механизм, посредством которого элиминируется чужеродная кожа, принадлежит к общей категории активно приобретенных иммунных реакций». Таким образом, стало ясно, что в основе неинфекционного трансплантационного иммунитета лежат те же механизмы, что и при защите от возбудителей заразных заболеваний. В последующие 10 лет было установлено, что иммунные механизмы отторгают такие аллотрансплантаты, клетки которых отличаются от клеток хозяина по минимальным генетическим признакам – всего лишь по одному гену гистосовместимости. В связи с этим возник вопрос, в чем же заключается основная функция иммунитета, для чего нужен столь строгий контроль, который позволяет отличить любую чужеродную клетку, даже если она отличается от всех других клеток организма только по одному гену.
Основная функция иммунитета – обеспечение структурной и функциональной целостности организма
Ответ на вопрос – для чего нужен иммунитет? – дал в 1964 г. австралийский ученый Ф. Бернет. Он сформулировал положение о том, что с помощью иммунитета осуществляется постоянный надзор за обеспечением генетического гомеостаза: «Величайший смысл иммунитета, по-видимому, заключается в той роли, которую он играет в процессах, направленных на поддержание структурной и функциональной целостности любого сложного организма… Центральным биологическим механизмом является механизм распознавания ″своего″ и ″чужого″». Необходимость осуществления такого постоянного иммунологического надзора вытекает из следующего положения. Тело большинства млекопитающих состоит из 1012– 1013 клеток, генетически идентичных друг другу. Однако в природе происходят так называемые спонтанные мутации с частотой, соответствующей появлению на 1 млн клеток одной мутантной. Следовательно, в каждый момент в организме может быть около 10 млн измененных (мутантных, в том числе раковых) клеток. Если бы не было механизмов, с помощью которых такие клетки распознаются и уничтожаются, это привело бы к катастрофическим последствиям. Поэтому живая природа в процессе эволюции изобрела и сохранила уникальные механизмы иммунитета, то есть самозащиты. Их действие направлено против вторгшихся или образующихся в организме любых генетически чужеродных ему, а следовательно, и опасных для него клеток, включая и собственные мутантные, и различные микроорганизмы, и образуемые ими чужеродные вещества, способные нарушить генетический гомеостаз.
Характерно, что в 60-х гг. XX в. были открыты два очень важных феномена, окончательно подтвердивших существование иммунологического надзора в организме. В 1964 г. был описан (Э. Хельстрем [и др.]) феномен сингенного предпочтения. Суть его в том, что ряд клеток и тканей растут и размножаются значительно медленнее при их трансплантации в генетически отличающийся организм (когда этот организм не способен включить в действие обычный иммунологический механизм отторжения чужеродной ткани). Клетки, идентичные по антигенному составу (клетки монозиготных близнецов), называют сингенными. Ткани организмов, относящихся к одному и тому же виду, но отличающиеся по изоантигенному составу, называют аллогенными, а ткани организмов, относящихся к разным видам, – ксеногенными, т. е. генетически чужеродными. В 1967 г. Р. В. Петров и Л. С. Сеславина обнаружили и описали феномен инактивации лимфоцитами несингенных стволовых клеток. Они установили, что живые лимфоциты при первичном контакте с генетически отличающимися клетками кроветворных тканей способны инактивировать содержащиеся там стволовые клетки, т. е. те элементы, от которых зависят рост и размножение этих тканей. Нежизнеспособные лимфоциты этим свойством не обладают.
Эти два феномена свидетельствуют о наличии по крайней мере двух механизмов, созданных для поддержания генетического гомеостаза соматических клеток. С помощью одного из них обеспечивается предпочтительное размножение генетически идентичных, а с помощью другого – активное торможение или даже элиминация способных к размножению (т. е. стволовых) генетически измененных клеток. Благодаря наличию этих механизмов возникающие в организме мутантные (несингенные) клетки распознаются, их активность подавляется, и поэтому они не дают сколько-нибудь значительного потомства, в конечном счете они уничтожаются и элиминируются из организма. Можно предположить, что развитие в организме аномальных (раковых) клеток – следствие иммунодефицита, т. е. нарушения функций одной из этих двух или каких-то других систем иммунитета. Таким образом, иммунитет к инфекционным заболеваниям есть лишь часть общей системы иммунитета, диапазон действия которой значительно многообразнее и шире. Поэтому изменилось и представление об иммунитете, и ему можно дать ныне более широкое определение.
Иммунитет представляет собой целостную систему биологических механизмов самозащиты организма, с помощью которых он распознает и уничтожает все чужеродное (т. е. генетически отличающееся от него), если оно проникает в организм или возникает в нем. С помощью этих механизмов поддерживается структурная и функциональная целостность организма на протяжении всей его жизни, т. е. сохраняется физическое здоровье людей и обеспечивается исцеление от многих болезней.
Современные направления развития иммунологии. Формы противоинфекционного иммунитета
В современной иммунологии можно выделить два основных раздела: инфекционная и неинфекционная иммунология. Инфекционная иммунология занимается изучением механизмов невосприимчивости к инфекционным болезням, роли гуморальных и клеточных факторов в формировании иммунитета, молекулярной структуры и биосинтеза антител, строения их активных центров с целью выяснения механизма специфического взаимодействия антител с антигенами, химической структуры рецепторов Т-, В-лимфоцитов, макрофагов и природы их кооперативного взаимодействия в распознавании чужеродных агентов и в выдаче соответствующих форм иммунного ответа. На основе изучения этих явлений инфекционная иммунология разрабатывает и совершенствует специфические методы диагностики инфекционных болезней, а также способы их профилактики и лечения путем создания искусственного иммунитета.
60 – 90-е гг. ХХ в. ознаменовались бурным развитием иммунологии: были открыты основные популяции лимфоцитов (в первую очередь, Т– и В-лимфоциты), изучены их рецепторы и функции, раскрыты молекулярная cтруктура антител и особенности генетического контроля их биосинтеза, достигнут дальнейший прогресс в изучении систем макрофагов, комплемента, интерферонов, главной системы гистосовместимости, разработаны новые поколения вакцин, усовершенствованы иммунологические методы диагностики инфекционных болезней, разработаны принципы и критерии оценки иммунологического статуса организма человека, методы коррекции иммунодефицитов и получены другие важные результаты.
Иммунология стала одной из фундаментальных медико-биологических наук. Именно благодаря достижениям иммунологии раскрыты главные механизмы биологической самозащиты организма, воздействуя на которые врач может наилучшим образом помочь больному.
Существуют две основные формы противоинфекционного иммунитета. Первая – видовой, или врожденный (наследственный), или неспецифический, иммунитет. Вторая – приобретенный, или специфический, иммунитет.
В неинфекционной иммунологии оформились и успешно развиваются следующие основные направления.
Иммуногенетика – изучает закономерности наследования антигенов клеток ткани и генетический контроль иммунных реакций.
Вакцинология – изучает особенности создания поствакцинального иммунитета, разрабатывает новые технологии производства вакцин и методы вакцинации.
Иммуноморфология – исследует морфологические аспекты иммунологических проявлений на тканевом, клеточном и субклеточном уровнях.
Трансплантационная иммунология – выясняет иммунологические аспекты несовместимости тканей, механизмы отторжения несингенных трансплантатов и пути преодоления тканевой несовместимости, т. е. создания иммунологической толерантности.
Иммунопатология – исследует роль иммунных (главным образом, аутоиммунных) механизмов в возникновении и развитии ряда заболеваний.
Иммуногематология – занимается изучением проблем иммуногенетики и иммунопатологии применительно к клеткам крови (закономерности наследования антигенов клеток крови, роль аутоиммунных механизмов в развитии ряда болезней крови и т. п.).
Иммунология онтогенеза – изучает роль иммунологических механизмов в процессах индивидуального развития (морфогенеза) и в поддержании генетического постоянства внутренней среды организма, а также природу иммунодефицитов.
Большое внимание в последние годы привлекает изучение противоопухолевого иммунитета.
Под видовым иммунитетом понимают невосприимчивость, обусловленную врожденными биологическими особенностями, присущими данному виду животных или человеку. По сути дела, это видовой признак, передающийся по наследству, подобно любому другому признаку вида. Примером подобной формы невосприимчивости может служить иммунитет человека к чуме рогатого скота, животных – к брюшному тифу, дизентерии и т. д. Видовой иммунитет может проявляться у животных одного и того же вида ко многим инфекционным агентам и у разных видов к одному и тому же возбудителю, например, к полиомиелиту невосприимчивы все млекопитающие, кроме обезьян, человека и некоторых видов грызунов. В основе видового иммунитета лежат различные механизмы естественной неспецифической резистентности. В связи с этим многие ученые предполагают, что данную форму невосприимчивости правильней называть не иммунитетом, а естественной неспецифической резистентностью. Характерными особенностями ее являются наследственная передача и отсутствие специфичности.
Биологические факторы, обусловливающие видовую резистентность, не имеют какой-либо избирательной направленности в отношении только одного какого-то возбудителя, их защитная роль проявляется независимо от природы вредного агента. По отношению ко многим возбудителям видовой иммунитет бывает весьма стойким, но не абсолютным. При изменении условий внешней среды в ряде случаев видовой иммунитет может быть преодолен. Например, в обычных условиях лягушка невосприимчива к столбняку, но если после введения возбудителя столбняка лягушку поместить в термостат при температуре 37 °C, она заболевает типичной формой столбняка. Резистентность человеческого организма к инфекционным болезням зависит от пола, возраста, климатических условий, времени года и в значительной степени от социально-экономических условий жизни. Как правило, резистентность наиболее высока, когда организм функционирует нормально во всех отношениях, и снижается под влиянием различных факторов, которые нарушают нормальное физиологическое состояние. В ряде случаев перенесенное заболевание до такой степени снижает резистентность организма, что менее вирулентные бактерии могут стать причиной вторичной инфекции.
Неспецифическая видовая резистентность обусловлена целым рядом анатомофизиологических механизмов. Схематически их можно разделить на следующие группы факторов: защитная роль кожных и слизистых покровов; нормальная микрофлора макроорганизма; воспаление; лихорадка; барьерная функция лимфатических узлов; гуморальные антимикробные вещества, содержащиеся в тканях и жидкостях организма; функции выделительной системы; фагоцитоз и др.
Кожа. Неповрежденная кожа представляет собой обычно непроницаемый барьер для микроорганизмов. Лишь при некоторых инфекционных болезнях, например лептоспирозах, прямое проникновение возбудителя через неповрежденную кожу, возможно, является первичным путем заражения. Кожа представляет собой не просто инертную механическую преграду для проникновения микроорганизмов. Напротив, здоровая неповрежденная кожа обладает отчетливой бактерицидной активностью в отношении тех микроорганизмов, которые не являются представителями ее нормальной микрофлоры. Так, если нанести на кожу взвесь стрептококков, то количество их через 30 мин уменьшается в 3 раза, через 1 ч – в 20 раз, а через 2 – 3 ч их останется лишь очень немного. Более эффективное действие проявляет чистая кожа. Гибель микроорганизмов значительно замедляется на загрязненной коже. Бактерицидные свойства кожи обусловлены, как полагают, наличием в секрете сальных и потовых желез ненасыщенных жирных кислот, особенно олеиновой. Свободные насыщенные алифатические кислоты, содержащиеся в секрете сальных желез, обладают определенным фунгистатическим действием. Бактерицидное и бактериостатическое действие оказывают также содержащиеся в секрете потовых желез перекись водорода, уксусная кислота, аммиак, мочевина, желчные пигменты и др. Нарушения целостности кожи, ранения – частая причина проникновения в организм возбудителей, в особенности гнойно-воспалительных болезней.
Слизистые оболочки. Слизистые оболочки также выполняют роль не только факторов механической защиты. Они обладают некоторыми приспособлениями и свойствами, которые уменьшают возможность проникновения возбудителя в организм. Так, например, покрытые слизью реснички мерцательного эпителия адсорбируют на себе микроорганизмы, содержащиеся во вдыхаемом воздухе, и способствуют его очищению. Слизь, выделяемая оболочками, наряду с другими физиологическими функциями используется организмом для адсорбции, вымывания и удаления различных раздражителей, в том числе и микробов. Бактерии, попавшие на слизистую глаза, относительно быстро удаляются путем вымывания слезной жидкостью. Наконец, слизистые оболочки вырабатывают различные ферменты и другие продукты жизнедеятельности, которые обладают антимикробным действием. В слюне, в слезной жидкости, в носовом секрете и в различных тканевых соках содержится фермент лизоцим. Идентичный фермент обнаружен и в яичном белке. Лизоцим разрушает клеточную стенку бактерий, разрывая β-гликозидные связи между аминосахарами пептидогликана. В результате этого образуются протопласты, которые оказываются нестойкими и подвергаются лизису. Особенно чувствителен к действию лизоцима Micrococcus lysodeikticus, который разрушается слезной жидкостью, разведенной 1: 40 000. Помимо лизоцима, в носовом секрете присутствует вирусинактивирующий агент, который по своим свойствам отличается от лизоцима. Этот агент действует на вирус гриппа и на ряд других вирусов, чувствительных к дезоксихолату. Механизм действия его пока не установлен. Мощным антимикробным действием обладает нормальный желудочный сок с его кислой реакцией. Большинство бактерий, попадающих в желудок, разрушаются здесь. Поэтому в желудке очень немного живых бактерий. Через желудок в кишечник бактерии могут проникать, очевидно, в том случае, когда они заключены в твердые частицы пищи и, таким образом, на какой-то срок защищены от бактерицидного действия желудочного секрета. Вещества, подавляющие рост микроорганизмов, обнаружены в секретах различных слизистых оболочек.
Нормальная микрофлора организма. Микроорганизмы, которые населяют кожу и слизистые оболочки, сообщающиеся с внешней средой, составляют нормальную микрофлору организма. Эти микроорганизмы способны лучше противостоять защитным механизмам организма, но не способны, за исключением тех случаев, когда резистентность сильно снижена, проникать в ткани.
В соответствии с физиологическими функциями и особенностями свойств секрета (рН среды, наличие питательных веществ, антимикробных факторов и т. п.) в различных участках слизистых оболочек верхних дыхательных путей, желудочно-кишечного и мочеполового трактов сформировались свои характерные сообщества микроорганизмов, составляющих нормальную микрофлору. Помимо прочих функций (снабжение организма дефицитными витаминами, аминокислотами, участие в переваривании ряда питательных веществ), нормальная микрофлора функционирует также как важная составная часть всего комплекса защитных механизмов, лежащих в основе резистентности организма. Защитный эффект нормальной микрофлоры заключается в том, что между ее представителями и патогенными микроорганизмами, которые попадают в данную область, неизбежно возникают сложные формы взаимоотношений, от конкуренции до прямого антагонизма, природа которых может быть самой различной (конкуренция за питательные вещества, обусловленная различной скоростью размножения, выделение антибиотических веществ, изменение рН среды в сторону, неблагоприятную для конкурента, и т. п.). Например, нормальная микрофлора слизистой влагалища у женщин представлена молочнокислыми бактериями. Кислая среда, создаваемая ими, препятствует размножению других, в том числе патогенных, бактерий.
Изменение нормальной микрофлоры – дисбактериоз – наступает или вследствие перенесенного заболевания, или в результате применения веществ, угнетающих нормальную микрофлору.
Воспаление. Как защитная реакция целостного организма на чрезмерное раздражение и повреждение ткани физическими, химическими и биологическими агентами воспаление возникло на более высокой ступени эволюции, чем фагоцитоз, а именно – у организмов, обладающих кровеносной и нервной системами. Помимо фагоцитоза, который является обязательным компонентом воспалительной реакции, в ней действуют и другие механизмы защиты, благодаря которым в очаге воспаления происходят фиксация и аккумуляция микроорганизмов или других инородных веществ и их уничтожение. Существенную роль в механизме воспаления играют гистамин, серотонин и другие биологически активные вещества, которые освобождаются главным образом из тучных клеток (мастоцитов). Они повышают проницаемость стенок капилляров, в результате чего в зоне воспаления появляются макрофаги и экссудат, содержащий комплемент, лейкотаксин, фибриноген и антитела; развивается отек. Лейкотаксин также увеличивает проницаемость капилляров и стимулирует миграцию полиморфноядерных лейкоцитов сквозь стенки сосудов. Фагоциты, скапливающиеся в изобилии в очаге воспаления, создают своеобразный вал, препятствующий дальнейшему распространению микроорганизмов. Коагуляция фибриногена приводит к закупорке межклеточных пространств фибрином. Тромбируются мелкие кровеносные и лимфатические сосуды, что препятствует диссеминации возбудителя гематогенным и лимфогенным путем. Такая «лимфатическая» блокада способствует задержке возбудителя в очаге воспаления. Для последующего размножения возбудителя неблагоприятные условия создаются также за счет развивающегося местного ацидоза, гипоксии и гипертермии, плохо сказывающихся на метаболизме микроорганизма. В результате кооперативного взаимодействия макрофагов, антител и комплемента происходит уничтожение возбудителя, вызвавшего воспаление.
Лихорадка. Повышение температуры тела в той или иной мере наблюдается, как правило, при всех инфекционных болезнях. Оно также является защитной реакцией организма. Повышение температуры тела способствует ускорению кровотока и усилению обменных процессов в организме. Температура 38 – 40 °C является оптимальной для активации макрофагов, дальнейшее ее повышение уже подавляет фагоцитоз. Вместе с тем повышение температуры оказывает мутагенное действие на микроорганизмы, а у возникающих температурочувствительных мутантов при 38 – 40 °C утрачивается или сильно угнетается способность размножаться. Высокая температура оказывает неблагоприятное действие и на внутриклеточное размножение различных вирусов.
Барьерные функции лимфатических узлов. По образному выражению П. Ф. Здродовского (1969), лимфатические узлы являются «своеобразным биологическим фильтром для возбудителей, переносимых с лимфой». У человека имеется около 1000 лимфатических узлов, размер которых варьирует от булавочной головки до зерна фасоли. Лимфа доставляется к ним по лимфатическим сосудам, которые начинаются межклеточными капиллярами в тканях. Особенно богаты лимфатическими сосудами кожа, а также слизистые оболочки желудочно-кишечного и дыхательного трактов. В случае проникновения через кожу или слизистые оболочки микроорганизмы, как и иные чужеродные частицы, током лимфы заносятся в лимфатические узлы, задерживаются в них и становятся объектом действия макрофагов. Таким образом, лимфатические узлы не просто «фильтруют» лимфу, но и активно удаляют из нее микробов, выполняя важнейшую неспецифическую защитную функцию. Именно в них при некоторых инфекционных болезнях, когда фагоцитоз носит незавершенный характер, раньше всего развивается воспалительный процесс (лимфадениты при туберкулезе, бруцеллезе, брюшном тифе, туляремии, чуме).
Лимфатические узлы в мозговом и особенно в корковом слое содержат большое количество лимфоцитов различной степени зрелости, которые играют важную роль в выработке специфического иммунитета. В этом случае барьерно-фиксирующая роль лимфатических узлов заметно возрастает.
Лимфатические узлы не только захватывают чужеродный материал, они являются местом, где происходит избирательное накопление активированных данным чужеродным веществом клеток, которые участвуют в иммунных реакциях против него. Клетки лимфатических узлов уже на самых ранних стадиях развития иммунной реакции вырабатывают особые медиаторы – факторы иммунных лимфатических узлов. Из костного мозга в периферические лимфатические органы постоянно поступают незрелые клетки мононуклеарной системы макрофагов, где они и осуществляют свои иммунорегулирующие функции с помощью синтезируемых ими особых миелопептидов.
Противомикробные вещества, содержащиеся в тканях и жидкостях организма. Давно установлено, что из тканей и жидкостей организма можно выделить много различных веществ с противомикробной активностью. Нередко эти вещества действуют избирательно. Например, из сыворотки непастеризованного коровьего молока выделен белок лактенин, который оказывает сильное бактерицидное действие на стрептококки группы А, но менее активен в отношении других микроорганизмов.
Лактенин обнаружен в молоке матери. Антимикробным действием обладают также пептиды, выделяемые из тканей. Один из них, с большим содержанием лизина, действует на стафилококки, стрептококки, сибиреязвенную палочку, а некоторые пептиды с большим содержанием аргинина активны против туберкулезной палочки.
Эффективным противомикробным действием обладает тромбоцитарный катионный белок (бетализин). Это пептид, бактерицидная активность которого проявляется путем стимуляции фагоцитоза, опсонизации патогенов, торможения колонизации и снижения персистентных свойств за счет предупреждения адгезии, торможения бактериальной пероксидазы и каталазы (О. В. Бухарин).
Установлено, что жирные кислоты с длинными цепями, накапливающиеся в большом количестве в уплотненной ткани легкого, способствуют быстрому исчезновению пневмококков из очагов поражения. Бактерицидное действие полиаминов спермина и спермидина на туберкулезную палочку проявляется после их активирования спермидиноксидазой.
Не подлежит никакому сомнению, что такие факторы, как доступ О2, содержание СО2, уровень активной реакции среды, наличие и концентрация различных органических кислот и других метаболитов, наличие или отсутствие у клеток рецепторов, с которыми взаимодействуют бактерии и вирусы, создают своеобразные условия и таким образом оказывают существенное влияние на выживаемость различных возбудителей в тканях организма. Например, вирус гриппа может взаимодействовать лишь с теми клетками, которые имеют на своей поверхности мукопептидные рецепторы. В свою очередь вещества мукоидной природы, содержащиеся в сыворотке крови, связывают вирус гриппа и являются его неспецифическими ингибиторами.
Функции выделительной системы. К числу неспецифических защитных механизмов организма следует отнести также и функции выделительных систем. Освобождение организма от микробов, продуктов их жизнедеятельности и токсинов происходит с помощью желудочно-кишечного тракта, мочевыводящих путей, потовых желез, дыхательной и других систем. Типичным примером такого рода неспецифической защитной реакции является рвота, часто наблюдаемая как при бактериальных, так и небактериальных кишечных отравлениях.
При попадании в организм достаточно больших доз микробов или их токсинов нормальная физиологическая деятельность, т. е. реактивность многих органов, в том числе выделительных систем, в результате воздействия микробных антигенов на рецепторы тканей изменяется. Учащается дыхание, изменяется кровообращение, расширяются кровеносные сосуды и реализуется ряд других реакций, направленных на освобождение организма от возбудителей и нейтрализацию их вредного воздействия.
Из всего вышеизложенного следует, что в организме имеется большое количество неспецифических приспособлений, которые обеспечивают определенную степень его резистентности к различным микроорганизмам. Однако главными биологическими высокоспециализированными системами, обеспечивающими видовой иммунитет, являются системы макрофагов, комплемента, интерферонов, Т-цитотоксических лимфоцитов и главная система гистосовместимости. Поэтому неспецифическую резистентность правильнее определять как видовой иммунитет, поскольку эта резистентность определяется в первую очередь специализированными иммунологическими системами.
Система макрофагов и формирование видового иммунитета
Одним из мощных факторов резистентности является фагоцитоз. И. И. Мечников установил, что фагоцитарными свойствами обладают зернистые лейкоциты крови и лимфы, главным образом полиморфно-ядерные нейтрофилы (микрофаги), а также моноциты и различные клетки ретикулоэндотелиальной системы, которые он назвал макрофагами. В настоящее время под макрофагами понимают клетки, которые обладают высокой фагоцитарной активностью. Они различаются по форме и размерам, в зависимости от тканей, где они обнаруживаются. По классификации ВОЗ (1972), все макрофаги объединены в систему мононуклеарных фагоцитов (табл. 8).
К этой системе относятся клетки, которые имеют костно-мозговое происхождение, обладают активной подвижностью, способны осуществлять фагоцитоз и прилипают к стеклу. Образование макрофагов происходит через следующие этапы: стволовая клетка → монобласт → промоноцит → моноцит костного мозга → моноцит периферической крови → тканевой макрофаг. В кровь из костного мозга клетки поступают на стадии промоноцитов и моноцитов и циркулируют в ней около 36 ч.
Таблица 8
Система мононуклеарных фагоцитов (СМФ)

Процесс фагоцитоза складывается из следующих этапов: продвижение фагоцита к объекту фагоцитоза, например к бактериальной клетке; прилипание бактерии к фагоциту; поглощение бактериальной клетки; исход фагоцитоза. Энергия, необходимая для поглощения макрофагами чужеродных частиц, обеспечивается благодаря гликолизу. Агенты, угнетающие гликолиз, резко подавляют фагоцитоз. Возможны три исхода фагоцитоза: 1) полное внутриклеточное переваривание микробных клеток – завершенный фагоцитоз; 2) приживление и активное размножение бактерий внутри фагоцита – незавершенный фагоцитоз (рис. 60); 3) выталкивание микробов из фагоцитов обратно в окружающую среду. Незавершенный фагоцитоз часто наблюдается при вяло и длительно протекающих инфекционных болезнях и служит одной из причин хрониосепсиса. Еще И. И. Мечниковым было установлено, что во время фагоцитоза происходит резкий сдвиг рН внутри фагоцита в кислую сторону, вероятно, вследствие гликолиза. Предполагалось, что ацидоз и является непосредственной причиной гибели фагоцитированных микробов, а их переваривание осуществляется под влиянием ферментов цитоплазмы. Однако в последующем было выяснено, что механизм уничтожения фагоцитированных бактерий (бактерицидного действия фагоцитов) заключается в следующем.
В процессе фагоцитоза происходит «дыхательный», или «окислительный», взрыв, который приводит к образованию активных форм кислорода: супероксидного аниона (O2-), перекиси водорода (H2O2) и радикала гидроксила (OH-), которые и обусловливают бактерицидный эффект. Убитые клетки далее подвергаются действию ферментов лизосом.

Рис. 60. Незавершенный фагоцитоз.
Neisseria gonorrhoeae
Макрофагам принадлежит исключительно важная роль в обеспечении защитных реакций. Основные функции, посредством которых они выполняют эту роль, могут быть разделены на четыре типа:
1. Хемотаксис.
2. Фагоцитоз.
3. Секреция биологически активных соединений.
4. Переработка антигена (процессинг) и представление его с участием белков MHC класса II иммунокомпетентным клеткам, принимающим участие в формировании иммунного ответа (кратко – процессинг и представление, или презентация антигена).
Таким образом, фагоцитоз – это не просто уничтожение чужеродного объекта, но и представление антигена для запуска цепи иммунных реакций, приводящих к формированию иммунитета. Функция фагоцитоза является центральной, поскольку она запускает секрецию обширного круга биологически активных веществ широкого спектра действия, в том числе медиаторов иммунного ответа, реакции воспаления, а также обеспечивает процессинг и представление антигена. Для осуществления своих функций макрофаги подвергаются активации. Она представляет собой серию взаимосвязанных структурных и биохимических изменений, результатом которых является повышение активности макрофагов, в частности готовность их к осуществлению «окислительного взрыва» и мобилизации других функций. «Окислительный взрыв» осуществляется при участии мембраносвязанных комплексов НАДФН-оксидаз, которые накапливаются во время прайминга (промежуточная стадия активации) и находятся в потенциально активном состоянии. При следующей за праймингом стимуляции эта система активируется и вызывает «окислительный взрыв». Активированные макрофаги синтезируют и секретируют целый комплекс биологически активных соединений (более 50), не имея себе равных среди других типов клеток организма. Среди секретируемых макрофагами веществ особенно важную роль играют простагландины (англ. prostate gland – предстательная железа, из ткани которой они были впервые выделены) – продукты превращения С20-три-, С20-тетра– и С20-пентаеновых жирных кислот, входящих в состав внутриклеточных фосфоацилглицеролов. Фагоцитоз стимулирует синтез и секрецию различных простагландинов: ПГ-Е1, ПГ-Е2, ПГ-Ф2α, в меньшем количестве ПГ-Д2 и пр. Наиболее активным является ПГ-Е2. Секретируемые макрофагами продукты, особенно простагландины, с одной стороны, выступают в роли медиаторов воспаления и иммунного ответа, а с другой – контролируют активность самих макрофагов по типу положительной и отрицательной обратной связи, благодаря чему осуществляется тонкая саморегуляция системы макрофагов. Макрофаги синтезируют также некоторые компоненты системы комплемента: C1q, C2, C3, C4, C5, факторы B, D, F, ингибиторы – факторы I, H; CI-инактиватор. Следовательно, между макрофагами и системой комплемента существуют взаимосвязь и взаимодействие.
Принято различать следующие формы макрофагов:
1) резидентные макрофаги – популяция макрофагов в определенных анатомических областях без какой-либо индукции (еще не активированные);
2) макрофаги воспалительного экссудата – клетки из пула моноцитов крови, мобилизованные (рекрутированные) к очагу воспаления;
3) индуцированные макрофаги – клетки, мобилизованные под влиянием экспериментального воздействия с целью изучения фагоцитарных свойств;
4) активированные макрофаги – клетки, готовые в полной мере осуществлять свои функции в иммунном процессе.
Условно различают два пути стимуляции макрофагов: первый опосредуется факторами иммунного ответа – антителами, различными цитокинами, комплементом и иными; второй – микробными и другими чужеродными агентами, а также продуктами распада клеток, ткани и т. п. Макрофаги активируются с помощью имеющегося на их мембране большого количества рецепторов для разных стимуляторов. Активированные макрофаги увеличиваются в размерах, обогащаются лизосомами, у них усиливаются адгезивные свойства. Одним из характерных признаков активированных макрофагов является их способность синтезировать фактор некроза опухолей (ФНО). К числу функций макрофагов следует отнести также их способность регулировать рост и пролиферацию нормальных и трансформируемых клеток. Проявление этой функции зависит от степени активации макрофагов, спектров секретируемых ими продуктов и ряда других обстоятельств.
Помимо клеток СМФ способностью к фагоцитозу (а также к процессингу и представлению антигена) обладают нейтрофилы. Сегментированную структуру их ядра и краткость жизни объясняют тем, что у них включена одна из программ апоптоза. Нейтрофилы в своих гранулах синтезируют, а затем секретируют широкий набор биологически активных веществ, с помощью которых взаимодействуют с клетками иммунной системы, в том числе с макрофагами, а они, с помощью цитокинов, – с нейтрофилами. Одним из самых важных для них является ИЛ-8. Он вызывает у нейтрофилов дегрануляцию, «окислительный взрыв» при фагоцитозе и другие реакции. Функции нейтрофилов тесно связаны с регуляцией тканевого метаболизма и с каскадом воспалительных реакций.
Система макрофагов – один из главных защитных механизмов не только естественной резистентности (видового иммунитета), но и приобретенного иммунитета. Подвергая процессингу антиген и представляя его другим иммунокомпетентным клеткам, макрофаги индуцируют синтез специфических антител и клеток иммунной памяти. Синтезированные антитела, взаимодействуя с данным антигеном, делают его более доступным и для системы комплемента, и для самих макрофагов. Их фагоцитоз становится более эффективным, антигенспецифичным; активность макрофагов стимулируется антителами против определенного возбудителя, и видовой иммунитет дополняется приобретенным.
Система комплемента и формирование видового иммунитета
Свежая сыворотка крови, как это было установлено Г. Наталлом в 1888 г., обладает отчетливой бактерицидной активностью в отношении многих видов бактерий. Бактерицидный эффект зависит от наличия в ней ряда веществ, но главным образом от присутствия антител и особенно фактора, содержание которого, в отличие от антител, не связано со специфическим иммунным ответом, а его количество в крови не увеличивается при иммунизации. Ж. Борде назвал этот фактор алексином (лат. alexo – защищаю), а П. Эрлих – комплементом (лат. complementum – дополнение). Последнее название сейчас стало общепринятым. Комплемент является нормальной составной частью сыворотки крови. Он обладает относительно слабой видовой специфичностью, его активность у различных животных варьирует и является функцией количественного содержания различных компонентов системы комплемента в данной сыворотке.
Изучение природы и механизма действия комплемента показало, что он состоит из различных белковых компонентов, отличающихся друг от друга по ряду признаков. В связи с этим, термином «комплемент» обозначают целый комплекс иммунной системы. Комплемент – большая группа взаимодействующих между собой белков и гликопротеидов сыворотки крови, имеющихся у всех позвоночных. На их долю приходится около 10 % общего количества белков сыворотки. Компоненты системы комплемента опосредуют процессы воспаления, опсонизируют чужеродные материалы для их последующего фагоцитоза и участвуют наряду с макрофагами в непосредственном уничтожении микроорганизмов и различных других клеток. Системы макрофагов и комплемента тесно взаимодействуют между собой и с другими компонентами иммунной системы. Комплемент представляет собой особую многокомпонентную систему, которая активируется с помощью механизмов ограниченного протеолиза. К настоящему времени обнаружены и изучены следующие факторы этой системы.
1. Девять белков, составляющих собственно комплемент и обозначаемых поэтому буквой С: С1…С9, причем С1-компонент состоит из трех белковых субъединиц (C1q, C1r, C1s), все остальные представляют собой единичные белковые молекулы. В составе молекулы C1q имеется рецептор для связывания с Fc-фрагментом молекулы антитела. Антитела, относящиеся к иммуноглобулинам различных классов, взаимодействуют с комплементами с различной степенью активности. Белки С5, С6, С7, С8 и С9 участвуют в организации мембрано-атакующего комплекса.
2. Регуляторные белки: С1Е1, C4bp, фактор Н (глобулин β1Н), фактор I (инактиватор C3b/C4b), белок S.
3. Факторы, участвующие в альтернативном пути активации системы комплемента: фактор В (протеиназа), фактор D (гликопротеин), фактор Р (пропердин) – γ-глобулин, его обнаружил в 1954 г. Л. Пиллемер. Этот белок, образуя комплекс с эндотоксином, в присутствии ионов Mg2+ разрушает С3, поэтому был назван пропердином (лат. pro и perdere – подготовлять разрушение). Пропердин стабилизирует С3-конвертазу альтернативного пути. Характеристика основных компонентов системы комплемента дана в табл. 9.
Ни одна другая система крови, пожалуй, не имеет такого разнообразия специфических рецепторов, активаторов и ингибиторов, как система комплемента. Наличие такого рецепторного аппарата, а также мембранных и внемембранных активаторов и регуляторов активности позволяет этой системе осуществлять гибкое взаимодействие клеточных и гуморальных факторов, от которых зависит проявление активности всей системы комплемента. Известны три пути активации системы комплемента: классический, альтернативный и с использованием механизма С1-шунта.
Классический путь активации реализуется при наличии в организме антител к данному антигену. Однако связывать С1 и инициировать классический путь могут не все классы антител. Такой способностью обладают антитела классов IgG и IgM, а антитела классов IgE, IgD и IgA – нет. Более того, при некоторых обстоятельствах антитела класса IgA могут подавлять активацию комплемента антителами IgG. С образовавшимся комплексом антиген + антитело взаимодействует компонент C1q. Присоединение антигена к активному центру молекулы антитела меняет конформацию иммуноглобулина, и его рецептор на Fc-фрагменте становится доступным для связывания с C1q. Таким образом, в присутствии ионов Ca2+ возникает комплекс антиген + антитело + С1. Он взаимодействует вначале с компонентом C4, а затем в присутствии ионов Mg2+ к нему присоединяется компонент С2, и образуется сложный комплекс антиген + антитело + С1С4С2.
Таблица 9
Характеристика основных компонентов системы комплемента
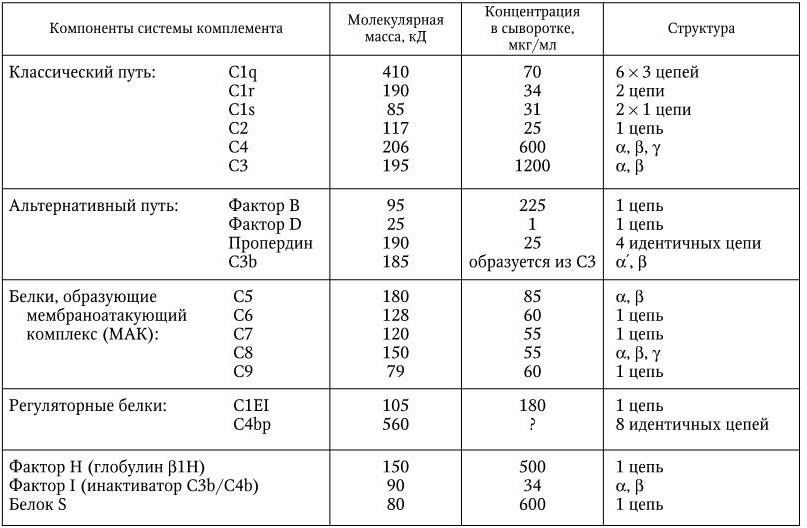
Одним из центральных событий активации системы комплемента является присоединение компонента С3, после которого весь этот комплекс приобретает способность прилипать к различным частицам и клеткам, в том числе к эритроцитам и фагоцитам (эффект иммунного прилипания). Чужеродное вещество под влиянием этого комплекса опсонизируется, т. е. подвергается более активному фагоцитозу и цитотоксическому действию. Однако для их проявления требуется присоединение остальных компонентов комплемента.
Участие комплемента в защите от микроорганизмов вовлекает по крайней мере три различных механизма: лизис бактерий, активацию всего аппарата макрофагов и воспаление. Лизис бактерий происходит после присоединения к комплексу антиген + + антитело + С1С4С2С3 остальных компонентов (C5, C6, C7, C8 и C9): компонент С5 расщепляется особым белком на компоненты С5a и С5b. Компонент C5a участвует в формировании воспалительного процесса, а компонент C5b инициирует образование мембрано-атакующего комплекса (МАК): C5bC6C7C8C9. Согласно общепринятому мнению, этот комплекс погружается в двойной липидный слой мембраны и формирует канал, по которому в клетку проникает вода, макромолекулярные компоненты клетки выходить по нему не могут, клетка набухает и лопается.
В инициации воспаления и активации фагоцитоза участвуют другие компоненты системы комплемента. Особый белок С3-конвертаза расщепляет С3 на два биологически активных фрагмента – C3a и С3b. Фиксация C3b на бактериальной клетке обусловливает эффект иммунного прилипания. Фагоциты прикрепляются к клетке в области, покрытой C3b, и, выделяя гидролитические ферменты, убивают и фагоцитируют бактериальную клетку, если она не подвергается лизису. В свою очередь С3а и фрагменты других компонентов, освобождающиеся в процессе активации комплемента, вызывают хемотаксис фагоцитов. Воздействуя на мастоциты, эффекторы комплемента вызывают освобождение гистамина, серотонина и других биологически активных веществ, что приводит к развитию очага воспаления.
Альтернативный путь активации системы комплемента реализуется, когда еще нет антител к данному антигену, т. е. при первичном контакте с возбудителем. Cчитается, что в инициации и контроле активации по альтернативному пути участвуют не менее 6 белков: фактор В, фактор D, пропердин, а также регуляторные белки – фактор Н и фактор I и компонент С3, который играет центральную роль в обоих путях активации.
Альтернативный путь индуцируется ЛПС и любыми другими микробными антигенами (вирусными, бактериальными, антигенами грибов, простейших и т. п.). В этом случае не участвуют компоненты С1, С4, С2, и другая конвертаза расщепляет С3 на его субкомпоненты C3a и C3b. На этом уровне и происходит смыкание альтернативного пути активации комплемента с классическим (рис. 61).
Существует и третий механизм активации комплемента. Он обнаружен при исследовании сыворотки свиней, дефицитных по С4-компоненту. Этот путь не связан с образованием С3-конвертазы, но для инициации каскада последовательных реакций необходима активация С1. Поэтому механизм этот, пока еще мало изученный, был назван механизмом С1-шунта. Таким образом, система комплемента выполняет следующие функции:
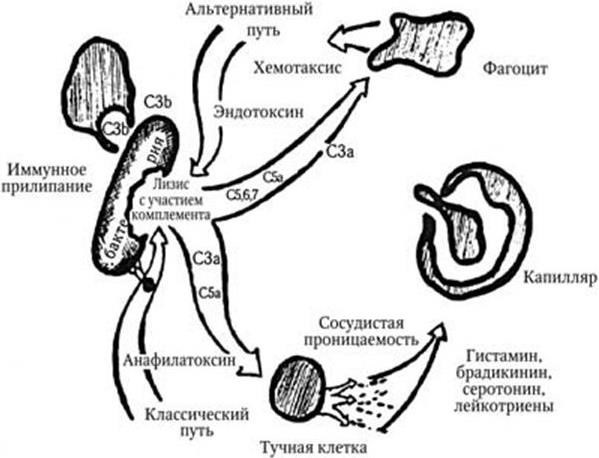
Рис. 61. Схема классического и альтернативного путей активации комплемента
1. Лизис чужеродных клеток, включая бактерии.
2. Опсонизация чужеродных клеток, включая бактерии, которые становятся более доступными для макрофагов благодаря феномену иммунного прилипания (он обусловлен фиксацией на клетках С3b, в меньшей степени – C4b, C5b, C3bi (один из продуктов расщепления фактора С3), C2-компонентов и фрагментов комплемента).
3. Стимуляция хемотаксиса (она обусловлена действием C5a, в меньшей степени – С3b, фрагмента Ва (продукта расщепления фактора В), комплекса С5b, С6, С7).
4. Стимуляция фагоцитоза – обусловлена присоединением к иммунному комплексу C1q или C3b.
5. Повышение сосудистой проницаемости (C5a, C3а).
6. Стимуляция анафилотоксинами (С5а, С3a) внутриклеточных процессов, в результате которых из мастоцитов выбрасываются биологически активные соединения (гистамин, брадикинин, серотонин, лейкотриены и т. п.), которые обусловливают развитие воспаления.
Лизоцим усиливает антибактериальную активность комплекса антитело – комплемент. При взаимодействии антител и комплемента образуется сферопласт, а затем лизоцим его лизирует (разрушает оставшуюся часть пептидогликана).
Взаимосвязь системы комплемента и макрофагов проявляется и в том, что многие компоненты и регуляторы системы комплемента синтезируются макрофагами: С1q, C2, C4, C5, факторы B, D, P, ингибиторные факторы I, H, C1-инактиватор (гены С2, С4 и фактора В связаны с седьмым локусом главной системы гистосовместимости).
Иные механизмы видового иммунитета
Давно было подмечено, что если ввести в организм два вируса одновременно или с интервалом не более 24 ч, между ними наблюдается какое-то взаимодействие, проявляющееся во взаимном угнетении (интерференция). В 1957 г. Л. Айзекс и Дж. Линдеман обнаружили, что явление интерференции связано с образованием в клетках, которые были заражены вирусом, особого белка – интерферона. Установлено, что существует не один интерферон, а целая система их, в которой выделены три основных типа. Интерфероны, синтезируемые в клетках человека, различаются по своим физико-химическим свойствам; рецепторам, с помощью которых они взаимодействуют с клетками; кислоточувствительности; антигенной специфичности. Современная номенклатура интерферонов такова.
Номенклатура интерферонов
(разработана специальной комиссией ВОЗ в 1980 г.):
• Новое обозначение:
1) IFN-α; 2) IFN-β; 3) IFN-γ.
• Старое обозначение:
1) тип I (лейкоцитарный), pH 2,0 – стабильный, индуцируемый чужеродными клетками;
2) тип II (фибробластный), pH 2,0 – стабильный;
3) тип III (иммунный), pH 2,0 – лабильный, индуцируемый антигенами и митогенами.
По своей химической природе интерфероны являются гликопротеидами. Каждый из трех типов интерферонов (α, β, γ) разделяют на подтипы. Например, тип (семейство) α-интерферона включает около 20 подтипов, различающихся по биологическим свойствам и структуре. Среди них обнаружены и такие подтипы, которые утрачивают свою активность при рН 2,0, т. е. кислотолабильные. Множественность и структурная гетерогенность интерферонов, очевидно, отражают их функциональную гетерогенность, а также способность синтезироваться под влиянием различных индукторов. Молекулярная масса интерферонов варьирует от 17 до 45 кД у α– и β-интерферонов и от 20 до 80 кД у γ-интерферона; γ-интерферон продуцируют Т-лимфоциты, натуральные, или природные, киллеры, активированные макрофаги. В свою очередь он стимулирует образование молекул МНС класса II, является кофактором дифференцировки и активации В-лимфоцитов и антагонистом действия на них интерлейкина-4. Гены, контролирующие синтез интерферонов у человека, локализованы на 2, 5 и 9-й хромосомах.
В соответствии с гипотезой об индукции интерферона предполагается, что в клетках его синтез блокирован репрессором. При контакте клетки с индуктором, например вирусом, репрессор связывается, что приводит к активации оперона, контролирующего образование интерферона. Затем происходит транскрипция мРНК для интерферона и ее трансляция. Оперон для α-интерферона содержит до 12 структурных генов. Противовирусное действие интерферонов проявляется в их способности подавлять внутриклеточное размножение широкого круга ДНК– и РНК-вирусов. Интерферон не взаимодействует непосредственно с вирусом, он не препятствует адсорбции вируса на клетке и его проникновению в клетку. Антивирусное действие интерферонов не связано с синтезом какого-то нового белка, а проявляется в повышении активности ряда ключевых ферментов клеточного обмена веществ (рис. 62). Один из возможных механизмов антивирусной активности интерферона заключается в том, что он увеличивает продукцию протеинкиназы, которая фосфорилирует один из факторов инициации трансляции и ингибирует синтез белка. Другой механизм сводится к тому, что под влиянием интерферона накапливается олигоаденилатсинтетаза, приводящая к образованию 2,5-олигоадениловой кислоты. Последняя активирует клеточную эндонуклеазу, которая разрушает молекулы РНК, в том числе и мРНК. Так или иначе, под влиянием интерферона блокируется синтез вирусных макромолекул. Повидимому, в зависимости от типа рецепторов клетки, особенностей самих клеток и типов интерферонов, последние реализуют свое воздействие через активацию синтеза разных ферментных систем. Индукция синтеза интерферона происходит под воздействием самых различных факторов: ДНК– и РНК-содержащих вирусов, бактерий, риккетсий, простейших, различных микробных антигенов, а также различных синтетических соединений. Наиболее характерные черты биологического действия интерферона следующие:
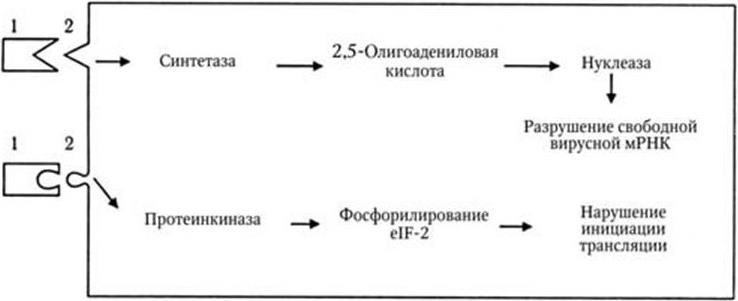
Рис. 62. Механизм действия интерферона (по А. Г. Букринской, 1986):
1 – интерферон; 2 – клеточный рецептор
1) универсальность – интерферон активен против широкого круга вирусов;
2) выраженная тканевая специфичность – он активен в гомологичных системах и практически не активен в гетерогенных тканях (поэтому для лечения человека можно использовать только интерферон человеческого происхождения), биологическая активность интерферона определяется его полипептидом, а тканеспецифичность – углеводным компонентом;
3) наличие эффекта последействия – даже после отмывания интерферона в клетках длительное время сохраняется способность подавлять размножение вирусов;
4) отсутствие какого-либо токсического эффекта – обработка интерфероном клеток не нарушает их нормальной жизнедеятельности;
5) высокая эффективность действия – даже небольшое количество интерферона (несколько десятков молекул) обладает противовирусной активностью.
Интерфероны обладают не только противовирусным, но и противобактериальным (более сильным против грамположительных бактерий и хламидий и менее сильным против других грамотрицательных бактерий) и противоопухолевым действием. Такое их действие связано прежде всего с тем, что интерфероны – мощные иммуномодуляторы. Они стимулируют гуморальный иммунитет, усиливая антителообразование, восстанавливают соотношение T-хелперы/T-супрессоры, уменьшают степень иммунодепрессии, стимулируют фагоцитоз, активность цитокинов, всех киллерных клеток и T-цитотоксических лимфоцитов и т. д. В основе такой широкой активности интерферонов лежит их способность включаться в различные метаболические процессы и регулировать их, поэтому систему интерферонов следует рассматривать как неотъемлемую составную часть общей иммунной системы. Синтез молекул интерферонов – первый ответ на получение клетками неспецифического сигнала о появлении чужеродных антигенов. Включаясь в регуляцию метаболических процессов в клетках, тканях и органах, интерфероны обеспечивают поддержание гомеостаза на всех уровнях организации от клетки до целостного организма. В связи с этим для стимуляции синтеза эндогенных интерферонов и усиления их иммуномодулирующего действия в практику лечения и профилактики вирусных и других инфекционных заболеваний, особенно таких, при которых возбудитель оказывает негативное действие на систему интерферонов, помимо собственно интерферонов все шире внедряются различные синтетические стимуляторы интерферонообразования.
Два таких препарата успешно используются: амиксин и арбидол. Амиксин – первый пероральный синтетический низкомолекулярный индуктор эндогенного интерферона. Его применяют по специальным схемам для профилактики и лечения гриппа и других острых респираторных вирусных инфекций (ОРВИ), герпетических, цитомегаловирусных и нейровирусных заболеваний, энтеральных (A, E) и парентеральных вирусных гепатитов (B, C, D, E, G, TTV) и хламидиозов. Амиксин нетоксичен и хорошо совместим с антибиотиками и средствами традиционного лечения вирусных и бактериальных болезней. Арбидол помимо интерферониндуцирующего и иммуномодулирующего обладает и прямым антивирусным действием. Он применяется для профилактики и лечения гриппа и ОРВИ у взрослых и детей по специальным схемам.
Помимо систем макрофагов, комплемента и интерферонов, в обеспечении видового иммунитета исключительно важная роль принадлежит Т-цитотоксическим лимфоцитам, а также главной системе гистосовместимости (см. соответствующие разделы).
Роль Т-цитотоксических лимфоцитов, или Т-киллеров, заключается в том, что они по представлению антигенов главной системы гистосовместимости класса I распознают любые чужеродные антигены, например вирусные, а также собственные мутантные клетки, например раковые, атакуют и уничтожают их.
Кроме Т-цитотоксических лимфоцитов, киллерными функциями обладают обнаруженные в 1976 г. в лимфоидной ткани природные, или естественные, киллеры – клетки NK (англ. natural killer – природный убийца). Они найдены в лимфоидной ткани животных всех изученных видов, кроме кошек. Хотя NK относятся к лимфоцитам, они не обладают свойствами ни зрелых В-, ни зрелых Т-лимфоцитов и имеют свойственные только им маркеры; происходят они из клеток-предшественников костного мозга. В отличие от Т-цитотоксических лимфоцитов киллерная активность NK не зависит от представления им чужеродных антигенов молекулами МНС класса I. NK способны распознавать и лизировать различные варианты опухолевых клеток. В этом заключается важная роль их в поддержании генетического гомеостаза.
Цитотоксическим фактором природных киллеров является особый белок, который по физико-химическим и иммунологическим свойствам напоминает белок перфорин из цитолитических гранул. Этот белок в присутствии ионов Ca2+ способен быстро полимеризоваться. Образующиеся субъединицы белка встраиваются в мембрану клетки, формируя в ней канал с малым диаметром. Через канал в клетку проникает вода, клетка разбухает и лизируется.
Таким образом, если естественная резистентность организма во многом определяется состоянием его различных анатомо-физиологических механизмов, перечисленных выше, то видовой иммунитет – функция высокоспециализированных иммунных систем. В результате хорошо координированного взаимодействия систем макрофагов, комплемента, интерферонов, главной системы гистосовместимости, Т-цитотоксических лимфоцитов и природных киллеров еще до приобретения специфического иммунитета обеспечивается своевременное распознавание и уничтожение всех генетически чужеродных веществ и существ (микроорганизмов и мутантных клеток), благодаря чему и сохраняется структурная и функциональная целостность организма. Вместе с тем иммунные системы служат основой для формирования приобретенного (специфического) иммунитета, и на их уровне видовой и приобретенный иммунитет стыкуются, образуя единую и наиболее эффективную систему самозащиты организма.
Основные биологические механизмы самозащиты генома клетки
Иммунитет существует не только на уровне целостного организма, но и на уровне клетки. Здесь он направлен на защиту самого ценного, что имеется в клетке, – ее генома и опосредуется самим геномом.
Одним из самых удивительных свойств генетической системы является ее способность к самозащите (иммунитету), реализуемая с помощью специальных биологических механизмов, обеспечивающих необходимую для существования и эволюции живой материи стабильность генетической информации и высокую надежность ее функционирования.
Действие этих механизмов проявляется как в особых реакциях, посредством которых осуществляется самоисправление различных нарушений в структуре ДНК (приводящих либо к извращению смысла генетической информации, либо к структурным повреждениям, имеющим летальные последствия), так и в реакциях, ведущих к исключению возможности функционирования в клетке чужеродного генома. В соответствии с этим, известные биологические механизмы самозащиты генома клетки можно разбить на следующие основные группы:
1) механизмы ревизии, позволяющие исключить из вновь синтезируемой ДНК ошибочно включенные нуклеотиды; благодаря этому механизму возможность включения ошибочного нуклеотида сводится к минимуму;
2) механизмы супрессии, или исправления нарушенного смысла генетического кода;
3) механизмы репараций, или самоисправлений структурных повреждений в ДНК;
4) механизмы модификации и ограничения (рестрикции), контролируемые хозяином;
5) механизмы подавления репродукции в клетке чужеродного генома;
6) механизмы подавления выражения информации чужеродного генома, интегрированного в геном клетки-хозяина.
Механизмы ревизии, или самокоррекции, осуществляются ДНК-полимеразой. Она способна устранять свои собственные ошибки, которые могут возникать в процессе репликации ДНК, обнаруживать и удалять неправильные пары и замещать их правильными. Благодаря такой саморевизии и самокоррекции обеспечивается необычайно высокая точность копирования при репликации ДНК. В среднем на каждые 1 · 109 комплементарных пар, образующихся при воспроизведении генома млекопитающего, состоящего из 3 · 109 пар оснований, происходит одна ошибка.
Супрессии, или супрессорные мутации, – это мутации, ведущие к восстановлению исходного фенотипа мутантной клетки. В основе супрессии лежат так называемые обратные мутации: восстановление исходного фенотипа происходит не в результате восстановления первоначального состояния самого мутантного гена, а вследствие дополнительных мутаций в том же или в других генах, которые и приводят к восстановлению исходного фенотипа.
Репарация ДНК основана на том, что генетическая информация в ДНК продублирована двумя копиями – по одной копии в каждой из двух цепей молекулы ДНК. Благодаря этому случайное повреждение в одной из цепей может быть удалено репарационными ферментами, и данный участок цепи заново синтезирован в своем нормальном виде за счет информации, которая содержится в неповрежденной цепи. Процессы репарации осуществляются с помощью особых наборов ферментов: ДНКполимераз, ДНК-лигаз или ДНК-гликозилаз.
Кроме явлений саморепликации, репарации и процессов, с помощью которых устраняются различные нарушения в структуре самого генома или исправляются нарушения информации, для его самозащиты клетка использует и другие биологические механизмы, направленные главным образом на исключение возможности конкурентного функционирования проникающего в него чужеродного генома. С помощью этих механизмов осуществляется либо избирательное разрушение чужеродного генома и таким образом исключается возможность его интеграции в геном клеткихозяина, либо предотвращается его репродукция в клетке, либо подавляется выражение содержащейся в нем информации, даже если он интегрировался в геном клетки-хозяина. К таким механизмам относятся, в частности, механизмы ограничения и модификации и система интерферонов.
Механизмы модификации и ограничения, контролируемые клеткой-хозяином, описаны у различных видов бактерий. Они связаны с активностью двух взаимодополняющих ферментных систем, одна из которых осуществляет специфическую модификацию «своей» ДНК (благодаря чему она и распознается ферментами ограничения как «своя» ДНК), а другая – система ограничения (рестрикции) – разрушает неприемлемую ДНК, если она не прошла соответствующей модификации, т. е. является «чужой» и должна быть разрушена.
О существовании в клетке специальных биологических систем, подавляющих репродукцию чужеродного генома, свидетельствует наличие белков-интерферонов. Хотя прямых доказательств существования систем, подавляющих выражение информации чужеродного генома, интегрированного в геном клетки-хозяина, еще не представлено, однако существует целый ряд косвенных данных, которые делают такое предположение весьма правдоподобным. Поскольку состояние лизогении (внедрение фагового генома в хромосому бактериальной клетки) или вирогении (внедрение вирусного генома в геном животной клетки) далеко не всегда проявляется фенотипически (вирус иммунодефицита человека может находиться в неактивном состоянии в течение ряда месяцев или лет), то правомерно предположить, что выражение чужеродной генетической информации каким-то образом временно или постоянно блокируется. Вместе с тем лизогения создает прочный иммунитет против суперинфекции данным фагом, т. е. обеспечивает специфический иммунитет против него. Таким же образом привнесенная в бактериальную клетку плазмида обеспечивает ей защиту против повторного заражения данной плазмидой. Так у бактерий возникает своеобразный иммунитет против чужеродных геномов.
Приобретенный иммунитет. Антигены
Приобретенный иммунитет отличается от видового следующими особенностями. Во-первых, он не передается по наследству. По наследству передается лишь информация об органе иммунитета, а сам иммунитет формируется в процессе индивидуальной жизни в результате взаимодействия с соответствующими возбудителями или их антигенами.
Во-вторых, приобретенный иммунитет является строго специфическим, т. е. всегда направлен против конкретного возбудителя или антигена. Один и тот же организм в течение своей жизни может приобретать невосприимчивость ко многим болезням, но в каждом случае формирование иммунитета связано с появлением специфических эффекторов против данного возбудителя.
Иммунологическая функция, как и всякая другая функция организма, связана с деятельностью определенной специализированной системы клеток и тканей. Органом иммунитета является лимфоидная система. Особенность ее состоит в том, что она существует не в виде единого дискретного анатомического образования, а расселена по всему телу, чтобы во всех его участках осуществлять свою защитную функцию. Кроме того, иммунной системе присущи еще две особенности:
1) ее клетки постоянно рециркулируют через лимфу и кровоток по всему организму, осуществляя иммунологический надзор;
2) она обладает способностью отвечать уникальными реакциями на попадание в организм антигена.
Совокупность всех лимфоидных органов и тканей организма (тимус, селезенка, лимфатические узлы, пейеровы бляшки и другие лимфоидные скопления, лимфоциты костного мозга и периферической крови) представляет единый орган иммунитета. Общий вес лимфоидной системы у человека около 1,5 – 2 кг, количество лимфоидных клеток составляет 1012.
Приобретенный иммунитет обеспечивается теми же самыми иммунными системами, которые осуществляют видовой иммунитет, но их активность и целенаправленность действия во много раз усиливаются благодаря синтезу специфических антител. Формирование приобретенного специфического иммунитета происходит благодаря кооперативному взаимодействию макрофагов (и других антигенпредставляющих клеток), В– и Т-лимфоцитов и при активном участии всех остальных иммунных систем.
Формы приобретенного иммунитета
В зависимости от механизма образования приобретенный иммунитет подразделяется на искусственный и естественный, а каждый из них в свою очередь – на активный и пассивный. Естественный активный иммунитет возникает вследствие перенесения заболевания в той или иной форме, в том числе легкой и скрытой. Такой иммунитет называется также постинфекционным. Естественный пассивный иммунитет создается в результате передачи ребенку от матери антител через плаценту и грудное молоко. Организм ребенка в этом случае сам не участвует в активной выработке антител. Искусственный активный иммунитет – иммунитет, образующийся в результате прививок вакцинами, т. е. поствакцинальный. Искусственный пассивный иммунитет обусловлен введением иммунных сывороток или препаратов гамма-глобулина, содержащих соответствующие антитела.
Активно приобретенный иммунитет, особенно постинфекционный, устанавливается спустя некоторое время после заболевания или прививки (1 – 2 нед.), сохраняется долго – годами, десятилетиями, иногда пожизненно (корь, оспа, туляремия). Пассивный иммунитет создается очень быстро, сразу после введения иммунной сыворотки, но зато сохраняется очень недолго (несколько недель) и снижается по мере исчезновения введенных в организм антител. Продолжительность естественного пассивного иммунитета новорожденных также невелика: к 6 мес. он обычно исчезает, и дети становятся восприимчивы ко многим болезням (корь, дифтерия, скарлатина и др.).
Постинфекционный иммунитет в свою очередь подразделяют на нестерильный (иммунитет при наличии возбудителя в организме) и стерильный (возбудителя в организме нет). Различают иммунитет антимикробный (иммунные реакции направлены против возбудителя), антитоксический, общий и местный. Под местным иммунитетом понимают возникновение специфической резистентности к возбудителю в той ткани, где он обычно локализуется. Учение о местном иммунитете было создано учеником И. И. Мечникова А. М. Безредкой. Долгое время природа местного иммунитета оставалась неясной. Теперь полагают, что местный иммунитет слизистых оболочек обусловлен особым классом иммуноглобулинов (IgAs). Благодаря наличию в них дополнительного секреторного компонента (s), который вырабатывается эпителиальными клетками и прикрепляется к молекулам IgA при прохождении их через слизистую оболочку, такие антитела оказываются устойчивыми к действию ферментов, содержащихся в секретах слизистых оболочек.
Приобретенный иммунитет во всех формах чаще всего является относительным и, несмотря на значительную в некоторых случаях напряженность, может быть преодолен большими дозами возбудителя, хотя течение болезни будет при этом значительно легче. На продолжительность и напряженность приобретенного иммунитета большое влияние оказывают также социально-экономические условия жизни людей.
Между видовым и приобретенным иммунитетом существует тесная взаимосвязь. Приобретенный иммунитет формируется на базе видового и дополняет его более специфическими реакциями.
Как известно, инфекционный процесс имеет двойственный характер. С одной стороны, он характеризуется нарушением функций организма в различной степени (вплоть до заболевания), с другой – происходит мобилизация его защитных механизмов, направленных на уничтожение и удаление возбудителя. Поскольку неспецифических механизмов защиты для этой цели часто оказывается недостаточно, на определенном этапе эволюции возникла дополнительная специализированная система, способная реагировать на внедрение чужеродного антигена более тонкими и более специфическими реакциями, которые не только дополняют специализированные биологические механизмы видового иммунитета, но и стимулируют функции некоторых из них. Системы макрофагов и комплемента приобретают уже специфически направленный характер действия против конкретного возбудителя, последний распознается и подвергается уничтожению с гораздо большей эффективностью. Одним из характерных признаков приобретенного иммунитета служит появление в сыворотке крови и тканевых соках специфических защитных веществ – антител, направленных против чужеродных веществ. Антитела образуются после перенесенного заболевания и после прививок как ответная реакция на введение микробных тел или их токсинов. Наличие антител всегда свидетельствует о контакте организма с соответствующим возбудителем.
Вещества, индуцирующие образование антител, называются антигенами (греч. anti – против, genos – рождение, происхождение). Однако образование антител – это лишь одна из форм иммунного ответа на чужеродный антиген. В связи с этим можно дать следующее общее определение этого понятия.
Антигены – любые вещества, содержащиеся в микроорганизмах и других клетках или выделяемые ими, которые несут признаки генетически чужеродной информации и при введении в организм вызывают развитие специфических иммунных реакций. Необходимо подчеркнуть, что антигены индуцируют реакции как гуморального, так и клеточного иммунитета.
Термин «антиген» употребляют очень часто, вкладывая в него двоякий смысл. Под антигенами понимают вещества, вызывающие появление антител, и вещества, реагирующие с антителами. Однако это совершенно разные характеристики антигена. Важнейшее качество антигена – способность индуцировать образование антител (и другие формы иммунного ответа), т. е. антигенность определяется чужеродностью и зависит от молекулярной массы антигена, его коллоидного состояния и способности метаболизироваться в организме.
Антигенами являются любые вещества или клетки, которые генетически чужеродны данному организму; только в этом случае они и распознаются его иммунной системой. Специфичность работы каждого генома проявляется прежде всего на уровне белка и других биологических макромолекул. Однако для того, чтобы иммунная система смогла распознать антигены, они должны обладать определенной молекулярной массой. Как правило, антигены – высокомолекулярные соединения: их молекулярная масса должна быть не менее 20 – 30 кД. Белки с меньшей молекулярной массой, например рибонуклеаза (молекулярная масса – 14 кД), вазопрессин (молекулярная масса – 1 кД), являются слабыми антигенами. Все известные до настоящего времени антигены являются веществами коллоидной природы. Значение этого обстоятельства для реализации антигенности не совсем ясно.
Установлено также, что реализация антигенности зависит от способности антигена метаболизироваться в организме, т. е. быть объектом разрушающего действия макрофагов и взаимодействовать с другими клетками иммунной системы. Благодаря такому взаимодействию происходит распознавание антигенной специфичности. Все антигены обладают специфичностью, т. е. определенными особенностями, генетически детерминированными и связанными с их структурой, почему они и отличаются друг от друга.
Независимо от происхождения антигенов, у них различают несколько уровней специфичности.
Видовая специфичность – антигенные особенности, присущие представителям данного вида. Отпечаток видовой специфичности имеют многие макромолекулы данного организма. Определение видовых антигенов может быть использовано для дифференциации особей одного вида от другого.
Групповая специфичность – особенности антигенного строения, свойственные определенной группе особей внутри данного вида организмов. Групповые антигены, позволяющие различать отдельных особей или группы особей внутри одного вида, называются изоантигенами. Например, в эритроцитах человека обнаружено помимо изоантигенов АВ0 еще более 70 других, все они объединены в 14 изоантигенных систем. Около 40 антигенов найдено в сыворотке крови. Большой интерес представляют лейкоцитарные изоантигены, относящиеся к антигенам гистосовместимости.
Гетероспецифичность – антигенная специфичность, обусловленная наличием общих для представителей разных видов антигенов. Примером таких гетероантигенов является обнаруживаемый в эритроцитах овец, лошадей, мышей, кур, собак, кошек, но отсутствующий у человека, обезьян и некоторых других животных антиген Форсмана. Гетероантигены обусловливают перекрестные иммунологические реакции.
Помимо перечисленных типов антигенной специфичности, выделяют еще органоидную (антигенные различия клеточных органоидов), функциональную (специфичность белков, связанная с выполнением различных функций), патологическую («ожоговые», «лучевые», «раковые» антигены), стадиоспецифичность (антигены различных тканей, связанные с их морфогенезом) и т. п.
Аутоантигены – вещества, обладающие способностью вызывать иммунные реакции в организме, из которого они получены. Их содержат мозг, хрусталик глаза, сперматозоиды, паращитовидные железы, гомогенаты семенной железы, кожи, почек, печени и других тканей. Так как в обычных условиях аутоантигены не приходят в соприкосновение с иммунными системами организма, антитела к подобным клеткам и тканям не образуются. Однако при повреждении этих тканей аутоантигены могут всасываться и вызывать образование антител, оказывающих повреждающее действие на соответствующие клетки. Аутоантигены могут возникать также из клеток некоторых органов и тканей под влиянием охлаждения, медикаментозного воздействия, вирусных инфекций, бактериальных белков и токсинов, например стрептококков, стафилококков, микобактерий туберкулеза, и других факторов. Они образуются в этом случае вследствие нарушения видовой специфичности собственных антигенов организма.
Для характеристики микроорганизмов помимо родовой, видовой и групповой антигенной специфичности очень важное значение имеет определение типоспецифичности антигенов. Типоспецифичность – особенность антигенного строения, которая обусловливает различия среди особей одной группы сходных организмов данного вида и позволяет выделить среди них серотипы, или сероварианты (серовары). Выявление сероваров дает возможность осуществлять очень тонкую дифференциацию внутри вида микроорганизмов.
Большинство современных классификаций патогенных микроорганизмов построены с учетом этих типов антигенной специфичности.
Полноценные и неполноценные антигены (гаптены и полугаптены)
Одной из важнейших характеристик антигена является его иммуногенность, т. е. способность индуцировать формирование иммунитета к соответствующему возбудителю, в состав которого входит данный антиген. Степень иммуногенной активности у разных микробных антигенов далеко не одинакова. Различают слабоиммуногенные антигены, т. е. антигены, индуцирующие слабый иммунный ответ; высокоиммуногенные антигены, индуцирующие сильный иммунный ответ, и так называемые суперантигены. Такое название получили бактериальные антигены, вызывающие чрезмерно сильный иммунный ответ, который может стать причиной тяжелых побочных реакций или привести к развитию иммунодефицита или аутоиммунных болезней. Об особенностях взаимодействия суперантигенов с клетками иммунной системы рассказано в главе 34. Все вакцины, применяемые для формирования иммунитета к инфекционным болезням, должны обладать высокой иммуногенностью, быть безвредными и не оказывать нежелательного воздействия на иммунную систему.
Изучение антигенных свойств различных сложных химических соединений – белков, полисахаридов, липидов, нуклеиновых кислот и т. д. – показало, что существует два типа антигенов – полноценные и неполноценные. Полноценные антигены обладают обеими функциями антигена: способностью индуцировать образование антител и специфически с ними взаимодействовать. Неполноценные антигены сами по себе способностью индуцировать образование антител не обладают, они приобретают это свойство только после соединения с белками или другими полноценными антигенами. Такие неполноценные антигены называются гаптенами или полугаптенами (греч. hapto – прикрепляю). Неполноценные антигены обладают только одним свойством антигена: они способны специфически взаимодействовать с теми антителами, в индукции синтеза которых они участвовали (после присоединения к белку и превращения в полноценные антигены).
Если взаимодействие неполноценного антигена с антителом сопровождается обычными иммунологическими реакциями, его называют гаптеном. Если неполноценный антиген имеет очень небольшую молекулярную массу и его взаимодействие с антителами не сопровождается обычными видимыми реакциями, его называют полугаптеном. О присутствии полугаптена в этом случае судят по тому признаку, что антитела, будучи связаны с полугаптеном, уже не проявляют себя в обычной реакции с полноценным антигеном (задерживающая реакция Ландштейнера).
Из высокомолекулярных соединений биологического происхождения свойствами полноценных антигенов обладают главным образом белки, а также некоторые полисахариды и липополисахариды бактериального происхождения. Например, капсульные полисахариды пневмококка являются антигенами для мышей и человека, но не для кролика и лошадей.
Основными носителями антигенной функции являются белки. Это связано с тем, что именно в структуре белков прежде всего реализуется специфичность работы генома каждого организма. Аминокислоты, моносахара, азотистые основания и другие относительно простые соединения, не говоря уже о химических элементах, которые имеют у всех организмов одинаковую структуру, не обладают признаками чужеродности и не могут поэтому быть антигенами. У разных белков антигенные свойства проявляются в разной степени: наряду с сильными антигенами (микробные экзотоксины, сывороточные белки и др.), есть белки с очень слабой антигенной активностью – гемоглобин, желатин, инсулин и другие низкомолекулярные белки. Низкую антигенную активность инсулина обычно связывают с его небольшой молекулярной массой (менее 6 кД). Однако такие белки, как, например, гемоглобин и актин, имеют большую молекулярную массу (64,5 кД и 50 кД соответственно), но обладают слабыми антигенными свойствами.
В настоящее время полагают, что антигенные свойства белков коррелируют со скоростью их эволюции. Выполняя сходные функции у разных организмов, такие белки, как инсулин, гемоглобин, обладают большим структурным сходством. Лишь инсулин морской свинки отличается от инсулина других млекопитающих по 16 – 18 аминокислотным остаткам. В то же время только морские свинки способны вырабатывать антитела к гетерологичному инсулину.
Таким образом, чем больше различий в аминокислотных последовательностях у белка-антигена по сравнению с аналогичным белком хозяина, тем больше выражена у него способность индуцировать синтез антител, и наоборот, чем более эволюционно консервативен белок, тем слабее у него антигенные качества. К числу наиболее консервативных белков относится семейство гистонов IV. За 1,5 млрд лет в них произошли всего 2 аминокислотные замены. Способность индуцировать синтез антител у гистонов IV не обнаружена.
Антигенность полисахаридов и липополисахаридов имеет такое же происхождение, как и антигенность белков, т. е. обусловлена необычностью структуры, сообщающей им свойства чужеродности. Например, антигенность полисахаридов сальмонелл группы А связана с наличием в их составе паратозы (3,6-ди-дезокси-глюкозы), группы В – абеквозы (3,6-ди-дезокси-галактозы) и т. д. Простые сахара и олигосахариды обладают свойствами гаптенов, т. е. их можно превратить в антиген путем присоединения к белкам. Многочисленные исследования антигенных свойств нуклеиновых кислот дали противоречивые результаты. По-видимому, лишь высокополимерным препаратам нуклеиновых кислот присущи антигенные свойства. Антигенные свойства доказаны для ДНК Т-четных фагов (Т2, Т4, Т6); в ее составе содержатся остатки 5-оксиметилцитозина, к некоторым из них присоединены 1 – 2 остатка глюкозы. Негликозилированная ДНК не способна индуцировать образование антител. Сыворотка крови людей, страдающих системной красной волчанкой, дает реакции преципитации с ДНК различного происхождения. Это связано с наличием в сыворотке крови больных антител к ДНК. Антитела, реагирующие с РНК, удается получить, используя в качестве антигена рибосомы.
Жирные кислоты, а также триглицериды и другие чистые липиды свойствами полноценных антигенов не обладают. Некоторые классы липидов могут быть составной частью молекулы гаптена. Помимо липидов, связанных ковалентной связью с белками, только два класса липидов, содержащиеся в живых тканях, функционируют как гаптены: фосфатиды и гликосфинголипиды. По крайней мере пять хорошо охарактеризованных фосфолипидов обладают свойствами гаптенов: кардиолипин и четыре фосфатидил-инозитол-олигоманнозида, выделенных из туберкулезных бактерий. Липиды обладают способностью усиливать иммуногенность других антигенов, поэтому их используют в качестве адъювантов (англ. adjuvant – помощник, полезный). Применению адъювантов во многом способствовали работы Дж. Фрейнда. В качестве адъюванта Дж. Фрейнд использовал смесь минерального масла с нейтральным детергентом для создания стабильных эмульсий водных растворов антигенов. Добавление к этой эмульсии убитых туберкулезных палочек повышает ее адъювантное действие («полный адъювант Фрейнда»). Применение адъювантов дает хороший эффект при иммунизации низкомолекулярными растворимыми антигенами. Высокомолекулярные антигены в адъювантах практически не нуждаются. По-видимому, основная роль адъювантов состоит в том, что они служат носителями для растворимых антигенов, благодаря чему последние становятся доступными действию фагоцитов. Кроме того, адъюванты вызывают воспалительную реакцию на месте введения, что также способствует фагоцитозу антигенов. Липиды (в основном в виде фосфолипидов) входят в состав эндотоксинов и усиливают их иммуногенность.
Природа специфичности антигенов
Изучение свойств гаптенов и полугаптенов дало возможность искусственно синтезировать комплексные антигены, состоящие из гаптенов и белка. Они получили название конъюгированных антигенов. При этом было установлено, что введение в белковую молекулу любого гаптена или полугаптена изменяет ее антигенную специфичность. Как было впервые показано К. Ландштейнером, если иммунизировать животных конъюгированными антигенами, содержащими один и тот же белок, но разные введенные химические группировки (NO, N=N, I2, Br2, бензольное кольцо и т. п.), то появляются антитела, специфичные к этим группировкам. В связи с этим было сделано заключение, что конъюгированные антигены состоят из двух компонентов: 1) активной химической группы, определяющей специфичность антигена, т. е. фактора специфичности, или детерминантной группы, или эпитопа; 2) белковой части антигена – шлеппера, в которую вводится фактор специфичности. Белок является носителем собственно антигенности. Специфичность детерминантной группы определяется следующими факторами: природой самой химической группировки; орто-, мета– или параположением группировки и ее стереоизомерией. Орто-, мета-, параизомеры, цис– и трансформы, лево– и правовращающие изомеры детерминантных групп индуцируют образование антител с различной специфичностью. Антитела к D-изомерам отличаются от антител к L-изомерам и т. д. В крупные белковые молекулы может быть введено несколько детерминантных групп (от 1 до 200 и более), а их размеры могут варьировать от 1 атома до крупных молекул. Каждый детерминант, или эпитоп, вызывает образование особого типа антител, реагирующих с данным детерминантом. Таким образом, сложные конъюгированные антигены с несколькими различными детерминантами индуцируют образование целого комплекса антител.
Природа антигенной специфичности белков
Для выяснения природы антигенности белков и ее специфичности большое значение имели модельные опыты с искусственными аминокислотами и продуктами расщепления белка. Как оказалось, гомополимеры различных аминокислот антигенными свойствами не обладают. Однако если гомополимеры ароматических аминокислот присоединить к желатину, то антигенные свойства последнего значительно усиливаются, в то время как от присоединения, например, полиглицина или полиаланина антигенность желатина не возрастает. Это обстоятельство указывает на важную роль ароматического кольца для проявления антигенности.
Антигенные свойства у искусственно получаемых полиаминокислот возникают только на уровне сополимеров, т. е. когда появляется возможность определенных сочетаний аминокислот в таких структурах. Последовательность расположения аминокислот в каждой природной полипептидной цепи уникальна и генетически детерминирована. Поэтому возможность появления необычных для данного организма сочетаний аминокислот в составе полиаминокислот возникает лишь в том случае, если для их синтеза берутся разные аминокислоты. При этом опять-таки антигенность и специфичность полиаминокислот в значительной степени определяются остатками ароматических аминокислот – тирозина, фенилаланина, триптофана, содержащих в себе жесткое кольцо. По мнению Ф. Гауровитца, жесткость структуры детерминантных групп является обязательным условием антигенности молекулы. Детерминантная группа должна находиться на поверхности молекулы и быть доступной для систем иммунного ответа. Неспособность жирных кислот служить антигенными детерминантами Ф. Гауровитц объясняет тем, что их молекулы содержат длинные цепи парафиновых углеводородов, лишенных жесткой структуры, в связи с чем взаимное расположение химических групп, образующих молекулу жирной кислоты, в пространстве постоянно меняется.
Детерминантные группы нативных белков возникают из различных аминокислотных остатков, представляющих поверхностно расположенные группы определенной конформации. Важную роль в их образовании, очевидно, играют указанные выше аминокислоты. Вместе с тем и общая конформация белковой молекулы, т. е. ее вторичная и третичная структура, также определяет иммунологическую специфичность. Денатурирование белка меняет его антигенную специфичность. В свете этого становится понятным, почему присоединение различных химических группировок к белку приводит к изменению его антигенной специфичности. Гаптен, присоединенный к молекуле белка, изменяет ее конформацию и придает ей новую специфичность. У белка РНКазы, аминокислотная последовательность которой известна, детерминантные группы образованы аминокислотными остатками 39 – 52 и 105 – 124. Окисление или восстановление РНКазы приводит к изменению ее антигенной специфичности. Все три формы молекулы РНКазы – нативная, восстановленная и окисленная – обладают антигенной специфичностью и индуцируют образование различных по специфичности антител.
Таким образом, антигенность белков является функцией их чужеродности, а ее специфичность зависит от аминокислотной последовательности, которая определяет все свойства белка; от вторичной, третичной и четвертичной структуры, т. е. от общей конформации белковой молекулы; от поверхностно расположенных детерминантных групп и концевых аминокислотных остатков. Количество детерминантных групп в белковой молекуле возрастает пропорционально ее молекулярной массе. Например, в молекуле дифтерийного токсина (м. м. 61 кД) обнаружено около 8, тиреоглобулина (м. м. 650 кД) – 40, а гемоцианина (м. м. 6,5 МД) – более 230 детерминантных групп.
Антигенное строение микробной клетки
Для медицинской микробиологии наибольший интерес представляют антигенные свойства бактерий, токсинов и вирусов. Результаты их изучения используются в практике получения высокоэффективных иммуногенных препаратов, а также для совершенствования методов идентификации возбудителей болезней. Обладая сложным химическим строением, бактериальная клетка представляет собой целый комплекс антигенов. Антигенными свойствами обладают жгутики, капсула, клеточная стенка, цитоплазматическая мембрана, рибосомы и другие компоненты цитоплазмы, а также различные продукты белковой природы, выделяемые бактериями во внешнюю среду, в том числе токсины и ферменты. В связи с этим различают следующие основные виды микробных антигенов: соматические, или О-антигены; жгутиковые, или Н-антигены; поверхностные, или капсульные К-антигены (нем. Kapsel – капсула).
Символы, обозначающие названия жгутиковых и соматических антигенов, были предложены в связи со следующим феноменом. Протей, обладающий жгутиками, дает на плотной среде характерный рост в виде роения, напоминающий налет на холодном стекле, образующийся при дыхании на него. Протей, лишенный жгутиков, растет иначе. Поэтому жгутиковые антигены стали обозначать символом «Н» (нем. Hauch – дыхание), соматические антигены – «О» (нем. ohne Hauch – без дыхания).
Соматические антигены в большинстве случаев термостабильны, выдерживают нагревание до 80 – 100 °C. Они представляют собой сложные полисахаридолипидопротеидные комплексы. Антигенную специфичность грамотрицательных бактерий, например сальмонелл, определяют полисахариды, содержащиеся в ЛПС клеточной стенки. Помимо общего гетерополисахарида, в состав которого входят гептозофосфат и N-ацетилглюкозамин, сальмонеллы имеют специфические полисахариды, в молекулах которых концевые дезоксисахара (тивелоза, паратоза, колитоза, абеквоза и др.) выполняют функцию соответствующих антигенных детерминант. Род Salmonella по О-антигенам подразделяется на ряд групп. Каждая группа характеризуется наличием общего группового антигена, специфичность которого определяется указанными дезоксисахарами. Например, в группе А – паратозой, в группе О – колитозой и т. д.
Жгутиковые антигены, имеющие белковую природу, как правило, термолабильны (разрушаются при температуре 60 – 80 °C). Они также отличаются высокой специфичностью. Изучение жгутиковых антигенов позволяет выделить, например в группах сальмонелл, различные серологические варианты. На основании особенностей строения О– и Н-антигенов род Salmonellа подразделяется более чем на 2200 сероваров.
Капсульный антиген пневмококков является чистым полисахаридом, он определяет специфичность, на основании которой пневмококки подразделяются более чем на 80 сероваров. Состав сахаров многих типов известен, и структура некоторых из них установлена. Например, у пневмококков третьего серовара полисахарид представлен полимером из повторяющихся единиц целлобиуроновой кислоты с молекулярной массой 276,5 кД. Целлобиуроновая кислота является дисахаридом D-глюкуроновой кислоты и D-глюкозы, связанных между собой b-1,4-гликозидной связью.
К-антиген располагается поверхностнее О-антигенов. Например, у E. coli, помимо О– и Н-антигенов выявлен ряд К-антигенов. По степени устойчивости к высокой температуре они подразделяются на L-, B– и А-антигены. У вирулентных штаммов S. typhi обнаружен относительно термолабильный поверхностный антиген, получивший название Vi-антигена.
Стрептококки обладают тремя разными по степени специфичности антигенами. У них имеются общий родовой нуклеопротеидный антиген (Р-антиген), групповой полисахаридный С-антиген и типоспецифические антигены. По С-антигену стрептококки подразделяются на 20 серологических групп (А, В, С, D, Е, F…V). В свою очередь стрептококки группы А по типоспецифическому белковому М-антигену дифференцируются на 100 сероваров.
Антигенные свойства присущи также микробным токсинам, ферментам и другим бактериальным белкам. Экзотоксины рассматриваются как внеклеточные антигены. У бактерий выделяют еще так называемые протективные антигены. Впервые они были найдены в экссудатах животных, больных сибирской язвой. Их можно получить при культивировании сибиреязвенных бацилл на животных тканях и специальных питательных средах, состоящих из аминокислот. Протективные антигены обладают весьма высокими предохраняющими свойствами и могут быть использованы в практике иммунизации против некоторых инфекционных болезней, в частности против сибирской язвы и чумы. Подобные антигены найдены у возбудителей коклюша, бруцеллеза, туляремии и у других микроорганизмов. Наконец, у бактерий выявлены также антигены, общие с антигенами тканей млекопитающих, так называемые перекрестно реагирующие антигены. Например, установлено наличие общих антигенов у эритроцитов человека, стафилококков, стрептококков, бактерий чумы, кишечной палочки, некоторых сальмонелл, шигелл, вирусов оспы, гриппа и других возбудителей инфекционных болезней. Если имеется сходство антигенной структуры хозяина и возбудителя, макроорганизм не способен вырабатывать иммунитет, и болезнь протекает более тяжело. Возможно, в отдельных случаях длительное носительство возбудителя и неэффективность вакцинации являются следствием общности антигенов микроба с антигенами тканей человека.
У некоторых бактерий обнаружены так называемые суперантигены. Ими являются, например, стафилококковые экзотоксины: энтеротоксины и токсин, вызывающий синдром токсического шока. Свое название суперантигенов такие белки получили потому, что они, связываясь отличным от других антигенов способом с рецепторами Т-лимфоцитов, активируют их. Т-лимфоциты (Т-хелперы) начинают быстро размножаться и секретировать избыточное количество интерлейкина-2, который и вызывает отравление. В свою очередь избыточное количество Т-лимфоцитов может привести к различным аутоиммунным заболеваниям и подавлению самmой иммунной системы.
Глава 30 Главная система гистосовместимости
В зависимости от степени генетического родства организмов различают ткани и, соответственно, трансплантаты сингенные, аллогенные и ксеногенные. Сингенные трансплантаты (изотрансплантаты) приживаются хорошо, так как иммунная система реципиента не распознает их как чужеродные. На пересадку аллогенной, отличающейся по изоантигенам, а тем более ксеногенной ткани индивидуумов разных видов организм отвечает трансплантационным иммунитетом, т. е. реакциями, направленными на отторжение генетически чужеродной ткани. Материальным субстратом несовместимости являются внутривидовые различия тканевых антигенов, т. е. изоантигены и их комбинации. Начало изучению изоантигенов положил К. Ландштейнер в 1901 г. Он описал изоантигены эритроцитов системы АВ0. Изоантигены эритроцитов человека изучены достаточно хорошо, их известно уже более 70.
Эритроцитарные изоантигены играют определенную роль в трансплантационном иммунитете, хотя значимость различных систем их в определении тканевой несовместимости неодинакова и антигенная дифференцировка тканей связана не только с ними. Существуют и другие системы изоантигенов ткани, в том числе и такие, которые главным образом ответственны за отторжение аллогенных трансплантатов. Они получили название трансплантационных антигенов, или антигенов гистосовместимости; гены, определяющие их синтез, называются Н-генами, или Н-локусами (англ. histocompatibility – тканевая совместимость). Трансплантационные антигены во многом определяют индивидуальную антигенную специфичность организма, в том числе и человека. Совокупность генов, определяющих синтез трансплантационных антигенов, получила название главной системы гистосовместимости, или кратко – системы МНС (англ. major histocompatibility complex). Общий план строения ее одинаков у всех млекопитающих. Он включает в себя несколько локусов, которые определяют синтез основных антигенов гистосовместимости, а также гены, контролирующие силу иммунного ответа, и некоторые другие.
У человека главная система гистосовместимости имеет второе название – система HLA (англ. human leucocyte antigens) в связи с тем, что контролируемые ею трансплантационные антигены HLA хорошо представлены на лейкоцитах. Гены системы МНС (HLA) у человека расположены на коротком плече хромосомы С6. В соответствии с решением Номенклатурной комиссии по лейкоцитарным антигенам (1985 г.) HLA-система включает в себя 7 генетических локусов, которые, помимо того что контролируют иммунный ответ на аллотрансплантаты, играют важнейшую роль в контроле клеточных взаимодействий, лежащих в основе иммунных реакций, а также синтезе некоторых компонентов системы комплемента. Эти локусы поделены на 3 класса.
К классу I относятся три локуса HLA – A, B и С. Они контролируют синтез антигенов (белков) МНС класса I: HLA-A включает 23 аллеля (нем. Allele – альтернативные варианты генов одного и того же локуса), определяющих синтез 23 антигенов класса I; HLA-B включает 49 аллелей, котoрые контролируют синтез 49 белков класса I; HLA-C включает 8 аллелей, контролирующих синтез 8 антигенов класса I.
К классу II относится область HLA-D, которая состоит из трех локусов: HLA-DR, HLA-DQ и HLA-DP. Эти гены контролируют синтез антигенов МНС класса II.
С областью HLA связаны также гены, контролирующие компоненты С2, С4А, С4В и Вf (фактор В пропердина) системы комплемента. Они обозначаются как белки класса III. Такое деление антигенов системы МНС на классы основано на различиях в их химической структуре и функциональных свойствах. Антигены класса I имеются на поверхности всех ядросодержащих клеток организма, но, по-видимому, в различном количестве.
Антигены класса II несут главным образом макрофаги и В-лимфоциты, в меньшем количестве они содержатся на некоторых активированных Т-лимфоцитах.
Антигены класса III (компоненты комплемента) встречаются только в крови, их нет на мембранах клеток. К системе МНС относятся и гены, контролирующие активность иммунной системы: гены Ir – силы иммунного ответа (англ. immune response) и гены Is – супрессии иммунного ответа (англ. immune suppress); они также сцеплены с областью HLA-D. Весь комплекс HLA состоит из 2 – 3 млн пар нуклеотидов.
Структура антигенов МНС класса I такова (рис. 63). Они представляют собой димерные гликопротеиды, которые состоят из тяжелой и легкой полипептидных цепей. Тяжелая цепь (45 кД) состоит из трех глобулярных внеклеточных (α1, α2, α3), гидрофобного трансмембранного и цитоплазматического доменов. К домену α1 с помощью N-гликозидной связи присоединяется короткая боковая углеводная цепочка. Домены α2 и α3 зафиксированы дисульфидными связями. С доменом α3 нековалентно связана легкая полипептидная цепь β-микроглобулин (11,6 кД), она кодируется геном, расположенным вне МНС. Детерминанты (эпитопы), распознаваемые антителами к антигенам класса I, расположены на внеклеточных доменах.
Антигены МНС класса II (Iα-антигены) состоят из двух пересекающихся полипептидных цепей: a (35 кД) и β (25 кД). Каждая цепь имеет два внеклеточных, гидрофобный трансмембранный и цитоплазматический домены. С помощью гидрофобных трансмембранных доменов полипептидные цепи «заякориваются» в мембране. В составе полипептидных цепей антигенов класса II и a-цепи антигенов класса I имеются константные домены (т. е. домены с постоянными аминокислотными последовательностями) и вариабельные (т. е. с вариабельными аминокислотными последовательностями) домены. Распознавание и связывание ими чужеродных антигенов, которые они затем представляют иммунокомпетентным клеткам, осуществляются особыми активными центрами, которые формируются за счет вариабельных доменов (один – от α-цепи, а другой – от β-цепи), соединенных на дне «щели» неспирализованной области, которая образуется сегментами обеих цепей. Антигены МНС класса I определяют индивидуальную антигенную специфичность, и они представляют любые чужеродные антигены Т-цитотоксическим лимфоцитам.
Рис. 63. Структура антигенсвязывающих участков молекул HLA класса I (а) и класса II (б) по Бьоркману (1987) и схема строения тримолекулярного комплекса (в), с дополнениями к схеме в обзоре Нельсон (1990):
а, б: 1 – альфа-спирали; 2 – платформа из восьми полос, образованная бета-складками дистальных доменов молекул HLA; в: 1 – антигенпредставляющая клетка; 2 – Т-лимфоцит; 3 – платформа антигенсвязывающего участка молекулы HLA класса II, образованная бета-складками ее дистальных доменов; 4 – альфа-спиральные структуры дистальных доменов молекулы HLA класса II, образующие боковые стенки углубления, в котором помещается антиген – 5; 6 – дезетоп; 7 – гистотоп; 8 – Т-клеточный рецептор; 9 – CD4-молекула (из обзора Сартаковой М. Л., Коненкова В. И., Успехи соврем. биол., 1997, т. 117, вып. 5, с. 568)
Назначение антигенов МНС класса II заключается в том, что они обеспечивают взаимодействие между макрофагами и В-лимфоцитами. Эти антигены необходимы на всех стадиях иммунологического процесса: на стадии представления антигена макрофагами Т-лимфоцитам, на стадии межклеточного иммунологического взаимодействия между макрофагами, Т– и В-лимфоцитами и на стадии дифференцировки иммунокомпетентных клеток. Антигены МНС класса II участвуют в формировании всех видов иммунного ответа: противомикробного, противоопухолевого, трансплантационного и др. На мембранах клеток-носителей антигены класса II располагаются независимо от антигенов класса I, рецепторных иммуноглобулинов и Fc-рецепторов. Количество антигенов класса II на мембранах фагоцитов возрастает при их активировании и в результате действия лимфокинов.
Структуры, с помощью которых белки МНС класса II и класса I связывают антигены, по уровню специфичности уступают только активным центрам антител.
Для обнаружения и типирования антигенов системы HLA вначале использовали метод агглютинации лейкоцитов, а сейчас используют в основном метод комплементзависимой цитотоксичности. С этой целью вначале лимфоидные клетки инкубируют с различными разведениями аллоиммунных сывороток, а затем с комплементом. Если искомый антиген присутствует на поверхности клетки, то произойдет ее лизис и гибель, опосредованная комплементом. Гибель клеток определяют либо биоскопически (по включению витального красителя), либо по выходу из предварительно меченных клеток изотопа.
С системой МНС связаны следующие иммунологические свойства:
1. Интенсивное отторжение трансплантатов тканей.
2. Стимуляция образования антител.
3. Стимуляция реакции в смешанной культуре лимфоцитов (стимуляция бласттрансформации).
4. Реакция «трансплантат против хозяина».
5. Клеточная реакция лимфолиза.
6. Контроль силы иммунного ответа (Ir-гены) и супрессия иммунного ответа (Is-гены).
7. Контроль синтеза некоторых компонентов системы комплемента (С2, С4А, С4В, В7).
Проявление этих свойств определяется генами класса I и класса II в неодинаковой степени (табл. 10). В общей сложности аллели локусов HLA-A и HLA-B определяют синтез более 70 различных по специфичности трансплантационных антигенов. Однако гаплотип, то есть набор локусов МНС, наследуемый от одного из родителей, всегда представлен одним из локусов HLA-A и одним из локусов HLA-B. Поэтому в парной хромосоме каждого человека может быть не менее двух (если гаплотипы обоих родителей идентичны) и не более четырех (если гаплотипы различаются по всем четырем локусам) трансплантационных антигенов HLA-A и HLA-B. Из-за большого количества аллелей изоантигенов МНС вероятность подбора двух людей с одинаковыми трансплантационными антигенами крайне незначительна. В случае редких гаплотипов вероятность обнаружения двух людей с одинаковым фенотипом, согласно расчетам А. Данссета, равна 1: 7000.
Определение антигенов гистосовместимости имеет первостепенное значение при пересадке тканей. Чем больше совпадение донора и реципиента по системе HLA, тем лучше приживается и дольше сохраняется трансплантат. Поэтому создаются специальные банки, содержащие сведения о генотипах трансплантационных антигенов у тех лиц, которые нуждаются в пересадке тканей и органов.
Изучение антигенов гистосовместимости представляет большой интерес также и потому, что обнаружена статистически достоверная корреляция между некоторыми антигенами HLA и наклонностью лиц, у которых они имеются, к определенным болезням (табл. 11).
Таблица 10
Связь между свойствами МНС и классами генов
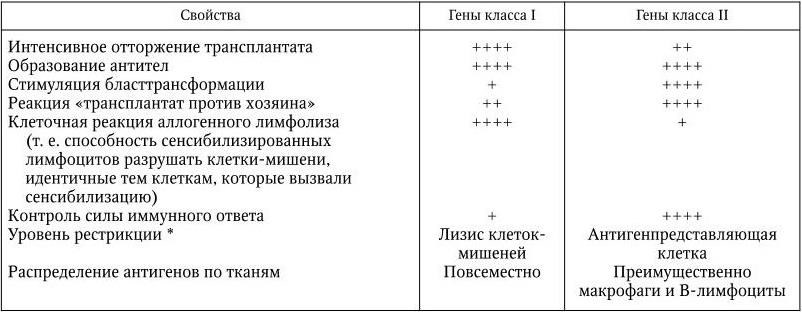
* Рестрикция (англ. restriction – ограничение) – способность продуктов генов МНС ограничивать функции Т-лимфоцитов в индукции, межклеточной кооперации и эффекторных механизмах иммунного ответа. Элементами рестрикции Т-цитотоксических лимфоцитов являются белки МНС класса I, Т-хелперов – белки МНС класса II.
Таблица 11
Взаимосвязь между некоторыми типами аллелей HLA и предрасположенностью их носителей к определенным болезням
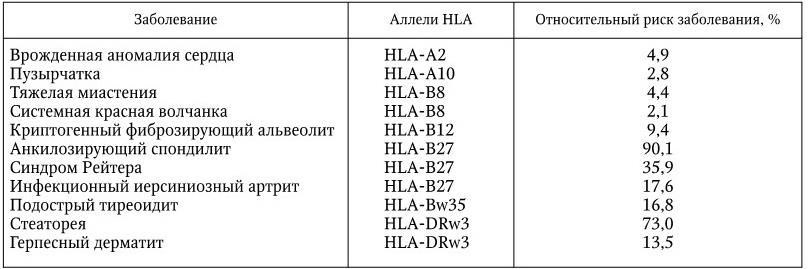
Например, 88 – 96 % людей, страдающих анкилозирующим спондилитом, имеют аллель HLA-B27. Хотя людей с такими аллелями встречается немного (8 – 12 % здоровых европейцев), но степень риска заболеть этой болезнью у них составляет 90 %. У лиц, имеющих аллели HLA-A3, выявляется иммунологическая дефектность в отношении некоторых вирусов. Причины такой связи между типами аллелей HLA и наклонностью их носителей к тем или иным заболеваниям в настоящее время интенсивно изучаются. Очевидно, у таких людей существует какая-то генетически обусловленная предрасположенность к возникновению таких болезней.
Приобретенный иммунитет. Формы иммунного ответа. Антитела
Возможны следующие формы иммунного ответа на проникновение антигена в организм: биосинтез антител, образование клеток иммунной памяти, реакция гиперчувствительности немедленного типа, реакция гиперчувствительности замедленного типа (в том числе трансплантационный иммунитет), иммунологическая толерантность, идиотип-антиидиотипические отношения.
Антитела являются уникальными сывороточными белками – глобулинами, которые вырабатываются в ответ на поступление в организм антигена и способны с ним специфически взаимодействовать. При электрофорезе сыворотки антитела мигрируют в составе γ-глобулинов, поэтому ранее их называли гамма-глобулинами. В соответствии с международной классификацией, ныне совокупность сывороточных белков, обладающих свойствами антител, называют иммуноглобулинами и обозначают символом Ig.
Уникальность антител заключается в том, что они способны взаимодействовать только с тем антигеном, который индуцировал их образование. Практически антитела могут быть получены к любому антигену. Число возможных специфичностей антител, вероятно, составляет не менее 109.
Молекулярная структура антител
Важная роль антител в формировании иммунитета и их исключительная специфичность стимулировали огромный интерес к изучению молекулярной структуры иммуноглобулинов, без этого было просто невозможно понять природу антител. В результате было установлено, что существует пять различных классов иммуноглобулинов: IgG, IgM, IgA, IgE, IgD. Они различаются по молекулярной массе, содержанию углеводов, составу полипептидных цепей, коэффициентам седиментации и другим характеристикам (табл. 12).
Основная структурная единица молекулы иммуноглобулина состоит из двух идентичных полипептидных L-цепей (англ. light – легкий) и двух идентичных H-цепей (англ. heavy – тяжелый). Эти четыре цепи ковалентно связаны дисульфидными связями. Молекулярная масса легких цепей составляет около 23 кД, и они состоят примерно из 214 – 220 аминокислотных остатков. Существуют легкие цепи двух типов, один из них обозначается греческой буквой каппа (χ), а другой – лямбда (λ). Соотношение каппа/лямбда у человека равно 70: 30. Каппа– и лямбда-цепи обладают одинаковой способностью связываться с любой тяжелой цепью.
Таблица 12
Свойства классов иммуноглобулинов человека (по: Д. Джеске, Дж. Капре, 1987)
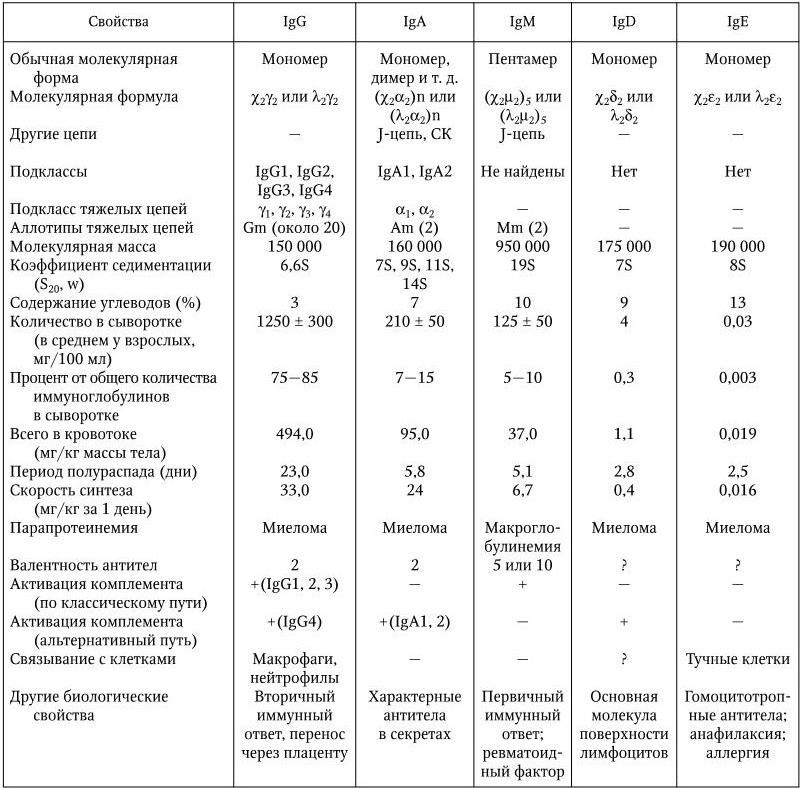
Молекулярная масса тяжелых цепей варьирует в пределах 50 – 73 кД. Идентифицировано пять классов тяжелых цепей, их обозначают греческими буквами: альфа (α), гамма (γ), эпсилон (ε), мю (μ) и дельта (δ). Соответственно обозначению тяжелой цепи обозначается и класс молекул иммуноглобулинов. У человека класс IgG в соответствии с подклассами гамма-цепи (γ1, γ2, γ3 и γ4) делится на 4 подкласса: IgG1, IgG2, IgG3 и IgG4. Класс IgA делится на 2 подкласса: IgA1 и IgA2, в соответствии с двумя подклассами альфа-цепи (α1 и α2).
На тяжелых цепях в зависимости от класса иммуноглобулинов может быть различное число углеводных остатков.
Крупным шагом на пути выяснения структуры молекулы антитела явились опыты Р. Портера и Г. Эдельмана. Р. Портер показал, что при обработке папаином молекула IgG распадается на 3 фрагмента (рис. 64). Два из них оказались одинаковыми;
каждый из них имел молекулярную массу около 45 кД и состоял из легкой цепи и половины тяжелой цепи и обладал способностью соединяться с антигеном. Поэтому эти два фрагмента обозначены как F(ab)1 и F(ab)2, т. е. фрагменты, связывающие антитела (англ. antigen binding). При этом каждый из них обладал только одним активным центром и поэтому связывание с антигеном не сопровождалось образованием крупных конгломератов. Таким образом было установлено, что Fab-фрагменты определяют антительную специфичность иммуноглобулина. Третий фрагмент имел молекулярную массу около 55 кД и состоял из других половин H-цепей. В связи с тем, что он характеризовался постоянством аминокислотного состава, его обозначили как Fc-фрагмент (англ. constant – постоянный). Fc-фрагмент не обладает способностью связывать антиген, но определяет ряд других важных видов биологической активности, необходимых для полного проявления всех функций антител. С Fc-фрагментом связана способность антител проходить через плаценту, усиливать фагоцитоз, нейтрализовать вирусы, связывать комплемент, фиксироваться на клетках кожи и пр.
Г. Эдельман для разрушения дисульфидных связей в молекулах антител обрабатывал их меркаптоэтанолом в концентрированном растворе мочевины. Это приводило к распаду молекул антител на две пары полипептидных цепей. Оказалось, что в полной мере активностью антител не обладает ни одна из цепей. Активные центры антител образуются только при совместном участии N-концевых половин тяжелой и легкой полипептидных цепей. Специфичность же активного центра определяется первичной структурой той и другой полипептидной цепи, т. е. генетически предопределена. Это подтверждается следующим опытом. Если поместить IgG в концентрированный раствор гуанидинхлорида, то это приведет к полному развертыванию полипептидных цепей из-за разрушения вторичной и третичной структуры и к утрате антительных свойств. Однако после длительного диализа и удаления таким путем гуанидинхлорида иммуноглобулин вновь приобретает первоначальную структуру и восстанавливает антительную активность.
Для выяснения природы специфичности антител большое значение имело изучение аминокислотной последовательности L– и Н-цепей. Как было установлено, все легкие цепи состоят из двух почти равных областей, по 110 – 112 аминокислотных остатков каждая. Первые 110 аминокислотных остатков очень изменчивы, т. е. составляют вариабельную (V) область, а остальные 110 остатков у данного вида всегда постоянны, составляя константную (C) область L-цепи. Тяжелая цепь также состоит из вариабельной области (VH), включающей около 110 аминокислотных остатков, и константной части (CH), на долю которой у молекул IgG приходится около 330 аминокислотных остатков. При более детальном исследовании аминокислотного состава в вариабельных участках L– и Н-цепей установлено наличие в них основных каркасных последовательностей и трех (у L-цепи) и четырех (у Н-цепи) коротких гипервариабельных участков:
у L-цепи – 24 – 34; 50 – 56; 89 – 97;
у Н-цепи – 31 – 37; 51 – 68; 84 – 91; 101 – 110.
Каркасная последовательность состоит из четырех постоянных участков, которые определяют аллотип цепей. Гипервариабельные последовательности определяют структуру активного центра. Он представляет собой своеобразную щель, которая обладает структурной дополнительностью к детерминантной группе «своего» антигена. Антитело только тогда свяжет соответствующий антиген, когда его детерминантная группа полностью вместится в щель активного центра, подобно тому, как ключ полностью входит в замочную скважину. Поскольку активный центр для каждого возможного антигена предопределен первичной структурой L– и Н-цепей, это обстоятельство свидетельствует об уникальном механизме генетического контроля биосинтеза антител. Легкие и тяжелые цепи иммуноглобулинов состоят из отдельных блоков – доменов (см. рис. 64). Каждый домен – это пептид, образованный из 100 – 110 аминокислотных остатков и содержащий одну внутрицепочечную петлю, которая возникает вследствие замыкания дисульфидного мостика внутри цепи. В легких цепях имеется два домена: один вариабельный и один константный; в тяжелых – один вариабельный и три или четыре (в зависимости от класса иммуноглобулина) константных. Активные центры антител образуются доменами вариабельных участков обеих цепей. Домены константных участков ответственны за другие функции молекул антител: домены CL и CH1 определяют изоантигенные различия антител; в области доменов CH2 и CH3 расположены рецепторы, ответственные за связывание C1q компонента комплемента, фиксацию антител на клетках и другие свойства (табл. 13).
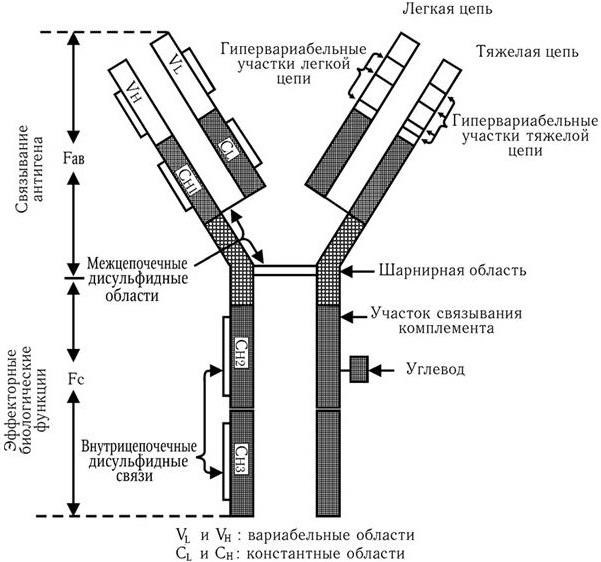
Рис. 64. Структура молекулы IgG. Показана локализация участков, ответственных за различные функции (по: Д. Джеске, Дж. Капре, 1987)
С доменом CH2 связаны также цепочки углеводов. Иммуноглобулины различных классов значительно отличаются по числу и локализации углеводных групп, хотя ряд олигосахаридов располагается в гомологичных положениях – между доменами или на их поверхности. Углеводные компоненты иммуноглобулинов имеют сходное строение. Они состоят из постоянного ядра (внутренняя часть олигосахаридной цепи) и вариабельной наружной части, определяющей специфичность углеводов. Углеводные компоненты влияют на реализацию биологических свойств антител в норме и обусловливают необычные свойства молекул при различных заболеваниях.
В молекуле IgG имеется единственный участок гликозилирования на Н-цепи, к которому могут присоединяться более 30 типов N-гликозилсахаров, что обусловливает микрогетерогенность молекул IgG. Наружные участки сахаров молекул иммуноглобулинов выступают в роли участков связывания с различными клеточными и белковыми рецепторами. Роль углеводов заключается, очевидно, в том, что они участвуют в транспорте и секреции гликозилированных белков молекул антител. Кроме того, они поддерживают конформацию доменов, необходимую для их функций, и защищают антитела от разрушения, прикрывая места, чувствительные к протеолизу.
Участок тяжелых цепей, соединяющий СН1 с Fc-фрагментом молекулы антитела, называется шарнирной областью; они у γ-, α– и δ-цепей не похожи на домены. У каждого класса тяжелых цепей шарнирная область имеет своеобразное строение, они представляют наиболее вариабельную часть тяжелых цепей и в связи с этим обусловливают различия между классами иммуноглобулинов по аминокислотной последовательности и варьированию сегментной гибкости.
Антитела, будучи сложными гликопротеидными молекулами, сами по себе также являются антигенами. В их составе различают три типа антигенных детерминантов (эпитипов): изотипы, аллотипы и идиотипы.
Таблица 13
Биологические функции доменов иммуноглобулинов человека

Изотипы – детерминанты, по которым различаются классы и подклассы тяжелых цепей и варианты каппа– и лямбда– легких цепей.
Аллотипы – детерминанты, кодируемые аллелями данного иммуноглобулинового гена.
Идиотипы – антигенные детерминанты, образуемые активными центрами молекул антител.
Полное схематическое изображение структуры молекулы IgG представлено на рис. 64. На долю этого класса приходится около 75 % общего количества всех иммуноглобулинов сыворотки крови человека.
Электронно-микроскопические исследования показали, что антитела класса IgG – гибкие молекулы, имеющие Y-форму, в которой две «руки» представлены Fab-фрагментами, а «талия» – Fc-фрагментом. Молекула IgG имеет размеры 240 × 57 × 19. Иммуноглобулины других классов характеризуются таким же типом строения, имеются лишь некоторые различия в дополнительной организации их функциональных единиц.
IgM – иммуноглобулины класса М
На поверхности зрелых В-лимфоцитов молекулы IgM располагаются в виде мономеров. Однако в сыворотке они существуют в форме пентамеров: молекула IgM состоит из пяти структурных единиц, аналогичных IgG, которые соединены между собой дисульфидными связями и J-цепью. Пять мономерных субъединиц в молекуле располагаются радиально, их Fc-фрагменты обращены к центру, а Fab-фрагменты – кнаружи (рис. 65).

Рис. 65. Схема пентамерной молекулы IgM (по Д. Джеске, Дж. Капре, 1987)
Тяжелая цепь IgM (μ-цепь) состоит из 576 аминокислотных остатков, 124 из них образуют вариабельный домен, а 452 – четыре константных домена. Эта тяжелая цепь не имеет шарнирной области, ее роль выполняет домен СμН2, обладающий некоторой конформационной лабильностью. J-цепь (англ. join – соединять) представляет собой особый полипептид, необходимый для полимеризации IgM и IgA. Он имеет молекулярную массу 15 кД и состоит из 129 аминокислотных остатков и одного сложного углеводного компонента. Синтез J-цепи кодируется особым геном, расположенным в хромосоме, не содержащей генов иммуноглобулинов.
IgA – иммуноглобулины класса А
Иммуноглобулин А может иметь одну из трех форм: обычную, димерную или тримерную. В организме имеется два вида молекул IgA – сывороточные и секреторные. Сывороточные IgA составляют 10 – 15 % всех иммуноглобулинов. Секреторные IgA (IgAs), которые находятся в слюне, слизи, пищеварительных соках, секретах слизистой носа, в молозиве и обеспечивают местный иммунитет всех слизистых оболочек, состоят из двух Ig-мономеров, J-цепи и гликопротеина, или секреторного компонента (рис. 66).
У человека имеется два изотипа этого иммуноглобулина – IgA1 и IgA2, причем в сыворотке преобладает подкласс IgA1, а в экстраваскулярных секретах несколько больше содержится изотипа IgA2. Все α-цепи состоят из одного вариабельного домена, трех С-доменов и шарнирной области, домены Сα2 и Сα3 содержат по одной добавочной дисульфидной связи, которых нет у других классов иммуноглобулинов. Секреторный компонент вырабатывается эпителиальными клетками слизистых оболочек и присоединяется к молекуле IgA в момент прохождения последней через эпителиальные клетки. Секреторный компонент повышает устойчивость молекул IgAs к действию протеолитических ферментов. Иммуноглобулины А обладают следующими свойствами: 1) препятствуют связыванию антигенов со слизистыми оболочками; 2) осуществляют транспорт полимерных иммунных комплексов, содержащих IgA; 3) в процессе транспорта через эпителиальные клетки они нейтрализуют находящиеся в них вирусы. Значение иммуноглобулинов класса А в обеспечении местного иммунитета исключительно велико, так как общая площадь поверхности слизистой оболочки составляет несколько сот квадратных метров. Через нее происходит интенсивное экзогенное воздействие на иммунную систему. Но и сама слизистая активно участвует в формировании иммунитета. В ней содержится большое количество антителообразующих клеток. Лимфоциты слизистой оболочки синтезируют различные интерлейкины (IL-2, IL-4, IL-6), γ-интерферон. Клетки кишечного эпителия индуцируют пролиферацию супрессорных CD8-лимфоцитов, а респираторного – хелперных CD4-лимфоцитов.
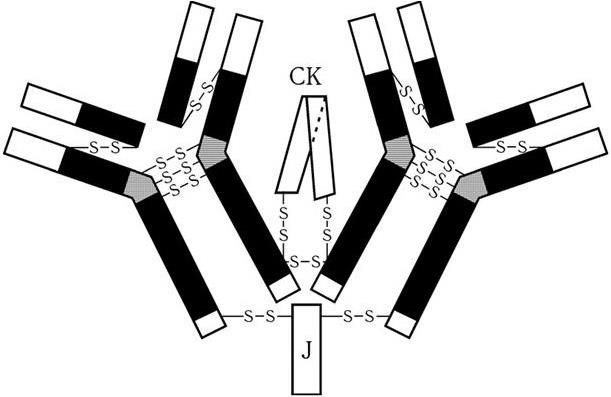
Рис. 66. Схема строения секреторного IgA человека. Соотношение размеров цепей соответствует истинному:
J – J-цепь; CK – секреторный компонент (по: Д. Джеске, Дж. Капре, 1987)
IgE – иммуноглобулины класса Е
Антитела этого класса содержатся в сыворотке крови в очень незначительных количествах. Молекулярная масса IgE составляет 190 кД, они содержат около 12 % углеводов. Тяжелая цепь (ε-цепь) состоит из 550 аминокислотных остатков, имеет один вариабельный и четыре константных домена. Основная роль антител этого класса заключается в том, что они своими Fc-фрагментами прикрепляются к мастоцитам и базофилам и опосредуют реакции гиперчувствительности немедленного типа.
IgD – иммуноглобулины класса D
IgD наряду с IgM являются главными мембранными рецепторами зрелых В-лимфоцитов. Тяжелая цепь (δ-цепь) состоит из вариабельного и трех константных доменов. Константная область δ-цепи человека построена из 383 аминокислотных остатков, следовательно, ее домены длиннее С-доменов γ– и α-цепей, но короче С-доменов ε– и μ-цепей. Шарнирная область δ-цепи – самая длинная, она состоит из 64 аминокислотных остатков, локализация углеводов в δ-цепи также необычна. Все это, возможно, имеет большое значение для функции IgD.
Под валентностью антител понимают количество способных реагировать с антигеном активных центров. В соответствии с указанными различиями молекулярной организации, иммуноглобулины разных классов бывают двухвалентными (IgG) или поливалентными (IgM). Являясь пентамерами, молекулы IgM имеют десять активных центров. Это свойство антител выявляется при взаимодействии их с антигенами: связываясь с аналогичными антигенными детерминантами, расположенными на разных, например бактериальных клетках, IgG и IgM вызывают их видимую агрегацию. Мономерные же молекулы IgA, хотя и имеют два активных центра, не осаждают антигены, так как их активные центры настолько сближены, что IgA не может выполнять роль связующего мостика.
Наряду с двухвалентными, или полными, антителами, при некоторых заболеваниях в организме человека накапливаются так называемые неполные, или моновалентные антитела. Соединяясь с антигеном, они не могут вызвать его агрегацию, так как связь между ними происходит только в одном из двух активных центров, а лишь блокируют его. Это не значит, что второй активный центр в таких антителах отсутствует. По неизвестным причинам он замаскирован, не проявляется. Присутствие неполных (блокирующих) антител выявляют с помощью антиглобулиновой реакции Кумбса (см. главу 42).
Особенности генетического контроля биосинтеза антител
Антитела могут быть получены к любому возможному антигену, общее количество которых превышает 107. Какие же механизмы обеспечивают появление огромного разнообразия иммуноглобулинов с различной антительной специфичностью? Антитела – это белки, а синтез каждого белка запрограммирован соответствующим геном. Генотип человека составляет около 100 000 генов. Поэтому долгое время вопрос о том, как осуществляется генетический контроль синтеза антител, оставался неясным, так как господствовал принцип: один ген – один белок. В 1965 г. У. Дрейер и Дж. Беннетт высказали предположение о том, что синтез иммуноглобулинов контролирует один для каждого класса С-ген и множество V-генов, расположенных отдельно от С-гена. Эта гипотеза нашла подтверждение в 1977 г. Используя набор рестриктаз, С. Тонегава с сотрудниками установили, что в эмбриональных клетках мышей участки ДНК, кодирующие V– и С-домены легкой цепи λ, находятся на далеком расстоянии друг от друга, а в зрелых клетках – значительно ближе. Клонирование этих генов показало, что в них отсутствуют нуклеотиды для 13 аминокислот. Они были обнаружены на расстоянии в несколько тысяч нуклеотидных пар от остальной части V-гена и получили название J-сегмента. Последний располагается около С-гена. Было установлено, что ген, кодирующий λ-цепь, имеет следующую экзон-интронную структуру: L (область, кодирующая лидерный пептид, необходимый для секреции иммуноглобулинов из клетки) – интрон – V-ген – интрон – J-ген – интрон – С-ген. В ДНК людей обнаружены шесть С-генов для λ-цепи, перед каждым из них имеется свой J-ген. Позднее было показано, что синтез γ-цепи контролируется 300 вариантами V-гена и 4 вариантами J-гена. Рекомбинации этих генов позволяют получить 1200 (300 × 4) вариантов различающихся по своей специфичности L-цепей.
Организация генов Н-цепи также имеет особенности:
1. Существует 9 разных С-генов, кодирующих С-домены Н-цепей различных изотипов (γ1, γ2, γ3, γ4, α1, α2, μ, ε, δ).
2. V-гены тяжелой цепи состоят не из двух сегментов, а из трех: V-, D-, J-. D-сегмент (англ. diversity – разнообразие) кодирует от 1 до 9 аминокислотных остатков.
3. Любой из V-генов тяжелой цепи может соединяться с любым из С-генов.
4. Все С-гены, как и V-гены, имеют экзон-интронную структуру. Каждый домен кодируется отдельным экзоном, между последними расположены интроны.
5. В ходе иммунного ответа V-гены тяжелой цепи могут переключаться с С-гена одного класса на С-гены другого класса, что приводит к появлению антител одной и той же антительной специфичности, но принадлежащих к разным классам (IgM, IgG, IgA, IgE, IgD).
В общей сложности синтез Н-цепей иммуноглобулинов контролируют 200 вариантов V-генов, 20 вариантов D-генов, 4 варианта J-генов и 9 вариантов С-генов. Схематически полный ген Н-цепи иммуноглобулинов выглядит таким образом: L-ген – интрон – V-ген – интрон – D-ген – интрон – J-ген – интрон – С-ген.
Организация генов иммуноглобулинов в эмбриональном и соматическом геномах различна. В эмбриональном геноме зародышевые V-гены (как L-цепи, так и Н-цепи) отделены от участков С-генов, D– и J-сегментов многими тысячами пар нуклеотидов. В соматических клетках эти сегменты сближаются, хотя по-прежнему сохраняют экзон-интронную структуру. Сборка V-генов и сближение их с D-, J– и С-генами происходят с помощью особых сигнальных последовательностей, которые расположены на 3'-концах всех зародышевых V-генов и в инвертированном виде – на 5'-концах всех зародышевых J-генов. У D-сегментов сигнальные последовательности располагаются и на 5'-, и на 3'-концах.
Формирование полного гена L-цепи молекулы иммуноглобулина происходит следующим образом. Путем рекомбинации вначале лидерный сегмент с его интроном сливается с одним из V– и с одним из J-генов. Одновременно при этом происходит их сближение с С-геном. Образующийся блок из экзонов и интронов транскрибируется в единую мРНК. После этого все интроны из нее вырезаются и формируется с помощью механизма сплайсинга зрелая мРНК, представленная только генами V, J, C, которая и транслируется в единую цепь.
Благодаря избирательному соединению одного из V-генов с одним из J-генов подавляется выражение остальных V– и J-генов в данной лимфоидной клетке. Таким же образом происходит формирование гена и для Н-цепи, только в нем участвует и D-сегмент. Кроме того, в случае образования Н-цепи имеется дополнительная рекомбинация, с помощью которой происходит переключение синтеза тяжелой цепи одного класса на синтез тяжелой цепи другого класса. Обычно вначале синтезируются иммуноглобулины класса IgM, а затем происходит переключение на синтез иммуноглобулинов класса IgG или других классов.
Таким образом, существует три системы генов иммуноглобулинов: две – для L-цепи (одна – для λ, другая – для χ) и одна – для Н-цепи.
Общее число возможных рекомбинаций для Н-цепей иммуноглобулинов составляет:
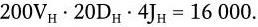
Общее же число возможных рекомбинаций для всех иммуноглобулинов составляет:
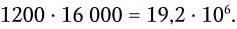
Точки объединения зародышевых генов строго не фиксированы. Это увеличивает количество возможных вариантов полипептидных цепей, а в том случае, когда они участвуют в формировании активных центров, то и их разнообразия. Кроме того, в период созревания В-лимфоцитов в V-генах происходят точечные соматические мутации, которые окончательно подгоняют структуру активного центра антитела к структуре детерминанта антигена. Считается, что общее количество вариантов антител возрастает за счет неточности сплайсинга и соматических мутаций еще в 100 раз и составляет около 2 млрд:
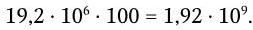
Таким образом, приобретенный иммунитет может быть обеспечен к любому возбудителю, к любому возможному чужеродному антигену. Решающий вклад в обеспечение многообразия иммуноглобулинов (специфичности антител) вносят следующие факторы:
1) наличие множества зародышевых генов иммуноглобулинов;
2) внутригенные рекомбинации, обусловленные экзон-интронной структурой V-, D-, J-, C-генов;
3) ассоциация различных L-цепей с различными Н-цепями;
4) неточность сплайсинга;
5) соматические мутации V-генов в зрелых В-лимфоцитах.
Роль антител в формировании иммунитета
Благодаря своей способности специфически взаимодействовать с бактериальными клетками и продуктами их жизнедеятельности, в том числе с токсинами и ферментами, а также с другими микроорганизмами, антитела играют важную роль в формировании приобретенного постинфекционного, поствакцинального и пассивного иммунитета. Эта их роль заключается в том, что связываясь с токсинами, они нейтрализуют их действие и обеспечивают формирование антитоксического иммунитета. Связываясь с вирусами, особенно блокируя рецепторы, с помощью которых они адсорбируются на клетках, антитела создают иммунитет против вирусов. Образование комплекса антитело + антиген запускает классический путь активации системы комплемента со всеми его эффекторными последствиями (лизис бактерий, опсонизация, формирование очага воспаления, стимуляция системы макрофагов). Антитела, взаимодействуя с бактериями, опсонизируют их, т. е. делают их фагоцитоз более эффективным. В результате взаимодействия антител с растворимыми антигенами, выделяющимися в кровь, образуются так называемые циркулирующие иммунные комплексы, с помощью которых антигены выводятся из организма, в основном, желчью и мочой.
Следовательно, специфически распознавая антигены и связываясь с ними, антитела стимулируют активность всех систем иммунитета и тем самым способствуют освобождению организма от чужеродных агентов.
Разные классы иммуноглобулинов в неодинаковой степени участвуют в различных иммунологических реакциях.
Высокая нейтрализующая активность антител, принадлежащих к IgG, свидетельствует о важной роли их в антитоксическом иммунитете. Антитела IgM особенно активны в реакциях фагоцитоза с корпускулярными антигенами и поэтому играют существенную роль в антимикробном иммунитете. В реакциях нейтрализации вирусов особенно активны антитела IgA, следовательно, им принадлежит большая роль в противовирусном иммунитете. Кроме того, секреторные IgAs обусловливают местный иммунитет слизистых оболочек. Наконец, антитела IgE, обладающие гомоцитотропностью, опосредуют реакции гиперчувствительности немедленного типа.
Выработка антител по первичному и вторичному иммунному ответу
Различают два варианта выдачи иммунного ответа в форме биосинтеза антител: первичный ответ – после первой встречи организма с данным антигеном, и вторичный ответ – при повторном контакте его с одним и тем же антигеном спустя 2 – 3 недели. Внешне первичный и вторичный иммунный ответ различаются по следующим признакам (рис. 67): продолжительность латентного периода, скорость нарастания титра антител, общее количество синтезируемых антител, последовательность синтеза иммуноглобулинов различных классов. Клеточные механизмы первичного и вторичного иммунного ответа, как будет показано ниже, также отличаются.
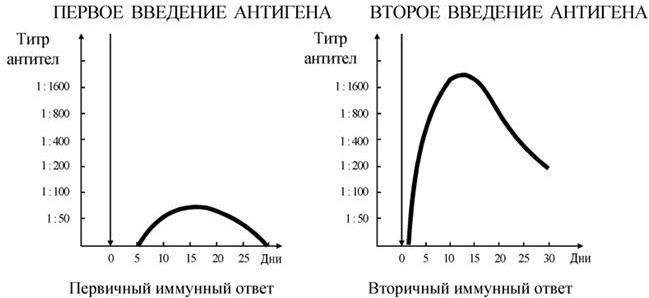
Рис. 67. Выработка антител при первичном и вторичном иммунном ответе
Первичный иммунный ответ. 1) Биосинтез антител начинается не сразу после контакта с антигеном, а после некоторого латентного периода, продолжающегося 3 – 5 дней. В течение этого периода происходит процесс распознавания антигена и формирования клеток, которые способны синтезировать антитела к нему; 2) скорость синтеза антител относительно невелика; 3) титры синтезируемых антител не достигают максимальных значений; 4) первыми синтезируются антитела, относящиеся к иммуноглобулинам класса IgM, затем IgG. Позже всех появляются, да и то не во всех случаях, IgA и IgE.
Вторичный иммунный ответ. 1) Латентный период очень непродолжительный, в пределах нескольких часов; 2) кривая, характеризующая скорость накопления антител, идет значительно круче вверх, чем при первичном ответе, и имеет логарифмический характер; 3) титры антител достигают максимальных значений; 4) синтезируются сразу антитела, относящиеся к классу IgG.
Вторичный иммунный ответ обусловлен формированием клеток иммунной памяти.
Существуют по крайней мере три системы регуляции продукции антител, или, в более широком плане, силы иммунного ответа. Одна из них действует на генетическом уровне, другая – на нейрогуморальном. Не исключено, что вторая подчинена первой. Давно было замечено, что введение одного и того же антигена индуцирует у разных индивидуумов данного вида появление различного количества антител: от нуля до высокого уровня. Исследование детей с наследственными иммунодефицитами позволило установить, что существуют разные генетические системы контроля иммунного ответа. Организм человека может быть неполноценным в отношении синтеза антител к определенному антигену или антител определенного класса иммуноглобулинов и в то же время выдавать нормальный иммунный ответ на другие антигены. Гены Ir, ответственные за силу иммунного ответа, тесно сцеплены с локусами главной системы гистосовместимости человека. Описано более 20 генов иммунного ответа.
Вместе с тем продукция антител регулируется и симпатико-адреналовой системой. Показано, что генерализованное возбуждение медиальных зон гипоталамуса ведет к резкому усилению продукции антител. Такой же эффект вызывает гормон роста, образуемый гипофизом. Наоборот, воздействие на симпатическую систему, ведущее к ослаблению адренергического звена регуляции, сопровождается сильным угнетением продукции антител вплоть до полного исчезновения их из сыворотки.
Третья система регуляции содержания антител связана с идиотип-антиидиотипическими отношениями.
Образование клеток иммунной памяти
Иммунная память – одна из форм иммунного ответа. Она означает способность организма человека или животного реагировать на повторное введение того антигена, которым он был иммунизирован ранее, быстрее и с большей силой. Иммунная память на клеточном уровне – это результат генерации особых антигенспецифических популяций T– и B-клеток памяти (Tп и Bп). Она проявляется как в отношении выработки антител, так и в отношении других форм иммунного ответа и может сохраняться долгое время.
Клетки памяти представляют собой ту часть Т– и В-антигенстимулированных лимфоцитов, которые после 2 – 3 делений переходят в покоящееся состояние и длительное время рециркулируют в организме. Таким образом, они служат своеобразным резервом иммунокомпетентных клеток, способных при повторной встрече с соответствующим антигеном быстро превращаться в клетки-эффекторы иммунного ответа. В-лимфоциты в этом случае быстро трансформируются в антителообразующие клетки, и выработка антител происходит по вторичному типу. В свою очередь антигенстимулированные Т-лимфоциты, циркулируя в организме, готовы в любой момент распознать антиген, который их сенсибилизировал, и немедленно включиться в иммунный ответ.
Следовательно, возникновение и поддержание популяции клеток иммунной памяти – одно из главных условий длительного сохранения приобретенного иммунитета. Состояние иммунной памяти обусловлено не столько присутствием долгоживущих клеток памяти, сколько постоянной стимуляцией их образования антигенами, которые длительно сохраняются в организме. Антигены могут долгое время сохраняться на поверхности фолликулярных дендритных клеток и в различных других клетках вне лимфоидной системы, постоянно воздействуя на иммунокомпетентные клетки.
Предполагается, что процесс дифференциации зрелых В-лимфоцитов в клетки памяти происходит на ранних стадиях иммунного ответа в зародышевых центрах, формирующихся в фолликулах лимфоидной ткани. Он зависит от сигнала, который получает митогенный рецептор В-клетки (мембранный белок CD40) от Т-хелпера. Этот сигнал и «разрешает» В-лимфоциту пойти по пути генерации клеток памяти. Сигнал В-лимфоциту передает мембранный рецептор Т-хелпера – гликопротеин gp39, который служит лигандом, т. е. связывающей молекулой, для белка CD40. Следовательно, формирование клеток памяти требует кооперативного участия В-клеток, Т-хелперов и фолликулярных дендритных клеток.
Антигензависимые неспецифические иммуноглобулины
У неиммунизированных людей и животных в сыворотке крови содержится около 2,5 – 7,0 % иммуноглобулинов, значительную часть которых составляют так называемые неспецифические иммуноглобулины (НИГ), т. е. иммуноглобулины с неустановленной антительной специфичностью. Поскольку их синтез также индуцируется данным антигеном, они получили название антигензависимых НИГ. Существует тесный параллелизм между образованием специфических и неспецифических иммуноглобулинов. Установлено, что антитела (специфические иммуноглобулины) и НИГ синтезируются клетками разных субпопуляций B-лимфоцитов. Количество НИГ при первичном иммунном ответе может превышать количество специфических антител в 10–100 раз. Синтез НИГ может быть индуцирован и в покоящихся B-клетках, но только при условии прямого контакта T– и B-клеток за счет антигенспецифического взаимодействия. У B-лимфоцитов есть маркер Ly-1 (СД5). По этому маркеру различают B-1a-лимфоциты (СД5+) и B-1b-лимфоциты (СД5–). Синтез антигенспецифических антител осуществляют лимфоциты B-2 («обычные» лимфоциты).
СД5 – типичный мембраносвязанный белок-рецептор. Он есть у большинства тимоцитов, всех зрелых Т-лимфоцитов и других клеток. Лиганды СД5 имеют разные клетки: лимфоидного, миелоидного и эпителиального происхождения, поэтому СД5+ B– и T-клетки взаимодействуют не только друг с другом, но и с другими клеточными популяциями. В отличие от B-2-лимфоцитов клетки B-1 используют ограниченный набор Ig-генов, поэтому они обладают специфическим антительным рецептором, главным образом IgM-изотипа, а их переключения на IgG-изотип практически не происходит, вследствие чего клетки B-1 продуцируют только IgM антитела, т. е. НИГ. Считается, что НИГ выполняют функции первой линии защиты от микробных и вирусных патогенов. Однако активация B-1a– и B-1b-клеток под действием микробных антигенов может быть и вредной. Установлено, что СД5+ B-клетки играют существенную роль в образовании аутоантител. Количество СД5+ B-клеток заметно увеличивается при ряде аутоиммунных заболеваний.
Моноклональные антитела – антитела, синтезируемые и секретируемые одним клоном антителообразующих клеток, т. е. клеток, генетически идентичных, происходящих из одного и того же зрелого В-лимфоцита. Поэтому все свойства моноклональных антител: класс иммуноглобулина, структура полипептидных цепей и активных центров, т. е. антительная специфичность, – идентичны. Они распознают только один антиген и взаимодействуют только с ним. В связи с этим значительно повышается и специфичность всех иммунологических реакций, протекающих с участием моноклональных антител. Образование в организме моноклональных антител было обнаружено давно, в частности при плазмоцитомах – при развитии лимфоидных опухолей. В этом случае в организме больного происходит размножение какого-то одного клона лимфоцитов. Синтезируемые ими миелоидные иммуноглобулины представляют собой моноклональные антитела, обладая одной и той же антительной специфичностью. Вместе с тем плазмоцитомные клетки способны, подобно другим раковым клеткам, бесконечно размножаться in vitro.
Искусственное получение клеток-продуцентов моноклональных антител оказалось возможным после того, как в 1975 г. Г. Кёлер и К. Мильштейн разработали методику получения клеточных гибридов – гибридоmм. Они осуществили слияние лимфоцитов селезенки мыши, иммунизированной бараньими эритроцитами, с культивируемыми клетками миеломы и установили, что некоторые из полученных гибридоmм секретируют антитела к бараньим эритроцитам. Для получения гибридmом были использованы такие штаммы миеломных клеток, которые не содержат фермента гипоксантинфосфорибозилтрансферазы и поэтому гибнут в селективной питательной среде – ГАТ (содержащей гипоксантин, аминоптерин и тимидин); лимфоциты в такой среде не погибают. Для слияния лимфоцитов с миеломными клетками был использован полиэтиленгликоль, так как под его влиянием сливаются преимущественно размножающиеся или активированные с помощью антигена В-лимфоциты. Возникающие при слиянии клеток гибридомы наследуют от иммунных В-лимфоцитов способность синтезировать иммуноглобулины только одной антительной специфичности и способность размножаться в селективной среде с ГАТ, а от миеломной клетки – способность к бесконечному размножению.
Процесс получения гибридmом довольно сложен и включает в себя следующие основные стадии:
1. Получение линии миеломных клеток. Чаще всего с этой целью применяют мышиные или крысиные клеточные линии.
2. Получение иммунных В-лимфоцитов (антителообразующих клеток) из селезенки иммунизированного соответствующим антигеном животного.
3. Создание таких условий в культурах смешанных клеток, при которых хотя бы некоторые клетки той и другой популяции могли осуществить слияние. Частота слияния относительно невелика: одна гибридома образуется примерно на 104 клеток.
4. Выделение гибридmом и отбор из них интересующего клона.
5. Накопление клеток полученного клона для его практического использования.
Образующиеся на всех стадиях клетки консервируют в жидком азоте, чтобы в любой момент можно было возвратиться на соответствующую стадию и сохранить нужные клоны. Отбор клеток интересующего клона, т. е. продуцирующих антитела заданной специфичности, – наиболее важная стадия гибридомной технологии, так как новообразованные гибридомы нередко являются нестабильными в отношении синтеза антител. Обнаруженные клоны антителообразующих гибридоmм должны быть немедленно реклонированы. Это связано с тем, что после слияния многие гибридные клетки начинают выбрасывать «лишние» хромосомы, пока число их не окажется равным диплоидному набору, поэтому существует опасность утраты той хромосомы, которая несет гены иммуноглобулинов. Путем клонирования полученных гибридоmм возможно разделить моноклональные антитела, специфичные в отношении одних и тех же или различных эпитопов одного антигена, т. е. получить набор моноклональных антител против различных, фактически любых, эпитопов определенной молекулы, или иммуногена. Одно из преимуществ гибридоmм заключается в том, что с их помощью можно получить неограниченное количество антител, которые сохраняют свою высочайшую специфичность и чувствительность. Моноклональные антитела используют для исследования структуры и функций разных частей молекул, а также различных типов клеток, например деталей строения рецепторов Т– и В-лимфоцитов.
Гибридомы можно создавать не только на основе В-лимфоцитов с целью получения моноклональных антител, но и на основе Т-лимфоцитов для получения клонов гибридmом, избирательно синтезирующих те или иные лимфокины. Этим термином обозначают не относящиеся к иммуноглобулинам белки и полипептиды, синтезируемые и секретируемые активированными Т-лимфоцитами. Идентифицированные лимфокины называют интерлейкинами.
Другие формы иммунного ответа. Реакции повышенной чувствительности
Действие антител проявляется немедленно и характеризуется специфичностью. Так, например, если в крови уже имеются антитоксины, то введенный токсин нейтрализуется сразу, как только с ним взаимодействует антитоксин. Соответственно введение иммунной сыворотки или γ-глобулина сразу же создает пассивный иммунитет против возбудителя или его токсина. Нейтрализация антителами возбудителей или их токсинов и обеспечивает состояние иммунитета к ним. Однако не во всех случаях антитела, образование которых индуцирует антиген, обусловливают невосприимчивость к нему. Иногда повторное введение некоторых антигенов, например сыворотки, приводит не к развитию состояния невосприимчивости, а, наоборот, вызывает повышение чувствительности к ней, которое проявляется в виде тяжелых реакций.
С. Рише и Г. Портье в 1902 г. высказали предположение, что такое повышение чувствительности к сыворотке обусловлено наличием в ней чужеродного белка. Своими опытами они показали, что первичное введение собакам экстрактов из актиний не вызывает у них каких-либо токсических проявлений. Однако повторное введение, сделанное через 2 – 9 нед., сразу же вызывало резкое ухудшение состояния собак. У них наблюдались слабость, нарушение дыхания, а некоторые собаки погибали. Смерть наступала даже в том случае, когда повторная доза была во много раз меньше первоначальной. С. Рише назвал эту реакцию анафилаксией (греч. ana – обратно, phylaxis – защита), т. е. состоянием беззащитности против данного яда. Сходные результаты были получены Г. П. Сахаровым в 1905 г. в опытах с повторным введением чужеродного сывороточного белка морским свинкам. Морские свинки, сенсибилизированные первичным введением лошадиной сыворотки, на ее повторное введение также отвечали резко повышенной чувствительностью, крайняя степень проявления которой получила название анафилактического шока. Особенностью этой формы повышенной чувствительности является немедленность ее проявления на повторное введение антигена.
В 1890 г. Р. Кох обнаружил другой тип реакций повышенной чувствительности. Он показал, что при подкожном введении больному туберкулезом туберкулина (антигенный препарат, представляющий собой фильтрат автоклавированной бульонной культуры возбудителя туберкулеза) через 6 – 12 ч на месте введения развивается туберкулиновая реакция: краснота, уплотнение, иногда припухлость. Максимального развития реакция достигает через 24 – 48 ч.
Таким образом, различают два типа повышенной чувствительности: гиперчувствительность немедленного и замедленного типов. Поскольку эти реакции на повторное введение антигена отличаются от обычных реакций иммунитета, они получили название аллергических (греч. allos – другой, ergo – реакция, действие).
Гиперчувствительность немедленного типа
К реакциям гиперчувствительности немедленного типа (ГЧН) относятся: сывороточная анафилаксия, лекарственная анафилаксия, сывороточная болезнь, сенная лихорадка, бронхиальная астма, крапивница и другие аллергические реакции, в том числе к таким аллергенам, как пыльца некоторых растений, красители, шерсть и т. п. В их основе лежат общие механизмы, которые лучше всего изучены при анафилаксии.
Реакции анафилаксии, как и другие реакции гиперчувствительности немедленного типа, являются иммунологически специфичными и проявляются в отношении того антигена, к которому организм сенсибилизирован. Для возникновения состояния сенсибилизации достаточно введения очень малых доз антигена (аллергена). В частности, первичная сенсибилизирующая доза лошадиной сыворотки для морской свинки составляет 0,000001 мл. Состояние повышенной чувствительности развивается через 7 – 14 дней после введения антигена и сохраняется месяцами и годами. Для его выявления вводят внутривенно вторую, разрешающую дозу антигена. Если разрешающую дозу ввести не внутривенно, а внутрикожно, то развивается местная анафилаксия (феномен Артюса). Она характеризуется появлением через 30 – 60 мин на месте введения отека и развитием гиперемии. В последующем воспалительный очаг уплотняется, подвергается некрозу и рубцеванию.
Реакция анафилаксии характеризуется следующими особенностями: иммунологической специфичностью, немедленностью проявления (анафилактический шок развивается через несколько минут после введения разрешающей дозы) и опосредованностью антителами. Доказательством ведущей роли антител в реакциях гиперчувствительности немедленного типа (ГЧН) является возможность переноса состояния повышенной чувствительности от сенсибилизированного донора с помощью его сыворотки или чистой фракции антител несенсибилизированному реципиенту. Такой пассивный перенос анафилаксии с помощью антител приводит к развитию у реципиента состояния повышенной чувствительности, которая может быть выявлена введением ему разрешающей дозы антигена. Другим доказательством роли антител в ГЧН является реакция Праустница – Кюстнера: если сыворотку человека, сенсибилизированного каким-то антигеном, ввести внутрикожно здоровому нормальному реципиенту, а затем ввести аллерген в это же место, то наступит характерная местная реакция ГЧН.
В развитии анафилаксии можно выделить следующие три стадии: 1) иммунологическую, 2) патохимическую и 3) патофизиологическую. Иммунологическая стадия, которая определяет специфичность анафилаксии, характеризуется взаимодействием антигена с антителом, фиксированным на клетках сенсибилизированного организма. Для патохимической стадии характерна активация протеолитических ферментов, в результате действия которых из клеток высвобождаются биологически активные вещества. В настоящее время известно более 30 таких веществ, участвующих в механизме развития анафилаксии, однако основная роль принадлежит гистамину, серотонину, брадикинину и лейкотриенам. Лейкотриены A, B, C, D, E – продукты липоксигеназного превращения арахидоновой кислоты – освобождаются тучными клетками, базофилами и тромбоцитами. Патофизиологическая стадия развивается в результате действия биологически активных веществ на различные системы органов, в особенности на гладкую мускулатуру. Наблюдающееся в результате такого воздействия сокращение гладких мышц определяет клиническую картину анафилактического шока у животных. В частности, у морских свинок поражается гладкая мускулатура бронхов, что ведет к развитию бронхиального спазма. У собак наблюдается спазм гладкой мускулатуры кишечника, у кроликов – спазм легочных артерий, у человека страдает сердечно-сосудистая система. К наиболее характерным симптомам анафилактического шока относятся: гипотония, учащение мочеиспускания и дефекации, отек, лейкопения, тромбоцитопения, снижение титра комплемента, понижение свертываемости крови и температуры тела.
Основную роль в механизме анафилаксии и других реакций гиперчувствительности немедленного типа играет процесс взаимодействия с антигеном антител, фиксированных на клетках, которые в результате этого взаимодействия высвобождают биологически активные вещества. Клетками, способными высвобождать медиаторы данного типа повышенной чувствительности (гистамин, брадикинин и т. п.), являются мастоциты и базофилы. Мастоциты находятся в соединительной ткани почти всех органов. Свойством фиксироваться на тучных клетках и базофилах обладают антитела, относящиеся к классу IgE. Ранее, пока природа этих антител не была еще установлена, они получили название реагинов. Особенностью антител IgE является отсутствие у них способности фиксировать комплемент и проникать через плаценту. Полагают, что помимо участия в реакциях ГЧН, антителам IgE принадлежит определенная роль в формировании местного иммунитета.
Цитофильные свойства этих иммуноглобулинов связаны с наличием особых рецепторов, которые располагаются в области Fc-компонента молекулы антитела. Иногда это свойство (цитофильность) называют гомоцитотропностью, т. е. сродством к клеткам собственного вида, или гетероцитотропностью, когда это сродство проявляется по отношению к клеткам другого вида животного. У человека и у некоторых животных антитела, относящиеся к классу IgE, обладают гомоцитотропностью, а гетероцитотропностью – иммуноглобулины IgG-1, IgG-3, IgG-4.
В самом общем виде механизм анафилаксии может быть описан следующим образом. Введение сенсибилизирующей дозы антигена индуцирует образование специфических антител, в том числе относящихся к классу IgE. Благодаря своей цитофильности последние фиксируются на поверхности тучных клеток и базофилов. Этот процесс и лежит в основе сенсибилизации организма к данному антигену. Попадая повторно в организм, он распознается антителами, фиксированными на клетках, и быстро вступает во взаимодействие с ними. Следствием этого является активация протеаз клеток, в результате которой высвобождаются медиаторы, опосредующие патофизиологическую основу анафилактического шока.
Таким образом, одним из необходимых условий развития анафилаксии является наличие доступа антигена к антителам, фиксированным на клетках. Если в крови циркулирует достаточное количество антител, обладающих такой же специфичностью, но относящихся к другим классам иммуноглобулинов (IgG, IgM), они распознают и блокируют его активные центры. Такой нейтрализованный антиген уже не может взаимодействовать с антителами IgE, фиксированными на клетках, поскольку его детерминантные группы блокированы. В случае, если специфичных к данному антигену и свободно циркулирующих в крови антител мало, антиген беспрепятственно достигает клеток, на которых располагаются антитела IgE. Следовательно, для предотвращения реакции ГЧН необходимо индуцировать образование антител, которые бы препятствовали доступу соответствующего антигена к антителам, фиксированным на клетках, т. е. антител классов IgG и IgM.
Развитие анафилактического шока можно предупредить с помощью различных лекарственных препаратов, например атропина, димедрола, эфирного наркоза, а также других веществ с различным механизмом действия (сапонин, желчно-кислотные соли и т. п.). Вместе с тем установлено, что если животное благополучно перенесло анафилактический шок, оно утрачивает на некоторое время (2 – 3 нед.) чувствительность к данному антигену. Такое же состояние десенсибилизации может быть достигнуто путем введения сенсибилизированному животному небольших разрешающих доз специфического антигена. В связи с этим А. М. Безредка предложил для предупреждения сывороточного анафилактического шока перед введением большой дозы сыворотки вводить сначала небольшую ее часть (0,5 – 1,0 мл) подкожно или несколько более мелких, но постепенно возрастающих доз внутривенно с интервалом 15 – 30 мин.
Реакции гиперчувствительности замедленного типа
Этот тип гиперчувствительности возникает при многих инфекционных болезнях, например при туберкулезе, бруцеллезе, дизентерии, токсоплазмозе, некоторых гельминтозах, микозах и т. д., и выявляется с помощью соответствующих кожных реакций, которые служат специфическими диагностическими пробами. Состояние гиперчувствительности замедленного типа могут индуцировать различные лекарственные препараты, красители, антисептики и другие аллергены. К аллергенам органической и неорганической природы, имеющим низкую молекулярную массу, но обладающим способностью соединяться с белками кожи и слизистых оболочек (т. е. являющимся гаптенами), нередко возникает так называемая контактная аллергия. Сенсибилизация формируется в результате длительного контакта с такими веществами и проявляется в местных изменениях на коже и слизистых оболочках. Наиболее типичным примером повышенной чувствительности замедленного типа является аллергическая реакция кожи больных туберкулезом людей и животных на туберкулин. К реакциям гиперчувствительности замедленного типа относится также трансплантационный иммунитет.
Основные особенности гиперчувствительности замедленного типа. Гиперчувствительность замедленная (ГЧЗ), как и повышенная чувствительность немедленного типа, индуцируется веществами антигенной природы и отличается высокой иммунологической специфичностью, т. е. она проявляется только в отношении того антигена, который индуцировал ее развитие. В связи с этим кожные аллергические пробы, выявляющие эти состояния, имеют большое диагностическое значение. Основные отличия гиперчувствительности замедленного типа от повышенной чувствительности немедленного типа следующие.
Во-первых, местные и общие реакции, выявляющие гиперчувствительность замедленного типа, развиваются спустя значительно больший срок после введения антигена, чем в случае гиперчувствительности немедленного типа. В частности, кожные реакции в этом случае появляются через 6 – 8 ч и достигают максимального развития через 1 – 2 суток. Интенсивность ГЧЗ определяют по диаметру уплотненного участка ткани на поверхности кожи, лишенной волос. Таким образом, для реакции повышенной чувствительности замедленного типа характерно отсутствие эффекта немедленности.
Во-вторых, гистологическая картина местных проявлений гиперчувствительности замедленного действия отличается от таковой при повышенной чувствительности немедленного типа тем, что в очаге реакции преобладают лимфоциты и моноциты. В развитии кожной реакции, выявляющей гиперчувствительность немедленного типа, преобладающую роль играют полиморфно-ядерные лейкоциты.
В-третьих, гиперчувствительность замедленного типа не может быть передана пассивно от сенсибилизированного организма с помощью его сыворотки интактному (несенсибилизированному) организму, т. е. этот тип повышенной чувствительности не связан с антителами.
Главное отличие реакций гиперчувствительности замедленного типа от реакций гиперчувствительности немедленного типа заключается в том, что они опосредуются не антителами, а сенсибилизированными клетками – Т-лимфоцитами, т. е. лимфоцитами, которые прошли иммунологическое «обучение» в тимусе. Т-лимфоциты несут на своей поверхности различные специфические рецепторы, с помощью которых распознают самые различные чужеродные вещества, в том числе трансплантационные антигены, и способны с ними взаимодействовать. Все типы реакций гиперчувствительности замедленного действия характеризуются общностью иммунологических механизмов, в которых главными действующими агентами являются лимфоциты и продуцируемые ими гуморальные факторы. Опосредуемость этих реакций лимфоцитами подтверждается многими феноменами среди которых в первую очередь можно выделить следующие три.
1. Состояние повышенной чувствительности замедленного типа можно передать от донора другому организму, но только путем введения последнему от сенсибилизированного организма его лимфоцитов, а не антител. В отличие от пассивного, такой тип иммунного состояния, передаваемого не сывороткой, а лимфоцитами, получил название адоптивного (англ. adopt – присваивать), т. е. присвоенного. Например, если от сенсибилизированного туберкулином животного передать внутривенно или внутрибрюшинно лимфоидные клетки здоровому животному, то оно будет отвечать на введение туберкулина положительными кожными реакциями гиперчувствительности замедленного типа.
2. Реакции гиперчувствительности замедленного типа можно подавить или ослабить, если перед введением разрешающей дозы аллергена ввести антилимфоцитарную сыворотку.
3. С реакцией ГЧЗ хорошо коррелирует способность сенсибилизированных Т-лимфоцитов синтезировать различные медиаторы – лимфокины, в том числе фактор, ингибирующий миграцию макрофагов (ФИМ). Он образуется при стимуляции сенсибилизированных Т-лимфоцитов in vitro соответствующим антигеном. Добавление питательной среды, содержащей ФИМ, к клеткам перитонеального экссудата морской свинки в стеклянных вертикальных капиллярах будет подавлять или ограничивать выход лейкоцитов из капилляров. Несенсибилизированные Т-лимфоциты этим свойством не обладают. Со способностью к реакциям коррелирует и такой признак сенсибилизированных Т-лимфоцитов, как стимуляция их пролиферации in vitro с помощью соответствующего антигена. Т-лимфоциты, участвующие в реакциях гиперчувствительности замедленного типа, обозначают как ТГЧЗ, они имеют обычно фенотип Lyt-1+2—, т. е. обладают специфическими рецепторами, с помощью которых осуществляют свои функции. Популяции таких ТГЧЗ-клеток можно лишить иммунологической компетентности, если обработать их антителами против этих рецепторов. Таким образом, можно считать окончательно установленным, что реакция ГЧЗ является одной из форм иммунного ответа, опосредуемого сенсибилизированными Т-лимфоцитами (ТГЧЗ) и выявляемого в виде характерного воспаления в месте введения (обычно в коже) антигена, который индуцировал ее развитие. Для проявления своей активности ТГЧЗ-клетки также нуждаются в представлении им антигенов с помощью молекул МНС класса I или класса II. Реакции ГЧЗ (т. е. сенсибилизацию клеток ТГЧЗ) могут индуцировать различные белковые антигены – агенты, вызывающие контактную аллергию, а также антигены бактерий, вирусов, грибов и простейших. Установлено, что клетки, сходные с клетками ТГЧЗ, имеющими фактор Lyt-1+, распознают антигены опухолей и играют важную роль в противоопухолевом иммунитете.
Под трансплантационным иммунитетом понимают отторжение генетически отличающегося от хозяина трансплантата. Хотя по отношению к антигенам трансплантата организм также может вырабатывать антитела, главная роль в механизме трансплантационного иммунитета, как и всех реакций гиперчувствительности замедленного типа, принадлежит популяции Т-лимфоцитов, которые получили название Т-цитотоксических лимфоцитов, или Т-киллеров. Ведущая роль лимфоцитов в реакциях трансплантационного иммунитета подтверждается следующими феноменами:
1. Феномен «трансплантат против хозяина». Клетки лимфоидной ткани, пересаженные в генетически отличающийся организм, продолжают вести себя так же, как и в собственном организме, – в соответствии со своей главной функцией они распознают клетки нового хозяина как генетически чужеродные, атакуют и разрушают их.
2. Трансфер-реакция (местное проявление реакции «трансплантат против хозяина»). Суть этого явления в том, что если организму, который был предварительно сенсибилизирован трансплантатом аллогенного донора, ввести внутрикожно лимфоциты того же донора, через 24 – 48 ч на месте введения наблюдается кожная реакция, аналогичная туберкулиновой. Подобная реакция может быть воспроизведена, хотя и не в столь резкой форме, при внутрикожном введении и неиммунных лимфоцитов, но обязательно от генетически чужеродного донора.
В основе этой реакции лежит все то же свойство Т-лимфоцитов – способность распознавать чужеродные антигены и реагировать на них. Из экстрактов сенсибилизированных Т-лимфоцитов выделен фактор переноса гиперчувствительности замедленного типа – трансфер-фактор (англ. transfer factor). Трансфер-фактор, ответственный за перенос ГЧЗ от иммунных доноров к неиммунным реципиентам, имеет м. м. около 10 кД и содержит два противоположно действующих начала, индуцирующих хелперную и супрессорную активность.
Цитотоксические Т-лимфоциты относятся к субпопуляции, несущей специфические рецепторы Lyt-2 и Lyt-3.
Механизм действия Т-цитотоксических лимфоцитов
Осуществляемое Т-клетками разрушение клеток чужеродной ткани не зависит ни от антител, ни от комплемента, однако оно требует тесного контакта между Т-лимфоцитами и клеткой-мишенью. Последняя лизируется в результате однократного взаимодействия с Т-цитотоксической клеткой. Такой эффект осуществляют только живые Т-клетки. После взаимодействия с клеткой-мишенью и ее уничтожения Т-клетки остаются живыми и сохраняют способность взаимодействовать с другими клетками-мишенями. Следовательно, процесс Т-цитотоксического лизиса носит циклический характер. Взаимодействие Т-клеток с клеткой-мишенью складывается из трех последовательных стадий: а) межклеточное взаимодействие; б) стадия программирования лизиса; в) летальный удар – разрыв мембраны клетки-мишени и выход содержимого цитоплазмы.
Для литической активности Т-клеток обязательным условием является их непосредственный контакт с клеткой-мишенью; если его исключить, то разрушения последних не произойдет. Рецепторы Т-клеток распознают поверхностные антигенные детерминанты клетки-мишени и связываются с ними. Этот процесс требует присутствия ионов Mg2+. После установления непосредственного контакта между Т-клетками и клетками-мишенями происходят какие-то метаболические процессы, приводящие к нанесению летального повреждения в структуре мембраны клетки-мишени. Заключительный этап действия Т-лимфоцитов на клетку-мишень получил название летального удара, приводящего к лизису клетки-мишени. Для этой стадии требуется наличие ионов Ca2+.
Содержащийся в Т-цитотоксических клетках особый белок перфорин после внедрения в мембрану клетки-мишени в присутствии ионов Ca2+ полимеризуется и образует внутримембранные каналы диаметром от 5 до 16 нм. Через эти каналы-поры в клетку-мишень проникает вода, клетка набухает и гибнет в результате осмотического шока. Таким образом, механизм цитотоксического действия Т-цитотоксических лимфоцитов и клеток NK очень напоминает механизм действия мембраноатакующего комплекса, образуемого компонентами комплемента (C5b, C6, C7, C8, C9).
Помимо Т-цитотоксических лимфоцитов и клеток NK, способноcтью оказывать литическое действие на клетки-мишени обладают и другие эффекторные клетки. Общим их свойством является наличие у них мембранного рецептора для Fc-фрагмента антител класса IgG. К таким клеткам-эффекторам, проявляющим цитотоксическую активность по отношению к клеткам-мишеням, обработанным антителами, относятся полиморфно-ядерные лейкоциты, макрофаги, клетки эмбриональной печени, а также популяция лимфоидных клеток, которая не имеет характерных для Ви Т-лимфоцитов маркеров. Эти лимфоциты получили название «нулевых клеток». Популяция «нулевых клеток» состоит как из цитотоксических, так и нецитотоксических клеток. Нулевые клетки, обладающие цитотоксичностью лишь в присутствии антител класса IgG, получили название К-клеток (англ. killer – убийца).
Зависимый от антител К-клеточный лизис, как и цитотоксическая активность Т-лимфоцитов и NK-клеток, требует непосредственного контакта К-клетки с клеткой-мишенью. Роль антител в К-клеточном лизисе достаточно сложна: в этот процесс вовлекаются как Fc-фрагмент, так и домен, несущий активный центр. Антитела выполняют роль мостика между К-клеткой и клеткой-мишенью.
Механизм литического действия К-клеток, по-видимому, сходен с механизмом лизиса, вызываемого Т-цитотоксическими лимфоцитами и NK-клетками. Хотя популяция К-клеток фенотипически сходна с популяцией NK-клеток, функционально они существенно различаются: NK-клетки лизируют клетки-мишени в отсутствие антител, а К-клеткам для проявления литической активности необходимо присутствие антител класса IgG. Имеются данные о том, что, подобно NK-клеткам, К-клетки также играют важную роль в подавлении роста опухолевых клеток.
Иммунологическая толерантность
Под иммунологической толерантностью (отсутствием иммунного ответа) понимают специфическое подавление иммунного ответа, вызванное предварительным введением антигена. Толерантность может проявляться в подавлении специфического иммунного ответа, включающего и синтез антител на соответствующий антиген, и гиперчувствительность замедленного типа, или же избирательно влияет на синтез антител того или иного класса иммуноглобулинов либо на тип иммунного ответа.
Толерантность может быть полной (образования антител не происходит) либо частичной (существенное снижение иммунного ответа).
Изучение механизма иммунологической толерантности стало особенно интенсивным после того, как в 1945 г. Р. Оуэн обнаружил, что у дизиготных, т. е. генетически отличающихся телят-двоен после рождения и на протяжении последующей жизни в крови циркулируют эритроциты обоих организмов, а кожный трансплантат, пересаженный от одного из них другому, стойко приживается. В 1949 г. Ф. Бернет и Ф. Феннер, исходя из того, что животные отвечают образованием антител и гиперчувствительностью замедленного типа на все чужеродные антигены, но не дают иммунного ответа на собственные антигены, сформулировали гипотезу о том, что еще в эмбриональном периоде организм способен различать «свои» и «чужие» антигены. Они предположили, что в результате воздействия на лимфоидную систему собственных антигенов во время эмбрионального развития, пока еще иммунная система не созрела, у животного формируется специфическая толерантность к антигенам собственных тканей. Поэтому, если воздействовать чужеродным антигеном на животное до созревания его иммунной системы, то такой антиген впоследствии будет распознаваться как собственный, и он не станет вызывать иммунного ответа. Это положение нашло подтверждение в опытах П. Медавара [и др.]. Они показали, что у мышей, которым вводили в эмбриональном периоде кроветворные клетки, аллотрансплантат, взятый от донора этих клеток, приживляется на длительный срок. Следовательно, введение антигена эмбриону не только не вызывает обычных иммунологических реакций, направленных на удаление этого антигена, а, наоборот, индуцирует развитие к нему толерантности. Состояние иммунологической толерантности к различным антигенам возможно получить искусственно, что позволило выяснить его основные механизмы.
Для иммунологической толерантности, как одной из форм иммунного ответа, характерны следующие особенности.
Во-первых, развитие этого состояния индуцируется только веществами антигенной природы. Во-вторых, толерантность иммунологически специфична. Она проявляется только в отношении того антигена, который индуцировал ее формирование. В-третьих, искусственно полученная толерантность проявляется в разной степени, и продолжительность ее сохранения сильно варьирует. Это зависит от периода жизни, во время которого индуцируется развитие толерантности, от характера используемого для этой цели антигена, его дозы, физических свойств и способа введения, а также от физиологического состояния организма.
Эффективнее всего развитие толерантности удается индуцировать в эмбриональном периоде, хотя ее можно вызвать и у взрослых животных. Однако чем позднее, тем это состояние индуцируется труднее и большей дозы антигена требует. Чем больше доза антигена, тем выше степень толерантности и тем дольше она сохраняется.
Определенные способы введения антигена, не вызывающие иммунного ответа, приводят к развитию толерантности. Например, возникновение толерантности стимулирует введение в желудок через зонд. Как правило, ее очень легко вызывают такие неметаболизируемые антигены, как микробные полисахариды. Установлено, что уменьшение молекулярной массы антигена при сохранении его специфичности снижает способность вызывать иммунный ответ, но повышает толерантную активность. Индукция специфической толерантности облегчается, если использовать в качестве носителя детерминантов неиммуногенные для данного животного антигены. В частности, гаптены, конъюгированные с сингенными клетками селезенки, легко индуцируют гаптен-специфическую толерантность.
Толерантность тем труднее индуцировать, чем больше степень генетической чужеродности антигена для данного организма. Наконец, для поддержания состояния иммунологической толерантности важно постоянное присутствие антигена (например, постоянный клеточный химеризм у телят-двоен).
Развитие иммунологической толерантности во многом зависит от физиологического состояния организма. Любые воздействия, подавляющие иммунный ответ, будут способствовать развитию толерантности. Пороговая доза антигена для индукции толерантности у иммунодепрессированных близка к таковой у новорожденных животных.
Необходимость создания иммунологической толерантности во взрослом состоянии всегда возникает при аллотрансплантации для преодоления трансплантационного иммунитета. В этих случаях прибегают к облучению организма реципиента рентгеновскими лучами или использованию химиопрепаратов, подавляющих биосинтез ДНК и размножение клеток лимфоидной ткани. Такими иммунодепрессивными препаратами являются 6-меркаптопурин, аметоптерин, акрифлавин, циклофосфамид, а также антилимфоцитарная сыворотка. Очень сильным супрессором иммунной системы является антибиотик циклоспорин А. Это циклический пептид из 11 аминокислотных остатков, его молекулярная масса около 1,2 кД, он выделен из плесневого гриба Trichoderma polysporum. Иммунодепрессивное действие циклоспорина А связано с тем, что он подавляет синтез интерлейкина-2, а также экспрессию молекул МНС класса II, рецептора к интерлейкину-1 и рецептора к интерлейкину-2. Однако широкому применению циклоспорина А при пересадке органов и тканей препятствует его токсическое действие на почки.
Механизм иммунологической толерантности
Условия развития индуцированной иммунологической толерантности указывают на то, что в ее основе лежат различные механизмы. Они реализуются в зависимости от природы антигена, индуцирующего возникновение толерантности, особенностей его применения и в значительной мере – от состояния организма хозяина. В некоторых случаях она возникает как следствие элиминации или постоянной инактивации специфических Т– и В-лимфоцитов в популяции периферических лимфоцитов. Если при дифференцировке В-лимфоцитов не произойдет образования достаточного количества клеток иммунной памяти, это приведет к состоянию толерантности, которое будет продолжаться до тех пор, пока из клеток костного мозга не образуются новые зрелые В-лимфоциты с данной антительной специфичностью. В других случаях толерантность может быть опосредована действием пассивно введенных антител, которые будут быстро выводить толероген и тем самым предотвращать его действие. Возможно, этому способствует стимуляция введенными антителами синтеза антиидиотипических антител.
Толерантность может быть следствием антигенных перегрузок: все образующиеся антитела связываются имеющимся в большом количестве в организме антигеном, а комплекс антиген + антитело подвергается фагоцитозу, и в сыворотке не остается свободных антител. В соответствии с теорией идиотип-антиидиотипических отношений, антиидиотипические антитела могут подавлять образование антител, несущих данный идиотип, и поэтому способны поддерживать состояние специфической толерантности к нему. Однако основную роль в формировании иммунологической толерантности, и прежде всего к антигенам собственных тканей, играют определенные изменения в функциях различных популяций Т– и В-лимфоцитов. В 1974 г. среди Т-лимфоцитов была обнаружена особая популяция клеток, получивших название Т-супрессоров. Т-супрессоры обладают способностью подавлять активность Т-хелперов 1 и 2. Вследствие этого предотвращается трансформация В-лимфоцитов в антителообразующие клетки, с одной стороны, и образование Т-эффекторных клеток (Т-цитотоксических и ТГЧЗ-лимфоцитов) – с другой. Иначе говоря, Т-супрессоры предотвращают образование клеток-эффекторов против данного антигена. Позднее появились данные о существовании супрессорных клеток и среди В-лимфоцитов. Эти два вида клеток – Т-супрессоры и В-супрессоры – и являются ответственными за развитие иммунологической толерантности. В организме эмбриона и новорожденного человека и животного Т-супрессоры предотвращают образование клонов Т-цитотоксических клеток. Этим самым они способствуют развитию толерантности к собственным антигенам и предотвращают иммунный ответ со стороны лимфоцитов матери на аллоантиген новорожденного, т. е. сохраняют его жизнь. Эта главная функция Т-супрессоров заканчивается к концу первой недели жизни новорожденного. К этому времени у него возникает новая специальная популяция клеток – Т-клетокконтрсупрессоров. Они продуцируют свой собственный лимфокин – специфический фактор, взаимодействующий с Т-хелперами. Благодаря этому фактору Т-хелперы становятся устойчивыми к Т-супрессорам и их факторам. Между различными популяциями Т– и В-лимфоцитов существуют сложные взаимоотношения, опосредуемые разнообразными лимфокинами, от которых зависят форма и выражение иммунного ответа.
Таким образом, благодаря действию Т-супрессоров, еще в эмбриональном периоде и в первые дни жизни после рождения предотвращается трансформация тех клонов В-лимфоцитов, которые имеют рецепторы к антигенам собственных тканей, в антителообразующие клетки, а Т-лимфоцитов – в Т-цитотоксические лимфоциты, способные разрушать собственные ткани.
Следовательно, состояние толерантности не характеризуется вообще отсутствием иммунной реакции на данный антиген. Иммунологическая толерантность опосредуется активностью особых регуляторных лимфоцитов – Т– и В-супрессоров. Поэтому иммунологическая толерантность представляет собой особую форму иммунного ответа, характеризующуюся запретом, налагаемым Т– и В-супрессорами на образование клеток-эффекторов против данного, в том числе собственного, антигена.
Идиотип-антиидиотипические отношения
Как уже отмечалось, в молекуле иммуноглобулина содержится три типа антигенных детерминантов: изотипы, аллотипы и идиотипы.
Идиотипами называют антигенные детерминанты, определяемые структурой активных центров антител, т. е. структурой вариабельных областей L– и Н-цепей. Собственно, под идиотипом понимают набор идиотопов, свойственный антителам, синтезируемым данным клоном В-клеток. В свою очередь, идиотоп – один из собственных антигенных детерминантов активного центра молекул антител, продуцируемых одним или небольшим числом близких клонов В-клеток. Идиотипические детерминанты обнаруживают и типируют с помощью антиидиотипических антител.
В 1974 г. Н. Ерне высказал идею о том, что иммунная система представляет собой сеть взаимодействующих идиотипов и антиидиотипов. Одно из положений этой теории заключается в том, что для каждого антитела с его идиотипом (АТ1) существует комплементарное антитело, способное связываться с этим идиотипом (АТ2), т. е. выступающее как антиидиотип. Однако такое антитело имеет также и свой идиотип, определяемый структурой его активного центра. Так как у неиммунизированных животных содержание антител и клонов клеток, их синтезирующих, по-видимому, постоянно, то, по мнению Н. Ерне, взаимодействие антител-антиидиотипов с мембранными иммуноглобулиновыми рецепторами лимфоцитов, которые имеют структуру идиотипа, будет подавлять (супрессировать) образование антител идиотипов. Иначе говоря, антиидиотипы подавляют синтез идиотипов. Наоборот, действие антител идиотипов на лимфоциты, несущие иммуноглобулиновые рецепторы типа антиидиотипов, будет стимулировать размножение этих клеток и синтез антиидиотипов. Таким образом, одним из механизмов регуляции функционирования иммунной системы (содержания антител) является механизм сетевого сбалансированного взаимодействия между идиотипами (идиотипами антител) и антиидиотипами (иммуноглобулиновыми лимфоцитарными рецепторами, активные центры которых определяют специфичность антиидиотипов). Как было установлено позднее, антитела могут возникать и против антиидиотипов (АТ3). Они сходны с исходными идиотипами (АТ1), а антитела против анти-антиидиотипов (АТ4) сходны с АТ2. В значительной степени благодаря этому взаимодействию в организме поддерживается оптимальный в данный момент уровень антител. В идиотип-антиидиотипической регуляции принимают участие и Т-лимфоциты.
Идиотипические детерминанты обнаружены в антигенсвязывающих рецепторах В– и Т-клеток. Это свидетельствует о том, что такие участки могут играть важную роль в осуществлении лимфоцитами своих функций, а иммунная система действительно представляет собой сеть вариабельных участков, поскольку идиотипические детерминанты В– и Т-лимфоцитов ассоциированы с их мембранными рецепторами. Равновесие между клонами В– и Т-лимфоцитов, основанное на идиотипических связях, играет существенную роль в физиологии иммунной системы, а его нарушение может стать причиной аутоиммунных заболеваний.
Клеточные основы иммунитета. Органы иммунитета
Иммунитет, как и любая другая функция организма, исполняется своим особым органом. Однако, в отличие от всех остальных, этот орган не является анатомически единой обособленной структурой, а состоит из совокупности расселенных по всему организму и свободно передвигающихся по кровеносной и лимфатической системам клеток. Эта его особенность связана с тем, что функции иммунологического надзора должны осуществляться непрерывно во всем организме, во всех его органах и тканях.
Органом иммунитета является лимфоидная ткань, а его основными исполнителями – макрофаги (а также другие антигенпредставляющие клетки), различные популяции и субпопуляции Т– и В-лимфоцитов. Возникнув из общей исходной, так называемой стволовой, клетки и пройдя соответствующую дифференцировку в центральных органах иммунной системы, Т– и В-лимфоциты приобретают иммунокомпетентность, выходят в кровь и, непрерывно циркулируя по организму, выполняют роль его эффективных защитников.
Различают центральные и периферические органы иммунной системы.
К ним относятся костный мозг, тимус (вилочковая железа), сумка Фабрициуса у птиц, печень у млекопитающих.
Роль его как центрального органа иммунитета заключается в том, что в нем возникает и непрерывно поддерживается популяция исходных клеток, являющихся общим предшественником клеток кроветворной и иммунной систем. Эти предшественники получили название костно-мозговых стволовых кроветворных клеток.
Морфологически они не идентифицированы, однако их можно обнаружить по присущей стволовым клеткам колониеобразующей способности. Если ввести летально облученным мышам клетки костного мозга, то через 8 – 10 дней после введения в селезенке реципиента обнаруживаются отдельные колонии, каждая из которых состоит из 106 стволовых клеток. Число образующихся колоний прямо пропорционально числу введенных стволовых кроветворных клеток.
Из костного мозга стволовые клетки поступают в кровь. Этот процесс находится под контролем гипоталамо-гипофизо-адреналовой системы. Понижение выработки адренокортикотропного гормона (АКТГ) приводит к усилению темпа миграции стволовых клеток в кровь. Наоборот, усиление выработки этого гормона приводит к подавлению выхода стволовых клеток из костного мозга.
Другой функцией костного мозга у млекопитающих является формирование в нем зрелых В-лимфоцитов.
Тимус состоит из двух основных долей, каждая из которых делится на еще более мелкие дольки, состоящие из коркового и мозгового слоев. В корковом слое находится большое количество малых лимфоцитов (тимоцитов), способных активно размножаться. Строму тимуса образуют эпителиальные клетки отростчатой формы. Роль тимуса как одного из центральных органов иммунитета была установлена в 1961 г. Дж. Миллером. Он показал, что удаление тимуса у новорожденных мышей приводит к развитию у них через 1,5 – 3 мес. так называемого вастинг-синдрома (англ. waste – опустошать, изнурять). Такие мыши отстают в развитии, у них отмечаются истощение, выпадение волос, развиваются диарея, дерматит, а главное – нарушается иммунитет. При этом особенно сильно снижаются реакции клеточного иммунитета, в частности пересаженные аллогенные ткани не отторгаются. Введение таким животным экстракта, полученного из тимуса, в значительной степени смягчало вастинг-синдром. Все это показало, что тимус играет центральную роль в реакциях клеточного иммунитета.
Каким образом исходные стволовые клетки приобретают под влиянием тимуса иммунокомпетентность, долгое время оставалось не совсем ясным. Для объяснения этого явления было предложено три гипотезы: клеточная, гуморальная и гипотеза «обучения».
В соответствии с клеточной гипотезой, предполагалось, что в тимусе происходит образование лимфоцитов с особыми свойствами. Эти лимфоциты затем поступают в кровь, а через нее расселяются в различных лимфоидных органах. Возникающие таким образом популяции Т-лимфоцитов размножаются, длительное время сохраняются в организме и обеспечивают развитие клеточного иммунитета.
В соответствии с гуморальной гипотезой, в лимфоидные органы поступают исходные стволовые клетки, а их дифференцировка и превращение в иммунокомпетентные Т-лимфоциты индуцируется секретируемыми в кровь гормонами, которые вырабатывают эпителиальные клетки тимуса.
Третья гипотеза объединила оба эти механизма. Согласно теории «обучения», клетки, являющиеся предшественниками Т-лимфоцитов, поступают из кровотока в тимус, где и происходит их превращение в иммунокомпетентные Т-лимфоциты под влиянием гуморальных факторов, секретируемых эпителиальными клетками тимуса; затем они покидают его и циркулируют по лимфатической и кровеносной системам, а также расселяются по лимфоидным образованиям организма.
Установлено, что для приобретения иммунокомпетентности клетки необязательно должны вступать в непосредственный контакт с тканью тимуса. В частности, смягчение последствий, связанных с удалением тимуса, достигается его пересадкой в диффузионных камерах с миллипоровыми стенками, непроницаемыми для клеток, или введением экстрактов тимуса.
Таким образом, решающая роль в дифференцировке предшественников Т-лимфоцитов в иммунокомпетентные клетки принадлежит гуморальным факторам, образуемым тимусом.
Из ткани тимуса выделено несколько десятков пептидных гуморальных факторов. К их числу относятся: фракция 3 (увеличивает количество Т-лимфоцитов в крови); еще более активная фракция 5-тимозина-ТФ5 (в ее состав входит более 20 пептидов, действующих на разные субпопуляции Т-лимфоцитов и их дифференцировку и стимулирующих продукцию ИЛ-6); тимопоэтин и его аналоги; сывороточный тимусный фактор (СТФ), его комплекс с цинком получил название тимулина; тимусный гуморальный фактор γ2 – ТГФγ2; тимусный гормон. Остальные факторы тимуса представляют пептиды с неустановленной структурой или их смеси.
Гуморальные факторы тимуса делят на продукты лимфоидных и продукты нелимфоидных (эпителиальных) клеток. Например, тимозины α1, α7, β4, тимопоэтин, тимулин синтезируются и секретируются эпителиальными клетками. Однако тимозин α1 и его предшественник (протимозин α) секретируются также тимоцитами, периферическими Т-лимфоцитами и некоторыми другими лимфоидными клетками.
По характеру действия на Т-клетки гуморальные факторы тимуса делят на факторы активации, дифференцировки и размножения. Помимо этого, к числу важнейших свойств пептидов тимуса относится их способность активировать продукцию лимфокинов; некоторые тимозины, а также сывороточный тимусный фактор усиливают продукцию Т-клетками интерлейкина-2.
Тимус играет важнейшую роль не только в функционировании иммунной системы и регуляции иммунного гомеостаза, но и опосредует взаимодействие иммунной системы с другими важнейшими системами организма.
Удаление сумки Фабрициуса у птиц приводит к угнетению процесса биосинтеза антител, однако способность отвечать реакциями гиперчувствительности замедленного типа у них не страдает. У людей иногда наблюдается симптом агаммаглобулинемии, т. е. отсутствие в крови иммуноглобулинов. Такие лица не способны вырабатывать антитела, но реакции клеточного иммунитета у них не нарушаются. В свою очередь гипоплазия тимуса приводит к развитию дефицита по клеточному иммунитету, но при этом сохраняется способность вырабатывать антитела. Таким образом было установлено, что тимус является центральным органом клеточного иммунитета, а сумка Фабрициуса у птиц и ее аналог – костный мозг – у млекопитающих – центральным органом гуморального иммунитета.
В соответствии с этим, лимфоциты, ответственные за клеточный иммунитет и получившие иммунокомпетентность в тимусе, стали называть Т-лимфоцитами (лат. thymus – тимус), а лимфоциты, ответственные за развитие гуморального иммунитета и получившие иммунокомпетентность у птиц в сумке Фабрициуса, а у млекопитающих в костном мозге, – В-лимфоцитами (лат. bursa – сумка).
Функция печени как одного из центральных органов иммунитета определяется тем, что в эмбриональном периоде она служит источником первичной популяции В-лимфоцитов – предшественников антителообразующих клеток. В печени происходят их антигеннезависимая дифференцировка и превращение в зрелые В-лимфоциты. Эмбриональная печень является и местом дифференцировки суп-
рессорных В-лимфоцитов. Кроме того, печень занимает особое положение в системе кровотока, которое позволяет ей «выхватывать» патогены, антигены, опухолевые клетки, другие чужеродные вещества и обезвреживать их с помощью иммунокомпетентных клеток. К ним относятся следующие типы клеток: 1. Купферовские клетки, благодаря которым печень играет ключевую роль в захвате и удалении циркулирующих иммунных комплексов и в очищении крови от эндотоксинов. Купферовские клетки осуществляют не только фагоцитоз, но и процессинг, и представление антигена Т-клеткам; секретируют интерлейкин-1, фактор некроза опухолей, простагландины Е2 и D2; несут на себе рецепторы для Fc-фрагмента иммуноглобулинов и для C1q-комплемента. 2. В эмбриональной печени обнаружено и наличие клеток-предшественников Т-лимфоцитов, в ней происходит дифференцировка лимфоцитов-супрессоров. 3. В печени содержатся различные типы лимфоцитов, обладающих цитотоксическими свойствами: Т-киллеры, NK-клетки, Pit-клетки (англ. pit – тутовая ягода) – большие зернистые лимфоциты, «нафаршированные» крупными гранулами (они обнаружены и в других органах), аналоги природных киллеров. Pit-клетки распознают и разрушают опухолевые клетки печени, а также клетки, зараженные вирусом гепатита.
Особое место среди белков, синтезируемых клетками печени, занимают альфафетопротеины, которые обладают иммуносупрессивными свойствами.
О взаимосвязи печени с другими системами иммунитета свидетельствует также тот факт, что в регуляции функции гепатоцитов участвуют интерлейкины-1, -6, -8, а интерлейкин-8 продуцируется гепатоцитами.
Периферические отделы иммунной системы
К ним относятся: селезенка, лимфатические узлы, лимфоидные ткани желудочно-кишечного тракта (пейеровы бляшки и солитарные фолликулы), а также кровь и лимфа, в которые поступают и непрерывно в них циркулируют все иммунокомпетентные клетки. В селезенке содержится больше всего плазматических клеток, возникающих в результате дифференцировки из В-лимфоцитов и являющихся основными продуцентами антител.
Основные популяции иммунокомпетентных клеток. Т-лимфоциты и их функции
Основную роль в реализации иммунных функций играют следующие клетки: 1) макрофаги, а также другие антигенпредставляющие, или вспомогательные, или А-клетки (англ. accessory – вспомогательный); 2) популяции В-лимфоцитов; 3) популяции Т-лимфоцитов; 4) популяции лимфоцитов, обладающих естественными цитотоксическими свойствами – способностью разрушать опухолевые клетки, вирусинфицированные клетки, клетки трансплантата и т. п.: NK-клетки, Pit-клетки, нулевые клетки.
По морфологическим свойствам Т– и В-лимфоциты не отличаются друг от друга. Однако они существенным образом различаются по вкладу в реакции иммунитета, по многим другим свойствам, в том числе структуре и функции рецепторов и по антигенной специфичности (табл. 14).
Таблица 14
Характеристика Т– и В-лимфоцитов
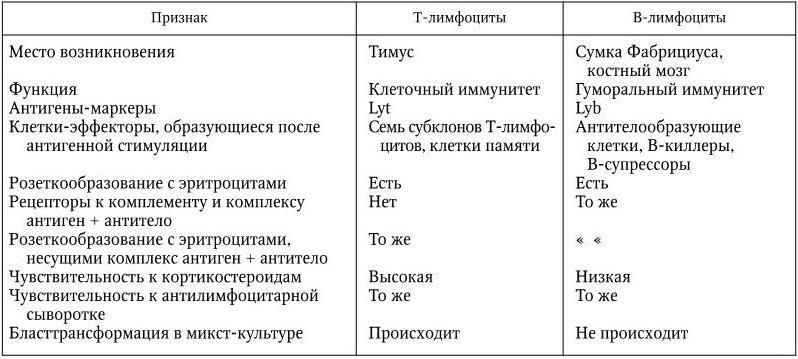
Самый ответственный момент в процессе иммунного ответа – это распознавание химического маркера, свойственного «чужому» агенту и отличающегося от «своего». Эту роль выполняют макрофаги, антитела, Т– и В-лимфоциты. Антитела распознают антиген с помощью своих активных центров, а макрофаги, Т– и В-лимфоциты – благодаря имеющимся на их мембранах особым рецепторам.
Экспериментальное обоснование предположения о наличии у клеток лимфоидной системы специфических рецепторов было получено в 60-е гг. ХХ в. после обнаружения двух важных феноменов: цитопатического действия лимфоцитов и розеткообразования (иммуного прилипания).
Способность сенсибилизированных лимфоцитов распознавать трансплантационный антиген и активно прикрепляться к клеткам-мишеням послужила прямым указанием на наличие у лимфоцитов рецепторов, подобных по структурной специфичности антителам.
Феномен розеткообразования состоит в том, что если к культуре нормальных или иммунных лимфоцитов добавить какой-либо антиген, например чужеродные эритроциты, то последние, прикрепляясь к лимфоцитам, образуют структуру типа розетки. Это явление высоко специфично: удаление лимфоцитов, образовавших розетки с эритроцитами данного вида животных, лишает популяцию лимфоцитов способности образовывать розетки из этих клеток.
Этот феномен не только свидетельствует о наличии у лимфоцитов особых рецепторов, но и говорит о том, что популяция лимфоидных клеток представлена клонами лимфоцитов, различающимися по специфичности этих рецепторов.
Первоначально Т-лимфоциты по своим функциям были разделены на три субкласса:
1) Т-хелперы, или Т-помощники (англ. help – помогать);
2) Т-киллеры (англ. kill – убивать), или Т-цитотоксические лимфоциты;
3) Т-супрессоры (англ. suppress – подавлять).
Т-хелперы необходимы для превращения В-лимфоцитов в антителообразующие клетки и клетки памяти. Т-киллеры разрушают клетки трансплантата, опухолевые клетки и клетки, инфицированные вирусными, бактериальными и другими антигенами. Т-супрессоры подавляют функции определенных эффекторных Т– и В-клеток и обеспечивают иммунологическую толерантность.
Особенность Т-лимфоцитов состоит в том, что их рецепторы, в отличие от антител и рецепторов В-лимфоцитов, не распознают свободно циркулирующих антигенов. Они распознают только те чужеродные вещества, точнее их пептидные фрагменты, которые представляются им клетками организма через посредство антигенов МНС класса I или класса II. Разные Т-лимфоциты распознают разные собственные антигены (белки МНС). Т-цитотоксические лимфоциты распознают клетки, несущие антигены МНС класса I и чужеродные антигены, представляемые ими. Основное назначение Т-цитотоксических лимфоцитов – обеспечение противовирусного, противоопухолевого и трансплантационного иммунитета. Т-киллеры с помощью своих специфических рецепторов распознают чужеродные антигены, ассоциированные на мембранах клеток с их антигеном МНС класса I, они атакуют такие клетки и уничтожают их.
T-хелперы распознают клетки, имеющие антигены МНС класса II (макрофаги, B-лимфоциты и некоторые другие), и представляемые ими чужеродные антигены. Белки МНС класса II связывают чужеродный антиген в макрофагах в ходе процессинга, выносят его на поверхность мембраны макрофага, и в таком виде этот антиген представляется T-хелперам. Последние также распознают его с помощью своих рецепторов и при участии своих белков МНС класса II. В свою очередь, B-лимфоциты также представляют чужеродные антигены Т-хелперам, используя собственные белки МНС класса II.
Таким образом, T-хелперы осуществляют регуляцию иммунного ответа, стимулируя В-лимфоциты, а также другие T-клетки, специализированные к данному антигену.
В настоящее время Т-лимфоциты подразделяют на 7 основных субклассов, объединенных в следующие три группы (табл. 15).
1. Т-помощники, или активаторы: индукторы Т-хелперов, индукторы Т-супрессоров, Т-хелперы 1, Т-хелперы 2.
2. Т-эффекторы – Т-цитотоксические лимфоциты. 3. Т-регуляторы: Т-супрессоры, Т-контрсупрессоры.
Кроме того, существуют различные варианты Т-клеток иммунной памяти.
Т-лимфоциты различаются по своим рецепторам. Каждый из субклассов выполняет специфические функции. Для активации Т-клеток требуется контакт их рецептора с комплексом чужеродного антигена с собственным белком МНС класса I или класса II. Через 16 – 20 ч после установления контакта возникают индукторы Т-хелперов. Последние, реагируя на представляемый А-клеткой процессированный антиген, быстро секретируют медиаторы, которые способствуют образованию молекул МНС класса II на поверхности макрофагов и продукции ими IL-1. Индукторы Т-хелперов отличаются от эффекторных Т-хелперов тем, что они имеют особый рецептор CD29, который может быть заблокирован моноклональными антителами, не влияющими на активность Т-хелперов. Только после исполнения функции индукторов данный антиген связывается с белком МНС класса II и возникает комплекс, который узнается рецепторами Т-хелпера. В результате этого на мембране Т-хелпера образуются рецепторы к IL-1. Присоединение к нему интерлейкина-1 приводит ко второму этапу активирования Т-хелпера: он начинает синтезировать и секретировать различные варианты лимфокинов. Существуют две категории Т-хелперов: Т-хелперы 1 (Th1) и Т-хелперы 2 (Th2), которые имеют одинаковые рецепторы CD4 и 4В4, но различаются по другим, а именно: Т-хелперы 1 имеют рецепторы CD45 и CD44, а Т-хелперы 2 – CD28. Их функции различны: Т-хелперы 1 секретируют IL-2, IL-3, фактор некроза опухолей, γ-интерферон и другие цитокины, которые способствуют созреванию Т-цитотоксических лимфоцитов после их взаимодействия с комплексом чужеродный антиген + молекула МНС класса I. Таким образом, Т-хелперы 1 обеспечивают дифференцировку и пролиферацию эффекторных Т-киллеров, способных распознавать и уничтожать как клетки аллотрансплантата, так и свои собственные, если на их поверхности содержатся антигены вирусов, других патогенов или опухолей. Кроме того, Т-хелперы 1 активируют Т-хелперы 2 и способствуют цитотоксической функции макрофагов.
Таблица 15
Субклассы Т-лимфоцитов, их функции и специфические рецепторы
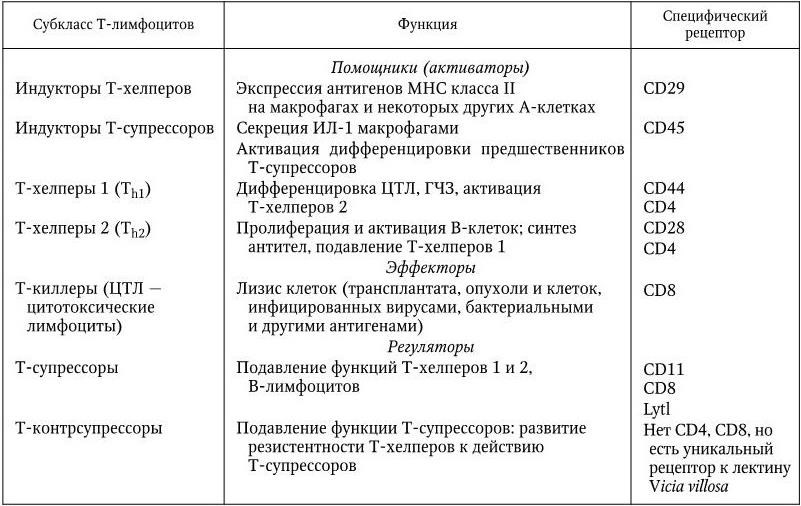
Т-хелперы 2 секретируют IL-4, IL-5, IL-6 и вводят их в цитоплазму В-лимфоцитов путем прямого контакта своих рецепторов с определенными рецепторами на мембране В-лимфоцитов. Таким образом, Т-хелперы 2 вызывают пролиферацию и дифференциацию В-лимфоцитов в антителообразующие клетки и тормозят функцию Т-хелперов 1. Т-хелперы 1 и Т-хелперы 2 различаются по чувствительности к IL-2 и IL-4; кроме того, Т-хелперы 1 устойчивы к радиоактивному облучению, а Т-хелперы 2 – чувствительны.
Активированные Т-супрессоры играют важную роль в регуляции иммунитета. Они способны непосредственно контактировать с рецепторами Т-хелпера, а также синтезировать и секретировать свои медиаторы. Благодаря этому Т-супрессоры могут подавлять функции Т-хелперов. Последние обладают высокой чувствительностью к Т-супрессорам и их медиаторам. Взаимодействуя с мембраной Т-хелпера, Т-супрессоры угнетают секрецию ими интерлейкинов, синтез рецепторов к IL-1, IL-2 и другие иммунобиологические функции Т-хелперов, в результате чего подавляется пролиферация и дифференциация эффекторных Т-клеток, а также формирование антителообразующих клеток против данного антигена. Иначе говоря, Т-супрессоры подавляют временно или постоянно образование клонов иммунокомпетентных Т– и В-клеток против определенного антигена. Особо важную роль Т-супрессоры выполняют в эмбриональном периоде и в течение первой недели жизни новорожденного: они способствуют возникновению толерантности к собственным белкам и подавляют действие проникающих в организм новорожденного Т-цитотоксических лимфоцитов матери на аллоантигены самогmо развивающегося ребенка. Функция Т-супрессоров через неделю после рождения блокируется возникающей к этому времени особой популяцией Т-клеток – Т-контрсупрессорами, которые продуцируют собственный лимфокин. Этот лимфокин взаимодействует с Т-хелперами, они приобретают резистентность к Т-супрессорам и их лимфокинам. Т-контрсупрессоры отличаются от Т-супрессоров по своим специфическим рецепторам, в частности, они содержат отсутствующий у Т-супрессоров рецептор к лектину Vicia villosa. Этот рецептор способствует выполнению функций Т-контрсупрессорами.
Т-лимфоциты распознают чужеродные антигены, предсталяемые им молекулами МНС класса I или класса II, с помощью особого Т-клеточного рецептора (ТКР). В результате взаимодействия этих структур образуется тримолекулярный комплекс: молекула МНС + антиген + ТКР (см. рис. 63, в). Биосинтез ТКР, как и антител, кодируется комплексом генов: V, D, J, C, однако они отличаются от генов Ig, это самостоятельное семейство генов. Число возможных вариантов их объединения составляет 1016, что обеспечивает большое разнообразие антигенсвязывающих центров ТКР. Все субпопуляции Т-клеток используют ТКР непосредственно для распознавания антигена.
Структура ТКР во многом напоминает структуру молекулы антитела. ТКР состоит из двух цепей – α и β (редко встречается вариант γ/δ). Каждая цепь содержит V– и С-домены, обладающие высокой степенью гомологии с V– и С-доменами Ig. За С-доменами, около мембраны, располагается шарнирная область – место образования дисульфидной связи между цепями. Каждая цепь заякорена в мембране своим гидрофобным участком. Антигенсвязывающий центр ТКР формируется тремя гипервариабельными участками каждой цепи и имеет форму щели, структура которой соответствует пространственной структуре представляемого антигена.
Каждый Т-лимфоцит несет ТКР, распознающий свой антиген только в комплексе с молекулой МНС (рис. 68А). Последняя имеет два участка связывания: гистотоп для ТКР и дезотоп – для пептида. Связь с пептидом осуществляется с помощью вариабельных аминокислотных остатков, обращенных внутрь антигенсвязывающего центра молекулы МНС.
Передача сигнала к ядру Т-клетки происходит по пути, общему для различных сигналов (факторы роста, деления, дифференцировки, антигены и др.). Трансмембранные рецепторы, воспринимающие эти сигналы, обладают (или приобретают ее, например, в случае присоединения к ТКР антигена) протеинтирозинкиназной активностью и регулируют так называемые Ras-зависимые сигнальные пути, в которых ключевую роль играет продукт протоонкогена ras – белок Ras. От него расходятся многие пути. Те трансмембранные белки-рецепторы, которые лишены протеинкиназной активности, приобретают ее, образуя после активации лигандом прочный комплекс с цитоплазматическими протеинтирозинкиназами Src-семейства. Именно через эти протеинкиназы цитокины осуществляют регуляторные функции, стимулируя Ras-зависимые и Ras-независимые сигнальные пути. Конечное звено всех сигнальных путей, регулирующих рост, деление и дифференцировку клеток, – образование фактора транскрипции и связывание его со специфическим цис-регуляторным элементом гена-мишени. Факторами транскрипции служат фосфорилированные белки – продукты протоонкогенов c-myc, c-fos, c-jun, c-myb и генов-супрессоров клетки. Цис-регуляторные элементы – это сравнительно короткие олигонуклеотиды, богатые гуанином и цитозином. Они образуют вилки («палиндромы»). Взаимодействие их с промоторами генов активирует или подавляет транскрипцию. Сигнальные белки узнают партнеров с помощьью особых некаталитических доменов SH2 (100 – 150 аминокислотных остатков) или SH3 (50 – 80 аминокислотных остатков), названных так из-за расположения рядом с каталитическим доменом Src-киназы SH1. За короткое время SH2– и SH3-домены были обнаружены не только в цитоплазматических протеинтирозинкиназах, но и во многих других сигнальных белках (липидкиназах, фосфолипазах, факторах транскрипции и т. д.). Каждый SH2-домен узнает своего партнера по определенной последовательности 3 – 5 аминокислот, расположенных сразу же после фосфотирозина, а SH3-домен – по участкам, богатым пролином. Такая специфичность взаимодействия позволяет связать звенья одного сигнального пути в единую цепь и обеспечить безошибочное проведение сигнала к месту назначения. В некоторых сигнальных белках обнаружены домены с избирательным сродством к мембранным фосфолипидам. Они названы плекстриновыми доменами (PH). Мишенью для сигнала, воспринятого ТКР и переданного в ядро, служит ген, кодирующий синтез ИЛ-2. Активация этого гена приводит к синтезу и секреции ИЛ-2, который стимулирует пролиферацию и дифференцировку В-лимфоцитов.
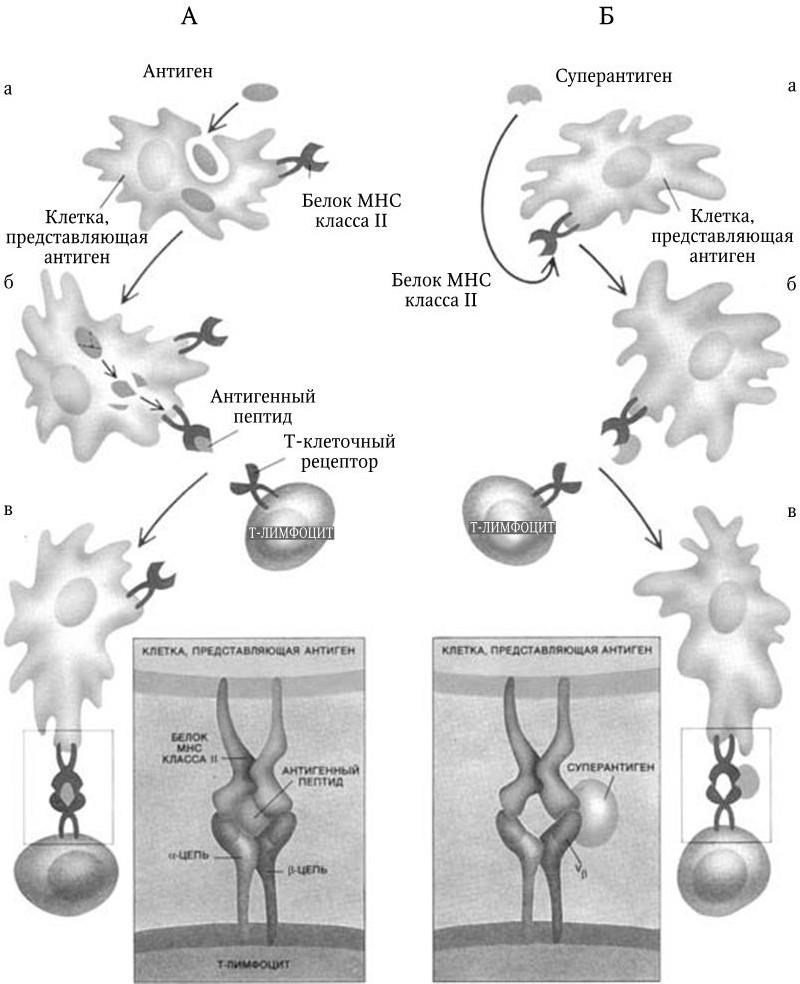
Рис. 68. Взаимодействие антигенов (А) и суперантигенов (В) с Т-лимфоцитами (по: Д. Бернс-Пайзеру, 1992):
Обычные антигены (слева) вначале поглощаются какой-либо из клеток, представляющих антигены (а), подвергаются в ней процессингу (б), и их антигенный пептид представляется в комплексе с молекулой МНС класса II Т-лимфоциту, который с помощью своих молекул МНС класса II распознает его и связывается с ним (в). Обе цепи рецептора (α и β) контактируют с антигеном (в рамке). Суперантигены (справа) прямо связываются с наружной стороной молекул МНС (а и б), а затем с Т-клеточным рецептором (в), присоединяясь к вариабельной (Vβ) части β-цепи (в рамке). Связывание с Vβ обусловливает мощное воздействие суперантигенов на Т-лимфоциты
Существует полная взаимосвязь между фенотипом Т-лимфоцитов (CD4/CD8) и молекулами МНС, которые определяют Т-клеточный ответ: все без исключения Т-киллеры (CD8+) несут молекулы МНС класса I, а все Т-хелперы (CD4+) – молекулы МНС класса II.
Предполагается, что гены Ir, открытые Бенасеррафом в 1967 г., каким-то образом определяют силу иммунного ответа на конкретный антиген через тримолекулярный комплекс.
Особенности взаимодействия суперантигенов с Т-лимфоцитами
Суперантигены отличаются от обычных антигенов очень большой силой иммунного ответа. Предполагается, что необычная сила ответа на суперантиген обусловлена по крайней мере двумя обстоятельствами: 1) суперантиген связывается с молекулой MHC без предварительного процессинга и 2) суперантиген присоединяется к наружному участку молекулы MHC. Поэтому он и распознается не внутренней поверхностью антигенсвязывающего центра ТКР (как обычный антиген), а той частью вариабельного участка b-цепи, которая находится с наружной стороны цепи (см. рис. 68Б). Обычный антиген распознается только Т-специфическим лимфоцитом, вызывает его пролиферацию и адекватный иммунный ответ (рис. 69). Суперантиген может распознаваться и связываться разными Т-лимфоцитами, у которых β-цепь ТКР содержит определенные типы вариабельных доменов (у человека таких типов около 30). Связываясь с ними, суперантиген оказывает сильное воздействие на Т-лимфоциты. Результат этого – суперпродукция ИЛ-2, отравляющего организм и вызывающего СТШ (рис. 70). Свойствами суперантигенов обладают некоторые бактериальные экзотоксины, а также различные компоненты самой бактериальной клетки. Наличие суперантигенов у бактерий влияет на клиническую картину вызываемых ими заболеваний.
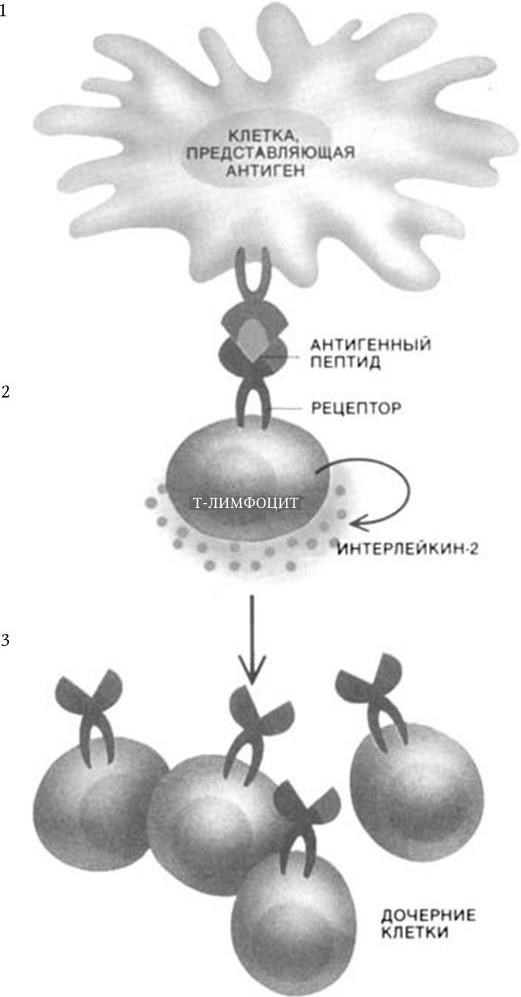
Рис. 69. Иммунный ответ на обычные антигены (по: Д. Бернс-Пайзер, 1992):
1. С данным антигеном связываются только те клетки, которые имеют специфичный к нему рецептор (≈ 0,01 % Т-хелперных лимфоцитов).
2. Связавшие антиген клетки секретируют интерлейкин-2.
3. Интерлейкин-2 вызывает пролиферацию антиген-специфических Т-лимфоцитов. Иммунная система распознает и разрушает зараженные любым патогеном клетки, не причиняя вреда нормальным клеткам
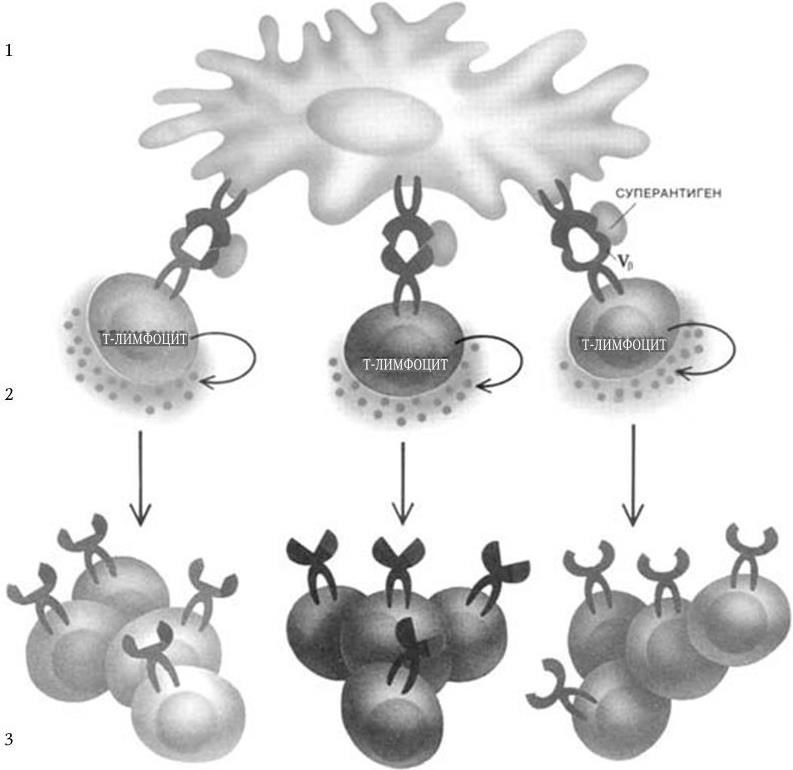
Рис. 70. Иммунный ответ на суперантигены (по: Д. Бернс-Пайзер, 1992):
1. С суперантигеном связывается около 20 % Т-лимфоцитов, несущих на своей поверхности в области Vβ рецепторы для различных антигенных пептидов.
2. Связавшие суперантигены Т-лимфоциты секретируют интерлейкин-2, что приводит к аномально высокой концентрации его.
3. Т-лимфоциты размножаются, образуется огромное множество таких клеток. Следствием суперпродукции интерлейкина-2 могут быть лихорадка и другие симптомы интоксикации, а образование избыточного количества антиген-специфических Т-лимфоцитов может стать причиной аутоиммунных реакций (активация и размножение немногочисленных Т-лимфоцитов, реагирующих на «свои» антигены, приводят к атаке нормальных тканей) или привести к подавлению иммунной системы, так как Т-лимфоциты, стимулированные суперантигеном, могут после активации погибнуть
В-лимфоциты и их функции
Как уже отмечено выше, B-лимфоциты помимо антигенов Ly, общих с T-лимфоцитами, имеют свойственные только им антигены Lyb. B-лимфоциты подразделяют на Lyb5+, т. е. имеющие этот антиген, и Lyb5– , т. е. лишенные его. Разные антигены – ТЗ, ТН-1 и ТН-2 (см. с. 259) – активируют различные субпопуляции B-лимфоцитов. Так, ТЗ– и ТН-1-антигены активируют как Lyb5+, так и Lyb5–-B-лимфоциты. В свою очередь, TH-2-антигены активируют только Lyb5+-В-лимфоциты. B-лим+фоциты подразделяют на следующие -шесть основных популяций: 1) клетки Bla (CD5 ), или просто Bla; 2) клетки Blb (CD5 ), или Blb. Клетки Bla и Blb объединяют в одну группу B-1-клеток, потому что они первыми появляются в онтогенезе; 3) клетки B-2, которые затем дифференцируются в АОК; 4) MZ-B, или B-клетки маргинальной зоны (от лат. margo – край); 5) B-супрессоры и 6) B-киллеры. Клетки Bla, Blb и MZ-B продуцируют только IgM, т. е. неспецифические иммуноглобулины. Все они осуществляют функции 1-й линии защиты организма от инфекций, т. е. опосредуют видовой иммунитет. Лимфоциты B-2 играют решающую роль в формировании специфического приобретенного, или адаптивного иммунитета. B-2 лимфоциты рециркулируют между кровью и лимфой (MZ-B-лимфоциты – не циркулирующие клетки) и в лимфатических фолликулах селезенки и лимфоузлов встречаются с антигенами, связанными с дендритными фолликулярными клетками. Дендритные клетки, как и все макрофаги, обладают способностью осуществлять процессинг и представление антигена. Здесь образуются зародышевые центры, в которых и происходит превращение B-2-лимфоцитов в антителообразующие клетки и формирование клеток иммунной памяти. B-супрессоры выполняют такие же функции, как и T-супрессоры. B-киллеры взаимодействуют с Fc-фрагментами IgG, фиксированных на клетках трансплантата, и разрушают их.
Мембраны B-лимфоцитов несут большое количество рецепторов (более 40 типов) с разнообразными свойствами. В частности, они имеют рецепторы к Fc-компоненту иммуноглобулина, к C3-компоненту комплемента. Благодаря этим рецепторам B-клетки легко выявить с помощью метода розеткообразования или методом бляшек. Суть последнего заключается в том, что если эритроциты барана использовать в качестве антигена для иммунизации животных, то в их лимфоидной ткани будут накапливаться B-лимфоциты, вырабатывающие соответствующие антитела. Добавление таких клеток в среду, содержащую эритроциты, приведет к тому, что комплексы эритроцит + антитело + комплемент будут связываться с лимфоцитом и лизироваться вблизи него, образуя пятно (бляшку). Химическая природа B-лимфоцитов рецепторов была выяснена в 1969 г. Р. Кумбсом, который установил, что они являются иммуноглобулинами.
В-лимфоциты несут на своей поверхности большое количество таких рецепторов до 150 000 на один лимфоцит. При этом все рецепторы данного лимфоцита обладают одной и той же антительной специфичностью, т. е. один лимфоцит может реагировать только с одним антигенным детерминантом. Вместе с тем установлено, что В-лимфоциты раньше всех начинают синтезировать иммуноглобулины класса IgM. Зрелые лимфоциты могут нести рецепторы, относящиеся более чем к одному классу. Например, IgM + IgD, IgM + IgG и т. п. Однако во всех случаях такие иммуноглобулины обладают только одной антительной специфичностью.
В-лимфоциты представлены громадным количеством клонов (вероятно, более чем 108). Клон – совокупность генетически идентичных клеток. Клетки данного клона несут рецепторы одной и той же антительной специфичности, поэтому каждый клон отличается от других по антительной специфичности своих рецепторов. Такие клоны формируются из исходных клеток-предшественников В-лимфоцитов.
В ходе своего созревания (от эмбриональной клетки до рождения), а также после рождения В-лимфоциты подвергаются дифференцировке, биологический смысл которой состоит в создании клона клеток, синтезирующих и секретирующих антитела, специфически взаимодействующие с данным антигеном.
Процесс созревания В-лимфоцитов включает в себя две стадии:
1. Антигеннезависимую, которая протекает в эмбриональном периоде.
2. Антигензависимую, которая протекает после рождения и наступает только после встречи с соответствующим антигеном.
Антигеннезависимая стадия дифференцировки
Она начинается с раннего предшественника В-лимфоцита (ранний предшественник В-лимфоцита, в свою очередь, возникает из исходной полипотентной кроветворной клетки, он же является одновременно и предшественником Т-лимфоцитов) и заканчивается образованием зрелых В-лимфоцитов, которые несут на своей мембране иммуноглобулиновый рецептор одной антительной специфичности.
В ходе антигеннезависимой дифференцировки В-лимфоцита происходит последовательное формирование генов вначале для Н-цепи, затем для L-цепи, сборка полного гена иммуноглобулина М, образование вначале цитоплазматического IgM и, наконец, мембранных иммуноглобулиновых рецепторов IgM и IgD.
В формировании полного гена Н-цепи принимают участие следующие гены, расположенные в определенном локусе хромосомы на значительном расстоянии друг от друга: V (200 вариантов), D (20 вариантов), J (4 – 6 вариантов), С (9 вариантов). Вначале происходит выбор одного из генов J– и одного из D-сегмента, затем соединение одного из V-генов с D-J-сегментом. Образующийся при этом тандем V-D-J сближается с геном Сμ. В результате этого происходит выбор одного из множества возможных вариантов генов V, D, J, т. е. такого, который будет контролировать структуру активного центра данного антитела. Образовавшийся ген вариабельной части Н-цепи ассоциирует с геном Сμ, и возникает полный ген Н-цепи μ-типа. Его транскрипция приводит к образованию цитоплазматической Н-цепи типа Сμ. Наличие этой цепи в цитоплазме является характерным признаком пре-В-лимфоцита. Он является пролиферирующей клеткой, поэтому происходит накопление клона таких клеток, которые имеют более широкий спектр специфичности, чем зрелые В-лимфоциты. Широкая специализация зрелых В-лимфоцитов будет зависеть от ассоциации Н– и L-цепей. Следующая стадия – превращение пре-В-лимфоцита в незрелый В-лимфоцит – характеризуется сборкой гена для L-цепи, формированием полного гена иммуноглобулина IgM и синтезом мембранной (рецепторной) формы иммуноглобулина М. Для образования рецепторной формы иммуноглобулина надо, чтобы Н-цепь включила гидрофобный «якорь». Он представляет собой пептид из 41 аминокислотного остатка, контролируемый фрагментом μ-гена, отделенным интроном от его последнего экзона. Сборка гена для L-цепи происходит по такому же типу, как и генов Н-цепи. Регуляция образования полных генов Н-цепи и L-цепи осуществляется сплайсингом ядерных пре-мРНК этих генов.
Конечная стадия антигеннезависимой дифференцировки – образование зрелого В-лимфоцита. Он характеризуется наличием двух мембранных рецепторов, обладающих одной антительной специфичностью: IgM и IgD. Синтез IgD также контролируется на уровне сплайсинга, при этом происходит переключение тандема V × D × J × Cμ на V × D × J × Cδ – класспереключающая рекомбинация. Формированием рецепторного IgD завершается процесс антигеннезависимой дифференцировки предшественника В-лимфоцита в зрелый В-лимфоцит.
Зрелый В-лимфоцит имеет два рецептора (IgM и IgD) с одинаковыми активными центрами. Таким образом возникают клоны лимфоцитов, каждый из которых обладает своей антительной специфичностью и способен распознать только «свой» антиген. Зрелый В-лимфоцит – покоящаяся клетка, т. е. он находится в фазе цикла G0. Однако он способен к дальнейшей пролиферации, дифференцировке и превращению в антителообразующую клетку и в клетку памяти. Все стадии антигеннезависимой дифференцировки В-лимфоцита происходят в тесном контакте с клетками окружающих тканей. Созревание В-лимфоцитов в эмбриональном периоде происходит в печени. После рождения исходные стволовые клетки перемещаются в костный мозг, здесь и происходит дальнейшее образование зрелых В-лимфоцитов с высокой скоростью – 108 клеток в сутки.
Зрелые В-лимфоциты покидают костный мозг и заселяют селезенку, лимфатические узлы и другие скопления лимфатических клеток, где их дифференцировка «замораживается» до встречи с соответствующим антигеном, т. е. они уже полностью созрели для реализации своих функций, для этого им нужна только встреча с антигеном.
Антигензависимая дифференцировка В-клеток
Превращение зрелых В-лимфоцитов в антителообразующие клетки и клетки иммунной памяти происходит после встречи лимфоцита с антигеном. Антигензависимая дифференцировка складывается из трех основных событий: 1) активация В-клеток, 2) их пролиферация, 3) дифференцировка.
Биологический смысл активации В-лимфоцитов заключается в том, что они, вопервых, переходят из покоящегося состояния в начальную стадию клеточного цикла G1, и, во-вторых, в том, что в результате активации они приобретают способность вступать во взаимодействие с другими клетками (Т-лимфоцитами) и воспринимать те сигналы, которые они им передают.
Для само́й активации необходимы по крайней мере два сигнала: превый – для перевода клетки из фазы покоя (G0) в G1-фазу клеточного цикла, а второй – для вступления ее в S-фазу. Роль первого сигнала выполняют различные антигены или митогены. Он воспринимается Ig-рецептором. В качестве второго сигнала выступают различные лимфокины, в том числе интерлейкины-1, -2, -4, -6. В результате их воздействия происходит активация генома клетки, что и обусловливает пролиферацию и дифференциацию В-лимфоцитов в антителообразующие клетки (АОК). Механизм передачи сигнала от Ig-рецептора геному В-клетки во многом совпадает с таковым у Т-лимфоцитов.
Активация В-клеток может осуществляться разными путями, что зависит как от участия в ней других клеток (макрофагов, Т-хелперов), так и от свойств самих антигенов. Их природа может определять интенсивность и длительность сигнала, подаваемого в клетку рецептором В-лимфоцита. Если он недостаточен, требуется помощь Т-хелперов. Например, бактериальные полисахариды могут прямо активировать В-клетки и индуцировать выдачу сильного ответа. Такие антигены получили название Т-независимых. Напротив, вирусные и растворимые антигены вызывают слабый ответ В-лимфоцитов, и для их активации требуется помощь Т-хелперов. Такие антигены называют Т-зависимыми (ТЗ). Комплекс антигена с антителом является более слабым активатором В-лимфоцитов, чем сам антиген. Поэтому, когда антитела нейтрализуют большинство молекул антигена, происходит постепенное торможение образования антител. Т-независимые антигены, в свою очередь, делят на два типа: Т-независимые антигены 1 (ТН-1) и Т-независимые антигены 2 (ТН-2). Различие между ними состоит в том, что ТН1-антигены вызывают иммунный ответ как Lyb5+-В-лимфоцитов, так и Lyb5–, в то время как ТН2-антигены способны индуцировать иммунный ответ только Lyb5+-В-лимфоцитов при участии макрофагов.
Известны следующие пути активации В-лимфоцитов:
1) Т-зависимым антигеном с помощью белков МНС класса II;
2) Т-независимым (т. е. без участия Т-лимфоцита) антигеном, который в своем составе имеет митогенный компонент;
3) Т-независимым антигеном, не содержащим митогенного компонента;
4) поликлональным активатором (липополисахаридом);
5) антииммуноглобулинами μ.
Основным выступает механизм активации с помощью Т-лимфоцитов.
Процесс антигензависимой дифференцировки В-лимфоцитов находится под контролем интерлейкинов. Все они полифункциональны и их действие не ограничивается только регуляцией иммунного ответа. Сам процесс антигензависимой дифференцировки протекает так: В-лимфоцит с помощью иммуноглобулиновых рецепторов распознает и связывает антиген. Это стимулирует его переход из покоящегося состояния (G0) в фазу G1. В-клетка увеличивается, на ее мембране образуются новые рецепторы: один – к фактору роста, другой – к фактору дифференцировки, третий – к фактору, замещающему Т-клетки.
В-лимфоциты в ряде случаев под действием антигена могут дифференцироваться в АОК без пролиферации, а под воздействием особого фактора созревания В-клеток. Одновременно с В-лимфоцитом антиген по представлению макрофага распознается Т-лимфоцитом-хелпером, который также активизируется и начинает синтезировать и секретировать факторы роста и дифференцировки. Последние взаимодействуют с рецепторами В-клетки и переводят ее в следующую стадию клеточного цикла (S-фазу) и в фазу дифференцировки. Факторы пролиферации нужны в течение первого и всех последующих циклов деления В-лимфоцитов, а факторы дифференцировки, очевидно, только на последних этапах ее.
Активированная В-клетка претерпевает 8 – 10 делений и одновременно дифференцируется в антителообразующую клетку (плазмоцит). В процессе дифференцировки ядро В-лимфоцита уплотняется, а объем цитоплазмы увеличивается. В ней развивается сеть мембран эндоплазматического ретикулума, и образуется большое количество связанных с мембранами рибосом. Такая клетка синтезирует и секретирует антитела одной антительной специфичности. 90 – 96 % всего производимого ею белка представляет антитело с одинаковым активным центром против антигена, который вызвал антигензависимую дифференцировку данного В-лимфоцита. Так возникает клон антителообразующих клеток.
Такой путь активации и дифференцировки проходит популяция В-лимфоцитов, имеющих антиген Lyb5, т. е. примерно 50 % всей популяции В-клеток. Клетки, лишенные Lyb5-антигена (Lyb5–), нуждаются для активации в прямом контакте с активированными Т-хелперами, которые выделяют в этом случае антигенспецифический фактор дифференцировки. Такие В-лимфоциты тоже превращаются в антителообразующие клетки.
Антигены, вызывающие агрегацию иммуноглобулиновых рецепторов на мембране В-лимфоцитов, например липополисахарид, полианионы, антитела к μ-цепи; и антигены, несущие повторяющиеся детерминанты в своей молекуле, способны активировать В-клетки без участия Т-лимфоцитов, но эти механизмы играют незначительную роль в иммунном ответе.
Происхождение и дифференцировка клеток иммунной системы
Не все индуцированные антигеном В-лимфоциты подвергаются дифференцировке до конца. Часть из них после нескольких циклов деления перестает размножаться и образует субклон клеток памяти (из одной В-клетки образуется около 1000 клеток памяти, таким же образом образуются клетки памяти и из Т-лимфоцитов). Клетки памяти определяют продолжительность приобретенного иммунитета. При повторном контакте с данным антигеном они быстро превращаются в клетки-эффекторы. При этом В-клетки памяти обеспечивают синтез антител в более короткие сроки, в большем количестве и с более высоким сродством антител другого класса иммуноглобулинов – IgG вместо IgM. Эта перестройка происходит благодаря рекомбинации генов Н-цепи: тандем генов V × D × J переносится с Сμ-гена к одному из СН-генов – γ, α, ε. Ее вызывает сигнал, получаемый СD40-рецептором В-клеток памяти, когда они выходят из зародышевого центра в пул памяти, от gp39-рецептора Т-хелперов. Установлено, что мутации в гене, кодирующем gp39, являются причиной редкого тяжелого первичного иммунодефицита – гипер-IgM-синдрома. Отсутствие у Т-хелперов молекул gp39 в этих случаях приводит к утрате ими способности связываться с CD40, что ведет к неправильному ответу на Т-зависимый антиген – гиперпродукции IgM.
В ходе антигензависимой дифференцировки В-лимфоцитов используется и механизм соматических мутаций в V-генах. Они происходят с частотой в 10 000 раз большей частоты спонтанных мутаций и ограничиваются определенной стадией дифференцировки, а именно – периодом перехода от продукции IgM к продукции IgG. Благодаря этим мутациям обеспечивается максимальная подгонка структуры активного центра антитела к детерминанту антигена.
Таким образом, наиболее важными событиями дифференцировки В-лимфоцитов являются: 1) сборка гена иммуноглобулина из его фрагментов, содержащихся в ДНК эмбриональных клеток; 2) формирование пула клеток памяти; 3) возникновение новых вариантов генов Ig в результате дополнительных класс-переключающих рекомбинаций; 4) вспышка соматических мутаций на строго определенной стадии дифференцировки. В результате этих событий происходит образование множества генетически стабильных клонов антителообразующих клеток (вероятно, не менее чем 108). Общая схема происхождения и дифференцировки Т– и В-лимфоцитов и макрофагов из исходных стволовых клеток представлена на рис. 71.
В соответствии с этой схемой, исходная костно-мозговая клетка (HSC) генерирует два типа предшественников: лимфоидную стволовую клетку (LSC), от которой происходят клетки-предшественники Т-лимфоцитов (PTC), клетки-предшественники В-лимфоцитов (PBC); и клетку, являющуюся предшественником клеток красной крови, от которой, в свою очередь, происходит предшественник лейкоцитов (CFUc) и берет начало система мононуклеарных макрофагов. Предшественники Т-лимфоцитов под влиянием тимуса превращаются в Т-лимфоциты и их субклассы. Пути дифференцировки В-лимфоцитов описаны выше.
В целом система В-лимфоцитов обеспечивает синтез антител, отвечает за иммунитет против большинства бактериальных и вирусных инфекций, анафилаксию и другие реакции гиперчувствительности немедленного типа, некоторые аутоиммунные болезни, за формирование клеток иммунной памяти и иммунологическую толерантность.
Система T-лимфоцитов играет регуляторную роль по отношению к B-лимфоцитам, отвечает за все реакции гиперчувствительности замедленного типа, иммунитет против вирусных и некоторых бактериальных инфекций (туберкулез, бруцеллез, туляремия и др.), осуществляет иммунологический надзор, отвечает за противоопухолевый иммунитет, иммунологическую толерантность, некоторые виды иммунопатологии.
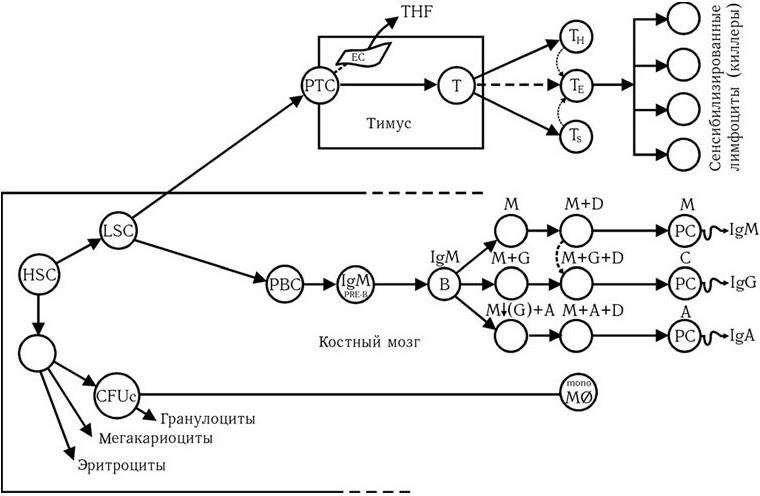
Рис. 71. Схема происхождения и дифференцировки клеток-эффекторов иммунной системы (ВОЗ, 1978).
HSC – костно-мозговая стволовая кроветворная клетка; LSC – лимфоидная стволовая клетка; PTC – предшественник Т-клеток; PBC – предшественник В-клеток; TE – Т-эффекторы; TH – Т-хелперы; TS – Т-супрессоры; CFUc – кроветворный предшественник макрофагов; PC – плазматическая клетка; EC – эпителиальная клетка; THF – тимусный гуморальный фактор
Вместе с тем T– и B-клетки являются двумя частями единой иммунной системы организма. Поэтому деление иммунитета на гуморальный и клеточный носит весьма условный характер, так как антитела синтезируются В-клетками, а Т-лимфоциты и другие клетки осуществляют свою иммунокомпетентность через синтезируемые ими гуморальные факторы (цитокины, лимфокины, интерлейкины и др.).
Координированное взаимодействие макрофагов, Т– и В-лимфоцитов при встрече с антигеном обеспечивает выдачу адекватного иммунного ответа.
Кооперативное взаимодействие макрофагов, Т– и В-лимфоцитов в выдаче иммунного ответа
Исходным этапом иммунного ответа, который завершается биосинтезом антител, является поглощение антигена, его процессинг и представление.
Под процессингом антигена понимают такую его переработку А-клеткой, в результате которой обнажаются и связываются с белками МНС класса II (или класса I)
пептидные фрагменты антигена, необходимые для представления другим иммунокомпетентным клеткам.
Дело в том, что в подавляющем большинстве случаев для активации Т-клеток антиген должен быть представлен в виде коротких пептидов, в то время как антитела и В-клетки (рецепторы В-клеток – это тоже антитела) распознают структуру поверхностного детерминанта нативного антигена. Функции процессинга и представления антигена в комплексе с белками МНС класса II выполняют активированные макрофаги, В-лимфоциты, дендритные клетки селезенки, а также эпителиальные, эндотелиальные клетки, астроциты, клетки Лангерганса кожи и купферовские клетки печени. Поэтому они и получили название антигенпредставляющих, или А-клеток (вспомогательных клеток, англ. accessory – вспомогательный). Основная роль в процессинге и представлении антигена принадлежит макрофагам. В структуре молекулы МНС класса II имеется специальный центр, способный связывать чужеродные антигены. Образование комплекса: белок МНС класса II + антигенный пептид происходит внутри клетки, куда антиген попадает в результате рецепторопосредованного эндоцитоза, и где он подвергается процессингу, а представление процессированного антигена белками МНС класса II – на мембране А-клетки (макрофага).
Кратко схема кооперативного взаимодействия макрофагов, Т– и В-лимфоцитов и выдачи иммунного ответа может быть описана следующим образом.
1. Патоген поглощается макрофагом.
2. Макрофаг осуществляет процессинг антигена.
3. Макрофаг с помощью белка МНС класса II представляет процессированный антиген Т-лимфоцитам (хелперам).
4. Т-хелпер узнает представленный антиген с помощью собственного белка МНС класса II и активируется (синтезирует факторы роста, дифференцировки и иные для В-лимфоцитов и других Т-клеток).
5. Антиген распознается и В-лимфоцитом, который также несет процессированный антиген и активируется (на его мембране синтезируются рецепторы для различных интерлейкинов: факторов активации, роста, дифференцировки и др.).
6. Активированный В-лимфоцит размножается и дифференцируется в антителообразующие клетки и клетки памяти. Клон антителообразующих клеток секретирует антитела в большом количестве.
7. Антитела связываются с антигеном и таким образом маркируют его для узнавания другими компонентами иммунной системы. Антитела сами не разрушают бактерии. Взаимодействуя с ними, они делают их более доступными для фагоцитоза. Выбрасываемые фагоцитами бактериальные антигены связываются антителами, образуются циркулирующие иммунные комплексы, благодаря им антигены выводятся из организма. Разрушение бактерий осуществляется также с помощью системы комплемента. С появлением антител она мобилизуется по классическому пути. Формируется очаг воспаления, происходит активирование других макрофагов. Феномен иммунного прилипания повышает активность макрофагов. Макрофаги, синтезируя отдельные компоненты системы комплемента, усиливают его активность. Происходит замыкание связи между системами макрофагов и комплемента. Чужеродные антигены, в особенности вирусные, активируют систему интерферонов. В работу включается и главная система гистосовместимости, ее третий локус, отвечающий за синтез некоторых компонентов системы комплемента. При участии белков МНС класса I Т-киллерам представляются чужеродные вирусные, бактериальные и другие антигены. Т-киллеры распознают эти комплексы, атакуют и разрушают инфицированные чужеродными агентами клетки.
Таким образом, в формирование иммунного ответа включаются все звенья иммунной системы: системы макрофагов, Т– и В-лимфоцитов, комплемента, интерферонов и главная система гистосовместимости.
Роль цитокинов, лимфокинов, интерлейкинов в регуляции активности иммунной системы
Для всех форм иммунного ответа требуется согласованное взаимодействие основных факторов иммунной системы: макрофагов, В-лимфоцитов, Т-лимфоцитов, NK-клеток, нулевых клеток (К-клеток), системы комплемента, интерферонов, главной системы гистосовместимости, а также антител. Взаимодействие между ними осуществляется с помощью разнообразных синтезируемых и секретируемых медиаторов. Все иммунокомпетентные клетки несут на своих мембранах уникальные рецепторы, с помощью которых они распознают и воспринимают сигналы от других иммунных клеток, перестраивают свой метаболизм, синтезируют или устраняют свои собственные рецепторы. Благодаря этим химическим сигналам-медиаторам все клетки иммунной системы функционируют как хорошо отлаженный симфонический оркестр, в котором в качестве дирижеров постоянно выступают то одна, то другая, а чаще всего – одновременно несколько ее частей. Благодаря прямой и обратной связи между различными субпопуляциями клеток иммунной системы, осуществляемой как путем прямого контакта, так и через различные факторы активации, пролиферации, дифференциации и презентации (представления), обеспечивается устойчивый механизм саморегуляции всей иммунной системы. Медиаторы, вырабатываемые клетками иммунной системы и участвующие в регуляции ее активности, получили общее название цитокинов (греч. kytos – клетка, kineo – приводить в движение). Их подразделяют на монокины – медиаторы, продуцируемые моноцитами и макрофагами, и лимфокины – медиаторы, секретируемые активированными лимфоцитами. Лимфокины представляют собой белки и пептиды, не относящиеся к иммуноглобулинам. Для тех лимфокинов, которые химически идентифицированы и получены в чистом виде, в 1979 г. было предложено название интерлейкинов, они обозначаются номерами – 1 – 20.
Интерлейкины – семейство биологически активных гормоноподобных белковых молекул, различных по структуре и функциям, которые участвуют в регуляции иммунитета и воспалительных процессов. В отличие от антител их структура не определяется структурой антигена, индуцирующего их синтез и секрецию. Синтез интерлейкинов побуждается действием не только антигенов, но и других факторов, в том числе и самих интерлейкинов. Они синтезируются при различных иммунных ответах, инфекционных процессах, повреждении тканей.
Все интерлейкины полифункциональны, а их действие опосредуется различными клеточными поверхностными рецепторами. Наиболее полно изучены следующие интерлейкины.
Интерлейкин-1 (IL-1). Белок с молекулярной массой 17,5 кД, синтезируется макрофагами, моноцитами, дендритными, эндотелиальными и эпителиальными клетками, NK-клетками, фибробластами, астроцитами. IL-1 является фактором активации лимфоцитов, кофактором роста и созревания Т– и В-лимфоцитов. Активирует Т– и В-лимфоциты, NK-клетки, вызывает хемотаксис макрофагов, нейтрофилов и лимфоцитов, обладает пирогенным действием. IL-1 индуцирует синтез IL-2, IL-4, IL-6, γ-интерферона, экспрессию рецепторов IL-2. Существует два варианта интерлейкина-1 – IL-1α и IL-1β; они кодируются разными генами. Синтез IL-1 индуцируется ЛПС, митогенами, а также нейро– и иммунопептидами.
Интерлейкин-2 (IL-2). Белок с молекулярной массой 15 кД. Синтезируется только активированными Т-клетками, стимулирует рост и созревание активированных Т-клеток и образование ими лимфокинов; стимулирует активность Т-цитотоксических клеток, NK-клеток, моноцитов. Является кофактором пролиферации В-лимфоцитов, стимулирует их созревание и защищает клетки от апоптоза.
Интерлейкин-3 (IL-3). Синтезируется активированными Т-клетками. У мышей имеет молекулярную массу 28 кД (у человека она не определена). IL-3 стимулирует рост полипотентных стволовых кроветворных клеток и их специализированных потомков. Стимулирует «дыхательный взрыв» фагоцитирующих клеток; необходим для поддержания роста клеток-предшественников В-лимфоцитов и мастоцитов.
Интерлейкин-4 (IL-4). Белок, у мышей с молекулярной массой 15 – 20 кД. Синтезируется и выделяется активированными Т-клетками, мастоцитами, линией В-лимфоцитов, служит кофактором стимуляции антителообразования; является фактором роста Т-лимфоцитов, стимулирует антигенпредставляющие функции макрофагов и В-лимфоцитов, а также является фактором роста для предшественников кроветворных клеток.
Интерлейкин-5 (IL-5). Белок, у мышей с молекулярной массой 45 – 60 кД. Синтезируется Т-клетками. Является фактором, заменяющим Т-хелперные клетки. Стимулирует пролиферацию активированных В-лимфоцитов и их созревание, а также секрецию антител, стимулирует рост и созревание Т-цитотоксических лимфоцитов, рост и созревание эозинофилов.
Интерлейкин-6 (IL-6). Белок с молекулярной массой у человека 19 – 34 кД. Синтезируется Т-лимфоцитами, макрофагами, моноцитами, фибробластами, некоторыми опухолевыми клетками, а также гибридомами. Является фактором роста плазмоцитmом и гибридmом. Стимулирует образование антител В-лимфоцитами, синтез молекул МНС класса I на фибробластах, синтез некоторых белков клетками печени, является кофактором стимуляции роста Т-лимфоцитов.
Интерлейкин-7 (IL-7). Идентифицирован как фактор, поддерживающий рост пре-В-лимфоцитов, поэтому получил название лимфопоэтина 1. Белок с молекулярной массой у мышей 25 кД.
Интерлейкин-8 (IL-8). Идентифицирован как гранулоцитный хемотаксический фактор. Стимулирует активность нейтрофилов. Белок с м. м. 8,8 кД. Основные продуценты – лимфоидные и макрофагальные клетки. Его синтез индуцируют бактериальные антигены, IL-1, фактор некроза опухолей.
Особый интерес среди интерлейкинов представляет так называемый нейролейкин, используемый нервной и иммунной системами. Нейролейкин продуцируют активированные Т-лимфоциты; являясь медиатором трофической связи через нервно-мышечный синапс, он стимулирует дифференцировку В-лимфоцитов в антителообразующие клетки, т. е. ведет себя как интерлейкин. По-видимому, семейство интерлейкинов будет пополняться новыми представителями, среди которых могут оказаться медиаторы, опосредующие взаимодействие и взаиморегуляцию иммунной, нервной и эндокринной систем.
В последние годы установлено, что IL-1 продуцируют нейроны головного мозга, периферические симпатические нейроны и норадренергические клетки мозгового вещества надпочечников. Он активирует гипоталамо-гипофизарно-адренокортикотропную систему и, по-видимому, способен изменять активность различных нейрогуморальных факторов.
Взаимодействие иммунной, эндокринной и нервной систем
Иммунная система – уникальная саморегулирующаяся организация, состоящая из различных популяций и субпопуляций лимфоидных клеток, постоянно взаимодействующих между собой. Однако их жизнедеятельность, активация, пролиферация и дифференцировка во многом зависят от других систем организма и, в первую очередь, от эндокринной и нервной. Между иммунной, эндокринной и нервной системами сложилось и постоянно осуществляется взаимодействие, с помощью которого они взаимно контролируют свои функции. Интеграция их со всеми другими функциями и обеспечивает существование организма как единого целого.
Связь между иммунной и эндокринной системами находит свое отражение в следующем. Тимус, являясь одним из центральных органов иммунитета, обеспечивает, наряду с этим, формирование нейроэндокринных структур на ранних этапах развития организма, благодаря чему в последующем обеспечивается их нормальная деятельность и создаются необходимые условия для функционирования самmой иммунной системы. Пептидные гормоны тимуса участвуют в двухсторонних связях между клетками иммунной и нейроэндокринной систем. Многие другие медиаторы, синтезируемые иммунокомпетентными клетками, – лимфокины, интерфероны, интерлейкины – обладают свойствами гормонов. Активное участие в общих механизмах регуляции иммунного ответа и болевой чувствительности играют различные интерлейкины ( IL-1, IL-8), а также интерфероны, ФНО и другие цитокины через систему простагландинов. В свою очередь, пептидные гормоны нейроэндокринных структур оказывают модулирующее воздействие на иммунную систему, синтез и реализацию функций тимусных гормонов. К числу важных регуляторов функций центральной нервной системы относят опиоидные пептиды. Оказалось, что опиоиды так же, как и лимфокины, обладают полифункциональными свойствами и оказывают влияние на иммунокомпетентность клеток лимфоидной системы. Они стимулируют выработку В-лимфоцитами антител, оказывают влияние на активность клеток NK, стимулируют хемотаксис и «окислительный взрыв» фагоцитов, выделение серотонина мастоцитами в ответ на присоединение к ним молекул IgE. Наконец, опиоиды и рецепторы к ним синтезируются некоторыми клетками иммунной системы. С другой стороны, иммунокомпетентные клетки служат источником многих медиаторов, секреция которых типична для нервной ткани.
Следовательно, взаимосвязь иммунной и нейроэндокринной систем проявляется в том, что клетки этих систем способны продуцировать одни и те же интерлейкины, простагландины, гормоны, нейропептиды и другие медиаторы. Как уже выше отмечалось, гипоталамо-гипофизо-симпатикоадреналовая система контролирует продукцию антител и выход зрелых В-лимфоцитов из костного мозга. Таким образом, иммунная, эндокринная и нервная системы действуют взаимосвязанно, обеспечивая генетический гомеостаз и нормальную жизнедеятельность организма в целом. Всякие нарушения иммунной системы – иммунодефициты – неизбежно повлекут за собой изменения функций эндокринной, нервной и других систем, которые нельзя не учитывать при оценке формы и степени заболевания иммунной системы и путей ее лечения.
Иммунный статус организма человека
В связи с тем что иммунная система играет важнейшую роль в обеспечении структурной и функциональной целостности организма, ее собственное состояние в каждый данный момент, т. е. иммунологический статус организма, представляет исключительный интерес для клинической медицины. Способности к выздоровлению от многих, особенно инфекционных, болезней являются функцией иммунного статуса организма. Любые нарушения иммунной системы, несомненно, делают организм более восприимчивым к возбудителям инфекционных болезней, в том числе к условно– и слабопатогенным; увеличивают вероятность возникновения опухолей, аутоиммунных и других патологических процессов. В свою очередь, нарушение самmой иммунной системы, ее дефициты могут быть обусловлены расстройствами на самых разных ее уровнях и в различных ее подсистемах. Обнаружение уязвимого звена иммунной системы в этом случае становится решающим моментом для поиска путей коррекции иммунодефицитов. Все это диктует необходимость разработки методов оценки общего состояния иммунной системы и критериев, с помощью которых можно было бы проверить, как функционируют отдельные ее звенья, и обнаружить пострадавшие. Под иммунным статусом организма следует понимать эффективность и согласованность работы каждой из систем иммунитета, т. е. систем макрофагов, комплемента, интерферонов, В– и Т-лимфоцитов, киллерных клеток, главной системы гистосовместимости, клеток иммунной памяти, антителопродуцирующих клеток и центральных органов иммунитета. Для оценки общего иммунного статуса необходимо отобрать наиболее простые, но вместе с тем и наиболее достоверные показатели, которые позволяли бы судить одновременно о суммарной эффективности работы всех систем иммунитета в целом. Для выявления же уязвимого звена иммунной системы требуются наборы более тонких дифференциальных показателей, специфичных для каждой данной системы. Следовательно, изучение иммунного статуса организма целесообразно проводить не менее чем в два приема: вначале выявить общее ее состояние, а затем определить, какое звено иммунной системы функционирует слабо или не работает совсем.
По мнению Ю. И. Зимина, Е. В. Васильевой и В. В. Сура (1988), для оценки общего состояния иммунной системы можно использовать определение числа Ти В-лимфоцитов в крови; их митогенного ответа на один или несколько поликлональных митогенов растительного происхождения – фитогемагглютинин (ФГА), конканавалин А (Кон А) и экстракт лаконоса (PWM); продукцию фактора, ингибирующего миграцию лейкоцитов (ФИМ); а также уровень иммуноглобулинов IgA, IgM и IgG в крови (табл. 16).
Таблица 16
Общая оценка иммунного статуса

В случае отклонений, выявленных на этом уровне исследований, или при наличии других симптомов иммунологической недостаточности эти же авторы рекомендуют производить дополнительные иммунологические исследования с целью выявления эффективности функционирования отдельных звеньев системы иммунитета, в частности определение фенотипа лимфоцитов, количества Т-супрессоров, Т-хелперов, киллерных клеток, реактивности на антиген, содержание компонентов комплемента, IgE, IgD, секреторных IgA, свободных κ– и λ-цепей иммуноглобулинов и т. п. Большой интерес представляет предложение А. Н. Чередеева и Л. В. Ковальчук (1997) использовать для оценки иммунного статуса организма тесты по патогенетическому принципу, т. е. оценивать с помощью набора специальных маркеров состояние иммунокомпетентных клеток по их способности осуществлять свои главные функции. Этих функций пять: 1) распознавание, 2) активация, 3) пролиферация, 4) дифференциация и 5) регуляция.
Возрастные особености иммунитета
Особенности иммунитета у детей. Во время внутриутробного развития у плода формируются центральные органы иммунитета, возникают различные иммунокомпетентные клетки, системы интерферонов, комплемента, макрофагов, главная система гистосовместимости, которые и обеспечивают как в процессе эмбриогенеза, так и в постнатальном периоде иммунную защиту организма.
Развивающийся плод содержит аллоантигены, но они не отторгаются во время беременности потому, что иммунная система матери проявляет к его антигенам толерантность. Она зависит от того, что, во-первых, клетки трофобласта плаценты содержат мало антигенов гистосовместимости. Во-вторых, плацента, в силу ее морфологических и функциональных особенностей, обладает способностью избирательно пропускать вещества из крови матери к плоду и в обратном направлении (плацентарный барьер).
В-третьих, женский организм, плацента и плод синтезируют ряд белковых (α-фетопротеин, уромодулин и др.) и небелковых факторов (эстрогены, прогестерон, простагландины Е1 и Е2), которые подавляют реакции отторжения. Но особенно важную роль в сохранении плода играют Т-лимфоциты, появляющиеся у него на 12-й неделе жизни. В частности, Т-супрессоры обеспечивают формирование иммунологической толерантности к собственным белкам плода, а также подавляют действие проникающих в него Т-цитотоксических лимфоцитов матери на аллоантигены самогmо развивающегося плода. Супрессорная активность иммунной системы ребенка в отношении лимфоцитов матери сохраняется на протяжении первого года жизни, но она регулируется после 1-й недели с помощью особой субпопуляции лимфоцитов – Т-контрсупрессоров.
Примерно на 7 – 8-й неделе развития плода у него в крови появляется система комплемента. В течение эмбрионального периода происходит также созревание В-лимфоцитов. В результате антигеннезависимой стадии дифференцировки, протекающей в печени плода, из клеток-предшественников В-лимфоцитов возникает большое количество различных клонов зрелых В-лимфоцитов. Клетки каждого клона несут на своих мембранах IgM и IgD, обладающие только одной антительной специфичностью. Именно в процессе образования зрелого В-лимфоцита происходит формирование генов иммуноглобулина путем выбора соответствующих V-, J-, D– и С-генов, которые и определяют антительную специфичность каждого клона В-лимфоцитов. Зрелые В-лимфоциты появляются у плода между 8-й и 10-й неделями его развития. В случае контакта плода с антигенами в его крови появляются антитела класса IgM. Содержание же антител IgG у плода к 17-й неделе развития составляет около 0,1 г/л. В самые последние недели беременности у плода содержание IgG существенно возрастает, но не за счет синтеза плодом, а вследствие активного транспорта антител IgG от матери через плаценту. Эти антитела, наряду с антителами, передаваемыми через молозиво и грудное молоко матери, и формируют пассивный иммунитет, защищающий ребенка в первые 3 – 6 мес. от различных инфекционных заболеваний.
Реакции клеточного иммунитета против некоторых возбудителей обеспечиваются путем передачи плоду трансфер-фактора от матери через плаценту. Иммуноглобулины других классов через плаценту не проходят. Секреторные IgA появляются у плода в ограниченном количестве к 3 – 4-му мес. его жизни.
Здоровый ребенок рождается, имея сформировавшиеся центральные органы иммунитета и различные иммунокомпетентные клетки, но его иммунные системы функционируют в первые месяцы жизни недостаточно активно.
У новорожденных в крови содержание компонентов системы комплемента С1, С2, С3, С4 примерно в 2 раза ниже, чем у взрослых, ослаблены процессы активации системы комплемента, особенно по альтернативному пути. Все это определяет низкую опсоническую активность крови у них. Продукция интерлейкинов и интерферонов у новорожденных также ниже, чем у взрослых. Вследствие этого противовирусный иммунитет у них ослаблен. Новорожденные и дети первых месяцев жизни особенно восприимчивы к респираторно-синцитиальному вирусу и вирусу энцефаломиокардита. Фагоцитоз у новорожденных часто оказывается незавершенным, слабее проявляются миграция и хемотаксис фагоцитов, понижена продукция фактора, тормозящего миграцию макрофагов. У новорожденных детей реакция бласттрансформации проявляется слабо, низка активность Т-цитотоксических лимфоцитов и NK-клеток. Кожные пробы при постановке ГЧЗ отрицательны.
В период жизни между 2-м и 6-м месяцами у ребенка собственный синтез IgG протекает слабо. Первичный иммунный ответ проявляется синтезом антител класса IgM. К концу первого года жизни содержание IgG составляет примерно 50 – 60 %, а IgA – лишь около 30 % содержания этих антител соответственно у взрослых. Секреторные иммуноглобулины класса IgA появляются в секретах после 3-го мес. жизни. В течение первых четырех лет их концентрация в некоторых секретах в 4 – 5 раз ниже, чем у взрослых, поэтому местный иммунитет в это время понижен. Из-за недостатка секреторных IgA в кишечнике дети часто страдают пищевой аллергией.
Лимфоидные органы ребенка раннего возраста отвечают на патогены выраженной гиперплазией, сохраняющейся долгое время после инфекции. Лимфаденопатия наблюдается при любом воспалительном процессе, а в лимфатических узлах возбудители могут сохраняться долгое время.
В процессе развития ребенка наблюдаются определенные критические периоды, когда на антигенное воздействие иммунная система дает неадекватный или даже парадоксальный ответ. Он может быть очень слабым, недостаточным для защиты, или, наоборот, чрезмерным, гиперергическим (аллергическим).
Первый из этих периодов наблюдается у новорожденных (в первые 29 дней жизни). Он проявляется в том, что на 5 – 7-е сут. происходит первое изменение лейкоцитарной формулы крови: нейтрофилез сменяется относительным и абсолютным лимфоцитозом. Гуморальный иммунитет обеспечивается в основном материнскими антителами. Фагоцитоз имеет незавершенный характер, хемотаксис и миграция фагоцитов ограничены, отмечается низкая активность системы комплемента и слабая опсонизация микробов. Из-за низкой активности иммунной системы ребенок очень восприимчив не только к патогенным, но и ко многим условно-патогенным возбудителям и некоторым вирусам. Именно в этот период у детей часто происходит генерализация гнойно-воспалительных заболеваний, сопровождающаяся септическим состоянием.
Второй критический период приходится на 3 – 6-й месяцы жизни. Он характеризуется ослаблением пассивного гуморального иммунитета в связи с исчезновением материнских антител. Сохраняется выраженный лимфоцитоз в крови. На проникновение большинства антигенов наблюдается первичный иммунный ответ с преобладающим синтезом антител IgM, клетки иммунной памяти не образуются. Такой тип иммунного ответа наблюдается и при вакцинации против столбняка, дифтерии, коклюша, кори, полиомиелита. Лишь после 2 – 3 повторных введений антигена происходит вторичный иммунный ответ с преобладающим синтезом IgG и появлением клеток иммунной памяти. У детей по-прежнему высокая чувствительность к респираторно-синцитиальному вирусу, аденовирусам, вирусам парагриппа, сохраняется недостаточность местного иммунитета (повторные острые респираторные вирусные инфекции). В этот период выявляются наследственные иммунодефициты.
Третий критический период – второй год жизни, когда контакты ребенка с внешним миром расширяются. В это время происходит переключение синтеза антител с класса IgM на класс IgG, вначале появляются антитела IgG1 и IgG3, позднее – IgG2 и IgG4. Однако сохраняется слабая активность местного иммунитета. Дети по-прежнему восприимчивы к вирусным заболеваниям. Они особенно склонны к повторным вирусным и бактериальным заболеваниям дыхательного тракта. Нередко проявляются незначительные аномалии иммунной системы, иммунопатологические диатезы, иммунокомплексные болезни.
Четвертый критический период падает на 4 – 6-й годы жизни. В этот период происходит второй перекрест в содержании форменных элементов крови. Концентрация антител IgG и IgM достигает величин этих показателей у взрослых, но уровень IgA в крови остается еще низким, повышается содержание IgE. Системы местного иммунитета еще не достигают окончательного развития. В этот период выявляются поздние иммунодефициты, наблюдаются различные хронические заболевания.
Пятый критический период приходится на подростковый возраст: у мальчиков – с 14 – 15 лет, у девочек – с 12 – 13 лет. В результате секреции половых гормонов (андрогенов) происходит подавление клеточного и стимуляция гуморального иммунитета. Снижается содержание в крови IgE. Наблюдается новый подъем частоты аутоиммунных, воспалительных и лимфопролиферативных заболеваний.
В указанные критические периоды формирования иммунной системы особенно часто выявляются наследственные изменения силы иммунного ответа, а также иммунопатологические состояния. Особенно тяжелые состояния у детей выявляются при таких иммунодефицитах, как агаммаглобулинемия, недоразвитие вилочковой железы, но они наблюдаются относительно редко.
Особенности иммунитета в пожилом и старческом возрасте. По мере старения организма главная функция иммунной системы – обеспечение генетического гомеостаза – постепенно ослабевает.
Распознавание чужеродных и аутоантигенов становится менее точным, эффективность иммунных реакций снижается. Все это приводит к появлению характерных для этого периода иммунопатологических синдромов: иммунного дефицита, усиления аутоиммунности, повышения уровня ЦИК, более частого возникновения доброкачественных моноклональных гаммапатий (гипериммуноглобулинемий). Следствием иммунного дефицита является снижение эффекта от иммунизации, падение титров антител в крови ниже защитного уровня, ослабление клеточных иммунных реакций и т. п.
Хотя при старении нарушаются функции различных звеньев иммунной системы, более всего страдает система Т-лимфоцитов. Это проявляется в снижении общего числа зрелых Т-лимфоцитов в крови, в ослаблении их иммунного ответа на поликлональные митогены (фитогемагглютинин, конканавалин А). Снижается клеточный и гуморальный ответ на Т-зависимые антигены, уменьшается количество Т-хелперов, выработка интерлейкина-2, антител классов IgG и IgA; понижается фагоцитарная активность макрофагов и нейтрофилов, страдают и другие функции. В значительной степени эти изменения в иммунитете при старении обусловлены возрастной инволюцией тимуса, в результате которой уменьшается выработка тимических гормонов, а следовательно, и созревание Т-лимфоцитов. Важнейшим следствием изменения функций иммунной системы в этом периоде является повышение чувствительности к инфекциям. Они протекают более тяжело, нередко принимают затяжное течение с переходом в хронические формы. В этом возрасте чаще наблюдаются внутрибольничные заражения, в том числе условно-патогенной микрофлорой. Нередко возникают осложнения в виде пневмоний, циститов, пиелоциститов и т. п. Снижение иммунитета благоприятствует развитию опухолевых заболеваний.
Профилактика нарушений иммунитета в этом возрасте заключается в коррекции питания, углеводного, жирового обмена и в проведении общеукрепляющих мероприятий. Применение иммуномодуляторов должно проводиться в каждом случае с учетом иммунного статуса.
Генетическая регуляция механизмов естественного иммунитета (резистентности) и инфекционного процесса
Один и тот же возбудитель вызывает инфекционный процесс различной тяжести у разных индивидуумов – от легкой (иногда латентной) формы болезни до тяжело протекающего заболевания. Это зависит не только от степени вирулентности возбудителя и его заражающей дозы, но и, в значительной мере, от возраста и интенсивности защитных реакций организма. Как известно, на один и тот же антиген у разных людей иммунный ответ может проявляться по сильному или слабому типу, что зависит от функции Ir-генов. Точно так же, по-видимому, защитные механизмы естественного иммунитета в отношении одного и того же возбудителя у разных людей проявляются по сильному или слабому типу, что также зависит от функции определенных генов.
Все процессы жизнедеятельности в конечном счете регулируются генетической системой, которая, воспринимая поступающие в клетки органов химические сигналы, отвечает на них изменением работы соответствующих генов, контролирующих эти процессы.
В настоящее время можно считать установленным, что развитие инфекционного процесса контролируется на всех его стадиях двумя категориями генов. Одна их них – система Ir-генов – определяет интенсивность гуморального и (или) клеточно-опосредованного иммунного ответа к данному возбудителю. Другая – контролирует степень естественного иммунитета (резистентности) к возбудителю.
Так, изучение механизмов развития инфекционного процесса у мышей, обусловленного Salmonella typhimurium, позволило идентифицировать ряд генов резистентности, в том числе Ity, Lps, xid и др.
Ген Ity (англ. immunity to typhimurium) регулирует способность организма животного подавлять размножение S. typhimurium в клетках СМФ (РЭС). Этот ген представлен двумя аллелями; доминантным является аллель резистентности Ityr (англ. resistant), рецессивным – Itys (англ. susceptible).
Локус Ity оказался аналогичным гену Lsh, контролирующему размножение Leishmania donovani в клетках СМФ, и гену BCG, который контролирует размножение Mycobacterium bovis (BCG) во внутренних органах мыши. Следовательно, единый ген Ity/Lsh/BCG оказался универсальным геном, определяющим естественный иммунитет животного к разным видам микроорганизмов.
Ген Lps контролирует устойчивость животного к действию эндотоксина (ЛПС). Дефект этого гена приводит к снижению активности макрофагов у мышей. Макрофаги теряют способность активироваться не только ЛПС, но и таким сильным активатором этих клеток, как BCG. У них снижается продукция монокинов и других медиаторов. Вместе с тем у мышей обнаружен еще один локус, отличный от Lps, который также определяет чувствительность мышей к S. typhimurium. Все указанные гены проявляют свое действие в первой, начальной стадии инфекции S. typhimurium. Их эффект связан с активацией ранних механизмов иммунной защиты. В период же формирования иммунитета против возбудителя начинают действовать другие гены.
Ген xid связан с Х-хромосомой, дефектный аллель xid-гена определяет недостаточность гуморального иммунитета (англ. X-linked immunodeficiency).
У мышей с таким показателем нарушается дифференцировка клеток Lyb5– в Lyb5+, в результате чего резко понижается образование антител IgM и IgG, необходимых для обеспечения гуморального иммунитета на поздней стадии инфекции. Однако нарушения функции Т-лимфоцитов и макрофагов не отмечено.
Ген nu влияет на активность Т-лимфоцитов на поздней стадии инфекции и, возможно, на переход болезни из острой формы в хроническую. Однако функции nu-гена, как и генов главной системы гистосовместимости мышей (H-2 генов), оказывающих влияние на течение инфекционного процесса, изучены слабо.
Ген поздней чувствительности мышей к сальмонеллезной инфекции определяет чувствительность их на поздней стадии инфекции: мыши погибают при внутрибрюшинном заражении на 4 – 5-й неделе заболевания, поэтому был обозначен как ген i/p (англ. intraperitoneally). Однако мыши погибают и при других способах заражения, поэтому ген получил новое обозначение Ity-2. Его хромосомная локализация пока не определена, а рецессивный характер наследования признака чувствительности не сцеплен с Х-хромосомой. Возможно, этот ген аналогичен Ir-гену.
При инфекционных процессах нередко наблюдается супрессия иммунного ответа хозяина на возбудителя. Она обусловлена активацией различных типов супрессорных клеток, в том числе Т-супрессоров и макрофагов. В результате иммуносупрессии снижается пролиферация Т– и В-лимфоцитов, синтез ИЛ-1, ИЛ-2, простагландинов, страдает функция представления антигенов иммунокомпетентным клеткам и т. п.
Индукция супрессии на антигены подавляется клетками Т-контрсупрессорами. Выраженность супрессии иммунного ответа, возможно, связана с генами Ity и Lps.
Изучение системы генов восприимчивости мышей к S. typhimurium показало, что эти гены контролируют все иммунологические реакции животного против возбудителя. Защита от возбудителя в месте его проникновения через слизистые оболочки, кроме секреторных IgA, контролируется геном Lps, подавление его размножения в системе мононуклеарных фагоцитов в ранней стадии – геном Ity. На поздних стадиях инфекции важную роль в механизмах защиты играют гены xid, nu, Ity-2 и другие категории генов, контролирующих иммунологические реакции организма.
Вряд ли можно сомневаться в том, что аналогичные гены, определяющие предрасположенность к различным заболеваниям или контролирующие их развитие по сильному или слабому типу, имеются и у человека. В частности, давно установлено, что у людей с разной системой изоантигенов эритроцитов существует неодинаковая генетическая предрасположенность к тем или иным инфекционным заболеваниям. Например, лица с группой крови А более устойчивы к брюшному тифу, но у них чаще формируется хроническое бактерионосительство S. typhi. У лиц, имеющих группу крови 0, такое бактерионосительство наблюдается наиболее редко. Тяжелые гнойно-септические заболевания, в том числе стафилококковой природы, чаще бывают у лиц, имеющих группу крови А и АВ, и реже у людей с группой крови 0 и В.
Установлена также определенная генетическая предрасположенность к тем или иным заболеваниям у людей с определенным фенотипом главной системы гистосовместимости (HLA). Например, опасность заболеть анкилозирующим спондилитом у лиц с фенотипом HLA-B27 составляет 90 %. Люди с этим фенотипом чаще болеют инфекционным иерсиниозным артритом и болезнью Рейтера. Лица с фенотипами HLA-A2, HLA-B5, HLA-B12 значительно чаще по сравнению с другими людьми болеют ревматизмом, гломерулонефритом и рожистым воспалением. Лица с фенотипом HLA-Bw15 в 6 раз, а с фенотипом HLA-B12 в 3 раза более подвержены опасности заболеть менингококковыми инфекциями, чем лица с фенотипом HLA-A1.
Механизмы, определяющие такую зависимость между предрасположенностью людей к различным заболеваниям, генами главной системы гистосовместимости и антигенами эритроцитов крови, сейчас интенсивно изучаются.
В свете этих новых данных открываются и новые пути фенотипической коррекции генетического контроля иммунного статуса организма.
Болезни иммунной системы (иммунодефицитные болезни)
Под болезнями иммунной системы понимают такие ее нарушения, которые препятствуют распознаванию и уничтожению всего чужеродного, что возникает в организме (мутантные клетки) или проникает в него (бактерии, вирусы и другие чужеродные антигены). Иммунодефицитные заболевания характеризуются снижением или полным отсутствием иммунного ответа в результате нарушения какого-то звена (звеньев) иммунной системы:
1. Дефицит функции тимуса.
2. Дефицит В-клеток. Дефекты стволовых костно-мозговых клеток. Дефицит антител.
3. Нарушение функции Т-клеток. Дефицит Т-клеток.
4. Одновременный дефицит Т– и В-клеток.
5. Дефицит макрофагов и других А-клеток.
6. Дефицит системы комплемента.
7. Дефицит системы интерферонов.
8. Те или иные аллельные факторы главной системы гистосовместимости.
9. Дефицит системы интерлейкинов.
Различают первичные и вторичные иммунодефицитные заболевания. Первичные иммунодефициты возникают в результате генетических нарушений, наступающих в стволовых клетках костного мозга или в системах Т– или В-лимфоцитов, или в обеих этих системах, или в других лимфоидных клетках (гранулоцитах), т. е. они являются генетически детерминированными болезнями иммунной системы. Вторичные иммунодефициты обусловлены поражением первоначально нормальной иммунной системы.
Первичные иммунодефициты сохраняются в течение всей жизни, но если они не распознаны и не лечены, больной может погибнуть. До 50-х гг. XX в. большинство таких больных умирало раньше, чем им ставили диагноз. Только после разработки методов диагностики первичных иммунодефицитов и способов их лечения (применение иммуноглобулинов, тимусных гормонов, антибиотиков, пересадка тимуса и т. п.) появилась возможность продления жизни больных. Известно около 20 форм первичных иммунодефицитов, связанных с нарушениями в системах Т– или В-клеток, или в обеих системах, или в системах других лимфоидных клеток. Они классифицируются в зависимости от типа нарушенных иммунных функций.
Дефицит лимфоцитов, макрофагов, антителообразующих клеток, гранулоцитов – это клеточная форма иммунодефицита. Больные с дефицитом Т-лимфоцитов особенно предрасположены к инфекционным заболеваниям. Многие вирусы могут вызывать у них из-за отсутствия Т-киллеров смертельное заболевание.
Большинство известных первичных иммунодефицитов связано с дефицитом антител. У таких больных очень низкий уровень IgG, IgA, IgM. Примерно у 25 % больных с первичным иммунодефицитом отсутствуют антитела, Т– и В-лимфоциты, поэтому они более всего восприимчивы к различным микроорганизмам, в том числе и к слабовирулентным.
Из числа первичных иммунодефицитов наиболее изучены следующие.
Болезнь Брутона – наследственная, сцепленная с полом гипогаммаглобулинемия, обусловленная дефектом В-клеток. У таких больных уровень IgG в крови снижен в 10 раз, а IgA и IgM – в 100 раз по сравнению с нормой, в периферической крови отсутствуют В-клетки. Однако реакции клеточного иммунитета не нарушены, у них нормально срабатывает противовирусный иммунитет (система интерферонов и Т-цитотоксических лимфоцитов).
У этих больных не образуются антитела против бактериальных инфекций, поэтому основное клиническое проявление этой формы иммунодефицита заключается в часто повторяющихся инфекциях, вызываемых гноеродными бактериями. Для их лечения и предупреждения необходимо введение массивных доз гамма-глобулина.
Швейцарская агаммаглобулинемия – наследственная, не сцепленная с полом (аутосомная) лимфопеническая агаммаглобулинемия, обусловленная дефицитом клеточного (Т-лимфоциты) и гуморального (В-лимфоциты) иммунитета. В крови абсолютная лимфопения (отсутствие Т– и В-лимфоцитов), уровень IgG, IgA и IgM очень низкий. Тимус не опускается, как в норме, и всегда имеется дефект его развития. Дети с таким иммунодефицитом не могут вырабатывать антитела и отвечать клеточными иммунными реакциями, они погибают в первые два года жизни от бактериальных или вирусных инфекций, или инфекций, вызванных Pneumocystis carinii.
Синдром третьего и четвертого глоточных мешков (синдром Ди Джорджи) – при этой форме иммунодефицита наблюдается аплазия тимуса и паращитовидных желез вследствие несостоявшегося развития третьего и четвертого глоточных мешков. У больных нарушены только клеточные механизмы иммунитета, но синтез иммуноглобулинов происходит нормально. Отсутствие клеточного иммунитета делает таких больных особо восприимчивыми к вирусным инфекциям. Самый ранний признак болезни – тетания, обусловленная недостатком кальция. На вскрытии иногда обнаруживают очень маленький тимус.
Избирательный дефицит IgA – довольно редкая форма иммунодефицита, сопутствующая чаще всего аутоиммунным болезням. Клеточные реакции иммунитета сохранены, уровни содержания в сыворотке крови IgG, IgM, IgE и IgD нормальны, но IgA отсутствуют, в том числе и секреторные антитела IgA. Поэтому больные особенно предрасположены к тем возбудителям, которые проникают через слизистые оболочки. Однако клинические симптомы IgA-агаммаглобулинемии отсутствуют.
Атаксия – телеангиэктазия – аутосомная рецессивная болезнь, связанная с дефектом развития мезенхимы. В сыворотке крови отсутствуют IgA, низкий или нормальный уровень IgG и нормальный уровень IgM. Нарушены реакции клеточного иммунитета. Тимус маленький и недоразвит, у девочек отсутствует нормальное развитие зародышевых клеток фолликулов яичников. Первым симптомом болезни является атаксия прогрессирующего мозжечкового типа. Позднее появляется кожноглазная телеангиэктазия (локальное чрезмерное расширение капилляров и мелких сосудов). Часто наблюдаются рецидивирующие респираторные инфекции, связанные с дефицитом IgA и IgE.
Иммунодефицит с тромбоцитопенией и экземой – наследственная болезнь, характеризующаяся центральной тромбоцитопенией, а также себорейными и экзематозными высыпаниями. Наиболее ранний признак – кровоточивость. В сыворотке крови – дефицит IgM. По мере развития болезни выявляются дефекты клеточного иммунитета. Больные очень предрасположены ко многим инфекциям, в особенности вызываемым грамотрицательными бактериями, а также к злокачественным лимфоретикулярным процессам.
Лечение обычно малоэффективно, и больные погибают либо от инфекционных болезней, либо от кровотечений, либо от злокачественных новообразований. Лишь пересадка костного мозга от хорошо подобранного донора или лечение массивными дозами циклофосфамида позволяют несколько продлить жизнь больного.
Хронический гранулематоз – заболевание, связанное с недостаточной функцией лизосомальных ферментов. Лейкоциты фагоцитируют бактерии, но не могут их переваривать. У больных часто наблюдаются рецидивирующие стафилококковые абсцессы, отиты, гнойные выделения из носа, экзематоидные высыпания. Сегментоядерные лейкоциты у таких больных не способны убивать бактерии in vitro и восстанавливать нитросиний тетразолий.
Диссеминированный слизисто-кожный кандидоз – редкое заболевание, наблюдается обычно у детей в виде трех форм: хронический кандидоз, сопряженный с эндокринопатиями, в том числе с развитием болезни Аддисона; хронический локализованный слизисто-кожный кандидоз, не сопровождающийся эндокринопатиями; кандидоз, характеризующийся грибковыми гранулемами.
Изменений в составе и содержании иммуноглобулинов в крови обычно не отмечается, лишь у больных с грибковыми гранулемами в сыворотке крови могут отсутствовать IgA. Как правило, больные не приобретают аллергии к кандидину, плохо отторгают кожный трансплантат, что указывает на нарушение реакций клеточного иммунитета. Отмечается дефицит синтеза фактора, угнетающего миграцию лейкоцитов. Лечение амфотерицином В смягчает инфекционный процесс, но не излечивает его.
Одна из причин иммунодефицита связана с недостаточностью ферментов аденозиндезаминазы и пуриннуклеозидфосфорилазы. Эти ферменты катализируют последовательные этапы распада пуриновых нуклеотидов – аденозина и дезоксиаденозина. Отсутствие ферментов у человека приводит к тяжелым последствиям. У некоторых, но не у всех, детей грудного возраста, больных швейцарской агаммаглобулинемией, наблюдается отсутствие фермента аденозиндезаминазы в эритроцитах и других тканях. Дефицит пуриннуклеозидфосфорилазы предрасполагает к тяжелым инфекционным заболеваниям, которые проявляются со второго полугодия жизни. В крови у таких больных – прогрессирующая с возрастом лейкопения, связанная со значительным уменьшением количества Т-лимфоцитов. Гены, кодирующие синтез аденозиндезаминазы и пуриннуклеозидфосфорилазы, идентифицированы, клонированы, их нуклеотидная последовательность изучена. Это позволит в перспективе осуществлять коррекцию таких нарушений путем замены поврежденных генов в соматических клетках на здоровые.
Установлены также дефекты ряда других конкретных генов, обусловливающих развитие того или иного варианта иммунодефицита. Не менее 7 таких генов несет Х-хромосома. Выдвинута гипотеза о значении апоптоза в развитии первичных иммунодефицитов. Согласно этой гипотезе, контролируемый апоптоз (в его регуляции участвуют интерлейкины 1 – 6, интерфероны, ФНОα и β) – главный механизм поддержания баланса в иммунной системе. Нарушение координации апоптоза может привести к серьезному нарушению баланса в сторону как подавления (аутоиммунная патология, иммуноонкология), так и усиления (иммунодефициты) запрограммированной гибели клеток. Такие иммунодефициты предложено обозначать как апоптотические иммунодефициты (Т. В. Ковальчук, А. Н. Чередеев).
Диагностика первичных иммунодефицитов
Поскольку иммунодефициты часто передаются по наследству, важно выявить в семейном анамнезе других детей с подобными заболеваниями, а также установить, не являются ли родители родственниками между собой, так как многие из этих болезней передаются как рецессивный признак. Конкретная же диагностика иммунодефицита определяется его природой, т. е. тем, какое звено иммунитета нарушено: системы Т-, В-лимфоцитов, макрофагов, других клеток иммунной системы или биосинтез антител.
С этой целью проводят следующие исследования:
1. Полный анализ крови с подсчетом общего количества лимфоцитов. Если их меньше чем 2000 в 1 мл, то можно предполагать наличие иммунодефицита. Важно также установить общее количество отдельно В– и Т-лимфоцитов и качественный состав последних. Подсчет тромбоцитов позволяет выявить тромбоцитопению, часто наблюдаемую при этих заболеваниях.
2. Определение общего уровня иммуноглобулинов и их количественного и качественного соотношения в сыворотке крови. Содержание в 100 мл крови иммуноглобулинов менее чем 400 мг % или IgG менее 200 мг % дает основание подозревать иммунодефицит.
3. Рентгенологическое исследование носоглотки и шеи в боковой проекции. Отсутствие тени тимуса и лимфоидной ткани указывает на клеточный иммунодефицит.
4. Проба на повышенную чувствительность замедленного типа. Ее отсутствие – свидетельство дефекта количества или функций Т-лимфоцитов.
5. Определение митогенного эффекта фитогемагглютинина на лимфоциты или определение эффекта бласттрансформации. Их отсутствие или слабое проявление также указывает на дефицит Т-клеток.
6. Определение фагоцитарной активности и активности системы комплемента в опытах с живыми бактериями. У больных, страдающих первичным иммунодефицитом, функции этих систем часто подавлены, поэтому они подвержены различным инфекционным процессам.
7. Использование других, более специализированных тестов, применяемых для изучения иммунного статуса.
Вторичные (приобретенные) иммунодефициты
Возникают на фоне изначально нормальной иммунной системы как следствие недостаточности питания, развития злокачественных опухолей, инфекционных заболеваний, воздействия ионизирующей радиации, цитотоксических препаратов, суперантигенов, аутоиммунных заболеваний и других патологических состояний, например серповидно-клеточной анемии, уремии и т. п.
Вторичные иммунодефициты, в отличие от первичных, проходят при излечении основного заболевания. Отмечено, что у больных с иммунодефицитами относительно часто обнаруживают аутоантитела и аутоиммунные болезни.
К наиболее тяжелым формам вторичного иммунодефицита относятся ВИЧинфекция, злокачественные процессы (рак). При всех формах первичной иммунологической недостаточности у человека повышена частота злокачественных процессов, которые обычно захватывают клетки лимфоретикулярной системы. Опухоли иммунной системы подразделяют на В-клеточные злокачественные новообразования (лимфосаркома, хронический лимфолейкоз), Т-клеточные новообразования (грибовидный микоз, острые формы лимфолейкоза); заболевания, которые протекают с усиленной пролиферацией «нулевых» лимфоцитов. Возникнув как следствие какого-то дефекта иммунной системы, злокачественные опухоли сами становятся причиной развития вторичного тяжелого иммунодефицита. Поэтому проблема рака – это во многом проблема иммунодефицита, первичного и приобретенного.
В ряде случаев организм иммунологически реагирует на некоторые собственные антигены (аутоантигены), к которым появляются аутоантитела. Если взаимодействия между аутоантигенами и аутоантителами приводят к повреждению тканей, их определяют как реакции повышенной чувствительности. Если же эти повреждения приводят к выраженным клиническим проявлениям, такие болезни относят к категории аутоиммунных. Аутоиммунные реакции могут быть опосредованы, как и другие реакции иммунитета, антителами или Т-клетками. Аутоиммунная болезнь – это патология, при которой аутоантитела или сенсибилизированные лимфоциты атакуют собственные ткани организма.
Аутоантигены возникают в результате изменений ткани, вызванных различными факторами (соматические мутации, воздействие патогенов, химических веществ и т. п.). Существуют нормальные, скрытые, или секвестированные, антигены (антигены спермы, хрусталика глаза, тиреоглобулин). Если эти антигены из-за травмы или инфекционного процесса выходят из своих тканей и поступают в кровь, к ним возникают аутоантитела. В свою очередь, соматические мутации В– и Т-клеток могут приводить к возникновению клонов этих клеток, способных синтезировать антитела к собственным антигенам или атаковать и разрушать клетки некоторых тканей. Аутоиммунные болезни могут возникать и вследствие утраты иммунологической толерантности к некоторым собственным антигенам (недостаточность супрессорных клеток). Это может быть результатом прямого воздействия химических веществ, медикаментов или патогенов на лимфоидную ткань либо унаследованной иммунологической недостаточностью. Аутоиммунные болезни часто встречаются у людей с первичным иммунодефицитом. Иммунодефицит и аутоиммунные явления нередко сочетаются у стареющих людей.
Таким образом, аутоиммунные болезни возникают в результате взаимодействия нормальных антител с аутоантигеном либо измененных антител (или клеток) – с нормальным антигеном. Частое сочетание у больных нескольких аутоиммунных явлений и наследуемый характер аутоиммунитета дают основание полагать, что в его основе лежит нарушение какого-то центрального механизма, контролирующего аутотолерантность.
Различают аутоиммунные болезни генерализованные (системная красная волчанка, прогрессирующий системный склероз, ревматоидный артрит и др.) и органо– и тканеспецифические (миастения, тиреоидит и др.). Генерализованные аутоиммунные болезни возникают вследствие образования антител к антигенам, общим для нескольких органов и тканей человека. Типичным примером такой аутоиммунной болезни является системная красная волчанка. Она характеризуется многообразием аутоиммунных явлений, обусловленным тем, что мишенью для образующихся при этой болезни комплексов антиген + антитело + комплемент являются компоненты ядра и цитоплазмы, общие для многих типов клеток. Эти комплексы вызывают осложнения главным образом благодаря их отложению в стенке малых кровеносных сосудов. Болезнь проявляется в развитии васкулитов во многих системах органов, включая кровеносную систему, кожу, суставы и почки, в результате чего развиваются гемолитическая анемия, лейкопения, тромбоцитопеническая пурпура, геморрагический синдром, гломеруло-нефрит и почечная недостаточность. В основе болезни лежит появление аутоантител к различным клеточным антигенам, в том числе к ДНК. Образование многочисленных аутоантител сочетается с гипергаммаглобулинемией и сопровождается снижением уровня комплемента. В патогенезе болезни играют роль генетические, иммунологические и вирусные факторы.
Для диагностики системной красной волчанки используют два основных метода.
1. Обнаружение клеток красной волчанки – гранулоцитов, поглощающих комплексы антиген + антитело и поэтому имеющих характерную морфологию: в центре образуется большая аморфная масса, а многодольчатое ядро окружает ее и сдвинуто на периферию.
2. Обнаружение антител против белка или ядерного материала гранулоцитов с помощью флуоресцирующих противоядерных антител.
Для лечения используют цитоксан (подавляет образование антител) и стероиды (наряду с угнетением образования антител подавляют воспаление). Ткане– и органоспецифические аутоиммунные болезни характеризуются аутоиммунным ответом на антиген, присутствующий только в определенном типе клеток.
Частота появления аутоантител с возрастом увеличивается, и соответственно увеличивается число заболеваний, при которых действует аутоиммунный фактор. Этому фактору приписывают ведущую роль в этиологии и патогенезе многих заболеваний, в частности при тиреоидите (болезнь Хашимото), гемолитической анемии, язвенном колите, аллергическом энцефаломиелите, тромбоцитопенической пурпуре, прогрессирующем системном склерозе, некоторых болезнях печени, хроническом мембранозном гломерулонефрите, склеродермии, миастении гравис, синдроме Гудпасчера (наследственный легочно-почечный синдром) и других болезнях.
Решение вопроса об аутоиммунной природе заболеваний основывается на следующих критериях: наличие в крови аутоантител, сенсибилизированных лимфоцитов, аутоантигенов; возможность пассивной передачи сенсибилизации к соответствующему антигену с помощью сыворотки или лимфоцитов; экспериментальное воспроизведение сенсибилизации к данному антигену и сходство клинической картины естественного и экспериментального иммунного процессов. Органоспецифические аутоиммунные заболевания поддаются лечению так же трудно, как и генерализованные. Это определяется природой нарушенных функций специфического органа.
Основной принцип лечения аутоиммунных заболеваний – использование иммуносупрессивных препаратов.
Иммунопрофилактика и иммунотерапия
Иммунопрофилактика – способ предупреждения инфекционных заболеваний в коллективе и у отдельных индивидуумов путем создания искусственного специфического иммунитета. Существует две основные формы иммунизации:
1) активная, в основе которой лежит введение в организм микробных антигенов (вакцин) с целью создания активного иммунитета;
2) пассивная, основанная на введении в организм препаратов, содержащих специфические антитела (иммунные сыворотки, гамма-глобулины), с целью создания искусственного пассивного иммунитета.
В некоторых случаях, например для предупреждения столбняка или бешенства, прибегают к сочетанию пассивной и активной иммунопрофилактики, когда в организм последовательно вводится вначале иммунная сыворотка (гамма-глобулин), а затем вакцина для получения более надежных результатов.
Массовая пассивная иммунизация проводилась ранее, когда не было эффективных вакцин против ряда болезней, например вирусных гепатитов, по эпидемическим показаниям путем введения гамма-глобулинов направленного действия, т. е. содержащих антитела против конкретного возбудителя, детям дошкольного возраста.
Препараты иммуноглобулина получают из сывороток крови (или плацентарной массы) лиц, переболевших данной инфекционной болезнью, или специально иммунизированных людей или животных. Они содержат концентрированные антитела, свободные от дополнительных сывороточных белков, и поэтому более эффективны и менее реактогенны, чем иммунные сыворотки. Однако такая массовая гамма-глобулиновая профилактика (пассивная иммунизация) не решила проблем ликвидации массовых инфекционных заболеваний. Поэтому в настоящее время пассивная иммунизация, осуществляемая с помощью иммунных сывороток или препаратов иммуноглобулинов, используется лишь в случаях конкретного риска заболеть столбняком, бешенством, корью, клещевым энцефалитом, ботулизмом и некоторыми другими инфекциями, особенно лиц с ослабленным видовым иммунитетом и детей раннего возраста.
Основную роль в специфической профилактике инфекционных болезней играет метод активной иммунизации, или вакцинопрофилактика. Со времен Э. Дженнера, который в 1796 г. впервые сделал прививку человеку против оспы с помощью вакцины (вируса коровьей оспы, лат. vaccinum – коровий, лат. vacca – корова), все препараты, используемые для искусственного создания приобретенного активного специфического иммунитета против определенных возбудителей или их токсинов, называют вакцинами. Они должны отвечать строгим требованиям, а именно: обладать достаточно высокой иммуногенностью, т. е. вызывать образование прочного и по возможности длительного специфического иммунитета; быть абсолютно безопасными для организма; обладать низкой реактогенностью; не вызывать нежелательных побочных реакций; стабильно сохранять при правильном хранении свои иммуногенные свойства; иметь возможность быть включенными в комплексные вакцины и отвечать другим установленным международным стандартам. По составу входящих в них антигенов различают моновакцины, содержащие антиген одного серовара; поливакцины, содержащие антигены нескольких сероваров, и комплексные, или комбинированные, или ассоциированные, вакцины, которые содержат антигены или нескольких видов микроорганизмов, или одного и того же, но в различных вариантах (корпускулярные и химические).
Методы введения вакцин в зависимости от особенностей микроорганизмов, из которых они получены, могут быть различными: накожно, внутрикожно, подкожно, внутримышечно, интраназально, перорально (энтерально), через слизистые оболочки дыхательных путей с использованием искусственных аэрозолей живых или убитых вакцин.
По природе составляющих их компонентов вакцины разделяют на три основные группы – живые, убитые и химические, включая анатоксины.
Живые вакцины готовят из штаммов бактерий и вирусов с ослабленной (или утраченной) вирулентностью. Главное достоинство таких вакцин состоит в том, что живые микроорганизмы, размножающиеся в организме привитых, вызывают бессимптомную (латентную) инфекцию, аналогичную очень часто наблюдаемой в естественных условиях. Поэтому образующийся в этом случае искусственный приобретенный иммунитет ничем не отличается от естественно приобретенного активного иммунитета и, как правило, является прочным и продолжительным, нередко пожизненным. С большим успехом живые вакцины применяют для профилактики полиомиелита, кори, желтой лихорадки, туляремии, бруцеллеза, эпидемического паротита и других заболеваний. Однако у живых вакцин имеются существенные недостатки. Они могут вызывать сенсибилизацию организма, содержат большой набор антигенов, среди которых могут встречаться и перекрестно реагирующие с антигенами человека, вызывают большую нагрузку на иммунную систему и т. п. Живые вакцинные штаммы некоторых вирусов могут стать причиной тяжелых персистентных инфекций, вызывать поражение генетического аппарата клеток.
Убитые вакцины, как правило, менее иммуногенны, чем живые, и также имеют недостатки – сенсибилизация организма, большая нагрузка на его иммунную систему, реактогенность и токсичность, обусловленные наличием липидов и других химических соединений.
Как бактериальная клетка, так и вирион представляют собой мозаику антигенов, среди которых лишь немногие обладают наибольшими протективными свойствами, т. е. являются главными эпитопами. Поэтому идеальным было бы готовить вакцины, содержащие только «нужные» антигены и лишенные «ненужных», вызывающих дополнительную нагрузку на иммунную систему антигенов. С этой целью и разрабатывались методы получения высокоиммуногенных химических вакцин. Большая заслуга в создании химических вакцин принадлежит Г. Рамону, разработавшему в 1923 – 1926 гг. метод химической модификации с помощью формалина экзотоксинов в анатоксины. Полученные им дифтерийный и столбнячный анатоксины оказались самыми эффективными средствами специфической профилактики этих инфекций. Химические вакцины готовят из различных антигенных компонентов как бактерий (антигены клеточной стенки, Vi-антиген, Н-антигены, рибосомальные антигены), так и вирусов (субвирионные, субъединичные вакцины). Большое внимание уделяется разработке липосомных вакцин, которые представляют собой комплексы, состоящие из антигенов и липофильных носителей. Иммунолипосомы более энергично стимулируют выработку антител, кроме того, они вызывают пролиферацию Т-лимфоцитов и секрецию ими IL-2.
В общей сложности в нашей стране производится 7 различных вариантов анатоксинов, 22 антибактериальных и 15 противовирусных вакцин. Вакцины против туберкулеза и массовых детских инфекций обязательны для применения, остальные используют для вакцинации угрожаемого контингента по эпидемическим показаниям.
Помимо традиционных вакцин (живых, убитых, химических) разработаны методы создания вакцин новых поколений, к которым относятся: искусственные (полностью синтетические) химические вакцины; вакцины, получаемые методами генной инженерии; и кассетные (экспозиционные) вакцины.
Искусственные вакцины создают из такого биоорганического комплекса, который обеспечивает сильный иммунный ответ организма на данный антиген, даже вопреки его генетически предопределенной Ir-генами слабости иммунного ответа. Для этого необходимо выявить главную антигенную молекулу, расшифровать ее структуру, определить главный детерминант (эпитоп), ответственный за иммунизацию, осуществить химический синтез этой молекулы или ее эпитопа и химически сшить ее с носителем антигенности (шлеппером). В качестве таких носителей антигенности используют синтетические (неприродные) полимеры – полиэлектролиты. Некоторые из них оказались мощными иммунными стимуляторами и вызывают сильный иммунный ответ, обходя контроль со стороны Ir-генов и тимуса. Таким образом, искусственные вакцины конструируются путем создания макромолекулярных комплексов на основе неприродных полиэлектролитов и химически синтезированных главных антигенных детерминантов.
Генно-инженерные вакцины. Принцип создания генно-инженерных вакцин заключается в том, что ген (гены), ответственный за синтез наиболее иммуногенных детерминантов, встраивается в какую-либо самореплицирующуюся генетическую структуру, например в состав плазмиды или безопасного вируса (вируса осповакцины). Если вектором (носителем) этого гена является вирус осповакцины, то, размножаясь в организме привитых, он будет индуцировать образование иммунитета не только против оспы, но и против того возбудителя, чей ген встроен в его геном. Если в состав генома вируса осповакцины ввести ген поверхностного антигена вируса гепатита В (HBsAg), то такой рекомбинантный вирус будет создавать иммунитет против гепатита В. Если же вектором этого гена является плазмида, то при размножении рекомбинантного клона микроорганизма, например дрожжей, будет вырабатываться поверхностный антиген, который затем используют для создания вакцин.
Имеются очень широкие возможности конструирования самых различных вариантов генно-инженерных вакцин, одним из которых являются кассетные вакцины.
Кассетные, или экспозиционные, вакцины. Носитель антигенности в такой вакцине представляет собой белковую структуру, на поверхности которой располагаются (экспонируются) введенные в нее генно-инженерным или химическим путем соответствующие детерминанты либо одной специфичности, либо разных. Такая вакцина, являясь носителем специально отобранных и представляемых ею антигенных детерминантов, должна быть «идеальным» иммуногеном, так как она обладает высокой антигенностью и несет только необходимые для формирования специфического иммунитета детерминанты.
Расширенная программа иммунизации ВОЗ и перспективы ликвидации ряда инфекционных заболеваний
Иммунизация – одно из наиболее эффективных средств борьбы со многими инфекционными болезнями. Однако долгое время прививками против массовых инфекционных заболеваний, особенно в развивающихся странах, охватывались далеко не все дети. Поэтому в 1974 г. 27-я Всемирная ассамблея ВОЗ приняла резолюцию, которая послужила основой для Расширенной программы иммунизации (РПИ). Подсчитано, что в отсутствие иммунизации ежегодно погибали бы от заболеваний, предотвращаемых ныне прививками, 5 млн детей, из них более половины – от кори, а 1,2 млн и 0,8 млн – от столбняка новорожденных и коклюша соответственно. В соответствии с РПИ, к 1990 г. все дети в возрасте до 1 года должны были получать прививки против туберкулеза, кори, коклюша, столбняка, полиомиелита, дифтерии. В 1989 г. были выдвинуты новые задачи для включения в РПИ:
1) ликвидировать столбняк новорожденных к 1995 г.;
2) сократить к 1995 г. число случаев кори на 90 %;
3) полностью искоренить к 2000 г. полиомиелит;
4) включить в РПИ новые вакцины – против желтой лихорадки и гепатита В;
5) добиться резкого снижения заболеваемости проказой во всем мире.
Успешный опыт борьбы с оспой показал, что с помощью иммунизации представляется возможной в ближайшие годы ликвидация еще ряда инфекционных болезней. В 1988 г. была организована международная служба по ликвидации заболеваний (МСЛЗ). К числу заболеваний, которые могут быть объектами глобальной ликвидации уже в ближайшие 10 – 15 лет, отнесены: полиомиелит, паротит, краснуха, корь. К числу потенциально ликвидируемых заболеваний – желтая лихорадка, коклюш, дифтерия, а к числу тех, распространение которых можно предупредить, – гепатит В и столбняк новорожденных. Для повышения эффективности вакцинации предусматривается расширение существующих и создание новых технологий производства вакцин. Имеется в виду разработка новых, более эффективных вакцин с расширением основного набора антигенов (до 14 универсальных антигенов) против главных бактериальных и вирусных инфекций при наличии региональных вариантов с включением, в случае необходимости, дополнительных антигенов.
В широком смысле слова под иммунотерапией следует понимать такой метод лечения, при котором осуществляется воздействие на иммунную систему: ее стимуляция, восстановление или исправление иммунных структур (коррекция иммунодефектов), временное замещение или подавление иммунного ответа и т. п. В более узком понимании, иммунотерапия – специфические методы лечения инфекционных заболеваний с помощью иммунных сывороток (серотерапия) или вакцин (вакцинотерапия), или аллергенов (десенсибилизация).
Серотерапия – метод лечения инфекционных болезней, основанный на введении больному иммунных сывороток или препаратов иммуноглобулина, содержащих специфические антитела к возбудителю болезни или его токсинам. Серотерапия наиболее эффективна при тех заболеваниях, патогенез которых определяется экзотоксином, продуцируемым возбудителем (дифтерия, столбняк, ботулизм, газовая гангрена). Своевременное введение антител приводит к нейтрализации токсина и прекращению его действия.
Вакцинотерапия. Вакцины могут быть использованы не только для профилактики, но и для лечения инфекционных болезней. Вакцинотерапия основана на введении больному вакцины (анатоксина) или отдельных микробных антигенов с целью стимуляции иммунитета и (или) десенсибилизации организма к данному микроорганизму или его антигенам. Вакцинотерапию используют обычно при хронических, рецидивирующих инфекциях или при тех заболеваниях, при которых естественноприобретенный иммунитет развивается медленно и непрочен. Для вакцинотерапии применяют либо стандартные лечебные вакцины, либо вакцину, изготовленную из штамма, выделенного от данного больного (аутовакцину).
Десенсибилизация. Различают два типа десенсибилизации:
1) временное подавление эффекторного звена при повторном введении антигена;
2) гиперсенсибилизация – способ лечения ГЧЗ путем многократного введения в возрастающих дозах (или однократно в форме депонированного препарата) аллергена для стимуляции синтеза антител, относящихся к классам IgG и IgM, которые конкурируют с антителами IgE за аллергены и подавляют дальнейший синтез IgE.
Реакции иммунной сыворотки (серологические реакции)
Взаимодействие антигена с антителом проявляется в форме различных иммунологических, или серологических (лат. serum – сыворотка), реакций. В связи с их высокой чувствительностью и специфичностью они нашли широкое диагностическое применение.
Серологические реакции применяют с одинаковым успехом для двух целей. Вопервых, по известному антигену (диагностикуму) определяют в исследуемой сыворотке наличие и количественное содержание специфических к данному антигену антител. Последнее устанавливают путем титрования сыворотки. Титром иммунной сыворотки называют то ее максимальное разведение, которое еще дает положительную реакцию. Во-вторых, с помощью известного антитела, т. е. диагностической иммунной сыворотки, определяют наличие в исследуемом материале специфического микробного антигена или осуществляют серологическую идентификацию выделенного возбудителя.
С диагностической целью используют следующие серологические реакции:
1. Реакция агглютинации в ее различных вариантах.
2. Реакция преципитации и ее различные модификации.
3. Реакции иммунофлуоресценции (РИФ) в прямом и непрямом вариантах.
4. Реакции, протекающие с участием комплемента.
5. Реакции, протекающие с участием фагоцитов.
6. Реакции иммуносорбентного анализа твердой фазы.
7. Реакции нейтрализации биологической активности возбудителя или токсинов.
Агглютинация (лат. agglutinatio – склеивание) – склеивание (соединение) антигеннесущих корпускулярных частиц (цельные клетки, частицы латекса и др.) молекулами специфических антител в присутствии электролитов, которое заканчивается образованием видимых невооруженным глазом хлопьев или осадка (агглютината). Характер осадка зависит от природы антигена: жгутиковые бактерии дают крупнохлопьевидный осадок, безжгутиковые и бескапсульные – мелкозернистый, капсульные – тяжистый. Различают агглютинацию прямую, при которой во взаимодействии со специфическими антителами непосредственно участвуют собственные антигены бактериальной или любой другой клетки, например эритроцитов; и непрямую, или пассивную, при которой бактериальные клетки или эритроциты, или частицы латекса являются носителями не собственных, а сорбированных на них чужих антигенов (или антител) для выявления специфических к ним антител (или антигенов). В реакции агглютинации участвуют главным образом антитела, относящиеся к классам IgG и IgM. Она протекает в две фазы: вначале происходит специфическое взаимодействие активного центра антител с детерминантом антигена, эта стадия может происходить в отсутствие электролитов и не сопровождается видимыми изменениями реагирующей системы. Для второй стадии – образования агглютината – необходимо наличие электролитов, которые снижают электрический заряд комплексов антиген + антитело и ускоряют процесс их склеивания. Эта фаза заканчивается образованием агглютината.
Реакции агглютинации ставят либо на стеклянных, либо на гладких картонных пластинках, либо в стерильных агглютинационных пробирках. Реакции агглютинации (прямые и пассивные) на стекле обычно применяют в качестве ускоренного метода обнаружения специфических антител в сыворотке больного (например, при бруцеллезе) или для серологической идентификации возбудителя. В последнем случае обычно используют хорошо очищенные (адсорбированные) диагностические сыворотки, содержащие только монорецепторные антитела или их набор к различным антигенам. Несомненным достоинством реакции агглютинации на стекле является простота ее постановки и то, что она протекает несколько минут или даже секунд, так как оба компонента в ней используются в концентрированном виде. Однако она имеет лишь качественное значение и менее чувствительна, чем пробирочная. Развернутая реакция агглютинации в пробирках дает более точные результаты, ибо она позволяет определить количественное содержание антител в сыворотке (установить ее титр) и при необходимости зарегистрировать факт нарастания титра антител, что имеет диагностическое значение. Для постановки реакции в агглютинационные пробирки вносят определенным образом разведенную 0,85 % раствором NaCl сыворотку и равный объем (обычно 0,5 мл) суспензии стандартного диагностикума (или исследуемой культуры), содержащего в 1 мл 1 млрд бактерий. Учет результатов реакции агглютинации производят предварительно через 2 ч инкубации пробирок при температуре 37 °C и окончательно через 20 – 24 ч по двум признакам: наличию и величине осадка и степени прозрачности надосадочной жидкости. Оценку осуществляют по четырехкрестной системе. Реакция обязательно сопровождается контролем сыворотки и антигена. В тех случаях, когда развернутую реакцию агглютинации в пробирке ставят для серологической идентификации возбудителя, она имеет диагностическое значение, если реакция оценена как положительная при разведении диагностической сыворотки не менее половины ее титра.
Необходимо учесть, что при смешивании растворов гомологичных антигенов и антител не всегда наблюдаются видимые проявления реакции агглютинации. Осадок образуется только при некоторых оптимальных соотношениях обоих компонентов реакции. Вне этих пределов, при значительном избытке антигена или антител, реакции не наблюдается. Это явление получило название «феномена прозоны». Оно наблюдается как при реакции агглютинации, так и при реакции преципитации. Появление прозоны в иммунных реакциях объясняется тем, что участвующие в них антигены, как правило, являются полидетерминантными, а молекулы антител IgG имеют два активных центра. При избытке антител поверхность каждой частицы антигена покрывается молекулами антител так, что не остается свободных детерминантных групп, поэтому второй, несвязанный активный центр антител не может взаимодействовать с другой антигенной частицей и связывать их друг с другом. Образование видимого агглютината или преципитата подавляется также при избытке антигена, когда не остается ни одного свободного активного центра антител, и поэтому комплексы антиген + антитело + антиген не могут более укрупняться.
Варианты ускоренных реакций агглютинации. Реакция пассивной гемагглютинации и ее варианты
Классическая реакция агглютинации предусматривает использование корпускулярных антигенов. Однако в ней могут участвовать и растворимые антигены. Чтобы это стало возможным, такие антигены адсорбируют на иммунологически инертных частицах. В качестве носителя можно использовать частицы латекса или бентонита, однако в настоящее время наиболее часто применяют эритроциты животных или человека, улучшая их адсорбирующие свойства обработкой растворами танина, формалина или бензидина. Эритроциты, адсорбировавшие на себе антиген, называются сенсибилизированными данным антигеном, а иммунная реакция, в которой они участвуют, – реакцией непрямой, или пассивной, гемагглютинации (РНГА, или РПГА), так как эритроциты участвуют в ней пассивно.
РПГА ставят в специальных полистироловых пластинках с луночками, имеющими полусферическое дно. При использовании ее для серологической диагностики в этих луночках готовят двукратные разведения в физиологическом растворе исследуемой сыворотки и затем добавляют к ней в качестве диагностикума взвесь сенсибилизированных эритроцитов. Учет результатов проводят через 2 ч инкубации при температуре 37 °C по четырехкрестной системе. При положительной реакции агглютинировавшиеся эритроциты оседают на дно луночки и равномерно покрывают его в виде перевернутого зонтика. При отрицательной реакции эритроциты тоже оседают, жидкость становится прозрачной, осадок выглядит как маленький диск в центре луночки. Титром сыворотки в РПГА считается последнее ее разведение, которое еще дает ярко выраженную гемагглютинацию без значительных признаков наличия диска.
РПГА может применяться также в качестве ускоренного метода бактериологической диагностики для обнаружения непосредственно в исследуемом материале неизвестных бактерий, вирусов, токсинов, например возбудителей чумы, стафилококковых энтеротоксинов и др. При таком варианте постановки РПГА в роли известного компонента реакции используют эритроциты, адсорбировавшие антитела известной специфичности – антительный эритроцитарный диагностикум. Если исследуемый материал содержит достаточное количество известного антигена, РПГА будет положительна.
Вариантами использования РПГА являются: реакция нейтрализации антигена (РНАг), реакция нейтрализации антител (РНАт), реакция торможения пассивной гемагглютинации (РТПГА). Для этих реакций используют антигенные и антительные эритроцитарные диагностикумы. Можно использовать одновременно две взаимно контролирующие однонаправленные реакции, например РПГА с антигенным диагностикумом и РНАг с антительным эритроцитарным диагностикумом.
Реакция нейтрализации антител (РНАт) заключается в том, что суспензию, содержащую искомый антиген, смешивают со специфической иммунной сывороткой, содержащей известные антитела, в соответствующих объемах и инкубируют при температуре 37 °C в течение двух часов. После этого добавляют антигенный эритроцитарный диагностикум. Смесь встряхивают и оставляют при комнатной температуре. Результаты учитывают через 3 – 4 ч и окончательно – через 18 – 24 ч. Если в исследуемом материале имеется антиген, он свяжет антитела (нейтрализует их), и поэтому гемагглютинации не произойдет.
По такому же принципу ставят реакцию нейтрализации антигена (РНАг). Только в этом случае в исследуемом материале обнаруживают антитела. Специфический антиген, добавленный к такому исследуемому материалу, будет связываться с антителами, содержащимися в нем, т. е. произойдет нейтрализация антигена антителами, и поэтому гемагглютинации при добавлении антительного эритроцитарного диагностикума не произойдет.
Реакция коагглютинации. Является одним из вариантов пассивной, т. е. опосредованной клетками-носителями антител, ускоренной реакции агглютинации на стекле. В основу этой реакции положено уникальное свойство золотистого стафилококка, имеющего в составе своей клеточной стенки белок А, связываться с Fc-фрагментами IgG и IgM. При этом активные центры антител остаются свободными и могут взаимодействовать со специфическими детерминантами антигенов. На предметное стекло наносят каплю 2 %-ной взвеси стафилококков, сенсибилизированных соответствующими антителами, и добавляют каплю взвеси исследуемых бактерий. При соответствии антигена антителам через 30 – 60 с происходит четкая агглютинация нагруженных антителами стафилококков.
Реакция латекс-агглютинации (ЛАГ). Носителем антител в этой диагностической системе являются мелкие стандартные частички латекса. Реакцию выполняют микрометодом в лунках на стекле. Основным условием успешной постановки ЛАГ является строгое соблюдение количественных соотношений компонентов системы: к 50 мкл исследуемого материала добавляют 10 мкл латекс-препарата, сенсибилизированного антителами. Специфичность ЛАГ контролируют с помощью трех контрольных тестов, содержащихся в коммерческих тест-системах: заведомо положительная реакция, заведомо отрицательная реакция и контроль качества латекс-суспензии по ЛАГ-несенсибилизированным (не несущим антител) латексам с исследуемым материалом. В нашей стране в качестве носителей специфических антител используют полистироловые монодисперсные латексы с разным диаметром частиц (0,3; 0,66; 0,75; 0,8 мкм). ЛАГ используют для быстрого обнаружения микроорганизмов или их антигенов в исследуемом материале.
Иммуномагнитное обнаружение антигенов. Один из вариантов ускоренной реакции агглютинации на стекле связан с применением супермагнитных полимерных частиц, покрытых специфическими антителами. Одна такая частица связывает до 107– 108 клеток микроорганизмов, благодаря чему чувствительность данного метода достигает 5 КОЕ/мл. Иммуномагнитное обнаружение микроорганизмов можно применять в комплексе с ЦПР.
Реакция агрегат-гемагглютинации (РАГА). Позволяет быстро обнаружить в крови больных как свободно циркулирующие антигены (антигенемия), так и антигены, связанные с антителами, – циркулирующие иммунные комплексы (ЦИК). Для РАГА используют эритроциты, сенсибилизированные соответствующими антителами. Добавление сыворотки крови больного, в которой содержатся антигены, к сенсибилизированным эритроцитам, на которых фиксированы антитела, приводит к склеиванию (агглютинации) эритроцитов и иммунных комплексов.
Антиглобулиновая проба Кумбса (реакция Р. Кумбса). При помощи реакций прямой и пассивной агглютинации определяют полные (двухвалентные) антитела. Неполные (моновалентные, блокирующие) антитела не выявляются этими методами, так как, соединяясь с антигеном, блокируют его, но не могут вызвать агрегации антигена в крупные конгломераты. Неполными (блокирующими) называют антитела, у которых функционирует только один активный центр; второй активный центр по неизвестной причине не срабатывает. Для выявления неполных антител используют специальную реакцию Кумбса (рис. 72). В реакции участвуют: сыворотка больного, в которой определяют неполные антитела, корпускулярный антиген-диагностикум, антиглобулиновая сыворотка, содержащая антитела к человеческому глобулину. Реакция протекает в два этапа.
1. Взаимодействие антигена с неполными антителами. Видимых проявлений при этом нет. Первый этап заканчивают отмывкой антигена от остатков сыворотки больного.
2. Взаимодействие антиглобулиновой сыворотки, полученной в результате иммунизации животного человеческим глобулином, с неполными антителами, адсорбированными на антигене. В силу того что антиглобулиновые антитела двухвалентны, они связывают два одновалентных антитела отдельных комплексов АГ + неполное антитело, что приводит к их склеиванию и появлению видимого осадка.
Рис. 72. Антиглобулиновая проба Кумбса для выявления неполных (моновалентных) антител:
а – антиген; б – неполное антитело; в – антитело против моновалентного антитела (антиглобулин). 1. Соединение неполных антител с антигенами (агглютинации не происходит). 2. Добавление антиглобулиновой сыворотки приводит к агглютинации антигенов, блокированных неполными антителами
Антиглобулиновую пробу Кумбса применяют, например, при серологической диагностике бруцеллеза, при анализе групп крови, в диагностике аутоиммунных заболеваний и др.
Реакция преципитации и ее варианты
Реакции агглютинации и преципитации очень близки по своей сути. Различия между ними зависят главным образом от величины частиц антигена. Преципитацией называют процесс, когда происходит агрегация антител с растворимыми антигенами; если же антиген представлен корпускулами, специфическая агрегация таких антигенов описывается как агглютинация.
Появление преципитата при реакции антиген – антитело определяется не только возникновением решетки, образуемой ее участниками, но и особой ролью Fc-фрагмента иммуноглобулина, изменение конформации которого приводит к утрате этим комплексом растворимости в солевых растворах. В связи с этим в реакции преципитации используют неразведенную или слабо разведенную сыворотку.

Рис. 73. Схема определения токсигенности Corynebacterium diphtheriae
Объяснение см. в разделе «Микробиология дифтерии»
Для постановки реакции преципитации необходимы: антитела – испытуемая сыворотка больного или иммунная диагностическая сыворотка (при идентификации выделенных микробов); антиген – экстрагированный гаптен или полный гаптен соответствующих микроорганизмов; физиологический раствор как источник электролитов. Существует множество модификаций этой реакции, которые подразделяют на две группы: преципитация в жидкой среде (реакция флоккуляции и реакция кольцепреципитации) и преципитация в геле.
Реакция флоккуляции представляет собой преципитацию, при которой растворы антигенов и антител смешивают в пробирке. Учет реакции производят с помощью измерения на фотоэлектроколориметре мутности получаемой системы, что позволяет определить концентрацию исследуемого антигена.
Значительно чаще применяется качественная реакция кольцепреципитации. Для ее постановки в тонкие преципитационные пробирки наливают сначала неразведенную преципитирующую сыворотку и сверху на нее наслаивают, не допуская перемешивания, раствор антигена. В случае гомологичности антител и антигена на границе между этими растворами быстро, через 3 – 10 мин, появляется кольцо преципитата. В отличие от реакции агглютинации, титр преципитирующей сыворотки определяют с помощью разведения не сыворотки, а антигена.
Реакция преципитации в геле является одним из наиболее эффективных методов анализа растворимых антигенов. Она позволяет выявить число индивидуальных антигенов в исследуемой жидкости и провести анализ их антигенного родства. В 1946 г. Дж. Оудин предложил метод простой диффузии, по которому один из компонентов реакции преципитации, обычно сыворотка, находится в геле, а другой – антиген – наслаивается на первый в виде раствора. Антиген, диффундируя в гель, образует в нем с антителами белые линии преципитации, хорошо видимые при боковом освещении. В 1948 г. Ё. Оухтерлоню разработал еще более простой и удобный метод встречной двумерной диффузии, позволяющий проводить прямое сравнение различных антигенов и сывороток. Этот метод также является весьма ценным при исследовании перекрестных реакций (рис. 73).
Для постановки реакции по Оухтерлоню используют 1 %-ный агар, приготовленный на физиологическом растворе, который разливают в чашки Петри слоем 0,5 см. После застывания в пластинке агара вырезают луночки диаметром 5 – 6 мм – одна в центре чашки, 4 – 5 – по окружности на расстоянии 1 – 2 см от центральной. В центральную луночку наливают диагностическую преципитирующую сыворотку, а в периферические – раствор гомологичного и сравниваемых с ним антигенов. Учет результатов проводят через 24, 48 и 72 ч инкубации при комнатной температуре. Антитела и антигены диффундируют навстречу друг другу, и в участках, где создаются их эквивалентные концентрации, образуются дугообразные полосы преципитации. Если полосы преципитации, идущие от двух соседних луночек, сливаются, это указывает на наличие нескольких антигенных компонентов в исследуемой жидкости. Реакцию встречной диффузии по Оухтерлоню часто применяют для определения токсигенности бактерий, например дифтерийных (см. рис. 73).
Дальнейшим развитием метода преципитации в геле является иммуноэлектрофорез. Этим термином обозначают метод, объединяющий электрофоретическое разделение смеси антигенов и встречную диффузию по Оухтерлоню на одной и той же пластинке агарового геля. Преципитирующую сыворотку при этом наливают в канавку, вырезанную в геле параллельно направлению электрофоретического разделения. Образующиеся в результате реакции линии преципитации имеют вид дуг, вытянутых в направлении электрофоретического движения фракций антигенов. Иммуноэлектрофорез позволяет определять состав сложных смесей растворимых антигенов, содержащих до 30 компонентов, и является поэтому ценным диагностическим методом.
Молекулы иммуноглобулинов способны необратимо связываться (метиться) с некоторыми химическими веществами без потери своей антительной специфичности и свойства связываться с антигеном. Для такого мечения можно использовать красители, флуоресцирующие при облучении их коротковолновым светом (ультрафиолетовым, фиолетовым, синим), например изотиоционат флуоресцеина, дающий зеленовато-желтое окрашивание, или другие флуорохромы. Использование для обнаружения антигенов меченных флуорохромами антител, т. е. реакцию иммунофлуоресценции (РИФ), предложил в 1950 г. А. Кунс. С помощью РИФ можно быстро обнаруживать даже ничтожные количества антигенов, в том числе бактериальных и вирусных, по эффекту флуоресценции комплекса антиген + антитело в люминесцентном микроскопе.
Метод иммунофлуоресценции используют в двух вариантах. Один из них получил название прямого метода РИФ, и в этом случае метят антитела, которые непосредственно участвуют в реакции с исследуемым антигеном. Второй вариант известен под названием непрямого метода РИФ. В этом случае с исследуемым антигеном вначале взаимодействуют специфические к нему антитела, а уже с ними взаимодействуют антивидовые антитела (антитела против иммуноглобулинов диагностической сыворотки), меченные флуорохромом (рис. 74). Преимуществом непрямого метода РИФ является то, что при его использовании отпадает необходимость иметь большой набор различных специфических флуоресцирующих антител, так как он основан на использовании антиглобулиновых антител. В качестве последних обычно используют сыворотку козы или барана, иммунизированных сывороткой кролика (коммерческие диагностические иммунные сыворотки чаще всего готовят путем иммунизации кроликов). Непрямой метод иммунофлуоресценции применяют не только для ускоренного обнаружения антигенов (возбудителя), но и для обнаружения антител в сыворотке крови больных. Например, для серологической диагностики токсоплазмоза токсоплазмы фиксируют на предметном стекле и обрабатывают сывороткой исследуемого больного. После ее отмывки мазок повторно обрабатывают сывороткой, содержащей меченные флуорохромом антитела против человеческого глобулина. Если в крови больного есть антитела, т. е. человек болен, в люминесцентный микроскоп будут видны светящиеся токсоплазмы.
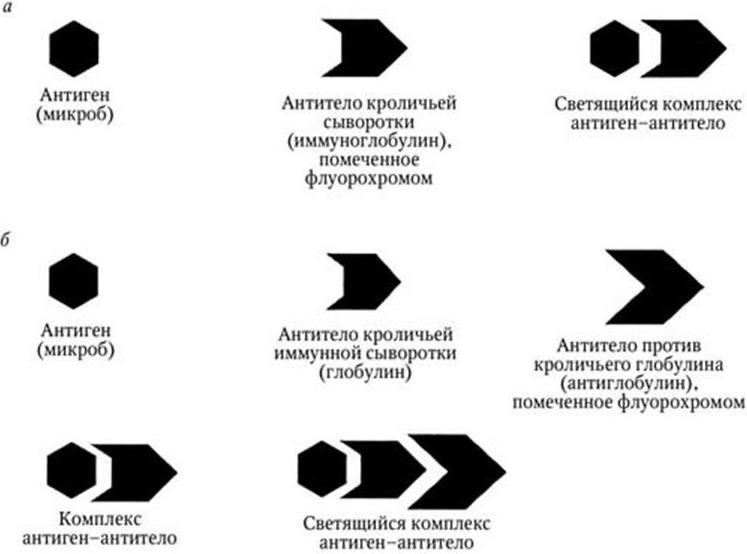
Рис. 74. Схема прямого (а) и непрямого (б) методов иммунофлуоресценции
Серологические реакции, протекающие с участием комплемента
Реакция бактериолиза. Используется для серологической диагностики холеры. Феномен бактериолиза легко удается наблюдать in vitro. Исследуемую сыворотку наносят в последовательном двукратном разведении каплями на поверхность питательной среды, на которую предварительно засевают культуру вибриона. Чашку с посевами инкубируют при температуре 37 °C в течение 18 – 20 ч. Под влиянием имеющихся в сыворотке антител и комплемента холерные вибрионы разрушаются (лизируются), и в местах нанесения капель образуются стерильные пятна. Антитела, разрушающие или умерщвляющие вибрионы, называют вибриоцидными. Титром вибриоцидных антител считается максимальное разведение сыворотки, при котором она еще вызывает отчетливый лизис бактерий.
Реакция иммобилизации трепонем. Применяется для диагностики сифилиса. Живые трепонемы в присутствии имеющихся в исследуемой сыворотке специфических антител и комплемента теряют свою подвижность.
Реакция гемагглютинации иммунного прилипания. В основе этой реакции лежит способность комплекса антиген + антитело в присутствии комплемента адсорбироваться на эритроцитах, вызывая их склеивание. Применяется для серологической диагностики гепатита А. Характеризуется высокой чувствительностью и специфичностью, но требует использования высокоочищенного антигена и специального подбора доноров эритроцитов.
Реакция гемолиза. Литическое действие иммунной сыворотки в присутствии комплемента особенно четко проявляется в отношении эритроцитов. Если кролика иммунизировать эритроцитами другого вида животных (барана), кроличья сыворотка приобретает специфическую гемолитическую активность, т. е. способность вызывать гемолиз эритроцитов, использованных для иммунизации. Этот эффект абсолютно зависим от комплемента. Инактивация последнего путем прогревания сыворотки при температуре 56 °C приводит к утрате ею гемолитической активности. Таким образом, наличие или отсутствие активного комплемента в гемолитической сыворотке очень четко выявляется по результатам ее взаимодействия с гомологичными эритроцитами: при наличии комплемента – гемолиз, образование «лаковой крови»; при его отсутствии – гемагглютинация, эритроциты выпадают на дно пробирки, образуя осадок в виде зонтика, жидкость бесцветна.
Реакция связывания комплемента
Уникальная способность комплемента специфически связываться с различными по своей природе комплексами антиген + антитело нашла широкое применение в реакции связывания комплемента (РСК). Особое преимущество РСК состоит в том, что природа антигена, участвующего в ней (корпускулярный или растворимый), не имеет значения, так как комплемент связывается с Fc-фрагментом любого антитела, относящегося к IgG и IgM, независимо от его антительной специфичности. Кроме того, РСК очень чувствительна: она позволяет обнаружить количество антител в 10 раз меньшее, чем, например, в реакции преципитации. РСК была предложена в 1901 г. Ж. Борде и О. Жангу. В ее основе лежат два свойства комплемента:
1) способность связываться с комплексом антиген + антитело;
2) лизирование эритроцитов, использованных для получения гемолитической сыворотки.
РСК ставят в два этапа, и в ней соответственно участвуют две системы – опытная, или диагностическая, и индикаторная. Диагностическая система состоит из исследуемой (или диагностической) сыворотки, которую перед постановкой реакции прогревают при 56 °C в течение 30 мин для инактивации имеющегося в ней комплемента, и антигена. К этой системе добавляют стандартный комплемент. Его источником служит свежая или высушенная сыворотка морской свинки. Смесь инкубируют при 37 °C в течение одного часа. Если в исследуемой сыворотке имеются антитела, произойдет их взаимодействие с добавленным антигеном, и образующиеся комплексы антиген + антитело свяжут добавленный комплемент. Если же в сыворотке антитела отсутствуют, образования комплекса антиген + антитело не произойдет, и комплемент останется свободным. Никаких видимых проявлений связывания комплемента на этой стадии реакции обычно нет. Поэтому для выяснения вопроса, произошло или нет связывание комплемента, добавляют вторую, индикаторную систему (инактивированная гемолитическая сыворотка + эритроциты барана), и смесь всех компонентов РСК вновь инкубируют при 37 °C в течение 30 – 60 мин, после чего оценивают результаты реакции. В случае, если комплемент связался на первой стадии, в диагностической системе, т. е. в сыворотке больного имеются антитела, и произошло связывание комплемента комплексом антитело + + антиген, лизиса эритроцитов не будет – РСК положительна: жидкость бесцветна, на дне пробирки осадок эритроцитов. Если же в сыворотке специфические антитела отсутствуют и связывания комплемента в диагностической системе не произойдет, т. е. РСК отрицательна, то неизрасходованный в диагностической системе комплемент связывается с комплексом эритроциты + антитела индикаторной системы и произойдет гемолиз: в пробирке «лаковая кровь», осадка эритроцитов нет. Интенсивность РСК оценивают по четырехкрестной системе в зависимости от степени задержки гемолиза и наличия осадка эритроцитов. Реакция сопровождается соответствующими контролями: контроль сыворотки (без антигена) и контроль антигена (без сыворотки), так как некоторые сыворотки и некоторые антигены обладают антикомплементарным действием. Перед постановкой РСК все компоненты, участвующие в ней, за исключением исследуемой сыворотки или антигена, подвергаются тщательному титрованию. Особенно важно ввести в реакцию точную дозу комплемента, так как его нехватка или избыток могут привести к ложным результатам. Титром комплемента является то его минимальное количество, которое в присутствии рабочей дозы гемолитической сыворотки обеспечивает полное растворение эритроцитов. Для постановки основного опыта берут дозу комплемента, увеличенную на 20 – 25 % по сравнению с установленным титром. Титром гемолитической сыворотки является то ее максимальное разведение, которое, будучи смешано с равным объемом 10 % раствора комплемента, полностью гемолизирует соответствующую дозу эритроцитов в течение 1 ч при температуре 37 °C. В основной опыт берут сыворотку, разведенную до 1/3 своего титра.
Непрямая реакция гемолиза используется как ускоренный метод обнаружения специфических антител. В качестве носителя антигенов используют эритроциты. При наличии в сыворотке больного специфических антител сенсибилизированные эритроциты в присутствии комплемента лизируются.
Серологические реакции, протекающие с участием фагоцитов
Определение опсонического индекса. Антитела, стимулирующие фагоцитарную активность лейкоцитов, получили название опсонинов (греч. opsoniazo – снабжать пищей, питать), или бактериотропинов. Различают термолабильные и термостабильные опсонины, или бактериотропины. К последним относятся антитела классов IgG1, IgG3, IgM. На первом этапе опсонизации антитела прикрепляются к детерминантным группам бактерий, а затем антитела с помощью Fc-фрагментов присоединяются к Fc-рецепторам макрофагов, способствуя поглощению ими бактерий (патогенов). Опсоническая активность антител резко возрастает в присутствии термолабильных опсонинов, в том числе молекул C3b, образующихся при активации системы комплемента. Молекулы C3b, осаждаясь на поверхности бактериальных клеток, способствуют прикреплению макрофагов в этих участках (эффект «иммунного прилипания»). Таким образом, опсонины и комплемент способствуют более эффективному прикреплению чужеродных частиц к макрофагам, поглощению и перевариванию их последними, а также, очевидно, процессингу и представлению антигенов. Для количественной оценки фагоцитарной активности, обусловленной опсонинами, используют определение опсонического индекса, опсоно-фагоцитарного индекса и титра опсонинов.
Под опсоническим индексом понимают отношение фагоцитарного числа исследуемой крови к фагоцитарному числу нормальной крови. Для определения фагоцитарного числа оба образца крови смешивают со стандартным количеством соответствующих живых или убитых бактерий. После 30 мин инкубации при температуре 37 °C из каждого образца крови готовят препараты-мазки, фиксируют по способу Никифорова и окрашивают метиленовым синим. Затем под микроскопом подсчитывают общее количество бактерий, фагоцитированных, например, 50 фагоцитами, и находят фагоцитарное число. Опсонический индекс является показателем того, насколько активно стимулируется фагоцитоз опсонинами и системой комплемента.
Опсоно-фагоцитарная реакция – способ оценки активности действия опсо-
нинов сыворотки на эффективность фагоцитоза бактерий или других корпускулярных антигенов, обработанных этой сывороткой. Для определения опсоно-фагоцитарного индекса, как и при определении опсонического, готовят и окрашивают мазок из смеси исследуемой крови с бактериями. Под микроскопом в нем просматривается 25 фагоцитов, и каждый из них в зависимости от числа поглощенных ими бактерий относят к определенной группе. Конкретный пример такого подсчета представлен в табл. 17. Интенсивность фагоцитоза характеризуют цифровым показателем, представляющим собой сумму произведений, полученных путем умножения количества фагоцитов на число соответствующих им плюсов. Максимально возможный показатель равен 75 (25 × 3 = 75). Условно считают, что показатель, равный 10 – 24, соответствует слабо положительной опсоно-фагоцитарной реакции, 25 – 49 – положительной, а 50 – 75 – резко положительной. У людей, не имевших контакта с данным возбудителем, опсоно-фагоцитарный индекс обычно невелик (1 – 5).
Таблица 17
Оценка опсоно-фагоцитарной реакции (пример)
Существуют различные варианты этой реакции, но из-за громоздкости их используют относительно редко, например для диагностики бруцеллеза и некоторых других болезней.
Титр опсонинов характеризует количественно силу опсонической активности по отношению к данному возбудителю. Активность опсонинов проверяют в опытах с использованием фагоцитов здоровых людей.
Реакции иммуносорбентного анализа твердой фазы
В основе методов иммуносорбентного анализа твердой фазы лежит сорбция антител (для обнаружения неизвестного антигена) или антигенов (для обнаружения специфических антител) и специфических антител, меченных ферментом (иммуноферментный метод – ИФМ) или изотопом (радиоиммунный метод – РИМ). Чувствительность этих методов значительно превышает чувствительность традиционных иммунологических реакций, поэтому они приобрели самое широкое распространение. Эти методы могут быть использованы для диагностики практически любого инфекционного заболевания. С их помощью можно определить как антигены любого возбудителя, так и антитела к ним. Методика постановки этих реакций включает три последовательных этапа.
Обнаружение антигена с помощью ИФМ и РИМ
Первый этап – адсорбция специфических антител твердой фазой, в качестве которой обычно используют полистироловые или поливинилхлоридные поверхности лунок пластиковых микротитраторных панелей. Антитела нековалентно связываются со стенками лунок, у них сохраняются свободными активные центры, и поэтому они способны специфически реагировать с соответствующим антигеном.
Второй этап – связывание антигена из суспензии исследуемого материала за счет реакции антитело + антиген, происходящей на границе твердая фаза – жидкость. После этого луночки промывают раствором, содержащим слабый неионный детергент, для удаления из системы других, неспецифически связанных с антителами компонентов.
Третий этап – обработка твердой фазы с фиксированными на ней комплексами антитело + антиген специфическими антителами против данного антигена, но меченными либо ферментом, либо изотопом. Такие меченые антитела присоединяются к антигенам, а их избыток удаляется из системы промыванием. Таким образом, в случае присутствия в исследуемом материале искомого антигена на поверхности твердой фазы формируется комплекс: антитело + антиген + меченое антитело. Результаты реакции учитывают в зависимости от характера метки. Для иммуноферментного метода антитела метят ферментом, чаще всего пероксидазой или щелочной фосфатазой. Субстратом для пероксидазы служит H2O2 в смеси с ортофенилендиамином, используемая в виде раствора в цитратно-фосфатном буфере (рН 5,0). Добавление в опытную луночку раствора субстрата приводит к тому, что он подвергается действию пероксидазы, фиксированной на антителах; образующиеся продукты реакции имеют желтую окраску, интенсивность которой может быть определена путем фотометрирования.
Радиоиммунный метод (РИМ) предусматривает использование антител, меченных изотопом, поэтому результаты реакции оценивают путем определения радиоактивности исследуемых образцов. При положительной реакции уровень радиоактивности опытных образцов более чем в 2 раза превышает уровень радиоактивности контрольных, заведомо отрицательных образцов (рис. 75, а).
Рис. 75. Схема использования иммуноферментного и радиоиммунного методов для обнаружения антигенов (а) и антител (б):
1. Поверхность твердой фазы. 2. Специфические антитела. 3. Антиген (исследуемый материал). 4. Cпецифические к данному антигену антитела, меченные ферментом (5) или изотопом (6). 7. Субстрат для фермента. 8. Специфический антиген. 9. Исследуемая сыворотка (антитела). 10. Антивидовая сыворотка, содержащая антитела к человеческому иммуноглобулину, меченные ферментом (11) или изотопом (12). 13. Субстрат для фермента
Обнаружение специфических антител с помощью ИФМ и РИМ
Для обнаружения антител реакции также ставят в три этапа.
Первый этап – адсорбция специфических антигенов на стенках луночек. Обычно планшеты в коммерческих тест-системах уже имеют сенсибилизированные луночки, т. е. на их дне и стенках антигены уже адсорбированы.
Второй этап – добавление в луночки образцов исследуемой сыворотки для обнаружения в ней специфических антител к данному антигену. Если они имеются, то вступают во взаимодействие с антигеном и образуют комплекс антиген + + антитело.
Третий этап – после отмывания луночек в них добавляют специфические антиглобулиновые антитела (антивидовые, т. е. антитела против человеческих иммуноглобулинов), но меченные ферментом (ИФМ) либо изотопом (РИМ). Результаты реакции оценивают, как указано выше (рис. 75, б). В качестве контроля используют образцы заведомо положительные и заведомо отрицательные.
Предложены различные варианты иммуноферментного метода. Большое значение имеет вариант ИФМ, позволяющий осуществлять «захват» антител, относящихся к IgM. Этот метод позволяет более точно производить серологическую диагностику, так как основан на обнаружении специфических иммуноглобулинов IgM, которые появляются в первую очередь при встрече с возбудителем.
Этот тип иммунологических реакций основан на способности антител специфически подавлять (нейтрализовать) биологическую активность возбудителя или его токсинов в различных тест-системах – организме животных, в куриных эмбрионах, культурах клеток – или каким-то иным способом. Это зависит от природы возбудителя и цели исследования. Например, для оценки эффективности иммунизации против дифтерии и столбняка определяют уровни антитоксинов в сыворотке крови привитых по их способности нейтрализовать биологическое действие определенной дозы токсина (реакция Шика). Однако реакции нейтрализации применяют и с диагностическими целями. Особенно широкое применение они получили в вирусологической практике как для серологической диагностики вирусных заболеваний, так и для идентификации вирусов. С этой целью используют реакции нейтрализации роста вирусов в культуре ткани, подавления бляшкообразования, гемадсорбции, торможения гемагглютинации (РТГА) и др.
Таблица 18
Активность антител, относящихся к различным классам иммуноглобулинов, в иммунологических реакциях
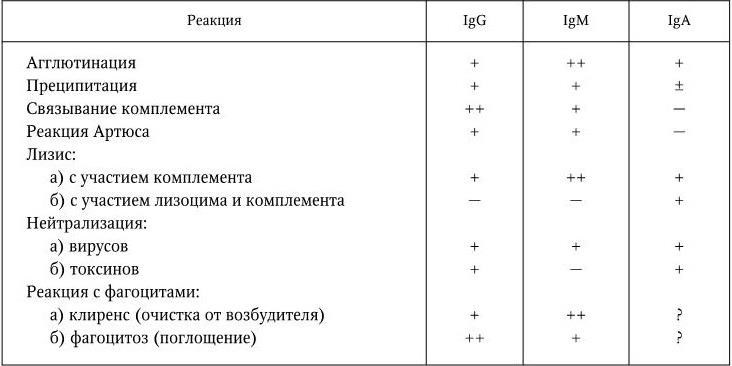
До тех пор, пока не была выяснена химическая природа антител, полагали, что каждая реакция иммунной сыворотки опосредуется особым видом антител, которые получили соответственно название агглютининов, преципитинов, опсонинов, антитоксинов и т. п. Хотя эти названия сохранились, они имеют чисто феноменологическое значение, т. е. отражают конечный результат взаимодействия антитела с антигеном. В настоящее время уже ясно, что нет специальных антител – агглютининов, преципитинов и т. д., а есть 5 классов иммуноглобулинов. Специфичность антител, относящихся к любому классу иммуноглобулинов, определяется структурой активного центра, причем антитела данной специфичности могут относиться к разным классам. Конечный исход взаимодействия антигена с антителами зависит от природы антигена (корпускулярный – агглютинация, растворимый – преципитация); от участия системы комплемента (бактериолиз, бактерицидное действие); макрофагов; от того, к какому классу иммуноглобулинов относится данное антитело; от свойств его Fc-фрагмента. Разные классы иммуноглобулинов в неодинаковой степени участвуют в различных иммунологических реакциях (табл. 18).
Например, в реакциях агглютинации наиболее активны антитела, относящиеся к IgM и IgG, в реакции связывания комплемента участвуют главным образом антитела IgG и IgM, в реакции лизиса с участием лизоцима и комплемента – только IgA.
ВИРУСЫ И ВЫЗЫВАЕМЫЕ ИМИ ЗАБОЛЕВАНИЯ
Основные свойства вирусов и их молекулярно-генетическая организация
Приоритет открытия вирусов принадлежит выдающемуся русскому ученому Д. И. Ивановскому. Еще будучи студентом Петербургского университета, в 1887 г. по предложению своих учителей А. Н. Бекетова и А. С. Фаминцына Д. И. Ивановский вместе со студентом В. В. Половцевым приступил к изучению мозаичной болезни табака, наносившей большой вред сельскому хозяйству. Ими было установлено, что описанная в Голландии А. Мейером мозаичная болезнь табака представляет собой не одно, а два совершенно различных заболевания одного и того же растения, одно из которых – рябуха (ее возбудитель – грибок), а другое – собственно мозаичная болезнь табака неизвестного происхождения. Изучение природы этого заболевания Д. И. Ивановский проводил самостоятельно, оно и привело его к открытию первого вируса. Капелькой сока, взятого от больного растения, Д. И. Ивановский заражал здоровое растение и вызывал его заболевание. Это убедило его в том, что инфекционное начало находится в соке. Однако при микроскопии сока он не обнаружил в нем никаких бактерий, а посевы сока на питательные среды не давали никакого роста. Тогда Д. И. Ивановский решил профильтровать такой странный сок через фарфоровые фильтры, через которые бактерии не проходят. Однако профильтрованный сок вызывал мозаичную болезнь у здоровых растений спустя 15 дней после заражения. Еще более любопытным был тот факт, что профильтрованный сок, нагретый до 60 – 70 °C, утрачивал инфекционные свойства. К тому же, при последовательном заражении соком больных растений болезнь проявлялась всегда, т. е. заразное начало не разбавлялось, а будучи введенным в растение, в нем размножалось, значит, являлось живым существом, которое Д. И. Ивановский назвал фильтрующимся вирусом. Результаты своих работ он опубликовал в журнале «Сельское хозяйство и лесоводство» в статье «О двух болезнях табака» и доложил на заседании Российской Академии наук 12 февраля 1892 г. Эта дата и является официальным днем рождения новой науки – вирусологии, а Д. И. Ивановский – ее основоположник.
Только спустя 6 лет (в 1898 г.) опыты Д. И. Ивановского повторил и воспроизвел его результаты М. Бейеринк. Поэтому попытки некоторых иностранных авторов приписать первооткрытие вирусов М. Бейеринку совершенно несостоятельны. Да и сам М. Бейеринк признал приоритет Д. И. Ивановского. Отвечая на замечания, сделанные ему Д. И. Ивановским, М. Бейеринк писал: «Я подтверждаю, что, как я теперь вижу, приоритет опыта с фильтрованием через свечу принадлежит господину Д. И. Ивановскому».
Очень скоро после работ Д. И. Ивановского было установлено, что вирусы широко распространены в природе и вызывают заболевания не только у растений, но и у животных и человека. Открытия вирусов следовали одно за другим: 1897 г. – вирус ящура; 1901 г. – вирус желтой лихорадки; 1903 г. – вирус бешенства; 1908 г. – вирус оспы человека; 1909 г. – вирус полиомиелита. Эти открытия не прекращаются и в наше время: 1970 г. – вирус гепатита В; 1973 г. – вирус гепатита А; 1977 г. – вирус дельта-гепатита; 1983 г. – вирус иммунодефицита человека.
Основные свойства вирусов, по которым они отличаются от всех остальных живых существ (кроме плазмид – см. с. 127 – 128), следующие:
1. Ультрамикроскопические размеры.
2. Вирусы содержат нуклеиновую кислоту только одного типа – или ДНК, или РНК. Все другие организмы содержат нуклеиновые кислоты обоих типов, а гено́м у них представлен только ДНК.
3. Вирусы не способны к росту и бинарному делению.
4. Вирусы размножаются путем воспроизводства себя из собственной геномной нуклеиновой кислоты. Размножение всех прочих организмов включает стадии бинарного деления клеток.
5. У вирусов отсутствуют собственные системы мобилизации энергии.
6. У вирусов нет собственных белоксинтезирующих систем.
7. В связи с отсутствием собственных систем синтеза белка и мобилизации энергии вирусы являются абсолютными внутриклеточными паразитами. Средой обитания вирусов являются бактерии, клетки растений, животных и человека.
С учетом перечисленных особенностей вирусам можно дать следующее определение: вирусы – особое царство ультрамикроскопических размеров организмов, обладающих только одним типом нуклеиновых кислот, лишенных собственных систем синтеза белка и мобилизации энергии и являющихся поэтому абсолютными внутриклеточными паразитами (А. И. Коротяев).
Существует и другой взгляд на природу вирусов: «…вирусы можно рассматривать как генетические элементы, одетые в защитную оболочку и способные переходить из одной клетки в другую» (Альберт Б. [и др.], 1986). Однако эти же авторы там же называют репродукцию вируса в клетке его жизненным циклом.
Молекулярно-генетическая организация вирусов
Основой таксономии вирусов является вирион, который представляет собой конечную фазу развития вируса. Вирион состоит из геномной нуклеиновой кислоты, окруженной одной или двумя оболочками. По строению вирусы можно разделить на четыре типа, которые различаются по характеру упаковки морфологических субъединиц:
1) вирусы со спиральной симметрией;
2) изометрические вирусы с кубической симметрией;
3) вирусы с бинарной симметрией, например фаги: у них головка имеет кубический тип симметрии, а хвостик – спиральный;
4) более сложно организованные вирусы, имеющие вторую оболочку.
Оболочка, в которую упакована геномная нуклеиновая кислота, называется капсидом (греч. capsa – ящик). Наиболее просто организованные вирусы представляют собой нуклеокапсиды: они состоят только из нуклеиновой кислоты и белковой оболочки, построенной из идентичных пептидных молекул. Поскольку число аминокислотных остатков в белковой молекуле всегда меньше числа нуклеотидов в гене (код триплетный), то для того, чтобы упаковать геномную нуклеиновую кислоту, требуется большое число одинаковых белковых молекул. А многократное повторение белок-белковых взаимодействий возможно лишь при условии симметричного расположения субъединиц. Существует всего два способа упаковки одинаковых белковых молекул в капсид, при которых он обладал бы стабильностью. Полимер будет стабильным, если он соответствует наименьшему уровню свободной энергии. Процесс образования такого полимера родствен процессу кристаллизации, он протекает по типу самосборки. Один из вариантов такой самосборки происходит с использованием спиральной симметрии, другой – кубической симметрии.
При спиральной симметрии (ее имеют нитевидные вирусы) белковые субъединицы располагаются по спирали, а между ними, также по спирали, уложена геномная нуклеиновая кислота. Лучше всего этот тип молекулярной организации вириона изучен у вируса мозаичной болезни табака. Он представляет собой нуклеопротеид, имеющий длину 300 нм и диаметр 18 нм. Молекулярная масса вириона 40 МД. Капсид вириона состоит из 2130 белковых молекул, винтообразно уложенных вокруг РНК, содержащей около 6000 нуклеотидов (рис. 76, а). Каждая белковая молекула имеет м. м. 18 240 Д и состоит из 158 аминокислотных остатков. С каждой белковой субъединицей связано три нуклеотида. Белковая спираль состоит из 130 витков, на каждый из которых приходится 16 1/3 субъединиц. Период идентичности (3 оборота спирали) равен 6,9 нм.
При спиральной симметрии белковый чехол лучше защищает геномную нуклеиновую кислоту, но при этом требуется большее количество белка, чем при кубической симметрии. Большинство вирусов с замкнутым чехлом обладает кубической симметрией. В ее основе лежат различные комбинации равносторонних треугольников, образующихся из сочетания шаровидных белковых субъединиц. Сочетаясь определенным образом друг с другом, они могут формировать замкнутую сферическую поверхность. Из различных сочетаний равносторонних треугольников, которые образуют общую вершину и общую ось симметрии, могут возникать различные варианты многогранников: тетраэдры, октаэдры и икосаэдры. Икосаэдры имеют 20 граней (каждая представляет равносторонний треугольник), 12 вершин и пятикратную тройную и двойную оси вращательной симметрии (рис. 76, б). Икосаэдры – самая эффективная и экономичная симметрия для формирования замкнутого чехла, так как в этом случае при его сборке используются строительные белки минимального размера и обеспечивается наибольший внутренний объем вириона. Видимо, поэтому сферические вирусы животных чаще всего имеют форму икосаэдра.
Рис. 76. Типы вирусных симметрий:
а – спиральная симметрия (вирус мозаичной болезни табака); б – один из возможных вариантов кубической симметрии
Основные различия между спиральными и сферическими вирусами, по мнению Д. Каспара, таковы.

Упаковка по типу икосаэдра позволяет осуществлять переход от структурных единиц (белковых субъединиц) к морфологическим – капсомерам (греч. meros – часть). Например, 60 молекул субъединиц могут быть представлены в виде 30 молекул димеров или 20 молекул тримеров, морфологически такие олигомеры будут отличаться друг от друга. Число капсомеров для вирусов данного вида является постоянным, оно имеет диагностическое значение. Например, вирион аденовирусов имеет 252 капсомера, причем группы из 9 капсомеров располагаются на поверхности 20 граней (180 капсомеров), а группы из 6 капсомеров образуют 12 вершин (72 капсомера). Число капсомеров у парвовирусов – 32, у паповавирусов – 72. Молекулярная организация всех простых вирусов сводится к использованию спиральной и кубической симметрии.
Более сложно устроены вирусы, у которых имеется вторая оболочка. Вначале она получила название «пеплоса» (накидка греческих солдат). Позднее ее стали называть суперкапсидом. Он представляет собой обычную биологическую мембрану, состоящую из двух слоев липидов, имеющих клеточное происхождение, и заключенных в них гликозилированных суперкапсидных вирусных белков, которые выступают над наружной поверхностью вириона в виде своеобразных шипов (рис. 85, 91). Суперкапсидные вирусные белки, образующие шипы, обладают жизненно важными для вируса функциями: они распознают клеточные рецепторы и связываются с ними, обеспечивают слияние вирусной мембраны с мембраной клетки и ее лизосом, способствуют распространению вируса в организме за счет слияния клеток, многие из них обладают свойствами протективных антигенов и т. д. Многие сложные вирусы, такие как ортомиксовирусы, парамиксовирусы, коронавирусы и др., устроены таким образом, что их нуклеокапсид, имеющий палочковидную спиральную структуру, свернутую определенным образом, окружен суперкапсидной липопротеиновой оболочкой, придающей вириону сферическую форму (см. рис. 85). Вирионы рабдовирусов содержат спиральный нуклеокапсид, образующий цилиндрическую структуру, покрытую липидсодержащим суперкапсидом, который придает вириону пулевидную форму (рис. 78, 8). У других вирусов, например у тогавирусов, нуклеокапсид имеет форму икосаэдра, который окружен суперкапсидной оболочкой, придающей вириону шаровидную форму. Вирион ретровирусов имеет икосаэдрический капсид, внутри которого располагается спиральный нуклеокапсид, а сам вирион покрыт липидсодержащей оболочкой, придающей ему сферическую форму (см. рис. 91).
Рис. 77. Форма и относительные размеры вирионов некоторых семейств ДНК-содержащих вирусов животных:
1 – Poxviridae; 2 – Herpesviridae; 3 – Adenoviridae; 4 – Papovaviridae; 5 – Parvoviridae
Рис. 78. Форма и относительные размеры вирионов некоторых семейств РНК-содержащих вирусов животных:
1 – Paramyxoviridae; 2 – Orthomyxoviridae; 3 – Coronaviridae; 4 – Arenaviridae; 5 – Retroviridae; 6 — Reoviridae; 7 — Picornaviridae; 8 — Rhabdoviridae; 9 — Orbiviridae; 10 — Togaviridae; 11 — Bunyaviridae
Наиболее сложное строение имеют самые крупные вирусы, относящиеся к семейству поксвирусов. Их вирионы имеют форму параллелепипеда (или овоидную), размером 300 – 450 × 170 – 260 нм. Вирионы покрыты внешней оболочкой, под которой располагаются сложное образование из тубулярных структур и внутреннее ядро, состоящее из ДНК-содержащей сердцевины и одного или двух боковых телец. Вирион содержит более 30 структурных белков и несколько ферментов. Таким образом, структура вириона у каждого семейства вирусов имеет отличительные особенности. Форма и относительные размеры ДНК– и РНК-содержащих вирусов представлены на рис. 77 и 78.
В природе помимо вирусов обнаружены другие очень мелкие загадочные инфекционные агенты с необычными свойствами. К ним относятся вироиды и прионы.
Вироиды. Название «вироид» было предложено в 1971 г. Т. Динером. Оно свидетельствует о том, что симптомы заболеваний, которые вызывают эти агенты у различных растений, похожи на симптомы заболеваний, вызываемых у них вирусами. Однако вироиды отличаются от вирусов по крайней мере по следующим четырем признакам.
1. Вироиды, в отличие от вирусов, не имеют белковой оболочки и состоят только из инфекционной молекулы РНК. Они не обладают антигенными свойствами и поэтому не могут быть обнаружены серологическими методами.
2. Вироиды имеют очень малые размеры: длина молекулы РНК вироидов равна 1 ⋅ 10– 6 мм, она состоит из 300 – 400 нуклеотидов. Вироиды – самые маленькие способные к размножению единицы, известные в природе.
3. Молекулы вироидов представляют собой одноцепочечные кольцевые РНК. Такую кольцевую структуру имеет еще только один вирус – вирус дельта-гепатита.
4. Молекулы РНК вироидов не кодируют собственных белков, поэтому их размножение может происходить либо аутокаталитически, либо с участием клетки-хозяина.
С 1971 г. обнаружено более 10 различных вироидов, отличающихся по первичной структуре, кругу поражаемых хозяев, по симптомам вызываемых ими заболеваний. Все известные вироиды построены по одному плану: 300 – 400 нуклеотидов образуют кольцо, которое удерживается парами оснований и образует двухцепочечную палочковидную структуру с перемежающимися короткими одно– и двухцепочечными участками.
Поскольку вироиды не имеют собственных генов и белков, их нельзя считать живыми существами. Поэтому вопрос о природе, происхождении вироидов и о том, каким способом они распространяются, остается открытым. Существует предположение, что вироиды образуются из нормальных клеточных РНК, однако убедительных подтверждений этому не было представлено.
Прионы. Название«прионы» предложил открывший их в 1982 г. С. Прузинер. Прионы – низкомолекулярные, не содержащие нуклеиновых кислот белки, которые вызывают так называемые трансмиссивные губкообразные энцефалопатии. Последние выделены в особую группу медленных летальных прионных инфекций, для которых характерны очень длительный инкубационный период, медленно прогрессирующее течение, дегенеративные изменения в ЦНС, отсутствие признаков воспаления и выраженного иммунного ответа и летальный исход.
Синтез прионов контролирует ген prnP, который несет у человека 20-я хромосома. Установлено 18 различный мутаций этого гена, которые связаны с различными прионовыми болезнями.
Прионы состоят из особого белка, который существует в виде двух изомеров. Один из них – нормальный клеточный прионовый протеин – изоформа PrPC. Он состоит из 254 аминокислотных остатков и имеет м. м. 33 – 35 кД. PrPC растворим в детергентах, чувствителен к действию протеинкиназы К. Он, как полагают, участвует в регуляции суточных циклов многих гормонов. У здоровых животных содержание его составляет 1 мкг/г ткани мозга (больше всего его в нейронах).
Другой изомер прионового протеина PrPSc – аномальный, имеет такую же м. м. Он отличается от PrPC вторичной структурой, устойчив к протеолизу, не растворяется детергентами, способен к самоагрегации / олигомеризации. Конверсия PrPC в PrPSc присходит очень медленно, но ускоряется в присутствии экзогенного приона. Прионы PrPSc – возбудители прионных медленных инфекций.
Содержание PrPSc в ткани мозга больных животных в 10 раз больше, чем у здоровых.
Известны 12 нозологических единиц прионных болезней, из них 6 наблюдаются у животных (скрепи у овец, губкообразные энцефалопатии крупного рогатого скота, экзотических копытных и кошачьих, хроническое истощение у лосей и трансмиссивная энцефалопатия норок). Шесть болезней прионной этиологии описаны у человека.
Ку́ру (папуасское curu – дрожать, трястись) впервые описано в 1957 г. К. Гайдушеком у папуасов-каннибалов в Новой Гвинее. Характеризуется прогрессирующей мозжечковой атаксией, общим дрожанием, адинамией, а также психическими изменениями (эйфория, беспричинный смех и т. п.).
Болезнь Крейтцфельда – Якоба (БКЯ – дегенерация кортикостриоспинальная) встречается повсеместно. Характеризуется прогрессирующей деменцией с симптомами поражения пирамидальных и экстрапирамидальных нервных путей. В 1996 г. началась эпизоотия губкообразной энцефалопатии коров («бешенство» коров) в Англии, а затем в ряде других стран Западной Европы. Она связана с нарушением природных схем питания животных: они стали получать в виде добавок к пище вещества, полученные из костей и мясных отходов овец и коров. Заражение мясом таких животных стало причиной заболевания людей БКЯ. В Англии описана новая форма БКЯ (она обозначена как VCJD). Она отличается от БКЯ тем, что ею болеют лица моложе 40 лет, а также более длительным течением и развитием нейропатологических изменений, не наблюдаемых при классическом течении болезни.
Летальная семейная бессонница – потеря сна, гиперреактивность симпатической системы, прогрессирующее ослабление автономных и эндокринных циклических временн́ых ритмов; наблюдается у лиц среднего возраста (около 45 лет).
Синдром Герстманна – Штрейслера (СГШ) – медленная инфекция. Зарегистрирована в Великобритании, США, Японии и других странах мира. Характеризуется дегенеративными поражениями ЦНС, которые проявляются в формировании губкообразного состояния, образовании амилоидных бляшек во всем мозге. Болезнь выражается в развитии медленно прогрессирующей атаксии и деменции.
Патогенез не изучен. Заболевание тянется длительно и заканчивается смертью.
Амиотрофический лейкоспонгиоз – медленная инфекция человека, характеризующаяся прогрессирующим развитием атрофических парезов мышц конечностей и туловища, нарушением дыхания и заканчивается смертью.
Синдром Альперса – медленная прионная инфекция. Наблюдается главным образом в детстве, характеризуется симптомами, свидетельствующими о поражении ЦНС.
Для прионовых болезней человека характеры 4 классических нейропатологических признака: спонгиозные изменения (множество овальных вакуолей диаметром 1 – 50 мк в сером веществе мозга), потеря нейронов, астроцитоз и формирование амилоидных бляшек.
Предполагается, что прионы играют роль в этиологии шизофрении, миопатии и некоторых других заболеваний человека. Природа прионов остается неясной. С вирусами их объединяют малые размеры (они способны проходить через бактериальные фильтры) и неспособность размножаться на искусственных питательных средах; специфический круг поражаемых хозяев; длительная персистенция в культуре клеток, полученной из тканей зараженного хозяина, а также в организме больного человека и животного. Вместе с тем они существенным образом отличаются от вирусов: во-первых, у них отсутствует собственный геном, следовательно, они не могут рассматриваться, в отличие от вирусов, как живые существа; во-вторых, они не индуцируют никакого иммунного ответа. В-третьих, прионы обладают значительно более высокой резистентностью, чем обычные вирусы, к действию высокой температуры (выдерживают кипячение в течение 1 ч), УФ-излучению, ионизирующей радиации и к различным дезинфектантам; нечувствительны к интерферонам и не индуцируют их синтеза.
По мнению С. Прузинера, есть два пути передачи аномального приона PrPSc: наследственный (мутации в гене prnP) и трансмиссивный, или инфекционный (алиментарный и нозокомиальный). Прионовые болезни в том и другом случае наблюдаются в виде спорадических или групповых заболеваний.
К. Гайдушек в 1976 г. за открытие инфекционной природы прионных болезней и С. Б. Прузинер в 1997 г. за открытие прионов и разработку прионной теории были удостоены Нобелевских премий.
Методы культивирования вирусов
Поскольку вирусы не растут на искусственных питательных средах, а размножаются только внутриклеточно, нужно было найти простые и общедоступные методы их культивирования. Крупным достижением было предложение Р. Гудпасчура в 1932 г. использовать для культивирования вирусов куриные эмбрионы, в клетках которых успешно размножаются многие вирусы. Однако окончательное решение проблемы их культивирования оказалось возможным лишь после того, как были разработаны основные способы культивирования клеток вне организма.
Хотя способность клеток расти вне организма была установлена еще в 1907 г., потребовалось много лет для разработки доступных методов культивирования клеток, а в них – вирусов. Вначале был использован метод переживающих тканей. Он заключался в том, что в колбу, содержащую питательную среду, вносили кусочек ткани. Клетки некоторых тканей в таких условиях могут переживать (но не размножаться) до 30 дней, а в них могут размножаться вирусы. Однако этот способ давал очень небольшой выход вирусов. Необходимо было разработать условия, при которых клетки ткани могли бы свободно размножаться. К началу второй половины ХХ в. эпидемии полиомиелита приняли настолько широкий и опасный характер, что требовалось принять немедленные меры для создания вакцины, которую можно было бы использовать для массового применения. Но для этого нужно было найти метод, позволяющий быстро выращивать вирусы в большом количестве. Это и явилось одним из обстоятельств, стимулировавших разработку методов культивирования вирусов. Для получения культур клеток, которые можно было бы использовать для выращивания вирусов, необходимо было решить четыре главных проблемы:
1) получить в необходимом количестве свободные (т. е. изолированные друг от друга) клетки;
2) создать такие питательные среды и условия, в которых клетки могли бы активно размножаться;
3) обеспечить условия, при которых в культурах клеток не могли бы размножаться бактерии;
4) определить методы, с помощью которых можно было бы распознавать рост вируса в культуре клеток и идентифицировать его.
Все эти проблемы были решены. Для выделения изолированных, но жизнеспособных клеток из разрушенных тканей использовали обработку их слабым раствором трипсина, разрушающего межклеточные мостики. Для культивирования клеток были предложены различные среды, содержащие все необходимые для размножения клеток питательные вещества (аминокислоты, основания, витамины и др.), минеральные соли, имеющие оптимальную рН и т. д. К питательным средам добавляли индикатор, по изменению цвета которого можно было судить о метаболизме клеток и их размножении. Было установлено, что в качестве основы, на которой клетки размножаются и образуют монослой, может быть использовано хорошо обработанное стекло пробирок и колб. Для подавления возможного роста бактерий вируссодержащий материал перед посевом его в культуры клеток обрабатывают антибиотиками. Решающее значение имели опыты, проведенные в 1949 г. Дж. Эндерсом, Т. Веллером и Ф. Роббинсом, которые показали, что вирус полиомиелита хорошо размножается в первично-трипсинизированных культурах клеток, полученных из почек обезьян.
Разработка способов получения культур клеток позволила широко внедрить в практическую медицину современные классические методы вирусологической диагностики инфекционных заболеваний, с одной стороны, и обеспечить накопление вирусов в количествах, достаточных для производства вакцин, с другой. Основной недостаток первично-трипсинизированных клеток заключается в том, что после нескольких пересевов они перестают размножаться. Поэтому предпочтением стали пользоваться культуры таких клеток, которые способны размножаться in vitro бесконечно долго. Такие перевиваемые культуры клеток получают из опухолевых тканей (HeLa, HEp-2 и др.) или из мутантных клеток с полиплоидным набором хромосом. Однако опухолевые клетки нельзя применять для получения вакцин. Для этих целей используют только культуры таких клеток, которые не содержат никаких контаминантных вирусов и не обладают злокачественностью. Лучше всего этим требованиям отвечают культуры диплоидных клеток. «Штаммом диплоидных клеток называется морфологически однородная культура клеток, стабилизированная в процессе культивирования in vitro, имеющая ограниченный срок жизни, характеризующаяся тремя фазами роста (стабилизации, активного роста и старения), сохраняющая в процессе пассирования кариотип, свойственный исходной ткани, свободная от контаминантов и не обладающая онкогенной активностью при трансплантации хомячкам» (решение Симпозиума по диплоидным клеткам, Москва, 1971).
Как оказалось, вирусы могут размножаться не только в культурах клеток, образующих монослой на стекле пробирок, но и в суспензиях живых клеток.
Таким образом, для выделения чистых культур вирусов в настоящее время используют чаще всего заражение куриных эмбрионов, первично-трипсинизированных и перевиваемых культур клеток.
Широкое распространение получил предложенный в 1952 г. Р. Дюльбекко метод бляшек (негативных колоний), позволяющий производить количественное определение вирусов (см. цв. вкл., рис. 79, 2). Для выделения вирусов монослой клеток после удаления питательной среды заражают вируссодержащим материалом и покрывают слоем агара, содержащего индикатор нейтральный красный. Чашки (флаконы) инкубируют при температуре 37 °C. Через 48 – 96 ч выявляются пятна-бляшки. Они имеют диаметр 1 – 3 мм и выглядят неокрашенными на розовом фоне. Пятна возникают за счет цитопатического действия вируса. Этот метод позволяет непосредственно обнаруживать рост вирусов.
Различают два механизма гибели клеток, вызываемой вирусами, – некроз и апоптоз. Некроз происходит из-за необратимых нарушений целостности клеточных мембран, апоптоз – вследствие фрагментации ядерной ДНК под действием клеточной эндонуклеазы. Установлено, что апоптоз играет важную роль в патогенезе инфекций, вызываемых рядом РНК-содержащих вирусов (ретровирусов, миксовирусов, альфавирусов, буньявирусов, пикорнавирусов, флавивирусов).
Цитопатическое действие вирусов может проявляться в виде следующих изменений:
1. Равномерная мелкозернистая деструкция клеток (полиовирусы, вирусы Коксаки и др.).
2. Очаговая мелкозернистая дегенерация клеток (вирус гриппа, клещевого энцефалита и др.).
3. Гроздевидная дегенерация клеток (аденовирусы).
4. Крупнозернистая равномерная деструкция клеток (вирус герпеса).
5. Симпластообразование (респираторно-синцитиальный вирус, вирус кори и другие).
О росте вирусов в клетках можно судить также по поведению индикатора, добавляемого к питательной среде. Если клетки активно осуществляют метаболизм, рН среды сдвигается в кислую сторону, и среда окрашивается в желтый цвет. В случае размножения вируса клетки погибают, рН среды мало меняется, и она сохраняет первоначальный (малиновый) цвет или (при нейтральной рН) приобретает оранжевый. Некоторые вирусы, в частности вирус гриппа, обладают особыми рецепторами (гемагглютининами), с помощью которых они адсорбируются на эритроцитах и вызывают их склеивание (гемагглютинацию). Такие вирусы легко обнаруживаются с помощью реакции гемагглютинации или гемадсорбции (эритроциты адсорбируются на инфицированных вирусами клетках культуры тканей, см. цв. вкл., рис. 79, 1). Кроме того, для обнаружения вируса в культурах клеток могут быть использованы различные серологические реакции: преципитации в агаре, иммунофлуоресценции, РСК, ИФМ и пр., а также метод ДНК-зонда и заражение животных, чувствительных к данному вирусу.
Методы идентификации (типирования) вирусов
Определение типа вируса (его идентификация) основано на нейтрализации биологической активности вируса с помощью типоспецифических сывороток. Конечный результат ее может быть установлен на основании следующих признаков:
1) нейтрализация цитопатического действия;
2) нейтрализация реакции гемадсорбции;
3) изменение проявления цветной пробы;
4) задержка (торможение) реакции гемагглютинации;
5) нейтрализация в опытах на животных.
Кроме того, для идентификации вирусов применяют методы иммунофлуоресценции, ДНК – ДНК-(РНК – РНК) – гибридизации, а также ПЦР.
Классификация вирусов
Для классификации вирусов в настоящее время используют следующие критерии:
1. Нуклеиновая кислота: тип, число нитей, процентное содержание, молекулярная масса, содержание гуанина и цитозина.
2. Морфология: тип симметрии или псевдосимметрии, число капсомеров для вирусов с кубической симметрией, наличие внешней липопротеиновой оболочки, форма, размеры вирионов.
3. Биофизические свойства: константа седиментации, плавучая плотность.
4. Белки: количество структурных белков, их локализация, аминокислотный состав.
5. Липидный состав.
6. Размножение в тканевых культурах, особенности репликации.
7. Круг поражаемых хозяев, особенности патогенеза инфекционного процесса; онкогенные свойства.
8. Устойчивость к физическим и химическим факторам (гамма-лучи, термоинактивация при 37 и 50 °C, действие жирорастворителей и отдельных катионов).
9. Антигенные свойства.
По этим критериям группируются все вирусы независимо от круга их носителей (вирусы позвоночных, беспозвоночных, растений). Название всех вирусных родов оканчивается словом «virus», для названия семейств используется суффикс «idae», а подсемейств – «inae». Из более чем 55 семейств вирусов, признанных Международным комитетом по таксономии вирусов, следующие 19 включают вирусы человека и животных (табл. 19).
Таблица 19
Классификация вирусов, наиболее часто вызывающих заболевания человека и животных
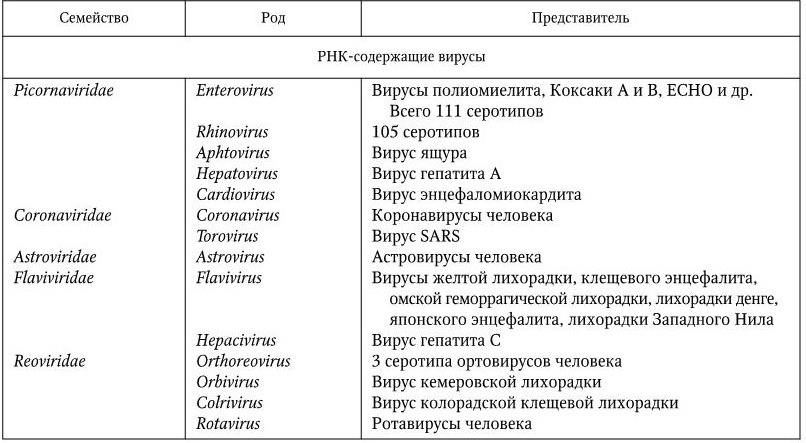
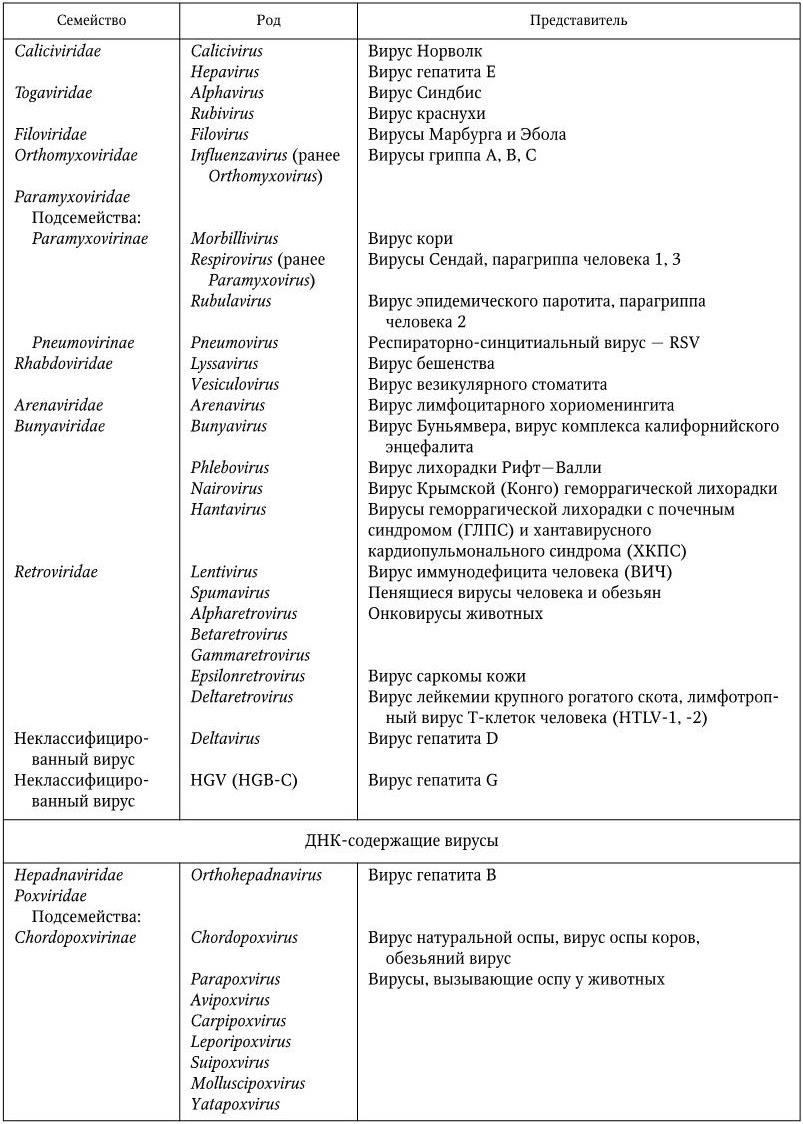
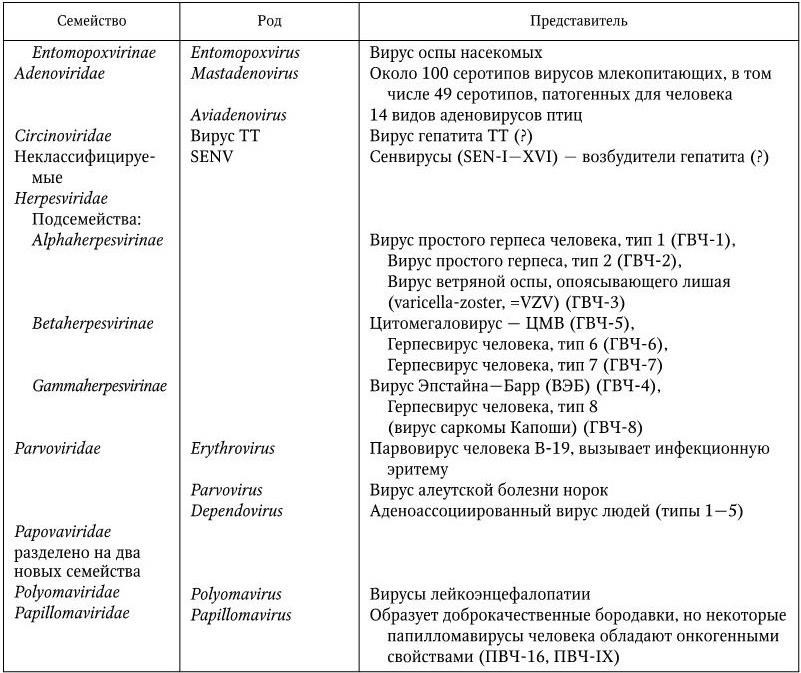
Жизненный цикл вирусов. Основные типы вирусных геномов
Под жизненным циклом вируса понимают процесс его размножения. Он происходит только внутриклеточно. Особенности размножения зависят прежде всего от вирусного генома.
1. Одноцепочечная нефрагментированная РНК, обладающая матричной активностью (позитивная, или +РНК). Вирус полиомиелита и другие пикорнавирусы.
2. Одноцепочечная нефрагментированная РНК, не обладающая матричной активностью (негативная, или –РНК). Вирион имеет в своем составе фермент РНК-зависимую РНК-полимеразу, называемую транскриптазой. Она синтезирует на вирионной РНК матричную РНК, необходимую для трансляции вирусспецифических белков. Парамиксовирусы, рабдовирусы и др.
3. Одноцепочечная фрагментированная РНК, не обладающая матричной активностью (негативная РНК); вирион имеет транскриптазу. Ортомиксовирусы (РНК вириона состоит из 8 фрагментов).
4. Двухцепочечная фрагментированная РНК; вирион имеет транскриптазу. Реовирусы (10 фрагментов).
5. Вирусы, геном которых представлен двумя идентичными нитями позитивной РНК (диплоидный геном). Вирионы имеют ферментобратную транскриптазу. Ретровирусы. 6. Одноцепочечная кольцевая РНК. Такой геном имеет только один вирус – вирус дельта-гепатита. Это дефектный вирус, для размножения его необходим вирус-помощник (вирус гепатита В).
1. Одноцепочечная линейная ДНК. Парвовирусы: «+» и « – » нити находятся в разных вирионах, но транскрибируется только « – » нить.
2. Одноцепочечная кольцевая ДНК. Фаги M13, φX174.
3. Двухцепочечная линейная ДНК. Вирусы герпеса и др.; ранняя мРНК синтезируется в ядре клеточным ферментом.
4. Двухцепочечная кольцевая ДНК. Паповавирусы, вирус гепатита В и др.; ранняя мРНК синтезируется в ядре клеточным ферментом.
5. Двухцепочечная ДНК с ковалентно связанным терминальным гидрофобным белком. Аденовирусы; ранняя мРНК синтезируется клеточным ферментом в ядре. 6. Двухцепочечная ДНК, замкнутая на каждом конце ковалентной связью. Вирус оспы; размножение происходит в цитоплазме, ранняя мРНК синтезируется вирусным ферментом.
Тип геномной вирусной ДНК определяет особенности ее репликации.
1. Двунитевая ДНК – репликация происходит по обычному механизму полуконсервативной репликации: нити разделяются, и на каждой из них достраивается комплементарная ей нить.
2. Однонитевая ДНК. Ее репликация происходит через образование вначале репликативной формы, а затем промежуточной репликативной формы. Репликативная форма возникает в результате синтеза на исходной вирионной ДНК («+» нити) комплементарной ей « – » нити, т. е. однонитевая ДНК превращается в двунитевую структуру ДНК. Промежуточная репликативная форма – это репликативная форма, « – » нить которой служит матрицей для синтеза «+» нити ДНК, идентичной исходной вирионной ДНК. Такой механизм обеспечивает передачу генов дочерним вирионам (рис. 80. I).
3. У вирусов, геном которых представлен однонитевой РНК, ее репликация происходит по следующей схеме: вначале на вирионной РНК (вРНК) синтезируются комплементарные ей РНК (кРНК). Этот процесс катализируется специфической РНК-репликазой I. Затем на кРНК синтезируется комплементарная ей, но идентичная исходной вирионная РНК (вРНК), этот процесс также катализируется специфической репликазой II. Таким образом, репликация идет по схеме (рис. 80. II):
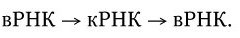
4. Репликация однонитевой РНК ретровирусов происходит с участием обратной транскриптазы. Вначале на вРНК обратная транскриптаза синтезирует комплементарную ей «минус» цепь ДНК, а затем на ней – «плюс» нить ДНК. Двунитевая ДНК интегрируется в хромосому клетки и там служит матрицей для синтеза разных классов вирусных РНК. Таким образом, репликация ретровирусов происходит по схеме:
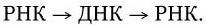
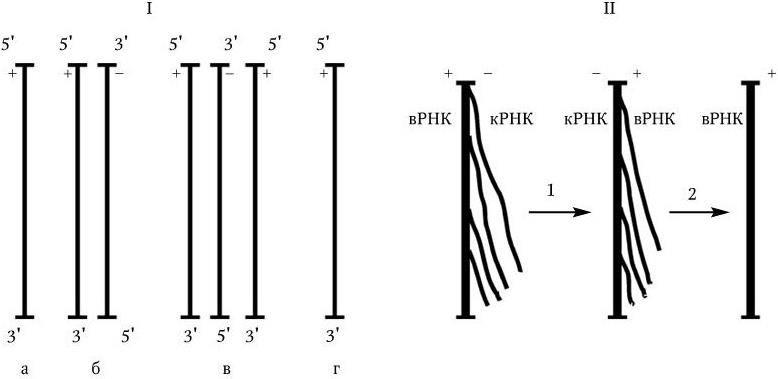
Рис. 80. Механизм репликации однонитевого вирусного ДНК-генома (I) и однонитевого вирусного РНК-генома (II):
а – геномная однонитевая ДНК; б – репликативная форма; в – промежуточная репликативная форма; г – однонитевая дочерняя геномная ДНК; вРНК – вирионная (геномная) РНК; кРНК – комплементарная РНК. Объяснение в тексте
5. Размножение вируса гепатита В также протекает с участием обратной транскриптазы, но вначале клеточная РНК-полимераза синтезирует на вирусной ДНК прегеномную РНК, после чего вирусная ревертаза синтезирует на ней минус-цепь ДНК, которая достраивается плюс-цепью ДНК. В виде двунитевой ДНК вирус интегрируется в хромосому клетки-хозяина, где на ней транскрибируется вирусная РНК.
Существуют некоторые общие закономерности размножения вирусов. Во-первых, все РНК-содержащие вирусы, кроме вирусов гриппа и ретровирусов, размножаются в цитоплазме. Для своего размножения вирусы гриппа А и В и ретровирусы проникают в ядро, что связано с особенностями поведения их генома. Во-вторых, размножение всех ДНК-содержащих вирусов, кроме вирусов оспы, протекает в ядре, где происходит транскрипция и репликация их геномных нуклеиновых кислот, и в цитоплазме, где происходит трансляция вирусных белков, их процессинг и морфогенез вирионов. Лишь размножение вирусов группы оспы происходит в цитоплазме клетки, поскольку они обладают собственными системами транскрипции.
Другая особенность размножения вирусов заключается в том, что их нуклеокапсидные белки синтезируются на свободных полирибосомах (не связанных с мембраной), а суперкапсидные белки – на рибосомах, ассоциированных с мембранами (на шероховатых мембранах). Кроме того, белки некоторых вирусов подвергаются протеолитическому процессингу и гликозилированию. Различают два типа протеолитического процессинга: каскадный и точечный.
При каскадном протеолизе вновь синтезированный вирусный полипептид-предшественник (полипротеин) подвергается последовательному «нарезанию» с образованием более коротких полипептидов, часть из которых дополнительно разрезается на более мелкие субъединицы. Ряд ступеней такого каскадного протеолиза осуществляется определенной областью самого полипротеина, обладающего протеазной активностью. Такому каскадному процессингу подвергаются белки у ретровирусов, пикорнавирусов, aльфа-, флави– и других вирусов. Для них такое протеолитическое нарезание белков является жизненно важным этапом репродукции, поскольку оно обусловливает реализацию их функций.
При точечном протеолизе разрезанию подвергается один (реже несколько) из вирусных полипептидов. Разрезание происходит, как правило, в определенном участке полипептида. Такой тип протеолиза необходим для того, чтобы определенный белок вируса приобрел свою специфическую активность. Например, суперкапсидный белок вируса гриппа – гемагглютинин – разрезается на две субъединицы: боEльшую и меньшую. В результате меньшая субъединица приобретает способность сливаться с мембранами клетки-мишени и ее лизосомами. Благодаря этому вирус гриппа приобретает способность проникать в клетку. Такой точечный протеолиз наблюдается у ортомиксовирусов, парамиксовирусов, ротавирусов, вирусов группы оспы и др. Точечный протеолиз, как и каскадный, жизненно важен для вируса.
Наконец, еще одна особенность вирусов, обладающих суперкапсидом, заключается в том, что суперкапсидные белки подвергаются в ходе своей транспортировки на наружную поверхность клеточной мембраны гликозилированию.
Механизм взаимодействия вируса с клеткой
Жизненный цикл вирусов начинается с их адсорбции на мембране клетки-мишени и заканчивается выходом вновь синтезированных вирионов из клетки. Цикл включает в себя следующие стадии:
1. Адсорбция.
2. Внедрение вириона в клетку, сопряженное с одновременным разрушением его суперкапсидных и капсидных белков и высвобождением его геномной нуклеиновой кислоты.
3. Внутриклеточное размножение вируса, включающее в себя целую серию последовательных событий, заканчивающихся формированием зрелых вирионов и выходом их из клетки. У вирусов, геном которых представлен позитивной РНК, внутриклеточное размножение начинается с ее трансляции. К ней присоединяются процессы репликации, затем сборки нуклеокапсида. У всех остальных вирусов процесс внутриклеточного размножения начинается с транскрипции геномной нуклеиновой кислоты, затем происходит трансляция вирусных мРНК, репликация геномной нуклеиновой кислоты, формирование нуклеокапсида.
Если вирусы обладают суперкапсидом, его белки после синтеза на рибосомах, ассоциированных с мембранами, и гликозилирования устанавливаются на наружной поверхности клеточной мембраны в виде своеобразных шипов, вытесняя клеточные белки. В этом случае завершающим этапом морфогенеза вириона является прохождение нуклеокапсида через модифицированную клеточную мембрану с образованием суперкапсидной оболочки. Заключительным этапом внутриклеточного размножения является выход вновь синтезированных вирионов из клетки.
Адсорбция вируса на мембране клетки является пусковым моментом в реализации его патогенных свойств, ибо без этого вирус не может проникнуть в клетку и размножаться в ней, он просто обречен на гибель.
У клеток различают две группы рецепторов для вирусов: липопротеиновые и мукопротеиновые. В связи с разнообразием клеточных и вирусных рецепторов на одних и тех же клетках могут адсорбироваться разные вирусы.
Проникновение (вход) вириона в клетку и инициация его жизненного цикла происходит в четыре этапа: 1) адсорбция вируса клеточным рецептором; 2) взаимодействие с ко-рецепторами, в результате которого происходят изменения конформации элементов вирусной оболочки; 3) перемещение вириона в клеточной мембране – вход в клетку; 4) освобождение генома вириона от нуклеокапсидной оболочки. В связи с открытием новых порталов (греч. porto – вход, ворота) для попадания питательных веществ в клетку выделяются такие группы порталов: а) фагоцитоз и б) пиноцитоз, подразделяемый на макропиноцитоз и различные эндоцитозы – кластрин-опосредованный (размер образуемой вакуоли ~ 120 нм), кавеолин-опосредованный (~ 60 нм), кавеолин– и кластрин-независимый эндоцитоз (~ 90 нм). Вирусы проникают в клетку всеми этими способами. Установлено, что при конформационных изменениях вирусных белков используется энергия клеткихозяина. В ходе взаимодействия вирусных белков с мембраной клетки в ней возникают специфические микродомены, получившие название плотов. Они способны транспортировать вирусные суперкапсидные белки, синтезируемые связанными с мембранами рибосомами, как бы «плавая» в мозаичном липидном слое мембраны от аппарата Гольджи на поверхность клетки. В процессе отпочковываниая вириона эти белки включаются в суперкапсид вируса.
Проникнув в клетку, вирусный геном полностью подчиняет жизнь клетки своим интересам и с помощью ее белоксинтезирующей системы и систем генераций энергии осуществляет собственное воспроизводство, очень часто ценой жизни клетки. В качестве примера на рис. 81 представлена схема жизненного цикла вируса леса Семлики, одного из представителей рода Alphavirus. Геном этого вируса – однонитевая позитивная нефрагментированная РНК. Вирион имеет суперкапсид, состоящий из липидного бислоя, через который проходят 240 копий гликопротеиновых комплексов, образующих на поверхности суперкапсида шипы. Капсид имеет форму икосаэдра (20 граней). Вирус входит в клетку, используя один из вариантов эндоцитоза, и далее по схеме: окаймленная ямка → окаймленный пузырек → эндосома → лизосома. В лизосоме происходит слияние примыкающих друг к другу липидных бислоев суперкапсида вириона и мембраны лизосомы, и нуклеокапсид выходит в цитозоль клетки. Здесь разрушается нуклеокапсид, и освобожденная геномная РНК транслируется на рибосомах клетки-хозяина, в результате чего синтезируется вирусспецифическая РНК-полимераза (репликаза), которая осуществляет многократную репликацию вРНК. В свою очередь молекула родительской вРНК и вновь синтезированные ее копии служат в качестве матриц, направляющих синтез четырех структурных белков вируса: С-белка капсида и трех белков (Е1, Е2 и Е3) суперкапсида. Синтез капсидного белка осуществляют свободные полирибосомы цитозоля, вновь синтезированный капсидный белок ассоциирует с реплицированными копиями вРНК, в результате чего формируются нуклеокапсиды. Суперкапсидные белки синтезируются на рибосомах, связанных с мембранами эндоплазматического ретикулума, включаются в мембрану и там гликозилируются, с помощью плотов переносятся в мембрану аппарата Гольджи, где они подвергаются дополнительному гликозилированию, после чего опять с помощью плотов поступают на наружную поверхность клеточной мембраны, вытесняя здесь клеточные белки. Заключительный этап морфогенеза вируса заключается в том, что нуклеокапсид, проходя через клеточную мембрану, обволакивается участком мембраны и встроенными в нее в этом месте вирусспецифическими суперкапсидными белками, после чего отпочковывается от клетки, отделяясь от ее поверхности так, что оказывается окруженным замкнутой внешней оболочкой (суперкапсидом).
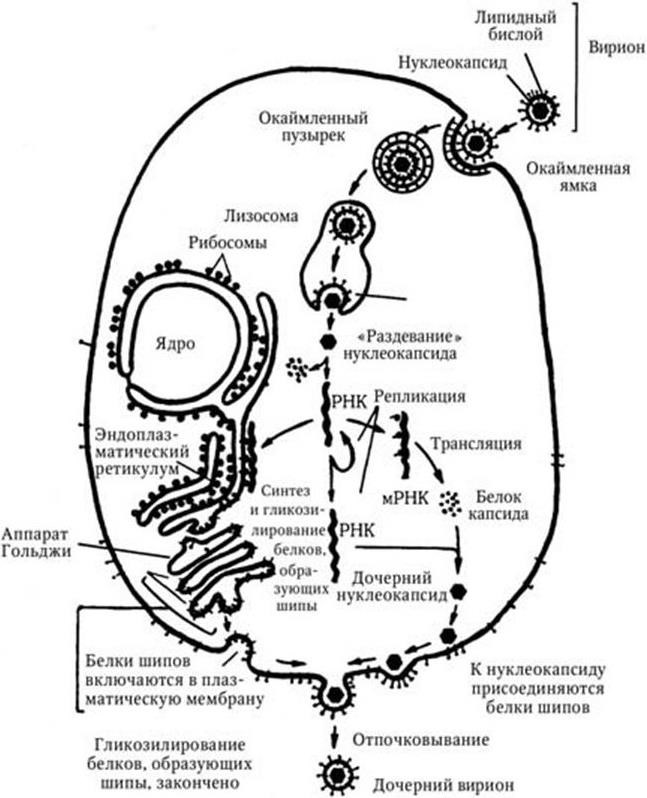
Рис. 81. Схема жизненного цикла вируса леса Семлики (геном – однонитевая позитивная РНК, вирион имеет суперкапсид, относится к альфа-вирусам)
Взаимодействие вируса с клеткой может протекать по-разному и приводить к различным клиническим проявлениям. В зависимости от продолжительности пребывания вируса в организме различают две группы вирусных инфекций:
1. Вирусные инфекции, связанные с непродолжительным пребыванием вируса в организме.
2. Вирусные инфекции, обусловленные длительным пребыванием (персистенцией) возбудителя в организме.
В случае непродолжительного пребывания вируса в организме заболевание протекает либо в форме острой инфекции, либо в виде бессимптомной (инаппарантной) инфекции. Острая инфекция, как правило, заканчивается выздоровлением, формированием приобретенного иммунитета и освобождением организма от возбудителя. Бессимптомная инфекция протекает без каких-либо проявлений и заканчивается также формированием иммунитета и освобождением от возбудителя.
Вирусные инфекции, обусловленные длительным пребыванием возбудителя в организме, подразделяют на латентные, хронические и медленные инфекции.
Латентные инфекции протекают бессимптомно и могут сопровождаться либо нормальной репродукцией вируса во внешне здоровом организме и выделением его во внешнюю среду, либо сопровождаться вирусоносительством, при котором нарушен нормальный цикл вирусной репродукции и вирус длительно персистирует в организме.
Хронические вирусные инфекции характеризуются периодическими состояниями выздоровления и рецидивов (обострений).
Термин «медленные инфекции» был предложен исландским микробиологом Б. Сигурдсоном в 1954 г. для вирусных заболеваний, характеризующихся продолжительным (иногда в течение многих лет) инкубационным периодом, длительным прогрессирующим течением болезни и заканчивающихся тяжелыми расстройствами или, чаще, смертью. Типичным примером медленных инфекций является СПИД. В основе развития медленных инфекций лежат нарушения генетических, иммунологических и физиологических механизмов, которые обеспечивают длительную персистенцию возбудителя в организме.
Как оказалось, медленные инфекции могут вызывать и такие вирусы, которые обычно вызывают острые инфекции (например, вирусы кори, бешенства и др.). Так, вирус кори оказался возбудителем такой тяжелой медленной инфекции, как подострый склерозирующий панэнцефалит.
Известны несколько механизмов, которые обусловливают длительное переживание вируса в организме: 1) вирус находится в дефектном состоянии, он не способен размножаться и индуцировать эффективный иммунный ответ; 2) вирус находится в клетке в виде свободной геномной нуклеиновой кислоты, не доступной действию антител; 3) геном вируса интегрирован в хромосому клетки-мишени.
Персистенция вирусов столь часто наблюдается в клетках различных организмов, что это дало основание В. Д. Тимакову сформулировать следующее положение: «Состояние вирусного носительства является, пожалуй, наиболее распространенной и общей формой взаимодействия вируса с клеткой, а острое вирусное заболевание – лишь проявлением нарушения этого характерного равновесия».
Вирусы бактерий (бактериофаги)
Бактериофаги (ныне просто фаги) – вирусы бактерий. Бактериофагия – процесс взаимодействия фагов с бактериями, заканчивающийся очень часто их разрушением (лат. bacteriophaga – пожирающий бактерии).
Явление бактериофагии наблюдали многие ученые, но приоритет открытия фагов (1916) принадлежит Ф. Д’Эреллю – канадскому ученому, работавшему в Париже в Институте Пастера. Занимаясь изучением дизентерии, Феликс Д’Эрелль задумался над вопросом: почему возбудитель этой болезни, высевающийся в ее начале в большом количестве, в конце заболевания очень часто перестает выделяться? Заподозрив здесь действие какого-то агента, Д’Эрелль решил его обнаружить. С этой целью к свежей бульонной культуре дизентерийной палочки он стал добавлять по нескольку капель фильтрата испражнений больного. После одного из таких посевов Д’Эрелль и обнаружил этот агент по его способности разрушать дизентерийные бактерии. При добавлении к мутной бульонной культуре он вызвал ее просветление, а при добавлении к культуре, засеянной на плотную среду, появлялись прозрачные (стерильные) пятна – колонии. Способность вызывать такие пятна и размножаться при повторных посевах дали основание считать его живым корпускулярным агентом. Д’Эрелль назвал его Baсteriophagum intestinale, т. е. выделенный из кишечника пожиратель бактерий. Последующие наблюдения показали, что бактериофаги распространены повсеместно. Они встречаются всюду, где есть бактерии, – в почве, воде, кишечном тракте человека и животных, гнойных выделениях и т. п. Особенно много фагов в сточных водах; из этого источника можно выделить практически любой фаг. Поскольку естественной средой обитания любого фага является микробная клетка, жизнь фагов связана с бактериями. Фагам присущи все биологические особенности, которые свойственны вирусам. Их геном представлен либо ДНК, либо РНК и заключен в белковую оболочку (капсид), структурные субъединицы которой уложены по типу либо спиральной, либо кубической симметрии. Крупные фаги, имеющие хвостик, устроены по типу бинарной симметрии (головка – икосаэдр, хвостик – спиральная симметрия). Фаги различаются по форме – нитевидные, сферические; фаги, имеющие головку и хвостик; по размерам – мелкие, среднего размера и крупные (рис. 82). Чем крупнее фаги, тем больше у них генов и сложнее их жизненный цикл. К самым маленьким относятся фаги M13 и φX174.
Фаг М13 – нитевидный, геном – однонитевая кольцевидная молекула ДНК с м. м. 2 МД, содержит 8 генов. Оболочка в виде нити, состоит из 3000 белковых субъединиц, уложенных по спирали. Длина вириона 1000 нм, его диаметр 6 нм.
Фаг φX174 – икосаэдр с м. м. 6,2 МД, диаметр 25 нм. Геном – однонитевая кольцевидная молекула ДНК, состоящая из 5400 нуклеотидов, несет 9 генов. Капсид построен из 60 молекул белка F, вирион имеет 12 вершин, на каждой из них вмонтирован шип, содержащий 5 молекул белка G и одну молекулу Н-белка (белок-лоцман). Наиболее сложно устроены крупные фаги, состоящие из головки и хвостика. У энтеробактерий обнаружено более 500 фагов, из них более 140 состоят из головки и хвостика.
Фаг Т2 паразитирует у E. coli и имеет следующую структуру (рис. 83): головка – икосаэдр, геном представлен двунитевой линейной ДНК, несущей около 200 генов. Головка с помощью воротника и зонтика связана с хвостиком, который имеет сложное строение – полый внутри стержень, заканчивающийся шестиугольной пластинкой с шестью шипами. Хвостик имеет белковый чехол, который состоит из 144 субъединиц, образующих 24 спирали; каждая белковая молекула содержит одну молекулу АТФ-азы и ион Ca2+. Белок актиноподобный и способен сокращаться. В пластинке и шипах содержится лизоцим. Кроме того, хвостик имеет 6 ворсинок. У неактивного фага они свернуты и сложноэфирными связями прикреплены к белкам чехла. В момент адсорбции ворсинки раскрываются и обеспечивают плотное прикрепление фага к бактериальной клетке. Основное назначение хвостика – обеспечение адсорбции фага на клетке. Длина хвостика сильно варьирует. В тех случаях, когда хвостик содержит белковый чехол, последний, благодаря своему сокращению, обеспечивает проникновение стержня через клеточную стенку и цитоплазматическую мембрану.

Рис. 82. Различные формы фаговых вирионов (по Г. Шлегелю, 1972):
1 – нитевидная форма (фаг fd); 2 – гексагональная головка с отростком и сократительным чехлом (фаги Т2, Т4, Т6); 3 – гексагональная головка с длинным, не способным к сокращению хвостиком; 4 – головка с коротким отростком (фаги Т3, Т7); 5 – октаэдр; 6 – икосаэдр
Резистентность фагов. По степени устойчивости к действию различных факторов внешней среды и химических веществ фаги занимают место между вирусами и неспоровыми бактериями. Они устойчивы в пределах рН от 5,0 до 8,0, большинство из них не инактивируется холодными водными растворами глицерина и этилового спирта. На них не действуют такие ферментные яды, как цианид, фторид, динитрофенол, а также хлороформ и фенол. Фаги хорошо сохраняются в запаянных ампулах и в лиофилизированном состоянии, но они легко разрушаются при кипячении, действии кислот, химических дезинфектантов, при УФ-облучении.
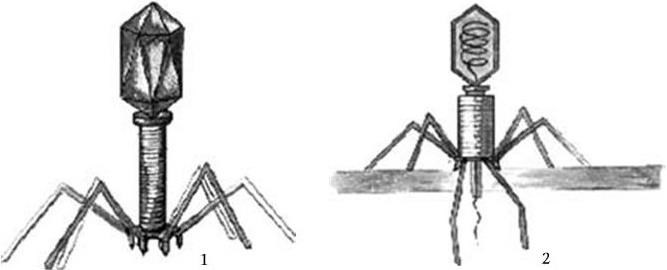
Рис. 83. Схема строения бактериофага Т2:
1 – до инъекции фаговой ДНК; 2 – после инъекции. Объяснение в тексте
Различают фаги инфекционные, т. е. способные вызвать разные формы фаговой инфекции, и неинфекционные (вегетативные), или незрелые, фаги, находящиеся еще в стадии размножения. В свою очередь инфекционные фаги разделяют на покоящиеся (находящиеся вне клетки), вирулентные – способные вызвать продуктивную форму инфекции, и умеренные фаги – способные вызывать не только продуктивную, но и редуктивную фаговую инфекцию.
Жизненный цикл фага может проявляться в форме продуктивной (фаг размножается в клетке и выходит из нее), редуктивной (геном фага проникает в клетку, однако размножения фага не происходит, его геном интегрируется в хромосому клетки-хозяина, становится ее составной частью, т. е. фаг превращается в профаг, а клетка становится лизогенной) и абортивной инфекции, при которой взаимодействие фага с клеткой обрывается на какой-то стадии жизненного цикла фага, и он погибает.
Клетка, несущая профаг, называется лизогенной, потому что профаг, передающийся клеткой по наследству, может выйти из хромосомы, активироваться и вызвать продуктивную форму инфекции.
Если в результате лизогении, т. е. внедрения профага в хромосому клетки-хозяина, она получает новые наследуемые признаки, такую форму ее изменчивости называют лизогенной конверсией, т. е. изменчивостью, обусловленной лизогенией. Лизогенную конверсию вызывают только умеренные фаги.
Жизненный цикл фага, сопровождающийся продуктивной инфекцией, складывается из шести последовательных стадий, каждая из которых, в свою очередь, состоит из нескольких этапов.
1. Адсорбция фагов на клеточной поверхности бактерий при помощи специфических рецепторов (белков-лоцманов), которые располагаются на кончике нити, шипа или хвостика. В свою очередь, на клеточной стенке бактерии располагаются ее фагоспецифические рецепторы, распознаваемые фагом. Адсорбция фага – пусковой момент его жизненного цикла. Она очень специфична и поэтому обусловливает возможность практического использования фагов, например для идентификации бактерий, а также для лечебных и профилактических целей.
2. Проникновение фагового генома через клеточную стенку и цитоплазматическую мембрану внутрь клетки и освобождение его от оболочки (раздевание фага).
3. Установление фагового генома с помощью белка-лоцмана для реализации содержащейся в геноме информации:
а) однонитевая ДНК – к репликативному аппарату для синтеза комплементарной ей нити и образования репликативной формы; далее ее поведение аналогично двунитевой ДНК;
б) двунитевая ДНК – к транскрипционному аппарату для синтеза мРНК и последующей трансляции вирусспецифических белков (ферментов и структурных);
в) РНК-геном – к трансляционному аппарату для синтеза вирусспецифических белков (ферментов репликации и структурных).
4. Репликация фаговой геномной ДНК или РНК.
5. Сборка вновь синтезированных вирионов – заключение геномной НК в белковую оболочку, морфогенез фагов.
6. Выход вновь синтезированных фагов из клетки:
а) путем отпочковывания (М13 – единственный фаг, не вызывающий при выходе из клетки ее гибели);
б) путем лизиса клетки изнутри. Он осуществляется свободным лизоцимом и вызывает гибель клетки.
Степень зависимости репликации ДНК фага от хромосомы клетки определяется набором генов у фагов. Крупные фаги, например Т4, осуществляют репликацию полностью автономно; средние – Т7 – частично нуждаются в помощи бактериальных генов, а мелкие (М13, φX174) почти полностью зависят от хромосомных генов.
Жизненный цикл фага Т4 протекает следующим образом. С помощью своего хвостика фаг распознает специфический для него рецептор на поверхности клеточной стенки бактерий (чаще всего липополисахаридной природы) и прикрепляется к нему. Эта фаза адсорбции обратима, но затем, когда ворсинки раскрываются и плотно прикрепляют фаг к клеточной стенке, она становится необратимой. Пластинка со своими шипами прикрепляется к стенке, содержащийся в них лизоцим вызывает в месте контакта лизис клеточной стенки. Одновременно ионы Ca2+ активируют содержащуюся в белках чехла аденозинтрифосфатазу (АТФазу), и чехол сокращается. Его длина уменьшается в 2 раза, количество витков также уменьшается в 2 раза: вместо 24 их становится 10 – 12 (см. рис. 83). В результате сокращения чехла внутренний стержень прокалывает клеточную стенку в участке, разрушенном лизоцимом, и цитоплазматическую мембрану. Прокалывание происходит в участках напротив зон адгезии цитоплазматической мембраны и нижнего слоя пептидогликана. Таких зон около 200 – 300, их размер 20 – 30 нм.
Внедрение фаговой ДНК в клетку происходит с помощью следующих механизмов:
а) около 10 % ее активно впрыскивается во время сокращения чехла хвостика;
б) остальная часть фаговой ДНК втягивается в цитоплазму бактерий благодаря процессам транскрипции и работе трансляционного аппарата.
Внутриклеточное размножение фага Т2 происходит в такой последовательности: уже через 1 мин синтезируются ранние мРНК, кодирующие белки, необходимые для репликации фаговой ДНК; через 5 мин начинается репликация ДНК; затем – синтез мРНК, необходимых для образования структурных белков фага и его морфогенеза, а через 13 мин в клетке появляются первые вирионы. Процесс синтеза ДНК, белков и морфогенез фагов продолжается далее: из одного фага в клетке синтезируется 200 – 300 новых вирионов.
Особенности морфогенеза фагов. Морфогенез мелких фагов протекает по типу самосборки. У крупных фагов этот процесс носит более сложный характер. Например, морфогенез фага Т4 требует активности более чем 40 генов и протекает при участии трех самостоятельных линий. На одной из них происходит сборка хвостика (участвует около 20 генов), на другой – головки фага (не менее 16 генов) и на третьей – сборка ворсинок (5 генов). Соединение хвостика с головкой не требует участия генов, однако оно не может произойти до тех пор, пока и хвостик, и головка не будут смонтированы полностью. Точно так же ворсинки могут присоединяться к хвостику только после того, как он соединится с полностью готовой головкой. Благодаря строгому генетическому контролю со стороны фага обеспечивается последовательность и согласованность всех процессов его внутриклеточного размножения.
Выход сформировавшихся фагов в большинстве случаев происходит благодаря лизису изнутри свободным лизоцимом. Он синтезируется на самом последнем этапе размножения фага. Иногда бывает лизис бактерий извне как следствие адсорбции многих фагов на одной клетке, но при этом размножения фагов не происходит.
Обычно же после внедрения фагового генома в клетку у нее возникает состояние иммунитета к суперинфекции данным фагом, т. е. проникновение других фаговых геномов становится невозможным. Иммунитет обеспечивается особым цитоплазматическим репрессором.
Ее вызывают только умеренные фаги. В этом случае их жизненный цикл складывается из следующих стадий:
а) адсорбция фага на поверхности клетки;
б) проникновение фаговой ДНК в бактериальную клетку;
в) сайт-специфическая интеграция фаговой ДНК в хромосому клетки-хозяина и превращение фага в профаг.
Если первые две стадии протекают так же, как в случае продуктивной инфекции, то третья требует участия дополнительных фаговых и хозяйских генов.
Механизм интеграции фаговой ДНК в хромосому бактериальной клетки лучше всего изучен на примере фага λ (лямбда). Фаг состоит из головки и хвостика. Его геном представлен двунитевой линейной ДНК, имеющей «липкие» концы (избыточные нуклеотидные последовательности на противоположных концах нитей, комплементарные друг другу), поэтому она может переходить в кольцевую структуру, необходимую для ее включения в хромосому клетки-хозяина. ДНК фага λ имеет м. м. около 30 МД, содержит 46 500 нуклеотидных пар и несет 32 гена, 7 из которых кодируют головку, 11 – хвостик, а остальные играют регуляторную роль.
Фаг λ включается в хромосому E. coli между генами gal и bio с помощью сайт-специфической рекомбинации. Она оказывается возможной потому, что ДНК фага имеет особый участок – attP (англ. attachment phage – прикрепление фага). Такой же участок имеется и в хромосоме E. coli – attB. Он расположен между генами gal и bio. Участки att имеют сложную структуру и состоят из 250 нуклеотидов. В результате рекомбинации между attP и attB, протекающей по механизму кроссинговера, фаговая ДНК оказывается включенной в хромосому, причем слева она фланкирована участком attL (англ. left – левый), а справа – attR (англ. right – правый), которые образуются вследствие рекомбинации между attP и attB. Рекомбинация протекает с участием генов red фага и recA – бактерии. Для интеграции требуется также белок фага – продукт гена int (интеграза) и особый хозяйский белок интеграции. Таким образом, геном фага, интегрируясь в хромосому, превращается в профаг, а клетка становится лизогенной. Выходу профага из хромосомы препятствует цитоплазматический репрессор, который наделяет клетку одновременно иммунитетом против повторного инфицирования данным фагом. Синтез репрессора контролируется фагом. Однако профаг спонтанно или под воздействием различных факторов (химические вещества, облучение УФ, рентгеновскими лучами, повышенная температура) может выходить из хромосомы клетки и вызывать продуктивную инфекцию, заканчивающуюся лизисом клетки и выходом из нее вновь синтезированных вирионов. Механизм выхода (исключение фага) из хромосомы состоит в том, что происходит рекомбинация между attL и attR, в результате которой восстанавливаются attP и attB, а фаговая ДНК принимает кольцевидную структуру и исключается из хромосомы. Процесс выхода требует участия, помимо указанных выше белков, еще одного белка – продукта фагового гена xis (ген эксцизии, исключения).
Умеренные фаги играют важную роль в обмене генетическим материалом между бактериями. Этот процесс получил название трансдукции. Различают общую (генерализованную, или неспецифическую) и специфическую трансдукцию.
Механизм ее заключается в том, что в процессе внутриклеточного размножения фага в его головку может быть случайно включен вместо фаговой ДНК фрагмент бактериальной ДНК, равный по длине фаговой. Это вполне возможно, так как в инфицированной клетке биосинтез ее ДНК блокирован, а сама ДНК подвергается распаду. Таким образом в процессе репродукции фага возникают дефектные вирионы, у которых в головках вместо собственной геномной ДНК содержится фрагмент ДНК бактерии. Такие фаги сохраняют инфекционные свойства. Они адсорбируются на бактериальной клетке, вводят в нее ДНК, содержащуюся в головке, но при этом размножения фага не происходит. Введенная в клетку реципиента донорная ДНК (фрагмент хромосомы донора), если она содержит гены, отсутствующие у реципиента, наделяет его новым признаком. Этот признак будет зависеть от того, какой ген (гены) попал в головку трансдуцирующего фага. В случае рекомбинации привнесенного фагом фрагмента ДНК донора с хромосомой клетки-реципиента этот признак наследственно закрепляется.
Отличается от неспецифической тем, что в этом случае трансдуцирующие фаги всегда переносят только определенные гены, а именно, те из них, которые располагаются в хромосоме лизогенной клетки слева от attL или справа от attR. Специфическая трансдукция всегда связана с интеграцией умеренного фага в хромосому клетки-хозяина. При выходе (исключении) из хромосомы профаг может захватить ген с левого или правого фланга, например или gal, или bio. Но в этом случае он должен лишиться такого же размера своей ДНК с противоположного конца, чтобы ее общая длина оставалась неизменной (иначе она не может быть упакована в головку фага). Поэтому при такой форме исключения образуются дефектные фаги: λdgal или λdbio.
Специфическую трансдукцию у E. coli осуществляет не только фаг лямбда, но и родственные ему лямбдоидные и другие фаги. В зависимости от места расположения сайтов attB на хромосоме они при своем исключении могут включать различные бактериальные гены, сцепленные с профагом, и трансдуцировать их в другие клетки. Встраивающийся в геном материал может замещать до 1/3 генетического материала фага.
Трансдуцирующий фаг в случае инфицирования реципиентной клетки интегрируется в ее хромосому и привносит в нее новый ген (новый признак), опосредуя не только лизогенизацию, но и лизогенную конверсию.
Таким образом, если при неспецифической трансдукции фаг является только пассивным переносчиком генетического материала, то при специфической фаг включает этот материал в свой геном и передает его, лизогенизируя бактерии, реципиенту. Однако лизогенная конверсия может произойти и в том случае, если геном умеренного фага содержит такие собственные гены, которые у клетки отсутствуют, но отвечают за синтез существенно важных белков. Например, способностью вырабатывать экзотоксин обладают только те возбудители дифтерии, в хромосому которых интегрирован умеренный профаг, несущий оперон tox. Он отвечает за синтез дифтерийного токсина. Иначе говоря, умеренный фаг tox вызывает лизогенную конверсию нетоксигенной дифтерийной палочки в токсигенную.
Фаги размножаются только за счет паразитирования в микробной клетке. Их размножение в бульонной культуре приводит к тому, что культура, бывшая перед добавлением фага мутной, через несколько часов инкубации при температуре 37 °C становится прозрачной. На плотных средах фаги обнаруживают либо с помощью спот-теста (англ. spot – пятно), либо методом агаровых слоев, предложенным А. Грациа (1936). В первом случае на поверхность агара в чашке засевают культуру, а затем на нее наносят каплю содержащего фаг материала. Если в нем содержится много вирионов, то на месте нанесения капли будет большое стерильное пятно (рис. 84, 1).
Метод агаровых слоев заключается в следующем. Вначале в чашку наливают слой питательного агара. После застывания на этот слой добавляют 2 мл расплавленного и охлажденного до 45 °C агара 0,7 %-ного, в который предварительно добавляют каплю концентрированной суспензии бактерий и определенный объем суспензии фага. После того как верхний слой застынет, чашку помещают в термостат. Бактерии размножаются внутри мягкого слоя агара, образуя сплошной непрозрачный фон, на котором хорошо видны колонии фага в виде стерильных пятен (рис. 84, 2). Каждая колония образуется за счет размножения одного исходного фагового вириона. Применение этого метода позволяет: а) путем подсчета колоний точно определить количество жизнеспособных фаговых вирионов в данном материале;
б) по характерным признакам (размер, прозрачность и др.) изучать наследственную изменчивость у фагов.
По спектру своего действия на бактерии фаги подразделяются на поливалентные (лизируют родственные бактерии, например поливалентный сальмонеллезный фаг лизирует почти все сальмонеллы), монофаги (лизируют бактерии только одного вида, например фаг Vi-I лизирует только возбудителей брюшного тифа) и типоспецифические фаги, которые избирательно лизируют отдельные варианты бактерий внутри вида. С помощью таких фагов производится наиболее тонкая дифференциация бактерий внутри вида, с разделением их на фаговарианты. Например, с помощью набора фагов Vi-II возбудитель брюшного тифа делится более чем на 100 фаговариантов. Поскольку чувствительность бактерий к фагам является относительно стабильным признаком, связанным с наличием соответствующих рецепторов, фаготипирование имеет важное диагностическое и эпидемиологическое значение.

Рис. 84. Обнаружение бактериофагов в исследуемом материале:
1 – спот-тест; 2 – титрование по Грациа
Благодаря своему разрушающему (литическому) действию на бактерии фаги могут быть использованы с лечебно-профилактической целью при различных заболеваниях (дизентерия, холера, различные гнойно-воспалительные заболевания и т. д.). Наборы стандартных фагов, в том числе международные, используются для фаготипирования возбудителей ряда болезней (холеры, брюшного тифа, сальмонеллезов, дифтерии, стафилококковых и других заболеваний). Фаги широко используют для изучения генетики микроорганизмов.
Методы диагностики вирусных заболеваний
Для диагностики вирусных заболеваний применяют следующие методы:
1. Вирусоскопический.
2. Иммунной электронной микроскопии.
3. Вирусологический.
4. Серологический.
5. Иммунофлуоресцентный.
6. Биологический.
7. Использование ДНК-(РНК) – зондов.
8. Цепная полимеразная реакция.
При вирусоскопическом методе в исследуемом материале обнаруживают с помощью электронной микроскопии вирионы или с помощью светооптической микроскопии – внутриклеточные включения. Метод электронной микроскопии дает возможность обнаружить вирионы, но он недостаточно специфичен.
Гораздо более специфичным, чувствительным и надежным является метод иммунной электронной микроскопии. Он оказался особенно полезным для обнаружения тех вирусов, которые не размножаются в культуре клеток и для которых нет других тест-систем. В основе этого метода лежит взаимодействие антител с вирусами при смешивании вируссодержащего материала со специфической сывороткой. В результате взаимодействия антител с вирусами образуются микропреципитаты, состоящие из вирусных частиц, покрытых своеобразным «венчиком». Специфичность агрегации вирионов антителами позволяет надежно их идентифицировать. Разрешающая способность метода возрастает благодаря тому, что образование иммунных агрегатов повышает концентрацию вирионов в микропрепарате. Сам процесс иммунной электронной микроскопии включает следующие процедуры:
1) приготовление водного экстракта исследуемого материала и смешивание его с соответствующим объемом специфической сыворотки;
2) осаждение образующихся микропреципитатов центрифугированием;
3) негативное контрастирование иммунного преципитата фосфорно-вольфрамовой кислотой;
4) нанесение материала на сеточку;
5) просмотр препарата в электронном микроскопе.
Единственный недостаток этого метода заключается в его громоздкости, поэтому он не может быть использован для массовых исследований.
Вирусологический метод основан на выделении вирусов и их идентификации с использованием культур клеток или куриных эмбрионов. Для проведения вирусологического исследования важное значение имеют: выбор материала и его предварительная обработка, условия транспортировки и соблюдение необходимых условий для культивирования вируса. Материал для исследования определяется характером вирусного заболевания, местом размножения вируса в организме и путями его выделения. Далее в соответствующих главах указано, при каких заболеваниях какой материал необходимо брать для выделения вируса. Для подавления возможного роста бактерий исследуемый материал обрабатывают антибиотиками, или последние (в определенных концентрациях) добавляют в питательную среду для выращивания культуры клеток. Выбор способа культивирования (заражение лабораторных животных, куриных эмбрионов или культур клеток) определяется биологией предполагаемого возбудителя. Важное значение имеет соблюдение стандартных условий культивирования: оптимальная температура, продолжительность, использование дополнительных тестов для индикации (бляшкообразование, реакции гемадсорбции, гемагглютинации, иммунофлуоресценции и т. д.). Методы индикации вирусов указаны в главе 44.
Для идентификации вирусов применяются типоспецифические сыворотки.
Серологические методы могут быть использованы для обнаружения в исследуемом материале как специфических антител, так и вирусных антигенов. Для этих целей могут быть использованы все известные серологические реакции:
1. Реакция связывания комплемента.
2. Реакция пассивной гемагглютинации и ее варианты (РНАг, РНАт).
3. Реакция торможения гемагглютинации.
4. Реакция гемагглютинации иммунного прилипания (комплекс антиген + антитело в присутствии комплемента адсорбируется на эритроцитах).
5. Реакции преципитации в геле.
6. Реакции нейтрализации вирусов.
7. Радиоиммунный метод.
8. Методы иммуноферментного анализа.
Из перечисленных методов все большей популярностью пользуются методы иммуноферментного анализа, отличающиеся высокой специфичностью и удобством использования.
Иммунофлуоресцентный метод, применяемый в прямом и обратном вариантах, является методом ускоренной диагностики.
Биологический метод основан на использовании животных, чувствительных к соответствующему вирусу.
Метод гибридизации ДНК-ДНК, или метод ДНК-зондов – один из наиболее перспективных способов исследования в современной биологии и медицине. Он может быть использован для выявления любых генов, любых фрагментов нуклеиновых кислот. В его основе лежит способность однонитевых молекул нуклеиновых кислот вступать во взаимодействие с комплементарными нитями и образовывать двунитевые гибридные молекулы. Гибридизация осуществляется или в растворах, или, чаще всего, на твердых подложках, таких, например, как нитроцеллюлозная мембрана. Исследуемую клеточную суспензию лизируют для высвобождения нуклеиновых кислот. После этого двухцепочечную ДНК предварительно денатурируют, а образующиеся одноцепочечные молекулы переносят на мембрану, где они ковалентно связываются с ДНК-зондом, который представляет собой меченные изотопом или ферментом денатурированные молекулы нуклеиновой кислоты. Гибридизация происходит лишь в том случае, если между зондом и иммобилизованной на мембране нитью ДНК имеется гомология.
Методы полимеразной цепной реакции (ПЦР) и геномной дактилоскопии описаны на с. 27, метод однопробирочного варианта реакции обратной транскрипции в сочетании с ПЦР – на с. 337.
Особенности противовирусного иммунитета
В основе некоторых существенных различий механизмов защиты организма от вирусов и бактерий лежат особенности биологии этих возбудителей.
В защите организма от вирусов участвуют все системы иммунитета, однако противовирусный иммунитет имеет существенные специфические черты. Они определяются тем, что в первую очередь на проникновение вируса в организм реагируют не системы комплемента и макрофагов, а системы интерферонов и Т-киллерных клеток. Другая особенность формирования иммунитета связана с тем, что вирусы оказывают слабое антигенное воздействие на В-лимфоциты и для их активирования, пролиферации и дифференцировки необходимо участие Т-хелперов и соответственно представление последним процессированного вирусного антигена (пептидных фрагментов) при участии молекул МНС класса II. Поэтому роль макрофагов и других антигенпредставляющих клеток заключается не столько в самом фагоцитозе, сколько в процессировании и представлении антигена.
Еще одна особенность противовирусного иммунитета обусловлена структурной организацией некоторых вирионов. Вирусы могут вызвать заболение лишь в том случае, если проникают в клетку. Для прикрепления к ней они используют клеточные рецепторы, которые клетка использует для собственных физиологических целей. Все идентифицированные вирусспецифические рецепторы – гликопротеиды или сиалогликолипиды. Вирус «узнает» специфические рецепторы и прикрепляется к ним с помощью своих прикрепительных белков VAP (англ. virion attachment proteins). Именно они играют роль своеобразных лоцманов, направляющих движение вируса в клетку. У некоторых вирусов молекулы этих белков-лоцманов расположены в скрытых местах – «щелях», «каньонах», т. е. углублениях на поверхности вириона. Их диаметр (глубина) у вирусов гриппа, полиомиелита, ВИЧ не превышает 2,5 нм. Диаметр же активного центра молекулы антитела составляет 3,5 нм, поэтому антитело не может связаться с белком-лоцманом вируса и блокировать его. В результате вируснейтрализующая активность антител ослабляется. На проникновение вируса раньше всего реагирует система интерферонов, которые подавляют внутриклеточное размножение вирусов. Кроме того, противовирусное действие оказывают находящиеся в сыворотке крови α– и β-ингибиторы. Альфа-ингибитор – термостабильный субстрат, входит в состав α-глобулинов, препятствует адсорбции вирусов на клетке, разрушается нейраминидазой орто– и парамиксовирусов. Бета-ингибитор – термолабильный мукопептид, входит в состав β-глобулинов, подавляет размножение орто– и парамиксовирусов.
Однако интерферонов и ингибиторов оказалось недостаточно для защиты от вирусов, поэтому природа создала против вирусов другой, очень мощный механизм защиты на уровне организма. Он представлен прежде всего Т-цитотоксическими лимфоцитами и другими киллерными клетками. Эти клетки распознают все чужеродные антигены, в том числе и вирусные, предсталяемые им молекулами МНС класса I. Главное биологическое значение Т-киллерных клеток и заключается в обнаружении и уничтожении любых клеток, инфицированных чужеродными антигенами.
Синтез антител связан, в свою очередь, с системой фагоцитов, В– и Т-лимфоцитов и МНС. В-лимфоциты с помощью иммуноглобулиновых рецепторов распознают соответствующий антиген и отвечают на него синтезом рецепторов, необходимых для распознавания сигналов от Т-хелперов. Активированные Т-хелперы синтезируют и секретируют факторы активации, пролиферации и дифференциации В-лимфоцитов. В результате их действия из активированных В-лимфоцитов формируются клоны антителообразующих клеток и клеток памяти (соответственно возникают и клоны клеток памяти Т-лимфоцитов).
Защитная роль антител в противовирусном иммунитете состоит главным образом в том, что они, взаимодействуя с вирусными рецепторами, исключают возможность адсорбции вирусов на мембране клеток и таким образом нейтрализуют их активность, делают невозможным проникновение вируса в клетку. Только таким путем, т. е. исключая возможность проникновения вируса в клетку, антитела обеспечивают формирование приобретенного иммунитета. Приобретенный противовирусный иммунитет при наличии постоянных клонов клеток памяти может сохраняться пожизненно. Помимо способности нейтрализовать вирусы, антитела выполняют большую роль в освобождении организма от вирусов и вирусных антигенов. Связываясь с ними, антитела образуют иммунные комплексы, которые выводят эти антигены из организма. Эффективность антител в формировании приобретенного иммунитета против вирусных инфекций подтверждена многолетней практикой специфической профилактики полиомиелита, кори, желтой лихорадки, других инфекций и полной ликвидацией на Земле натуральной оспы.
Вместе с тем сами по себе вирусы могут стать причиной вторичных иммунодефицитов. Типичным примером такого вирусного иммунодефицита является ВИЧ-инфекция (см. главу 57).
Вирусы – возбудители острых респираторных заболеваний
Возбудителями заболеваний дыхательных путей могут быть различные виды бактерий (в том числе Mycobacterium tuberculosis, Staphylococcus, Streptococcus pneumoniae, Haemophilus, Klebsiella, Coxiella burnetii, Mycoplasma и др.), а также вирусы. Инфекции, вызываемые вирусами, принято называть острыми респираторными заболеваниями (ОРЗ). По частоте они занимают первое место среди всех заболеваний. Каждый человек в течение жизни неоднократно болеет ОРЗ. Причин этому несколько: большое количество вирусов – возбудителей ОРЗ (более 130); отсутствие перекрестного иммунитета между ними; отсутствие против многих из них эффективных вакцин; наипростейший способ заражения (воздушно-капельным путем), обусловливающий быстрое распространение возбудителя, которое при отсутствии иммунитета может стать причиной не только эпидемий, но и пандемий.
Возбудителями ОРЗ являются следующие вирусы:
1. Вирусы гриппа А, В, С (Оrthomyxoviridae).
2. Парамиксовирусы (Paramyxoviridae) – это семейство включает три рода: Рaramyxovirus – вирусы парагриппа человека (ВПГЧ) 1, 2, 3, 4-го типов, болезни Ньюкасл, парагриппа птиц и паротита; Pneumovirus – респираторно-синцитиальный вирус (RS-вирус); Morbillivirus – вирус кори.
3. Респираторные коронавирусы (Coronaviridae).
4. Респираторные реовирусы (Reoviridae).
5. Пикорнавирусы (Picornaviridae). Из этого семейства собственно возбудителями ОРЗ являются риновирусы (Rhinovirus, более 100 серовариантов), а также некоторые сероварианты вирусов Коксаки и ЕСНО (Enterovirus).
Все перечисленные пять семейств относятся к РНК-содержащим вирусам. 6. Респираторные аденовирусы (Adenoviridae), их геном представлен ДНК.
Возникает вопрос: почему столь большое количество разнообразных вирусов может поражать эпителиальные клетки слизистой оболочки дыхательных путей (главным образом верхних) и глаза? Ответ на этот вопрос может быть только один: мембраны этих клеток несут множество разнообразных рецепторов, с которыми взаимодействуют разнообразные рецепторы вирусов. Только после специфической адсорбции на клетке вирус может в нее проникнуть и вызвать заболевание.
По частоте, с которой они вызывают ОРЗ, вирусы можно расположить в следующей последовательности в порядке убывания: риновирусы, коронавирусы, RS-вирус, вирусы парагриппа, аденовирусы, вирус гриппа. Однако по масштабу вызываемых вспышек и по ущербу, который они наносят здоровью человека и экономике, первое место занимают вирусы гриппа. Грипп и гриппоподобные болезни ответственны за 90 % всей инфекционной заболеваемости в мире и в России.
Вирус гриппа А вызвал крупнейшие пандемии в 1889, 1918 («испанка»), 1957, 1968, 1977 гг. Название болезни «грипп» было дано в XVIII в. французским врачом Ф. Бруссе (фр. gripper – схватить). В Италии эта болезнь получила название «инфлюэнца» (итал. influenza di freddo – влияние холода). Грипп вызывают три вируса: А (открыт в 1933 г. В. Смитом, С. Эндрюсом и П. Лейдлоу), В (открыт в 1940 г. Т. Френсисом) и С (открыт в 1947 г. Р. Тэйлором).
Отличаются типы вируса А, В и С по нуклеопротеидным антигенам.
Вирус типа А вызывает грипп у человека, млекопитающих и птиц, а вирусы типов В и С – только у человека.
Наибольшую роль в эпидемиологии гриппа играет вирус типа А, он вызывал все пандемии, что связано с особой изменчивостью его антигенной структуры. Начиная с 1957 г., эпидемии гриппа происходят ежегодно.
Вирион имеет сферическую форму и диаметр 80 – 120 нм, его молекулярная масса 250 МД. Геном вируса представлен однонитевой фрагментированной (8 фрагментов) негативной РНК с общей м. м. 5 МД. Тип симметрии нуклеокапсида спиральный. Вирион имеет суперкапсид (мембрану), содержащий два гликопротеида – гемагглютинин и нейраминидазу, которые выступают над мембраной в виде различных шипов (рис. 85). Гемагглютинин имеет структуру тримера с м. м. 225 кД; м. м. каждого мономера 75 кД. Мономер состоит из меньшей субъединицы с м. м. 25 кД (НА2) и большей – с м. м. 50 кД (НА1).
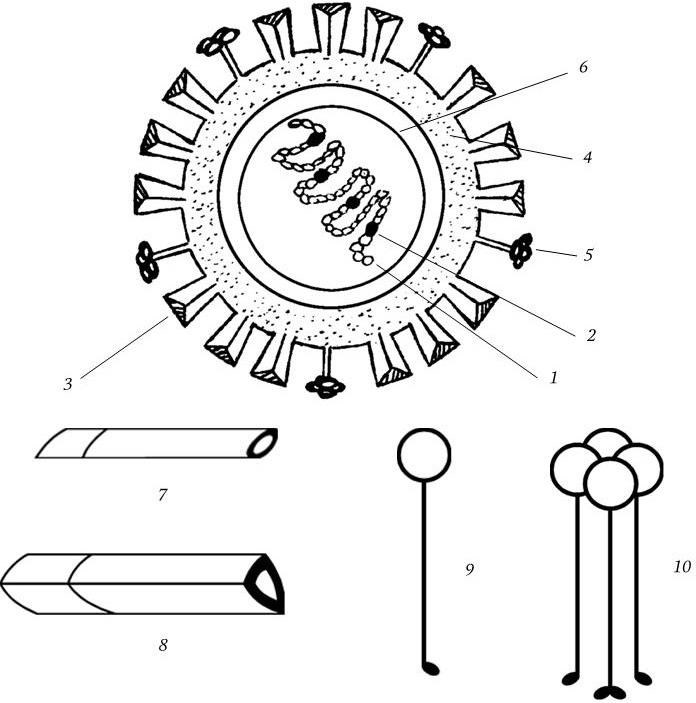
Рис. 85. Схема строения вириона вируса гриппа А:
1 – спираль РНП; 2 – белки РВ1, РВ2, РА; 3 – гемагглютинин; 4 – липидный бислой; 5 – нейраминидаза; 6 – матриксный белок; 7, 8 – мономер и тример гемагглютинина; 9, 10 – мономер и тетрамер нейраминидазы
Основные функции гемагглютинина:
1) распознает клеточный рецептор – мукопептид, имеющий N-ацетилнейраминовую (сиаловую) кислоту;
2) обеспечивает слияние мембраны вириона с мембраной клетки и мембранами ее лизосом, т. е. отвечает за проникновение вириона в клетку;
3) определяет пандемичность вируса (смена гемагглютинина – причина пандемий, его изменчивость – эпидемий гриппа);
4) обладает наибольшими протективными свойствами, отвечая за формирование иммунитета.
У вирусов гриппа А человека, млекопитающих и птиц обнаружено 13 различающихся по антигену типов гемагглютинина, которым присвоена сквозная нумерация (от Н1 до Н13).
Нейраминидаза (N) является тетрамером с м. м. 200 – 250 кД, каждый мономер имеет м. м. 50 – 60 кД. Ее функции: 1) обеспечение диссеминации вирионов путем отщепления нейраминовой кислоты от вновь синтезированных вирионов и мембраны клетки; 2) совместно с гемагглютинином определение пандемических и эпидемических свойств вируса. У вируса гриппа А обнаружено 10 различных вариантов нейраминидазы (N1 – N10).
Нуклеокапсид вириона состоит из 8 фрагментов вРНК и капсидных белков, образующих спиралевидный тяж. На 3'-концах всех 8 фрагментов вРНК имеются одинаковые последовательности из 12 нуклеотидов. 5'-концы каждого фрагмента также имеют одинаковые последовательности из 13 нуклеотидов. 5'– и 3'-концы частично комплементарны друг другу. Это обстоятельство, очевидно, позволяет осуществлять регуляцию транскрипции и репликации фрагментов. Каждый из фрагментов транскрибируется и реплицируется самостоятельно. С каждым из них прочно связаны четыре капсидных белка: нуклеопротеид (NP), он выполняет структурную и регуляторную роль; белок РВ1 – транскриптаза; РВ2 – эндонуклеаза и РА – репликаза. Белки РВ1 и РВ2 обладают основными (щелочными) свойствами, а РА – кислотными. Белки РВ1, РВ2 и РА образуют полимер. Нуклеокапсид окружен матриксным белком (М1-белком), который играет ведущую роль в морфогенезе вириона и защищает вирионную РНК. Белки М2 (кодирует одна из рамок считывания 7-го фрагмента), NS1 и NS2 (кодируются восьмым фрагментом вРНК, который имеет, как и седьмой фрагмент вРНК, две рамки считывания) синтезируются в ходе репродукции вируса, но в его структуру не входят.
Жизненный цикл вируса. Адсорбция вируса на мембране клетки происходит благодаря взаимодействию его гемагглютинина с мукопептидом. Затем вирус проникает в клетку с помощью одного из двух механизмов: 1) слияние мембраны вириона с мембраной клетки или 2) по пути окаймленная ямка – окаймленный пузырек – эндосома – лизосома – слияние мембраны вириона с мембраной лизосомы – выход нуклеокапсида в цитозоль клетки. Второй этап «раздевания» вириона (разрушение матриксного белка) происходит на пути к ядру. Особенность жизненного цикла вируса гриппа заключается в том, что для транскрипции его вРНК необходима затравка. Дело в том, что вирус не может сам синтезировать «шапочку», или кэп (англ. cap) – особый участок на 5'-конце мРНК, состоящий из метилированного гуанина и 10 – 13 прилежащих нуклеотидов, который необходим для распознавания мРНК рибосомой. Поэтому он с помощью своего белка РВ2 откусывает шапочку от клеточной мРНК, а так как синтез мРНК в клетках происходит только в ядре, вирусная РНК должна обязательно проникнуть сначала в ядро. Она проникает в него в виде рибонуклеопротеида, состоящего из 8 фрагментов РНК, связанных с белками NP, PB1, PB2 и PA. Теперь жизнь клетки полностью подчиняется интересам вируса, его репродукции.
Особенность транскрипции. В ядре на вРНК синтезируются три типа вирусспецифических РНК: 1) позитивные комплементарные РНК (мРНК), используемые в качестве матриц для синтеза вирусных белков; они содержат на 5'-конце шапочку, отщепленную от 5'-конца клеточной мРНК, а на 3'-конце – поли-А-последовательность; 2) полноразмерная комплементарная РНК (кРНК), которая служит матрицей для синтеза вирионных РНК (вРНК); на 5'-конце кРНК шапочки нет, на 3'-конце отсутствует поли-А-последовательность; 3) негативная вирионная РНК (вРНК), являющаяся геномом для вновь синтезированных вирионов.
Немедленно, еще до завершения синтеза, вРНК и кРНК вступают в ассоциацию с капсидными белками, которые поступают в ядро из цитозоля. Однако в состав вирионов включаются только рибонуклеопротеиды, связанные с вРНК. Рибонуклеопротеиды, содержащие кРНК, не только не попадают в состав вирионов, но даже не покидают ядро клетки. Вирусные мРНК поступают в цитозоль, где и транслируются. Вновь синтезированные молекулы вРНК после ассоциации с капсидными белками мигрируют из ядра в цитозоль.
Особенности трансляции вирусных белков. Белки NP, PB1, PB2, PA и M синтезируются на свободных полирибосомах. Белки NP, PB1, PB2 и PA после синтеза из цитозоля возвращаются в ядро, где и связываются с вновь синтезированной вРНК, а затем в виде нуклеокапсида возвращаются в цитозоль. Белок матриксный после синтеза движется к внутренней поверхности клеточной мембраны, вытесняя из нее в этом участке клеточные белки. Белки H и N синтезируются на рибосомах, связанных с мембранами эндоплазматического ретикулума, транспортируются по ним, подвергаясь гликозилированию, и устанавливаются на внешней поверхности клеточной мембраны, образуя шипы как раз напротив белка М, расположенного на ее внутренней поверхности. Белок Н подвергается в ходе процессинга разрезанию на НА1 и НА2.
Заключительный этап морфогенеза вириона контролируется М-белком. С ним взаимодействует нуклеокапсид; он, проходя через мембрану клетки, покрывается вначале М-белком, а затем клеточным липидным слоем и суперкапсидными гликопротеидами Н и N. Жизненный цикл вируса занимает 6 – 8 ч и завершается отпочковыванием вновь синтезированных вирионов, которые способны атаковать другие клетки ткани.
Устойчивость вируса во внешней среде невелика. Он легко разрушается при нагревании (при 56 °C в течение 5 – 10 мин), под действием солнечного и УФ-света и легко обезвреживается дезинфицирующими веществами.
Эпидемиология. Источник инфекции – человек, больной или носитель, редко животные (домашние и дикие птицы, свиньи). Заражение от людей происходит воздушно-капельным путем, инкубационный период очень короткий (1 – 2 сут.), поэтому эпидемия распространяется очень быстро и может при отсутствии коллективного иммунитета перерасти в пандемию. Иммунитет – основной регулятор эпидемий гриппа. По мере нарастания коллективного иммунитета эпидемия идет на убыль. Вместе с тем вследствие формирования иммунитета происходит отбор штаммов вируса с измененной антигенной структурой, прежде всего гемагглютинина и нейраминидазы; эти вирусы продолжают вызывать вспышки до тех пор, пока и к ним не появятся антитела. Такой антигенный дрейф и поддерживает непрерываемость эпидемии. Однако у вируса гриппа А обнаружена еще одна форма изменчивости, получившая название шифта, или сдвига. Она связана с полной сменой одного типа гемагглютинина (реже – и нейраминидазы) на другой.
Все пандемии гриппа были вызваны вирусами гриппа А, претерпевшими шифт. Пандемия 1918 г. была вызвана вирусом с фенотипом H1N1 (погибло около 20 млн человек), пандемия 1957 г. – вирусом H2N2 (переболело более половины населения мира), 1968 г. – вирусом H3N2.
Для объяснения причин резкой смены типов вирусов гриппа А предложены две основные гипотезы. Согласно гипотезе А. А. Смородинцева, вирус, исчерпавший свои эпидемические возможности, не исчезает, а продолжает циркулировать в коллективе без заметных вспышек или длительно персистировать в организме человека. Через 10 – 20 лет, когда появится новое поколение людей, не имеющих иммунитета к этому вирусу, он становится причиной новых эпидемий. В пользу этой гипотезы говорит тот факт, что вирус гриппа А с фенотипом H1N1, исчезнувший в 1957 г., когда его вытеснил вирус H2N2, вновь появился после 20-летнего отсутствия в 1977 г.
По другой гипотезе, развиваемой и поддерживаемой многими авторами, новые типы вируса гриппа А возникают вследствие реассоциации геномов между вирусами гриппа человека и птиц, между вирусами гриппа птиц, между вирусами гриппа птиц и млекопитающих (свиньи), чему способствует сегментарная структура вирусного генома (8 фрагментов).
Таким образом, у вируса гриппа А есть два пути изменения генома.
1. Точечные мутации, обусловливающие антигенный дрейф. Им подвержены, прежде всего, гены гемагглютинина и нейраминидазы, особенно у вируса H3N2. Благодаря этому вирус H3N2 за период с 1982 по 1998 г. вызвал 8 эпидемий и сохраняет эпидемическое значение до сих пор.
2. Реассоциация генов между вирусами гриппа человека и вирусами гриппа птиц и свиней. Считается, что именно реассоциация геномов вирусов гриппа А с геномами вируса гриппа птиц и свиней – главная причина возникновения пандемических вариантов этого вируса. Антигенный дрейф позволяет вирусу преодолевать существующий у людей иммунитет. Антигенный шифт создает новую эпидемическую ситуацию: к новому вирусу у большинства людей иммунитета нет, и возникает пандемия гриппа. Возможность такой реассоциации геномов вирусов гриппа А доказана экспериментально.
Установлено, что эпидемии гриппа у людей вызывают вирусы типа А только 3 или 4 фенотипов: H1N1 (H0N1); H2N2; H3N2.
Однако существенную угрозу для человека предсталяет и куриный (птичий) вирус. Вспышки куриного гриппа наблюдались неоднократно, в частности куриный вирус H5N1 вызвал миллионную эпизоотию среди домашних и диких птиц с 80 – 90 %-ной летальностью. От кур заражались и люди; так в 1997 г. от кур заразилось 18 человек, треть из них погибла. Особенно крупная вспышка наблюдалась в январе – марте 2004 г. Она охватила почти все страны Юго-Восточной Азии и один из штатов США и нанесла огромный экономический ущерб. От кур заразилось и погибло 22 человека. Для ликвидации этой вспышки были предприняты самые жесткие и решительные меры: строгий карантин, ликвидация всего поголовья птиц во всех очагах, госпитализация и изоляция больных и всех людей с повышенной температурой, а также лиц, находившихся в контакте с больными, запрет импорта куриного мяса из указанных выше стран, строгий медицинский и ветеринарный надзор за всеми пассажирами и транспортными средствами, прибывающими из этих стран. Широкого распространения гриппа среди людей не произошло потому, что не было реассоциации генома вируса куриного гриппа с геномом вируса гриппа человека. Однако опасность такой реассоциации остается реальной. Всего в течение 2003–2007 гг. в мире переболело 322 человека, из них 195 умерли.
В названии выявляемых штаммов вирусов гриппа указывают серотип вируса (A, B, C), вид хозяина (если им не является человек), место выделения, номер штамма, год его выделения (последние 2 цифры) и фенотип (в круглых скобках).
Например: «A/Сингапур/1/57 (H2N2), A/утка/СССР/695/76 (H3N2)».
Особенности патогенеза и клиники. Инкубационный период при гриппе короткий – 1 – 2 сут. Вирус размножается в эпителиальных клетках слизистой оболочки дыхательных путей с преимущественной локализацией в области трахеи, что клинически проявляется в виде сухого мучительного кашля с болями по ходу трахеи. Продукты распада пораженных клеток попадают в кровь, вызывают сильную интоксикацию и повышение температуры тела до 38 – 39 °C. Повышение проницаемости сосудов, обусловленное повреждением клеток эндотелия, может стать причиной патологических изменений в различных органах: точечных кровоизлияний в трахее, бронхах, а иногда и отека мозга с летальным исходом. Вирус гриппа оказывает угнетающее действие на кроветворение и иммунную систему. Все это может приводить к вторичным вирусным и бактериальным инфекциям, которые осложняют течение болезни.
Постинфекционный иммунитет. Прежние представления о том, что после перенесенного гриппа остается слабый и кратковременный иммунитет, опровергнуты после возвращения вируса H1N1 в 1977 г. Этот вирус вызывал заболевание главным образом у людей не старше 20 лет, т. е. у тех, кто не болел им раньше, до 1957 г. Следовательно, постинфекционный иммунитет достаточно напряженный и продолжительный, но имеет выраженный типоспецифический характер.
Главная роль в формировании приобретенного иммунитета принадлежит вируснейтрализующим антителам, блокирующим гемагглютинин и нейраминидазу, а также секреторным иммуноглобулинам IgAs.
Лабораторная диагностика. Материалом для исследования служит отделяемое носоглотки, которое получают либо путем смыва, либо с помощью ватно-марлевых тампонов, и кровь. Методы диагностики применяют следующие:
1. Вирусологический – заражение куриных эмбрионов, культур клеток почек зеленых мартышек (Vero) и собак (МДСК). Культуры клеток особенно эффективны для выделения вирусов А (H3N2) и В.
2. Серологический – выявление специфических антител и возрастания их титра (в парных сыворотках) с помощью РТГА, РСК, иммуноферментного метода.
3. В качестве ускоренной диагностики используют иммунофлуоресцентный метод, позволяющий быстро обнаружить вирусный антиген в мазках-отпечатках со слизистой оболочки носа или в смывах из носоглотки больных.
4. Для обнаружения и идентификации вируса (вирусных антигенов) предложены методы РНК-зонда и ПЦР.
Лечение. Для лечения, которое следует начинать как можно раньше, и профилактики гриппа и других вирусных ОРЗ применяют дибазол, интерферон и его индукторы амиксин и арбидол по специальным схемам, а для лечения и профилактики гриппа у детей старше 1 года – альгирем (ремантадин) по специальным схемам.
Специфическая профилактика. Ежегодно в мире гриппом болеют сотни миллионов людей, что наносит колоссальный ущерб здоровью населения и экономике каждой страны. Единственным надежным средством борьбы с ним является создание коллективного иммунитета. Для этой цели предложены и используются следующие типы вакцин: 1) живая из аттенуированного вируса; 2) убитая цельновирионная; 3) субвирионная вакцина (из расщепленных вирионов); 4) субъединичная – вакцина, содержащая только гемагглютинин и нейраминидазу.
В нашей стране создана и применяется тривалентная полимер-субъединичная вакцина («гриппол»), в которой стерильный конъюгат поверхностных белков вирусов А и В связан с сополимером полиоксидонием (иммуностимулятор).
Детей от 6 мес. до 12 лет, по рекомендации ВОЗ, следует прививать только субъединичной вакциной как наименее реактогенной и токсичной.
Главная проблема в повышении эффективности противогриппозных вакцин – обеспечение их специфичности против актуального вируса, т. е. того варианта вируса, который вызвал данную эпидемию. Иначе говоря, вакцина должна содержать специфические антигены актуального вируса. Основной путь повышения качества вакцины – использование наиболее консервативных и общих для всех антигенных вариантов вируса А эпитопов, которые обладают максимальной иммуногенностью.
Структура вириона сходна со структурой вируса А. Геном состоит из 8 фрагментов, кодирующих 3 неструктурных и 7 структурных белков. По антигенным свойствам гемагглютинина и нейраминидазы различают несколько серовариантов. Процесс антигенного дрейфа выражен слабее, чем у вируса А. Вирусы гриппа типа В являются виновниками локальных вспышек и эпидемий; пандемий не вызывают. Клиника заболевания такая же, как и при гриппе типа А. Лабораторная диагностика такая же, вирус дифференцируется серологически. О создании тетравакцины, содержащей антиген не только вируса гриппа человека, но и вируса H5N1, см. стр. 6.
Вирион имеет такую же форму, как вирусы типов А и В. Однако он отличается от них не только антигенными свойствами, но и по ряду других признаков. Геном представлен однонитевой негативной РНК из 7 фрагментов, нуклеотидная последовательность которых существенно отличается от таковых вирусов типов А и В. Геном кодирует 1 – 2 неструктурных и 6 структурных белков. У вируса типа С отсутствует нейраминидаза, поэтому на наружной мембране вириона имеется только один тип шипов, имеющих такие же размеры, как и у вирусов типов А и В (высота 8 – 10 нм, диаметр 4 – 5 нм), но расположенных, в отличие от вирусов А и В, не беспорядочно, а с четкой гексагональной ориентацией на расстоянии 7,5 нм друг от друга. Шипы образованы гликозилированным пептидом gp88, который имеет две функции: гемагглютинина и нейраминат-О-ацетил-эстеразы (гликопептид НЕ). Соответственно вирус типа С распознается другим клеточным рецептором – мукопептидом, содержащим N-ацетил-9-О-ацетилнейраминовую кислоту. Это обстоятельство обусловливает отсутствие конкуренции на стадии адсорбции между вирусом типа С и вирусами других типов. Вирус гриппа типа С значительно труднее адаптируется к куриным эмбрионам, чем вирусы типов А и В, причем и на куриных эмбрионах, и в культурах клеток размножается только при пониженной температуре (32 – 33 °C). Вирусу типа С не свойственна такая изменчивость, как вирусу типа А. Хотя вирус гриппа С не вызывает пандемий и больших эпидемий, он часто является причиной спорадических заболеваний гриппом. Клиника заболевания такая же, как при относительно умеренных формах гриппа А. Диагностика основана на выделении вируса в куриных эмбрионах; применяются также иммунофлуоресцентный метод и другие серологические реакции.
Вирусы парагриппа человека (ВПГЧ) впервые выделены в 1956 – 1958 гг. в США из носоглотки у детей, больных гриппоподобными заболеваниями, в связи с чем и получили такое название. Вирионы имеют сферическую форму, их диаметр 150 – 200 нм. Геном представлен однонитевой нефрагментированной негативной РНК с м. м. 5,6 МД и состоит из 6 генов. С вирионной РНК связаны белок NP и полимеразные белки P и L, образующие нуклеокапсид со спиральным типом симметрии. В составе полимеразного комплекса P и L имеется транскриптаза. Нуклеокапсид окружен оболочкой из матриксного белка М, играющего важную роль в морфогенезе вириона. Вирион покрыт суперкапсидом, состоящим из липидного бислоя и гликозилированных белков HN и F (англ. fusion – слияние), которые выступают в виде шипов. Белок HN, обладающий гемагглютинирующей и нейраминидазной активностью, ответствен за связывание вируса клеточными рецепторами. Белок F (F1 и F2), образующийся после протеолитического расщепления его предшественника F0, опосредует три вида активности: гемолиз эритроцитов; слияние вирусной мембраны с мембраной клетки и ее лизосом; слияние клеток, которое обеспечивает возможность вирусу распространяться от клетки к клетке при помощи образующегося синцития, минуя околоклеточную среду. Таким образом, вирусы парагриппа обладают гемагглютинирующей, нейраминидазной, гемолитической и симпластообразующей активностью, однако у разных типов вирусов эти свойства проявляются в разной степени.
Особенностью размножения вирусов парагриппа, как и всех парамиксовирусов, является то, что, в отличие от вирусов гриппа, они не нуждаются для своей транскрипции в затравочной мРНК и поэтому не проникают в ядро клетки. Их жизненный цикл, подобно вирусу леса Семлики, протекает в цитоплазме клетки. ВПГЧ плохо размножаются в куриных эмбрионах. Для их выделения применяют культуры клеток, в основном первично-трипсинизированных, при размножении в которых они легко могут быть обнаружены с помощью реакции гемадсорбции. Парамиксовирусы не имеют общего антигена, единого для всего семейства. ВПГЧ по поверхностным антигенам разделены на четыре сероварианта, но их внутренние белки имеют общие детерминанты. Вирусы парагриппа – очень распространенные возбудители ОРЗ. У взрослых эти заболевания протекают легче, чем грипп. При этом ВПГЧ чаще поражают клетки гортани, поэтому заболевание протекает с явлениями ларингита (сухой болезненный кашель, охрипший голос). У детей заболевания, вызываемые ВПГЧ, протекают более тяжело, у них чаще развивается интоксикация. Наиболее тяжело протекают заболевания, вызываемые ВПГЧ-3, особенно у детей первого года жизни. ВПГЧ-3 являются виновником 60 – 70 % заболеваний нижних отделов дыхательных путей (бронхиолиты, пневмонии) у детей первых полутора лет жизни. Для заболеваний, вызываемых вирусами парагриппа 1-го и 2-го типов, характерен симптом ложного крупа.
Вирусы парагриппа вызывают в основном локальные вспышки, однако они наблюдаются повсеместно, особенно в странах с умеренным климатом.
Для лабораторной диагностики парагриппозных заболеваний применяются следующие методы:
а) обнаружение вирусных антигенов с помощью методов иммунофлуоресценции и ИФМ в эпителиальных клетках слизистой оболочки носовых ходов и носоглотки;
б) выделение вируса в культурах клеток с последующей идентификацией его с помощью реакций торможения гемадсорбции или гемагглютинации;
в) определение противовирусных антител с помощью реакций торможения гемадсорбции (гемагглютинации) или нейтрализации в культуре клеток с использованием парных сывороток (нарастание титра антител).
Методы специфической профилактики не разработаны.
Вирус эпидемического паротита (свинки)
Эпидемический паротит – острое вирусное заболевание, для которого характерно поражение одной или обеих околоушных слюнных желез. Возбудитель был выделен в 1934 г. К. Джонсоном и Р. Гудпасчуром из слюны больного свинкой путем заражения обезьян в проток слюнной железы.
Морфологически вирус сходен с другими парамиксовирусами, обладает гемагглютинирующей, гемолитической, нейраминидазной и симпластообразующей активностью. Геном представлен однонитевой нефрагментированной негативной РНК, м. м. ее 8 МД. В составе вириона 8 белков; суперкапсидные белки HN и F выполняют такие же функции, как и у других парамиксовирусов. Вирус хорошо размножается в амниотической полости 7 – 8-дневных куриных эмбрионов и в культурах клеток, лучше первично-трипсинизированных, с образованием симпластов. Антигенная структура вируса стабильна, никаких серовариантов не описано.
Вирус малоустойчив, разрушается в течение нескольких минут при воздействии жирорастворителей, детергентов, 2 %-ного фенола, 1 %-ного лизола и других дезинфицирующих веществ. Лабораторные животные к вирусу паротита малочувствительны. Лишь у обезьян путем введения им вируса в проток слюнной железы удается воспроизвести сходное с паротитом человека заболевание.
Особенности эпидемиологии. Заболевание встречается повсеместно. Источником инфекции является только больной человек (в том числе с бессимптомной формой болезни). Он заразен в течение всего инкубационного периода и первой недели болезни. Болеют дети 5 – 15 лет (чаще мальчики), однако могут болеть и взрослые.
Особенности патогенеза и клиника. Инкубационный период составляет в среднем 14 – 21 день. Вирус проникает из полости рта по стенонову (околоушному) протоку в околоушную слюнную железу, где и происходит в основном его размножение. Возможно, что первичное размножение вируса происходит в эпителиальных клетках верхних дыхательных путей. Поступая в кровь, вирус может проникнуть в различные органы (яички, яичники, поджелудочную и щитовидную железы, мозг) и вызвать соответствующие осложнения (орхит, менингит, менингоэнцефалит, реже – тиреоидит, полиартрит, нефрит, панкреатит; тяжелые формы орхита могут обусловить последующую половую стерильность). Наиболее типичным проявлением болезни является воспаление и увеличение околоушных и других слюнных желез, сопровождающееся умеренным повышением температуры. Как правило, в неосложненных случаях заболевание заканчивается полным выздоровлением. Очень часто оно протекает бессимптомно.
Постинфекционный иммунитет прочный, длительный, повторных заболеваний почти не бывает. Естественный пассивный иммунитет сохраняется в течение первых шести месяцев жизни ребенка.
Лабораторная диагностика. Применяют вирусологические и серологические методы, используя слюну, мочу, спинномозговую жидкость, пунктат желез. Заражают 7 – 8-дневные куриные эмбрионы или культуры клеток. Вирус идентифицируют с помощью реакций торможения гемагглютинации (гемадсорбции), иммунофлуоресценции, нейтрализации и связывания комплемента. Серологическая диагностика осуществляется на основании нарастания титра антител в парных сыворотках больных с помощью РТГА или РСК.
Специфическая профилактика. По мнению Международной службы по ликвидации заболеваний, эпидемический паротит относится к группе потенциально ликвидируемых болезней. Основным средством для ее ликвидации является создание коллективного иммунитета с помощью живой вакцины, приготовленной из аттенуированного штамма (пассажи на куриных эмбрионах приводят к снижению патогенности вируса для человека). Вакцина вводится подкожно однократно детям на первом году жизни, иммунитет столь же стойкий, как и постинфекционный. К категории потенциально ликвидируемых болезней относятся также краснуха и корь. Поэтому для ликвидации их рекомендуется применение трехвалентной вакцины (против кори, краснухи и паротита).
Респираторно-синцитиальный вирус (RS-вирус)
RS-вирус является одним из наиболее частых возбудителей ОРЗ у детей первых 2 – 3 лет жизни. Впервые был выделен в 1956 г. от шимпанзе, страдавшей ОРЗ, а в 1957 г. Р. Ченок [и др.] выделили сходные штаммы от детей, больных ОРЗ.
Вирион сферической формы, диаметр его варьирует у отдельных частиц от 120 до 200 нм. Геном представлен однонитевой нефрагментированной негативной РНК с м. м. около 5,6 МД; она несет, очевидно, 10 генов, кодирующих 10 вирусспецифических белков, из которых 7 входят в состав вириона, а остальные являются неструктурными. RS-вирус отличается от других парамиксовирусов тем, что у него не обнаружены гемагглютинин и нейраминидаза, и он не обладает гемолитической активностью. Структура генома такова: 3' – 1C – 1B – N – P – M – 1A – G – F – 22K – L – 5'. Белки G и F – гликопротеиды, которые входят в состав суперкапсида и образуют поверхностные шипы. Белок G обеспечивает фиксацию вируса на чувствительных клетках, а белок F обеспечивает слияние двух типов: а) слияние мембраны вируса с мембраной клетки и ее лизосом; б) слияние инфицированной клетки с прилегающими неинфицированными клетками, вследствие чего и образуется синцитий – симпласт из клеток, связанных между собой цитоплазматическими отростками («сетчатая ткань»). Этот феномен и послужил основанием назвать вирус «респираторно-синцитиальным». Белки N, P и L (полимеразный комплекс, содержащий транскриптазу) входят в состав нуклеокапсида. Белки М и К связаны с внутренней поверхностью суперкапсида вириона. Функции остальных белков пока не известны. По антигенным свойствам различают два сероварианта вируса. Вирус хорошо размножается в культурах многих штаммов перевиваемых клеток (HeLa, HЕp-2 и др.) с проявлением характерного цитопатического действия, а также с образованием бляшек; не культивируется на куриных эмбрионах. RS-вирус очень лабилен и легко разрушается при замораживании и оттаивании, при обработке жирорастворителями, детергентами, различными дезинфицирующими веществами; при нагревании до 55 °C погибает за 5 – 10 мин.
Источником инфекции является больной человек. Заражение происходит воздушно-капельным путем. Инкубационный период 3 – 5 дней. Вирус размножается в эпителиальных клетках дыхательных путей, процесс быстро распространяется и на их нижние отделы. Особенно тяжело заболевание протекает у детей первых шести месяцев жизни в виде бронхита, бронхиолита, пневмонии. У 75 % детей трехлетнего возраста обнаруживаются антитела к вирусу.
Постинфекционный иммунитет стойкий и длительный, он обусловлен появлением вируснейтрализующих антител, клеток иммунной памяти и секреторных антител класса IgAs.
Лабораторная диагностика основана на быстром обнаружении вирусных антигенов в отделяемом носоглотки (у погибших исследуют ткани легких, трахеи, бронхов) с помощью иммунофлуоресцентного метода, выделении и идентификации вируса и определении специфических антител. Для выделения вируса исследуемым материалом заражают культуры клеток, о его размножении судят по характерному цитопатическому эффекту; вирус идентифицируют с помощью иммунофлуоресцентного метода, РСК и реакции нейтрализации в культуре клеток.
Серологический метод (РСК, РН) у детей первых шести месяцев жизни, которые имеют материнские антитела в титре до 1: 320, недостаточно надежен. Для диагностики заболевания у них лучше использовать методы обнаружения специфических антигенов с помощью РИФ или ИФМ.
Специфическая профилактика не разработана.
Корь (лат. morbilli) – острое вирусное заболевание преимущественно детского возраста, характеризующееся общей интоксикацией, повышением температуры, катарами слизистых оболочек дыхательных путей и макулопапулезной сыпью.
Возбудитель кори был выделен в 1954 г. Дж. Эндерсом и Т. Пиблесом. Морфологически он сходен с другими парамиксовирусами: диаметр вириона 150 – 250 нм, геном вируса представлен однонитевой нефрагментированной негативной РНК длиной в 15 900 нуклеотидов, включенной в спиральный нуклеокапсид. Геном несет 6 расположенных в следующем порядке генов: N, P, М, F, H, L. Они кодируют белки: нуклеопротеин (N), фосфопротеин (Р), матриксный (М), белок слияния (F), гемагглютинин (Н) и полимеразу (L). Особенностью вирусного генома является наличие в его M – F-межгенном участке большой некодирующей области размером около 1000 нуклеотидов. Подобно другим парамиксовирусам, вирус кори обладает гемаг-
глютинирующей, гемолитической и симпластообразующей активностью, но у него отсутствует нейраминидаза.
Гемагглютинин, гемолизин (F), нуклеопротеид (NP) и матриксный белок различаются по антигенной специфичности и степени иммуногенности. Наибольшей иммуногенностью обладает гемагглютинин. С помощью моноклональных антител обнаружено несколько серовариантов вируса кори человека. Он имеет также общие антигенные детерминанты с вирусами чумы собак и чумы рогатого скота.
Лабораторные животные к вирусу кори маловосприимчивы. Только у обезьян вирус вызывает болезнь с характерными клиническими симптомами, причем в естественных условиях обезьяны могут заражаться от людей.
В куриных эмбрионах вирус кори размножается плохо. Для его выделения используют первично-трипсинизированные культуры клеток почек обезьян или эмбрионов человека, в которых вирус при размножении вызывает характерный цитопатический эффект (образование гигантских многоядерных клеток – симпластов и синцитиев – и зернистых включений в цитоплазме и ядре). Однако вирус кори может быть адаптирован и к клеточным культурам из почки собак, телят или к клеткам амниона человека, а также к различным перевиваемым линиям. Вирус может оказывать мутагенное действие на хромосомы клеток.
Вирус нестоек, быстро инактивируется в кислой среде, снижает свою активность при температуре 37 °C, при 56 °C погибает через 30 мин, легко разрушается жирорастворителями, детергентами, очень чувствителен к солнечному свету и во внешней среде быстро погибает. Устойчив к низкой температуре (–70 °C). Эти обстоятельства следует учитывать при транспортировке и хранении живой противокоревой вакцины.
Особенности эпидемиологии. Источником инфекции является только больной человек. Он становится заразным с последнего дня инкубационного периода и до 4 – 5-го дня после появления сыпи.
Особенности патогенеза и клиники кори. Заражение происходит воздушно-капельным путем. Вирус размножается в эпителиальных клетках слизистой оболочки носоглотки, трахеи и бронхов. Проникая в кровь, вызывает поражение клеток эндотелия сосудов, вследствие чего появляется сыпь. Наиболее характерным симптомом является образование на слизистой оболочке щек пятен Коплика – Филатова. Инкубационный период около 10 дней. Картина болезни настолько характерна, что диагноз легко ставится клинически. В продромальном периоде – явления ОРЗ (ринит, фарингит, конъюнктивит). Дифференциальное диагностическое значение имеет появление пятен Коплика – Филатова. Сыпь папулезного характера появляется обычно на четвертый день после повышения температуры, сначала на голове (лоб, за ушами), а затем распространяется по всему телу. Температура тела нормализуется к 7 – 8-му дню.
Наиболее частое осложнение – пневмония, а в раннем периоде заболевания – отек гортани, круп. Очень редко корь протекает в необычной, тяжелой форме – в виде острого коревого энцефалита, чаще у детей старше 8 – 10-летнего возраста. У детей, получавших с профилактической целью противокоревой иммуноглобулин, болезнь протекает в легкой форме (митигированная корь). Постинфекционный иммунитет прочный, пожизненный, обусловлен вируснейтрализующими антителами, Т-цитотоксическими лимфоцитами и клетками иммунной памяти.
Лабораторная диагностика проводится в случае необходимости. Предложена тест-система для идентификации генома вируса кори на основе однопробирочного варианта реакции обратной транскрипции в сочетании с ПЦР (с использованием модифицированной полимеразы). Для выделения вируса исследуемым материалом (слизь из носоглотки, кровь за сутки до появления сыпи) заражают культуры клеток. Идентифицируют вирус с помощью РИФ, РТГА и РН в культурах клеток. Для мониторинга состояния иммунитета применяют РТГА, ИФМ и РСК.
Специфическая профилактика кори. Единственный радикальный способ борьбы с корью – вакцинопрофилактика. Для этой цели используют высоко эффективные живые вакцины из аттенуированных штаммов кори (в России – из штамма Л-16 и клона М-5). Элиминация кори из региона Европы должна быть достигнута к 2007 г., а к 2010 г. ее элиминация должна быть сертифицирована во всех странах мира. Для этого необходимо достигнуть вакцинации 98 – 100 % вновь родившихся детей в возрасте 9 – 12 мес. Кроме того, необходимо каждые 5 – 7 лет дополнительно ревакцинировать всех детей в возрасте от 9 – 10 мес. до 14 – 16 лет для снижения количества лиц, восприимчивых к кори.
Подострый склерозирующий панэнцефалит
Вирус кори вызывает не только острую продуктивную инфекцию, каковой является корь, но и, очень редко, тяжелую медленную инфекцию – подострый склерозирующий панэнцефалит (ПСПЭ). Он впервые был описан в 1933 г. Дж. Даусоном и представляет собой прогрессирующее заболевание центральной нервной системы у детей и подростков. Больные дети становятся раздражительными, плаксивыми, у них расстраивается речь, нарушается зрение, они перестают узнавать окружающие предметы; у больных быстро снижается интеллект, наступает коматозное состояние и смерть.
Причина этой болезни долгое время оставалась неясной. В 60-х гг. ХХ в. у больных детей обнаружили в огромных титрах (до 1: 16 000) противокоревые антитела, а в мозговых клетках – характерные для кори включения, содержащие нуклеокапсиды, подобные парамиксовирусам. Наконец, из мозговой ткани и лимфатических узлов погибших людей были выделены штаммы, подобные вирусу кори.
Болезнь развивается в тех случаях, когда вирус кори заносится в клетки ЦНС. Размножение вируса в этих клетках нарушается на стадии морфогенеза, по-видимому, из-за отсутствия М-белка (у таких больных антитела к М-антигену не обнаруживаются). В результате в клетках накапливается большое количество дефектных вирионов, лишенных суперкапсида и М-белка. Молекулярные механизмы нарушения синтеза вирусных белков могут быть разными. Один из них связан с существованием градиента уровня транскрипции, который проявляется в том, что гены, удаленные от 3'-конца геномной РНК, транскрибируются в меньшей степени, чем гены, расположенные ближе к нему. Если при острой коревой инфекции уровни транскрипции ближних и дальних от 3'-конца генов различаются не более чем в 5 раз, то при ПСПЭ эти различия достигают 200-кратного уровня. Это ведет к снижению синтеза белков М, F и Н ниже уровня, необходимого для сборки и почкования вириона, т. е. к образованию и накоплению дефектных интерферирующих частиц (ДИЧ). Возможно потому, что в основе патогенеза ПСПЭ лежат нарушения не только иммунных, но и каких-то генетических механизмов.
К семейству Coronaviridae с двумя родами, Coronavirus (включающим также возбудителей гастроэнтерита у детей – см. табл. 20, с. 346) и Torovirus, относятся вирусы округлой формы диаметром 50 – 220 нм. Вирионы имеют суперкапсид, над которым выступают шипы длиной 12 – 24 нм, они состоят из тонкой шейки и массивной головки шаровидной или грушевидной формы и напоминают фигуру солнечной короны, в связи с чем семейство получило название коронавирусов. В сердцевине вириона располагается нуклеокапсид. Из всех РНК-вирусов коронавирусы имеют самый большой геном в виде однонитевой нефрагментированнойпозитивной РНК из 27 000 – 32 000 п. н. Вирион содержит 3 группы белков: белок нуклеокапсида, связанный с РНК; матриксный белок и наделяющие вирус способностью адсорбироваться на рецепторах клетки и проникать в нее гликозилированные белки суперкапсида. Естественными хозяевами коронавирусов являются человек, домашние и дикие животные, у которых они вызывают широкораспространенные заболевания.
Респираторные коронавирусы разделяют на 3 серогруппы. Заражение от больного человека происходит воздушно-капельным путем; заболеваемость спорадическая. Эпидемические вспышки коронавирусных инфекций в виде лихорадки, насморка, бронхита и пневмонии отмечаются преимущественно в холодное время года. До появления SARS эти вспышки чаще всего вызывал коронавирус HCV-209E.
В ноябре 2002 г. в Китае произошла вспышка болезни, получившей название SARS (англ. Severe Acute Respiratory Syndrome), или тяжелый острый респираторный синдром (ТОРС), или атипичная пневмония; она была описана в Гонконге К. Урбани. Болезнь стала быстро распространяться и, по данным ВОЗ, на 19 июня 2003 г. в 32 странах было зарегистрировано 8462 случая SARS (больше всего в Китае (7058)). Погибло 804 человека (летальность около 9,5 %). В России зарегистрирован 1 случай. Благодаря предпринятым по инициативе ВОЗ энергичным профилактическим мерам (обязательная госпитализация, изоляция, карантинизация, широкое использование ватно-марлевых масок и т. д.) эпидемия SARS к июню 2003 г. была ликвидирована, однако позднее было выявлено еще несколько случаев заболевания, и опасность повторения эпидемии не исключена. Возбудитель SARS обнаружен в апреле 2003 г. Им оказался коронавирус, не родственный ни одному из известных штаммов этого вируса. Его геномная РНК состоит из 29 727 – 29 736 п. н. По нуклеотидным последовательностям вирус SARS отличается на 50 – 60 % от трех известных серогрупп коронавирусов.
Природные носители вируса пока точно не установлены. Ими могут быть крысы, другие грызуны, насекомые. В Китае полагают, что главным носителем его является мелкий хищник виверра азиатская, или восточная (Viverra zibetha). Ее разводят в вольерах для продажи, так как мясо высоко ценится гурманами.
Основная биологическая особенность вируса – высокая контагиозность, которая во много раз превышает таковую вирусов возбудителей различных ОРЗ, включая грипп. Причина ее также не ясна.
Инкубационный период 4 – 6, реже 7 – 10 дней.
Клиника SARS. Заболевание начинается с повышения температуры до 38 °C и выше, озноба, сухого кашля, слабости, одышки, а затем быстро развивается тяжелая пневмония, вызывающая нарушение дыхания в силу возникновения отека и воспаления альвеол.
Лабораторная диагностика коронавирусных инфекций, включая SARS, осуществляется путем выделения культур вирусов и их идентификации либо путем определения вирусспецифических антител и нарастания их титра в парных сыворотках с помощью различных серологических реакций или с помощью ДНКи РНК-зондов, ПЦР. В частности, для диагностики SARS с помощью ПЦР уже предложено несколько типов праймеров. Для обнаружения РНК-вируса с помощью ПЦР может быть использован любой биологический материал: кровь, мокрота, моча, фекалии и т. п. Однако все предложенные тест-системы для диагностики SARS нуждаются в дополнительном изучении степени их специфичности.
Для лечения коронавирусных заболеваний, включая SARS, используют противовирусные препараты: рибавирин, интерфероны, специфические иммуноглобулины (плазма крови людей, переболевших SARS); для предупреждения бактериальных осложнений – антибиотики (β-лактамные, фторхинолоны, цефалоспорины, тетрациклины).
Профилактика SARS. Меры общей профилактики такие же, как при чуме. В России ведутся исследования для создания эффективной безвредной вакцины против SARS.
Первые представители семейства аденовирусов были выделены в 1953 г. У. Роу [и др.] из миндалин и аденоидов детей, в связи с чем и получили такое название. Семейство Adenoviridae разделяется на два рода: Mastadenovirus – аденовирусы млекопитающих, он включает аденовирусы человека (41 серовариант), обезьян (24 сероварианта), а также крупного рогатого скота, лошадей, овец, свиней, собак, мышей, земноводных; и Aviadenovirus – аденовирусы птиц (9 серовариантов).
Аденовирусы лишены суперкапсида. Вирион имеет форму икосаэдра – кубический тип симметрии, его диаметр 70 – 90 нм. Капсид состоит из 252 капсомеров диаметром 7 – 9 нм. Группы из 9 капсомеров образуют 20 равносторонних граней (180 капсомеров), а по их углам расположены 12 вершин, состоящих из 6 капсомеров (72 капсомера). Поскольку каждый из 180 капсомеров соседствует с шестью другими, он называется гексоном (рис. 86б). В свою очередь гексон состоит из трех субъединиц с м. м. 120 кД. Каждый из 12 вершинных капсомеров соседствует с пятью, поэтому он называется пентоном. Двенадцать вершинных капсомеров икосаэдра несут нитчатые выступы (фибры) длиной 8 – 30 нм, заканчивающиеся головкой диаметром 4 нм. В сердцевине вириона расположен дезоксирибонуклеопротеид, состоящий из молекулы двунитевой геномной ДНК (20 – 25 МД), с 5'-концами обеих нитей которой ковалентно связан терминальный белок (55 кД), и двух основных белков: VII (18 кД) и V (48 кД). Дезоксирибонуклеопротеид представляет собой структуру из 12 петель, вершины которых направлены к основаниям вершинных капсидов, поэтому сердцевина вириона на срезе имеет форму цветка (рис. 86а). На наружной поверхности располагается белок V. Кроме того, в сердцевине находятся белки VI и X. Геном аденовирусов представлен двунитевой линейной ДНК с м. м. 19 – 24 МД. Нити ДНК фланкированы терминальными инвертированными повторами, позволяющими формировать кольцевые молекулы. С 5'-концами обеих нитей ковалентно связан гидрофобный терминальный белок, который необходим для инициации репликации ДНК. Количество генов в молекуле ДНК точно не установлено. У аденовирусов человека на долю белков приходится 86 – 88 % от массы вириона. Общее число их, вероятно, более 30, а м. м. варьирует от 5 до 120 кД. Белки обозначают римскими цифрами, охарактеризованы из них II – XIII. В настоящее время в геноме аденовирусов выделено четыре области ранней транскрипции Е1, Е2, Е3, Е4 и не менее 5 областей поздней – L1, L2, L3, L4, L5.
Продукты Е1 угнетают транспорт клеточных мРНК в цитоплазму и их трансляцию. Область Е2 кодирует синтез ДНК-связывающего белка, который играет важную роль в репликации вирусной ДНК, экспрессии ранних генов, в контроле сплайсинга и сборке вирионов. Один из поздних белков защищает аденовирусы от действия интерферона. К числу главных продуктов, кодируемых поздними генами, относятся белки, формирующие гексоны, пентоны, сердцевину вириона, и неструктурный белок, который выполняет три функции: а) участвует в образовании гексоновых тримеров; б) осуществляет транспорт этих тримеров в ядро; в) участвует в формировании зрелых вирионов аденовируса. В составе вириона выявлено не менее 7 антигенов. Антиген А (гексон) является группоспецифическим и общим для всех аденовирусов человека. По антигену В (основание пентона) все аденовирусы человека подразделяются на три подгруппы. Антиген С (нити, фибры) является типоспецифическим. По этому антигену все аденовирусы человека делятся на 41 серовариант. Все аденовирусы человека, кроме серовариантов 12, 18 и 31, обладают гемагглютинирующей активностью, которая опосредуется пентоном (вершинным капсомером). Для идентификации серовариантов аденовирусов Л. Розеном в 1960 г. была предложена РТГА.
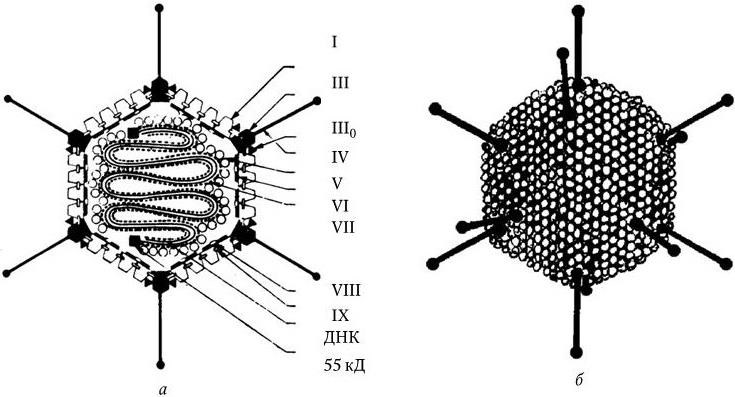
Рис. 86. Аденовирус:
а – схема строения вириона (по А. Г. Букринской, 1986); б – модель аденовируса.
Римскими цифрами обозначены основные белки вириона; в центре – дезоксирибонуклеопротеид, содержащий вирусный геном
Жизненный цикл аденовирусов при продуктивной инфекции складывается из следующих этапов:
1) адсорбция на специфических рецепторах клеточной мембраны с помощью головки фибров;
2) проникновение в клетку с помощью механизма рецепторопосредованного эндоцитоза, сопровождающегося частичным «раздеванием» в цитоплазме;
3) окончательная депротеинизация генома у ядерной мембраны и проникновение его в ядро;
4) синтез ранних мРНК с помощью клеточной РНК-полимеразы;
5) синтез ранних вирусспецифических белков;
6) репликация геномной вирусной ДНК;
7) синтез поздних мРНК;
8) синтез поздних вирусных белков;
9) морфогенез вирионов и выход их из клетки.
Процессы транскрипции и репликации происходят в ядре, процесс трансляции – в цитоплазме, откуда белки транспортируются в ядро. Морфогенез вирионов также происходит в ядре и носит многоступенчатый характер: вначале полипептиды собираются в мультимерные структуры – фибры и гексоны, затем формируются капсиды, незрелые вирионы и, наконец, зрелые вирионы. В ядрах инфицированных клеток вирионы нередко образуют кристаллические скопления. На поздних стадиях инфекции в ядрах накапливаются не только зрелые вирионы, но и незрелые капсиды (без ДНК). Выход вновь синтезированных вирионов сопровождается разрушением клеток. Из клетки, в которой синтезируется до миллиона новых вирионов, выходят далеко не все они. Остающиеся вирионы нарушают функции ядра и вызывают дегенерацию клеток.
Помимо продуктивной формы инфекции, аденовирусы могут вызывать абортивную инфекцию, при которой репродукция вируса резко нарушена на ранней или более поздней ее стадии. Кроме того, некоторые сероварианты аденовирусов человека способны индуцировать злокачественные опухоли при инокуляции различным грызунам. По своим онкогенным свойствам аденовирусы разделяют на высокоонкогенные, слабоонкогенные и неонкогенные. Онкогенные способности находятся в обратной зависимости от содержания Г – Ц пар в ДНК аденовирусов. Основным событием, которое приводит к трансформации клеток (в том числе в их культурах), является интеграция вирусной ДНК в хромосому клетки-хозяина. Молекулярные механизмы онкогенного действия аденовирусов остаются неясными.
Онкогенными свойствами в отношении человека аденовирусы не обладают.
Аденовирусы не размножаются в куриных эмбрионах, но хорошо размножаются в первично-трипсинизированных и перевиваемых культурах клеток различного происхождения, вызывая характерный цитопатический эффект (округление клеток и образование из них гроздевидных скоплений, мелкоточечная дегенерация).
По сравнению с другими вирусами человека аденовирусы несколько более устойчивы во внешней среде, не разрушаются жирорастворителями (нет липидов), не погибают при температуре 50 °C и при рН 5,0 – 9,0; хорошо сохраняются в замороженном состоянии.
Особенности эпидемиологии. Источник инфекции – только больной человек, в том числе со скрытой ее формой. Заражение происходит воздушно-капельным, контактно-бытовым путем, через воду в плавательных бассейнах и фекально-оральным путем. В кишечник вирус может проникать и через кровь. Заболевания верхних дыхательных путей и глаз вызывают сероварианты 1 – 8, 11, 19, 21. Сероварианты 1, 2, 3, 12, 18, 31, 40 и 41 вызывают гастроэнтериты у детей от 6 мес. до 2 лет, мезентеральный аденит. Сероварианты 1, 2, 5, 6 часто обнаруживаются при латентных формах инфекции.
Нет данных о способности аденовирусов животных вызывать заболевания у людей, и, наоборот, аденовирусов человека – у животных. Аденовирусы вызывают спорадические заболевания и локальные эпидемические вспышки. Самая крупная вспышка в нашей стране охватила 6000 человек.
Особенности патогенеза и клиники. Инкубационный период 6 – 9 дней. Вирус размножается в эпителиальных клетках верхних дыхательных путей, слизистой оболочки глаз. Может проникать в легкие, поражать бронхи и альвеолы, вызывать тяжелую пневмонию; характерное биологическое свойство аденовирусов – тропизм к лимфоидной ткани.
Аденовирусные заболевания можно характеризовать как лихорадочные с катаральным воспалением слизистой оболочки дыхательных путей и глаз, сопровождающиеся увеличением подслизистой лимфоидной ткани и регионарных лимфатических узлов. Чаще всего они протекают в виде тонзиллита, фарингита, бронхита, атипичной пневмонии, гриппоподобного заболевания, в форме фаринго-конъюнктивальной лихорадки. Конъюнктивит в одних случаях сопровождает аденовирусное заболевание, в других – основной симптом его.
Таким образом, для аденовирусных заболеваний характерно преобладание респираторного, конъюнктивального или кишечного синдрома. Вместе с тем вирус способен вызывать латентную (бессимптомную) или хроническую инфекцию с длительным персистированием в тканях миндалин и аденоидов.
Постинфекционный иммунитет длительный, стойкий, но типоспецифический, перекрестного иммунитета нет. Иммунитет обусловлен вируснейтрализующими антителами и клетками иммунной памяти.
Лабораторная диагностика. 1. Выявление вирусных антигенов в пораженных клетках с помощью методов иммунофлуоресценции или ИФМ. 2. Выделение вируса. Материалом для исследования служат отделяемое носоглотки и конъюнктивы, кровь, испражнения (вирус удается выделить не только в начале болезни, но и на 7 – 14-й ее день). Для изоляции вируса используют первично-трипсинизированные культуры клеток (в том числе диплоидные) эмбриона человека, которые чувствительны ко всем серовариантам аденовирусов. Вирусы обнаруживают по их цитопатическому эффекту и с помощью РСК, так как все они обладают общим комплементсвязывающим антигеном. Идентификацию производят по типоспецифическим антигенам с помощью РТГА и РН в культуре клеток. 3. Выявление нарастания титра антител в парных сыворотках больного с помощью РСК. Определение нарастания титра типоспецифических антител осуществляют с эталонными сероштаммами аденовирусов в РТГА или РН в культуре клеток.
Специфическая профилактика. Против некоторых серовариантов аденовирусов получены живые иммуногенные пероральные вакцины, но они широкого применения не получили.
Вирус краснухи является единственным представителем рода Rubivirus, относящегося к семейству тогавирусов.
Краснуха (коревая краснуха) – острое инфекционное заболевание, характеризующееся пятнистыми высыпаниями на коже, катаральным воспалением верхних дыхательных путей и конъюнктивы, увеличением шейных лимфатических узлов и признаками незначительной общей интоксикации.
Вирус краснухи является типичным представителем семейства тогавирусов и по основным характеристикам похож на альфа-вирусы (см. главу 54). Вирион сферической формы, диаметр около 60 нм, геном представлен позитивной нефрагментированной однонитевой молекулой РНК с молекулярной массой 3 МД. Вирус имеет суперкапсид, на поверхности которого присутствуют шипы гликопротеидной природы длиной 6 – 10 нм. Имеются две разновидности гликопротеидов: Е1 – обладает гемагглютинирующими свойствами в отношении птичьих эритроцитов, и Е2 – выполняет функцию рецептора при взаимодействии с клеткой. Оба гликопротеида являются протективными антигенами. Существует только один серовар вируса.
Вирус сравнительно нестоек во внешней среде, легко инактивируется жирорастворителями, детергентами, при рН ниже 5,0, при температуре выше 56 °C. Хорошо сохраняется при замораживании, особенно при –70 °C.
Вирус краснухи хорошо размножается и вызывает цитопатические изменения в культурах клеток амниона человека, почек кролика и почек обезьян Vero. В пораженных клетках наступает дегенерация, появляются гигантские многоядерные клетки. В других клеточных культурах вирус может размножаться без видимых изменений, но индуцирует развитие интерференции, защищающей от цитопатического действия других вирусов. Именно на этом основан стандартный метод выделения вируса краснухи, заключающийся в заражении исследуемым материалом клеток почки зеленой мартышки и внесении в культуру через 7 – 10 дней вируса ЕСНО типа II или вируса везикулярного стоматита. Если развиваются цитопатические изменения, вызванные вирусом ЕСНО, следовательно, материал не содержит вируса краснухи, и, наоборот, отсутствие цитопатического действия вируса ЕСНО свидетельствует о присутствии вируса краснухи в исследуемом материале.
Вирус краснухи патогенен для человека, обезьян макак и кроликов. Другие животные к вирусу нечувствительны.
Эпидемиология. Краснуха является типичной антропонозной воздушно-капельной инфекцией, высококонтагиозной для лиц, не имеющих иммунитета. Пик заболеваемости краснухой обычно приходится на весну. В ХХ в. эпидемии наблюдались каждые 6 – 9 лет, и после каждой эпидемии в последующие 5 лет заболеваемость снижалась, а затем опять возрастала до эпидемического уровня через 6 – 9 лет после последней крупной вспышки. При краснухе вирус выделяется из слизи носоглотки и верхних дыхательных путей за 1 – 2 нед. до появления сыпи и в течение 2 – 3 нед. после начала высыпания. У внутриутробно зараженных детей вирус может выделяться с мочой и испражнениями в течение 1 – 1,5 лет.
Патогенез и клиника. Попавший в организм человека воздушно-капельным путем вирус сначала размножается в шейных лимфатических узлах. Через неделю развивается вирусемия, и еще через неделю появляется сыпь, начинающаяся с лица и переходящая на туловище и конечности. В этот период возможны лихорадка, увеличение других регионарных лимфатических узлов, боли в суставах (особенно у взрослых). Сыпь обычно держится 2 – 3 дня.
Если у детей краснуха обычно протекает доброкачественно, в виде легкого заболевания, то у взрослых течение болезни довольно тяжелое, иногда развиваются артриты, энцефалиты и тромбоцитопения. Особенно опасна краснуха для женщин детородного возраста, так как она может стать причиной синдрома врожденной краснухи (СВК), обусловленного способностью вируса проникать через плаценту в период вирусемии и оказывать на растущий плод тератогенное действие. Это связано с цитопатическим действием вируса как на делящиеся клетки плода, так и на клетки сосудов плаценты. Следствием этого могут быть пороки сердца, глухота, врожденные заболевания органов зрения, микроцефалия, спонтанный аборт, мертворождение и др.
Иммунитет. Вируснейтрализующие антитела (IgM) появляются в крови в период проявления сыпи, максимума их титр достигает через 2 – 3 нед., а через 2 – 3 мес. они исчезают. IgG появляются после исчезновения сыпи и сохраняются длительно.
Иммунитет после перенесенной в детстве краснухи пожизненный.
Лабораторная диагностика. Диагностика краснухи может проводиться вирусологическим и серологическим методами. Материал для выделения вируса – отделяемое носоглотки (при наличии катаральных явлений) и кровь до появления сыпи;
кровь, моча, испражнения – после появления сыпи. Материалом заражают культуры клеток, идентифицируют вирус в РТГА, а также по тесту интерференции. При врожденной краснухе используют в качестве материала для исследования мочу и испражнения детей.
При серологической диагностике определяют антитела класса IgМ с помощью РИФ, ИФМ, РИМ. Используют парные сыворотки, определяют нарастание титра антител.
Специфическая профилактика и лечение. Основное в профилактике краснухи – карантинные мероприятия в детских коллективах. Целесообразна выборочная иммунизация девочек 12 – 14 лет, девушек и женщин детородного возраста. Для этих целей используют живые и убитые вакцины, полученные из аттенуированных штаммов вируса, пассируемых при низкой температуре в культуре клеток почек зеленых мартышек и диплоидных клеток легких эмбриона человека. Существуют ассоциированные препараты в комбинации с вакцинами против кори и эпидемического паротита. ВОЗ поставлена задача снижения частоты синдрома врожденной краснухи к 2010 г. на уровень ниже 1 на 100 000 родов живым ребенком. Как уже было указано, для массовой вакцинации против кори, паротита и краснухи применяется живая трехвалентная вакцина.
Методов специфического лечения не существует.
Вирусы – возбудители острых кишечных инфекций
Острые кишечные заболевания (ОКЗ) по частоте, по-видимому, занимают второе место после острых респираторных заболеваний. По данным диарейного центра (Бангладеш), ежегодно в 80-х гг. ХХ в. ОКЗ болело около 3 млрд человек и умирало от них не менее 5 – 18 млн человек. По данным ВОЗ (1992), ежегодно регистрируется от 68,4 до 275 млн диарейных заболеваний детей и взрослых. Причин повсеместного распространения ОКЗ много, но можно выделить по крайней мере три главные из них:
1. Низкий уровень жизни населения, плохие санитарно-гигиенические условия (недостаточное водоснабжение, отсутствие канализации, плохая очистка населенных мест и т. п.) значительной части населения развивающихся стран. ВОЗ установлен основной закон здравоохранения: чем выше национальный доход на душу населения страны, тем больше средняя продолжительность жизни человека и, наоборот, тем ниже заболеваемость вообще и ОКЗ в частности.
2. Отсутствие эффективных вакцин против многих кишечных заболеваний.
3. Наличие большого количества разнообразных возбудителей ОКЗ. К ним относятся различные виды бактерий (шигеллы, сальмонеллы, вибрионы, диареегенные кишечные палочки и т. п.). Однако бEольшая часть ОКЗ (около 60 %) вызывается вирусами.
Во второй половине XX в. были обнаружены неизвестные ранее вирусы (ротавирусы, астровирусы, калицивирусы и вирусы Норволк) и установлена их этиологическая роль при ОКЗ. Большинство случаев небактериальных диарей в различных регионах мира (60 – 70 %) вызывают ротавирусы и калицивирусы, остальные приходятся на долю других вирусов. Известно более 200 потенциальных возбудителей инфекционных заболеваний желудочно-кишечного тракта человека из 11 семейств: Picornaviridae, Togaviridae, Caliciviridae, Reoviridae, Hepadnaviridae, Flaviviridae, Coronaviridae, Adenoviridae, Paramyxoviridae, Orthomyxoviridae, Parvoviridae (табл. 20). Кроме того, один из возбудителей гепатита является дефектным вирусом (HDV), структура его РНК-генома сходна со структурой вироида. Большой ущерб здоровью населения во всем мире наносят также вирусы, вызывающие гепатиты.
В истории изучения этих групп вирусов решающую роль сыграли следующие открытия: 1) 1909 г. – вирус полиомиелита; 2) 1948 г. – вирусы Коксаки; 3) 1951 г. – вирусы ЕСНО; 4) начиная с 1964 г. – возбудители вирусных гепатитов A, B, C, D, E, G (GB-C) и TT; 5) 1968 г. – калицивирусы (Норволк); 6) 1973 г. – ротавирусы.
Таблица 20
Вирусные инфекции желудочно-кишечного тракта (из обзора Д. К. Львова. Вопросы вирусологии. 1997, 6)
Основные признаки энтеровирусов, по которым они объединяются в один род, следующие.
Вирусологические:
1) размер 22 – 30 нм;
2) геном – однонитевая нефрагментированная позитивная РНК;
3) отсутствие суперкапсида;
4) тип симметрии – кубический, количество капсомеров – 60;
5) устойчивость к эфиру (нет липидов);
6) повышение термостабильности в присутствии ионов Mg++ или Ca++;
7) устойчивость к желчи, а также к кислотам и щелочам (в диапазоне рН от 3,0 до 10,0);
8) способность размножаться в определенных культурах клеток;
9) устойчивость во внешней среде.
Эпидемиологические особенности вызываемых вирусами болезней:
1) выраженная сезонность заболеваний (лето – осень);
2) фекально-оральный путь распространения;
3) выделение вируса из кишечника, носоглотки, ликвора и крови;
4) обнаружение вирусов в сточных водах;
5) преимущественное поражение детей в возрасте до 12 лет;
6) широкое носительство среди здоровых людей.
Типичным представителем рода Enterovirus является вирус полиомиелита – Poliovirus.
Геном вируса полиомиелита представлен однонитевой нефрагментированной РНК, состоящей из 7,5 – 8 тыс. нуклеотидов, ее молекулярная масса составляет 2,5 МД. Организация вирионной РНК имеет следующие особенности, определяющие характер ее поведения в клетке:
1) на долю кодирующих последовательностей приходится около 90 % всей длины;
2) между 5'-концом и началом рамки считывания находится так называемая 5'-нетранслируемая область, на долю которой приходится около 10 % длины РНК;
в этой области располагается от 6 до 12 АУГ-инициаторных кодонов;
3) геномная РНК полиовируса на 5'-конце не содержит шапочки (кэпа), вместо нее с 5'-концом РНК ковалентно связан небольшой вирусспецифический гликопротеид, который перед трансляцией отщепляется клеточным ферментом;
4) под влиянием вирионной РНК в клетке подавляется синтез белковых факторов, необходимых для инициации кэпзависимой трансляции, в результате чего кэпнезависимая трансляция вирусных белков происходит очень активно;
5) в 5'-нетранслируемой области РНК полиовируса содержится особый регуляторный элемент, который обеспечивает ее кэпнезависимую трансляцию. Установлена зависимость между нейровирулентностью вируса и степенью активности этого регуляторного элемента, который определяет интенсивность синтеза вирусных белков, особенно в нервных клетках.
Масса вириона составляет 8 – 9 МД. Вирус имеет сферическую форму. Тип симметрии – кубический. Капсид вириона образован четырьмя белками по 60 копий каждого. Три из них – VP1, VP2, VP3 – образуют внешнюю поверхность капсида, а VP4 – внутреннюю, поэтому он снаружи не виден.
Оболочка вириона формируется из 12 компактных структур, называемых пентамерами, так как они содержат по 5 молекул каждого белка. Пентамеры устроены наподобие горы, вершину которой занимает VP1, а ее основание образует VP4; белки VP2 и VP3 вперемежку окружают подножие. Геном вириона очень плотно заключен в его центральной полости. Белки оболочки играют роль в распознавании рецептора клетки-хозяина, в прикреплении вириона к ней и в высвобождении вирионной РНК внутри клетки. Гемагглютинирующими свойствами вирион не обладает. Способность вируса полиомиелита вызывать паралич также, по-видимому, связана с одним из белков оболочки. Они же – белки – определяют иммуногенные свойства вируса. По антигенным признакам вирусы полиомиелита подразделяются на три типа: I, II, III.
Наибольшей патогенностью для человека обладает полиовирус I типа: все значительные эпидемии полиомиелита были вызваны этим типом. Полиовирус III типа вызывает эпидемии реже. Полиовирусы II типа чаще вызывают латентную форму инфекции.
Внутриклеточное размножение вируса. Взаимодействие вируса с клеткой складывается из следующих стадий:
1) адсорбция вируса;
2) проникновение в клетку, сопровождающееся разрушением капсида и выделением геномной РНК.
Являясь позитивной, вРНК непосредственно транслируется в вирусспецифические белки. Одним из таких белков – неструктурным – является РНК-репликаза, при участии которой происходит репликация вРНК по схеме:
Структурные белки, все четыре, синтезируются в виде исходной единой полипептидной цепи, которая затем подвергается каскадному протеолизу и расщепляется в конечном счете на четыре белка VP1 – VP4. Это разрезание, по-видимому, катализируется самим вирусным белком, оно необходимо для формирования вновь образующихся вирионов. Вновь синтезированная вРНК включается в капсид, и формирование вириона на этом заканчивается. Вновь синтезированные вирионы выходят из клетки. Из одного вириона в клетке синтезируется до 150 000 вирионов.
Слово полиомиелит (poliomyelitis) в переводе на русский язык означает воспаление серого вещества мозга (греч. polios – серый, myelitis – воспаление спинного мозга). Дело в том, что важнейшим биологическим свойством полиовирусов является их тропизм к нервной ткани, они поражают двигательные клетки серого вещества спинного мозга.
Эпидемиология. Источником инфекции является только человек. Хотя вирус размножается в эпителиальных и лимфоидных тканях верхних дыхательных путей, воздушно-капельный способ заражения существенной роли не играет из-за отсутствия катаральных явлений. Основной способ заражения – фекально-оральный. Вирус выделяется с испражнениями в огромном количестве с конца инкубационного периода (последние 3 – 7 дней) до 40-го дня болезни, а в ряде случаев – несколько месяцев.
Патогенез и клиника полиомиелита. Входными воротами при полиомиелите является слизистая оболочка глотки, желудка и кишечника. В них происходит первичное размножение вируса, и поэтому через несколько дней после заражения его можно обнаружить в глоточной слизи и испражнениях. После размножения в эпителиальных клетках вирус проникает в регионарные лимфатические узлы, а затем в кровь. Иначе говоря, вслед за алиментарной стадией болезни наступает вирусемия с гематогенной диссеминацией возбудителя. Эти две стадии, как правило, протекают бессимптомно. Лишь иногда вирусемия сопровождается кратковременным повышением температуры и легким недомоганием, это характеризует так называемую «малую» болезнь, она заканчивается выздоровлением и формированием постинфекционного иммунитета. Однако полиовирусы могут преодолевать гематоэнцефа-
лический барьер и проникать в центральную нервную систему, в результате чего развивается «большая» болезнь. Вызываемая вирусом гибель двигательных нейронов передних рогов спинного мозга приводит к развитию параличей скелетных мышц, вследствие чего больной либо умирает, либо остается инвалидом на всю жизнь.
Различают четыре основные клинические формы полиомиелита: 1) абортивная (малая болезнь); 2) непаралитическая (менингеальная), проявляющаяся серозным менингитом; 3) паралитическая и 4) инаппарантная (скрытая).
Паралитическую форму в зависимости от локализации очага разделяют на спинальную, бульбарную, понтинную (варолиев мост) и другие, более редкие формы.
Форма течения полиомиелита определяется величиной инфицирующей дозы, степенью нейровирулентности вируса и иммунным статусом организма. Очаги поражения обнаруживаются в передних рогах спинного мозга, чаще всего в области поясничного расширения, в двигательных клетках ретикулярной формации продолговатого мозга и варолиева моста, мозжечке, в моторной и премоторной областях коры головного мозга.
Иммунитет. После перенесенного заболевания (в том числе и в скрытой форме) остается прочный пожизненный иммунитет, обусловленный вируснейтрализующими антителами и клетками иммунной памяти.
Лечение острого полиомиелита должно быть комплексным и проводиться с учетом стадии и формы болезни. При паралитических формах особенно важно соблюдать ранний ортопедический режим. Основное значение в лечении полиомиелита принадлежит правильно и длительно проводимой гимнастике. Больные с дыхательными нарушениями должны находиться под особым наблюдением специально обученного персонала. Специфическая терапия отсутствует.
Специфическая профилактика. Полиомиелит к середине ХХ в. превратился в грозную эпидемическую болезнь, периодически поражавшую тысячи и десятки тысяч человек, из которых около 10 % умирало, а у 40 % оставались пожизненные параличи. Единственным надежным оружием против этой болезни могли быть только вакцина и создание с ее помощью коллективного иммунитета. Для этого необходимо было разработать методы, которые бы позволяли накапливать вирус в необходимом количестве. И упорные усилия ученых дали, наконец, свои плоды. В конце 1940-х – начале 1950-х гг. были разработаны методы получения однослойных культур клеток (вначале первично-трипсинизированных, затем перевиваемых), которые были широко использованы для выращивания вирусов, а стало быть, возникли реальные условия для создания вакцины против полиомиелита. Следует отметить, что разработка методов получения культур клеток имела огромное значение для развития вирусологии.
В 50-х гг. ХХ в. были созданы две вакцины против полиомиелита:
1. Инактивированная формалином вакцина Дж. Солка.
2. Живая вакцина А. Себина из аттенуированных им штаммов полиовирусов I, II и III типов.
Крупномасштабное производство живой вакцины впервые было освоено в 1950-х г. в нашей стране. Сразу же (с 1959 г.) была начата массовая вакцинация детей против полиомиелита этой вакциной. Обе вакцины – убитая и живая – являются достаточно эффективными, однако в нашей стране отдается предпочтение живой вакцине, так как вакцинные штаммы, размножаясь в эпителиальных клетках кишечного тракта, выделяются во внешнюю среду и, циркулируя в коллективах, вытесняют дикие штаммы полиовирусов. По рекомендации ВОЗ, прививки против полиомиелита являются обязательными и проводятся начиная с 3-месячного возраста и до 16 лет. Поскольку живая вакцина, хотя и крайне редко, вызывает осложнения, прививки теперь рекомендуется проводить инактивированной вакциной Солка. С помощью имеющихся вакцин заболеваемость полиомиелитом во всех странах мира может и должна быть сведена до единичных случаев, т. е. появилась возможность резко снизить ее.
В 1948 г. Г. Долдорф и Г. Сиклс выделили из содержимого кишечника больных полиомиелитоподобным заболеванием детей вирус, близкий к полиовирусам, но отличающийся от них не только по антигенным свойствам, но и по вирулентности для новорожденных мышей (полиовирусы I и III типов патогенны только для обезьян, полиовирус II типа удается адаптировать к хлопковым крысам). Указанный вирус был выделен в местечке Коксаки (штат Нью-Йорк), поэтому Г. Долдорф предложил временно назвать этот и сходные с ним вирусы вирусами группы Коксаки. Это название сохранилось до наших дней.
Как оказалось, вирусы группы Коксаки широко распространены в природе, представлены множеством вариантов. По вирусологическим и эпидемиологическим свойствам они во многом подобны полиовирусам и играют значительную роль в патологии человека. Следует отметить, что вирусы Коксаки являются наиболее кардиотропными из всех энтеровирусов. У 20 – 40 % больных в возрасте до 20 лет Коксаки-инфекция осложняется миокардитом. Вирусы Коксаки представлены двумя группами: группа Коксаки А включает 23 сероварианта (А1 – А22, 24); группа Коксаки В включает 6 серовариантов (В1 – В6).
Вирусы Коксаки группы А вызывают у новорожденных мышей вялый паралич, обусловленный поражением скелетной мускулатуры. В отличие от них, вирусы Коксаки В вызывают у новорожденных мышей поражение центральной нервной системы, а изменения в мышцах выражены слабо. Характерным для инфекции является некроз бурого межлопаточного жира. Кроме того, некоторые серовары Коксаки А (20, 21, 24) и все серовары Коксаки В обладают, в отличие от полиовирусов, гемагглютинирующими свойствами.
Считали также, что вирусы Коксаки А, в отличие от вирусов Коксаки В, не размножаются в культурах клеток человека. Но оказалось, что целый ряд сероваров Коксаки А, как и Коксаки В и полиовирусы, способен размножаться в культурах клеток человека. Вирусы Коксаки А и В могут вызывать у человека помимо полиомиелитоподобных заболеваний, иногда сопровождающихся параличами, и различные другие заболевания со своеобразной клиникой: асептический менингит, эпидемическая миалгия (Борнхольмская болезнь), герпангина, малая болезнь, гастроэнтериты, острые респираторные заболевания, миокардиты (кардиотропность больше выражена у вирусов Коксаки).
Наряду с вирусами краснухи и паротита вирусы Коксаки В, вызывая панкреатит, могут играть существенную роль в этиологии диабета. Возможна также внутриутробная передача вирусов Коксаки от матери с персистентной формой Коксакиинфекции плоду – врожденная хроническая форма Коксаки-инфекции, нередко на фоне врожденного иммунодефицита.
В 1951 г. были обнаружены другие вирусы, сходные с полиовирусами и вирусами Коксаки, но отличающиеся отсутствием патогенности для обезьян и новорожденных мышей. В связи с тем что впервые обнаруженные вирусы этой группы были выделены из кишечника человека и обладали цитопатическим действием, но не были связаны ни с какими заболеваниями, их назвали вирусами-сиротками или сокращенно вирусами ЕСНО, что означает: E – enteric; C – cytopathogenic; H – human; O – orphan – сиротка.
В настоящее время группа ECHO насчитывает 32 сероварианта. Значительная часть из них обладает гемагглютинирующими свойствами, и все они хорошо размножаются в культуре клеток обезьян. Некоторые серотипы вирусов ECHO (11, 18, 19) относятся к числу наиболее частых возбудителей кишечных диспепсий человека. Источником Коксаки– и ECHO-инфекций является человек. Заражение вирусами происходит фекально-оральным путем.
Патогенез заболеваний, вызываемых вирусами Коксаки и ЕСНО, сходен с патогенезом полиомиелита. Входными воротами являются слизистая оболочка носа, глотки, тонкого кишечника, в эпителиальных клетках которых, а также в лимфоидной ткани и происходит размножение этих вирусов.
Сродство к лимфоидной ткани – одна из характерных особенностей этих вирусов. После размножения вирусы проникают в лимфу, а затем в кровь, обусловливая вирусемию и генерализацию инфекции. Дальнейшее развитие болезни зависит от свойств вируса, его тканевого тропизма, а также иммунологического статуса организма. Попадая в ток крови, вирусы гематогенно распространяются по всему организму, избирательно оседая в тех органах и тканях, к которым они обладают тропизмом. Развитие полиомиелитоподобного заболевания или серозного менингита происходит лишь в тех случаях, когда вирус проникает через гематоэнцефалический барьер в центральную нервную систему. Однако это происходит далеко не во всех случаях. Нейротропные свойства особенно выражены у вирусов Коксаки А 7, 14, 4, 9, 10 и у вирусов Коксаки В 1 – 5.
В случае возникновения острого серозного менингита у больного могут наблюдаться симптомы не только этой болезни, но и связанные с поражением других органов и систем организма, которыми часто ограничивается данная энтеровирусная инфекция. Поэтому сочетание различных форм энтеровирусных заболеваний у одного и того же больного наблюдается нередко.
В связи с тем что между полиовирусами, вирусами Коксаки и ЕСНО существует большое сходство, они были объединены в один род Enterovirus, и в 1962 г. было предложено обозначать их видовым названием и определенным порядковым номером.
Позднее были выделены еще четыре энтеровируса – 68 – 71. Серотип 70 вызвал вспышку новой болезни – острый геморрагический конъюнктивит. Энтеровирус 71 вызвал в 1978 г. в Болгарии эпидемию полиомиелитоподобного заболевания с летальностью 65 %. Этот же серотип 71 стал причиной крупной вспышки заболевания людей на Тайване, протекавшего с геморрагическим пульмональным шоком, энцефалитом и 20 %-ной летальностью. Выделенный в 1973 г. вирус гепатита А по своим признакам (размеры, структура, геном и эпидемиологические свойства) оказался также очень сходным с энтеровирусами, поэтому его иногда называют энтеровирусом 72. Всего род энтеровирусов человека включает 68 антигенно различающихся серотипов, в том числе:
– полиовирусы: 1 – 3 (3 серотипа);
– Коксаки А: А1 – А22, А24 (23 серотипа);
– Коксаки В: В1 – В6 (6 серотипов);
– ЕСНО: 1 – 9; 11 – 27; 29 – 34 (32 серотипа);
– энтеровирусы человека: 68 – 71 (4 серотипа).
Методы диагностики энтеровирусных заболеваний. Для диагностики заболеваний, вызываемых энтеровирусами, используют вирусологический метод и различные серологические реакции. При этом следует отметить, что на фоне резкого снижения заболеваемости полиомиелитом наблюдается рост полиомиелитоподобных заболеваний, принимающих иногда характер групповых вспышек. В связи с этим при диагностике полиомиелита необходимо иметь в виду возможность обнаружения вирусов Коксаки и ЕСНО, т. е. исследование необходимо проводить в таких случаях на всю группу энтеровирусов. Для их выделения используют кишечное содержимое, смыв и мазки из зева, реже ликвор или кровь, а в случае смерти больного исследуют кусочки ткани из разных органов.
Исследуемым материалом заражают культуры клеток (полиовирусы, ЕСНО, Коксаки В и некоторые серовары Коксаки А), а также новорожденных мышей (Коксаки А).
Типирование выделенных вирусов осуществляют в реакциях нейтрализации, РТГА, РСК, реакции преципитации, используя эталонные смеси сывороток различных сочетаний. Для выявления антител в сыворотках людей при энтеровирусных инфекциях используют те же серологические реакции (РН, цветные реакции, РТГА, РСК, реакции преципитации), но для этих целей необходимо иметь парные сыворотки от каждого больного (в острый период и через 2 – 3 нед. от начала болезни). Реакции считаются положительными при увеличении титра антител не менее чем в 4 раза. При двух этих методах используют также ИФМ (для обнаружения антител или антигена).
Ротавирус человека впервые обнаружил в 1973 г. Р. Бишоп с соавторами при электронно-микроскопическом исследовании энтероцитов двенадцатиперстной кишки у больных гастроэнтеритом детей и в их испражнениях с помощью метода иммунной электронной микроскопии (были использованы сыворотки реконвалесцентов с заведомо известными антителами), а в опытах на добровольцах была доказана их этиологическая роль.
В 1978 г. Международный комитет по таксономии вирусов выделил ротавирусы человека и животных (у которых они также были обнаружены) в самостоятельный род Rotavirus семейства Reoviridae. Родовое название происходит от латинского слова rota – колесо, так как форма вириона сходна с колесом. Это обусловлено тем, что вирион имеет сферическую форму, а его геном окружен нуклеокапсидом, состоящим из двух слоев: внутренний слой плотно окружает сердцевину, имеет форму икосаэдра и соприкасается с тонким наружным слоем капсида, в результате образуется структура, напоминающая колесо: втулка, спицы и ободок (рис. 87).
В выделениях больного обычно встречаются однокапсидные (60 – 65 нм) и двухкапсидные вирионы (70 – 75 нм). Инфекционными являются полные двухкапсидные вирионы.
Геном вириона представлен двунитевой фрагментированной РНК (11 фрагментов); в сердцевине кроме геномной РНК располагается вирионная РНК-полимераза. Суперкапсид отсутствует. В составе вириона имеется 8 белков (VP1 – VP8). Особенно важным является VP3-белок наружного капсида. Он отвечает за проникновение вируса в клетку и его вирулентность. Кроме того, он обладает гемагглютинирующим свойством. По белкам VP3 и VP7 ротавирусы делят на 4 сероварианта.
Ротавирусы человека и животных по групповым антигенам подразделяются на 6 серогрупп: A, B, C, D, E, F. Их представители не имеют антигенного родства и различаются по электрофоретическим свойствам геномной РНК. Для каждой серогруппы характерен свой профиль миграции фрагментов, состоящий из 4 классов. Идентифицированы:
С помощью электрофореза выявляют и дифференцируют вирусы различных серогрупп.
Особенностью ротавирусов человека является то, что они плохо размножаются в лабораторных условиях, и поэтому требуется длительное время для адаптации их к росту в культурах клеток.
Рис. 87. Схема строения ротавирусного вириона (по А. Г. Букринской, 1986):
1 – сердцевина, содержащая вирионную РНК; 2 – внутренний капсид; 3 – наружный капсид
Эпидемиология. Источник заражения – человек. Болеют главным образом дети в возрасте до 4 лет. Ротавирусы ежегодно вызывают более 130 млн случаев заболевания диареей, в результате чего ежегодно умирает до 600 тыс. человек.
Патогенез и клиника. Вирус размножается в эпителиальных клетках двенадцатиперстной кишки, вызывая различные повреждения. Инкубационный период варьирует от 1 до 7 дней, но обычно менее 2 сут. При типичной ротавирусной инфекции основным ранним симптомом является рвота, которая возникает раньше, чем понос, и продолжается от 2 до 6 дней. Отмечается небольшое повышение температуры. Понос проявляется в виде частых позывов, стул жидкий или полужидкий, частота позывов до 20 раз в день. Дегидратация наблюдается у 83 % больных. Длительность болезни варьирует от 4 до 7 дней, выделение вируса продолжается до 10 дней. Рвота достигает максимума в первые 2 дня болезни, понос длится дольше.
Лечение ротавирусной диареи преследует три главные цели:
1) прекращение дегидратации;
2) восстановление и поддержание нормального водно-солевого обмена;
3) обеспечение нормального питания.
Ротавирусная диарея успешно излечивается путем регидратации с помощью орального солевого раствора (NaCl – 3,5 г; NaHCO3 – 2,5 г; KCl – 1,5 г; глюкоза – 20,0 г на 1 литр воды).
Методы диагностики ротавирусных диарей. 1. Обнаружение вируса в испражнениях с помощью электронной и иммунной электронной микроскопии, иммуноферментного анализа в твердофазном варианте, встречного иммуноэлектрофореза, иммунодиффузионной преципитации в агаре, РСК, реакции коагглютинации, клонированных РНК-зондов. 2. Специфические антитела выявляют с помощью различных серологических реакций, в том числе с помощью иммуноферментного метода, РСК, реакции нейтрализации и иммунофлуоресценции.
В нашей стране для диагностики ротавирусной инфекции предложены следующие методы: а) РПГА с применением антительного ротавирусного диагностикума; б) реакция коагглютинации; в) тест-системы для обнаружения антигена с помощью ИФМ.
Эти методы предназначены для быстрого обнаружения ротавирусов в испражнениях больного. Для обнаружения специфических антител к ротавирусам используют реакцию торможения непрямой (пассивной) гемагглютинации.
В США создана высокоэффективная вакцина против ротавирусной инфекции.
В 1968 г. во время вспышки ОКЗ среди школьников и учителей в городе Norwolk (США) был обнаружен возбудитель этой вспышки – вирус, получивший название Norwolk. Он был идентифицирован с помощью метода иммунной электронной микроскопии. Вирус имеет сферическую форму и диаметр 27 – 32 нм. Подобные вирусы были обнаружены при многих других вспышках гастроэнтеритов в Англии, США,
Австралии. В антигенном отношении они оказались неоднородными, установлено не менее 4 серовариантов. Геном представлен однонитевой нефрагментированной РНК позитивной полярности. Вирус отнесен к семейству Caliciviridae; это самые частые возбудители гастроэнтеритов у детей старше 4 лет и у взрослых. Вирус выделяется в первые 48 – 72 ч после заболевания, очень устойчив во внешней среде. Распространяется фекально-оральным путем через инфицированную воду и пищу. Инкубационный период 18 – 48 ч. Начало болезни острое, в 70 % случаев рвота, в 65 % – диарея. Болезнь длится 2 – 3 дня. У пожилых людей возможен летальный исход. Диагностика заболевания затруднена из-за отсутствия лабораторных тестсистем и невозможности культивирования вируса in vitro.
Впервые были выделены от животных в 1932 г., а в 1976 г. были обнаружены в фекалиях детей, страдающих острым гастроэнтеритом. Сейчас они выделены в самостоятельное семейство – Caliciviridae.
Вирионы имеют сферическую форму и диаметр 37 нм, суперкапсида нет. Геном представлен позитивной однонитевой РНК с м. м. около 2,6 – 2,8 МД. При негативно-контрастной микроскопии на поверхности вирионов обнаруживается 32 глубоких (около 10 нм) чашевидных вдавления, что послужило основанием дать им название калицивирусы (греч. calyx – чаша). Калицивирусы не размножаются в культурах клеток, это затрудняет их обнаружение. Для диагностики в основном используют метод иммунной электронной микроскопии.
Были обнаружены в 1975 г. при электронномикроскопическом исследовании испражнений 120 детей в возрасте до 2-х лет, страдающих гастроэнтеритом. При электронной микроскопии вирион имел типичную звездообразную форму, поэтому ему и дали название астровирус (греч. astron – звезда). Астровирусы способны вызывать диареи и у животных. Астровирусы имеют размер около 28 нм. Геном представлен однонитевой РНК. Астровирусы относятся к семейству Caliciviridae. Различают 5 их серотипов. Повсеместно распространенное заболевание у людей – диарею новорожденных – в 75 случаев вызывает серотип 1. В составе вириона обнаружены два структурных белка. Астровирусы с трудом культивируются в культурах клеток человека и обезьян без цитопатического эффекта, поэтому вирион обнаруживают с помощью иммунофлуоресценции в культуре клеток. Для обнаружения вируса в испражнениях больных можно использовать метод иммунной электронной микроскопии.
Вирусные гепатиты
Вирусные гепатиты – группа заболеваний с общими клиническими синдромами – представляют собой серьезнейшую глобальную проблему. Только гепатитом А ежегодно в СССР заболевало более 1 млн человек. Сколько человек ежегодно инфицируется вирусом гепатита В, сказать трудно во всяком случае не менее 50 млн человек. Если еще несколько лет тому назад в мире насчитывалось примерно 200 млн носителей вируса гепатита В, то теперь, по данным ВОЗ, носителей вируса гепатита В в мире более 2 млрд человек. Гепатит А занимает по уровню заболеваемости и причиняемому экономическому ущербу одно из первых мест среди инфекционных болезней человека.
Впервые инфекционный гепатит был выделен в самостоятельную нозологическую единицу в 1888 г. выдающимся русским врачом С. П. Боткиным. Он сумел дифференцировать инфекционный гепатит (катаральную желтуху) от других болезней печени, сопровождающихся желтухой. Поэтому в нашей стране инфекционный гепатит в течение многих десятилетий называли болезнью Боткина. Заражение инфекционным гепатитом происходит фекально-оральным путем. Однако начиная с 30-х гг. ХХ в., а именно, после того как начались массовые заболевания желтухой среди привитых против желтой лихорадки, стало ясно, что существуют две этиологически и эпидемиологически разные формы гепатита; одну из них назвали инфекционным гепатитом, а другую – сывороточным, поскольку заражение в последнем случае связывали с парентеральными манипуляциями. Следует сказать, что название «сывороточный гепатит» явно не совсем удачное, так как последний тоже является инфекционным заболеванием, как и инфекционный гепатит. Поэтому еще в 1947 г. Ф. Мак-Каллум предложил называть инфекционный гепатит гепатитом А, а сывороточный гепатит – гепатитом В. Это предложение было узаконено ВОЗ только в 1973 г.
В 1974 г. была выделена еще одна форма вирусного гепатита, а именно гепатит ни А ни В, а в 1977 г. был обнаружен возбудитель дельта-гепатита. Тот факт, что инфекционный и сывороточный гепатиты вызываются вирусами, был установлен давно в опытах на добровольцах, однако их истинные возбудители были обнаружены в 70-х гг. ХХ в. Это обусловлено тем, что, во-первых, указанные вирусы долгое время не удавалось выращивать в культурах клеток, во-вторых, долгое время не могли обнаружить восприимчивых к ним животных.
Вирусный гепатит А – инфекционная болезнь человека, характеризующаяся преимущественным поражением печени и проявляющаяся клинически интоксикацией и желтухой. Вирус гепатита А был обнаружен в 1973 г. С. Фейнстоном [и др.] с помощью метода иммунной электронной микроскопии и путем заражения обезьян – шимпанзе и мармозеток. Суть метода иммунной электронной микроскопии состоит в том, что к фильтрату испражнений больного гепатитом А добавляют специфические антитела (сыворотку реконвалесцента) и осадок подвергают электронной микроскопии. Благодаря взаимодействию вирусов со специфическими антителами они подвергаются специфической агрегации. Их в этом случае легче обнаружить, а агрегация под влиянием антител подтверждает специфичность возбудителя. Открытие С. Фейнстона было подтверждено в опытах на добровольцах.
Вирус гепатита А имеет сферическую форму, диаметр вириона – 27 нм. Геном представлен однонитевой позитивной РНК с м. м. 2,6 МД. Суперкапсид отсутствует. Тип симметрии кубический – икосаэдр. Капсид имеет 32 капсомера, он образован четырьмя полипептидами (VP1 – VP4). По своим свойствам вирус гепатита А отнесен к роду Heparnovirus, семейству Picornaviridae. В антигенном отношении вирус гепатита А (HAV – hepatitis A virus) является однородным. HAV хорошо размножается в организме шимпанзе, павианов, гамадрилов и игрунковых обезьян (мармозеток). Длительное время вирус не умели культивировать. Лишь в 1980-х гг. удалось получить культуры клеток, в которых HAV размножается. Вначале для этих целей использовали перевиваемые линии клеток почки эмбриона макака-резус (культура FRhK-4), а сейчас – перевиваемую линию клеток почек зеленых мартышек (культура 4647).
Резистентность. Вирус относительно устойчив к высокой температуре, кислотам, жирорастворителям (отсутствуют липиды), дезинфицирующим средствам, хорошо переносит низкую температуру. Все это способствует длительному сохранению его во внешней среде. При комнатной температуре он выживает несколько недель, при 60 °C частично утрачивает инфекциозность через 4 – 12 ч, полностью – через несколько минут при 85 °C. Высокорезистентен к хлору, благодаря чему способен проникать в водопроводную воду через барьеры водоочистных сооружений.
Эпидемиология. Вирус гепатита А обладает высокой патогенностью для человека. По заключению ВОЗ (1987 г.), для возникновения болезни достаточно заражения всего одним вирионом. Однако практическая заражающая доза, вероятно, значительно выше. Источником инфекции является только инфицированный человек. Вирус выделяется в большом количестве с испражнениями за 12 – 14 дней до появления желтухи и в течение 3 нед. желтушного периода. Существенных различий в выделении возбудителя у больных желтушными, безжелтушными и бессимптомными формами гепатита А не выявлено. Способ заражения – фекально-оральный, главным образом водный, а также бытовым и пищевым путем. Способ заражения – фекальнооральный, главным образом водный, а также бытовым и пищевым путем. Основной (первичный) путь передачи вируса – водный. Возможно также заражение воздушно-капельным путем. Восприимчивость населения всеобщая. Болеют преимущественно дети в возрасте до 14 лет. Болезнь имеет выраженную осенне-зимнюю сезонность.
Патогенез, клиника. Инкубационный период варьирует от 15 до 50 дней, что зависит от величины заражающей дозы вируса, но в среднем составляет 28 – 30 дней. Попав в организм, вирус гепатита А размножается в регионарных лимфатических узлах, проникает в кровь, а затем в клетки печени и вызывает острый диффузный гепатит, который сопровождается поражением гепатоцитов и ретикулоэндотелиальных элементов печени и снижением ее дезинтоксикационной и барьерной функций. Повреждение гепатоцитов возникает не за счет прямого действия вируса, а в результате иммунопатологических механизмов.
Наиболее типичной картиной гепатита А является острая желтушная циклическая форма: инкубационный период, продромальный (преджелтушный), желтушный период и реконвалесценция. Однако в очагах инфекции выявляется большое количество больных с безжелтушными и бессимптомными формами инфекции, число которых значительно преобладает над желтушными («феномен айсберга»).
Постинфекционный иммунитет прочный и длительный, обусловлен вируснейтрализующими антителами и клетками иммунной памяти.
Методы микробиологической диагностики. Для диагностики гепатита А (кроме заражения животных – шимпанзе, мармозет, павианов, которых у нас нет) предложены различные иммунологические методы: РСК, иммунофлуоресцентный метод, гемагглютинация иммунного прилипания (комплекс вирусный антиген + антитело в присутствии комплемента адсорбируется на эритроцитах и вызывает их склеивание). Однако возможности применения этих методов ограничены из-за отсутствия специфических вирусных антигенов, а реакция иммунофлуоресценции требует биоптатов печени, что нежелательно. Надежным и специфическим является метод иммунной электронной микроскопии, однако он очень трудоемкий. Поэтому пока единственной приемлемой иммунологической реакцией является метод иммуносорбентного анализа твердой фазы в виде ИФМ или РИМ, особенно в модификации «захвата» иммуноглобулинов класса M. В нашей стране для этой цели предложена тест-система – «ДИАГН-А-ГЕП». Принцип работы этой тест-системы следующий. На стенках полистироловых луночек сорбируются вначале антитела к иммуноглобулинам класса М (антииммуноглобулины М), затем добавляется исследуемая сыворотка больного. Если в ней есть антитела класса IgM, они будут связываться анти-антителами М, затем добавляется специфический вирусный антиген (вирус гепатита А), который получают путем выращивания в культуре клеток. Система промывается, и к ней добавляются противовирусные антитела, меченные пероксидазой хрена. Если произошло взаимодействие всех четырех компонентов системы, возникает четырехслойный «сэндвич»:
1) антииммуноглобулины М, 2) иммуноглобулины М (против вируса гепатита А – в исследуемой сыворотке больного), 3) вирусный антиген, 4) антивирусные антитела, меченные ферментом.
Для обнаружения этого комплекса в луночки добавляют субстрат для фермента. Под влиянием фермента он разрушается, и образуется окрашенный продукт. Интенсивность окраски можно измерить количественно с помощью спектрофотометра или фотоколориметра.
Преимущество метода «захвата» IgM состоит в том, что антитела этого класса иммуноглобулинов появляются при первичном иммунном ответе и свидетельствуют об активной стадии инфекции, они исчезают после перенесенного заболевания. Противовирусные антитела, относящиеся к классу IgG, напротив, длительное время сохраняются после перенесенного заболевания, обеспечивая приобретенный иммунитет. Для обнаружения вируса гепатита А предложен метод ДНК-зонда: используют в качестве зонда ДНК комплементарную вРНК.
Специфическая профилактика. Ранее широко применявшаяся серопрофилактика гепатита А с помощью гамма-глобулина себя не оправдала, поэтому основной упор был сделан на проведение вакцинопрофилактики. С этой целью разрабатываются и уже используются различные варианты вакцин. В России эффективная вакцина против гепатита A была получена еще в 1995 г., и сейчас она успешно применяется.
Лечение. В связи с тем что при вирусных гепатитах нарушена продукция интерферонов, для лечения гепатитов, в том числе гепатита A, применяют интерферон и индуктор его эндогенного синтеза амиксин.
Гепатит В – инфекционное заболевание человека, характеризующееся избирательным поражением печени вирусом. Эта форма гепатита является наиболее опасной по своим последствиям среди всех известных форм вирусных гепатитов. Его возбудителем является вирус гепатита В (HBV).
Впервые антиген вируса гепатита В был обнаружен Б. Блюмбергом в 1964 г. в сыворотке крови австралийского аборигена, а сам возбудитель был обнаружен в 1970 г. Д. Дейном [и др.] и получил название частиц Дейна, поскольку не было полной уверенности в том, что это действительно вирус, а не его компоненты. В последующем все сомнения отпали, так как в составе частиц Дейна были обнаружены геномная ДНК и вирусная ДНК-зависимая ДНК-полимераза. В составе вириона имеются три основных антигена, для которых в 1974 г. были введены следующие обозначения:
1. HBsAg – поверхностный (superficial), или растворимый (soluble), или австралийский антиген.
2. HBcAg – сердцевинный антиген (сor-антиген).
3. HBeAg – антиген e, локализован в сердцевине вириона и, в отличие от HBcAg, не только присутствует в составе вириона, но и циркулирует в крови в свободном виде или в виде комплекса с антителом анти-HBeAg. Он выделяется в кровь из гепатоцитов при активной репликации HBV.
Поверхностный антиген – HBsAg – существует в виде трех морфологически различных вариантов: 1) представляет суперкапсид цельного вириона; 2) в большом количестве встречается в виде частиц диаметром 20 нм, имеющих сферическую форму; 3) в виде нитей длиной 230 нм. Химически они идентичны. В составе HBsAg имеется один общий антиген а и две пары взаимоисключающих типоспецифических детерминантов: d/y и w/r, поэтому существуют четыре основных субтипа HBsAg (и соответственно HBV): adw, adr, ayw и ayr. Антиген а обеспечивает формирование общего перекрестного иммунитета ко всем субтипам вируса.
Собственно вирион – частица Дейна – имеет сферическую форму и диаметр 42 нм. Суперкапсид вириона состоит из трех белков: главного (основного), большого и среднего (рис. 88, 1). Геном заключен в капсид и представлен двунитевой кольцевидной ДНК с м. м. 1,6 МД. ДНК состоит приблизительно из 3200 нуклеотидов, однако ее «плюс» – нить на 20 – 50 % короче «минус» – нити. С 5'-концом длинной нити ковалентно связан вирусспецифический белок. 5'-концы обеих нитей комплементарны и образуют «липкие» последовательности длиной в 300 нуклеотидов, благодаря чему нити замыкаются в кольцо. Содержание Г + Ц в вирионной ДНК 48 – 49 мол %. В сердцевине вириона находится кроме геномной ДНК-вирусная ДНК-зависимая ДНК-полимераза. «Минус» – нить ДНК HBV содержит всего четыре гена (S, C, P и X), но они организованы очень компактно (рис. 88, 2). Гены S, C, P, X сильно перекрываются и контролируют синтез следующих продуктов. Ген S кодирует синтез главного белка оболочки и содержит всю информацию о поверхностном антигене HBsAg. Кроме того, он кодирует синтез среднего и большого белков оболочки. Белки содержат общий СООН-конец, но их трансляция начинается с трех различных инициаторных кодонов. Ген С кодирует синтез капсидных белков (HBcAg и HBeAg); хотя эти белки кодируются одним геном, пути их трансляции различны. Ген Р – самый большой. Он включает в себя часть всех трех других генов и кодирует ферменты, необходимые для репликации вируса. В частности, он кодирует обратную транскриптазу, домен фермента РНК-азы Н, 5'-концевой белок «минус» – цепи. Ген X кодирует белки, регулирующие экспрессию (выражение) всех вирусных генов, в частности белок с м. м. 17 кД, который является трансактиватором транскрипции генов.
Белки, образующие поверхностный антиген, существуют в гликозилированной (gp) и негликозилированной форме. Гликозилированными являются gp27, gp33, gp36 и gp42 (цифры обозначают м. м. в кД). Суперкапсид HBV состоит из главного, или основного, S-белка (92 %); среднего М-белка (4 %) и большого, или длинного, L-белка (1 %).
Главный белок – p24/gp27, или основной белок (белок S), является основным компонентом оболочки HBV. В отсутствие других оболочечных белков он полимеризуется и образует сферические частицы диаметром 20 нм, которые состоят из 100 полипептидных молекул.
Рис. 88. Структура вириона HBV (1) и его генома (2)
Большой белок – p39/gp42, или длинный белок (белок L), присутствует во всех трех формах HBsAg. Он играет важную роль в морфогенезе вирионов и в выходе их из клетки. L-белок содержит последовательность белка М, которая на N-конце дополнена последовательностями из 108 (ayw) или 119 (adw, adr, ayr) аминокислотных остатков, кодируемых пре-S1-областью S-гена.
Средний белок – gp33/gp36, или белок М, также присутствует во всех трех морфологических формах HBsAg. Белок М содержит на N-конце участок из 55 аминокислотных остатков, кодируемых пре-S2-областью S-гена. Предполагается, что этот участок играет важную роль в распознавании вирусом гепатита В клеток печени ограниченного круга хозяев (человек, обезьяна шимпанзе). Последовательности белков, кодируемых пре-S-областями S-гена, обладают высокой иммуногенностью, а их детерминанты расположены на поверхности вириона. Поэтому антитела против этих антигенов играют важную роль в формировании иммунитета против гепатита В.
Синтез вирусных белков жестко контролируется на уровне транскрипции и трансляции. При транскрипции вирусного генома синтезируются два типа мРНК: а) меньшая – 2100 нуклеотидов – кодирует главный и средний белки оболочки;
б) бо́льшая – 3500 нуклеотидов, т. е. длиннее само́й геномной ДНК; она содержит концевые повторы длиной 100 нуклеотидов. Этот вид мРНК кодирует белок капсида и продукты гена Р. Она также является матрицей для репликации вирусной ДНК. В составе генома есть энхансеры (усилители транскрипции) – регуляторные элементы, которые активируют экспрессию всех вирусных генов и действуют преимущественно в клетках печени. В частности, ген S экспрессируется на очень высоком уровне только в клетках печени и под влиянием стероидных гормонов. Это обстоятельство и объясняет, почему хронический гепатит В и рак печени (гепатома) наблюдаются у мужчин чаще, чем у женщин, у которых уровень стероидных гормонов ниже.
Другие регуляторные элементы вируса гепатита В модулируют (контролируют) уровни синтеза отдельных белков. Например, большой белок синтезируется лишь в малом количестве. Больше всего его на поверхности инфекционных вирионов. А главный белок и, в меньшей степени, средний белок синтезируются в огромном количестве и покидают клетки в составе частиц поверхностного антигена, которых в сыворотке крови содержится во много раз больше, чем зрелых вирионов. Количество частиц поверхностного антигена может составлять 1011– 1013 на 1 мл крови (несколько сотен мкг).
Вирус гепатита В выделен в новое семейство вирусов – Hepadnaviridae, род Orthohepadnavirus. Сходные с ним гепаднавирусы обнаружены у различных животных (земляных белок, сурков, бурундуков, пекинских уток).
Репродукция гепаднавирусов происходит несколько необычным образом. В частности, репликация геномной ДНК происходит через промежуточное звено – РНК, т. е. с механизмом обратной транскрипции.
Жизненный цикл вируса гепатита В.
1. Адсорбция на клетке.
2. Проникновение в клетку с помощью механизма рецепторопосредованного эндоцитоза (окаймленная ямка → окаймленный пузырек → лизосома → выход нуклеокапсида и проникновение вирусного генома в ядро гепатоцита).
3. Внутриклеточное размножение.
В ходе проникновения в клетку происходит удлинение (достраивание) короткой («плюс») цепи ДНК. В ядре клеточная ДНК-зависимая РНК-полимераза синтезирует РНК размером 3500 нуклеотидов (прегеном) и мРНК, меньшие по размерам, для синтеза вирусных белков. Затем прегеном и вирусная ДНК-полимераза упаковываются во вновь синтезированный капсид, который переносится в цитоплазму. Здесь и происходит обратная транскрипция прегенома. На нем синтезируется новая «минус» – нить ДНК. После завершения синтеза «минус» – нити ДНК прегеномная РНК разрушается. Вирионная ДНК-полимераза на «минус» – цепи синтезирует «плюс» – цепь. Вирусная ДНК, теперь уже двухцепочечная, может существовать в клетке довольно долго и возвращаться в ядро для следующего цикла репликации. Если новая вирусная частица не подвергается дальнейшей репликации, то сформировавшийся нуклеокапсид, проходя через мембрану клетки, покрывается суперкапсидом, отпочковывается от клетки, и в нем немедленно прекращается удлинение короткой «плюс» – цепи ДНК. Вот почему длина этой нити варьирует. При типичной острой форме гепатита В в крови последовательно появляются следующие серологические маркеры: HBsAg, HBeAg и антитела (IgM, IgG): анти-HBcAg, анти-HBeAg и анти-HBsAg.
В составе вируса гепатита В нет онкогена, однако установлено, что, внедряясь в клеточную хромосому (в разные ее участки), вирусная ДНК может индуцировать в них различные генетические перестройки – делеции, транслокации, амплификации, которые и могут стать причиной развития рака печени – одного из самых тяжких последствий вирусного гепатита В.
Резистентность. Вирус гепатита В обладает высокой устойчивостью. При комнатной температуре сохраняет жизнеспособность в течение 3 мес., в замороженном состоянии – несколько лет. Вирус полностью инактивируется при автоклавировании (120 °C), при кипячении в течение 30 мин, сухим жаром при температуре 180 °C в течение 60 мин, при 60 °C – в течение 10 ч. Устойчив в кислой среде, но разрушается в щелочной. Вирус погибает при обработке Н2О2, хлорамином, формалином, фенолом и при УФ-облучении.
Эпидемиология. Источником заражения вирусом гепатита В является только человек. Вопреки прошлым представлениям о том, что заражение вирусом гепатита В
происходит исключительно парентеральным путем, теперь доказано, что он обнаруживается в различных секретах и экскретах: в слюне, носоглоточных выделениях, испражнениях, слезной жидкости, в сперме, менструальной крови и пр. Таким образом, заражение происходит не только парентеральным путем, но и половым, и вертикальным (от матери плоду), т. е. практически заражение вирусом гепатита В возможно разными способами.
От гепатита B в мире погибло столько же людей, сколько за все годы Второй мировой войны. Число носителей HBV, по данным ВОЗ, составляет от 0,1 до 20 % населения разных стран или регионов.
Патогенез и клиника. Вирус гематогенным путем заносится непосредственно в печень. В патогенезе гепатита важную роль играют аутоиммунные гуморальные и клеточные реакции. Предполагается, что поражение гепатоцитов связано не столько с непосредственным действием самого вируса, сколько с иммунологическими реакциями хозяина, возникающими в связи с модификацией клеточной мембраны вирусными белками, которые индуцируют появление аутоантител к клеткам печени. Поэтому развивающийся хронический гепатит и цирроз печени можно рассматривать как аутоиммунное заболевание.
Клеточные аутоиммунные реакции к вирусным белкам, содержащимся в мембране гепатоцитов, опосредуются Т-цитотоксическими лимфоцитами и другими киллерными клетками печени. Поэтому острую дистрофию печени можно рассматривать как реакцию отторжения своеобразного гетеротрансплантата.
Инкубационный период длится от 45 до 180 дней, в среднем составляет 60 – 90 дней. Клиническое течение гепатита В характеризуется большим разнообразием;
болезнь может протекать: в латентной форме, выявляемой лишь лабораторными методами, в типичной желтушной форме и в злокачественной форме, заканчивающейся летально. Продолжительность преджелтушной стадии составляет от одного дня до нескольких недель. Желтушный период, как правило, длительный и характеризуется хорошо выраженными симптомами (желтуха, гипербилирубинемия, потемнение мочи, желтушность склер). Затяжная форма наблюдается у 15 – 20 % больных, а у 90 % из них развивается хронический гепатит В. У больных с затяжной формой нередко наблюдаются аутоиммунные процессы, сопровождающиеся повышенным содержанием противопеченочных антител, которые выявляются с помощью иммуносорбентного анализа (ИФМ). У детей гепатит В протекает в более легкой форме и часто без развития желтухи, у детей младшего возраста – преимущественно бессимптомно.
Постинфекционный иммунитет (гуморальный и клеточный) длительный, пожизненный, обусловлен вируснейтрализующими антителами (анти-HBsAg) при отсутствии в крови поверхностного антигена. Нередко наблюдается скрытая иммунизация вследствие повторного контакта с HBV, которая является причиной широкого распространения иммунитета к вирусу среди населения. Обычно больные с острой формой гепатита В выздоравливают полностью по мере накопления антител к нему. Однако в некоторых случаях, несмотря на высокий уровень вирусного антигена в крови (обстоятельство, объясняющее, почему парентеральное заражение происходит наиболее часто), антитела к нему не вырабатываются. Вирус сохраняется в печени, и человек на долгое время, иногда пожизненно, становится хроническим носителем. Это обстоятельство связано, очевидно, со слабым иммунным ответом. Одним из наиболее частых исходов хронического гепатита В является цирроз печени и рак печени, который развивается по истечении латентного периода продолжительностью до 30 – 50 лет.
Методы диагностики гепатита В. В настоящее время основным методом диагностики гепатита В является использование реакции обратной пассивной гемагглютинации (РОПГА) для обнаружения вируса или его поверхностного антигена – HBsAg. Как уже отмечалось, в крови поверхностного антигена содержится во много раз больше, чем самого вируса (в 100 – 1000 раз). Для реакции РОПГА используют сенсибилизированные антителами против вируса гепатита В эритроциты. При наличии антигена в крови происходит реакция гемагглютинации. РОПГА проста, удобна, очень специфична. Для обнаружения антител к вирусному антигену HBsAg используют различные иммунологические методы (РСК, РПГА, ИФМ, РИМ и др.). Кроме того, для обнаружения HBV и его антигенов используют варианты ПЦР.
Для обнаружения в сыворотке больного антител к вирусному антигену (HBsAg) могут быть использованы различные иммунологические методы (РСК, РПГА, реакция преципитации, ИФМ, РИМ и др.).
Специфическая профилактика. Принимая во внимание высокий уровень заболеваемости гепатитом В, а также, что в мире очень много носителей HBV, по рекомендации ВОЗ прививки против гепатита В являются обязательными и должны проводиться на первом году жизни. Для вакцинации предложено два типа вакцин. Для приготовления одной из них в качестве сырья используют плазму вирусоносителей, поскольку в ней вирусный антиген содержится в количествах, достаточных для приготовления вакцины. Главное условие для приготовления этого типа вакцин – их полная безопасность, т. е. полная инактивация вируса, что и предусматривается технологией приготовления вакцины. Для изготовления вакцины другого типа применяют методы генной инженерии, в частности, для получения антигенного материала используют рекомбинантный клон дрожжей, вырабатывающих поверхностный антиген вируса гепатита В. О дивакцине против гепатитов A и B см. с. 6.
Обе вакцины обладают высокой эффективностью (защищают 95 % привитых). Продолжительность поствакцинального иммунитета не менее 5 – 6 лет. В России созданы вакцины как для взрослых людей, так и для новорожденных и детей раннего возраста – наиболее важный компонент борьбы с гепатитом В в глобальном плане. Полный курс прививки состоит из трех инъекций:
I доза – сразу после рождения; II доза – через 1 – 2 мес.; III доза – до конца 1-го года жизни.
Эти прививки включены в расширенную программу иммунизации ВОЗ и совмещаются с календарем ее проведения (по рекомендации ВОЗ, на 1-м году жизни проводят прививки против туберкулеза, полиомиелита, гепатита В, кори, столбняка, дифтерии, коклюша).
Гамма-глобулин, содержащий антитела против HBV, применяют для экстренной пассивной иммунопрофилактики лицам, имевшим контакт с больным гепатитом В. Для лечения гепатита B (острой и хронической форм) используют интерферон и амиксин (для индукции его эндогенного синтеза). При лечении хронического гепатита B эффективен новый препарат ламивудин (синтетический нуклеозид).
Возбудитель (HDV) обнаружен в 1977 г. М. Ризетто с сотрудниками в ядрах гепатоцитов у больных хроническим гепатитом с помощью метода иммунофлуоресценции. Форма вириона сферическая, диаметр 35 – 37 нм. Геном – одноцепочечная кольцевая РНК с м. м. 0,5 МД (как у вироидов). Вирион имеет два белка – внутренний и наружный. Внутренний белок HDAg кодируется геном HDV, а наружный – геном HBV, т. е. это поверхностный антиген вируса гепатита В – HBsAg. В связи с этим полагают, что HDV – это сателлит вируса гепатита В, и для размножения HDV требуется наличие вируса-хозяина (HBV). Различают три геноварианта HDV (I – III). Заражение происходит парентерально (с кровью и ее препаратами) или от матери к плоду. С HDV связано большинство молниеносных форм гепатита В и около 30 % циррозов печени у больных гепатитом В. Около 5 % носителей HBV в мире инфицированы HDV. Основной метод диагностики – обнаружение специфических к HDV антител (ИФМ, РИФ и др.) или антигена (ПЦР). Вакцинация против гепатита В служит средством профилактики и дальта-гепатита.
Вирус гепатита Е (HEV) имеет сферическую форму, диаметр 27 – 34 нм, тип симметрии нуклеокапсида икосаэдрический, наружной оболочки нет. Геном представлен одноцепочечной нефрагментированной позитивной РНК из 7500 оснований, содержит три открытые рамки считывания, кодирующие вирусспецифические белки. На поверхности вириона имеются вдавления, напоминающие чаши (греч. calyx), поэтому первоначально вирус был включен в семейство Caliciviridae (род Hepavirus). Более подробное изучение генома HEV показало, что нуклеотидная последовательность его РНК уникальна и имеет лишь некоторое сходство с вирусом краснухи. HEV имеет и ряд других существенных отличий от калицивирусов. Поэтому в 1998 г. было решено исключить его из семейства Caliciviridae и отнести его к неклассифицированным вирусам. Возможно, что это самостоятельный вид отдельного семейства.
Источник инфекции – только человек, возбудитель выделяется с испражнениями. Механизм заражения – фекально-оральный. Основной путь заражения – через загрязненную испражнениями воду. Заражающая доза по сравнению с вирусом гепатита А существенно выше. Восприимчивость к вирусу HEV всеобщая. Эпидемии могут охватить десятки тысяч людей при нарушении питьевого режима, особенно во время сезонных работ летом и осенью.
Клинически болезнь протекает легче, чем гепатит А, перехода в хроническую форму не отмечено. У 85 – 90 % больных гепатит Е протекает в легкой или средней тяжести форме, часто бессимптомно. Однако у беременных женщин гепатит Е протекает тяжело – с летальностью до 20 %.
Для диагностики используют метод иммунной электронной микроскопии; предложена тест-система для обнаружения антител к антигенам HEV. Постинфекционный иммунитет прочный, пожизненный, обусловлен вируснейтрализующими антителами и клетками иммунной памяти. Для специфической профилактики предложена цельновирионная вакцина и разрабатываются живые и рекомбинантные вакцины.
Вирус гепатита C (HCV) открыт в конце 80-х гг. XX в. М. Хогтом с соавторами (Hougt M. [et al.]). Он относится к семейству Flaviviridae, рoду Hepacivirus; имеет суперкапсид, форма сферическая, диаметр 55 – 65 нм. Геном представлен однонитевой нефрагментированной РНК позитивной полярности длиной 9500 – 10 000 нуклеотидов. Образующийся при репликации вируса полипротеиновый предшественник разрезается клеточной и вирусной протеазами на белки: С (нуклеопротеин), 2 белка оболочки и 6 неструктурных белков, необходимых для регуляции репродукции вируса. Вирус отличается высокой изменчивостью всех генов. Известно до 14 геновариантов и более 90 их подтипов. Геновариант вируса определяет течение инфекции, переход ее в хроническую форму и в последующем – развитие цирроза и карциномы печени. Наиболее опасны геноварианты 1b и 4a. В России циркулируют генотипы 1b, 2a, 2b и 3а. Вирус гепатита С распространен повсеместно. По данным ВОЗ, около 1 % населения планеты инфицировано HCV.
Источником инфекции является только человек. Вирус у больных и носителей обнаруживается в 100 % случаев в крови (2/3 всех посттрансфузионных гепатитов вызывает HCV), в 50 % – в слюне, в 25 % – в сперме, в 5 % – в моче. Это определяет пути заражения.
Клиническое течение гепатита С легче, чем гепатита В. Вирус С называют «мягким убийцей». Желтуха наблюдается в 25 % случаев; до 70 % случаев заболевания протекают в скрытой форме. Независимо от тяжести течения в 50 – 80 % случаев гепатит С принимает хроническую форму, а у таких больных в 20 % случаев впоследствии развиваются цирроз, карцинома. В опытах на мышах установлено, что вирус гепатита С помимо гепатоцитов может поражать и нервные клетки, вызывая тяжелейшие последствия.
Вирус в культуре клеток размножается плохо, поэтому диагностика его затруднена. Это один из немногих вирусов, для которых определение РНК – единственный способ идентификации. Возможно определение РНК вируса с помощью ЦПР в варианте с обратной транскрипцией, методом ИФА антител к вирусу с использованием рекомбинантных белков и синтетических пептидов.
Интерферон, продукция которого при хронических гепатитах нарушена, и индуктор его эндогенного синтеза амиксин – основные патогенетические средства лечения всех вирусных гепатитов.
Вирус гепатита G (HGV) открыт в 1995 г., относится к семейству Flaviviridae (poд Hepacivirus). Геном вируса G – одноцепочечная нефрагментированная позитивная РНК длиной ~9500 оснований. Структурная организация генома вируса G подобна таковой HVC. Геном содержит одну большую рамку считывания, которая кодирует полипротеин-предшественник, содержащий около 2800 аминокислотных остатков. Он разрезается клеточной и вирусной протеазами с образованием двух структурных и не менее пяти неструктурных белков. Гены, кодирующие структурные белки (cor и env), прилегают к 5'-концу вирусной РНК, а гены неструктурных белков (хеликазы, протеазы, полимеразы) – к 3'-концу. Установлено, что неструктурные гены HGV сходны с генами вируса гепатита С, а также вирусов GBV-A и GBV-B. Все эти вирусы выделены в один род Hepacivirus семейства Flaviviridae. По строению структурных генов HGV не имеют ничего общего с GBV-A и HCV и лишь отдаленно напоминают GBV-B. Вирус гепатита G оказался идентичным вирусу GBV-C, выделенному также при изучении субпопуляции вирусов GBV от обезьян тамаринов, через которых пассировали РНК-вирус от больного острым гепатитом неустановленной этиологии, имевшего инициалы GB; в честь него все эти вирусы и получили название вирусов гепатита GBV-A, GBV-B, GBV-C. Вирус HGV (GB-C) имеет дефектный cor-белок и обладает менее выраженной изменчивостью, чем HCV. Выделено 3 типа и 5 субтипов генома HGV. Доминирует генотип 2а, в том числе и на территории России, Казахстана и Киргизии. Маркеры вируса G обнаружены у 2 % населения этих стран. Вирус G обнаруживается в разных странах мира у 1 – 2 % доноров крови, т. е. чаще, чем вирус гепатита С. Подобно гепатоцитным вирусам HBV/HCV этот вирус способен к персистенции, но реже ведет к хронической патологии, и протекает эта персистенция, вероятно, по типу здорового носительства. Острые клинические проявления гепатита G также менее тяжелы, чем при гепатитах В и С. Для диагностики гепатита G используют ЦПР и ИФМ.
Вирус открыт японским ученым Т. Нисизавой (T. Nishizava) [и др.] в 1997 г. в сыворотке больного (TT – инициалы больного), но не в виде вириона, а как фрагмент его геномной однонитевой кольцевидной минус-ДНК размером 2,6 кД. Вирион диаметром 30 – 50 нм лишен липидной оболочки, капсид имеет кубический тип симметрии. ДНК содержит три открытые рамки считывания и нетранслируемый участок, содержащий много инвертированных повторов, за счет которого и происходят внутригеномные перестройки. Дифференцировано более 16 генотипов. Вирус идентифицирован как первый представитель нового семейства Circinoviridae. Диагностика основана на выявлении вирусной ДНК с помощью ПЦР. Вирусоносительство среди населения достигает 80 % и обнаруживается у 15 – 30 % людей с заболеваниями печени. Вирус способен размножаться в гепатоцитах, передается гемотрансфузионно и фекально-оральным путем. Однако вопрос о том, действительно ли вирус TT является возбудителем гепатита, остается открытым; высказываются различные версии. К числу возможных возбудителей гепатита относится также группа SEN-вирусов (SENV) (SEN-A – SEN-H). Геном SENV – одноцепочечная линейная ДНК, состоящая из 3800 нуклеотидов, имеет три вариабельные открытые рамки считывания. Вирусы размножаются в гепатоцитах, передаются при переливании крови. Вирусы SEN-D и SEN-H чаще присутствуют в крови больных гепатитами B и C.
Герпесвирусы человека и вызываемые ими заболевания
Семейство Herpesviridae (греч. herpes – ползучий) по современной классификации подразделяют на 3 подсемейства. Alphaherpesvirinae характеризуются высокой цитопатической активностью с относительно коротким репликативным циклом и широким кругом поражаемых хозяев, часто вызывают латентное пожизненное инфицирование ганглиев. К ним относятся вирусы простого герпеса 1-го и 2-го типов (соответственно ГВЧ-12 и ГВЧ-2 – род Simplexvirus), вирус ветряной оспы – опоясывающего лишая, или вирус VZV (ГВЧ-3, род Varicellovirus), и многочисленные вирусы животных. Betaherpesvirinae включают вирусы цитомегалии человека и мышей и характеризуются более длительным репродуктивным циклом с медленно развивающимся цитопатическим эффектом и узким кругом хозяев. К ним относятся цитомегаловирус человека (ГВЧ-5 – род Cytomegalovirus), а также ГВЧ-6 и ГВЧ-7 – возбудители внезапной экзантемы (эритемы новорожденных) и синдрома хронической усталости и иммунной депрессии (род Roseolovirus). Gammaherpesvirinae также имеют узкий круг хозяев, размножаются в лимфобластоидных клетках и специфичны для Т– и В-лимфоцитов, часто вызывая латентную инфекцию, обнаруживаемую в лимфоидной ткани. В это подсемейство включены вирус Эпстайна-Барр (ГВЧ-4 – род Lymphocryptovirus), вирус саркомы Капоши (ГВЧ-8 – род Rhadinovirus), вирус болезни Марека и некоторые герпесвирусы обезьян.
ГВЧ-1 вызывает у человека орофарингеальный герпес (десны и слизистая рта), лабиальный герпес, герпес кожи, офтальмогерпес, генитальный герпес, энцефалит, пневмонии. ГВЧ-2 вызывает генитальный герпес, неонатальный герпес, диссеминированный герпес. ГВЧ-3 вызывает ветряную оспу (ветрянку) и опоясывающий лишай (опоясывающий герпес); язвенно-некротическая форма herpes zoster – один из признаков заболевания СПИД. ГВЧ-4 – причина инфекционного мононуклеоза, назофарингеальной карциномы, лимфомы Беркитта, В-клеточной лимфомы, синдрома хронической усталости и иммунной депрессии. ГВЧ-5 вызывает врожденные повреждения ЦНС, ретинопатии, интерстициальную пневмонию, гепатит, энтероколит при ВИЧ-инфекции, цитомегалию при иммунодефиците и трансплантации органов и костного мозга.
Вирион герпесвируса состоит из трех основных компонентов (см. рис. 77.2): нуклеоида, располагающегося в центральной части; капсида, покрывающего нуклеоид и состоящего из капсомеров; и оболочки. Диаметр вириона 150 – 210 нм. Геном представлен двунитевой линейной ДНК с молекулярной массой 92 – 102 МД и состоит из двух фрагментов, связанных ковалентно: короткого S (10 МД) и длинного L (68 – 75 МД). Содержание Г + Ц составляет 57 – 74 мол. %. Капсид окружает «ядро» вириона, состоящее из ДНК, покрытой белком. ДНК вируса как бы намотана на цилиндрическую массу, расположенную внутри капсида. Капсид имеет форму икосаэдра диаметром 100 нм (иногда 120 – 150 нм) и построен из 162 капсомеров. Каждый капсомер имеет длину 12,5 нм, диаметр 8,5 нм и центральное углубление в 4 нм.
Герпесвирусы термолабильны: инактивируются при температуре 50 – 52 °C в течение 30 мин, при 37 °C – в течение 10 ч. Соли, добавленные в среду, могут или увеличивать (Na2SO4, Na2HPO4), или снижать (MgCl2, MgSO4, NaCl, KCl и др.) термостабильность. Наиболее термостабилен вирус при рН 6,5 – 6,9. Способен длительно сохраняться при низких температурах, особенно при – 70 °C. Инактивируется УФ-лучами, фотодинамическим действием красителей. Очень чувствителен к спиртам и другим органическим жирорастворителям, детергентам, протеазам, фосфатазе, желчи.
Инфекция, вызванная вирусом простого герпеса, может иметь несколько клинических форм, но чаще всего бессимптомна. Обычными клиническими проявлениями бывают везикулярные высыпания на коже и слизистых оболочках. Иногда может быть тяжелый кератит, менингоэнцефалит или диссеминированное заболевание новорожденных. Вирус простого герпеса патогенен для многих видов животных – мышей, крыс, хомячков, морских свинок, кроликов, собак, обезьян, у которых обычно вызывает лихорадку и энцефалит (при внутримозговом заражении), а у кроликов также кератоконъюнктивит.
Так как вирус обладает дермонейротропным действием, то у выживших животных и инфицированных людей он может длительно сохраняться в латентном состоянии в мозге, эпителиальных клетках, ганглиях тройничного и других нервов в виде двунитевых кольцевых форм ДНК.
Вирус хорошо размножается в хорион-аллантоисной оболочке куриных эмбрионов, где через 2 – 3 сут. после заражения образует выпуклые белые бляшки, видимые невооруженным глазом. В препаратах-отпечатках из них видны гигантские клетки с внутриядерными включениями. Вирус легко размножается почти во всех широко используемых культурах клеток, образуя в монослоях бляшки. В зараженных клетках образуются тельца-включения, появляются гигантские многоядерные клетки, которые далее некротизируются (цитопатический эффект). Особенно пригодна для заражения первичная культура клеток почек кролика.
Эпидемиология различна для вирусов типов 1 и 2. Имеются данные, что до 70 – 90 % людей инфицированы вирусом герпеса типа 1 и что он присутствует в организме человека более постоянно, чем любой другой вирус. Первичное инфицирование происходит в раннем периоде жизни. После исчезновения материнских антител инфекция протекает в виде везикулярного или афтозного стоматита. Вирус уже не удаляется из организма, так как не доступен действию антител. Вирус герпеса типа 1 передается прямым контактом через слюну или через посуду, загрязненную слюной носителя. Источником заражения детей обычно является один из родителей с активной формой герпеса.
Вирус простого герпеса типа 2 передается половым путем или во время родов от больной матери. Распространяется как типичная венерическая болезнь. Источник инфекции – только человек.
Особенности патогенеза. ГВЧ-1 и -2 проникают в клетку-мишень в несколько стадий при участии различных своих гликопротеидов, однако решающим является связывание гликопротеида D со специфическим рецептором клетки-хозяина; только после этого происходит депротеинизация вируса и проникновение его нуклеокапсида в цитоплазму. ГВЧ-1 в качестве рецептора распознает нектин-1 и HVEM (родствен фактору некроза опухоли), а ГВЧ-2 – также и нектин-2. Т-лимфоциты экспрессируют HVEM и нектин-2, но не нектин-1, нервные клетки – только нектин-1, а эпителиоциты – полный спектр распознаваемых этими вирусами рецепторов, что и определяет тропизм их действия.
После попадания в организм вирус может далее распространяться нейрогенно (эндоневрально, периневрально, по шванновским клеткам) и гематогенным путем. Вирус простого герпеса обладает не только дермотропным, но и комбинированным нейроиммунотропным действием и способен к пожизненной персистенции в организме. У 30 – 50 % инфицированных людей может развиваться рецидивирующая герпетическая инфекция в той или иной форме, причем лабиальный герпес и поражения полости рта хотя бы раз на протяжении жизни возникают у 75 % людей. Рецидивы могут быть спровоцированы различными агентами: солнечная радиация, лихорадка, стресс, острая пища, прием алкоголя и др.
Есть две гипотезы, объясняющие причины возникновения рецидивов инфекции, – статическая и динамическая. Согласно первой, вирус находится в клетках паравертебральных ганглиев в виде провируса, но под влиянием пускового фактора реактивируется и перемещается по аксону периферического нерва к участку, где формируется очаг поражения. Динамическая гипотеза предполагает постоянную репродукцию и выделение ограниченного числа вируса к очагу поражения, где возникают бессимптомно протекающие микроочаги благодаря адекватному функционированию местного иммунитета кожи и слизистых. Доказана способность вируса простого герпеса «ускользать» от иммунной системы хозяина за счет подавления апоптоза клеток, инфицированных вирусом, и за счет блокирования классического и альтернативного путей активации системы комплемента (один из гликопротеидов вируса препятствует связыванию С5 компонента комплемента и пропердина с C5b, делая невозможным лизис инфицированной вирусом клетки).
ГВЧ-1 может вызывать острый (афтозный) стоматит, чаще у детей; губной герпес, герпетическую экзему, кератоконъюнктивит, редко – менингоэнцефалит. ГВЧ-2 вызывает генитальный герпес (характерны частые рецидивы) и герпес новорожденных. Возможно трансплацентарное заражение плода, приводящее к врожденным уродствам.
Иммунитет. Ребенок первых 6 мес. жизни имеет, как правило, антитела к вирусу, приобретенные пассивно от матери. Далее они утрачиваются, ребенок наиболее восприимчив к герпетической инфекции в возрасте от 6 мес. до 2 лет. В крови переболевших обнаруживаются антитела, нейтрализующие вирус, а также специфические IgA на слизистых, но они не препятствуют персистированию вируса и развитию латентной инфекции.
Лабораторная диагностика. Для диагностики могут быть использованы вирусоскопический, вирусологический и серологический методы. Материалом для исследования служат соскобы с роговой оболочки, содержимое пузырьков, слюна и др. Соскобы и мазки, взятые из основания свежих герпетических высыпаний и окрашенные по Романовскому – Гимзе после немедленной фиксации в абсолютном спирте, содержат гигантские многоядерные клетки с внутриядерными включениями (тельца Каудри).
Для выделения вируса используют культуры клеток, куриные эмбрионы и лабораторных животных. В зараженных культурах клеток обнаруживают бляшки и характерный цитопатический эффект, в куриных эмбрионах при заражении на хорион-аллантоисную оболочку обнаруживают бляшки, причем бляшки, образованные вирусом герпеса типа 2, крупнее бляшек, образованных вирусом типа 1. При заражении новорожденных мышей в мозг симптомы энцефалита развиваются на 2 – 6-й день. Очень чувствительно и специфично для вируса герпеса заражение на скарифицированную роговицу кролика. Окончательную идентификацию производят в реакции нейтрализации на мышах, куриных эмбрионах или клеточных культурах с использованием стандартных противогерпетических иммунных сывороток животных, а также в реакции иммунофлуоресценции (РИФ).
При серодиагностике важно решить, первичное это заболевание или обострение хронической инфекции. Поэтому используют парные сыворотки, которые исследуют с помощью РСК, РИФ и ИФМ.
Лечение и специфическая профилактика. В качестве средств специфического лечения используют химиопрепараты – модифицированные нуклеозиды, подавляющие репликацию вируса, но обладающие токсичностью и способствующие появлению резистентных к ним штаммов вируса (аденин-арабинозид, 5-йод-2'-дезоксиуридин, ацикловир и др.). Эффективны, особенно в случае острого течения заболевания, индукторы интерферона. Для лечебных целей в тяжелых случаях, а также для профилактики при частых рецидивах используют убитую культуральную герпетическую вакцину.
Вирус ветряной оспы – зостер (V – Z)
Вирус V – Z может вызывать высококонтагиозное легкое заболевание у детей – ветряную оспу, проявляющуюся в развитии везикулезной сыпи на коже и слизистых. У взрослых (и крайне редко у детей) этот же вирус вызывает опоясывающий лишай (зостер), характеризующийся воспалительной реакцией в задних корешках спинного мозга и в ганглиях; он сопровождается высыпанием пузырьков на коже в участке, иннервируемом пораженным чувствительным нервом. Ветряная оспа рассматривается как реакция на первичный контакт вируса с организмом человека, тогда как зостер – это ответ частично иммунного хозяина на реактивацию вируса, присутствующего в латентной форме в чувствительных ганглиях.
Этот вирус идентичен вирусу простого герпеса по морфологическим, биологическим и даже антигенным свойствам, но он не размножается в организме лабораторных животных. Оказывает действие на клетки человека: часто видны остановка деления в метафазе, сморщивание хромосом, разрыв хромосом и образование микроядрышек.
Патогенез и клиника. Вирус V – Z передается воздушно-капельным путем, источник инфекции – больной человек. Первичное размножение вируса происходит в эпителии слизистой оболочки верхних дыхательных путей. Далее лимфогенным путем вирус проникает в кровь, с ней – в кожу. Эпителиальные клетки набухают, наблюдается баллонирующая дегенерация (дистрофия) клеток шиповатого слоя, накопление тканевой жидкости приводит к образованию пузырьков. В ядрах пораженных клеток, особенно на ранних стадиях, обнаруживаются эозинофильные тельца-включения. При опоясывающем лишае, помимо этого, имеется воспалительная реакция в задних корешках спинного мозга и чувствительных ганглиях. Инкубационный период при ветряной оспе – 14 – 21 день, при опоясывающем лишае не известен. Заболевание начинается с недомогания, подъема температуры, появления сыпи на лице, затем на туловище и конечностях. Сначала появляется зудящее пятнышко, которое довольно быстро превращается в пузырек, наполненный серозно-мутной жидкостью. Затем пузырек лопается, на его месте образуется корочка, впоследствии отторгающаяся и не оставляющая рубца. Высыпания новых пузырьков продолжаются 3 – 4 дня, содержимое их включает огромное количество вируса. Летальность и осложнения (энцефалит, пневмония) довольно редки, чаще наблюдаются у новорожденных. В первые три месяца беременности перенесенная ветряная оспа у женщин может привести к врожденным уродствам плода.
При опоясывающем лишае вслед за недомоганием и подъемом температуры появляются сильнейшие боли в области слизистой оболочки или кожи, иннервируемой одной или несколькими группами чувствительных ганглиев. Через несколько дней в этой зоне появляются пузырьки. Чаще всего это наблюдается на туловище (по ходу межреберного нерва), на коже головы или шеи.
Лабораторная диагностика проводится так же, как диагностика простого герпеса, но следует учитывать следующие моменты. Вирус простого герпеса вызывает развитие поражений в роговице кроликов, мозге мышей и на хорион-аллантоисной оболочке куриного эмбриона, тогда как вирус V – Z почти не заражает указанные ткани. В большинстве культур клеток вирус простого герпеса растет быстро, образует бляшки за 18 – 24 ч. Вирус V – Z растет в основном в фибробластных клетках в течение 3 – 5 дней. Отличаются эти вирусы по морфологии (в основном, размерами) вирионов в везикулярной жидкости при электронной микроскопии, а также по присутствию в везикулярной жидкости антигена, выявляемого методом иммунодиффузии в геле со специфическими преципитирующими сыворотками (против вирусов герпеса, V – Z и осповакцины).
Лечение и специфическая профилактика. Хорошим лечебным эффектом обладает гамма-глобулин, полученный из сыворотки больных опоясывающим лишаем в стадии выздоровления. Этот препарат можно использовать и для профилактики ветряной оспы у контактных детей, имеющих иммунодефицитные состояния.
Цитомегалия с внутриклеточными включениями является генерализованной инфекцией новорожденных, вызванной внутриутробным заражением цитомегаловирусом (ЦМВ) или заражением сразу после рождения. Инфекция распространена широко и повсеместно, антитела к вирусу цитомегалии обнаружены у 80 % людей старше 35 лет. ЦМВ удается выделять из шейки матки почти у 10 % здоровых женщин. Заболевание характеризуется возникновением крупных внутриядерных включений в слюнных железах, легких, печени, поджелудочной железе, почках, железах внутренней секреции и иногда в мозге. Умирают в основном дети в возрасте до 2 лет. Для старших детей и подростков характернее бессимптомная инфекция. У взрослых, получающих для лечения иммунодепрессанты, часто развивается тяжелая цитомегаловирусная инфекция.
ЦМВ весьма похож на вирусы простого герпеса и V – Z, но отличается от них по следующим признакам. ЦМВ имеет более продолжительный цикл внутриклеточной репродукции (1 – 2 нед.) и поэтому обладает меньшей цитопатической активностью, имеет чрезвычайно узкий круг хозяев (только человек) и менее чувствителен к модифицированным нуклеозидам, так как слабо способен индуцировать вирусспецифическую тимидинкиназу.
Патогенез и клиника. При внутриутробном заражении развивается наиболее тяжелая форма болезни. Дети могут инфицироваться также контактным или алиментарным путем, так как больные способны выделять вирус с мочой довольно продолжительное время. ЦМВ размножается в эпителиальных клетках различных внутренних органов, в них он может длительно персистировать. Характерны изменения в клетке, в которой размножается ЦМВ: размер цитомегалических клеток 25 – 40 мкм, в их ядрах имеются 1 – 2 включения, состоящие из вирусных частиц и ядерного хроматина, окруженные светлым ободком.
При врожденной цитомегалии наблюдается специфический синдром, характеризующийся признаками незрелости плода, желтухой, увеличенными печенью и селезенкой, тромбоцитопенической пурпурой, пневмонией и различными повреждениями ЦНС (микроцефалия, хориоретинит, атрофия зрительного нерва, олигофрения и др.). У детей при приобретенной цитомегалии развиваются гепатит, интерстициальная пневмония или гемолитическая анемия. Вирус обнаруживают в слюнных железах и почках, откуда он может продолжительное время выделяться. При заболевании большое значение имеют иммунопатологические реакции: иммунный лизис клеток системой антитело + комплемент и цитотоксическими лимфоцитами, появление иммунных комплексов в крови и тканях. Резко увеличивается количество Т-супрессоров, и отношение Т-хелперов к Т-супрессорам падает до 0,23.
Иммунитет носит гуморальный характер: в сыворотке появляются комплементсвязывающие и вируснейтрализующие антитела.
Лабораторная диагностика. Вирус может быть выделен из разного патологического (в том числе секционного) материала путем заражения культур клеток фибробластов человека и диплоидных культур клеток легких человека. Через 1 – 2 нед. появляются типичные цитомегалические клетки. Их также можно обнаружить с помощью электронной микроскопии клеточного осадка мочи, где вирус присутствует в больших количествах. Антитела в парных сыворотках определяют в реакции нейтрализации в культуре клеток, а также с помощью РСК, РПГА, РИФ, ИФМ и РИМ.
Лечение и специфическая профилактика. Имеются данные об успешном применении аномальных нуклеозидов с лечебной целью при различных формах цитомегалии. Целесообразно также использование иммуномодуляторов (левомизол), так как вирус обладает иммунодепрессивным действием. Для специфической профилактики разработаны живые вакцины, полученные из аттенуированных штаммов и применяющиеся в виде моновакцины и дивакцины в сочетании с вакциной против краснухи.
Вирус Эпстайна – Барр (ЭБ) вызывает инфекционный мононуклеоз, которым болеют люди всех возрастных групп, а также встречающуюся у детей и юношей в Центральной Африке опухоль чаще всего верхней челюсти – лимфому Беркитта и у взрослых мужчин в Китае – назофарингеальную карциному. Вирус ЭБ впервые был выявлен при электронной микроскопии перевиваемых клеток, полученных из лимфомы Беркитта.
Вирус ЭБ от других герпесвирусов существенно отличается по антигенным свойствам. С помощью РСК, иммунодиффузии и РИФ обнаруживают различные антигены. Раньше всего обнаруживается мембранный антиген (МА, или LYDMA: membrane antigen, или lymphocyte detected membrane antigen), комплементсвязывающий ядерный антиген (EBNA – Epstein – Barris nucleic antigen); поздним антигеном является антиген вирусного капсида (VCA – virus capsid antigen).
Вирус ЭБ весьма оригинален во взаимодействии с поражаемой им клеткой-хозяином: он вызывает не гибель, а пролиферацию лимфоцитов. Вызванная вирусом ЭБ трансформация лимфоцитов позволяет длительно культивировать последние; при этом выявляется положительная РИФ с антисывороткой к вирусу ЭБ. Указанная трансформация делает лимфоциты способными к бесконечному делению. Во всех клетках в больших количествах появляются геномы вируса ЭБ, а в окружающую среду выделяется ядерный антиген (EBNA).
Патогенез и клиника. Патогенез инфекции, вызванной вирусом ЭБ, до сих пор мало понятен. При инфекционном мононуклеозе вирус ЭБ попадает на слизистую рото– и носоглотки, далее проникает в регионарные лимфатические узлы, размножается и диссеминируется гематогенным путем. В лимфатических узлах, миндалинах и селезенке происходит пролиферация ретикулярных и лимфоидных клеток с образованием крупных мононуклеарных форм; нередко возникают очаговые некрозы. В печени могут образовываться лимфоидные клеточные инфильтраты.
Инкубационный период при инфекционном мононуклеозе от 4 до 60 дней, чаще 7 – 10 дней. Для заболевания характерно постепенное развитие: повышается температура, появляется боль в горле, нарушается носовое дыхание, увеличиваются регионарные лимфатические узлы, на миндалинах появляется налет. В крови отмечается лейкоцитоз, одним из самых характерных признаков заболевания является появление в крови атипичных зрелых одноядерных клеток среднего и крупного размера с широкой базофильной протоплазмой – атипичных мононуклеаров и широкоплазменных лимфоцитов; их количество составляет 10 – 15 % и более. Осложнения (синуситы, пневмония, менингит, нефрит) бывают редко, прогноз благоприятный. Весьма своеобразен иммунитет. В-лимфоциты продуцируют вирусные частицы, но малигнизации обычно не наступает. Это связано с появлением специфических Т-киллеров, мишенью которых является вирусный антиген МА на поверхности В-лимфоцита. Активируются естественные киллеры, К-клеточный механизм. Увеличивается активность супрессоров, тормозящих пролиферацию и дифференциацию В-лимфоцитов и тем самым препятствующих размножению пораженных клеток. При выздоровлении появляются Т-клетки памяти, которые уничтожают зараженные вирусом В-лимфоциты после их рестимуляции. Эти клетки циркулируют в крови переболевших пожизненно. Синтезируются также вируснейтрализующие антитела. При лимфоме Беркитта и карциноме носоглотки пораженные клетки содержат множественные копии интегрированного генома вируса ЭБ, в ядрах клеток появляется антиген EBNA. В крови переболевших появляются антитела к капсидному антигену сначала класса IgM, затем класса IgG. Позднее появляются антитела к ранним антигенам MA и EBNA. Антитела сохраняются пожизненно. Для выявления вирусной ДНК в пораженных трансформированных клетках применяется метод ДНК-зонда.
Саркома Капоши – мультифокальное заболевание с преимущественным поражением кожных покровов, а также внутренних органов и лимфатических узлов. Возбудитель открыт недавно, получил название KSHV (герпесвирус, ассоциированный с саркомой Капоши), или HHV-8. Различают 3 геноварианта: F, B, C. Вирус широко распространен в разных странах мира. Антитела к нему обнаружены у 90 % ВИЧ-инфицированных.
Арбовирусы
Под названием «арбовирусы» (лат. Arthropoda – членистоногие и англ. borne – передающийся) в настоящее время понимают вирусы, передающиеся восприимчивым позвоночным (в том числе и человеку) через укусы кровососущих членистоногих. Участие переносчика в передаче возбудителя обусловливает такие особенности арбовирусных инфекций, как сезонность, связанную с жизненным циклом переносчика, и распространение в регионах его обитания. Эти вирусы не обязательно вызывают летальные инфекции у членистоногих, у них инфекция может протекать бессимптомно, не вызывая каких-либо поражений или изменений. Арбовирусы обладают уникальной способностью к репликации как при температуре тела теплокровных позвоночных, так и при сравнительно низких температурах внешней среды. Передача возбудителя у членистоногих из поколения в поколение может осуществляться трансовариально.
Арбовирусы – нетаксономическое, собирательное понятие. В настоящее время насчитывается около 400 арбовирусов, относящихся в основном к семействам тогавирусов, флавивирусов, буньявирусов, аренавирусов, реовирусов, рабдовирусов. Для человека патогенны около 100 из них. Природные очаги арбовирусных инфекций встречаются во всех районах земного шара, но чаще в тропических дождевых лесных зонах из-за обилия видов теплокровных животных и членистоногих. В России встречаются лишь некоторые из арбовирусных инфекций.
Заболевания, вызываемые арбовирусами, могут проявляться в виде трех клинических синдромов:
1) лихорадки недифференцированного типа, часто называемой «денгеподобной», с наличием мелкопятнистой сыпи или без нее и с относительно легким течением;
2) энцефалита, нередко с летальным исходом;
3) геморрагической лихорадки, часто с тяжелым течением и летальным исходом.
Деление это весьма условно, так как один и тот же возбудитель может вызывать заболевание с преобладанием тех или иных симптомов и различной тяжестью течения.
Тогавирусы (лат. toga – плащ) подразделяют на 3 рода:
– альфа-вирусы (арбовирусы антигенной группы А) с типовым видом – вирусом Синдбис;
– рубивирус; единственный представитель – вирус коревой краснухи: арбовирусом не является, передается воздушно-капельным путем;
– пестивирусы, включающие вирусы чумы животных, поражающие слизистые оболочки, арбовирусами также не являются.
Флавивирусы (арбовирусы антигенной группы В), типовой – вирус желтой лихорадки.
Все альфа– и большинство флавивирусов – полихозяинные и циркулируют в природе между позвоночными и членистоногими. Среди них многие служат возбудителями тяжелых заболеваний людей – желтой лихорадки, геморрагических лихорадок, клещевого и японского энцефалитов, денге и т. д. (табл. 21). Все альфа-вирусы экологически связаны с комарами; флавивирусы связаны с комарами и клещами, но часть их выделяется только от позвоночных.
Таблица 21
Наиболее тяжелые и распространенные инфекции человека, вызываемые альфа-вирусами и флавивирусами
Альфа-вирусы имеют геном, представленный одноцепочечной позитивной линейной РНК с молекулярной массой 4,2 МД. Вирионы сферической формы, диаметр 60 – 80 нм. Геномная РНК покрыта капсидом, состоящим из 240 молекул С-белка, тип симметрии кубический, форма правильного дельта-икосаэдра (20 граней). Поверх капсида располагается бислойная липидная мембрана, в которую встроены 240 – 300 гликопротеиновых комплексов, пронизывающих липидную мембрану. В их составе 2 – 3 белка (Е1, Е2, иногда Е3). Белки мембраны взаимодействуют с С-белком, благодаря чему они скрепляют мембрану с нуклеокапсидом. Гликозилированные части белков мембраны всегда находятся на наружной стороне липидного бислоя; комплексы этих белков формируют шипы длиной 10 нм, выступающие наружу с поверхности вириона.
Альфа-вирусы включают 21 серотип; по данным РТГА, реакции нейтрализации и радиоиммунной преципитации их делят на три антигенные группы: 1) комплекс вируса западного энцефаломиелита лошадей (в том числе вирус Синдбис), 2) комплекс вируса восточного энцефаломиелита лошадей и 3) комплекс вируса леса Семлики;
некоторые вирусы находятся вне групп. Альфа-вирусы имеют следующие антигены: видоспецифический суперкапсидный гликопротеид Е2 – антитела к нему нейтрализуют инфекционность вируса; группоспецифический суперкапсидный гликопротеин Е1 (гемагглютинин); родоспецифический – нуклеокапсидный белок С. Гемагглютинирующие свойства альфа-вирусов, как и всех тогавирусов, лучше проявляются в отношении к птичьим, особенно гусиным, эритроцитам.
Для проникновения в клетку вирус использует следующий путь (см. рис. 81, с. 314): адсорбция вируса шипами (белок Е2) на белковых рецепторах клетки, далее – окаймленная ямка – окаймленный пузырек – лизосома. Попавший в лизосому вирус избегает опасности быть переваренным благодаря особым свойствам белков своей внешней оболочки. Эти белки способствуют слиянию примыкающих друг к другу липидных бислоев при кислых значениях рН внутри лизосомы. И как только вирус оказывается в лизосоме, его внешняя оболочка «сплавляется» с мембраной лизосомы, что позволяет нуклеокапсиду выйти в цитоплазму.
Альфа-вирусы размножаются в цитоплазме клетки. Когда нуклеокапсид «раздевается», геномная РНК транслируется на рибосомах, и образуется вирусспецифическая РНК-полимераза. Транскрипция альфа-вирусной РНК происходит следующим образом: сначала синтезируется комплементарная негативная нить РНК, а затем уже на ней синтезируется много копий РНК двух размеров: вирионная РНК 42S и меньшая РНК 26S. Синтез 42S РНК инициируется с 3'-конца, и транскрибируется полная цепь 42S РНК. 26S РНК продуцируется независимо, инициация ее транскрипции начинается со второго сайта инициации, находящегося на расстоянии 2/3 длины от 3'-конца, и продолжается до 5'-конца молекулы матрицы. РНК 42S является вирионной РНК и идет на сборку новых нуклеокапсидов, а также кодирует синтез неструктурных белков. РНК 26S служит матрицей, направляющей синтез четырех структурных белков: капсидного С-белка и оболочечных Е1, Е2, Е3. Каждая из этих РНК транслируется в большой полипептид, который последовательно подвергается каскадному расщеплению. Синтез белков оболочки происходит на мембраносвязанных рибосомах шероховатой эндоплазматической сети, а белок капсида синтезируется на свободных рибосомах цитозоля.
Далее вновь синтезированный капсидный белок присоединяется к реплицированным копиям геномной РНК, что приводит к образованию нуклеокапсидов. Белки внешней оболочки включаются в мембрану эндоплазматической сети и там гликозилируются, потом транспортируются к комплексу Гольджи, где подвергаются дополнительному гликозилированию, и затем переносятся к цитоплазматической мембране. Проходя сквозь нее, нуклеокапсиды обволакиваются участком мембраны, сильно обогащенным белками внешней оболочки, которые встроены в липиды клетки-хозяина. Далее происходит отпочковывание нуклеокапсида таким образом, что, отделяясь от поверхности клетки, он оказывается окруженным замкнутым суперкапсидом.
Лабораторная диагностика – см. разделы «Флавивирусы», «Клещевой энцефалит».
Флавивирусы во многом сходны с альфа-вирусами и по предыдущей классификации в качестве самостоятельного рода входили в состав семейства тогавирусов. Геномная РНК одноцепочечная, линейная, позитивная, ее молекулярная масса 4,0 – 4,6 МД. Диаметр сферических вирионов 40 – 50 нм, иногда 25 – 45 нм (вирус клещевого энцефалита). Строение вирионов принципиально не отличается от такового у альфа-вирусов, но у флавивирусов капсидный белок имеет меньшую молекулярную массу (13,6 кД вместо 30 – 34 кД), а шипы состоят всегда из двух белков, только один из них гликозилирован (Е1) и обладает гемагглютинирующей активностью.
По результатам РПГА все флавивирусы (около 50 серотипов) делят на 4 подгруппы: клещевого энцефалита, японского энцефалита (в том числе лихорадки Западного Нила), желтой лихорадки и лихорадки денге. Важная особенность флавивирусов – наличие растворимого антигена, обладающего типоспецифической активностью в РСК; это неструктурный белок, который образуется в инфицированных клетках в процессе репродукции.
Внутриклеточная репродукция флавивирусов протекает медленнее, чем альфавирусов, но проходит те же стадии с некоторыми отличиями: в инфицированных клетках обнаруживается только один класс мРНК – 45S; репликация вирионной РНК происходит на ядерной оболочке, а созревание вириона идет почкованием через мембраны эндоплазматической сети.
Альфа-вирусы инактивируются протеазами, в то время как флавивирусы устойчивы к ним.
Тогавирусы нестабильны при комнатной температуре, но сохраняются при –70 °C. Легко инактивируются эфиром и дезоксихолатом натрия. Патогенны для различных животных, инфекция легко воспроизводится на мышах при внутримозговом заражении. Особо восприимчивы новорожденные мыши. У чувствительных позвоночных хозяев первичное размножение вируса происходит в миелоидной, лимфоидной ткани или в эндотелии сосудов. Размножение в ЦНС зависит от способности вируса проходить через гематоэнцефалический барьер и инфицировать нервные клетки.
Вирусы размножаются в курином эмбрионе при заражении в желточный мешок или аллантоисную полость. Они хорошо размножаются в культурах клеток почек обезьян и фибробластов куриных эмбрионов, вызывая очаговую мелкозернистую дегенерацию.
Патогенез и клиника. После проникновения через кожу при укусе переносчиком вирус попадает в кровяное русло или лимфатические сосуды. Местом первичного размножения большинства тогавирусов являются эндотелий сосудов и ретикулоэндотелиальные клетки лимфатических узлов, печени, селезенки. После 4 – 7 дней инкубационного периода вирус выходит в кровь. Многие инфекции имеют вторую фазу – локальное размножение вируса в избранных органах: печени, мозге, почках. Первая фаза сопровождается лейкопенией, вторая – лейкоцитозом. Заболевание возникает обычно внезапно, начало его совпадает с выходом возбудителя в кровь.
Неизменным признаком является лихорадка, сопровождающаяся головной болью, миалгией, ломотой в суставах, тошнотой, часто мелкоточечной сыпью и увеличением лимфатических узлов. В значительном числе случаев клинические проявления ограничиваются периодом диссеминации вируса, за которым следует выздоровление без последствий. Лихорадка может осложняться геморрагическими симптомами, обусловленными сосудистыми нарушениями. Появляются кровоточивость слизистых оболочек, геморрагическая сыпь. Лихорадка может иметь двухволновое течение: после короткой ремиссии вновь появляются лихорадка и новые симптомы (альбуминурия, желтуха, менингеальные симптомы, энцефалит, миелит), свидетельствующие о поражении различных органов.
Клещевой энцефалит – заболевание, которое регистрируется в России от Приморья до западных границ в лесной зоне, т. е. местах обитания переносчиков – иксодовых клещей. Как самостоятельная нозологическая единица был выделен в 1937 г. в результате работы в сибирской тайге комплексной экспедиции, возглавляемой Л. А. Зильбером. В составе экспедиции работали видные вирусологи (М. П. Чумаков, В. Д. Соловьев), клиницисты, эпидемиологи. В течение 3 мес. была установлена вирусная природа заболевания, определены особенности вируса и основные эпидемиологические закономерности, в том числе природная очаговость, сезонность в связи с активностью клещей. Одновременно были описаны особенности клиники и патоморфологии клещевого энцефалита, разработаны некоторые пути профилактики и терапии. Дальнейшие исследования этого заболевания показали его распространенность не только у нас в стране, но и за рубежом. Со времени выделения вируса клещевого энцефалита было обнаружено более 500 его штаммов. По степени патогенности для мышей, отношению к культурам ткани фибробластов куриных эмбрионов и другим показателям они были разделены на 3 группы. В третью группу включены слабовирулентные штаммы.
В соответствии с видом переносчика различают два основных типа вируса клещевого энцефалита: персулькатный, восточный (переносчик Ixodes persulcatus) и рицинусный, западный (переносчик Ixodes ricinus). Изучение нуклеотидной последовательности геномной РНК у представителей восточного и западного типов вируса выявило у них 86 – 96 % гомологии. В последние годы в Греции из клещей Rhipicephalus bursa был выделен третий тип вируса. По клиническому течению различают два основных варианта заболевания: восточный, протекающий более тяжело, и западный, имеющий более легкое течение.
Примерно в 80 % случаев заражение происходит трансмиссивным путем при укусе клещей и в 20 % случаев – алиментарным путем при употреблении сырого козьего, коровьего или овечьего молока. Известны также случаи лабораторного заражения. Чаще заболевают дети дошкольного и школьного возрастов, а также работники геологических партий.
Инкубационный период от 1 до 30 дней, чаще 7 – 12 дней от момента присасывания клеща. Начало заболевания обычно острое: озноб, сильная головная боль, подъем температуры до 38 – 39 °C, тошнота, иногда рвота, боли в мышцах, их подергивание, развиваются менингеальные знаки.
Различают три основные формы клещевого энцефалита – лихорадочную, менингеальную и очаговую. Лихорадочная форма составляет 30 – 50 %, признаков менингита нет, исход благоприятный, астения наблюдается нечасто. Менингеальная форма составляет 40 – 60 % заболеваемости, характеризуется менингеальным синдромом с изменениями в ликворе, лихорадка может иметь двухволновый характер, постинфекционный астенический синдром отмечается у 40 % переболевших. Очаговые формы наблюдаются реже (8 – 15 %), характерными признаками являются менингеальные симптомы и очаговые поражения нервной системы разной степени выраженности, сопровождаемые параличами, потерей чувствительности и иной неврологической симптоматикой, поражением стволовых отделов мозга, что ведет к нарушению дыхательной и сердечной деятельности. Летальность высокая, после болезни остаются стойкие осложнения.
Лабораторная диагностика осуществляется в основном вирусологическим и серологическим методами. Вирус выделяют из крови, ликвора, мочи, реже носоглоточных смывов, испражнений и секционного материала при заражении культур клеток. Типируют вирус в различных вариантах реакции биологической нейтрализации вируса. При серологическом методе обнаруживают специфические в отношении вируса антитела в РСК, нейтрализации, РТГА, иммуносорбентных реакциях.
Лечение симптоматическое. Для профилактики заболевания используют убитую культуральную вакцину.
Японский энцефалит – природно-очаговое заболевание, передающееся комарами рода Culex и других родов подсемейства Culicinae. Впервые вирус был выделен в 1933 г. японским ученым М. Хаяши, в России он впервые выделен в 1938 г. во время работы комплексной экспедиции в Приморье А. К. Шубладзе (1940) и А. А. Смородинцевым и В. Д. Неустроевым (1941). Заболевание распространено на юге Восточной Азии, особенно в Японии, где заболеваемость нередко достигает 250 на 100 000 населения. В России японский энцефалит регистрируется в южных районах Приморья. В природе вирус сохраняется не только у членистоногих, но и у различных видов птиц и летучих мышей. Заболевания японским энцефалитом выявляются исключительно в летне-осенний период. Это одно из самых тяжелых заболеваний с наиболее высокой летальностью, составляющей от 20 до 70 и даже 80 %, чаще у лиц пожилого возраста и женщин.
Основу патогенетических механизмов составляют поражения сосудистой системы как в ЦНС, так и во всех органах и тканях, где вирус интенсивно размножается и распространяется гематогенным путем. Инкубационный период от 4 до 14 дней. Болезнь начинается очень остро: температура 39 °C и выше, нарушается сознание, нередко возникают кома, психические расстройства. Смерть может наступить уже в течение нескольких первых часов. При более благоприятном течении развиваются судороги, генерализованное перенапряжение мышц, параличи. Острый период, с самого начала которого отмечается менингеальный синдром, длится не более 8 – 9 дней. В терминальной стадии заболевания характерны поражения жизненно важных стволовых центров и бульбарные нарушения.
Лабораторная диагностика, лечение и профилактика – см. раздел «Клещевой энцефалит».
Желтая лихорадка – острое тяжелое инфекционное заболевание, для которого характерны сильная интоксикация, двухволновая лихорадка, выраженный геморрагический синдром, поражение почек и печени. Из-за высокой летальности (40 – 90 %) и тяжелого течения отнесено к группе особо опасных конвенционных (включенных в международные соглашения) заболеваний.
Возбудитель желтой лихорадки – вирус, открыт в 1901 г. В. Ридом [и др. ], относится к семейству Flaviviridae и обладает свойствами, типичными для флавивирусов. Во внешней среде малоустойчив; быстро погибает под влиянием обычных дезинфектантов, в жидкой среде при температуре 60 °C погибает в течение 10 мин, но в высушенном состоянии сохраняется при 100 – 110 °C в течение 5 ч, в замороженном виде – в течение нескольких лет. В зараженных погибших комарах сохраняется до 4 нед. Вирус хорошо размножается в курином эмбрионе и в различных культурах клеток. Из лабораторных животных к нему восприимчивы белые мыши и обезьяны (Macacus rhesus). В антигенном отношении однороден.
Эпидемиология. Желтая лихорадка – заболевание, имеющее эндемические природные очаги, расположенные в тропическом поясе Центральной и Западной Африки, Южной и Центральной Америки. Эпидемиологически различают два варианта желтой лихорадки.
1. Желтая лихорадка джунглей. Основным резервуаром вируса служат приматы, хотя к вирусу чувствительны некоторые виды других животных (опоссумы, муравьеды, броненосцы и др.). Заражение обезьян (и других хозяев) происходит через укусы комаров: в Америке рода Haemagogus, а в Африке – рода Aedes. Эпизоотии среди обезьян повторяются через 3 – 4 г., после них вся популяция приматов или погибает, или приобретает иммунитет.
2. Городская (классическая) форма желтой лихорадки. Эта форма болезни представляет главную опасность, так как основным источником вируса становится инфицированный человек. Городская желтая лихорадка возникает при попадании человека в природный очаг желтой лихорадки джунглей. Вирус размножается в организме человека, циркулирует в его крови и во внешнюю среду не выделяется. Человек становится заразным с конца инкубационного периода (он продолжается 3 – 6 дней, в отдельных случаях до 10 – 12 дней) и в первые 3 – 4 дня болезни (стадия вирусемии). Заражение происходит преимущественно через укусы самки комара Aedes aegypti. Вирус размножается и накапливается в слюнных железах комара, сохраняется в нем до конца жизни комара (1 – 2 мес.), но потомству комара не передается. Комар нападает на человека обычно днем, ночью – редко; напитавшись, становится заразным при температуре 36 – 37 °C через 4 – 5 сут., при 24 °C – через 11, при 21 °C – через 18 сут. При температуре 18 °C размножение вируса в организме комара приостанавливается, при температуре ниже 15 °C комар становится малоподвижным и поэтому не способен передавать вирус. В связи с этими биологическими особенностями комара эпидемии желтой лихорадки возникают при высокой влажности и жаре, способствующих массовому размножению комаров.
В отличие от желтой лихорадки джунглей, являющейся зоонозной инфекцией, городская желтая лихорадка – антропонозное заболевание с единственным, трансмиссивным путем передачи. К желтой лихорадке восприимчивы все люди. Только дети первых шести месяцев, если они получили пассивный иммунитет от матери, болеют редко.
Патогенез и клиника. В развитии болезни выделяют следующие основные стадии:
I – заражение (вирус проникает в организм);
II – вирус лимфогенно проникает в регионарные лимфатические узлы, где он размножается;
III – вирусемия, вирус разносится кровью по всему организму и циркулирует в ней пять дней. Начало вирусемии соответствует началу болезни;
IV – вирус в силу своей пантропности проникает в клетки различных органов и систем и поражает их, в особенности эндотелий капилляров, вследствие чего нарушается система свертывания крови и развивается геморрагический диатез, при этом особенно страдают печень и почки, что приводит к печеночно-почечной недостаточности;
V – формирование иммунитета и постепенное выздоровление.
Заболевание характеризуется цикличностью: инкубационный период, начальный (общетоксический) период, период выраженного поражения функций отдельных органов и период выздоровления. Однако болезнь может протекать как в легкой форме, так и молниеносно с летальным исходом. Летальность при тяжелой форме болезни достигает 85 – 90 %.
Иммунитет. После перенесенного заболевания остается прочный длительный иммунитет, обусловленный антителами и клетками иммунной памяти.
Лабораторная диагностика включает использование вирусологического, биологического и серологического методов. Вирус из крови может быть выделен путем заражения куриных эмбрионов или культур клеток. Для идентификации вируса используют реакцию нейтрализации. Биологическая проба заключается в заражении кровью больных внутримозговым путем мышей-сосунков, у которых вирус вызывает смертельный энцефалит. Для обнаружения вирусспецифических антител в парных сыворотках, которые берут через 7 – 8 дней, используют РСК, РТГА, РН и другие серологические реакции.
Лечение. Специфических методов лечения нет, проводится патогенетическая терапия. Антибиотики и другие химиопрепараты на вирус не действуют, но их назначают для профилактики вторичных инфекций.
Специфическая профилактика. Основным методом борьбы с желтой лихорадкой является активная иммунизация в эпидемических очагах с помощью живой вакцины, полученной М. Тэйлором в 1936 г. (штамм 17Д). Вакцинируют детей с первого года жизни и взрослых в дозе 0,5 мл подкожно. Поствакцинальный иммунитет развивается через 10 дней после прививки и сохраняется в течение 10 лет. Все лица, направляющиеся в эпидемические очаги и выезжающие из них, подлежат обязательной вакцинации. В соответствии с решением ВОЗ (1989) прививки против желтой лихорадки включены в расширенную программу иммунизации. По данным ВОЗ, в 1998 – 2000 гг. из 1202 заболевших желтой лихорадкой 446 умерли.
Существуют две самостоятельные клинические формы этой болезни. 1. Лихорадка денге, характеризующаяся повышением температуры, сильными болями в мышцах и суставах, а также лейкопенией и формированием лимфаденита. Боли в суставах и мышцах вынуждают больного изменить походку, это и определило название болезни (англ. dandy – франт). 2. Геморрагическая лихорадка денге, для которой помимо лихорадки характерны тяжелая геморрагическая диарея, шок и высокая летальность.
Возбудителем лихорадки денге и геморрагической лихорадки денге является один и тот же вирус, который был выделен и изучен в 1945 г. А. Себином. Этот вирус во многом подобен другим флавивирусам. Он имеет сферическую форму, диаметр вириона около 50 нм, на поверхности суперкапсида расположены выступы длиной 6 – 10 нм. Вирус патогенен для новорожденных мышей при заражении внутрь мозга и в брюшную полость, а также для обезьян; размножается в культурах некоторых перевиваемых клеток. Обладает гемагглютинирующими свойствами. Чувствителен к высокой температуре (быстро инактивируется при 56 °C), эфиру, формалину и другим дезинфектантам, но долго сохраняется в лиофилизированном состоянии и при температуре –70 °C.
По антигенным свойствам различают 4 серотипа (I – IV), которые хорошо дифференцируются с помощью реакции нейтрализации.
Эпидемиология. Единственным резервуаром вируса является человек, а основным переносчиком вируса – комары Aedes aegypti, иногда A. albopictus. Поэтому и зоны очагов лихорадки денге совпадают с ареалами этих комаров: тропические и субтропические районы Африки, Азии, Америки и Австралии. Имеются сведения о существовании джунглевого варианта лихорадки денге в Малайзии, где переносчиком вируса служит комар A. niveus, однако эта форма существенного эпидемиологического значения не имеет. Основную роль играет городская форма лихорадки денге. Эпидемии городской лихорадки денге в определенных эндемичных районах наблюдаются регулярно и охватывают большое количество людей.
Патогенез и клиника. В основе патогенеза болезни лежит нарушение проницаемости сосудов. В результате утечки воды, электролитов и части белков плазмы может наступить шок. Геморрагические явления возникают вследствие тромбоцитопении и дефектов свертывающей системы крови.
Геморрагическая форма лихорадки денге, согласно современным данным, возникает при повторном заражении через несколько месяцев или лет лиц, ранее болевших денге, и обязательно другим серотипом. Нарушения сосудистой проницаемости, активация комплемента и других систем крови в этом случае возможны как следствие повреждающего действия иммунного ответа. Вирус денге размножается в различных органах, но наиболее интенсивно в клетках макрофагально-моноцитарной системы. Инфицированные вирусом макрофаги синтезируют и секретируют фактор, изменяющий проницаемость кровеносных сосудов; ферменты, действующие на С3-компонент комплемента, систему свертывания крови и т. д. Все это оказывает влияние на патогенез заболевания и клинику лихорадки денге и геморрагической лихорадки денге, которая характеризуется широкой вариабельностью.
Основное отличие геморрагической лихорадки от лихорадки денге – развитие шокового синдрома денге, который является главной причиной высокой летальности, достигающей иногда 30 – 50 %.
Диагностика. Для диагностики лихорадки денге используются биологический (внутримозговое заражение 1 – 2-дневных белых мышей), вирусологический (заражение культур клеток) и серологические методы. Нарастание титра вирусспецифических антител определяется в парных сыворотках с помощью РПГА, РСК, РН, ИФМ.
Специфическая профилактика не разработана. Специфического лечения нет.
Используется принцип патогенетической терапии.
Омская геморрагическая лихорадка
Омская геморрагическая лихорадка – эндемическое заболевание, передающееся через укусы клещей рода Dermacentor и иногда путем заражения при прямом и непрямом контакте с ондатрами или водяными крысами. Регистрируется только в некоторых лесостепных районах Омской и Новосибирской областей. Подъем заболеваемости отмечается в мае – июне, затем в сентябре – октябре. Вирус был выделен и изучен в 1947 г. М. П. Чумаковым [и др. ]. Инкубационный период от 2 до 5 – 7, иногда до 10 дней. Начало острое: озноб с температурой до 39 – 40 °C, головная боль, слабость. С 3 – 4-го дня развиваются геморрагические симптомы – мелкоточечная сыпь, кровотечения (носовые, желудочно-кишечные, маточные). Отмечаются также бронхит и пневмония. Лихорадка продолжается от 5 до 15 сут. и обычно заканчивается выздоровлением, на фоне которого иногда наблюдается вторая волна заболевания.
Иммунитет после тогавирусных и флавивирусных инфекций сохраняется длительное время, в ряде случаев формируется стойкий пожизненный иммунитет. В эндемичных областях он может формироваться у людей в результате инаппарантной инфекции. Число людей с антителами к местным арбовирусам увеличивается с возрастом. При выздоровлении раньше всего, на 6 – 7-й день, в крови появляются антигемагглютинины, к концу 2-й нед. обнаруживают комплементсвязывающие антитела, и на 3 – 4-й нед. – вируснейтрализующие антитела, сначала IgM, затем IgG. Особенностью клещевого энцефалита является продолжительность продукции IgM, которые обнаруживаются даже спустя 3 – 6 нед. после начала болезни.
Лабораторная диагностика. Для диагностики альфа-вирусных и флавивирусных инфекций могут быть использованы вирусологический, биологический и серологический методы. Материал от больного человека – кровь (в период вирусемии), ликвор (при развитии признаков менингоэнцефалита), секционный материал (ткань головного мозга) – используется для заражения культур клеток почек и фибробластов куриных эмбрионов, заражения куриных эмбрионов в аллантоисную полость и внутримозгового заражения белых мышей. В культурах тканей вирус обнаруживают по цитопатическому эффекту, бляшкообразованию, реакциям гемадсорбции и гемагглютинации. Типируют вирусы в РСК, РТГА, а также с помощью реакции нейтрализации на мышах или в культуре клеток.
При серологическом методе вирусспецифические антитела в парных сыворотках больного могут быть обнаружены с помощью РСК, РТГА, а также реакцией нейтрализации на мышах или в культуре клеток. Эти реакции считаются положительными при четырехкратном увеличении титра антител. По степени специфичности к этиологическому агенту антитела располагают в следующей последовательности: вируснейтрализующие, комплементсвязывающие, антигемагглютинины (в порядке убывания).
Лечение и профилактика. Специфическое лечение не разработано, ограничиваются проведением симптоматической терапии. Данные о применении интерферона разноречивы, оценка его терапевтического эффекта затруднена из-за малого числа наблюдений. Для профилактики некоторых флавивирусных инфекций используют вакцины. Например, для профилактики весенне-летнего клещевого энцефалита в России используют инактивированную формалином культуральную вакцину из штаммов «Софьин» или «205». Для лечения и профилактики этого заболевания применяют гамма-глобулин, полученный путем гипериммунизации лошадей. Для профилактики желтой лихорадки используют живую аттенуированную вакцину из штамма 17Д, выращенного в курином эмбрионе.
Семейство Bunyaviridae (от названия местности Буньямвера в Африке) является крупнейшим по числу входящих в него вирусов (свыше 250). Это типичная экологическая группа арбовирусов. Подразделяется на пять родов: 1) Bunyavirus (свыше 140 вирусов, объединенных в 16 антигенных групп, и несколько несгруппированных) – передаются в основном комарами, реже мокрецами и клещами; 2) Phlebovirus (около 60 представителей) – передаются в основном москитами; 3) Nairobivirus (около 35 вирусов) – передаются иксодовыми клещами; 4) Uukuvirus (22 антигенно родственных вируса) – также передаются иксодовыми клещами; 5) Hantavirus (более 25 серовариантов). Кроме того, насчитывается несколько десятков буньявирусов, не отнесенных к какому-либо из родов.
Вирусы содержат однонитевую негативную фрагментированную (3 фрагмента) РНК с молекулярной массой 6,8 МД. Нуклеокапсид спиральной симметрии. Зрелые вирионы имеют сферическую форму (см. рис. 78, 11, с. 301) и диаметр 90 – 100 нм. Оболочка состоит из мембраны толщиной 5 нм, покрытой поверхностными выступами длиной
8 – 10 нм. Поверхностные выступы состоят из двух гликопептидов, которые, объединяясь, образуют цилиндрические морфологические единицы диаметром 10 – 12 нм с центральной полостью диаметром 5 нм. Они располагаются таким образом, что образуют поверхностную решетку. Мембрана, на которой фиксированы поверхностные субъединицы, состоит из бислоя липидов. Тяжеподобный нуклеопротеид располагается непосредственно под мембраной. Буньявирусы имеют три основных белка: один белок, связанный с нуклеокапсидом (N), и два гликопротеина (G1 и G2), связанных с оболочкой. Размножаются в цитоплазме клетки, аналогично флавивирусам; созревание происходит путем почкования во внутриклеточные пузырьки, далее вирусы транспортируются на клеточную поверхность. Обладают гемагглютинирующими свойствами.
Буньявирусы чувствительны к действию повышенной температуры, жирорастворителей и колебаниям температуры. Очень хорошо сохраняются при низких температурах.
Буньявирусы культивируют в куриных эмбрионах и в культурах клеток. Они образуют бляшки в клеточных монослоях под агаром. Могут быть выделены при заражении 1 – 2-дневных белых мышей-сосунков.
Из заболеваний, вызываемых буньявирусами, чаще встречаются москитная лихорадка (лихорадка паппатачи), калифорнийский энцефалит, крымская (Конго) геморрагическая лихорадка (КГЛ – Конго).
Патогенез и клиника. Патогенез многих буньявирусных инфекций человека изучен сравнительно мало, а клиническая картина не имеет характерных симптомов. Даже при заболеваниях, протекающих с симптомами поражения ЦНС и геморрагическим синдромом, клиника варьирует от крайне редких тяжелейших случаев с летальным исходом до скрытых форм, которые преобладают.
Переносчиком москитной лихорадки является москит Phlebotomus papatasi. Инкубационный период 3 – 6 дней, начало заболевания острое (лихорадка, головная боль, тошнота, конъюнктивит, светобоязнь, боли в животе, лейкопения). За 24 ч до и через 24 ч после начала болезни вирус циркулирует в крови. Все больные выздоравливают. Специфического лечения нет. Профилактика неспецифическая (москитные сетки, применение репеллентов и инсектицидов).
Калифорнийский энцефалит (переносчик – комар рода Aedes) начинается внезапно сильной головной болью в лобной области, повышением температуры до 38 – 40 °C, иногда рвотой, заторможенным состоянием и судорогами. Реже наблюдаются признаки асептического менингита. Летальные случаи и остаточные неврологические явления редки.
Крымская (Конго) геморрагическая лихорадка встречается на юге нашей страны и во многих других странах. Заражение наступает при укусах клещей родов Hyalomma, Rhipicephalus, Dermacentor, а также контактным путем. Вирус выделен М. П. Чумаковым в 1944 г. в Крыму. Инкубационный период 3 – 5 дней. Начало острое (озноб, лихорадка). В основе заболевания лежит повышение проницаемости сосудистой стенки. Нарастающая вирусемия обусловливает развитие кровоизлияний, тяжелого токсикоза, вплоть до инфекционно-токсического шока с диссеминированным внутрисосудистым свертыванием крови. Летальность – 8 – 12 %.
Иммунитет. В результате перенесенной буньявирусной инфекции формируется длительный иммунитет за счет накопления вируснейтрализующих антител.
Лабораторная диагностика. Буньявирусы могут быть выделены из патологического материала (кровь, секционный материал) при внутримозговом заражении мышей-сосунков, у которых наступают параличи и смерть. Типируют вирусы в реакции нейтрализации, РСК, РПГА и РТГА. При серологическом методе исследуют парные сыворотки в РН, РСК или РТГА (следует учитывать, что у вируса крымской геморрагической лихорадки гемагглютинин отсутствует).
Семейство Arenaviridae (лат. arena – песок) состоит из одного рода, включающего свыше десятка антигенно родственных представителей. Четыре из них вызывают тяжелейшие заболевания, протекающие обычно с геморрагическим синдромом: лимфоцитарный хориоменингит (ЛХМ), лихорадки Ласса, Хунин и Мачупо.
Аренавирусы варьируют как по форме (округлые, овальные, полиморфные), так и по величине (50 – 300 нм), но преимущественно имеют округлую форму и средний диаметр 110 – 130 нм (см. рис. 78.4). Окружены плотной оболочкой, на которой расположены без видимой симметрии тесно прилегающие друг к другу поверхностные отростки, или ворсинки, часто булавовидной формы, длиной около 10 нм. Наиболее характерным морфологическим признаком семейства служит наличие внутри вирусных частиц электронно-плотных зернистых структур, напоминающих песчаные вкрапления, что нашло отражение в названии семейства. Эти включения являются рибосомами клеток-хозяев, располагаются циркулярно, особенно в крупных вирусных частицах, и иногда соединены тонкими нежными волоконцами.
Геном аренавирусов представлен одноцепочечной линейной негативной РНК, состоит из пяти фрагментов, два из которых являются вирусспецифическими (с молекулярной массой 3,2 и 1,6 МД), а остальные, вероятно, происходят из рибосом клеток-хозяев. В состав вирионов входит транскриптаза, которая синтезирует комплементарную нить РНК, функционирующую как мРНК; репродукция происходит в цитоплазме, созревание вирионов – на клеточных мембранах.
Аренавирусы, как все имеющие липидную оболочку вирусы, инактивируются жирорастворителями и детергентами. Легко теряют инфекционность при нагревании, особенно в присутствии двухвалентных катионов, в щелочной (рН выше 8,5) и кислой (рН ниже 5,5) средах. Чувствительны к УФ– и гамма-лучам. Хорошо сохраняются в замороженном и лиофилизированном состоянии. Способны к размножению в курином эмбрионе и в организме грызунов различного возраста в зависимости от вида аренавируса. Из клеточных культур наибольшей чувствительностью к аренавирусам обладает культура клеток почек зеленых мартышек (Vero); вирусы активно в ней размножаются и образуют бляшки под агаровым покрытием.
Аренавирусы не обладают гемагглютинирующими свойствами, но имеют комплементсвязывающий растворимый антиген, который может быть обнаружен в РСК, реакции иммунофлуоресценции и идентичен внутреннему антигену вириона. За счет этого антигена возможны перекрестные реакции между разными аренавирусами. С помощью непрямой иммунофлуоресценции с использованием иммунных сывороток морских свинок и хомячков и иммунных асцитических жидкостей мышей выявляются две антигенные группы аренавирусов – вирусы Старого Света (ЛХМ и лихорадки Ласса) и Нового Света (вирусы Мачупо и Хунин). Реакция нейтрализации характеризуется высокой специфичностью и позволяет идентифицировать отдельные виды вирусов.
Лимфоцитарный хориоменингит широко распространен практически повсеместно, в том числе в России. ЛХМ – зооантропоноз. Основной хозяин вируса – серые домовые мыши, иногда сирийские хомячки и полевки. Человек может заражаться от инфицированных животных аэрозольным и алиментарным путем, а также через укусы гамазовых клещей. У человека наблюдается прямое повреждающее действие вируса. Он размножается в лимфатических узлах, откуда распространяется по всей ретикулоэндотелиальной ткани (системе мононуклеарных фагоцитов), вызывая повреждение капилляров, нарушение их проницаемости и обширные кровоизлияния. Инкубационный период 6 – 7 дней; клинически ЛХМ
протекает как гриппоподобное заболевание, иногда с картиной асептического менингита или менингоэнцефалита. Сопровождается лейко– и тромбоцитопенией. Как правило, протекает благоприятно и заканчивается полным выздоровлением. Имеются данные о возможном тератогенном действии вируса ЛХМ на плод при внутриутробном инфицировании.
Лихорадка Ласса – эндемичная инфекция саванн к югу от Сахары (Нигерия, Либерия, Сьерра-Леоне). Основным резервуаром вируса является многососковая крыса Mastomys natalensis, которая выделяет большое количество вируса с мочой. Вирус передается путем контакта от человека к человеку (во время вспышек), от животных аэрогенным, алиментарным путем, возможно заражение через поврежденную кожу. Все это обусловливает возникновение внутрибольничных и семейных вспышек, заболеваний медицинского персонала. Вирус Ласса относится к числу наиболее опасных для человека, работа с ним требует строжайших мер предосторожности. Патогенез такой же, как при ЛХМ, но с преимущественным поражением внутренних органов. Инкубационный период 7 – 8, иногда до 20 дней. Начало заболевания постепенное: нарастает интоксикация, появляются геморрагический диатез, язвенный фарингит, желудочные боли, позже – отек лица и шеи, выпот в брюшную и плевральную полости и в перикард. Летальность в среднем около 43 %, во время отдельных эпидемических вспышек – до 67 %.
Боливийская геморрагическая лихорадка (Мачупо) имеет природно-очаговый характер, встречается в северо-восточных провинциях Боливии Манора и Итенес. Вирус персистирует в организме мышевидного грызуна – хомячка Calomys callosus, от которого передается человеку через воду и пищу, загрязненные мочой грызуна. Возможно также заражение воздушно-капельным путем в первые дни болезни при контакте с больным, когда вирус выделяется из верхних дыхательных путей. Инкубационный период 7 – 14 дней. Клиника заболевания складывается из признаков, присущих другим геморрагическим лихорадкам, особенностью является дрожание конечностей и языка, протеинурия; в период выздоровления наблюдаются выпадение волос и ломкость ногтей. Прогноз благоприятный, но при отдельных вспышках летальность достигает 30 %. У погибших обнаруживаются глубокие изменения в разных органах, особенно в печени (кровоизлияния, участки некроза паренхимы).
Аргентинская геморрагическая лихорадка (Хунин) – заболевание, встречающееся в центральной части Аргентины (провинции Буэнос-Айрес, Кордова и Санта-Фе), где ежегодно регистрируют до 3,5 тыс. случаев. Резервуар и источник вируса Хунин – грызуны Calomys musculinus и Calomys laucha; вирус также удается выделить от их экзопаразитов. У грызунов наблюдается персистентная инфекция, и вирус длительно и массивно выделяется с мочой. Человек заражается при вдыхании пыли или при употреблении продуктов, загрязненных грызунами. Не исключен трансмиссивный путь заражения. Инкубационный период 7 – 16 дней. Начало постепенное: нарастают признаки интоксикации, с 5-го дня – явления геморрагического диатеза. Заболевание протекает на фоне нарушения функции почек, нервной и сердечно-сосудистой систем. Исход в общем благоприятный, хотя летальность иногда может достигать 10 – 20 %.
Иммунитет. При аренавирусных инфекциях происходит накопление антител, динамика которого хорошо изучена. Антитела, определяемые методом непрямой иммунофлуоресценции, обычно появляются на 2 – 3-й нед. заболевания, когда состояние больного начинает улучшаться, причем во многих случаях находят IgA-антитела. Комплементсвязывающие и вируснейтрализующие антитела удается обнаружить значительно позже.
Лабораторная диагностика. При применении вирусологического и биологического методов для выделения вирусов в качестве материала используют смывы из носоглотки, кровь, ликвор, мочу, плевральный выпот, секционный материал. Выбор тест-объекта для заражения определяется патогенностью предполагаемого возбудителя для лабораторных животных (белые мыши, морские свинки, обезьяны различного возраста; используется заражение в мозг), а также разной чувствительностью к нему клеточных культур. Чаще используются клетки Vero, амниона человека, эмбриона мышей (цитопатический эффект с внутриклеточными включениями, образование бляшек). Идентифицируют вирусы в РСК, реакции нейтрализации или непрямой иммунофлуоресценции.
Наиболее доступными методами серологической диагностики служат реакция непрямой иммунофлуоресценции (антитела появляются в более ранние сроки и сохраняются дольше), а также РСК и РПГА.
Лечение и специфическая профилактика. Для большинства аренавирусных инфекций специфическое лечение не разработано. Единственным эффективным методом лечения лихорадки Ласса является применение гипериммунной сыворотки от переболевших или иммунизированных людей. Сыворотку от реконвалесцентов следует применять с осторожностью, так как вирус может персистировать в крови в течение нескольких месяцев после острой инфекции. Для профилактики перспективно применение живых аттенуированных вакцин, которыми в первую очередь должны иммунизироваться медицинские и лабораторные работники, а также лица, контактирующие с грызунами.
Семейство Reoviridae состоит из 3 родов: реовирусы, ротавирусы (см. главу 51) и орбивирусы. Представители орбивирусов – вирусы колорадской клещевой лихорадки, вирусы группы Кемерово и др. – являются типичными арбовирусами, передаваемыми комарами Aedes, мокрецами и клещами. Эти вирусы в основном имеют ветеринарное значение, но некоторые из них могут вызывать легкие лихорадочные заболевания у человека. Орбивирусы имеют сферическую форму, диаметр вириона 60 – 80 нм (см. рис. 78.9). Геном представлен двунитевой РНК, состоящей из 10 фрагментов и имеющей молекулярную массу 12 МД. Имеется вирионная транскриптаза. Капсид двухслойный, 32 капсомера кольцевидной формы (лат. orbis – кольцо) упакованы в икосаэдр. Пушистый, трудно различимый даже при электронной микроскопии белковый слой покрывает снаружи основной капсид. Суперкапсид отсутствует. Репликативный цикл аналогичен циклу реовирусов. Орбивирусы чувствительны к низким значениям рН, инактивируются при рН менее 3,0.
Колорадская клещевая лихорадка. Заболевание регистрируется на Тихоокеанском побережье США, в основном в горной сельской местности. Вирус передается через укусы инфицированного клеща Dermacentor andersoni и циркулирует в крови в острой стадии заболевания. Инкубационный период 4 – 6 дней. Начало острое – озноб, миалгия, головная боль, тошнота, рвота. Лихорадка имеет двухволновый характер, наблюдается лейкопения. Исход благоприятный. Иммунитет после заболевания гуморальный, длительный.
Лабораторная диагностика: в течение первых 14 дней заболевания вирус выделяют из крови путем внутримозгового или внутрибрюшинного заражения молодых хомячков или новорожденных мышей. Комплементсвязывающие и вируснейтрализующие антитела появляются на 2-й нед. болезни и сохраняются до 3 лет.
Геморрагическая лихорадка с почечным синдромом
Геморрагическая лихорадка с почечным синдромом (ГЛПС) – острое тяжелое инфекционное заболевание, характеризующееся системным поражением мелких сосудов, геморрагическим диатезом, гемодинамическими расстройствами и своеобразным поражением почек (интерстициальный нефрит с развитием острой почечной недостаточности).
Возбудитель ГЛПС относится к роду Hantavirus семейства Bunyaviridae. Хантавирусы имеют сферическую форму, липидсодержащую оболочку; диаметр вириона 90 – 120 нм. Оболочка имеет выступы, образованные гликопротеидами. Геном вируса – сегментированная одноцепочечная негативная РНК. Три сегмента: большой (L), средний (M) и малый (S) кодируют вирусную РНК-полимеразу, оболочечные гликопротеиды (G1 и G2) и нуклеокапсид соответственно. Инициация транскрипции у хантавирусов происходит так же, как и у вируса гриппа А: с помощью вирионной эндонуклеазы, входящей в комплекс РНК-полимеразы, отрезается кэп (шапочка) от клеточной мРНК. Кэп служит в качестве праймера – затравки для синтеза вирионной мРНК. Жизненный цикл хантавирусов также сходен с таковым вируса гриппа. Как все РНК-содержащие вирусы, хантавирусы подвержены частым мутациям. К настоящему времени род Hantavirus включает уже более 25 серологически и генетически отличающихся друг от друга вирусов. Их делят на вирусы Старого Света (Хантаан, Сеул, Пумала, Добрава/Белград, Хабаровск, Таиланд, Тоттопалаяма и др.) и вирусы Нового Света (Проспект Хилл, Син Номбре, Нью-Йорк, Андес, Байон, Лагуна Негра и др.). Они вызывают две клинические формы хантавирусной инфекции у людей: ГЛПС (возбудители – Хантаан, Сеул и др.) и хантавирусный кардиопульмональный синдром (ХКПС), возбудителями которого являются вирусы Син Номбре, Нью-Йорк, Байон, Андес, Лагуна Негра и, возможно, другие.
Хантавирусы распространены повсеместно.
В г. Сочи выделен новый подвид вируса Добрава – До/Сочи, его носитель – кавказская лесная мышь Apodemus ponticus.
Эпидемиология. Заражение хантавирусами происходит от грызунов воздушнопылевым, контактным или алиментарным, но не трансмиссивным путем. Вирусы, передающиеся таким путем, названы робовирусами (англ. rodent – грызун и borne – рожденный). Высокая заболеваемость ГЛПС (в 1997 г. в России зарегистрирован 20 921 случай заболевания) обусловлена наличием на территории страны активно действующих природных очагов, особенно в Поволжье, Уральском и Волго-Вятском районах, а также в Приморском крае. Установлена естественная инфицированность хантавирусами более чем 50 видов мелких млекопитающих, принадлежащих к различным семействам из отрядов грызунов и насекомоядных. Широкое признание получила гипотеза, согласно которой каждый хантавирус в природных условиях связан с единственным видом мелких млекопитающих. Однако вопрос о реальном количестве существующих в природе хантавирусов и видов их основных носителей требует дальнейшего изучения.
У животных при заражении хантавирусами развивается бессимптомная инфекция, во время которой вирусные антигены могут быть обнаружены во многих органах, преимущественно в легких. Вирус длительное время выделяется у животных со слюной, фекалиями и мочой. Заражение человека происходит через воздух. Вирус вместе с аэрозолем, содержащим продукты жизнедеятельности грызунов, через верхние дыхательные пути попадает в легкие, где условия для его размножения наиболее благоприятны, затем с кровью переносится в другие органы и ткани. Заражения здоровых людей от больного не происходит.
Патогенез. Проникнув в организм, вирус циркулирует в крови, поражая стенки капилляров и мелких вен, особенно в сосудах мозгового слоя почек. Вирус размножается в клетках почек, селезенки, легких и в эндотелии сосудов. Он содержится в крови и моче больных в течение всего лихорадочного периода. Иммунные комплексы вирусный антиген + антитело откладываются в клетках клубочков и извитых канальцев почек, что и вызывает почечный синдром.
Клиника. Инкубационный период 11 – 23 дня. Болезнь начинается с озноба, повышения температуры до 39 – 40 °C. Отмечаются сильная головная боль, гиперемия лица и шеи, инъекция сосудов склеры, с 3 – 5-го дня болезни появляется геморрагическая сыпь на коже и возникает олигоурия, в тяжелых случаях – анурия и уремия. Выздоровление медленное. Функции почек восстанавливаются через 1 – 3 мес. полностью. Перехода ГЛПС в хроническую форму не бывает. Наряду с тяжелой формой ГЛПС (геморрагический нефрозонефрит) наблюдаются стертые, легкие и среднетяжелые формы болезни. Летальность варьирует от 0 до 44 %.
Иммунитет после перенесенного заболевания стойкий, длительный, обусловлен вируснейтрализующими антителами и клетками иммунной памяти.
Лабораторная диагностика. Хантавирусы плохо размножаются в культуре клеток, и для них нет лабораторной модели инфекции, поэтому их трудно выделить и идентифицировать. Практически единственным методом прямого обнаружения хантавирусов является ПЦР. Все остальные методы могут лишь косвенно указывать на присутствие вируса в исследуемом материале. ПЦР позволяет непосредственно обнаружить вирус в различных биологических образцах, взятых как от животных, так и от человека.
Лечение. Применение интерферона и его индукторов. При острой почечной недостаточности, уремии и геморрагическом нефрозонефрите необходим гемодиализ. В России создана убитая вакцина против ГЛПС на основе штамма К-27 вируса Пумала.
Рабдовирусы и филовирусы
Рабдовирусы – возбудители бешенства и везикулярного стоматита
Бешенство – острое инфекционное заболевание, вызываемое рабдовирусом, – возникает при укусе человека больным животным или при попадании на поврежденную кожу или слизистую оболочку слюны больного животного. Эта инфекция центральной нервной системы почти всегда заканчивается летально.
Первые упоминания о заболевании, передающемся через укус собаки и весьма напоминающем по описанию бешенство, встречаются в клинописных глиняных табличках Древней Месопотамии, относящихся к III тысячелетию до н. э. Вирус был выделен и аттенуирован путем пассажей на мозге кролика в 1882 г.
Л. Пастером.
Везикулярный стоматит – заболевание лошадей, крупного рогатого скота и свиней, иногда людей, протекающее у них доброкачественно, – также вызывается рабдовирусом. Для человека этот вирус слабо патогенен. Он изучен лучше всех рабдовирусов.
Рабдовирусы – семейство, в котором насчитывается 3 рода: Vesiculovirus (10 вирусов млекопитающих, типовой – вирус везикулярного стоматита, или ВВС); Lyssavirus (6 серологически родственных вирусов, типовой – вирус бешенства);
Sigmavirus (единственный представитель – вирус сигма-дрозофил). Неклассифицированными остаются 6 вирусов, вызывающих заболевания рыб, и 13 вирусов, поражающих растения. Для рабдовирусов характерна палочковидная или пулевидная форма вириона (см. рис. 78.8): длина 60 – 400 нм, ширина 60 – 85 нм. Частицы окружены двухслойной липидной мембраноподобной оболочкой с выступающими шипами длиной 10 нм и шириной 3 нм. Под оболочкой находится рибонуклеокапсид, имеющий спиральный тип симметрии, в котором при электронной микроскопии видны полосы. Геном рабдовирусов представлен негативной однонитевой линейной нефрагментированной молекулой РНК с молекулярной массой 3,8 МД; обнаружены пять генов, кодирующих синтез структурных белков, и определен порядок их расположения. На 3'-конце располагается ген нуклеокапсидного белка N (50 кД). За ним следует ген белка NSV (30 кД) – одного из компонентов вирусной транскриптазы, входящего в состав нуклеокапсида. Следующий ген кодирует матриксный белок М (30 кД) и выстилающий двуслойную липидную мембрану с внутренней стороны. Далее идет ген белка G (65 кД) – внешнего гликопротеида вирусного суперкапсида. На 5'-конце находится ген высокомолекулярного компонента вирусной транскриптазы – белка L (160 кД).
Взаимодействие рабдовирусов с клетками и их репродукция идут по следующей схеме: адсорбция вируса на клетке (гликопротеид G) – проникновение в клетку путем эндоцитоза – слияние с мембраной лизосомы – депротеинизация вируса. Под действием вирионной транскриптазы (РНК-полимеразы) образуется кРНК, служащая матрицей для синтеза вРНК и выполняющая функцию мРНК. Далее синтезируются вирусспецифические белки на рибосомах клетки-хозяина. Белки М и G встраиваются в плазматическую мембрану. Образующийся при взаимодействии вРНК с белками N, L и NS нуклеокапсид, проходя через мембрану, обволакивается суперкапсидом. Созревший вирион отделяется от клетки путем почкования.
Вирус бешенства по строению и особенностям внутриклеточной репродукции очень сходен с вирусом везикулярного стоматита. Важной особенностью этих вирусов является выраженное угнетение процессов биосинтеза белка в клетке-хозяине за счет блокирования инициации трансляции.
Существует несколько серовариантов вирусов везикулярного стоматита, которые различаются по белку G, являющемуся также протективным антигеном.
Вирусы хорошо размножаются в куриных эмбрионах, клетках почек новорожденных хомячков и в культурах диплоидных клеток человека. В культурах клеток вирус везикулярного стоматита обычно вызывает цитопатический эффект и гибель клеток, иногда – симпластообразование.
Вирус бешенства имеет широкий круг хозяев. Чувствительны к нему все теплокровные животные. Степень патогенности разных штаммов вирусов бешенства для различных животных не одинакова. У некоторых видов летучих мышей вирус адаптировался только к слюнным железам, не вызывая признаков заболевания; заражение других животных всегда ведет к гибели.
Штаммы вирусов бешенства, циркулирующие в природе у животных, называются уличными. Они вызывают заболевания с довольно длительным инкубационным периодом и обычно образуют специфические тельца-включения в цитоплазме клеток. У зараженных животных может наблюдаться длительный период возбуждения и агрессивности. Вирус может проникать в слюнные железы и ЦНС. Последовательные пассажи в мозге кроликов приводят к образованию фиксированного вируса, не способного в дальнейшем размножаться в каких-либо клетках, кроме нервных. Фиксированный вирус размножается быстро, инкубационный период короткий, включения в клетках обнаруживаются редко. Этот вирус патогенен только для кроликов.
Вирус бешенства мало устойчив во внешней среде, быстро инактивируется при действии на него ультрафиолетовых лучей или солнечного света. При кипячении он погибает через 2 мин, при 60 °C – через 5 мин. Быстро инактивируется растворами лизола, хлорамина, фенола, жирорастворителями и трипсином. В трупах животных, особенно при низких температурах, сохраняется до 4 мес.
Эпидемиология. Бешенство – типичный зооантропоноз. Основным источником и резервуаром вируса являются дикие и домашние плотоядные животные: собаки, кошки, волки, шакалы, лисицы, скунсы, мангусты, летучие мыши. Заболевание обычно передается через укус или при ослюнении поврежденной кожи или слизистой оболочки, так как вирус размножается в слюнных железах животного. Больное животное заразно не только во время болезни, но и в инкубационном периоде за 2 – 3 дня, иногда больше, до появления первых признаков заболевания.
Патогенез и клиника. Первичное размножение вируса бешенства происходит в мышечной ткани вблизи входных ворот, затем возбудитель внедряется в рецепторы периферических чувствительных нервов и по эндоневрию шванновских клеток или по периневральным пространствам попадает в ЦНС. Там вирус размножается в нейронах гиппокампа, продолговатого мозга, черепных нервов, симпатических ганглиев, вызывая воспалительные, дистрофические и некротические изменения нервной системы. В этот период вирус также размножается в клетках слюнных желез. Наиболее короткий инкубационный период бывает при укусе головы и кистей рук, более длительный – при укусе нижних конечностей; в целом варьирует от 8 до 90 дней. В развитии заболевания выделяют три стадии: предвестников (депрессии), возбуждения, параличей. Сначала появляются беспокойство, страх, тревога, неприятные ощущения в области укуса. Через 1 – 3 дня наступают выраженное возбуждение, судороги дыхательной и глотательной мускулатуры, появляется выраженная водобоязнь (гидрофобия – второе название этой болезни). В этот период характерны агрессивность, слуховые и зрительные галлюцинации. Далее развиваются параличи, и через 5 – 7 дней от начала болезни наступает смерть от паралича сердечного или дыхательного центров.
Иммунитет. Поскольку заболевание бешенством заканчивается смертью, постинфекционный иммунитет не изучен. Установлено, что антитела могут образовываться во время заболевания и после вакцинации. Поствакцинальный иммунитет сохраняется до 1 года.
Лабораторная диагностика проводится с использованием вирусоскопического, биологического и серологического методов. У погибших животных и людей в гистологических срезах или мазках-отпечатках исследуют мозговую ткань (кору больших полушарий и мозжечка, аммонов рог, продолговатый мозг), а также ткань слюнных желез. В пирамидальных клетках мозговой ткани обнаруживают специфические эозинофильные включения (тельца Бабеша – Негри), располагающиеся в цитоплазме около ядра и являющиеся скоплениями вирусных нуклеокапсидов. Их появление обусловлено затрудненным созреванием вирионов в нервных клетках. Тельца Бабеша – Негри выявляют специальными методами окраски (по Романовскому – Гимзе, Манну, Туревичу, Муромцеву и др.). Они имеют характерную зернистую структуру с базофильными гранулами на ацидофильном фоне, размер их – 4 – 10 мкм (см. цв. вкл., рис. 89). Недостатком метода является то, что воспользоваться им можно только после смерти человека или животного.
Вирусный антиген может быть обнаружен в тех же препаратах с помощью прямой или непрямой реакции иммунофлуоресценции.
Выделить вирус бешенства удается из слюны больных людей или животных, а также из свежего секционного материала (мозговая ткань, ткань подчелюстных слюнных желез) путем внутримозгового заражения белых мышей и кроликов или хомячков – внутримышечно. У животных развиваются параличи с последующей гибелью. Мозг погибшего животного должен быть исследован для обнаружения телец Бабеша – Негри или вирусного антигена с помощью реакции иммунофлуоресценции.
Антитела могут быть выявлены у вакцинированных лиц с помощью реакций нейтрализации, связывания комплемента, иммунофлуоресценции, а также иммуносорбентных реакций (РИМ и ИФМ).
Специфическая профилактика и лечение. Профилактика заключается в борьбе с бешенством среди животных и предупреждении развития болезни у людей, подвергшихся укусам или ослюнению больным животным. Программу ликвидации бешенства наземных животных необходимо рассматривать в двух аспектах: 1) искоренение городского собачьего бешенства и 2) оздоровление природных очагов рабической инфекции. Опыт многих стран убедительно доказывает возможность контроля за эпизоотиями городского типа путем регистрации и иммунизации собак. Однако для полной ликвидации рабической инфекции необходимо оздоровление ее природных очагов, причем истребление диких плотоядных животных дает лишь временный и локальный результат и грозит развитием нежелательных экологических последствий. За рубежом уже имеется большой положительный опыт профилактики бешенства среди диких животных (лис, енотов) путем скармливания им приманок, содержащих вакцину. Весьма перспективными в этом плане считаются оральные антирабические вакцины: живая модифицированная цельновирионная вакцина из аттенуированных вакцинных штаммов (САД-Берн, Внуково-32) и рекомбинантная генно-инженерная оральная вакцина с использованием в качестве вектора вируса осповакцины, экспрессирующего ген G-протеина вируса бешенства.
При укусах или ослюнении необходимо тщательно промыть рану или кожу в месте попадания слюны мыльной водой, рану прижечь спиртовым раствором йода и начать проведение специфической профилактики антирабической вакциной и антирабическим гамма-глобулином. Вместо использовавшейся ранее весьма реактогенной вакцины Ферми (из мозговой ткани овец, зараженных фиксированным вирусом) сейчас для профилактики бешенства рекомендована антирабическая инактивированная культуральная вакцина, которая изготовлена на культуре клеток, инфицированных аттенуированным вирусом бешенства (штамм Внуково-32). Экстренная лечебно-профилактическая вакцинация проводится вакциной или вакциной в сочетании с антирабическим гамма-глобулином по схемам, указанным в наставлениях к их применению. Схема вакцинации определяется степенью тяжести укуса, его локализацией, временем, прошедшим после укуса, информацией об укусившем животном и другими обстоятельствами.
Филовирусы: вирусы Марбург и Эбола
Эти возбудители заболеваний, протекающих по типу геморрагических лихорадок, описаны сравнительно недавно и мало изучены. Они отнесены в отдельное семейство Filoviridae с единственным родом Filovirus. Вирусы имеют нитевидную или цилиндрическую форму и иногда внешне напоминают рабдовирусы. Геном их также представлен РНК. Хотя внешний вид и цитоплазматические включения в зараженных клетках слегка и напоминают таковые при бешенстве, по строению вирусы Марбург и Эбола отличаются от рабдовирусов, к которым их относили ранее, и не имеют антигенного родства ни с ними, ни с каким-либо другим из известных вирусов.
По морфологическим особенностям и размерам вирусы Марбург и Эбола во многом сходны. Это прямые (вирус Эбола) или извитые различным образом нити (вирус Марбург – спиральные, в виде цифры 6, V-образные); концы их закруглены. Иногда встречаются формы с нитевидными ответвлениями. Наружный диаметр вирионов – 70 – 100 нм, средняя длина – 665 нм, но в электронно-микроскопических препаратах встречаются частицы длиной до 1400 нм (вирус Эбола).
Геном вируса Эбола представлен одной молекулой одноцепочечной негативной РНК с молекулярной массой 4,0 – 4,2 МД. В центре вириона располагается тяж диаметром 20 нм, который составляет основу цилиндрического спирального рибонуклеопротеида вируса диаметром 30 нм. Между рибонуклеопротеидом и оболочкой вириона располагается промежуточный слой толщиной 3,3 нм. Вирион имеет наружную липопротеиновую мембрану толщиной 20 – 30 нм, на поверхности которой на расстоянии 10 нм друг от друга располагаются шипы длиной 7 – 10 нм. В составе вириона, так же как и у вируса Марбург, 7 структурных белков.
В материале от больного вирусы Марбург и Эбола достаточно устойчивы к нагреванию. В крови и плазме они инактивируются при температуре 60 °C в течение 30 мин, в 10 %-ной суспензии печени больных обезьян – при 56 °C в течение 1 ч, под действием УФ-лучей – в течение 1 – 2 мин. В суспензии печени под действием ацетона, метанола или формалина инактивируются в течение 1 ч. Чувствительны к действию жирорастворителей – этанола, хлороформа и дезоксихолата натрия. Хорошо сохраняются при – 70 °C, в лиофилизированном виде (более 1 года – срок наблюдения).
Вирусы Марбург и Эбола различаются по антигенным свойствам. Сыворотка реконвалесцентов и иммунные сыворотки морских свинок по-разному реагируют с этими вирусами. Углубленные исследования антигенных взаимоотношений между вирусами Марбург и Эбола подтвердили их различия. Антигены их могут быть выявлены при помощи реакций иммунофлуоресценции, связывания комплемента и нейтрализации на морских свинках. У вируса Эбола известны 2 сероварианта – суданский и заирский. Вирусы хорошо размножаются в культурах клеток обезьян, патогенны для морских свинок и в эксперименте вызывают у различных видов обезьян заболевание, патогенез и клиника которого напоминают заболевание у человека.
Марбургская лихорадка. Марбургский вирус впервые обнаружен в 1967 г. во время вспышки геморрагической лихорадки в Югославии и Германии среди людей, контактировавших с мартышками из Уганды (31 случай). Вирус передается и при прямом контакте от больных к здоровым людям. Болезнь эндемична для стран Восточной и Южной Африки (ЮАР, Кения, Зимбабве). Возможны также случаи заболевания в других странах при въезде лиц, находящихся в инкубационном периоде, который составляет 3 – 9 дней. Начало болезни острое: быстро наступает прострация, выраженная лихорадка (иногда двухволнового типа). В первые дни вирус обнаруживается в крови, моче и отделяемом носоглотки. Позже появляется сыпь, на мягком нёбе – везикулы, переходящие в язвочки. Повреждается печень, развиваются почечная недостаточность, иногда психические и нервные нарушения. Продолжительность заболевания – до 2 нед., выздоровления – до 3 – 4 нед.; в этот период отмечается сонливость, адинамия, выпадение волос. Летальность – 30 – 50 %. У переболевших мужчин вирус сохраняется в сперме до 3 мес.
Лихорадка Эбола. Вирус Эбола (по названию реки в Заире) был впервые выделен в 1976 г. в Судане и Заире при вспышке тяжелейшей геморрагической лихорадки. Заболело свыше 500 человек, 350 из них умерли. В последующие годы спорадические случаи заболевания регистрировались в этом же регионе. Антитела к вирусу обнаружены у жителей стран Центральной Африки. Природные очаги вируса не выявлены. Предполагается, что заболевание является зооантропонозом (резервуар вируса – дикие грызуны или летучие мыши). Предположение основано на периодическом появлении заболевания в результате заражения в джунглях, но заболеваемость прекращается до того, как достигнет эпидемического уровня. Заболевают в основном взрослые, они становятся источником заражения окружающих в семье и больнице. Болезнь передается при тесном контакте с больными, особенно с кровью или выделениями, содержащими кровь, а также с мокротой и спермой. Поэтому не исключен воздушно-капельный (особенно среди медицинских работников) или половой путь заражения. Инкубационный период 3 – 16 дней. Начало болезни острое: сильнейшая головная боль, лихорадка, миалгия, тошнота, боли в груди. Затем появляются сыпь, профузный понос с кровью, приводящий к обезвоживанию; развиваются кровотечения. Выздоровление медленное. Летальность – до 90 %.
Ранняя диагностика лихорадок Марбург и Эбола заключается в обнаружении вируса или его антигенов в крови, моче, геморрагическом экссудате при заражении культуры клеток обезьян или с помощью реакций нейтрализации, связывания комплемента, ИФМ, РИФ и др. В более поздних стадиях заболевания и в период реконвалесценции диагностическим признаком служит обнаружение комплементсвязывающих (со 2 – 3-й недели) или вируснейтрализующих антител.
Лечение симптоматическое: поддержание водно-солевого баланса, функции почек и печени, борьба с геморрагическим синдромом. Очень хороший эффект оказывает переливание плазмы реконвалесцентов, особенно в сочетании с введением интерферона.
Профилактика. Выявленных больных изолируют. Следует применять исключительные меры предосторожности для предупреждения контактов медицинского персонала с кровью, слюной, мокротой, мочой больных (работа с индивидуальными средствами защиты). Если однажды вирусы Марбург и Эбола были переданы людям при контакте с неизвестным резервуаром, не исключена возможность, что они смогут адаптироваться к прямой передаче от человека к человеку, в результате чего эти тяжелые инфекции смогут внедриться из природных очагов в регионы, где естественных хозяев не существует. Разработаны рекомендации ВОЗ по предупреждению завоза инфекции с обезьянами и другими животными в неэндемичные страны.
Специфическая профилактика. В США и в России созданы вакцины для профилактики лихорадки Эбола.
Поксвирусы. Вирус оспы человека
Семейство Poxviridae (англ. pox – оспа + вирусы) включает два подсемейства: Chordopoxvirinae, куда входят вирусы оспы позвоночных, и Entomopoxvirinae, объединяющее вирусы оспы насекомых. Подсемейство вирусов оспы позвоночных, в свою очередь, включает 6 самостоятельных родов и несколько неклассифицированных вирусов. Представители каждого рода имеют общие антигены и способны к генетической рекомбинации. Роды отличаются друг от друга по процентному содержанию и свойствам ДНК, расположению и форме нитеобразных структур на внешней оболочке вириона, устойчивости к эфиру, гемагглютинирующим свойствам и другим признакам.
Представители рода Orthopoxvirus – вирусы натуральной оспы, оспы обезьян и осповакцины. Вирус натуральной оспы вызывает особо опасную инфекцию человека, которая усилиями мирового сообщества ликвидирована в середине 70-х гг. ХХ в. Вирус оспы обезьян патогенен не только для приматов: описаны случаи заболевания у людей, по течению напоминающие натуральную оспу. Учитывая это обстоятельство, полезно иметь общие представления о микробиологии натуральной оспы.
Наиболее изученным представителем рода Orthopoxvirus является вирус осповакцины, который произошел либо от вируса коровьей оспы, либо от вируса натуральной оспы. Он адаптирован к организму человека и долгое время использовался как первая живая вирусная вакцина.
Вирус натуральной оспы и другие представители этого рода – самые крупные из всех известных вирусов животных. Это один из самых высокоорганизованных вирусов животных, приближающийся по строению некоторых структур к бактериям. Вирион имеет форму кирпича с несколько закругленными углами и размер 250 – 450 нм. Он состоит из хорошо различимой сердцевины (нуклеоида, или ядра), содержащей геномную двунитевую линейную молекулу ДНК с молекулярной массой 130 – 200 МД, ассоциированную с белками. По обе стороны от нуклеоида расположены овальные структуры, называемые белковыми телами. Сердцевина и боковые тела окружены четко различимой поверхностной оболочкой с характерной бороздчатой структурой. Стенка сердцевины состоит из внутренней гладкой мембраны толщиной 5 нм и наружного слоя из регулярно расположенных цилиндрических субъединиц. Вирус имеет химический состав, напоминающий бактериальный: он содержит не только белок и ДНК, но и нейтральные жиры, фосфолипиды, углеводы.
Поксвирусы – единственные из ДНК-содержащих вирусов, размножающиеся в цитоплазме клетки-хозяина. Цикл репродукции вируса складывается из следующих основных этапов. После адсорбции на поверхности чувствительной клетки вирус проникает в цитоплазму путем рецепторопосредованного эндоцитоза, и далее происходит двухэтапное «раздевание» вириона: сначала под действием протеаз клетки разрушается наружная оболочка, происходит частичная транскрипция и синтез сверхранних мРНК, кодирующих синтез белка, ответственного за дальнейшее раздевание. Параллельно с этим идет репликация вДНК. Дочерние копии ДНК транскрибируются, синтезируются поздние мРНК. Затем идет трансляция, и синтезируется около 80 вирусспецифических белков с молекулярной массой от 8 до 240 кД. Часть из них (около 30) является структурными белками, остальные – ферменты и растворимые антигены. Особенностью размножения поксвирусов можно считать модификацию ими клеточных структур, которые превращаются в специализированные «фабрики», где происходит постепенное созревание новых вирусных частиц. Созревшее вирусное потомство покидает клетку либо при ее лизисе, либо путем отпочковывания. Цикл репродукции вирусов оспы занимает около 6 – 7 ч.
Вирус оспы обладает гемагглютинирующими свойствами; гемагглютинин состоит из трех гликопротеидов. Важнейшими антигенами являются: NP-нуклеопротеидный, общий для всего семейства; термолабильный (Л) и термостабильный (С), а также растворимые антигены.
Поксвирусы выдерживают высушивание (особенно в патологическом материале) в течение многих месяцев при комнатной температуре, устойчивы к эфиру, в 50 % растворе этанола при комнатной температуре инактивируются в течение 1 ч, а в 50 % растворе глицерина при температуре 4 °C сохраняются в течение нескольких лет. Устойчивы к большинству дезинфицирующих веществ: 1 %-ный фенол или 0,2 %-ный формальдегид при комнатной температуре инактивируют их только в течение 24 ч, 5 %-ный хлорамин – в течение 2 ч.
К вирусу натуральной оспы восприимчивы человек, а также обезьяны. При экспериментальном заражении в мозг новорожденных мышей развивается генерализованная инфекция, заканчивающаяся летально; для взрослых мышей вирус непатогенен. Он хорошо размножается в куриных эмбрионах при заражении на хорион-ал-
лантоисную оболочку, в амнион, в желточный мешок и аллантоисную полость. На хорион-аллантоисной оболочке 10 – 12-дневных куриных эмбрионов вирус натуральной оспы дает мелкие белые бляшки; вирус осповакцины вызывает поражения больших размеров, с черной впадиной в центре, вызванной некрозом. Важным дифференциальным признаком вируса натуральной оспы является предельная температура размножения вируса в курином эмбрионе 38,5 °C.
К вирусу натуральной оспы чувствительны первичные и перевиваемые культуры клеток, полученные от человека, обезьян и других животных. На культуре клеток опухолевого происхождения (HeLa, Vero) вирус натуральной оспы образует мелкие бляшки пролиферативного типа, в то время как при заражении вирусом оспы обезьян клеток Vero выявляются круглые, с литическим центром бляшки. В клетках почки эмбриона свиньи вирус натуральной оспы способен вызывать четкий цитопатический эффект, которого не бывает при заражении этих клеток вирусом оспы обезьян. В клетках HeLa вирус натуральной оспы вызывает круглоклеточную дегенерацию, тогда как вирусы оспы обезьян и верблюдов вызывают дегенерацию с образованием многоядерных клеток.
Эпидемиология. Источник инфекции – больной человек. Подавляющее большинство не привитых против оспы или непереболевших людей чувствительны к этой инфекции. Заболевание чаще всего передается воздушно-капельным путем, но не исключено заражение и контактным путем (через одежду, полотенце, постель, предметы обихода). Больной заразен для окружающих в течение всего периода развития сыпи, вплоть до отпадения последних корочек, но наиболее опасен в первые 8 – 10 дней, когда имеются поражения на слизистых оболочках.
Патогенез и клиника. Входные ворота инфекции – слизистая оболочка верхних дыхательных путей. Первичное размножение вируса происходит в лимфоидной ткани глоточного кольца, затем на короткое время вирус проникает в кровь и инфицирует клетки ретикулоэндотелиальной ткани (СМФ). Вирус там размножается, и опять возникает вирусемия, но более интенсивная и продолжительная. Дерматотропное действие вируса связано с его способностью проникать из кровяного русла в эпидермис, вызывать раннюю пролиферацию шиповидных клеток и характерную дегенерацию клеток мальпигиева слоя.
Инкубационный период составляет 8 – 18 дней. Заболевание начинается остро: головные боли, боли в мышцах, прострация, лихорадка. Через 2 – 4 дня на слизистой оболочке полости рта и коже появляется характерная сыпь – все элементы почти одновременно, локализуются больше на лице и конечностях. Сыпь проходит стадии макулы, папулы, пузырька и пустулы, затем образуется корочка (струп), после отпадения которой остается рубец. С появлением сыпи температура снижается и вновь повышается на стадии пустулы. От появления сыпи до отпадения корочек проходит около 3 нед. При таком классическом тяжелом течении (variola major) летальность во время эпидемий может достигать 40 %; при более легкой форме заболевания – алястрим (variola minor) – летальность не превышает 1 – 2 %.
Иммунитет. У людей, выздоровевших после оспы, иммунитет сохраняется пожизненно. Длительный стойкий иммунитет формируется и после вакцинации. Иммунитет в основном гуморальный, вируснейтрализующие антитела появляются уже через несколько дней после начала заболевания, однако не препятствуют прогрессирующему распространению кожных проявлений: больной может умереть на пустулезной стадии, имея высокий уровень антител в крови. За создаваемый путем вакцинации искусственный иммунитет также отвечают антитела, появляющиеся на 8 – 9-й день после иммунизации и достигающие максимальных титров через 2 – 3 нед.
Клеточный иммунитет играет не меньшую роль, чем циркулирующие антитела. Установлено, что у лиц с гипогаммаглобулинемией биосинтеза антител не происходит, но они становятся невосприимчивыми к вирусу оспы. В основе такого клеточного иммунитета лежит активность Т-цитотоксических лимфоцитов.
Лабораторная диагностика. Диагностика оспы может проводиться вирусоскопическим, вирусологическим и серологическим методами. Наиболее эффективным и быстрым методом является непосредственная электронная микроскопия материала, взятого из элементов сыпи до стадии пустул, так как количество вируса на этой стадии резко уменьшается. При световой микроскопии в препаратах из содержимого пузырьков обнаруживаются крупные клетки с тельцами Гварниери (см. цв. вкл., рис. 90.1), которые представляют собой цитоплазматические включения овальной формы около ядра клетки, обычно гомогенные и ацидофильные, реже гранулированные и с неправильными очертаниями. Тельца Гварниери – это «фабрики», где происходит размножение вируса оспы. В мазках, приготовленных из содержимого оспенных пузырьков и окрашенных по методу М. Морозова, обнаруживаются вирионы оспы – тельца Пашена (см. цв. вкл., рис. 90.2).
Для выделения и идентификации вируса используют заражение 12 – 14-дневных куриных эмбрионов на хорион-аллантоисную оболочку, где вирус образует мелкие белесые бляшки, а также заражают культуры клеток для обнаружения цитопатического эффекта, постановки реакции гемадсорбции или иммунофлуоресценции. Материал для заражения – кровь, отделяемое носоглотки, соскобы кожных элементов сыпи, корочки, а также секционный материал.
Специфический антиген вируса оспы может быть обнаружен в мазках-отпечатках из элементов сыпи и отделяемого носоглотки с помощью непрямой иммунофлуоресценции. В материале из элементов сыпи антиген может быть определен с помощью иммунодиффузии, РСК или ИФМ.
Уже после первой недели заболевания удается обнаруживать вируснейтрализующие, комплементсвязывающие антитела и гемагглютинины. Наличие комплементсвязывающих антител считается наиболее достоверным признаком оспы, так как они у вакцинированных редко сохраняются дольше 12 мес.
Специфическая профилактика и лечение. С целью специфического лечения и профилактики используется метисазон (марборан) – препарат, подавляющий внутриклеточную репродукцию вируса оспы. Он особенно эффективен на ранних стадиях заболевания и в инкубационном периоде.
История человеческой цивилизации помнит много эпидемий и пандемий натуральной оспы. Только в Европе до конца XVIII в. от оспы погибло не менее 150 млн человек. После получения Э. Дженнером (1796) вакцины против оспы началась активная борьба с этой болезнью, которая закончилась полной ее ликвидацией. В Советском Союзе оспа была ликвидирована в 1936 г., но за счет завозных случаев она регистрировалась до 1960 г. В 1958 г. по инициативе делегации СССР на ассамблее ВОЗ была принята резолюция об искоренении оспы во всем мире, а в 1967 г. ВОЗ приняла интенсифицированную программу искоренения оспы. Широкую материальную помощь этой программе оказали СССР, США, Швеция. СССР не только оказал помощь специалистами, работавшими во многих эндемичных странах, но и поставил безвозмездно около 1,5 млрд доз оспенной вакцины. Использовалась вакцина, представленная живым вирусом осповакцины, выращенным на коже теленка, затем очищенным и высушенным. Хорошие результаты также давали культуральная и эмбриональная (ововакцина) живые вакцины. Для профилактики и лечения осложнений, возникающих иногда при вакцинации, применяли противооспенный донорский иммуноглобулин (10 % раствор в физиологическом растворе гамма-глобулиновой фракции крови доноров, специально ревакцинированных против оспы) и иммуноглобулин крови человека, титрованный на содержание противооспенных антител.
Ретровирусы
Вирусы, относящиеся к этому семейству, обладают целым рядом следующих особенностей, свойственных только им.
1. Геном представлен однонитевой нефрагментированной позитивной РНК, состоящей из 9000 – 9700 нуклеотидов, но в виде двух идентичных молекул, которые связаны своими 5'-концами. Следовательно, геном их диплоидный. Ретровирусы – единственное семейство вирусов с диплоидным геномом.
2. В состав вириона входит обратная транскриптаза, т. е. РНК-зависимая ДНКполимераза, или ревертаза. По этому признаку семейство получило название (англ. retro – обратно, назад). Этот фермент, называемый полимеразным комплексом, состоит из нескольких доменов и обладает 3 видами активности: обратной транскриптазы, РНКазы Н и ДНК-зависимой ДНК-полимеразы.
3. Благодаря наличию обратной транскриптазы РНК-геном вируса в клетке превращается в ДНК-геном и в таком виде интегрируется в хромосому клетки-хозяина, в результате чего она либо погибает (ВИЧ), либо превращается в опухолевую (онковирусы).
4. В связи с тем что функция обратной транскриптазы не контролируется, фермент допускает много ошибок. Это влечет за собой высокую частоту мутаций в генах, кодирующих структурные белки вируса, т. е. его постоянную изменчивость, что создает трудности в создании эффективных вакцин.
5. По структуре нуклеокапсида и расположению его в вирионе ретровирусы подразделяют на 5 форм: A, B, C, D, E. У вирусов типа А шарообразный нуклеокапсид занимает бо́льшую часть вириона. У вируса типа В нуклеокапсид округлой формы расположен эксцентрично. У вируса типа С шарообразный нуклеокапсид расположен в центре вириона. У вируса типа D нуклеокапсид цилиндрической формы (типа снаряда) с центральным расположением в вирионе. Вирусы типа Е по морфологическим признакам близки к вирусам типа С, но по ряду других свойств отличаются от них.
6. Все ретровирусы имеют общие структурные гены: gag, pol, env, но антигенные связи между родами вирусов или отсутствуют, или крайне слабые.
Семейство Retroviridae включает три подсемейства.
А. Spumavirinae – «пенящие» вирусы; такое название дано потому, что при размножении в культуре клеток происходит интенсивное симпластообразование, которое придает культуре «вспененный» вид. Связи этих вирусов с какими-либо патологическими процессами не установлено.
Б. Oncovirinae – онкогенные вирусы, т. е. вирусы, ответственные за превращение нормальной клетки в опухолевую.
В. Lentivirinae – вирусы – возбудители медленных инфекций. К этому подсемейству относится вирус, вызывающий СПИД.
Синдром приобретенного иммунодефицита был выделен в качестве особого заболевания в 1981 г. в США, когда у ряда молодых людей тяжелые заболевания были вызваны микроорганизмами, непатогенными или слабопатогенными для здоровых людей. Исследование иммунного статуса больных выявило у них резкое уменьшение количества лимфоцитов вообще и Т-хелперов в особенности. Это состояние получило название AIDS (англ. Acquired Immune Deficiency Syndrome – синдром приобретенного иммунодефицита, или СПИД). Способ заражения (половой контакт, через кровь и ее препараты) указывал на инфекционный характер заболевания.
Возбудитель СПИДа был открыт в 1983 г. независимо друг от друга французом Л. Монтанье, который назвал его LAV (Lymphoadenopathy Associated Virus), так как обнаружил у больного лимфоаденопатией; и американцем Р. Галло, который назвал вирус HTLV-III (англ. Human T-lymphotropic Virus III – Т-лимфотропный вирус человека III): ранее им были обнаружены лимфотропные вирусы I и II.
Сопоставление свойств вирусов LAV и HTLV-III показало их идентичность, поэтому во избежание путаницы вирус получил в 1986 г. название HIV (англ. Human Immunodeficiency Virus – вирус иммунодефицита человека, или ВИЧ).
ВИЧ шаровидной формы, его диаметр 110 нм. Оболочка вируса имеет форму многогранника, составленного из 12 пятиугольников и 20 шестиугольников. В центре и углах каждого шестиугольника расположена молекула гликозилированного протеина gp120 (число 120 означает молекулярную массу белка в килодальтонах). Всего на поверхности вириона располагаются в виде своеобразных шипов 72 молекулы gp120, каждая из которых связана с внутримембранным белком gp41. Эти белки вместе с двойным липидным слоем образуют суперкапсид (мембрану) вириона (рис. 91).
Белки gp120 и gp41 образуются в результате нарезания клеточной протеазой белка-предшественника Env. Белок gp41 формирует «ножку» шипа, связываясь цитоплазматическим доменом с располагающимся непосредственно под оболочкой матриксным белком р17МА. Молекулы р17, взаимодействуя при созревании вириона, образуют икосаэдр, подстилающий оболочку.
В центральной части вириона белок р24 образует конусообразный капсид. Суженная часть капсида при участии белка р6 связана с оболочкой вириона. Внутри капсида заключены две идентичные молекулы вирусной геномной РНК. Они связаны своими 5'-концами с нуклеокапсидным белком p7NC. Этот белок интересен тем, что имеет два аминокислотных остатка (мотива), богатых цистеином и гистидином и содержащих атом Zn, – их называют «цинковыми пальцами», так как они захватывают молекулы геномной РНК для включения в формирующиеся вирионы. В состав капсида входят также три фермента. Ревертаза (RT), или роl-комплекс, включает в себя обратную транскриптазу, РНК-азу Н и ДНК-зависимую ДНК-полимеразу. Ревертаза присутствует в виде гетеродимера р66/р51. Протеаза (PR) – р10, запускает и реализует процесс созревания вириона. Интеграза (IN) – p31, или эндонуклеаза, обеспечивает включение провирусной ДНК в геном клетки-хозяина. В капсиде содержится также молекула затравочной РНК (тРНКлиз).
РНК-геном в клетке с помощью обратной транскриптазы превращается в ДНКгеном (ДНК-провирус), состоящий из 9283 нуклеотидных пар. Он ограничен слева и справа так называемыми длинными концевыми повторами, или LTR (англ. long terminal repeat): 5'-LTR – слева и 3'-LTR – справа. LTR содержат по 638 нуклеотидных пар.
Геном ВИЧ состоит из 9 генов, часть из которых перекрывается концами (имеет несколько рамок считывания) и имеет экзон-интронную структуру. Они контролируют синтез 9 структурных и 6 регуляторных белков.
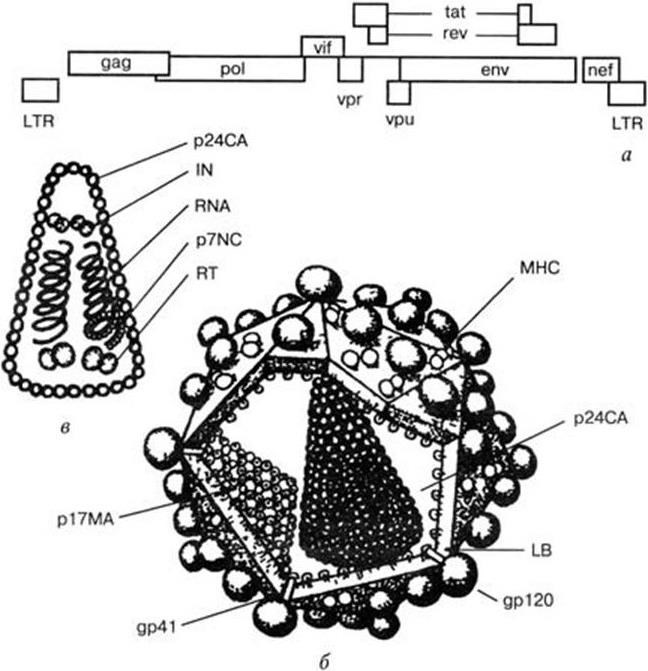
Рис. 91. Геном и схема строения вириона ВИЧ-1 (из обзора С. Н. Иорданского [и др.].
Успехи соврем. биол., 1998, т. 118, в. 1. С. 50):
а – геном ВИЧ-1 (tat, rev, vpu – регуляторные гены, LTR – повторяющиеся концевые последовательности, остальные объяснения в тексте); б – схема строения вириона [по Нермуту (1994), с изменениями];
в – строение капсида.
IN – интеграза; LB – липидный бислой; MHC – белки главного комплекса гистосовместимости и другие клеточные трансмембранные белки; RNA – вирусная геномная РНК; RT – ревертаза; gp41, gp120 – оболочечные гликопротеины; p7NC – нуклеокапсидный белок; р24СА – капсидный белок;
p17MA – матриксный белок
Схематически структура генома ВИЧ выглядит так:
5'-LTR – gag pol vif vpr tat rev vpu env nef – 3'-LTR.
Структурные гены и белки

Регуляторные гены и белки

Значение LTR для вирусного генома заключается в том, что в них расположены следующие регуляторные элементы, контролирующие его работу:
а) сигнал транскрипции (область промотора);
б) сигнал добавления поли-А;
в) сигнал кэпирования;
г) сигнал интеграции;
д) сигнал позитивной регуляции (TAR для белка ТАТ);
е) элемент негативной регуляции (NRЕ для белка NEF);
ж) участок прикрепления затравочной РНК (тРНКлиз) для синтеза минус-цепи ДНК на 3'-конце; сигнал на 5'-конце LTR, который служит затравкой для синтеза плюс-цепи ДНК.
Кроме того, в LTR имеются элементы, участвующие в регуляции сплайсинга мРНК, упаковки молекул вРНК в капсид (элемент Psi). Наконец, при транскрипции генома в длинных мРНК образуются два сигнала для белка REV, которые переключают синтез белков: CAR – для регуляторных белков и CRS – для структурных белков. Если белок REV связывается с CAR, синтезируются структурные белки; если он отсутствует, синтезируются только регуляторные белки.
В регуляции работы генома вируса особенно важную роль играют следующие гены-регуляторы и их белки: 1) белок ТАТ, который осуществляет позитивный контроль размножения вируса и действует через регуляторный участок TAR; 2) белки NEV и VPU, осуществляющие негативный контроль размножения через участок NRE; 3) белок REV, осуществляющий позитивно-негативный контроль. Белок REV контролирует работу генов gag, pol, env и осуществляет негативную регуляцию сплайсинга. Таким образом, размножение ВИЧ находится под тройным контролем – позитивным, негативным и позитивно-негативным.
Белок VIF определяет инфекционность вновь синтезированного вируса. Он связан с капсидным белком р24 и присутствует в вирионе в количестве 60 молекул. Белок NEF представлен в вирионе небольшим числом молекул (5 – 10), возможно, связанных с оболочкой.
Белок VPR тормозит клеточный цикл на фазе G2, участвует в транспорте преинтеграционных комплексов в ядро клетки, активирует некоторые вирусные и клеточные гены, повышает эффективность репликации вируса в моноцитах и макрофагах. Место расположения белков VPR, TAT, REV, VPU в вирионе не установлено.
Помимо собственных белков в состав оболочки вириона могут входить некоторые белки клетки-хозяина. Белки VPU и VPR участвуют в регуляции репродукции вируса.
Механизм взаимодействия ВИЧ с клеткой
Проникнув в организм, вирус в первую очередь атакует клетки, содержащие специфический для него рецептор CD4. Этот рецептор имеют в большом количестве Т-хелперы, в меньшем – макрофаги и моноциты, особенно к вирусу чувствительны Т-хелперы.
Вирус распознает CD4-рецепторы с помощью своего белка gр120. Процесс взаимодействия ВИЧ с клеткой протекает по следующей схеме: рецепторопосредованная адсорбция → окаймленная ямка → окаймленный пузырек → лизосома. В неймембрана вириона сливается с мембраной лизосомы, и нуклеокапсид, освобожденный от суперкапсида, выходит в цитоплазму; на пути к ядру он разрушается, и высвобождаются геномная РНК и ассоциированные с ней компоненты сердцевины. Далее обратная транскриптаза синтезирует на вирионной РНК минус-цепь ДНК, затем РНК-аза Н разрушает вирионную РНК, а вирусная ДНК-полимераза синтезирует плюс-цепь ДНК. На концах ДНК-провируса образуются 5'-LTR и 3'-LTR. ДНК-провирус может находиться в ядре некоторое время в неактивной форме, но рано или поздно он с помощью своей интегразы встраивается в хромосому клетки-мишени. В ней провирус находится в неактивном состоянии до тех пор, пока данный Т-лимфоцит не будет активирован микробными антигенами или другими иммунокомпетентными клетками. Активация транскрипции клеточной ДНК регулируется особым ядерным фактором (NF-kB). Он является ДНК-связывающим белком и вырабатывается в большом количестве при активации и пролиферации Т-лимфоцитов и моноцитов. Этот белок связывается с определенными последовательностями клеточной ДНК и сходными последовательностями LTR ДНК-провируса и индуцирует транскрипцию как клеточной ДНК, так и ДНК-провируса. Индуцируя транскрипцию ДНК-провируса, он и осуществляет переход вируса из неактивного состояния в активное и соответственно персистентной инфекции – в продуктивную. Пребывание провируса в неактивном состоянии может продолжаться очень долго. Активация вируса является критическим моментом в его взаимодействии с клеткой.
С момента проникновения вируса в клетку начинается период ВИЧ-инфекции – вирусоносительства, которое может продолжаться 10 и более лет; а с момента активации вируса начинается болезнь – СПИД. С помощью своих регуляторных генов и их продуктов вирус начинает активно размножаться. ТАТ-белок может повысить скорость репродукции вируса в 1000 раз. Транскрипция вируса имеет сложный характер. Она включает образование как полноразмерных, так и субгеномных мРНК, сплайсинг мРНК, а далее происходит синтез структурных и регуляторных белков.
Синтез структурных белков происходит так. Вначале синтезируется полипротеинпредшественник Pr55Gag (белок с м. м. 55 кД). Он содержит 4 основных домена: матриксный (МА), капсидный (СА), нуклеокапсидный (NC) и домен р6, из которых в результате нарезания Pr55Gag вирусной протеазой (она самовырезается из другого белка-предшественника – Gag-Pol) образуются соответственно структурные белки р17, р24, р7 и р6. Образование полипротеина Pr55Gag – главное условие формирования вирусных частиц. Именно этот белок определяет программу морфогенеза вириона. Она включает последовательно стадии транспорта полипротеина Gag к плазматической мембране, взаимодействия с ней и белок-белковых взаимодействий при формировании вирусной частицы и ее почковании. Pr55Gag синтезируется на свободных полирибосомах; молекулы белка транспортируются к мембране, на которой заякориваются своими гидрофобными участками. Основную роль в создании нативной конформации Gag-белка играет СA-домен. NC-домен обеспечивает включение (с помощью своих «цинковых пальцев») 2 молекул геномной РНК в состав формирующейся вирусной частицы. Молекула полипротеина вначале димеризуется благодаря взаимодействию матриксных доменов. Затем димеры объединяются в гексамерные (из 6 единиц) комплексы в результате взаимодействия доменов СA и NC. Наконец, гексамеры, соединяясь боковыми поверхностями, образуют незрелые вирионы сферической формы, внутри которых содержится геномная вирусная РНК, захваченная NC-доменом.
Другой белок-предшественник Prl60Gag-Pol (белок с м. м. 160 кД) синтезируется в результате сдвига рамки считывания рибосомой при трансляции 3'-конца гена gag в области, расположенной непосредственно перед участком, кодирующим белок р6. Этот полипротеин Gag-Pol содержит неполную последовательность Gag-белка (1 – 423 аминокислоты) и последовательности Pol, которые включают домены PR, RT и IN. Молекулы полипротеина Gag-Pol также синтезируются на свободных полири-
босомах и транспортируются к плазматической мембране. Полипротеин Prl60GagPol содержит все присущие полипротеину Gаg сайты межмолекулярных взаимодействий и сайты связывания с мембраной. Поэтому молекулы полипротеина Gag-Pol сливаются с мембраной и наряду с Gag-молекулами включаются в формирующиеся вирионы, в результате чего появляется активная протеаза и начинается процесс созревания вириона. Протеаза ВИЧ-1 высокоактивна только в виде димера, поэтому для ее самовырезания из Prl60Gаg-Pol требуется димеризация этих молекул. Созревание вириона заключается в том, что освободившаяся активная протеаза разрезает Prl60Gag-Pol и Gаg55 в узнаваемых ею сайтах; образуются белки р17, р24, р7, р6, ревертаза, интеграза и происходит их ассоциация в вирусную структуру.
Белок Env синтезируется на рибосомах, связанных с мембранами эндоплазматического ретикулума, затем он гликозилируется, разрезается клеточной протеазой на gр120 и gр41 и транспортируется на клеточную поверхность. При этом gр41 пронизывает мембрану и связывается матриксными доменами молекулы Gаg-белка, ассоциированными с внутренней поверхностью мембраны. Эта связь сохраняется и в зрелом вирионе.
Таким образом, сборка вирусных частиц заключается в агрегации белков-предшественников и связанных с ними молекул РНК на плазматической мембране клетки-хозяина, образовании незрелых вирионов и их высвобождении путем почкования с клеточной поверхности. При почковании вирион окружает себя клеточной мембраной, в которую встроены молекулы gр41 и gр120. Во время почкования или, возможно, после высвобождения вирионов происходит их созревание, которое осуществляется при помощи вирусной протеазы и заключается в протеолитическом нарезании белков-предшественников Рr55Gаg и Рrl60Gаg-Pol на белки зрелого вируса и их ассоциации в определенные структурные комплексы. Ведущую роль в процессах морфогенеза вируса играет полипротеин-предшественник Рr55Gag, который организует и осуществляет сборку незрелого вириона; процесс его созревания завершает специфическая вирусная протеаза.
Антигенные варианты. Вирус иммунодефицита очень изменчив. Даже из организма одного больного могут быть выделены штаммы вируса, существенно различающиеся по антигенным свойствам. Такой изменчивости способствуют интенсивное разрушение клеток СD4+ и мощный антительный ответ на ВИЧ-инфекцию. У больных из Западной Африки выделена новая форма ВИЧ, биологически близкая к ВИЧ-1, но иммунологически отличающаяся от него, – ВИЧ-2. Гомология первичной структуры геномов этих вирусов составляет ~42 %. ДНК-провирус ВИЧ-2 содержит 9671 п. н., а его LTR – 854 п. н. ВИЧ-2 впоследствии выделен и в других регионах мира. Перекрестного иммунитета между ВИЧ-1 и ВИЧ-2 нет. Известны две крупные формы ВИЧ-1: О (Outlier) и М (Маjor), последнюю подразделяют на 10 субтипов (А – J). В России циркулируют 8 субтипов (А – Н).
Методы культивирования. ВИЧ-1 и ВИЧ-2 удается культивировать в клетках только одного клона ТCD4-лимфоцитов – Н9, полученного из лейкозных ТСВ4лимфоцитов. Для этих же целей могут быть использованы и монослойные культуры клеток астроцитов, в которых ВИЧ-1 хорошо размножается. Из животных к ВИЧ-1 восприимчивы шимпанзе.
Резистентность вируса во внешней среде невелика. Он погибает под влиянием солнечных лучей и УФ-облучения, разрушается при 80 °C в течение 30 мин, при обработке обычно применяемыми дезинфицирующими веществами – в течение 20 – 30 мин. Для обеззараживания вируссодержащего материала необходимо пользоваться микобактерицидными дезинфицирующими веществами, поскольку они эффективны против микроорганизмов, обладающих самой высокой резистентностью.
Источником ВИЧ-инфекции является только человек – больной или вирусоноситель. Вирус содержится в крови, сперме, цервикальной жидкости; у кормящих матерей – в грудном молоке. Заражение происходит половым путем, через кровь и ее препараты, а также от матери к ребенку до родов, во время и после родов. Случаи заражения вирусом через пищевые продукты, напитки и через укусы насекомых не известны.
От пандемии ВИЧ-инфекции в мире уже погибло более 42 млн человек. По данным ВОЗ, этим вирусом ежедневно заражается 14 тыс. человек.
Распространению СПИДа способствует наркомания. Зараженность ВИЧ растет с каждым годом. По данным ВОЗ, с 1980 по 2000 г. 58 млн человек было инфицировано ВИЧ. Только в течение 2000 г. в мире было инфицировано 5,3 млн, а умерли от СПИДа 3 млн человек. В России на 1 января 2004 г. было зарегистрировано 264 тыс. ВИЧ-инфицированных людей. Половина лиц, зараженных ВИЧ, умирает в течение 11 – 12 лет с момента заражения. В начале 2004 г. из каждых 100 тыс. граждан России около 180 жили с диагнозом «ВИЧ-инфекция». Прогнозируется, что при таком уровне заболеваемости суммарное число ВИЧ-инфицированных в России к 2012 г. составит 2,5 – 3 млн человек. Сложность борьбы с ВИЧ-инфекцией зависит от ряда причин: во-первых, еще нет эффективных методов ее лечения и специфической профилактики; во-вторых, инкубационный период при ВИЧ-инфекции может превышать 10 лет. Его продолжительность зависит от момента активации Т-лимфоцита и содержащегося в его хромосоме ДНК-провируса. Пока неясно, обречен ли каждый инфицированный вирусом на СПИД или возможно длительное вирусоносительство без заболевания (что кажется маловероятным). Наконец, существует несколько вирусов иммунодефицита человека (ВИЧ-1, ВИЧ-2), антигенные различия между которыми предотвращают формирование перекрестного иммунитета. Обнаружение вируса иммунодефицита обезьян (ВИО) пролило свет на вопрос о происхождении ВИЧ. ВИО по организации генома сходен с ВИЧ, но существенно отличается по нуклеотидной последовательности. ВИЧ-2 по серологическим свойствам занимает промежуточное положение между ВИЧ-1 и ВИО, а по нуклеотидной последовательности оказался ближе к ВИО. В связи с этим В. М. Жданов предположил, что вирусы ВИЧ-1, ВИЧ-2 и ВИО произошли от общего предка. Не исключено, по мнению Р. Галло, что один из ВИО каким-то образом попал в организм человека, где претерпел ряд мутаций, в результате которых возникли ВИЧ-1, ВИЧ-2 и другие его формы.
Особенности патогенеза и клинической картины ВИЧ-инфекции
Вирусу иммунодефицита человека свойственны некоторые особенности, от которых во многом зависит патогенез заболевания. Вирус обладает очень высокой скоростью размножения, определяемой его регуляторными элементами (за 5 мин в активной стадии синтезируется до 5000 вирионов). Благодаря наличию белка слияния (gp41) вирус индуцирует образование обширных синцитиальных структур за счет слияния инфицированных и неинфицированных Т-хелперов, следствием чего является их массовая гибель. Образующиеся в большом количестве молекулы белка gp120 свободно циркулируют в крови и связываются с рецепторами неинфицированных Т-хелперов, в результате чего они также распознаются и уничтожаются Т-киллерами. Вирус может распространяться по межклеточным каналам из клетки в клетку, в этом случае он становится мало доступен антителам.
Причины иммунодефицита. Одной из основных причин иммунодефицита при ВИЧ-инфекции является массовая гибель Т-хелперов. Она наступает вследствие следующих событий. Во-первых, зараженные вирусом Т-хелперы гибнут вследствие апоптоза. Считается, что у больных СПИДом репликация вируса, апоптоз и снижение числа Т-хелперов связаны между собой. Во-вторых, Т-киллеры распознают и разрушают Т-клетки, инфицированные вирусом или несущие на себе адсорбированные молекулы gp120, а также вирусинфицированные и не зараженные вирусом Т-хелперы, которые образуют симпласты (синцитий), состоящие из нескольких десятков клеток (часть из них погибает в результате размножения в них вирусов). Вследствие разрушения большого количества Т-хелперов происходит снижение экспрессии мембранных рецепторов у В-лимфоцитов к интерлейкину-2, нарушается синтез различных интерлейкинов (факторов роста и дифференцировки В-лимфоцитов – IL-4, IL-5, IL-6 и др.), в результате чего нарушается функция системы Т-киллеров. Происходит подавление активности систем комплемента и макрофагов. Инфицированные вирусом макрофаги и моноциты долго не гибнут, но они не способны удалять вирус из организма. Наконец, из-за структурного и антигенного сходства gp120 с рецепторами некоторых эпителиальных клеток организма (в том числе с рецепторами трофобластов, опосредующих трансплантационную передачу ВИЧ) происходит синтез антирецепторных антител с широким спектром действия. Такие антитела способны блокировать различные клеточные рецепторы и осложняют течение болезни аутоиммунными расстройствами. Следствием ВИЧ-инфекции является поражение всех основных звеньев системы иммунитета. Такие больные становятся беззащитными против самых различных микроорганизмов. Это приводит к развитию у них оппортунистических инфекций и опухолевых заболеваний. Для больных ВИЧ-инфекцией повышен риск развития рака по меньшей мере трех типов: саркомы Капоши; карциномы (включая рак кожи); В-клеточной лимфомы, возникающей из-за злокачественного перерождения В-лимфоцитов. Однако ВИЧ обладает не только лимфоцито-, но и нейротропностью. Он проникает в клетки ЦНС (астроциты) как путем рецепторопосредованного эндоцитоза, так и при фагоцитозе астроцитами вирусинфицированных лимфобластов. При взаимодействии вируса с астроцитами также образуются симпласты, способствующие распространению возбудителя по межклеточным каналам. В макрофагах и моноцитах вирус может сохраняться длительное время, поэтому они служат резервуаром и распространителями его в организме, будучи способны проникать во все ткани. Инфицированным макрофагам принадлежит главная роль в заносе ВИЧ в ЦНС и ее поражении. У 10 % больных первичные клинические синдромы связаны с поражением ЦНС и проявляются в виде деменции (слабоумия). Таким образом, для людей, пораженных ВИЧинфекцией, характерны 3 группы заболеваний – оппортунистические инфекции, опухолевые болезни и поражение ЦНС.
Клинические критерии. У взрослых ВИЧ-инфекцию устанавливают при наличии у них по меньшей мере двух серьезных симптомов в сочетании хотя бы с одним незначительным симптомом и при отсутствии других известных причин иммунодефицита (рак, врожденный иммунодефицит, тяжелая форма голодания и т. п.). К серьезным симптомам относят: а) похудение на 10 % и более; б) длительное лихорадочное состояние, перемежающееся или постоянное; в) хроническая диарея. Незначительные симптомы: упорный кашель, генерализованный дерматит, рецидивирующий опоясывающий герпес, кандидоз ротовой полости и глотки, хронический простой герпес, генерализованная лимфоаденопатия. Диагноз СПИДа ставят при наличии одной лишь саркомы Капоши, криптококкового менингита, пневмоцистной пневмонии. На клиническую картину болезни оказывает влияние присоединившаяся оппортунистическая инфекция.
Лабораторная диагностика. Основным способом диагностики вирусоносительства и ВИЧ-инфекции является иммуноферментный метод. Для этой цели существуют различные тест-системы, с помощью которых обнаруживаются антитела к ВИЧ. Однако в связи с тем, что gp120 имеет структурное и антигенное сходство с рецепторами некоторых клеток человека, в том числе с рецепторами, которые осуществляют транспорт иммуноглобулинов через эпителиальные клетки слизистых оболочек, в организме могут появляться антитела, родственные антителам против gp120. В этом случае могут быть ложнопозитивные результаты ИФМ. Поэтому все положительно реагирующие сыворотки исследуемых подвергаются дополнительному анализу с помощью метода иммуноблотинга, или вестернблотинга. В основе этого метода лежит идентификация исследуемых антител после электрофоретического разделения их и последующего тестирования с помощью меченых антивидовых антител. Вирусологический метод мало применяется из-за сложности культивирования вируса. Клон лимфоцитов Н9 используется для получения вирусных антигенов – необходимых компонентов диагностических тест-систем. Метод ЦПР позволяет выявить вирус уже на раннем этапе вирусемии.
Лечение и профилактика. Необходимо найти или синтезировать препараты, эффективно подавляющие активность обратной транскриптазы (ревертазы) или вирусной протеазы. Они предотвращали бы образование ДНК-провируса и (или) ингибировали внутриклеточное размножение вируса. Современная стратегия лечения ВИЧ-инфицированных основана на принципе комбинированного применения препаратов, ингибирующих вирусную протеазу (один из препаратов) и ревергазу (2 разных препарата), – комбинированная (тройная) терапия. В России для лечения ВИЧ-инфицированных рекомендовано совместное применение 2 отечественных препаратов: фосфазида и криксивана, специфически подавляющих репродукцию ВИЧ на ранних и поздних стадиях размножения, особенно при пониженной активности азидотимидина. С помощью имеющихся препаратов пока удается лишь продлить жизнь больных СПИДом на несколько лет, однако у ВИЧ-1 и ВИЧ-2 вырабатывается резистентность к этим препаратам.
Проблема специфической профилактики заключается в необходимости создания вакцины, которая бы обеспечивала формирование эффективного клеточноопосредованного иммунитета на основе вирусспецифических цитотоксических лимфоцитов без сколько-нибудь существенной продукции антител. Такой иммунитет обеспечивают Th1-хелперы. Возможно, что антитела, в том числе и вируснейтрализующие, не только не эффективны в подавлении ВИЧ-инфекции, но при высоком уровне подавляют клеточно-опосредованный иммунитет. Поэтому анти-ВИЧ-вакцина должна отвечать прежде всего двум основным требованиям: а) быть абсолютно безопасной и б) стимулировать активность Т-цитотоксических лимфоцитов. Изучается эффективность различных вариантов вакцин, полученных из убитых (инактивированных) вирусов и из отдельных антигенов, с высокими протективными свойствами. Такие антигены могут быть либо выделены из самих вирионов, либо синтезированы химически. Предложена вакцина, созданная на основе методов генной инженерии. Она представляет собой рекомбинантный вирус осповакцины, несущий гены ВИЧ, ответственные за синтез антигенов с сильными иммуногенными свойствами. Решение вопроса об эффективности этих вакцин требует значительного времени из-за большой продолжительности инкубационного периода ВИЧ-инфекции и высокой изменчивости возбудителя. Создание высокоэффективной вакцины против ВИЧ – неотложная фундаментальная проблема.
Вирусы и рак
Для объяснения природы рака были предложены две господствующие теории – мутационная и вирусная. В соответствии с первой рак есть результат последовательных мутаций ряда генов в одной клетке, т. е. в его основе лежат изменения, возникающие на генном уровне. Эта теория в законченном виде была сформулирована в 1974 г. Ф. Бернетом: раковая опухоль моноклональна она происходит от одной исходной соматической клетки, мутации в которой вызываются химическими, физическими агентами и вирусами, повреждающими ДНК. В популяции таких мутантных клеток происходит накопление дополнительных мутаций, увеличивающих способность клеток к неограниченному размножению. Однако накопление мутаций требует определенного времени, поэтому рак развивается постепенно, и вероятность появления болезни зависит от возраста.
Вирусно-генетическая теория рака наиболее четко была сформулирована русским ученым Л. А. Зильбером: рак вызывают онкогенные вирусы, они интегрируются в хромосому клетки и создают раковый фенотип. Полному признанию вирусно-генетической теории некоторое время препятствовало то обстоятельство, что многие онкогенные вирусы имеют РНК-геном, поэтому непонятно было, как он интегрируется в хромосому клетки. После того как у таких вирусов была обнаружена обратная транскриптаза, способная воспроизводить из вирионной РНК ДНК-провирус, это препятствие отпало и вирусно-генетическая теория получила признание наряду с мутационной.
Решающий вклад в понимание природы рака внесло открытие в составе онкогенных вирусов гена злокачественности – онкогена и его предшественника, имеющегося в клетках человека, млекопитающих животных и птиц, – протоонкогена.
Протоонкогены – семейство генов, выполняющих в нормальной клетке жизненно важные функции. Они необходимы для регуляции ее роста и размножения. Продуктами протоонкогенов являются различные протеинкиназы, которые осуществляют фосфорилирование клеточных сигнальных белков, а также факторы транскрипции. Последние представляют собой белки – продукты протоонкогенов c-myc, c-fos, c-jun, c-myh и генов-супрессоров клетки.
Существуют два типа онковирусов:
1. Вирусы, содержащие онкоген (вирусы onc+).
2. Вирусы, не содержащие онкогена (вирусы onc–).
Вирусы onc+ могут утрачивать онкоген, но это не нарушает их нормальной жизнедеятельности. Иначе говоря, сам по себе онкоген вирусу не нужен.
Основное различие между вирусами onc+ и onc– состоит в следующем: вирус onc–, проникнув в клетку, не вызывает ее трансформации в раковую или вызывает крайне редко. Вирусы onc+, попадая в ядро клетки, трансформируют ее в раковую.
Стало быть, превращение нормальной клетки в опухолевую происходит вследствие того, что онкоген, будучи привнесенным в хромосому клетки, наделяет ее новым качеством, которое позволяет ей размножаться в организме бесконтрольно, образуя клон раковых клеток. Этот механизм превращения нормальной клетки в раковую напоминает трансдукцию бактерий, при которой умеренный фаг, интегрируясь в хромосому бактерий, наделяет их новыми свойствами. Это тем более правдоподобно, что онкогенные вирусы ведут себя как транспозоны: они могут интегрироваться в хромосому, перемещаться в ней из одного участка в другой или переходить из одной хромосомы в другую. Суть вопроса заключается в следующем: каким образом протоонкоген превращается в онкоген, когда он взаимодействует с вирусом?
Прежде всего необходимо отметить то важное обстоятельство, что у вирусов в связи с высокой скоростью их размножения промоторы работают с гораздо большей активностью, чем промоторы в эукариотных клетках. Поэтому, когда onc—-вирус интегрируется в хромосому клетки по соседству с одним из протоонкогенов, он подчиняет работу этого гена своему промотору. Выходя из хромосомы, вирусный геном выхватывает из нее протоонкоген, последний становится составной частью вирусного генома и превращается в онкоген, а вирус из onc— – в onc+-вирус. Интегрируясь в хромосому другой клетки, такой уже onc+-вирус одновременно трансдуцирует в нее и онкоген со всеми последствиями. Таков наиболее частый механизм образования онкогенных (onc+) – вирусов и начала превращения нормальной клетки в опухолевую. Возможны и другие механизмы превращения протоонкогена в онкоген:
а) транслокация протоонкогена, в результате которой протоонкоген оказывается по соседству с сильным вирусным промотором, который берет его под свой контроль;
б) амплификация протоонкогена, в результате которой количество копий его возрастает, как и количество синтезируемого продукта;
в) превращение протоонкогена в онкоген происходит вследствие мутаций, вызываемых физическими и химическими мутагенами.
Таким образом, основные причины превращения протоонкогена в онкоген следующие:
1. Включение протоонкогена в геном вируса и превращение последнего в onc+-вирус.
2. Попадание протоонкогена под контроль сильного промотора либо в результате интеграции вируса, либо вследствие транслокации блока генов в хромосоме.
3. Точечные мутации в протоонкогене.
4. Амплификация протоонкогенов.
Последствиями всех этих событий могут быть:
1) изменение специфичности или активности белкового продукта онкогена, тем более, что очень часто включение в геном вируса протоонкогена сопровождается мутациями протоонкогена;
2) утрата клеточно-специфической и временной регуляции этого продукта;
3) увеличение количества синтезируемого белкового продукта онкогена.
Продукты онкогенов – также протеинкиназы и факторы транскрипции, поэтому нарушения активности и специфичности протеинкиназ и рассматриваются как начальные пусковые механизмы превращения нормальной клетки в опухолевую. Поскольку семейство протоонкогенов состоит из 20 – 30 генов, то и семейство онкогенов включает в себя, очевидно, не более трех десятков вариантов.
Однако злокачественность таких клеток зависит не только от мутаций протоонкогенов, но и от изменений во влиянии на работу генов со стороны генетической среды в целом, характерной для нормальной клетки. Такова современная генная теория рака.
Таким образом, первичная причина превращения нормальной клетки в злокачественную – мутации протоонкогена или попадание его под контроль мощного вирусного промотора. Различные внешние факторы, индуцирующие образование опухолей (химические вещества, ионизирующая радиация, УФ-облучение, вирусы и др.), действуют на одну и ту же мишень – протоонкогены. Они имеются в хромосомах клеток каждого индивидуума. Под влиянием указанных факторов включается тот или иной генетический механизм, который приводит к изменению функции протоонкогена, а это, в свою очередь, дает начало перерождению нормальной клетки в злокачественную.
Раковая клетка несет на себе чужеродные вирусные белки или собственные измененные белки. Она распознается Т-цитотоксическими лимфоцитами и при участии остальных механизмов иммунной системы уничтожается. Кроме Т-цитотоксических лимфоцитов раковые клетки распознаются и уничтожаются другими киллерными клетками: NK, Pit-клетками, В-киллерами, а также К-клетками, чья цитотоксическая активность зависит от антител. В качестве К-клеток могут функционировать полиморфно-ядерные лейкоциты; макрофаги; моноциты; тромбоциты; мононуклеарные клетки лимфоидной ткани, лишенные маркеров Т– и В-лимфоцитов; Т-лимфоциты, имеющие Fс-рецепторы для IgM.
Противоопухолевым действием обладают интерфероны и некоторые другие биологически активные соединения, образуемые иммунокомпетентными клетками. В частности, раковые клетки распознаются и разрушаются рядом цитокинов, в особенности такими, как фактор некроза опухоли и лимфотоксин. Они представляют собой родственные белки с широким спектром биологической активности. Фактор некроза опухоли (ФНО) – один из главных медиаторов воспалительных и иммунных реакций организма. Он синтезируется различными клетками иммунной системы, главным образом макрофагами, Т-лимфоцитами и купферовскими клетками печени. ФНОα был обнаружен в 1975 г. Е. Карсвеллом с сотрудниками; это полипептид с м. м. 17 кД. Он обладает сложным плейотропным действием: индуцирует экспрессию молекул МНС класса II у иммунокомпетентных клеток; стимулирует продукцию интерлейкинов IL-1 и IL-6, простагландина ПГЕ2 (он служит негативным регулятором механизма секреции ФНО); оказывает хемотаксическое действие в отношении зрелых Т-лимфоцитов и т. п. Важнейшая физиологическая роль ФНО – модуляция роста клеток в организме (рострегулирующая и цитодифференцирующая функции). Кроме того, он селективно подавляет рост злокачественных клеток и вызывает их лизис. Предполагается, что ростмодулирующая активность ФНО может быть использована в противоположном направлении, а именно, для стимуляции роста нормальных и подавления роста злокачественных клеток.
Лимфотоксин, или ФНОβ, – белок с м. м. около 80 кД, синтезируется некоторыми субпопуляциями Т-лимфоцитов, также обладает способностью лизировать клетки-мишени, несущие чужеродные антигены. Способностью активировать функции NK-клеток, К-клеток, макрофагов, нейтрофильных лейкоцитов обладают и другие пептиды, в частности пептиды, являющиеся фрагментами молекул IgG, например тафтеин (цитофильный полипептид, выделенный из CH2-домена), фрагменты Fab, Fc и др. Только благодаря постоянному взаимодействию всех иммунокомпетентных систем обеспечивается противоопухолевый иммунитет.
Большинство людей не болеет раком не потому, что у них не возникают мутантные раковые клетки, а потому, что последние, возникнув, своевременно распознаются и уничтожаются Т-цитотоксическими лимфоцитами и другими звеньями иммунной системы раньше, чем успевают дать злокачественное потомство. У таких людей противоопухолевый иммунитет работает надежно. Напротив, у больных раком мутантные клетки вовремя не распознаются или не уничтожаются иммунной системой, а беспрепятственно и бесконтрольно размножаются. Следовательно, рак – это следствие иммунодефицита. Какое звено иммунитета при этом страдает, – необходимо выяснить, чтобы наметить более эффективные пути борьбы с заболеванием. В этом плане большое внимание уделяется разработке способов биотерапии рака, основанных на комплексном и последовательном использовании модуляторов биологической и иммунологической реактивности, т. е. химических веществ, синтезируемых иммунокомпетентными клетками, которые способны модифицировать реакции взаимодействия организма с опухолевыми клетками и обеспечивать противоопухолевый иммунитет. С помощью таких модификаторов иммунологической реактивности открывается возможность воздействия как в целом на иммунную систему, так и избирательно на ее отдельные механизмы, в том числе контролирующие образование факторов активации, пролиферации, дифференцировки, синтез интерлейкинов, факторов некроза опухолей, лимфотоксинов, интерферонов и т. п., чтобы устранить состояние иммунодефицита при раке и повысить эффективность его лечения. Уже описаны случаи излечения миеломы человека с помощью лимфокинактивированных киллеров и интерлейкина-2. В экспериментальной и клинической иммунотерапии рака наметились следующие направления.
1. Введение в опухолевые ткани активированных клеток иммунной системы.
2. Использование лимфо– или (и) монокинов.
3. Применение иммуномодуляторов бактериального происхождения (наиболее эффективны ЛПС и производные пептидогликана) и индуцированных ими продуктов, в частности ФНО.
4. Использование противоопухолевых антител, в том числе моноклональных.
5. Комбинированное использование различных направлений, например первого и второго.
Перспективы использования модуляторов иммунологической реактивности для биотерапии рака необычайно широки.
ЧАСТНАЯ МЕДИЦИНСКАЯ МИКРОБИОЛОГИЯ
Глава 59 Возбудители гнойно-воспалительных заболеваний
Гнойно-воспалительные заболевания относятся к числу наиболее распространенных. Ими ежегодно болеют многие миллионы людей. Одна из причин этого – наличие большого количества возбудителей. Способностью вызывать гнойные и серозно-гнойные воспаления у человека и животных обладают многие патогенные и условно-патогенные бактерии, но громадное большинство острых и подострых нагноений вызывают кокки. На втором месте стоят грамотрицательные бактерии – факультативные анаэробы: Esсherichia, Proteus, Klebsiella, Pseudomonas и др., а также строгие анаэробы, не образующие спор, из семейства Bacteroidaceae (Bacteroides и Fusоbacterium). Однако репутация гноеродных (пиогенных) укоренилась прежде всего за кокками, так как они вызывают 70 – 80 % всех гнойных заболеваний.
Грамположительные кокки относятся к семействам Micrococcaceae (Staphylococcus) и Streptococcaceae (роды Streptococcus, Enterococcus, Aerococcus, Leuconostoc, Pediococcus, Lactococcus); грамотрицательные кокки – к роду Neisseria.
Стафилококк был обнаружен в 1878 г. Р. Кохом и в 1880 г. Л. Пастером в гнойном материале. Л. Пастер, заразив кролика, окончательно доказал роль стафилококка как возбудителя гнойного воспаления. Название «стафилококк» дал в 1881 г. А. Огстон (из-за характерного расположения клеток), а подробно описал его свойства в 1884 г. Ф. Розенбах. Стафилококки – грамположительные, правильной геометрической формы шаровидные клетки диаметром 0,5 – 1,5 мкм, располагающиеся обычно в виде гроздьев (см. цв. вкл., рис. 92), каталазопозитивны, восстанавливают нитраты в нитриты, активно гидролизуют белки и жиры, сбраживают в анаэробных условиях глюкозу с образованием кислоты без газа. Обычно могут расти в присутствии 15 %-ного NaCl и при температуре 45 °C. Содержание Г + Ц в ДНК – 30 – 39 мол %. Стафилококки не имеют жгутиков, не образуют спор. Они широко распространены в природе. Их главным резервуаром являются кожные покровы человека и животных и их слизистые оболочки, сообщающиеся с внешней средой. Стафилококки – факультативные анаэробы, лишь один вид (Staphylococcus saccharolyticus) – строгий анаэроб. Стафилококки не требовательны к питательным средам, хорошо растут на обычных средах, температурный оптимум для роста 35 – 37 °C, рН 6,2 – 8,4. Колонии круглые, 2 – 4 мм в диаметре, с ровными краями, выпуклые, непрозрачные, окрашены в цвет образуемого пигмента. Рост в жидкой культуре сопровождается равномерным помутнением, со временем выпадает рыхлый осадок. При росте на обычных средах стафилококки не образуют капсулы, однако при посеве уколом в полужидкий агар с плазмой или сывороткой большинство штаммов S. aureus образует капсулу. Бескапсульные штаммы в полужидком агаре растут в виде компактных колоний, капсульные – образуют диффузные колонии.
Стафилококки обладают высокой биохимической активностью: ферментируют с выделением кислоты (без газа) глицерин, глюкозу, мальтозу, лактозу, сахарозу, маннит; образуют различные ферменты (плазмокоагулазу, фибринолизин, лецитиназу, лизоцим, щелочную фосфатазу, ДНКазу, гиалуронидазу, теллуритредуктазу, протеиназу, желатиназу и др.). Указанные ферменты играют важную роль в метаболизме стафилококков и во многом определяют их патогенность. Такие ферменты, как фибринолизин и гиалуронидаза, обусловливают высокую инвазивность стафилококков. Плазмокоагулаза является главным фактором их патогенности: она защищает от фагоцитоза и переводит протромбин в тромбин, который вызывает свертывание фибриногена, в результате чего каждая клетка покрывается белковой пленкой, защищающей от фагоцитов.
Классификация. Род Staphylococcus включает в себя более 20 видов, которые подразделяются на две группы – коагулазоположительные и коагулазоотрицательные стафилококки. Для дифференциации видов используют различные признаки (табл. 22).
Таблица 22
Дифференциальные признаки основных видов стафилококков
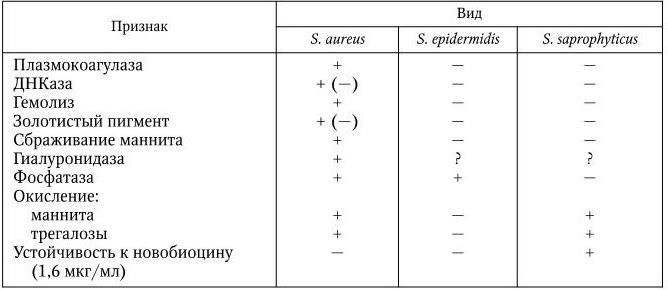
Примечание. (+) – признак положительный; ( – ) – признак отрицательный; + ( – ) – признак непостоянный;? – неизвестно.
I. Коагулазоположительные стафилококки:
1. S. aureus***.
2. S. intermedius**.
3. S. hyicusa.
II. Коагулазоотрицательные стафилококки:

* Патогенные только для человека.
** Патогенные только для животных.
*** Патогенные для человека и животных.
a Не все штаммы S. hyicus имеют коагулазу.
Патогенными для человека являются, главным образом, коагулазоположительные стафилококки, но многие коагулазоотрицательные также способны вызывать заболевания, особенно у новорожденных детей (конъюнктивит новорожденных, эндокардит, сепсис, заболевания мочевыводящих путей, острый гастроэнтерит и др.). S. aureus в зависимости от того, кто является его основным носителем, разделяется на 10 эковаров (hominis, bovis, ovis и др.).
У стафилококков обнаружено более 50 типов антигенов, к каждому из них в организме образуются антитела, многие из антигенов обладают аллергенными свойствами. По специфичности антигены подразделяют на родовые (общие для всего рода Staphylococcus); перекрестно реагирующие – антигены, общие с изоантигенами эритроцитов, кожи и почек человека (с ними связаны аутоиммунные заболевания); видовые и типоспецифические антигены. По типоспецифическим антигенам, выявляемым в реакции агглютинации, стафилококки разделяют более чем на 30 серовариантов. Однако серологический метод типирования стафилококков не получил еще широкого применения. К числу видоспецифических относят белок А, который образует S. aureus. Этот белок располагается поверхностно, он ковалентно связан с пептидогликаном, его м. м. составляет около 42 кД. Белок А особенно активно синтезируется в логарифмической фазе роста при температуре 41 °C, термолабилен, не разрушается трипсином; уникальным его свойством является способность связываться с Fc-фрагментом иммуноглобулинов IgG (IgG1, IgG2, IgG4), в меньшей степени с IgM и IgA. На поверхности белка А выявлено несколько участков, способных соединяться с участком полипептидной цепи иммуноглобулина, расположенным на границе доменов СН2 и СН3. Это свойство нашло широкое применение в реакции коагглютинации: стафилококки, нагруженные специфическими антителами, у которых остаются свободными активные центры, при взаимодействии с антигеном дают быструю реакцию агглютинации.
Взаимодействие белка А с иммуноглобулинами приводит к нарушениям функций систем комплемента и фагоцитов в организме больного. Он обладает антигенными свойствами, является сильным аллергеном и индуцирует размножение Т– и В-лимфоцитов. Его роль в патогенезе стафилококковых заболеваний выяснена еще не полностью.
Штаммы S. aureus различаются по чувствительности к стафилококковым фагам. Для типирования S. aureus используют международный набор из 23 умеренных фагов, которые разделены на четыре группы:
1-я группа – фаги 29, 52, 52А, 79, 80;
2-я группа – фаги 3А, 3С, 55, 71;
3-я группа – фаги 6, 42Е, 47, 53, 54, 75, 77, 83А, 84, 85;
4-я группа – фаги 94, 95, 96;
вне групп – фаг 81.
Отношение стафилококков к фагам своеобразное: один и тот же штамм может лизироваться либо одним фагом, либо одновременно несколькими. Но поскольку чувствительность их к фагам является признаком относительно стабильным, фаготипирование стафилококков имеет важное эпидемиологическое значение. Недостаток этого метода состоит в том, что типированию поддается не более 65 – 70 % S. aureus. В последние годы получены наборы специфических фагов и для типирования S. epidermidis.
Факторы патогенности стафилококков. Стафилококк – уникальный микроорганизм. Он может вызывать более 100 различных заболеваний, относящихся к одиннадцати классам по Международной классификации 1968 г. Стафилококки могут поражать любую ткань, любой орган. Это свойство стафилококков обусловлено наличием у них большого комплекса факторов патогенности.
1. Факторы адгезии – прикрепление стафилококков к клеткам тканей обусловлено их гидрофобностью (чем она выше, тем сильнее проявляются адгезивные свойства), а также адгезивными свойствами полисахаридов, возможно также белка А, и способностью связывать фибронектин (рецептор некоторых клеток).
2. Разнообразные ферменты, играющие роль факторов «агрессии и защиты»: плазмокоагулаза (главный фактор патогенности), гиалуронидаза, фибринолизин, ДНКаза, лизоцимоподобный фермент, лецитиназа, фосфатаза, протеиназа и т. д.
3. Комплекс секретируемых экзотоксинов:
а) мембраноповреждающие токсины – α, β, δ и γ. Ранее их описывали как гемолизины, некротоксины, лейкоцидины, летальные токсины, т. е. по характеру их действия: гемолиз эритроцитов, некроз при внутрикожном введении кролику, разрушение лейкоцитов, смерть кролика при внутривенном введении. Однако оказалось, что такой эффект вызывает один и тот же фактор – мембраноповреждающий токсин. Он обладает цитолитическим действием в отношении различных типов клеток, которое проявляется следующим образом. Молекулы этого токсина сначала связываются с неизвестными пока рецепторами мембраны клетки-мишени или неспецифически абсорбируются липидами, содержащимися в мембране, а затем формируют из 7 молекул грибовидный гептамер, состоящий из 3 доменов. Домены, формирующие «шляпку» и «край», расположены на внешней поверхности мембран, а домен «ножки» служит трансмембранным каналом-порой. Через нее и происходит вход и выход небольших молекул и ионов, что ведет к набуханию и гибели клеток, имеющих ядро, и осмотическому лизису эритроцитов. Обнаружено несколько типов мембраноповреждающих (порообразующих) токсинов: α-, β-, δ– и γ-гемолизины (α-, β-, δ– и γ-токсины). Они различаются по ряду свойств. Гемолизин α чаще обнаруживается у стафилококков, выделенных от человека, он лизирует эритроциты человека, кроликов и баранов. Летальный эффект у кроликов вызывает при внутривенном введении через 3 – 5 мин. Гемолизин β обнаруживают чаще у стафилококков животного происхождения, он лизирует человеческие и бараньи эритроциты (лучше при более низкой температуре). Гемолизин δ лизирует эритроциты человека и многих видов животных. Летальное действие на кролика при внутривенном введении вызывает через 16 – 24 – 48 ч. Очень часто у стафилококков обнаруживаются α– и δ-токсины одновременно;
б) эксфолиативные токсины А и В различают по антигенным свойствам, отношению к температуре (А – термостабилен, В – термолабилен), локализации генов, контролирующих их синтез (А контролируется хромосомным геном, В – плазмидным). Нередко у одного и того же штамма S. aureus синтезируются оба эксфолиатина. С этими токсинами связана способность стафилококков вызывать пузырчатку у новорожденных, буллезное импетиго, скарлатиноподобную сыпь;
в) истинный лейкоцидин – токсин, отличающийся от гемолизинов по антигенным свойствам, избирательно действует на лейкоциты, разрушая их;
г) экзотоксин, вызывающий синдром токсического шока (СТШ). Он обладает свойствами суперантигена. Для СТШ характерны повышение температуры, снижение артериального давления, кожные высыпания с последующим шелушением на кистях и стопах, лимфоцитопения, иногда диарея, поражение почек и др. К продукции и секреции этого токсина способны более 50 % штаммов S. aureus.
4. Сильные аллергизирующие свойства, которыми обладают как компоненты структуры клеток, так и экзотоксины и другие секретируемые бактериями продукты жизнедеятельности. Стафилококковые аллергены способны вызывать реакции гиперчувствительности как замедленного типа (ГЧЗ), так и немедленного типа (ГЧН). Стафилококки являются главными виновниками кожных и респираторных аллергий (дерматиты, бронхиальная астма и т. п.). Особенность патогенеза стафилококковой инфекции и ее тенденция к переходу в хроническую форму коренятся в эффекте ГЧЗ.
5. Перекрестно реагирующие антигены (с изоантигенами эритроцитов А и В, почек и кожи – индукция аутоантител, развитие аутоиммунных заболеваний).
6. Факторы, угнетающие фагоцитоз. Наличие их может проявляться в угнетении хемотаксиса, защите клеток от поглощения фагоцитами, в обеспечении стафилококкам возможности размножаться в фагоцитах и блокировке «окислительного взрыва». Фагоцитоз угнетают капсула, белок А, пептидогликан, тейхоевые кислоты, токсины. Кроме того, стафилококки индуцируют синтез некоторыми клетками организма (например, спленоцитами) супрессоров фагоцитарной активности. Угнетение фагоцитоза не только препятствует очищению организма от стафилококков, но и нарушает функцию процессинга и представления антигенов Т– и В-лимфоцитам, что ведет к снижению силы иммунного ответа.
Наличие капсулы у стафилококков повышает их вирулентность для белых мышей, делает устойчивыми к действию фагов, не позволяет типировать агглютинирующими сыворотками и маскирует белок А.
Тейхоевые кислоты не только защищают стафилококки от фагоцитоза, но, очевидно, играют существенную роль в патогенезе стафилококковых инфекций. Установлено, что у детей, страдающих эндокардитом, в 100 % случаев обнаруживаются антитела к тейхоевым кислотам.
7. Митогенное действие стафилококков в отношении лимфоцитов (этим действием обладают белок А, энтеротоксины и другие продукты, секретируемые стафилококками).
8. Энтеротоксины A, B, C1, C2, C3, D, E. Они характеризуются антигенной специфичностью, термостабильностью, устойчивостью к действию формалина (не превращаются в анатоксины) и пищеварительных ферментов (трипсина и пепсина), устойчивы в диапазоне рН от 4,5 до 10,0. Энтеротоксины являются низкомолекулярными белками с м. м. от 26 до 34 кД со свойствами суперантигенов.
Установлено также, что существуют генетически обусловленные различия в чувствительности к стафилококковой инфекции и характеру ее течения у людей. В частности, тяжелые стафилококковые гнойно-септические заболевания чаще обнаруживаются у людей с группами крови А и АВ, реже – у лиц 0 и В групп.
С синтезом энтеротоксинов связана способность стафилококков вызывать пищевые отравления типа интоксикации. Чаще всего они вызываются энтеротоксинами A и D. Механизм действия этих энтеротоксинов мало изучен, но он отличается от действия других бактериальных энтеротоксинов, которые нарушают функцию аденилатциклазной системы. Все типы стафилококковых энтеротоксинов вызывают сходную картину отравления: тошнота, рвота, боли в поджелудочной области, диарея, иногда головная боль, повышение температуры, мышечный спазм. Эти особенности стафилококковых энтеротоксинов обусловлены их суперантигенными свойствами: они индуцируют избыточный синтез интерлейкина-2, который и вызывает интоксикацию. Энтеротоксины возбуждают гладкую мускулатуру кишечника и повышают моторику желудочно-кишечного тракта. Отравление чаще всего связано с употреблением инфицированных стафилококком молочных продуктов (мороженого, пирожных, тортов, сыра, творога и т. п.) и консервов с маслом. Инфицирование молочных продуктов может быть связано с маститами у коров или с гнойно-воспалительными заболеваниями людей, имеющих отношение к производству продуктов.
Таким образом, обилие различных факторов патогенности у стафилококков и их высокие аллергизующие свойства обусловливают особенности патогенеза стафилококковых заболеваний, их характер, локализацию, тяжесть течения и клинические проявления. Авитаминоз, диабет, снижение иммунитета способствуют развитию стафилококковых заболеваний.
Резистентность стафилококков. Среди не образующих спор бактерий стафилококки, как и микобактерии, обладают наибольшей устойчивостью к внешним факторам. Они хорошо переносят высыхание и остаются жизнеспособными и вирулентными неделями и месяцами в сухой мельчайшей пыли, являясь источником пылевой инфекции. Прямой солнечный свет убивает их лишь в течение многих часов, а рассеянный действует очень слабо. Они устойчивы и к высокой температуре: нагревание до 80 °C выдерживают около 30 мин, сухой жар (110 °C) убивает их в течение 2 ч; низкие температуры переносят хорошо. Чувствительность к химическим дезинфектантам сильно варьирует, например, 3 %-ный раствор фенола убивает их в течение 15 – 30 мин, а 1 %-ный водный раствор хлорамина – за 2 – 5 мин.
Особенности эпидемиологии. Поскольку стафилококки являются постоянными обитателями кожи и слизистых оболочек, заболевания, вызываемые ими, могут иметь характер либо аутоинфекции (при различных повреждениях кожи и слизистых оболочек, в том числе и при микротравмах), либо экзогенной инфекции, обусловленной контактно-бытовым, воздушно-капельным, воздушно-пылевым или алиментарным (при пищевых отравлениях) способами заражения.
Особое значение имеет носительство патогенных стафилококков, так как носители, особенно в медицинских учреждениях (различные хирургические клиники, родильные дома и т. п.) и в закрытых коллективах, могут стать причиной стафилококковых инфекций. Носительство патогенных стафилококков может иметь временный или перемежающийся характер, но особую опасность для окружающих представляют лица, у которых оно является постоянным (резидентные носители). У таких людей стафилококки длительное время и в большом количестве персистируют на слизистых оболочках носа и зева. Причина длительного носительства не совсем ясна. Оно может быть следствием ослабления местного иммунитета (недостаток секреторных IgA), нарушения функций слизистой оболочки, повышения адгезивных свойств стафилококка или обусловлено какими-либо другими его свойствами.
Особенности патогенеза и клиники. Стафилококки легко проникают в организм через мельчайшие повреждения кожи и слизистых оболочек и могут вызвать самые различные заболевания – от юношеских угрей (acne) до тяжелейшего перитонита, эндокардита, сепсиса или септикопиемии, при которых летальность достигает 80 %. Стафилококки вызывают фурункулы, гидрадениты, абсцессы, флегмоны, остеомиелиты; в военное время – частые виновники гнойных осложнений ран; стафилококки играют ведущую роль в гнойной хирургии. Обладая аллергенными свойствами, они могут стать причиной псориаза, геморрагического васкулита, рожистого воспаления, неспецифического полиартрита. Инфицирование стафилококками пищевых продуктов – частая причина пищевых отравлений. Стафилококки – главные виновники сепсиса, в том числе у новорожденных. В отличие от бактериемии (бактерии в крови), которая является симптомом болезни и наблюдается при многих бактериальных инфекциях, сепсис (септицемия – гнилокровие) представляет собой самостоятельную болезнь с определенной клинической картиной, в основе которой лежит поражение органов ретикулоэндотелиальной системы (системы мононуклеарных фагоцитов – СМФ). При сепсисе имеется гнойный очаг, из которого в кровь периодически поступает возбудитель, разносится по организму и поражает ретикулоэндотелиальную систему (СМФ), в клетках которой он размножается, выделяя токсины и аллергены. При этом клиническая картина сепсиса слабо зависит от вида возбудителя, а определяется поражением тех или иных органов.
Септикопиемия – форма сепсиса, при котором возбудитель вызывает гнойные очаги в различных органах и тканях, т. е. это сепсис, осложненный гнойными метастазами.
Бактериемия при сепсисе и септикопиемии может быть кратковременной и длительной.
Постинфекционный иммунитет существует, он обусловлен как гуморальными, так и клеточными факторами. Важную роль в нем играют антитоксины, антимикробные антитела, антитела против ферментов, а также Т-лимфоциты и фагоциты. Напряженность и длительность иммунитета против стафилококков изучены недостаточно, так как у них слишком разнообразна антигенная структура, а перекрестного иммунитета нет.
Лабораторная диагностика. Основной метод – бактериологический; разработаны и внедрены серологические реакции. В случае необходимости (при интоксикациях) прибегают к биологической пробе. Материалом для бактериологического исследования служат кровь, гной, слизь из зева, носа, отделяемое ран, мокрота (при стафилококковой пневмонии), испражнения (при стафилококковом колите), в случае пищевых интоксикаций – рвотные массы, испражнения, промывные воды желудка, подозрительные продукты. Материал засевают на кровяной агар (гемолиз), на молочно-солевой (молочно-желточно-солевой) агар (угнетается рост посторонних бактерий за счет NaCl, лучше выявляются пигмент и лецитиназа). Выделенную культуру идентифицируют по видовым признакам, определяют у нее наличие основных признаков и факторов патогенности (золотистый пигмент, сбраживание маннита, гемолиз, плазмокоагулаза), обязательно проверяют чувствительность к антибиотикам, в случае необходимости проводят фаготипирование. Из числа серологических реакций для диагностики гнойно-септических заболеваний применяют РПГА и ИФМ, в частности для определения антител к тейхоевой кислоте или к видоспецифическим антигенам.
Для определения энтеротоксигенности стафилококков используют три метода:
1) серологический – с помощью специфических антитоксических сывороток в реакции преципитации в геле обнаруживают энтеротоксин и устанавливают его тип;
2) биологический – внутривенное введение фильтрата бульонной культуры стафилококка кошкам в дозе 2 – 3 мл на 1 кг веса. Токсины вызывают у кошек рвоту и понос;
3) непрямой бактериологический метод – выделение из подозрительного продукта чистой культуры стафилококка и определение у него факторов патогенности (образование энтеротоксина коррелирует с наличием других факторов патогенности, в частности РНК-азы).
Наиболее простым и чувствительным является серологический метод обнаружения энтеротоксина.
Лечение. Для лечения стафилококковых заболеваний используют главным образом бета-лактамные антибиотики, к которым прежде всего следует определять чувствительность. При тяжелых и хронических стафилококковых инфекциях положительный эффект дает специфическая терапия – применение аутовакцины, анатоксина, противостафилококкового иммуноглобулина (человеческого), антистафилококковой плазмы.
Специфическая профилактика. Для создания искусственного иммунитета против стафилококковой инфекции применяют стафилококковый анатоксин (жидкий и таблетированный), но он создает антитоксический иммунитет только против стафилококков, лизируемых главным образом фагами I группы. Применение вакцин из убитых стафилококков или их антигенов хотя и приводит к появлению антимикробных антител, но только против тех серовариантов, из которых изготовлена вакцина. Проблема изыскания высокоиммуногенной вакцины, эффективной против многих видов патогенных стафилококков, – одна из важнейших проблем современной микробиологии.
Стрептококки относятся к семейству Streptococcaceae (род Streptococcus). Впервые были обнаружены Т. Бильротом в 1874 г. при роже; Л. Пастером – в 1878 г. при послеродовом сепсисе; выделены в чистой культуре в 1883 г. Ф. Фелейзеном.
Стрептококки (греч. streptos – цепочка и coccus – зерно) – грамположительные, цитохромнегативные, каталазонегативные клетки шаровидной или овоидной формы диаметром 0,6 – 1,0 мкм, растут в виде цепочек различной длины (см. цв. вкл., рис. 92) или в виде тетракокков; неподвижны (кроме некоторых представителей серогруппы Д); содержание Г + Ц в ДНК – 32 – 44 мол % (для семейства). Спор не образуют. Патогенные стрептококки образуют капсулу. Стрептококки – факультативные анаэробы, но имеются и строгие анаэробы. Температурный оптимум 37 °C, оптимальная рН 7,2 – 7,6. На обычных питательных средах патогенные стрептококки или не растут, или растут очень скудно. Для их культивирования обычно используют сахарный бульон и кровяной агар, содержащий 5 % дефибринированной крови. Среда не должна содержать восстанавливающих сахаров, так как они угнетают гемолиз. На бульоне рост придонно-пристеночный в виде крошковатого осадка, бульон прозрачен. Стрептококки, образующие короткие цепочки, вызывают помутнение бульона. На плотных средах стрептококки серогруппы А образуют колонии трех типов: а) мукоидные – крупные, блестящие, напоминают каплю воды, но имеют вязкую консистенцию. Такие колонии образуют свежевыделенные вирулентные штаммы, имеющие капсулу;
б) шероховатые – более крупные, чем мукоидные, плоские, с неровной поверхностью и фестончатыми краями. Такие колонии образуют вирулентные штаммы, имеющие М-антигены;
в) гладкие, менее крупные колонии с ровными краями; образуют невирулентные культуры.
Стрептококки ферментируют глюкозу, мальтозу, сахарозу и некоторые другие углеводы с образованием кислоты без газа (кроме S. kefir, который образует кислоту и газ), молоко не свертывают (кроме S. lactis), протеолитическими свойствами не обладают (кроме некоторых энтерококков).
Классификация стрептококков. Род стрептококков включает около 50 видов. Среди них выделяют 4 патогенных (S. pyogenes, S. pneumoniae, S. agalactiаe и S. equi), 5 условно-патогенных и более 20 оппортунистических видов. Для удобства весь род подразделяют на 4 группы, используя следующие признаки: рост при температуре 10 °C; рост при 45 °C; рост на среде, содержащей 6,5 % NaCl; рост на среде с рН 9,6;
рост на среде, содержащей 40 % желчи; рост в молоке с 0,1 %-ным метиленовым синим; рост после прогревания при температуре 60 °C в течение 30 мин.
Большинство патогенных стрептококков относится к первой группе (все перечисленные признаки, как правило, отрицательны). Энтерококки (серогруппа Д), которые также вызывают различные заболевания человека, относятся к третьей группе (все перечисленные признаки, как правило, положительны).
В основе наиболее простой классификации лежит отношение стрептококков к эритроцитам. Различают:
– β-гемолитические стрептококки – при росте на кровяном агаре вокруг колонии четкая зона гемолиза (см. цв. вкл., рис. 93а);
– α-гемолитические стрептококки – вокруг колонии зеленоватое окрашивание и частичный гемолиз (позеленение обусловлено превращением оксигемоглобина в метгемоглобин, см. цв. вкл., рис. 93б);
– α1-гемолитические стрептококки по сравнению с β-гемолитическими стрептококками образуют менее выраженную и мутноватую зону гемолиза;
– α– и α1-стрептококки называют S. viridans (зеленящими стрептококками);
– γ-негемолитические стрептококки не вызывают гемолиза на плотной питательной среде.
Большое практическое значение получила серологическая классификация. Стрептококки имеют сложное антигенное строение: у них имеется общий для всего рода антиген и различные другие антигены. Среди них особое значение для классификации имеют группоспецифические полисахаридные антигены, локализованные в клеточной стенке. По этим антигенам по предложению Р. Лансфельд стрептококки разделены на серологические группы, обозначаемые буквами A, B, C, D, F, G и т. д. Сейчас известны 20 серологических групп стрептококков (от А до V). Патогенные для человека стрептококки относятся к группе А, к группам B и D, реже – к C, F и G. В связи с этим определение групповой принадлежности стрептококков является решающим моментом в диагностике вызываемых ими болезней. Групповые полисахаридные антигены определяются с помощью соответствующих антисывороток в реакции преципитации.
Помимо групповых антигенов у гемолитических стрептококков обнаружены типоспецифические антигены. У стрептококков группы А ими являются белки М, Т и R. Белок М термоустойчив в кислой среде, но разрушается трипсином и пепсином. Его обнаруживают после соляно-кислого гидролиза стрептококков с помощью реакции преципитации. Белок Т разрушается при нагревании в кислой среде, но устойчив к действию трипсина и пепсина. Его определяют с помощью реакции агглютинации. R-антиген обнаружен также у стрептококков серогрупп B, C и D. Он чувствителен к пепсину, но не к трипсину, разрушается при нагревании в присутствии кислоты, но устойчив при умеренном нагревании в слабом щелочном растворе. По М-антигену гемолитические стрептококки серогруппы А подразделяют на большое количество серовариантов (около 100), их определение имеет эпидемиологическое значение. По Т-белку стрептококки серогруппы А также подразделяют на несколько десятков серовариантов. В группе В различают 8 серовариантов.
Стрептококки также имеют перекрестно реагирующие антигены, общие для антигенов клеток базального слоя эпителия кожи и эпителиальных клеток корковой и медуллярной зон тимуса, что, возможно, является причиной аутоиммунных нарушений, вызываемых этими кокками. В клеточной стенке стрептококков обнаружен антиген (рецептор II), с которым связана их способность, как и стафилококков, имеющих белок А, взаимодействовать с Fc-фрагментом молекулы IgG.
Болезни, вызываемые стрептококками, распределены по 11 классам. Основные группы этих болезней таковы: а) различные нагноительные процессы – абсцессы, флегмоны, отиты, перитониты, плевриты, остеомиелиты и др.;
б) рожистое воспаление – раневая инфекция (воспаление лимфатических сосудов кожи и подкожной клетчатки);
в) гнойные осложнения ран (особенно в военное время) – абсцессы, флегмоны, сепсис и др.;
г) ангины – острые и хронические;
д) сепсисы: острый сепсис (острый эндокардит); хронический сепсис (хронический эндокардит); послеродовый (пуэрперальный) сепсис;
е) ревматизм;
ж) пневмонии, менингиты, ползучая язва роговицы (пневмококк);
з) скарлатина;
и) кариес зубов – возбудителем его чаще всего является S. mutans. Выделены и изучаются гены кариесогенных стрептококков, ответственные за синтез ферментов, которые обеспечивают колонизацию этими стрептококками поверхности зубов и десен.
Хотя бо́льшая часть патогенных для человека стрептококков относится к серогруппе А, важную роль в патологии человека играют и стрептококки серогрупп D и B. Стрептококки серогруппы D (энтерококки) признаны возбудителями раневых инфекций, различных гнойных хирургических заболеваний, гнойных осложнений у беременных, родильниц и гинекологических больных, инфицируют почки, мочевой пузырь, вызывают сепсис, эндокардит, пневмонии, пищевые токсикоинфекции (протеолитические варианты энтерококков). Стрептококки серогруппы В (S. agalactiae) часто вызывают заболевания новорожденных – инфекции дыхательных путей, менингит, септицемию. Эпидемиологически они связаны с носительством этого вида стрептококков у матери и персонала родильных домов.
Анаэробные стрептококки (Peptostreptococcus), которые обнаруживаются у здоровых людей в составе микрофлоры дыхательных путей, рта, носоглотки, кишечника и влагалища, также могут быть виновниками гнойно-септических заболеваний – аппендицита, послеродового сепсиса и др.
Основные факторы патогенности стрептококков.
1. Белок М – главный фактор патогенности. М-белки стрептококка представляют собой фибриллярные молекулы, которые образуют фимбрии на поверхности клеточной стенки стрептококков группы А. М-белок определяет адгезивные свойства, угнетает фагоцитоз, определяет антигенную типоспецифичность и обладает свойствами суперантигена. Антитела к М-антигену обладают защитными свойствами (антитела к Т– и R-белкам такими свойствами не обладают). М-подобные белки обнаружены у стрептококков групп С и G и, возможно, являются факторами их патогенности.
2. Капсула. Она состоит из гиалуроновой кислоты, аналогичной той, которая входит в состав ткани, поэтому фагоциты не распознают стрептококки, имеющие капсулу, как чужеродные антигены.
3. Эритрогенин – скарлатинозный токсин, суперантиген, вызывает СТШ. Различают три серотипа (А, В, С). У больных скарлатиной он вызывает появление ярко-красной сыпи на коже и слизистой оболочке. Обладает пирогенным, аллергенным, иммуносупрессивным и митогенным действием, разрушает тромбоциты.
4. Гемолизин (стрептолизин) О разрушает эритроциты, обладает цитотоксическим, в том числе лейкотоксическим и кардиотоксическим, действием, его образуют большинство стрептококков серогрупп А, С и G.
5. Гемолизин (стрептолизин) S обладает гемолитическим и цитотоксическим действием. В отличие от стрептолизина О, стрептолизин S является очень слабым антигеном, его также продуцируют стрептококки серогрупп А, С и G.
6. Стрептокиназа – фермент, который превращает преактиватор в активатор, а он – плазминоген в плазмин, последний и гидролизует фибрин. Таким образом, стрептокиназа, активируя фибринолизин крови, повышает инвазивные свойства стрептококка.
7. Фактор, угнетающий хемотаксис (аминопептидаза), подавляет подвижность нейтрофильных фагоцитов.
8. Гиалуронидаза – фактор инвазии.
9. Фактор помутнения – гидролиз липопротеидов сыворотки крови.
10. Протеазы – разрушение различных белков; возможно, с ними связана тканевая токсичность.
11. ДНКазы (A, B, C, D) – гидролиз ДНК.
12. Способность взаимодействовать с Fc-фрагментом IgG с помощью рецептора II – угнетение системы комплемента и активности фагоцитов.
13. Выраженные аллергенные свойства стрептококков, которые обусловливают сенсибилизацию организма.
Резистентность стрептококков. Стрептококки хорошо переносят низкие температуры, довольно устойчивы к высыханию, особенно в белковой среде (кровь, гной, слизь), сохраняют жизнеспособность в течение нескольких месяцев на предметах и пыли. При нагревании до температуры 56 °C погибают через 30 мин, кроме стрептококков группы D, которые выдерживают нагревание до 70 °C в течение 1 ч 3 – 5 % раствор карболовой кислоты и лизола убивает их в течение 15 мин.
Особенности эпидемиологии. Источником экзогенной стрептококковой инфекции служат больные острыми стрептококковыми болезнями (ангина, скарлатина, пневмония), а также реконвалесценты после них. Основной способ заражения – воздушно-капельный, в других случаях – прямой контакт и очень редко алиментарный (молоко и другие пищевые продукты).
Особенности патогенеза и клиники. Стрептококки являются обитателями слизистых оболочек верхних дыхательных путей, пищеварительного и мочеполового трактов, поэтому вызываемые ими заболевания могут быть эндогенного или экзогенного характера, т. е. вызываются либо собственными кокками, либо в результате заражения извне. Проникнув через поврежденную кожу, стрептококки распространяются из местного очага через лимфатическую и кровеносную системы. Заражение воздушно-капельным или воздушно-пылевым путем приводит к поражению лимфоидной ткани (тонзиллиты), в процесс вовлекаются регионарные лимфатические узлы, откуда возбудитель распространяется по лимфатическим сосудам и гематогенно.
Способность стрептококков вызывать различные заболевания зависит от:
а) места входных ворот (раневые инфекции, пуэрперальный сепсис, рожистое воспаление и др.; инфекции дыхательных путей – скарлатина, ангины);
б) наличия у стрептококков различных факторов патогенности;
в) состояния иммунной системы: при отсутствии антитоксического иммунитета заражение токсигенными стрептококками серогруппы А приводит к развитию скарлатины, а при наличии антитоксического иммунитета возникает ангина;
г) сенсибилизирующих свойств стрептококков; они во многом определяют особенность патогенеза стрептококковых заболеваний и являются основной причиной таких осложнений, как нефрозонефриты, артриты, поражение сердечно-сосудистой системы и др.;
д) гноеродных и септических функций стрептококков;
е) наличия большого количества серовариантов стрептококков серогруппы А по М-антигену.
Антимикробный иммунитет, который обусловлен антителами к белку М, имеет типоспецифический характер, а поскольку серовариантов по М-антигену очень много, возможны повторные заболевания ангиной, рожей и другими стрептококковыми болезнями. Более сложный характер имеет патогенез хронических инфекций, обусловленных стрептококками: хронический тонзиллит, ревматизм, нефрит. Подтверждением этиологической роли в них стрептококков серогруппы А служат следующие обстоятельства:
1) эти заболевания, как правило, возникают после перенесения острых стрептококковых инфекций (ангина, скарлатина);
2) у таких больных часто обнаруживают стрептококки или их L-формы и антигены в крови, особенно при обострениях, и, как правило, гемолитические или зеленящие стрептококки на слизистой зева;
3) постоянное обнаружение антител к различным антигенам стрептококков. Особенно ценное диагностическое значение имеет обнаружение у больных ревматизмом во время обострения в крови анти-О-стрептолизинов и антигиалуронидазных антител в высоких титрах;
4) развитие сенсибилизации к различным стрептококковым антигенам, в том числе к термостабильному компоненту эритрогенина. Возможно, что в развитии ревматизма и нефрита играют роль аутоантитела к соединительной и почечной ткани соответственно;
5) очевидный терапевтический эффект от применения антибиотиков против стрептококков (пенициллина) во время ревматических атак.
Постинфекционный иммунитет. Основную роль в его формировании играют антитоксины и типоспецифические М-антитела. Антитоксический иммунитет после скарлатины носит прочный длительный характер. Антимикробный иммунитет также прочный и длительный, но его эффективность ограничивается типоспецифичностью М-антител.
Лабораторная диагностика. Основным методом диагностики стрептококковых заболеваний является бактериологический. Материалом для исследования служат кровь, гной, слизь из зева, налет с миндалин, отделяемое ран. Решающим этапом исследования выделенной чистой культуры является определение ее серогруппы. Для этой цели используют два метода.
А. Серологический – определение группового полисахарида с помощью реакции преципитации. Для этой цели используют соответствующие группоспецифические сыворотки. Если штамм является бета-гемолитическим, его полисахаридный антиген экстрагируют HCl и испытывают с антисыворотками серогрупп A, B, C, D, F и G. Если штамм не вызывает бета-гемолиза, его антиген экстрагируют и проверяют с антисыворотками только групп B и D. Антисыворотки групп A, C, F и G часто дают перекрестные реакции с альфа-гемолитическими и негемолитическими стрептококками. Стрептококки, которые не вызывают бета-гемолиза и не принадлежат к группам B и D, идентифицируют по другим физиологическим тестам (табл. 20). Стрептококки группы D выделены в самостоятельный род Enterococcus.
Б. Метод группирования – основан на способности аминопептидазы (фермент, который продуцируют стрептококки серогрупп A и D) гидролизовать пирролидин-нафтиламид. С этой целью выпускают коммерческие наборы необходимых реагентов, предназначенных для определения стрептококков группы А в кровяных и бульонных культурах. Однако специфичность этого метода составляет менее 80 %. Серотипирование стрептококков серогруппы А производят с помощью реакции либо преципитации (определяют М-серотип), либо агглютинации (определяют Т-серотип) только в эпидемиологических целях.
Из числа серологических реакций для обнаружения стрептококков серогрупп A, B, C, D, F и G используют реакции коагглютинации и латекс-агглютинации. Определение титра антигиалуронидазных и анти-О-стрептолизиновых антител используют как вспомогательный метод диагностики ревматизма и для оценки активности ревматического процесса.
Для обнаружения стрептококковых полисахаридных антигенов может быть использован также ИФМ.
ПНЕВМОКОККИ
Особое положение в роде Streptococcus занимает вид S. pneumoniae, играющий очень важную роль в патологии человека. Обнаружен он был Л. Пастером в 1881 г. Его роль в этиологии крупозной пневмонии установили в 1886 г. А. Френкель и А. Вейксельбаум, вследствие чего S. pneumoniae называют пневмококком. Морфология его своеобразна: кокки имеют форму, напоминающую пламя свечи: один ко-
Таблица 20
Дифференциация некоторых категорий стрептококков
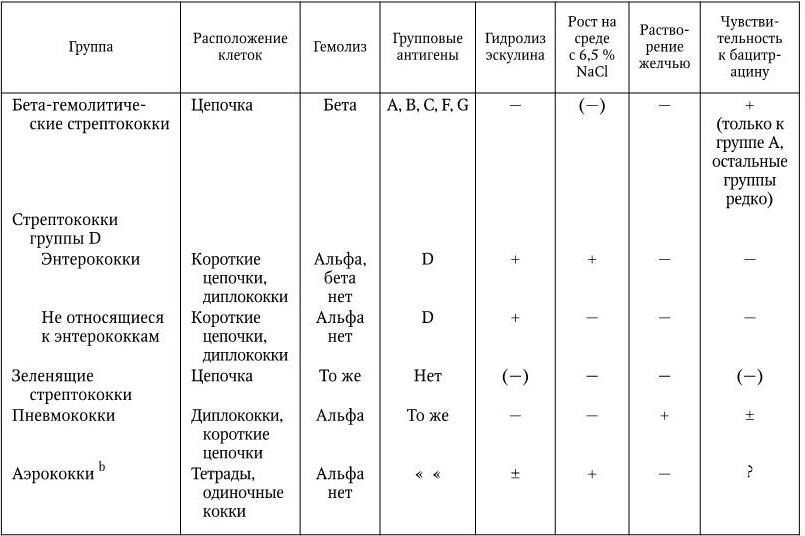
Примечание: + – положительный, – негативный, ( – ) – очень редкие признаки, (±) – признак непостоянный; b аэрококки – Aerococcus viridans, обнаруживается приблизительно у 1 % больных, страдающих стрептококковыми заболеваниями (остеомиелит, подострый эндокардит, инфекции мочевых путей). Выделены в самостоятельный вид в 1976 г., изучены недостаточно.
нец клетки заострен, другой – уплощен; располагаются обычно парами (плоские концы обращены друг к другу), иногда в виде коротких цепочек (см. цв. вкл., рис. 94б). Жгутиков не имеют, спор не образуют. В организме человека и животных, а также на средах, содержащих кровь или сыворотку, образуют капсулу (см. цв. вкл., рис. 94а). Грамположительны, но в молодых и старых культурах нередко грамотрицательны. Факультативные анаэробы. Температурный оптимум для роста 37 °C, при температуре ниже 28 °C и выше 42 °C не растут. Оптимальная рН для роста 7,2 – 7,6. Пневмококки образуют перекись водорода, но у них нет каталазы, поэтому для роста они требуют добавления субстратов, содержащих этот фермент (кровь, сыворотка). На кровяном агаре мелкие круглые колонии окружены зеленой зоной, образующейся в результате действия экзотоксина гемолизина (пневмолизина). Рост на сахарном бульоне сопровождается помутнением и выпадением небольшого осадка. Помимо О-соматического антигена, пневмококки имеют капсульный полисахаридный антиген, отличающийся большим разнообразием: по полисахаридному антигену пневмококки разделяют на 83 сероварианта, 56 из них разбиты на 19 групп, 27 представлены самостоятельно. От всех остальных стрептококков пневмококки отличаются морфологией, антигенной специфичностью, а также тем, что ферментируют инулин и проявляют высокую чувствительность к оптохину и желчи. Под влиянием желчных кислот у пневмококков активируется внутриклеточная амидаза. Она разрывает связь между аланином и мураминовой кислотой пептидогликана, клеточная стенка разрушается, и наступает лизис пневмококков.
Главным фактором патогенности пневмококков является капсула полисахаридной природы. Бескапсульные пневмококки утрачивают вирулентность.
Пневмококки являются основными возбудителями острых и хронических воспалительных заболеваний легких, которые занимают одно из ведущих мест в заболеваемости, инвалидизации и смертности населения всего мира.
Пневмококки наряду с менингококками являются главными виновниками менингита. Кроме того, они вызывают ползучую язву роговицы, отиты, эндокардиты, перитониты, септицемии и ряд других заболеваний.
Постинфекционный иммунитет типоспецифический, обусловлен появлением антител против типового капсульного полисахарида.
Лабораторная диагностика основана на выделении и идентификации S. pneumoniae. Материалом для исследования служат мокрота и гной. К пневмококкам очень чувствительны белые мыши, поэтому нередко для выделения пневмококков пользуются биологической пробой. У погибших мышей пневмококки обнаруживаются в препарате-мазке из селезенки, печени, лимфатических узлов, а при посеве из этих органов и из крови выделяют чистую культуру. Для определения серотипа пневмококков используют реакцию агглютинации на стекле с типовыми сыворотками или феномен «набухания капсул» (в присутствии гомологичной сыворотки капсула пневмококков резко набухает).
Специфическая профилактика пневмококковых заболеваний осуществляется с помощью вакцин, приготовленных из высокоочищенных капсульных полисахаридов тех 12 – 14 серовариантов, которые чаще всего вызывают заболевания (1, 2, 3, 4, 6A, 7, 8, 9, 12, 14, 18C, 19, 25). Вакцины высокоиммуногенны.
МИКРОБИОЛОГИЯ СКАРЛАТИНЫ
Скарлатина (позднелат. scarlatium – ярко-красный цвет) – острое инфекционное заболевание, которое клинически проявляется ангиной, лимфаденитом, мелкоточечной ярко-красной сыпью на коже и слизистой оболочке с последующим шелушением, а также общей интоксикацией организма и наклонностью к гнойно-септическим и аллергическим осложнениям.
Возбудителями скарлатины являются бета-гемолитические стрептококки группы А, имеющие М-антиген и продуцирующие эритрогенин. Этиологическую роль при скарлатине приписывали разным микроорганизмам – простейшим, анаэробным и другим коккам, стрептококкам, фильтрующимся формам стрептококка, вирусам. Решающий вклад в выяснение истинной причины скарлатины был сделан русскими учеными Г. Н. Габричевским, И. Г. Савченко и американскими учеными супругами Дик (G. F. Dick и G. H. Dick). И. Г. Савченко еще в 1905 – 1906 гг. показал, что скарлатинозный стрептококк вырабатывает токсин, а полученная им антитоксическая сыворотка обладает хорошим лечебным действием. Исходя из работ И. Г. Савченко, супруги Дик в 1923 – 1924 гг. показали, что:
1) введение внутрикожно небольшой дозы токсина лицам, не болевшим скарлатиной, вызывает у них положительную местную токсическую реакцию в виде покраснения и припухлости (реакция Дика);
2) у лиц, переболевших скарлатиной, эта реакция отрицательна (токсин нейтрализуется имеющимся у них антитоксином);
3) введение больших доз токсина подкожно лицам, не болевшим скарлатиной, вызывает у них симптомы, характерные для скарлатины.
Наконец, путем заражения добровольцев культурой стрептококка они смогли воспроизвести скарлатину. В настоящее время стрептококковая этиология скарлатины общепризнана. Своеобразие здесь заключается в том, что скарлатину вызывает не один какой-либо серотип стрептококков, а любой из бета-гемолитических стрептококков, обладающий М-антигеном и продуцирующий эритрогенин. Однако в эпидемиологии скарлатины в разных странах, в разных их регионах и в разное время основную роль играют стрептококки, имеющие разные серотипы М-антигена (1, 2, 4 или другой) и продуцирующие эритрогенины разных серотипов (A, B, C). Возможна смена этих серотипов.
В качестве главных факторов патогенности стрептококков при скарлатине выступают экзотоксин (эритрогенин), гноеродно-септические и аллергенные свойства стрептококка и его эритрогенина. Эритрогенин состоит из двух компонентов – термолабильного белка (собственно токсин) и термостабильной субстанции, обладающей аллергенными свойствами.
Заражение при скарлатине происходит в основном воздушно-капельным путем, однако входными воротами могут быть и любые раневые поверхности. Инкубационный период 3 – 7, иногда 11 дней. В патогенезе скарлатины находят свое отражение 3 основных момента, связанные со свойствами возбудителя:
1) действие скарлатинозного токсина, который обусловливает развитие токсикоза – первый период болезни. Он характеризуется поражением периферических кровеносных сосудов, появлением мелкоточечной сыпи ярко-красного цвета, а также повышением температуры и общей интоксикацией. Развитие иммунитета связано с появлением и накоплением в крови антитоксина;
2) действие самого стрептококка. Оно неспецифично и проявляется в развитии различных гнойно-септических процессов (отиты, лимфадениты, нефриты появляются на 2 – 3-й нед. болезни);
3) сенсибилизация организма. Она находит свое отражение в виде различных осложнений типа нефрозонефритов, полиартритов, сердечно-сосудистых заболеваний и т. п. на 2 – 3-й нед. болезни.
В клинике скарлатины также различают I (токсикоз) и II стадию, когда наблюдаются гнойно-воспалительные и аллергические осложнения. В связи с применением для лечения скарлатины антибиотиков (пенициллин) частота и тяжесть осложнений значительно снизились.
Постинфекционный иммунитет прочный, длительный (повторные заболевания наблюдаются в 2 – 16 % случаев), обусловлен антитоксинами и клетками иммунной памяти. У переболевших сохраняется и аллергическое состояние к скарлатинозному аллергену. Оно выявляется с помощью внутрикожного введения убитых стрептококков. У переболевших на месте введения – покраснение, припухлость, болезненность (проба Аристовского – Фанкони). Для проверки наличия антитоксического иммунитета у детей используют реакцию Дика. С ее помощью установлено, что пассивный иммунитет у детей 1-го года жизни сохраняется в течение первых 3 – 4 мес.
Лабораторная диагностика. В типичных случаях клиническая картина скарлатины так ясна, что бактериологическая диагностика не проводится. В иных случаях она заключается в выделении чистой культуры бета-гемолитического стрептококка, который у всех больных скарлатиной обнаруживается на слизистой оболочке зева. Аэробные грамположительные кокки, отнесенные к родам Aerococcus, Leuconostoc, Pediococcus и Lactococcus, характеризуются слабой патогенностью. Заболевания, которые они вызывают у человека, наблюдаются редко и преимущественно у лиц с нарушениями иммунной системы.
Грамотрицательные кокки относятся к семейству Neisseriaceae класса Betaproteobacteria (роды Neisseria и Kingella) и семейству Moraxellaceae класса Gammaproteobacteria (роды Moraxella и Acinetobacter). Род Neisseria получил название в честь А. Нейссера, который впервые обнаружил в 1879 г. возбудителя гонореи. К роду Neisseria относят 22 вида, из которых два являются патогенными – N. meningitidis и N. gonorrhoeae, а еще шесть (N. flava, N. subflava, N. perflava, N. sicca, N. mucosa и N. flavescens) – представители нормальной микрофлоры слизистой носоглотки и верхних дыхательных путей. В последние годы все чаще наблюдаются гнойновоспалительные заболевания (ангины, менингиты, отиты, конъюнктивиты и т. п.), возбудителями которых служат бактерии родов Moraxella, Acinetobacter и Kingella.
Микробиология менингококковых инфекций
N. meningitidis – возбудитель гнойного цереброспинального менингита – был впервые обнаружен в 1884 г. Е. Маркиафавой и Е. Челли, а выделен в 1887 г. А. Вейксельбаумом.
Менингококки – грамотрицательные шаровидные клетки диаметром 0,6 – 0,8 мкм. В мазках, приготовленных из материала, взятого от больного, они имеют форму кофейного зерна, часто располагаются парами или тетрадами, или беспорядочно, нередко внутри лейкоцитов – незавершенный фагоцитоз. В мазках из культур менингококки имеют правильную круглую форму, но разные размеры, располагаются беспорядочно или тетрадами, наряду с грамотрицательными могут быть и грамположительные кокки. Спор не образуют, жгутиков не имеют. Все менингококки, кроме группы В, образуют капсулу. Содержание Г + Ц в ДНК – 50,5 – 51,3 мол %. Менингококки – строгие аэробы, на обычных средах не растут. Для их роста требуется добавление сыворотки, оптимальная для роста рН 7,2 – 7,4, температура – 37 °C, при температуре ниже 22 °C не растут. Колонии на плотных средах нежные, прозрачные, размером 2 – 3 мм. На сывороточном бульоне образуют помутнение и небольшой осадок на дне. На поверхности через 2 – 3 дня появляется пленка. При посеве от больных менингококки чаще выделяются в S-форме, однако при культивировании на питательных средах они нередко превращаются в R-формы и утрачивают ряд биологических свойств, в том числе часть антигенов, что необходимо учитывать.
Биохимическая активность менингококков невелика. Они ферментируют глюкозу и мальтозу с образованием кислоты без газа, не разжижают желатин, оксидазоположительны.
Антигенное строение. У менингококков учитывают четыре антигенные системы.
1. Капсульные полисахаридные антигены; в зависимости от их специфичности менингококки делятся на следующие группы: A, B, C, Y, X, Z, D, N, 29E, W135, H, I, K, L. У большинства известных серогрупп определен химический состав специфических полисахаридов, например у серогруппы А – N-ацетил-3-О-ацетил-маннозоаминофосфат.
2. Белковые антигены наружной мембраны. Они разделены на 5 классов. Белки классов 2 и 3 определяют 20 серотипов, а белки класса 1 – подтипы.
3. Белковый антиген, общий для всего вида N. meningitidis.
4. Липополисахаридные антигены – 8 серотипов.
В соответствии с этим антигенная формула менингококков имеет следующий вид: серогруппа: серотип по белку: субтип по белку: серотип по ЛПС. Например, В:15:Р1:16 – серогруппа В, серотип 15, субтип 16. Изучение антигенного строения имеет важное значение не только для дифференциации менингококков, но и для выяснения тех антигенов, которые обладают наибольшей иммуногенностью.
Резистентность. Менингококки крайне неустойчивы к действию факторов внешней среды. Быстро погибают под влиянием прямых солнечных лучей, от высыхания гибнут через несколько часов, при нагревании до 80 °C – через 2 мин. Обычные химические дезинфектанты убивают их за несколько минут. В отличие от многих других бактерий, они быстро погибают при низких температурах, что следует учитывать при доставке материала от больных в зимнее время.
Факторы патогенности. Менингококки обладают факторами патогенности, которые обусловливают их способность к адгезии и колонизации клеток, инвазии и защите от фагоцитоза. Кроме того, они обладают токсичностью и аллергенностью. Факторами адгезии и колонизации являются пили и белки наружной мембраны. Факторами инвазивности – гиалуронидаза и другие ферменты, деполимеризующие субстраты ткани хозяина. Главным фактором патогенности менингококков являются капсульные полисахаридные антигены, защищающие их от фагоцитоза. У бескапсульных менингококков серогруппы В защиту от фагоцитоза обеспечивает также полисахаридный антиген В. Подавление активности фагоцитов способствует беспрепятственному распространению менингококков в организме и генерализации инфекционного процесса.
Токсичность менингококков обусловлена наличием у них липополисахарида, который, помимо токсичности, обладает пирогенным, некротическим и летальным действием. В качестве факторов патогенности можно рассматривать и наличие у них таких ферментов, как нейраминидаза, некоторых протеаз, плазмокоагулазы, фибринолизина, а также проявление гемолитической и антилизоцимной активности, хотя они обнаруживаются и проявляются в неодинаковой степени у разных серогрупп.
Эпидемиология. Источником инфекции является только человек. Особенностью эпидемиологии менингококковых инфекций является довольно широкое распространение так называемого «здорового» носительства, т. е. носительство менингококков практически здоровыми людьми. Такое носительство – основной фактор, поддерживающий циркуляцию менингококков среди населения и поэтому создающий постоянную угрозу вспышек заболевания. Соотношение больных менингококковой инфекцией и «здоровых» носителей может варьировать от 1: 1000 до 1: 20 000.
Причина «здорового» носительства менингококков требует выяснения.
Все крупные вспышки менингококковых инфекций были связаны с менингококками серогрупп А и, реже С. После создания эффективных вакцин против этих серогрупп основную роль в эпидемиологии менингита стали играть менингококки серогруппы В. Менингококки других серогрупп вызывают спорадические заболевания.
Особенности патогенеза и клиники. Заражение происходит воздушно-капельным путем. Входными воротами инфекции является носоглотка, откуда менингококки проникают в лимфатические сосуды и в кровь. Менингококки могут вызывать следующие клинические формы болезни: назофарингит (наиболее легкая форма болезни); менингококцемия (менингококковый сепсис); в результате преодоления гематоэнцефалического барьера менингококки могут проникнуть в спинномозговую жидкость и вызвать наиболее тяжелую форму болезни – эпидемический цереброспинальный менингит – гнойное воспаление мозговых оболочек спинного и головного мозга. У таких больных ликвор мутный, содержит много лейкоцитов и при пункции вытекает струей вследствие высокого давления. В некоторых случаях развивается менингококковый эндокардит. При менингококцемии поражаются надпочечники и свертывающая система крови. Многообразие клинических проявлений болезни определяется, по-видимому, состоянием специфического иммунитета, с одной стороны, и степенью вирулентности менингококка, с другой. Летальность при тяжелых формах менингита до применения сульфаниламидных препаратов и антибиотиков достигала 60 – 70 %. Она остается достаточно высокой до сих пор, в немалой степени это зависит от появления у менингококков резистентности к сульфаниламидным препаратам и антибиотикам.
Постинфекционный иммунитет. После перенесенной болезни, в том числе в легкой форме, формируется прочный длительный антимикробный иммунитет против всех серогрупп менингококков. Он обусловлен бактерицидными антителами и клетками иммунной памяти.
Лабораторная диагностика. Используются следующие методы.
Бактериологический – выделяют чистую культуру возбудителя и проверяют ее чувствительность к сульфаниламидным препаратам и антибиотикам. Материалом для исследования служат ликвор, кровь, экссудат, слизь из зева и носоглотки.
Выделить возбудителя от больного человека удается не всегда, поэтому большое значение имеют серологические реакции, с помощью которых у больных обнаруживают либо специфические менингококковые антигены, либо антитела к ним.
Для обнаружения антигенов могут быть использованы следующие серологические реакции: коагглютинации, латекс-агглютинации, реакция встречного иммуноэлектрофореза, иммуноферментный метод и микрометод эритроиммуноадсорбции. Для обнаружения антител в крови больных и переболевших применяют РПГА и ИФМ, в которых в качестве антигенов используют группоспецифические полисахариды.
Лечение. Применяют сульфаниламидные препараты и антибиотики (пенициллин, рифампицин и др.).
Специфическая профилактика. Для создания искусственного иммунитета против менингита предложены вакцины, получаемые из высокоочищенных полисахаридов серогрупп A, C, Y и W135, но каждая из них формирует лишь группоспецифический иммунитет. Полисахарид серогруппы В оказался неиммуногенным. Поскольку после перенесенной болезни иммунитет возникает против всех серогрупп менингококков, предложена новая цельнокультуральная пероральная поливалентная менингококковая ABC-вакцина, содержащая липополисахариды менингококков серогрупп A, BиC.
Гонорея (греч. gonos – семя и rhoe – истечение) – инфекционное заболевание человека, вызываемое гонококком и характеризующееся воспалительным поражением преимущественно слизистых оболочек мочеполовых органов.
Возбудитель – Neisseria gonorrhoeae, открытый в 1879 г. А. Нейссером, представляет собой кокк, имеющий сходство с кофейным зерном или почкой, располагается парами, вогнутые стороны клеток обращены друг к другу. Размеры 0,7 – 0,8, иногда 1,25 – 1,60 мкм. Деление кокков происходит в одной плоскости. При электронно-микроскопическом исследовании вокруг гонококка обнаруживают слизистое капсулоподобное образование толщиной 0,35 – 0,40 мкм, благодаря ему кокки не соприкасаются между собой: между ними сохраняется щель. Гонококки грамотрицательны, они хорошо воспринимают основные анилиновые красители. Для окрашивания препаратов из гонорейного гноя чаще используют метиленовый синий, так как при этом лучше выявляется бобовидная форма гонококков, а для отличия от других сходных диплококков обязательна окраска по Граму. Фагоцитоз гонококков имеет незавершенный характер (см. рис. 60), завершенный фагоцитоз наблюдается в моноцитах и гистиоцитах. Гонококки не имеют жгутиков, капсул, спор и пигмента не образуют. Содержание в ДНК Г + Ц 49,5 – 49,6 мол %. На мясо-пептонном агаре они растут плохо, лучше размножаются на средах, содержащих сыворотку, асцитическую жидкость или кровь. Гемолиза не вызывают. Для роста гонококков необходимо наличие в среде железа. Добавление к плотным питательным средам крахмала, холестерола, альбумина или частичек угля способствует росту, а добавление ионов Ca++ повышает жизнеспособность. Оптимальная температура для роста 35 – 36 °C, но рост происходит в диапазоне 30 – 38,5 °C, оптимальная рН 7,2 – 7,6. Гонококки – строгие аэробы, но при первичных посевах лучше вырастают при некотором повышении содержания СО2.
Д. Келлог [и др.] выявили зависимость между вирулентностью гонококков и характером образуемых ими колоний. Вирулентные для человека гонококки, выделенные от больных острой гонореей, обладают пилями и образуют мелкие, в виде капель, блестящие колонии, обозначаемые как Т1 и Т2. Колонии больших размеров, плоские и тусклые (Т3 и Т4), образуют невирулентные и не содержащие пилей гонококки. Из углеводов гонококки ферментируют только глюкозу с образованием кислоты без газа. Среди гонококков существуют различные антигенные популяции. Это подтверждается отсутствием у людей иммунитета к повторному заражению. В соответствии с этим предпринимались попытки разработать универсальную серологическую классификацию гонококков. В частности, по белковым антигенам наружной мембраны гонококки распределены на 16 серотипов. Кроме того, гонококки различаются и по своим липополисахаридным антигенам. Обнаружено антигенное родство гонококков с другими видами нейссерий, наиболее близко оно с менингококками. Гонококки синтезируют бактериоцины, которые также могут быть использованы для их типирования. Дифференциальные признаки, отличающие гонококков от других видов рода Neisseria, представлены в табл. 24.
Факторы патогенности. Экзотоксины у гонококков не обнаружены. Основными факторами патогенности являются пили, с помощью которых гонококки осуществляют адгезию и колонизацию эпителиальных клеток слизистой оболочки мочеполовых путей, и освобождающийся при разрушении гонококков эндотоксин (липополисахарид).
Резистентность. Гонококки обладают слабой устойчивостью к внешним воздействиям: они быстро погибают под влиянием прямых солнечных лучей, УФ-света, высушивания, высокой температуры (при 40 °C быстро утрачивают жизнеспособность). Различные химические вещества, как например соли серебра, ртути, и обычные дезинфектанты убивают их в течение короткого времени. Так, нитрат серебра в разведении 1: 5000 убивает гонококки в течение 1 мин, а в разведении 1: 10 000 – через 10 мин.
Таблица 24
Дифференциальные признаки отдельных видов рода Neisseria
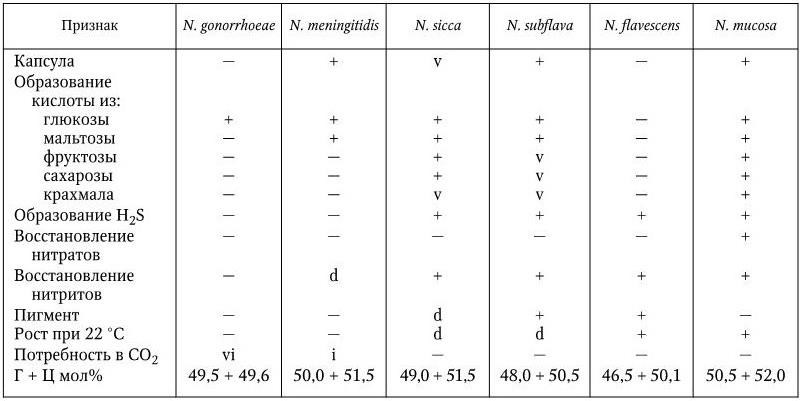
Примечание. (+) – признак положительный более чем у 90 % штаммов; d – у некоторых штаммов признак положительный, у некоторых – отрицательный; v – признак непостоянный, у одного штамма может быть иногда положительным, иногда отрицательным; vi – очень важно; i – важно; ( – ) – признак отсутствует.
Эпидемиология, патогенез и клиника гонореи. Для животных гонококк не патогенен. Единственным источником инфекции является человек, инфицированный гонококками. Заражение происходит главным образом половым путем, иногда через предметы обихода. Основным местом обитания гонококков является поверхность слизистой оболочки мочеполовых путей, реже – прямой кишки и глотки. Местом входных ворот у мужчин является слизистая оболочка уретры, у женщин – чаще всего слизистая оболочка преддверия влагалища, уретры и шейки матки. В случае проникновения через эпителиальный барьер гонококки могут распространяться в окружающие ткани: в железы уретры и шейки матки, предстательную железу, семенные пузырьки, матку и фаллопиевы (маточные) трубы, поступать в кровь, проникать в синовиальные оболочки суставов, сердце и другие органы, вызывая воспалительные процессы, а иногда и септицемию. В определенных условиях гонококки могут проникать в конъюнктиву и вызывать офтальмию (воспаление слизистой глаза – бленнорею). Это наблюдается чаще всего у детей, рожденных инфицированными гонококками матерями. Инкубационный период варьирует от одного дня до 2 – 3 нед. и больше, но чаще всего составляет 3 – 4 дня. Клинически различают две основные формы гонореи – острую и хроническую. Типичным симптомом острой гонореи является острое гнойное воспаление уретры, желез нижнего отдела половых органов и шейки матки у женщин, сопровождающееся болевыми ощущениями, а также обильными гнойными выделениями из уретры. Для хронической гонореи типично более вялое проявление клинических симптомов, связанных с местом локализации возбудителя.
Постинфекционный иммунитет. Перенесенное заболевание не оставляет иммунитета к повторному заражению, но это обстоятельство, вероятно, связано с тем, что иммунитет имеет типоспецифический характер, так как в крови переболевших обнаруживают антитела в достаточно высоких титрах.
Методы диагностики: бактериоскопический – материалом для исследования является гнойное отделяемое уретры, влагалища, шейки матки, предстательной железы и других органов, пораженных гонококком, а также осадок и нити мочи. Как правило, мазки окрашивают по Граму и метиленовым синим. Гонококки обнаруживают по трем характерным для них признакам: грамотрицательная окраска, бобовидные диплококки, внутриклеточное расположение (см. рис. 60). Для обнаружения гонококков в мазке применяют также метод прямой и непрямой иммунофлуоресценции. Однако под влиянием химио– и антибиотикотерапии, а также при хронической гонорее морфология и окраска по Граму у гонококков могут изменяться, кроме того, их в мазке может быть очень мало. Нередко при хронической гонорее в мазках обнаруживают гонококки типа Аша: клетки диплококка имеют неодинаковую величину и форму. В таких случаях используют бактериологический метод. С этой целью исследуемый материал засевают на специальные питательные среды. Выделенную культуру идентифицируют с учетом характерных для гонококка признаков (см. табл. 21). Следует учитывать, что если в мазках из гнойного материала гонококки окрашивались по Граму положительно, то в мазках из выросшей культуры у них восстанавливается грамотрицательная окраска. Все гонококки в 24-часовой культуре имеют почти одинаковую величину, форму диплококков или кокков, но через 72 – 96 ч культура становится полиморфной и клетки окрашиваются по Граму неравномерно. При хронической гонорее для диагностики могут быть использованы РСК или аллергическая кожная проба со специальным гонококковым аллергеном.
Лечение гонореи проводят антибиотиками и сульфаниламидными препаратами. Хорошие результаты дает применение различных пенициллинов, тетрациклиновых препаратов и других антибиотиков. Поскольку у гонококков к ним появляется устойчивость, следует определять, к каким антибиотикам выделенные от больного гонококки чувствительны.
Профилактика. Специфическая профилактика не разработана. Общая профилактика такая же, как при других венерических болезнях, поскольку заражение происходит главным образом половым путем. Для предупреждения бленнореи у новорожденных детей им в конъюнктивальный мешок вводят 1 – 2 капли 2 % раствора нитрата серебра или (особенно у недоношенных детей) 2 капли 3 %-ного масляного раствора пенициллина, к которому гонококки очень чувствительны и быстро от него погибают (через 15 – 30 мин).
К роду Moraxella относятся грамотрицательные бактерии, обычно имеющие форму очень коротких округлых палочек с типичными размерами 1,0 – 1,5 × 1,5 – 2,5 мкм, часто приобретающие форму кокков, располагающихся преимущественно парами или короткими цепочками. Некоторые культуры сохраняют четкую форму, другие – плеоморфны: размеры и форма клеток варьируют, иногда они образуют нити и длинные цепочки. Полиморфность возрастает при недостатке кислорода и при температуре выше оптимальной для роста (32 – 35 °C). Спор не образуют, жгутиков не имеют. Некоторые штаммы проявляют «дергающуюся» подвижность на плотной поверхности. Капсулы и фимбрии могут быть либо отсутствовать. Моракселлы – хемоорганотрофы с окислительным метаболизмом, оптимальная рН 7,0 – 7,5. Строгие аэробы. Большинство штаммов требовательно к питательным средам, но специфические ростовые факторы мало известны. Небольшое число органических кислот, стеринов и аминокислот используют как источник углерода и энергии. Углеводов не потребляют. Обладают оксидазой и обычно каталазой. Индола, ацетоина и H2S не образуют. Высоко чувствительны к пенициллину. Содержание Г+Ц в ДНК – 40 – 46 мол %.
Моракселлы являются паразитами слизистых оболочек людей и теплокровных животных; возможно, существуют и сапрофиты. Род Moraxella включает два подрода: собственно Moraxella и Branhamella. Ключевые признаки основных видов Moraxella таковы.
I. Не растут на минеральной среде с ацетатом и солями аммония.
А. Свернутую сыворотку разжижают.
Вызывают гемолиз на «шоколадном» агаре.
1. Образуют обычно нитриты.
На кровяном агаре гемолиза не дают.
1. M. lacunata.
2. Нитриты не образуют.
На кровяном агаре обычно дают гемолиз.
2. M. bovis.
B. Cвернутую сыворотку не разжижают.
Гемолиза на «шоколадном» агаре не дают.
1. Фенилаланиндезаминаза отсутствует.
3. M. nonliquefaciens.
2. Фенилаланиндезаминаза имеется.
4. M. phenylpyruvica.
II. Растут на минеральной среде с ацетатом и солями аммония.
5. M. osloensis.
Подрод Branhamella включает 4 вида, в том числе Moraxella catarrhalis, ранее называвшийся Micrococcus catarrhalis. Обычно имеет форму грамотрицательных кокков, располагающихся парами. Спор не образует, жгутиков не имеет, образует капсулу, углеводов не ферментирует, полисахаридов из сахарозы не образует. Растет на питательном агаре и на среде, содержащей аминокислоты, минеральные соли, биотин и лактат или сукцинат как источник энергии и углерода. Не образует уреазы, H2S и индола. Образует липазу, цитохромоксидазу, каталазу и ДНКазу. Нитраты восстанавливает в нитриты. Аэроб, температурный оптимум 37 °C, но растет при 22 °C. Содержание Г + Ц в ДНК – 40 – 45 мол %. Чувствителен к пенициллину. Является паразитом слизистых оболочек человека и млекопитающих животных. Нередко обнаруживается на слизистой оболочке шейки матки и уретры у здоровых женщин. Может вызывать воспаление слизистых оболочек самостоятельно или в ассоциации с другими бактериями. Имеется сообщение о том, что может быть причиной менингита. Патогенность многих моракселл для человека изучена недостаточно, но они вызывают воспалительные заболевания слизистых оболочек, на которых паразитируют. Например, M. lacunata, M. bovis нередко вызывают у людей, живущих в плохих санитарно-гигиенических условиях, конъюнктивит. Некоторые виды, например M. osloensis и M. phenylpyruvica, являются потенциальными возбудителями септицемий, менингита или гноеродных заболеваний.
Род Acinetobacter (6 видов) включает в себя грамотрицательные палочки, обычно очень короткие и округлые, размеры их в логарифмической фазе роста составляют 1,0 – 1,5 × 1,5 – 2,5 мкм. В стационарной фазе роста они приобретают преимущественно форму кокков, располагающихся парами или в виде коротких цепочек. Большие непостоянной формы клетки и нити обнаруживаются в небольшом количестве во всех культурах, а иногда и преобладают. Спор не образуют, жгутиков не имеют, однако некоторые штаммы на плотной поверхности демонстрируют «дергающуюся» подвижность. Капсулы и фимбрии могут быть, но могут и отсутствовать. Хемоорганотрофы с окислительным метаболизмом. Способность использовать органические соединения в качестве источников энергии и углерода непостоянна. Оксидазы не образуют, каталазопозитивны. Ацетоина, индола и H2S не образуют. Строгие аэробы, оптимальная температура для роста 30 – 32 °C, рН около 7,0. Обычно резистентны к пенициллину. Соотношение Г + Ц в ДНК – 40 – 47 мол %. Являются свободно живущими сапрофитами, распространены повсеместно. Acinetobacter часто выделяют из почвы, воды, сточных вод, загрязненных пищевых продуктов, со слизистых оболочек животных (включая рыб) и людей. Они могут быть причиной многих инфекционных процессов, включая менингиты и септицемии у людей и септицемии и аборты у животных. Основной средой их обитания являются почва и вода. Патогенность обычно низкая, но могут играть важную клиническую роль для людей и их органов с ослабленной природной резистентностью. Возможно также, что существует более чем один экологический вариант Acinetobacter, включающий паразитические или потенциально патогенные для животных и людей варианты A. calcoaceticus. Отсутствие оксидазы – признак, по которому бактерии этого рода отличаются от оксидазопозитивного рода Moraxella, включая подрод Branhamella.
Род Kingella включает 3 вида, типовой вид K. kingae. Клетки кокковидные или короткие палочки с прямоугольными концами, размером 0,5 – 0,8 мкм, т. е. меньше, чем большинство моракселл. Образуют на кровяном агаре колонии размером 1,0 – 2,0 мм через 48 ч, иногда они имеют слизистую консистенцию. На кровяном агаре образуют узкую зону бета-гемолиза, но на «шоколадном» агаре гемолиза не происходит. При комнатной температуре культуры на кровяном агаре очень плохо сохраняются. Свернутую сыворотку не разжижают. Некоторые кингеллы восстанавливают нитраты в нитриты. Уреазы, каталазы и фенилаланиндезаминазы не образуют. Требовательны к питательным средам, но добавление сыворотки роста не улучшает. Ферментируют с образованием кислоты глюкозу и мальтозу, но не сахарозу на среде, содержащей асцитическую жидкость. Содержание Г + Ц в ДНК – около 44 – 46 мол %. Высокочувствительны к пенициллину. Наиболее часто выделяются из глоточной слизи, а также со слизистых оболочек мочеполовых путей, носа, из абсцессов, при повреждениях костей, заболевании суставов и т. п. Основным местом обитания является слизистая оболочка глотки. Патогенность для человека выясняется.
Грамотрицательные бактерии – наиболее частые возбудители гнойных воспалений
В этом разделе рассмотрены такие грамотрицательные бактерии, которые весьма часто являются возбудителями гнойно-воспалительных заболеваний у человека: псевдомонады, протей, клебсиеллы. Другие потенциальные возбудители гнойновоспалительных процессов описаны в соответствующих главах. Эпидемиологической особенностью всех этих заболеваний является преимущественное их распространение по типу госпитальной (внутрибольничной) инфекции.
Род Pseudomonas относится к семейству Pseudomonadaceae (класс Gammaproteobacteria, тип Proteobacteria) и содержит более 20 видов. Одни из них являются естественными обитателями почвы и воды и поэтому играют огромную роль в круговороте веществ в природе. Другие виды играют значительную роль в патологии человека (см. также раздел «Возбудители сапа и мелиоидоза»), животных и растений. Исследования, проведенные в последние 10 – 20 лет, показали, что для человека патогенны не только давно известная и хорошо изученная синегнойная палочка – P. aeruginosa (открыта в 1862 г. А. Люкке, выделена и описана в 1872 г. Дж. Шретером), но и целый ряд других псевдомонад (P. putida, P. fluorescens, P. cepacia и др.).
Для P. aeruginosa характерны следующие признаки: грамотрицательная прямая или слегка изогнутая палочка с закругленными концами, размером 0,5 – 0,7 × 1 – 3 мкм, хорошо окрашивается всеми анилиновыми красителями. В мазках располагается одиночно, парами или короткими цепочками. Обычно подвижна (монотрих или лофотрих). Спор не образует, капсулы не имеет, но продуцирует слизь, которая тонким слоем окружает микробную клетку.
Синегнойная палочка является аэробом и обладает необходимым для дыхания набором ферментов (дегидразы, цитохромы, цитохромоксидаза). Хемоорганотроф, растет в широких интервалах температуры, от 6 до 45 °C, диапазон рН от 4,5 до 9,0. Оптимальная температура роста 37 °C, рН 7,2 – 7,5, но так же хорошо растет и при температуре 42 °C. К питательным средам нетребовательна, хорошо растет на МПА и МПБ. При выращивании в бульоне в течение суток синегнойная палочка образует равномерное помутнение с сероватой пленкой на поверхности и осадком на дне. На МПА через сутки образуются довольно крупные (3 – 5 мм) полупрозрачные колонии сероватого цвета с перламутровым оттенком. Центр колонии более темный, чем периферия, края ровные, четкие. На скошенном агаре культура синегнойной палочки дает тонкий блестящий налет. Культура часто имеет специфический запах жасмина. Характерным свойством ее является появление уже к концу первых суток сине-зеленого окрашивания культуры с последующим проникновением пигмента (пиоцианина) в питательную среду. Псевдомонады других видов могут образовывать пигменты иного цвета, например: P. fluorescens и P. putida (впрочем, как и сама синегнойная палочка) образуют желтый пигмент, который флуоресцирует с зеленоватым оттенком; некоторые штаммы образуют красный (пиорубин) или коричнево-черный (пиомеланин) пигмент.
Синегнойная палочка обладает слабой сахаролитической активностью: она обычно расщепляет только глюкозу с образованием кислоты без газа. Более выражена протеолитическая активность: разжижает желатин и свернутую кровяную сыворотку, гидролизует казеин. Свертывает лакмусовое молоко и затем расщепляет сгусток. Восстанавливает нитраты в нитриты и далее до азота. Не образует индола иH2S, дает отрицательную реакцию Фогеса – Проскауэра. Проба на оксидазу положительная. Содержание Г + Ц в ДНК составляет 67 мол %.
Другие патогенные для человека виды псевдомонад отличаются от синегнойной палочки и друг от друга по следующим биохимическим свойствам: флуоресценции в УФ-свете, наличию аргининдигидролазы, желатиназы, амилазы, лизиндекарбоксилазы, способности расти при температуре 42 °C, образованию сероводорода и другим тестам (табл. 25).
Таблица 25
Биохимические отличия некоторых видов и биоваров рода Pseudomonas

Примечание. (+) – положительный признак; ( – ) – отрицательный признак; (±) – непостоянный признак; (?) – неизвестно.
Синегнойная палочка имеет соматический О-антиген, по которому были предприняты попытки делить ее на серогруппы, и жгутиковый Н-антиген. У штаммов, продуцирующих слизь и имеющих капсулоподобную оболочку, имеется М-антиген. Факторы патогенности. Одним из главных факторов патогенности синегнойной палочки и других псевдомонад является О-антиген – липополисахарид клеточной стенки, механизм действия которого такой же, как у других грамотрицательных бактерий. Помимо этого, псевдомонады могут продуцировать различные экзотоксины: гемотоксин, лейкоцидин, гистотоксины, энтеротоксин. Синтез их часто контролируется плазмидами широкого круга хозяев, которые псевдомонады могут приобретать при обмене генетическим материалом с бактериями других родов и семейств.
Важнейший из всех экзотоксинов – экзотоксин А, по молекулярной структуре и механизму действия весьма схожий с дифтерийным экзотоксином: это белок, состоящий из двух субъединиц примерно с такой же молекулярной массой, как у дифтерийного токсина, чувствителен к трипсину, повышенной температуре, кислой рН среды. В основе летального действия экзотоксина А также лежит специфическая инактивация белкового фактора элонгации EF-2, приводящая к нарушению биосинтеза белка на рибосомах. Существуют и другие типы токсинов, синтезируемых синегнойной палочкой, которые иммунологически отличны от экзотоксина А. К таким токсинам можно отнести экзофермент S, который, в отличие от экзотоксина А, рибозилирует не EF-2, а другие белки, в частности EF-1.
Синегнойная палочка продуцирует ряд ферментов, усиливающих ее патогенные свойства: коллагеназу, разрушающую строму соединительной ткани и способствующую распространению возбудителя; протеазы, некоторые из них блокируют систему комплемента; лецитиназу, нейраминидазу и др.
Эпидемиология. Псевдомонады широко распространены в природе: встречаются в почве, воде, воздухе, постоянно обитают в кишечнике человека и животных, обнаруживаются на коже и слизистых оболочках.
Синегнойная палочка устойчива к ультрафиолетовому облучению, а также антисептикам, традиционно применяемым в хирургии (фурацилин, риванол и др.). В пыли больничных палат сохраняется 2 нед., в кусочках ожоговых корочек – до 8 нед. При температуре 60 °C погибает в течение 15 мин, при 55 °C – в течение 1 ч. Быстро гибнет под действием 2 % раствора фенола.
Заражение происходит либо извне (например, инфицирование раны), когда псевдомонада попадает с почвой, водой, воздухом, нестерильным инструментарием, перевязочным материалом, пищей; либо при активации эндогенной микрофлоры, составной частью которой может быть псевдомонада, т. е. как проявление дисбактериоза. В последнем случае заболевание чаще наблюдается у детей, пожилых лиц и людей со сниженной по разным причинам общей резистентностью.
Патогенез и клиника. Синегнойная палочка может вызывать у человека самые различные заболевания: сепсис, менингит, остеомиелит, артрит, отит, пневмонию, плеврит, абсцессы печени, мозга, воспаления мочеполового тракта и др. Огромную роль играет она также в гнойно-воспалительных осложнениях операционных ран и ожогов, которые сводят на нет лечение и приводят нередко к летальному исходу. Немаловажное значение синегнойная палочка имеет как возбудитель пищевых токсикоинфекций. Заболевания, вызванные ею, протекают довольно тяжело; отмечается чрезвычайная устойчивость к лечению. Это связано, с одной стороны, с разнообразием факторов патогенности, с другой стороны – с наличием R-плазмид, определяющих устойчивость к 6 – 10 и более антибиотикам одновременно. Нередко заболевание протекает вяло, не поддается лечению, приобретает хронический характер (уретрит, цистит, плеврит, остеомиелит и т. д.).
Лабораторная диагностика. Единственным эффективным методом диагностики является бактериологический. Материал для посева может быть различным, но чаще всего это гной, экссудат, пунктаты из органов, моча. Большую роль в идентификации культуры играет обнаружение пигмента пиоцианина, присутствие которого в жидкой культуре определяют добавлением в среду нескольких капель хлороформа: наблюдается сине-зеленое окрашивание. Видовая идентификация в пределах рода Pseudomonas ведется по биохимическим и культуральным свойствам.
Лечение и специфическая профилактика. Лечение антибиотиками должно назначаться только после изучения чувствительности штамма-возбудителя к химиопрепаратам. При пищевых токсикоинфекциях и дисбактериозах кишечника, вызванных синегнойной палочкой, весьма эффективен комплексный интести-бактериофаг, в состав которого входит псевдомонадный фаг. При хронических вялотекущих процессах, вызванных синегнойной палочкой, особенно в случае безуспешности проводимого лечения, весьма эффективным может оказаться использование аутовакцины.
Плановая специфическая профилактика не проводится. Общая профилактика сводится к недопущению попадания возбудителя в раны, на ожоговую поверхность, т. е. к правильной организации работы в отделениях и строжайшему соблюдению санитарно-гигиенических норм.
Род Klebsiella относится к семейству Enterobacteriaceae. В отличие от подавляющего большинства родов этого семейства, бактерии рода Klebsiella обладают способностью образовывать капсулу. К роду Klebsiella относится несколько видов. Основную роль в патологии человека из них играет вид Klebsiella pneumoniae, которая подразделяется на три подвида: K. pneumoniae subsp. pneumoniae, K. pneumoniae subsp. ozaenae и K. pneumoniae subsp. rhinoscleromatis. Однако за последние годы выявлены новые виды клебсиелл (K. oxytoca, K. mobilis, K. planticola, K. terrigena), которые пока мало изучены и роль их в патологии человека уточняется. Название рода дано в честь немецкого бактериолога Э. Клебса. Клебсиеллы постоянно обнаруживают на коже и слизистых оболочках человека и животных. K. pneumoniae – частый возбудитель внутрибольничных инфекций, в том числе смешанных.
Клебсиеллы – грамотрицательные эллипсоидные бактерии, имеют форму толстых коротких палочек с закругленными концами, размером 0,3 – 0,6 × 1,5 – 6,0 мкм, капсульная форма имеет размеры 3 – 5 × 5 – 8 мкм. Размеры подвержены сильным колебаниям, особенно у клебсиелл пневмонии. Жгутики отсутствуют, бактерии спор не образуют, у части штаммов имеются реснички. Обычно видна толстая полисахаридная капсула; бескапсульные формы могут быть получены при воздействии на бактерии низкой температуры, сыворотки, желчи, фагов, антибиотиков и при мутациях. Расположены попарно или поодиночке.
Клебсиеллы хорошо растут на простых питательных средах, факультативные анаэробы, хемоорганотрофы. Оптимальная температура роста 35 – 37 °C, рН 7,2 – 7,4, но могут расти при 12 – 41 °C. Способны расти на среде Симмонса, т. е. использовать цитрат натрия в качестве единственного источника углерода (кроме K. rhinoscleromatis). На плотных питательных средах образуют мутные слизистые колонии, причем в молодых 2 – 4-часовых колониях бактерии озены располагаются рассеянно-концентрическими рядами, риносклеромы – концентрическими, пневмонии – петлеобразно, что легко определяется при микроскопии колонии с малым увеличением и может быть использовано для их дифференциации. При росте в МПБ клебсиеллы вызывают равномерное помутнение, иногда со слизистой пленкой на поверхности; на полужидких средах рост более обилен в верхней части среды.
Содержание в ДНК Г + Ц – 52 – 56 мол %.
Клебсиеллы ферментируют углеводы с образованием кислоты или кислоты и газа, восстанавливают нитраты в нитриты. Желатин не разжижают, индола и сероводорода не образуют. Обладают уреазной активностью, не всегда створаживают молоко. Менее всего биохимическая активность выражена у возбудителя риносклеромы (табл. 26).
Таблица 26
Биохимические признаки клебсиелл

Примечание. (+) – признак положительный; ( – ) – признак отсутствует; d – признак непостоянный.
Антигены. У клебсиелл имеются О– и К-антигены. По О-антигену клебсиеллы подразделяют на 11 серотипов, а по капсульному К-антигену – на 82. Серологическое типирование клебсиелл основано на определении К-антигенов. Группоспецифический антиген обнаружен почти у всех штаммов клебсиелл. Некоторые К-антигены родственны К-антигенам стрептококков, эшерихий и сальмонелл. Обнаружены О-антигены, родственные О-антигенам E. coli.
Основными факторами патогенности клебсиелл являются К-антиген, подавляющий фагоцитоз, и эндотоксин. Помимо них, K. pneumoniae может продуцировать термолабильный энтеротоксин – белок, по механизму действия подобный токсину энтеротоксигенной кишечной палочки. Клебсиеллы обладают выраженными адгезивными свойствами.
Эпидемиология. Клебсиеллез является чаще всего внутрибольничной инфекцией. Источником служит больной человек и бактерионоситель. Возможно как экзогенное, так и эндогенное заражение. Наиболее частые пути передачи – пищевой, воздушно-капельный и контактно-бытовой. Факторами передачи чаще всего являются пищевые продукты (особенно мясные и молочные), вода, воздух. В последние годы частота клебсиеллезов возросла, одна из причин этого – повышение патогенности возбудителя в связи со снижением резистентности организма человека. Этому способствует также широкое использование антибиотиков, изменяющих нормальное соотношение микроорганизмов в естественном биоценозе, иммунодепрессантов и т. д. Следует отметить высокую степень резистентности клебсиелл к различным антибиотикам.
Клебсиеллы чувствительны к действию различных дезинфицирующих веществ, при температуре 65 °C погибают в течение 1 ч. Довольно устойчивы во внешней среде: слизистая капсула предохраняет возбудителя от высыхания, поэтому клебсиеллы могут сохраняться в почве, пыли палат, на оборудовании, мебели при комнатной температуре неделями и даже месяцами.
Патогенез и клиника. K. pneumoniae чаще всего вызывают заболевание, протекающее по типу кишечной инфекции и характеризующееся острым началом, тошнотой, рвотой, болями в животе, диареей, лихорадкой и общей слабостью. Продолжительность болезни – 1 – 5 дней. Клебсиеллы могут вызывать поражение органов дыхания, суставов, мозговых оболочек, конъюнктивы, мочеполовых органов, а также сепсис и гнойные послеоперационные осложнения. Наибольшей тяжестью отличается генерализованное септико-пиемическое течение болезни, приводящее нередко к летальному исходу.
K. ozaenae поражает слизистую оболочку носа и его придаточных пазух, вызывает их атрофию, воспаление сопровождается выделением вязкого зловонного секрета. K. rhinoscleromatis поражает не только слизистую оболочку носа, но и трахею, бронхи, глотку, гортань, при этом в пораженной ткани развиваются специфические гранулемы с последующим склерозированием и развитием хрящевидных инфильтратов. Течение заболевания хроническое, смерть может наступить на фоне обтурации трахеи или гортани.
Постинфекционный иммунитет непрочный, носит в основном клеточный характер. При хроническом заболевании иногда развиваются признаки ГЧЗ.
Лабораторная диагностика. Основным методом диагностики является бактериологический. Материал для посева может быть различным: гной, кровь, ликвор, испражнения, смывы с предметов и др. Его сеют на дифференциально-диагностическую среду К-2 (с мочевиной, рафинозой, бромтимоловым синим), через сутки вырастают крупные блестящие слизистые колонии с окраской от желтой или зеленожелтой до голубой. Далее у бактерий определяют подвижность посевом в среду Пешкова и наличие орнитиндекарбоксилазы. Эти признаки не свойственны клебсиеллам. Окончательная идентификация заключается в изучении биохимических свойств и определении серогруппы с помощью реакции агглютинации живой культуры с К-сыворотками. Выделенная чистая культура проверяется на чувствительность к антибиотикам.
Иногда для диагностики клебсиеллезов может быть использована реакция агглютинации или РСК со стандартным О-клебсиеллезным антигеном или с аутоштаммом.
Диагностическое значение имеет четырехкратное нарастание титров антител.
Профилактика и лечение. Специфическая профилактика не разработана. Общая профилактика сводится к строгому соблюдению санитарно-гигиенических норм при хранении пищевых продуктов, строгому соблюдению асептики и антисептики в лечебных учреждениях, а также соблюдению правил личной гигиены.
Лечение клебсиеллезов по клиническим показаниям проводится в условиях стационара. При поражении кишечника антибиотики не показаны. При явлениях обезвоживания (наличие у возбудителя энтеротоксина) перорально или парентерально вводят солевые растворы. При генерализованных и вялотекущих хронических формах применяют антибиотики (в соответствии с результатами проверки на чувствительность к ним), аутовакцины; проводят мероприятия, стимулирующие иммунитет (аутогемотерапия, пирогенотерапия и т. д.).
Род Proteus относится к семейству Enterobacteriaceae и включает в себя три вида. Важную роль в патологии человека, особенно в качестве возбудителей гнойно-воспалительных заболеваний и пищевых токсикоинфекций, играют два вида: P. vulgaris и P. mirabilis.
Все представители рода Proteus – грамотрицательные палочки с закругленными концами, размером 0,4 – 0,6 × 1 – 3 мкм, спор и капсул не образуют, являются перитрихами. Склонны к полиморфизму, наблюдаются кокковидные и нитевидные формы. Иногда встречаются и неподвижные варианты, лишенные жгутиков (О-форма).
Факультативные анаэробы, хемоорганотрофы. Температурный оптимум 37 °C, рН 7,2 – 7,4; температурные пределы роста от 20 до 38 °C. К питательным средам нетребовательны, хорошо растут на простых средах. Н-форма (жгутиковая) протея дает на МПА характерный ползучий рост в виде нежной вуали голубовато-дымчатого цвета (феномен роения). Ползучим ростом протея пользуются для выделения чистой культуры при посеве по методу Шукевича (посев производят в конденсационную влагу свежескошенного МПА, культура протея постепенно поднимается в виде вуали вверх по поверхности среды). О-форма протея дает на МПА крупные с ровными краями колонии. На МПБ отмечается диффузное помутнение среды с густым белым осадком на дне и нежной пленкой на поверхности. О-форма протея растет на определенных питательных средах, содержащих желчные кислоты (среда Плоскирева); 0,1 – 0,2 % карболовой кислоты; 5 – 6 % этанола, красители, борную кислоту, детергенты. На среде Плоскирева протей дает прозрачные, нежные, блестящие колонии с характерным запахом, слегка щелочащие среду, которая окрашивается вокруг них в желтоватый цвет. С возрастом колонии мутнеют, их центр принимает бурую окраску. Колонии протея в О-форме мало отличаются от колоний сальмонелл, что затрудняет их идентификацию. В качестве сред обогащения используют среды Кауфмана, Мюллера, 5 %-ный желчный бульон.
Представители рода Proteus ферментируют глюкозу с образованием кислоты и небольшого количества газа, не ферментируют лактозу и маннит, устойчивы к цианиду, образуют уреазу и фенилаланиндезаминазу. Виды дифференцируют по дополнительным биохимическим тестам (табл. 27).
Как и у других жгутиковых представителей семейства энтеробактерий, у протея различают термостабильный соматический О-антиген (49 серотипов) и жгутиковый термолабильный Н-антиген (19 серотипов). Следует отметить родство соматического антигена протея с антигенами риккетсий (штаммы протея серии ОХ). По антигенным свойствам P. vulgaris и P. mirabilis подразделяют на 110 серотипов.
Таблица 27
Биохимические признаки протеев
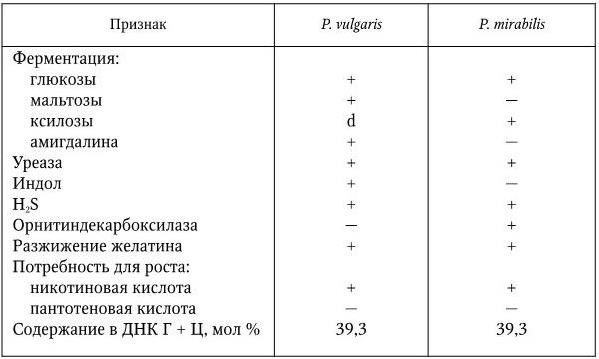
Примечание. (+) – признак положительный; ( – ) – признак отсутствует;
d – признак непостоянный.
ЛПС клеточной стенки протея является важнейшим фактором патогенности, выполняющим роль эндотоксина.
Эпидемиология. Протеи обычно являются сапрофитами гниющих отбросов, в небольших количествах присутствуют в кишечнике животных и человека, обнаруживаются в сточных водах и почве. Чаще всего заражение происходит алиментарным путем, когда в организм человека с пищей попадает большое количество протея. Нередко протей может выступать как возбудитель дисбактериоза (эндогенная инфекция) или как типичный возбудитель госпитальной инфекции.
Протей сравнительно устойчив во внешней среде, хорошо переносит замораживание. При температуре 60 °C погибает в течение 1 ч, при 80 °C – в течение 5 мин, в 1 %-ном растворе фенола гибнет через 30 мин. Может быть устойчив одновременно ко многим антибиотикам и дезинфицирующим веществам.
Патогенез и клиника. Протей может вызывать у человека различные заболевания, чаще протекающие по типу пищевой токсикоинфекции. В ассоциации с другими условно-патогенными микроорганизмами протей вызывает различные формы гнойно-воспалительных и септических заболеваний: цистит, пиелит, гнойные осложнения ран и ожоговых поверхностей, флегмоны, абсцессы, плеврит, пневмонию, остеомиелит, менингит, сепсис. Патогенез пищевой токсикоинфекции связан с массовым разрушением протея в желудочно-кишечном тракте и всасыванием в кровь освобождающегося при этом эндотоксина. Степень тяжести заболевания находится в прямой зависимости от количества попавшего в организм протея.
Лабораторная диагностика. Используется бактериологический метод. Материалом для посева являются гной, моча, рвотные массы, промывные воды, кровь, ликвор, мокрота, плевральный экссудат, которые засевают на дифференциально-диагностические среды (среда Плоскирева), среды обогащения и МПА по методу Шукевича. Выделенная чистая культура идентифицируется по биохимическим свойствам, серовар определяют в реакции агглютинации живой и гретой культуры с поливалентными и монорецепторными О– и Н-сыворотками. Можно также определять нарастание титров О– и Н-антител в реакции агглютинации с аутоштаммами.
Лечение. При пищевой токсикоинфекции, вызванной протеем, проводят неспецифическое лечение, направленное на дезинтоксикацию (промывание желудка, обильное питье и т. д.). В случае заболевания, сопровождающегося нагноением или сепсисом, используют антибиотики с учетом результатов антибиотикограммы. При колите, связанном с дисбактериозом кишечника, когда протей присутствует в больших количествах, целесообразно пероральное использование интестибактериофага, в состав которого входит протейный фаг, а также протейного или колипротейного бактериофага. Последние препараты эффективны и при местных воспалительных процессах (гнойные осложнения ран, мочеполовых органов), когда они назначаются в виде примочек, орошений, тампонирования, обкалывания. При вялотекущих воспалительных процессах, трудно поддающихся антибиотикотерапии, целесообразно применение аутовакцины.
Специфическая профилактика не разработана.
Возбудители особо опасных инфекций
К категории особо опасных инфекций бактериальной природы относятся чума, туляремия, бруцеллез, сибирская язва, сап и холера. Первые пять болезней – зооантропонозы, а холерой болеют только люди. Эти болезни относятся к особо опасным потому, что их возбудители:
1) обладают высокой заразительностью (к чуме, туляремии, бруцеллезу восприимчивы все люди);
2) способны вызывать не только эпидемии, но и пандемии (чума, холера);
3) вызывают тяжело протекающие заболевания.
Чума (pestis) – острое инфекционное заболевание, протекающее по типу геморрагической септицемии. В прошлом чума была грозным бичом для человечества. Известны три пандемии чумы, которые унесли миллионы человеческих жизней.
Первая пандемия была в VI в. н. э. От нее погибло с 531 по 580 г. около 100 млн человек – половина населения Восточной Римской империи («юстинианова» чума). Вторая пандемия разразилась в XIV веке. Она началась в Китае и поразила многие страны Азии и Европы. В Азии от нее погибло 40 млн человек, а в Европе из 100 млн человек погибло 25 млн. Вот как описывает эту пандемию Н. М. Карамзин в «Истории государства Российского»: «Болезнь обнаруживалась железами в мягких впадинах тела, человек харкал кровью и на второй или третий день умирал. Нельзя, говорят летописцы, вообразить зрелища более ужасного… От Пекина до берегов Евфрата и Ладоги недра земли наполнились миллионами трупов, и государства опустели… В Глухове и Белозерске не осталось ни одного жителя… Сия жестокая язва несколько раз приходила и возвращалась. В Смоленске она свирепствовала 3 раза, наконец, в 1387 г. осталось в нем только 5 человек, которые, по словам летописи, вышли и затворили город, наполненный трупами». Третья пандемия чумы началась в 1894 г. и закончилась в 1938 г., унеся 13 – 15 млн человеческих жизней.
Возбудитель чумы был открыт в 1894 г. французским ученым А. Иерсеном, в честь которого и получил название Yersinia pestis. Род Yersiniа относится к семейству Enterobacteriaceae и включает 11 видов, из них патогенными для человека являются три: Y. pestis, Y. pseudotuberculosis и Y. enterocolitica; патогенность остальных пока еще не ясна.
Y. pestis имеет длину 1 – 2 мкм и толщину 0,3 – 0,7 мкм. В мазках из организма больного и из трупов погибших от чумы людей и грызунов выглядит как короткая овоидная (яйцевидная) палочка с биполярной окраской. В мазках из бульонной культуры палочка располагается цепочкой, в мазках из агаровых культур – беспорядочно (см. цв. вкл., рис. 95). Биполярная окраска в том и другом случае сохраняется, но в мазках из агаровых культур несколько слабее. Возбудитель чумы по Граму окрашивается отрицательно, лучше красится щелочными и карболовыми красителями (синькой Леффлера), спор не образует, жгутиков не имеет. Содержание Г + Ц в ДНК – 45,8 – 46,0 мол % (для всего рода). При температуре 37 °C образует нежную капсулу белковой природы, которая выявляется на влажных и слегка кислых питательных средах. Y. pestis – аэроб, дает хороший рост на обычных питательных средах. Оптимальная для роста температура 27 – 28 °C (диапазон – от 0 до 45 °C), рН = 6,9 – 7,1. Палочка чумы дает характерный рост на жидких и плотных питательных средах: на бульоне он проявляется образованием рыхлой пленки, от которой спускаются нити в виде сосулек, напоминающих сталактиты, на дне – рыхлый осадок, бульон остается прозрачным. Развитие колоний на плотных средах проходит через три стадии: через 10 – 12 ч под микроскопом рост в виде бесцветных пластинок (стадия «битого стекла»); через 18 – 24 ч – стадия «кружевных платочков», при микроскопировании заметна светлая кружевная зона, расположенная вокруг выступающей центральной части, желтоватой или слегка буроватой окраски. Через 40 – 48 ч наступает стадия «взрослой колонии» – буровато-очерченный центр с выраженной периферической зоной (см. цв. вкл., рис. 95.3). Y. pseudotuberculosis и Y. enterocolitica стадии «битого стекла» не имеют. На средах с кровью колонии Y. pestis зернистые со слабо выраженной периферической зоной. С целью быстрейшего получения характерного для Y. pestis роста на средах к ним рекомендуется добавлять стимуляторы роста: сульфит натрия, кровь (или ее препараты) или лизат культуры сарцины. Палочке чумы свойствен выраженный полиморфизм, особенно на средах с повышенной концентрацией NaCl, в старых культурах, в органах разложившихся чумных трупов (см. цв. вкл., рис. 95.2). Чумная палочка не имеет оксидазы, не образует индола и H2S, обладает каталазной активностью и ферментирует глюкозу, мальтозу, галактозу, маннит с образованием кислоты без газа.
Резистентность. В мокроте палочка чумы может сохраняться до 10 дней; на белье и одежде, испачканных выделениями больного, сохраняется неделями (белок и слизь охраняют ее от губительного действия высыхания). В трупах людей и животных, погибших от чумы, выживает с начала осени до зимы; низкая температура, замораживание и оттаивание не убивают ее. Солнце, высыхание, высокая температура губительны для Y. pestis. Нагревание до 60 °C убивает через 1 ч, при температуре 100 °C погибает через несколько минут; 70° спирт, 5 % раствор фенола, 5 % раствор лизола и некоторые другие химические дезинфектанты убивают за 5 – 10 – 20 мин.
Антигенный состав. У Y. pestis, Y. pseudotuberculosis и Y. enterocolitica обнаружено до 18 сходных соматических антигенов. Для Y. pestis характерно наличие капсульного антигена (фракция I), антигенов T, V – W, белков плазмокоагулазы, фибринолизина, белков наружной мембраны и pH6-антигена. Однако в отличие от Y. pseudotuberculosis и Y. enterocolitica, Y. pestis в антигенном отношении более однородна;
серологической классификации этого вида нет.
Факторы патогенности. Y. pestis является самой патогенной и агрессивной среди бактерий, поэтому и вызывает наиболее тяжелое заболевание. У всех чувствительных к нему животных и у человека возбудитель чумы подавляет защитную функцию фагоцитарной системы. Он проникает в фагоциты, подавляет в них «окислительный взрыв» и беспрепятственно размножается. Неспособность фагоцитов осуществить свою киллерную функцию в отношении Y. pestis – основная причина восприимчивости к чуме. Высокая инвазивность, агрессивность, токсигенность, токсичность, аллергенность и способность подавлять фагоцитоз обусловлены наличием у Y. pestis целого арсенала факторов патогенности, которые перечислены ниже.
1. Способность клеток сорбировать экзогенные красители и гемин. Она связана с функцией системы транспорта железа и обеспечивает Y. pestis возможность размножаться в тканях организма.
2. Зависимость роста при температуре 37 °C от наличия в среде ионов Ca2+.
3. Синтез V – W-антигенов. Антиген W расположен в наружной мембране, а V – в цитоплазме. Эти антигены обеспечивают размножение Y. pestis внутри макрофагов. 4. Синтез «мышиного» токсина. Токсин блокирует процесс переноса электронов в митохондриях сердца и печени чувствительных животных, поражает тромбоциты и сосуды (тромбоцитопения) и нарушает их функции.
5. Синтез капсулы (фракции I – FraI). Капсула угнетает активность макрофагов.
6. Синтез пестицина – видовой признак Y. pestis.
7. Синтез фибринолизина.
8. Синтез плазмокоагулазы. Оба эти белка локализованы в наружной мембране и обеспечивают высокие инвазивные свойства Y. pestis.
9. Синтез эндогенных пуринов.
10. Синтез термоиндуцибельных белков наружной мембраны – Yop-белков (англ. Yersinia outer proteins). Белки YopA, YopD, YopE, YopH, YopK, YopM, YopN подавляют активность фагоцитов.
11. Синтез нейраминидазы. Она способствует адгезии (высвобождает рецепторы для Y. pestis).
12. Синтез аденилатциклазы. Предполагается, что она подавляет «окислительный взрыв», т. е. блокирует киллерное действие макрофагов.
13. Синтез пилей адгезии. Они угнетают фагоцитоз и обеспечивают внедрение Y. pestis, как внутриклеточного паразита, в макрофаги.
14. Синтез аминопептидаз широкого спектра действия.
15. Эндотоксин (ЛПС) и другие компоненты клеточной стенки, обладающие токсическим и аллергенным действием.
16. pH6-антиген. Он синтезируется при температуре 37 °C и низкой рН, подавляет фагоцитоз и обладает цитотоксическим действием на макрофаги.
Значительная часть факторов патогенности Y. pestis контролируется генами, носителями которых являются следующие 3 класса плазмид, обнаруживаемых обычно вместе у всех патогенных штаммов:
1) рYP (9,5 т. п. н.) – плазмида патогенности. Несет 3 гена:
pst – кодирует синтез пестицина;
pim – определяет иммунитет к пестицину;
pla – определяет фибринолитическую (активатор плазминогена) и плазмокоагулазную активность.
2) рYТ (65 МД) – плазмида токсигенности. Несет гены, определяющие синтез «мышиного» токсина (сложный белок, состоящий из двух фрагментов А и В, с м. м. 240 и 120 кД соответственно), и гены, контролирующие белковый и липопротеиновый компоненты капсулы. Третий ее компонент контролирует гены хромосомы. Ранее плазмида имела название pFra.
3) pYV (110 т. п. н.) – плазмида вирулентности. Она определяет зависимость роста Y. pestis при 37 °C от присутствия в среде ионов Ca2+, поэтому имеет другое название – Lcr-плазмида (англ. low calcium response). Гены этой, особенно важной, плазмиды кодируют также синтез антигенов V и W и термоиндуцируемых белков Yop. Их синтез осуществляется под сложным генетическим контролем при температуре 37 °C и в отсутствие в среде Ca2+. Все типы Yop-белков, кроме YopM и YopN, гидролизуются за счет активности активатора плазминогена (ген pla плазмиды pYP). Белки Yop во многом определяют вирулентность Y. pestis. YopE-белок обладает антифагоцитарным и цитотоксическим действием. YopD обеспечивает проникновение YopE в клетку-мишень; YopH обладает антифагоцитарной и протеин-тирозин-фосфатазной активностью; белок YopN – свойствами кальциевого сенсора; YopM связывается с α-тромбином крови человека.
Эпидемиология. Круг теплокровных носителей чумного микроба чрезвычайно обширен и включает более 200 видов 8 отрядов млекопитающих. Основным же источником чумы в природе являются грызуны и зайцеобразные. Естественная зараженность установлена у более чем 180 их видов, свыше 40 из них входят в состав фауны России и сопредельных территорий (в пределах бывшего СССР). Из 60 видов блох, для которых в экспериментальных условиях установлена возможность переноса возбудителя чумы, на этой территории обитают 36.
Чумной микроб размножается в просвете пищеварительной трубки блох. В ее переднем отделе образуется пробка («чумной блок»), содержащая большое количество микробов. При укусе млекопитающих c обратным током крови в ранку с пробки смывается часть микробов, что и ведет к заражению. Кроме того, выделяемые блохой при питании экскременты при попадании в ранку также могут вызывать заражение.
Основные (главные) носители Y. pestis на территории России и Средней Азии – суслики, песчанки и сурки, в некоторых очагах также пищухи и полевки. С ними связано существование следующих очагов чумы:
1) 5 очагов, в которых основным носителем чумного микроба выступает малый суслик (Северо-Западный Прикаспий; Терско-Сунженское междуречье; Приэльбрусский очаг; Волго-Уральский и Зауральский полупустынные очаги).
2) 5 очагов, в которых носители – суслики и сурки (на Алтае – пищухи): Забайкальский, Горно-Алтайский, Тувинский и высокогорные Тянь-Шанский и ПамироАлайский очаги.
3) Волго-Уральский, Закавказский и Среднеазиатский пустынные очаги, где основные носители – песчанки.
4) Высокогорные Закавказский и Гиссарский очаги с основными носителями – полевками.
Разные классификации Y. pestis основываются на разных группах признаков – биохимических особенностях (глицерин-позитивные и глицерин-негативные варианты), области распространения (океанические и континентальные варианты), видах основных носителей (крысиный и сусликовый варианты). По одной из наиболее распространенных классификаций, предложенной в 1951 г. французским исследователем чумы Р. Девинья (R. Devignat), в зависимости от географического распространения возбудителя и его биохимических свойств различают три внутривидовые формы (биовара) Y. pestis (табл. 28).
По классификации отечественных ученых (Саратов, 1985), вид Y. pestis разделен на 5 подвидов: Y. pestis subsp. pestis (основной подвид; он включает все три биовара классификации Р. Девинья), Y. pestis subsp. altaica (алтайский подвид), Y. pestis subsp. caucasica (кавказский подвид), Y. pestis subsp. hissarica (гиссарский подвид) и Y. pestis subsp. ulegеica (улэгейский подвид).
Заражение человека происходит через укус блох, при прямом контакте с заразным материалом, воздушно-капельным, редко алиментарным путем (например, при употреблении мяса верблюдов, больных чумой). В 1998 – 1999 гг. чумой в мире переболело 30 534 человека, из них 2 234 умерли.
Дифференциальные признаки биоваров Y. pestis
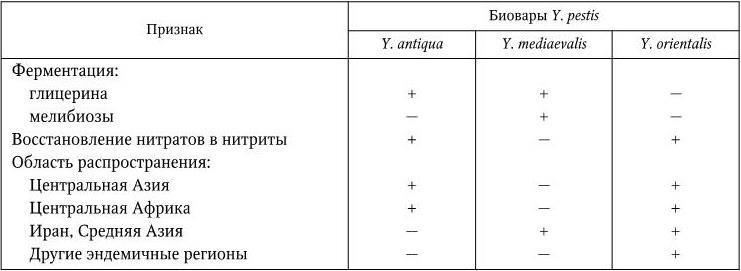
Таблица 28
Примечание. (+) – признак положительный; ( – ) – признак отсутствует.
Патогенез и клиника. В зависимости от способа заражения различают бубонную, легочную, кишечную форму чумы; редко септическую и кожную (гнойные пузырьки на месте укуса блохи). Инкубационный период при чуме варьирует от нескольких часов до 9 сут. (у лиц, подвергнутых серопрофилактике, до 12 сут.). Возбудитель проникает через мельчайшие повреждения кожи (укус блохи), иногда через слизистую оболочку или воздушно-капельным путем, достигает регионарных лимфатических узлов, в которых начинает бурно размножаться. Болезнь начинается внезапно: сильная головная боль, высокая температура с ознобом, лицо гиперемировано, затем оно темнеет, под глазами темные круги («черная смерть»). Бубон (увеличенный воспаленный лимфатический узел) появляется на второй день. Иногда болезнь развивается столь стремительно, что больной погибает раньше, чем появится бубон. Особенно тяжело протекает легочная чума. Она может возникнуть и как результат осложнения бубонной чумы, и при заражении воздушно-капельным путем. Болезнь развивается также очень бурно: озноб, высокая температура и уже в первые часы присоединяются боли в боку, кашель, вначале сухой, а потом с мокротой кровянистого характера; появляется бред, цианоз, коллапс, и наступает смерть. Больной легочной чумой представляет исключительную опасность для окружающих, так как выделяет с мокротой огромное количество возбудителя. В развитии болезни основную роль играет подавление активности фагоцитов: нейтрофильных лейкоцитов и макрофагов. Ничем не сдерживаемое размножение и распространение возбудителя через кровь по всему организму полностью подавляет иммунную систему и приводит (при отсутствии эффективного лечения) к гибели больного.
Постинфекционный иммунитет прочный, пожизненный. Повторные заболевания наблюдаются крайне редко. Природа иммунитета клеточная. Хотя антитела появляются и играют определенную роль в приобретенном иммунитете, он опосредуется главным образом Т-лимфоцитами и макрофагами. У лиц, переболевших чумой или вакцинированных, фагоцитоз имеет завершенный характер. Он и обусловливает приобретенный иммунитет.
Лабораторная диагностика. Используются бактериоскопический, бактериологический, серологический и биологический методы, а также аллергическая проба с пестином (для ретроспективной диагностики). Материалом для исследования служат: пунктат из бубона (или его отделяемое), мокрота, кровь, при кишечной форме – испражнения. Y. pestis идентифицируют на основании морфологии, культуральных, биохимических признаков, пробы с чумным фагом и с помощью биологической пробы. Простым и надежным методом определения антигенов чумной палочки в исследуемом материале является применение РПГА, особенно с использованием эритроцитарного диагностикума, сенсибилизированного моноклональными антителами к капсульному антигену, и ИФМ. Эти же реакции могут быть использованы для обнаружения антител в сыворотке больных.
Биологический метод диагностики заключается в заражении исследуемым материалом (когда он очень загрязнен сопутствующей микрофлорой) морской свинки накожно, подкожно или, реже, внутрибрюшинно.
При работе с материалом, содержащим возбудителя чумы, требуется соблюдение строгого режима, поэтому все исследования проводятся только хорошо обученным персоналом в специальных противочумных учреждениях.
Профилактика. Постоянный контроль за природными очагами чумы и организация мероприятий по предупреждению заболеваний людей в стране осуществляется специальной противочумной службой. Она включает в себя пять противочумных институтов и десятки противочумных станций и отделений.
Несмотря на наличие природных очагов, с 1930 г. на территории России в них не было ни одного случая заболевания людей чумой. Для специфической профилактики чумы используется живая ослабленная вакцина из штамма EV. Она вводится накожно, внутрикожно или подкожно. Кроме того, предложена сухая таблетированная вакцина для перорального применения. Поствакцинальный иммунитет формируется к 5 – 6-му дню после прививки и сохраняется в течение 11 – 12 мес. Для его оценки и ретроспективной диагностики чумы предложена внутрикожная аллергическая проба с пестином. Реакция считается положительной, если на месте введения пестина через 24 – 48 ч образуется уплотнение не менее 10 мм в диаметре и появляется краснота. Аллергическая проба положительна и у лиц, имеющих постинфекционный иммунитет.
Большой вклад в изучение чумы и организацию борьбы с ней внесли русские ученые: Д. С. Самойлович (первый не только в России, но и в Европе «охотник» за микробом чумы еще в XVIII в., он же первым предложил делать прививки против чумы), Д. К. Заболотный, Н. П. Клодницкий, И. А. Деминский (изучение природных очагов чумы, носителей возбудителя ее в очагах и т. п.) и др.
Иерсинии – возбудители псевдотуберкулеза (Y. pseudotuberculosis) и кишечного иерсиниоза (Y. enterocolitica)
Эти два вида иерсиний не относятся к категории особо опасных, но они тоже играют значительную роль в патологии человека. Y. pseudotuberculosis и Y. enterocolitica представляют собой полиморфные, не образующие спор грамотрицательные палочки, имеющие часто овоидную форму, клетки в старых культурах окрашиваются неравномерно. Бактерии псевдотуберкулеза, взятые с влажного агара, могут иметь биполярную окраску, образуют капсулу, но с различной степенью выраженности. Оба вида бактерий обладают, в отличие от Y. pestis, подвижностью, обусловленной наличием перитрихиальных жгутиков. Подвижность выявляется посевом в столбик полужидкого агара уколом, но только при 18 – 20 °C, при 37 °C она отсутствует. Иерсинии нетребовательны к питательным средам, хорошо растут на обычных универсальных средах, способны активно размножаться в почве и воде. Оптимальная для роста температура 30 °C, верхняя и нижняя температурные границы роста составляют 43 °C и 0 – 2 °C соответственно, диапазон рН 6,6 – 7,8. На среде Эндо через сутки колонии имеют диаметр 0,1 – 0,2 мм, круглые, выпуклые, блестящие, с ровными краями, бесцветны (не ферментируют лактозу), через несколько суток размер колоний 0,5 – 3 мм. Колонии возбудителя псевдотуберкулеза, находящиеся в R-форме, почти не отличаются от колоний Y. pestis (пигментированный центр и фестончатый «кружевной» край), но не имеют стадии «битого стекла».
Основные различия между возбудителями чумы, псевдотуберкулеза и кишечного иерсиниоза представлены в табл. 29.
Все три вида иерсиний отличаются и по антигенным свойствам.
Возбудитель псевдотуберкулеза по О-антигенам разделяется на восемь групп (I – VIII) с 20 О-факторными антигенами (1 – 20). По О– и Н-антигенам (а – е) этот вид подразделяют на 13 сероваров и подсероваров (Ia, Ib, IIa, IIb, IIc, III, IVa, IVb, Va, Vb, VI, VII, VIII).
Y. enterocolitica характеризуется неоднородностью по О-антигену. Различают 34 серовара этого вида. Большинство из них адаптированы к некоторым видам животных или широко распространены во внешней среде. Подавляющее большинство штаммов, выделенных от человека, принадлежит к сероварам О3 и О9, реже встречаются серовары О6, О8, О5 и очень редко серовары О1, О2, О10, О11, О13 – О17.
От больных псевдотуберкулезом чаще всего выделяются штаммы сероваров I (Ib), III и IV.
Таблица 29
Основные различия между возбудителями чумы, псевдотуберкулеза и кишечного иерсиниоза
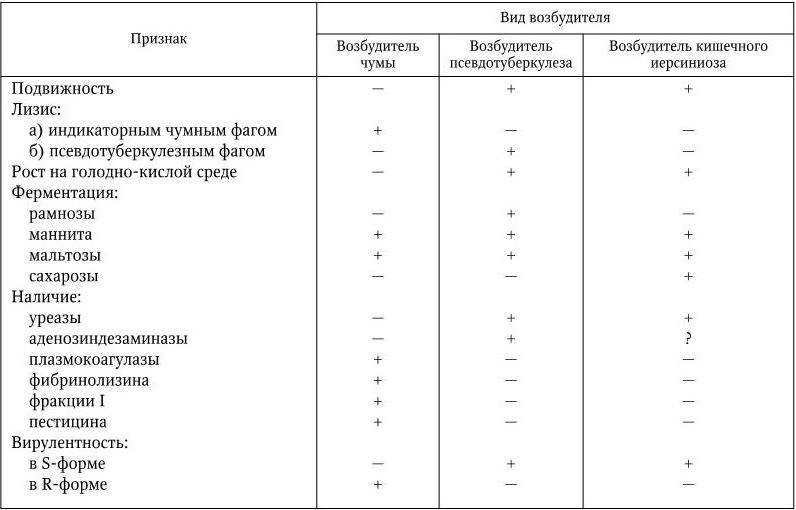
Примечание. (+) – признак положительный; ( – ) – признак отсутствует;? – не известно.
В ходе эволюции у иерсиний закрепилась необходимость существования в двух средах обитания – внешней (сапрофитическая фаза) и в организме теплокровных животных и человека (паразитическая фаза). Для осуществления паразитической фазы иерсинии должны проникнуть в организм теплокровного животного. Заражение возбудителем псевдотуберкулеза чаще всего происходит при употреблении в пищу инфицированных иерсиниями продуктов, хранившихся при пониженной температуре (4 – 12 °C) в холодильниках и овощехранилищах. В этих условиях в силу своей психрофильности бактерии могут размножаться и накапливаться в пищевых субстратах. Примером такого способа заражения является заболевание в 1988 г. псевдотуберкулезом 106 человек в Краснодарском крае, связанное с употреблением капусты, инфицированной Y. pseudotuberculosis. Основным резервуаром ее служит почва. Иерсинии при пониженной температуре обладают высоким потенциалом клеточной и тканевой инвазивности и способны сохранять высокий уровень вирулентности, однако возбудитель может проникнуть в организм человека и через любые слизистые оболочки, вероятно, за счет неспецифических механизмов. Источником иерсиниозов являются также дикие и синантропные грызуны, домашние и сельскохозяйственные животные. Возможно заражение человека от человека.
Штаммы Y. pseudotuberculosis выделены от 175 видов млекопитающих, 124 видов птиц, 7 видов рыб. Зараженные грызуны, животные и люди выделяют возбудителя с испражнениями и мочой, загрязняя воду, растения и другие объекты внешней среды, а через них заражается и человек. Таким образом, пищевой путь в передаче возбудителей псевдотуберкулеза и кишечного иерсиниоза является ведущим: заражение происходит в результате употребления в пищу сырых или недостаточно термически обработанных продуктов (мяса, мясных продуктов, молока, овощей, фруктов, зелени). Оба вида возбудителя способны размножаться не только на растениях, но и внутри них (салата, гороха, овса и т. п.).
Заболевания, вызываемые иерсиниями, характеризуются полиморфностью клинических проявлений, поражением желудочно-кишечного тракта, тенденцией к генерализации, септикопиемии и поражению различных органов и систем.
Y. enterocolitica вызывает у человека гастроэнтерит с повреждением стенок тонкого кишечника. Нередко после перенесенной болезни наблюдаются аутоиммунные спондилоартриты типа синдрома Рейтера и реактивного артрита. Полагают, что эти последствия связаны с наличием у Y. enterocolitica суперантигенов. Свойствами суперантигенов обладают мембранные белки этих бактерий.
Псевдотуберкулез людей на Дальнем Востоке описан как Дальневосточная скарлатиноподобная лихорадка. Она протекает тяжелее, чем псевдотуберкулез в западных областях, и характеризуется более сильными аллергическими и токсическими проявлениями, особенно на 2-й стадии болезни.
Патогенные свойства иерсиний обоих видов, как и возбудителя чумы, определяются не только хромосомными, но и плазмидными генами. У них обнаружены плазмиды, очень сходные с плазмидами Y. pestis, которые кодируют синтез антигенов V – W и наружных белков (Yop), таких же, как у Y. pestis, и других факторов вирулентности. Они имеют общий с Y. pestis кластер генов, связанных с системой транспорта железа. Установлено, что Y. pseudotuberculosis синтезирует термостабильный токсин, вызывающий гибель морских свинок при внутрибрюшинном заражении. Важную роль в патогенезе псевдотуберкулеза играет способность возбудителя к адгезии и колонизации слизистой кишечника.
Микробиологическая диагностика иерсиниозов включает использование бактериологических методов и серологических реакций. При бактериологическом методе исследуемый материал от больного (испражнения, кровь, слизь из зева), а также подозрительные продукты или воду засевают на среды Эндо, Плоскирева, Серова (индикаторную и дифференциальную) и инкубируют при 37 °C в течение 48 – 72 ч. Подозрительные колонии (мелкие бесцветные на средах Эндо и Плоскирева и окрашенные колонии двух различных форм на средах Серова) пересевают для получения чистых культур, которые идентифицируют по биохимическим признакам и окончательно типируют с помощью диагностических агглютинирующих сывороток.
Для серологической диагностики псевдотуберкулеза и кишечного иерсиниоза используют развернутую реакцию агглютинации (по типу реакции Видаля) с соответствующими диагностикумами или РПГА с антигенным эритроцитарным диагностикумом. Положительными считают реакции при титре антител 1: 400 и выше. Реакции рекомендуется ставить с парными сыворотками с интервалом в несколько дней. Нарастание титра антител свидетельствует о специфичности инфекционного процесса.
Бруцеллез – своеобразное заболевание людей и животных, вызываемое бактериями рода Brucella. В России ежегодно регистрируется около 500 первичных заболеваний людей бруцеллезом.
Человек заражается бруцеллезом главным образом от домашних животных (овцы, козы, коровы, свиньи, северные олени – главный резервуар возбудителя в природе). Болезнь существует давно и была описана под названиями, определяемыми ее географическим распространением (мальтийская, неаполитанская, гибралтарская, средиземноморская лихорадка).
Возбудитель открыт в 1886 г. Д. Брюсом, который обнаружил его в препарате из селезенки солдата, умершего от мальтийской лихорадки, и назвал мальтийским микрококком – Micrococcus melitensis. Было установлено, что основным носителем его являются козы и овцы, а заражение происходит при употреблении сырого молока от них. В 1897 г. Б. Банг и Б. Стрибольт обнаружили возбудителя инфекционного аборта коров – Bacterium abortus bovis, а в 1914 г. Дж. Траум открыл возбудителя инфекционного аборта свиней – B. abortus suis. Проведенное в 1916 – 1918 гг. А. Ивенс сравнительное изучение свойств M. melitensis и B. abortus bovis показало, что они почти не отличаются друг от друга по многим свойствам. В связи с этим было предложено объединить их в одну группу, названную в честь Брюса – Brucella. В 1929 г. И. Хеддльсон включил в эту группу B. abortus suis и предложил род Brucella разделить на 3 вида: Brucella melitensis (Micrococcus melitensis), Brucella abortus (B. abortus bovis) и Brucella suis (B. abortus suis).
Заболевание людей и животных, вызываемое бруцеллами, было решено называть бруцеллезом. В последующем род Brucella пополнился еще тремя видами: B. ovis выделен от баранов, страдающих эпидидимитами (1953), B. neotomae – от кустарниковых крыс (1957) и B. canis – от гончих собак (1966). По классификации Берджи (2001), бруцеллы относятся к классу Alphaproteobacteria.
Бруцеллы обладают сходными морфологическими, тинкториальными и культуральными свойствами. Они представляют собой грамотрицательные мелкие кокковидные клетки диаметром 0,5 – 0,7 мкм и длиной 0,6 – 1,5 мкм (см. цв. вкл., рис. 96.1), располагаются беспорядочно, иногда парами, не имеют жгутиков, не образуют спор и капсул. Содержание Г + Ц в ДНК составляет 56 – 58 мол %. Бруцеллы являются аэробами или микроаэрофилами, в анаэробных условиях не растут. Температурный оптимум для роста 36 – 37 °C; рН 7,0 – 7,2; хорошо растут на обычных питательных средах, но лучше – с добавлением сыворотки или крови. Рекомендуемые среды: питательный агар с добавлением сыворотки (5 %) и глюкозы; агар, приготовленный на картофельном настое, с добавлением 5 % сыворотки; кровяной агар; мясо-пептонный бульон. Особенностью B. abortus является потребность ее в повышенном содержании CO2 (5 – 10 %) в атмосфере роста. Очень характерен для бруцелл медленный рост, особенно в первых генерациях: при высеве от человека и животных рост иногда появляется через 2 – 4 нед. Колонии бруцелл бесцветны, выпуклые, круглые – S-формы, или шероховатые – R-формы, нежные и прозрачные вначале, с возрастом мутнеют.
Колонии B. canis, B. ovis и 5-го биотипа B. suis всегда имеют R-форму. Рост бруцелл в бульонных средах сопровождается равномерным помутнением. Для роста бруцелл необходимы тиамин, биотин, ниацин. Бруцеллы ферментируют глюкозу и арабинозу с образованием кислоты без газа, не образуют индола, восстанавливают нитраты в нитриты. Образование сероводорода наиболее сильно выражено у B. suis.
В общей сложности у бруцелл с помощью иммуноэлектрофореза экстрактов, приготовленных из разрушенных ультразвуком клеток, обнаружено 10 – 14 антигенных фракций. Бруцеллы имеют общий родоспецифический антиген, различные другие соматические антигены, в том числе видоспецифические М (преобладает у B. melitensis), А (преобладает у B. abortus) и R (у шероховатых форм). Антигены М и А обнаруживаются также и у других видов (биоваров) бруцелл, но в разных соотношениях, что необходимо учитывать при их идентификации (табл. 26). Обнаружены антигены, общие с Francisella tularensis, Bordetella bronchiseptica и Y. enterocolitica (серотип 09). В связи с тем, что некоторые признаки у бруцелл варьируют, вид B. melitensis подразделяют на 3 биовара, вид B. abortus – на 9 и B. suis – на 5 биоваров. Для их дифференциации на виды и биотипы и идентификации используют комплекс признаков, включающий в себя, помимо морфологических и тинкториальных свойств, также потребность в CO2 для роста, способность расти на средах в присутствии некоторых красителей (основной фуксин, тионин, сафранин), выделять H2S, образовывать уреазу, фосфатазу, каталазу (активность этих ферментов наиболее сильно выражена у B. suis, они же не растут на среде с сафранином), чувствительность к тбилисскому бактериофагу, агглютинация моноспецифическими сыворотками (табл. 30). В случае необходимости используют дополнительные метаболические тесты: способность окислять некоторые аминокислоты (аланин, аспарагин, глутаминовую кислоту, орнитин, цитруллин, аргинин, лизин) и углеводы (арабинозу, галактозу, рибозу, D-глюкозу, L-эритритол, D-ксилозу).
Четвертый биовар B. suis, поскольку его основным носителем являются не свиньи, а северные олени, и с учетом других его особенностей целесообразно выделять в качестве самостоятельного вида Brucella rangiferis.
К пятому биовару B. suis относят культуры, выделенные от абортировавших коров и овец и имеющие стойкую R-форму бруцелл.
Отношение бруцелл к тбилисскому фагу: в обычном рабочем разведении фаг лизирует только B. abortus. Однако в дозе, равной десяти рабочим, фаг лизирует, хотя и слабо, штаммы B. suis и B. neotomae.
Резистентность бруцелл. Бруцеллы обладают относительно высокой устойчивостью во внешней среде. Они сохраняются во влажной почве и в воде до 2 – 3, а при температуре 11 – 13 °C – до 4,5 мес.; в непроточных водоемах – до 3 мес.; в молоке – до 273 дней; в масле – до 142 дней; в сыре – до 1 года; в брынзе – до 72 дней; в кислом молоке – до 30 дней; в кефире – до 11 дней. Однако они очень чувствительны к высокой температуре – при 70 °C погибают через 10 мин, а при кипячении – за несколько секунд. Пастеризация молока при 80 – 90 °C вызывает их гибель через 5 мин. Бруцеллы чувствительны также к различным химическим дезинфектантам.
Таблица 30
Дифференциация бруцелл на виды и биовары
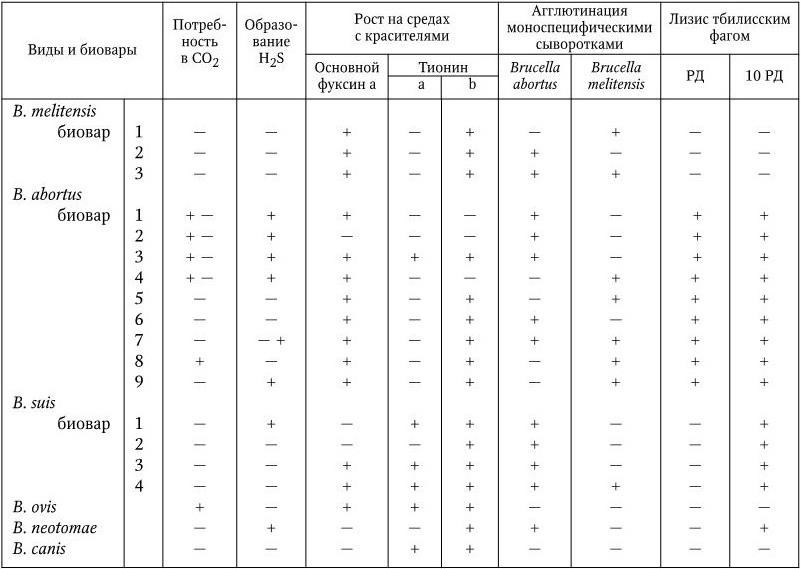
Примечание.а – концентрация в мкг/мл среды 1: 25 000; b – концентрация в мкг/мл среды 1: 50 000; РД – рабочая доза фага (стандартное тест-разведение).
Факторы патогенности. Бруцеллы не образуют экзотоксина. Их патогенность обусловлена эндотоксином и способностью подавлять фагоцитоз, предотвращать «окислительный взрыв». Конкретные факторы, подавляющие фагоцитоз, изучены недостаточно. Патогенность бруцелл связана также с гиалуронидазой и другими ферментами. Существенно важным является то, что бруцеллы обладают сильнейшим аллергенным свойством, которое во многом определяет патогенез и клинику бруцеллеза.
Особенности эпидемиологии. Основными носителями бруцелл являются овцы, козы (B. melitensis), крупный рогатый скот (B. abortus), свиньи (B. suis) и северные олени (B. rangiferis). Однако они могут переходить и на многие другие виды животных (яки, верблюды, буйволы, волки, лисицы, грызуны, ламы, сайгаки, бизоны, лошади, зайцы, ежи, куры и др.). Особенно большую эпидемиологическую опасность представляет переход Brucella melitensis на крупный рогатый скот, так как в этом случае она сохраняет свою высокую патогенность для человека. Из всех видов наиболее патогенным для человека в нашей стране является B. melitensis. Он служит причиной заболевания людей более чем в 95 – 97 % всех случаев бруцеллеза. B. abortus, как правило, вызывает латентную форму болезни, и только в 1 – 3 % отмечаются клинические проявления. Еще реже заболевание вызывает B. suis (менее 1 %). Патогенность бруцелл варьирует в зависимости не только от вида, но и от биовара. В частности, биовары 3, 6, 7, 9 B. abortus по вирулентности не уступают B. melitensis. Американские варианты B. suis являются также высоковирулентными, поэтому в разных странах этиологическая роль отдельных видов бруцелл проявляется по-разному. Например, в Мексике основную роль в эпидемиологии бруцеллеза играет B. melitensis, в США – B. suis, а в Канаде и некоторых европейских странах – B. abortus. Не исключено, что биовары 3, 6, 7, 9 B. abortus возникли в результате миграции на крупный рогатый скот Brucella melitensis и ее трансформации.
У животных бруцеллез протекает в виде общего заболевания, картина которого бывает различной. Для крупного и мелкого рогатого скота наиболее характерные проявления болезни – инфекционные аборты, особенно если они носят массовый характер. У свиней аборты отмечаются реже, болезнь протекает как хронический сепсис с поражением суставов, яичек и других органов. От больных животных возбудитель выделяется с молоком, мочой, испражнениями, гноем и особенно обильно – в период выкидыша с плодом, околоплодными оболочками и истечениями из родовых путей, которые представляют наиболее заразительный материал. Обильное размножение бруцелл в оболочках плода связывают с наличием в них многоатомного спирта – эритритола, который служит важным фактором роста для бруцелл всех видов, кроме B. ovis.
Человек заражается от животных (от больного человека крайне редко) главным образом контактным или контактно-бытовым путем (80 – 90 % всех заболеваний). Алиментарный способ заражения наблюдается в основном при употреблении непастеризованного молока от больных животных или молочных продуктов, приготовленных из него, а также воды. Контактным или контактно-бытовым способом могут заразиться все лица, постоянно или временно имеющие дело с животными или животным сырьем в силу своей профессии (пастухи, скотники, доярки, ветеринарные работники и другие лица). Бруцеллы при этом проникают в организм человека через кожу или, значительно чаще, через слизистые оболочки полости рта, носа, глаза (заносятся грязными руками).
Особенности патогенеза и клиники. Инкубационный период при бруцеллезе варьирует от 1 нед. до нескольких месяцев.
По лимфатическим путям возбудитель попадает в лимфатические узлы; размножаясь, образует «первичный бруцеллезный комплекс», локализация которого зависит от места входных ворот, но чаще всего это лимфатический аппарат ротовой полости, заглоточные, шейные, подчелюстные железы и лимфатический аппарат кишечника. Из лимфатических узлов возбудитель проникает в кровь и распространяется по всему организму, избирательно поражая ткани лимфо-гемопоэтической системы. Бактериемия и генерализация процесса приводят к сильной аллергизации организма. Бруцеллез протекает как хрониосепсис. Это обусловлено незавершенным характером фагоцитоза. Находясь и размножаясь внутри клеток, в том числе фагоцитов, бруцеллы оказываются не доступными ни для антител, ни для химиопрепаратов. Кроме того, они могут превращаться внутри клеток в L-формы и в таком виде длительно персистировать в организме, а возвращаясь в исходную форму, вызывать рецидив болезни.
Клиника бруцеллеза очень многообразна и сложна. Она зависит прежде всего от аллергизации и интоксикации организма и от того, какие органы и ткани вовлечены в инфекционный процесс. Чаще всего страдают лимфатическая, сосудистая, гепатолиенальная, нервная, и особенно опорно-двигательная системы. Бруцеллезу свойственно длительное течение (иногда до 10 мес.), в тяжелых случаях он может приводить к длительной потере трудоспособности и временной инвалидности, но все же болезнь, как правило, заканчивается полным выздоровлением.
Постинфекционный иммунитет длительный, прочный, но возможны повторные заболевания. Иммунитет перекрестный (против всех видов бруцелл) и обусловлен Т-лимфоцитами и макрофагами. У иммунных людей и животных фагоцитоз носит завершенный характер. Роль антител в иммунитете заключается в стимуляции фагоцитарной активности. Положительная аллергическая реакция свидетельствует не только о сенсибилизации организма, но и о наличии иммунитета. Прорыв иммунитета может произойти при инфицировании большими дозами возбудителя или при его высокой вирулентности.
Лабораторная диагностика бруцеллеза осуществляется с помощью биологической пробы, бактериологического метода, серологических реакций, аллергической пробы Бюрне и метода ДНК – ДНК гибридизации. Материалом для исследования служат кровь, костный мозг, конъюнктивальный секрет, моча, грудное молоко (у кормящих матерей), реже – испражнения, околосуставная жидкость. Поскольку основным местом пребывания возбудителя в организме являются клетки гемо– или лимфопоэтической систем, предпочтение следует отдавать выделению гемо– или миелокультуры. При бактериологическом исследовании необходимо обеспечить условия для роста B. abortus (потребность в CO2). Идентификацию выделенных культур бруцелл проводят на основании указанных в табл. 30 признаков. К биологической пробе (заражение морских свинок) прибегают в том случае, когда материал сильно загрязнен посторонней микрофлорой и получить непосредственно из него чистую культуру возбудителя трудно. Серологические реакции могут быть использованы либо для обнаружения антигенов возбудителя, либо для выявления антител к нему. Для обнаружения бруцеллезных антигенов, которые могут циркулировать в крови либо в свободном виде, либо в виде комплексов антиген + антитело (ЦИК – циркулирующие иммунные комплексы), используют следующие реакции: РПГА (особенно с использованием эритроцитарных диагностикумов с моноклональными антителами к родоспецифическому антигену бруцелл); реакцию агрегат-гемагглютинации (РАГА); эритроциты несут антитела к бруцеллезным антигенам; реакции коагглютинации, преципитации и ИФМ. Для обнаружения антител в сыворотке больного используют: реакцию агглютинации Райта, реакцию Кумбса (для выявления неполных антител), реакцию иммунофлуоресценции в непрямом варианте, РПГА, ИФМ, РСК, ОФР, а также ускоренные реакции на стекле: Хеддльсона, розбенгал, латекс-агглютинации, непрямую реакцию гемолиза (эритроциты, сенсибилизированные ЛПС бруцелл, в присутствии антител и комплемента лизируются).
Специфическая профилактика осуществляется с помощью живой вакцины, приготовленной из штамма B. abortus (живая бруцеллезная вакцина – ЖБВ), только в очагах козье-овечьего бруцеллеза. Вакцина применяется накожно, однократно. Ревакцинацию проводят только лицам, у которых проба Бюрне и серологические реакции отрицательны. Поскольку ЖБВ обладает сильным аллергенным действием, вместо нее предложена химическая бруцеллезная вакцина (ХБВ), приготовленная из антигенов клеточной стенки бруцелл. Она обладает высокой иммуногенностью, но менее аллергенна. Взвесь убитых бруцелл (убитая лечебная вакцина) или ХБВ могут быть использованы для лечения хронического бруцеллеза (стимулируют формирование постинфекционного иммунитета).
Туляремия – первичная болезнь животных (грызунов), у человека протекает в виде острого инфекционного заболевания с разнообразной клинической картиной и медленным восстановлением трудоспособности. Возбудитель – Francisella tularensis – открыт Г. Мак-Коем и Ш. Чепином в 1912 г. во время эпизоотии среди земляных белок в местности с озером Туляре (Калифорния), подробно изучен Э. Френсисом, в честь которого и назван род. Это очень маленькие (см. цв. вкл., рис. 96.2), размерами 0,2 – 0,7 мкм кокковидные или эллипсоидные полиморфные палочки, которые очень часто при специальных методах окрашивания дают биполярную окраску;
неподвижны, грамотрицательны, спор не образуют; каталазонегативны, образуют H2S, строгие аэробы, температурный оптимум для роста 37 °C, рН 6,7 – 7,2. Вирулентные штаммы имеют капсулу, образуют кислоту без газа при ферментации некоторых углеводов (глюкоза, мальтоза, манноза, фруктоза, декстрин), степень ферментации у разных штаммов варьирует, содержание Г + Ц в ДНК – 33 – 36 мол %. F. tularensis на обычных средах не растет. Г. Мак-Кой и Ш. Чепин использовали свернутую желточную среду. На ней туляремийная палочка растет в виде нежных мелких колоний, напоминающих капельки росы, затем культура приобретает характер нежного шагреневого налета со слабо выраженной слизистой консистенцией. Э. Френсис предложил для выращивания туляремийной палочки питательный агар, содержащий 0,05 – 0,1 % цистина, 1 % глюкозы и 5 – 10 % крови. На такой среде рост более пышный и грубый: колонии круглые с гладкой поверхностью, молочного цвета, влажные, со слизистой консистенцией, окружены характерным зеленым ореолом. Рост медленный, максимального размера колонии достигают на 3 – 5-й день (1 – 4 мм). Туляремийные бактерии хорошо размножаются в желточном мешке куриного эмбриона, вызывая его гибель на 3 – 4-й день.
Для роста F. tularensis необходимы следующие аминокислоты: аргинин, лейцин, изолейцин, лизин, метионин, пролин, треонин, гистидин, валин, цистин, для некоторых подвидов – серин, тирозин, аспарагиновая кислота; кроме того, для роста они нуждаются также в пантотеновой кислоте, тиамине и ионах Mg2+. С учетом этих особенностей для культивирования F. tularensis можно использовать синтетические среды.
Род Francisella отнесен к классу Gammaproteobacteria, тип Proteobacteria. К этому же роду относится F. novicida, патогенность которой для человека не установлена.
Возбудитель туляремии является внутриклеточным паразитом. Его вирулентность обусловлена капсулой, угнетающей фагоцитоз; нейраминидазой, которая способствует адгезии; эндотоксином; аллергенными свойствами клеточной стенки, а также способностью размножаться в фагоцитах и подавлять их киллерный эффект. Механизмы вирулентности пока не расшифрованы. Кроме того, у туляремийной палочки обнаружены рецепторы, способные взаимодействовать с Fc-фрагментами иммуноглобулинов класса IgG. В результате такого связывания нарушается активность систем комплемента и макрофагов.
F. tularensis в S-форме (вирулентный) имеет два антигена – О и Vi (капсульный антиген). О-антиген обнаруживает родство с антигенами бруцелл. Диссоциация S→SR→R приводит к утрате капсулы, вирулентности и иммуногенности. Вид F. tularensis подразделяют на три географические расы (подвида):
1) голарктическую (слабопатогенная для домашних кроликов, не ферментирует глицерина и не имеет фермента цитруллинуреидазы, встречается в странах северного полушария);
2) среднеазиатскую (малопатогенная для кроликов, имеет цитруллинуреидазу и ферментирует глицерин);
3) неарктическую (американскую), более патогенна для кроликов, ферментирует глицерин, имеет цитруллинуреидазу.
Кроме того, штаммы американского и среднеазиатского подвидов обладают фосфатазной активностью, отсутствующей у штаммов голарктического подвида.
Резистентность. F. tularensis довольно устойчива во внешней среде, особенно если содержится в патологическом материале. В фураже, зерне, загрязненных выделениями больных грызунов, выживает до 4 мес.; в воде – до 3 мес.; во льду – более 1 мес. Чувствительна к прямым солнечным лучам (погибает за 30 мин), высокой температуре (при 60 °C гибнет через 10 мин), под действием 3 % раствора лизола, 50 %-ного спирта, формалина и других антисептиков погибает через 5 – 10 мин.
Эпидемиология. Основным резервуаром туляремии в природе являются грызуны, среди которых в естественных условиях наблюдаются эпизоотии. Человек заражается только от животных, от человека к человеку возбудитель не передается. Возбудитель обнаружен у 82 видов грызунов и зайцеобразных, наиболее часто встречается у представителей 4 семейств: мышевидных (Muridae), заячьих (Leporidae), беличьих (Sciuridae) и тушканчиковых (Dipodidae). На территории России основными носителями являются мышевидные грызуны: водяные крысы, обыкновенные полевки, домовые мыши и ондатры.
По чувствительности к туляремии животные могут быть разбиты на четыре группы:
1-я группа – наиболее восприимчивы (полевки, водяные крысы, домовые мыши, белые мыши, морские свинки и некоторые другие). Минимальная смертельная доза составляет одну микробную клетку;
2-я группа – менее чувствительны (серые крысы, суслики и др.). Минимальная смертельная доза – 1 млрд микробных клеток, однако для заражения некоторых из них достаточно одной микробной клетки;
3-я группа (хищники – кошки, лисицы, хорьки). Устойчивы к высоким заражающим дозам, заболевание протекает без видимых проявлений;
4-я группа – невосприимчивы к туляремии (копытные животные, холоднокровные, птицы).
Для человека минимальная инфицирующая доза – одна микробная клетка. Заражение человека происходит всеми возможными способами: прямым и непрямым контактом с больными грызунами, их трупами или с предметами, зараженными грызунами; алиментарным (при употреблении пищевых продуктов и воды, инфицированных грызунами), воздушно-пылевым и трансмиссивным путем. Зараженность туляремийными бактериями установлена у 77 видов кровососущих членистоногих. Особенно большое значение имеют иксодовые клещи, у которых возбудитель сохраняется в течение всей жизни и даже передается трансовариально потомству. Эти обстоятельства способствуют укоренению болезни в природе. Заражение человека клещами происходит не путем укуса, а в результате попадания возбудителя на кожу вместе с испражнениями клеща.
На территории России различают 7 основных ландшафтных типов природных очагов туляремии: пойменно-болотный, луго-полевой, степной, лесной, предгорноручьевой, тундровый и тугайный (пойменно-пустынный).
Особенности патогенеза и клиники. F. tularensis проникает в организм через наружные покровы (поврежденную и неповрежденную кожу и слизистые). На месте внедрения нередко образуются язвочки. Через лимфатические сосуды бактерии попадают в регионарный лимфатический узел и беспрепятственно размножаются в нем; воспалительный процесс приводит к формированию бубона. Отсюда возбудитель проникает в кровь, бактериемия обусловливает генерализацию процесса, в него вовлекаются различные органы и ткани, размножение в которых бактерий приводит к образованию гранулем и некротических язв. С бактериемией и генерализацией связана аллергическая перестройка организма. Инкубационный период при туляремии варьирует от 2 до 8 дней. Болезнь начинается остро: появляются лихорадка, головная боль, боли в мышцах, гиперемия лица. Дальнейшее течение зависит от места входных ворот, в соответствии с которым различают следующие клинические формы туляремии: язвенно-железистую (бубонную), глазо-железистую, ангинозножелезистую, абдоминальную и легочную. Летальность при туляремии не превышает 1 – 2 %.
Постинфекционный иммунитет прочный, стойкий, в большинстве случаев пожизненный, имеет клеточную природу, обусловлен главным образом Т-лимфоцитами и макрофагами, в меньшей степени – антителами. Фагоцитоз у лиц, имеющих иммунитет, имеет завершенный характер.
Лабораторная диагностика. В связи с полиморфной клинической картиной туляремии в ее диагностике решающее значение имеют лабораторные методы: бактериологический, биологический, серологические реакции и аллергическая проба. Бактериологический метод имеет существенную особенность: выделить возбудителя от больного человека непосредственно не удается. Поэтому исследуемым материалом (пунктат бубона, гной из конъюнктивы, пленка из зева, мокрота, испражнения, кусочки органов из трупов грызунов) вначале заражают подкожно белых мышей или морских свинок, а затем уже делают посев крови или материала из органов для получения чистой культуры, которую идентифицируют по морфологическим, культуральным (не растет на обычных средах) свойствам, по реакции агглютинации со специфической сывороткой и окончательно – биологической пробой на белых мышах.
F. tularensis можно выделить также путем заражения в желточный мешок куриных эмбрионов. Возбудитель легко в нем обнаруживается с помощью метода иммунной флуоресценции. Однако биологические пробы и бактериологические исследования по туляремии возможно проводить только в специальных лабораториях. В обычных клинических условиях для диагностики туляремии применяют только серологические реакции (со 2-й нед. развернутая пробирочная агглютинация, РПГА и др.) и аллергическую пробу с тулярином. Последняя является наиболее ранним методом специфической диагностики. При внутрикожной постановке она бывает положительной с 3 – 5-го дня болезни, при накожной – с 6 – 8-го дня. В природных очагах туляремии для контроля эпизоотий среди грызунов используют РПГА и ее варианты (РНАг, РТПГА), а также ИФМ с целью обнаружения антигенов туляремийной палочки в трупах грызунов, погадках хищных птиц, помете хищников.
Специфическая профилактика. Основным методом предупреждения заболевания людей, проживающих на территории природных очагов туляремии, является вакцинация, осуществляемая с помощью живой (ослабленной) сухой накожной вакцины. Вакцину вводят однократно, иммунитет не менее 5 – 7 лет.
Сибирская язва является острым инфекционным заболеванием человека и животных (домашних и диких).
Русское название болезни дал С. С. Андриевский в связи с крупной эпидемией на Урале в конце XVIII в. В 1788 г. героическим опытом самозаражения он доказал идентичность сибирской язвы человека и животных и окончательно подтвердил ее нозологическую самостоятельность. Возбудитель – Bacillus anthracis – был неоднократно описан разными авторами (Поллендер А., 1849; Дален К., 1850; Браун Ф., 1854), однако его этиологическая роль была окончательно установлена Р. Кохом (1876) и Л. Пастером (1881).
B. anthracis (род Bacillus) относится к семейству Bacillaceae (класс Bacilli). Это крупная палочка длиной 5 – 8, иногда до 10 мкм, диаметром 1,0 – 1,5 мкм. Концы у живых палочек слегка закруглены, у убитых они как бы обрублены и слегка вогнуты. Палочки в мазках располагаются парами и очень часто – цепочками (см. цв. вкл., рис. 97.1), особенно длинными на питательных средах, напоминая бамбуковую трость. Сибиреязвенная палочка хорошо красится всеми анилиновыми красителями, грамположительна. Жгутиков не имеет, образует споры, но только вне организма человека или животного при наличии кислорода и определенной влажности. Температурный оптимум для спорообразования 30 – 35 °C (ниже 12 °C и выше 43 °C спорообразования не происходит). Споры располагаются центрально, их диаметр не превышает диаметра бактериальной клетки. Образование спор происходит в тех случаях, когда бактерии испытывают дефицит либо источников энергии, либо аминокислот или оснований. Поскольку в крови и тканях эти источники питания бактерий имеются, спорообразования в организме не происходит. Возбудитель сибирской язвы образует капсулу, но только в организме животного или человека (см. рис. 97.2), на питательных средах она наблюдается редко (на средах, содержащих кровь или сыворотку). Капсулообразование патогенных бактерий – защитный механизм. Оно индуцируется факторами, содержащимися в крови и тканях, поэтому капсулы образуются, когда бактерии находятся в организме или при выращивании на средах с кровью, плазмой или сывороткой. Содержание Г + Ц в ДНК варьирует в пределах 32 – 62 мол % (для рода в целом).
Возбудитель сибирской язвы – аэроб или факультативный анаэроб. Температурный оптимум для роста 37 – 38 °C, рН среды 7,2 – 7,6. К питательным средам нетребователен. На плотных средах образует характерные крупные матовые шероховатые колонии R-формы. Структура колоний, благодаря цепочечному расположению палочек, которые образуют нити, отходящие от центра, имеет сходство с локонами или львиной гривой (рис. 98). На агаре, содержащем пенициллин (0,05 – 0,5 ЕД/мл), через 3 ч роста бациллы распадаются на отдельные шарики, располагающиеся в виде цепочки, образуя феномен «жемчужного ожерелья». В бульоне палочка, находящаяся в R-форме, растет на дне, образуя осадок в виде комочка ваты, бульон при этом остается прозрачным. B. anthracis вирулентна в R-форме, при переходе в S-форму она утрачивает свою вирулентность. Такие палочки на плотной среде образуют круглые гладкие колонии с ровными краями, а в бульоне – равномерное помутнение. При этом палочки утрачивают способность располагаться в мазках цепочками и приобретают вид коккобактерий, располагающихся скоплениями.
Рис. 98. Колония Bacillus anthracis
B. anthracis довольно активна в биохимическом отношении: ферментирует с образованием кислоты без газа глюкозу, сахарозу, мальтозу, трегалозу, образует H2S, свертывает молоко и пептонизирует его, каталазопозитивна, имеет нитратредуктазу. При посеве уколом в столбик 10 – 12 %-ного мясо-пептонного желатина вызывает послойное разжижение его (рост в виде елочки, опрокинутой вниз вершиной).
Для отличия B. anthracis от других видов Bacillus используют комплекс признаков (табл. 31).
Антигенное строение. Возбудитель сибирской язвы имеет соматические антигены и капсульный антиген белковой природы (состоит из D-глутаминовой кислоты), образуемый главным образом в организме животного и человека. Соматический антиген полисахаридной природы термостабилен, длительно сохраняется во внешней среде и в трупах животных. На его обнаружении основана диагностическая реакция термопреципитации Асколи. Сибиреязвенная палочка имеет также антигены, общие для рода Bacillus.
Факторы патогенности. Важнейшим фактором вирулентности сибиреязвенной палочки является капсула. Утрата капсулы приводит к потере вирулентности. Капсула предохраняет B. anthracis от фагоцитоза. Другим важным фактором вирулентности, который ответствен за смерть животных, является сложный комплекс токсина, содержащего 3 различных компонента: фактор I, состоящий из белка и углевода; и два фактора чисто белковой природы (факторы II и III). Синтез сложного токсина контролируется плазмидой pX01 c м. м. 110 – 114 МД. В составе плазмиды pX01 есть три гена, определяющих синтез основных компонентов экзотоксина:
ген cya – фактора отечности (ОФ);
ген pag – протективного антигена (ПА);
ген lef – летального фактора (ЛФ).
Продуктом гена cya (ОФ) является аденилатциклаза, катализирующая накопление в клетках эукариот цАМФ. Фактор отечности вызывает повышение проницаемости сосудов.
Протективный антиген индуцирует синтез защитных антител (однако наиболее иммуногенным является комплекс из всех трех компонентов обезвреженного токсина), летальный фактор вызывает смерть животных. Все три компонента токсина действуют синергидно.
Синтез капсулы сибиреязвенной палочки контролируется также плазмидой pX02 c м. м. 60 МД.
В связи со сложной структурой комплекса генов, контролирующих патогенность B. anthracis, уточняется локализация генов в геноме бактерии с применением различных методов генотипирования, в том числе сравнительного анализа MLVA и хромосомных VNTR (см. с. 27).
Таблица 31
Дифференциальные признаки B. anthracis и некоторых других видов рода Bacillus

Резистентность B. anthracis. В вегетативной форме возбудитель обладает такой же степенью устойчивости к воздействию факторов внешней среды и химических веществ, как и другие бесспоровые бактерии. Споры бактерии очень устойчивы, сохраняются в почве десятилетиями, в воде – годами, выдерживают кипячение в течение 45–60 мин, автоклавирование (110 °C) – 5 мин, сухой жар (140 °C) – до 3 ч, долго сохраняются в шкурах животных и засоленном мясе.
Особенности эпидемиологии. Основным источником сибирской язвы являются больные травоядные животные. Они в течение всего периода болезни выделяют возбудителя с мочой, испражнениями и слюной в почву, инфицируя ее, поэтому почва, особенно богатая органическими веществами, становится дополнительным резервуаром возбудителя. Заражение животных происходит главным образом алиментарным путем (через корм и питьевую воду, зараженные спорами), реже – трансмиссивным – через укусы мух, клещей, слепней, которые переносят возбудителя от больных животных, трупов и из инфицированных объектов внешней среды; очень редко – воздушным путем. При непосредственном контакте от больного животного к здоровому возбудитель не передается.
Заражение человека сибирской язвой происходит при непосредственном контакте с трупами животных, при разделке туш вынужденно убитых животных, при уходе за больными животными, при употреблении мяса или мясных продуктов, полученных от больных животных, при контакте с шерстью, шкурами, кожей, щетиной, зараженными возбудителем или его спорами. Заражение здорового человека от больного происходит крайне редко.
Входными воротами инфекции являются кожа и слизистые оболочки кишечного тракта и дыхательных путей. В соответствии с входными воротами заболевание человека сибирской язвой протекает в виде кожной (чаще всего, до 98 % всех случаев заболевания), кишечной или легочной форм. Инкубационный период варьирует от нескольких часов до 6 – 8 дней, чаще всего – 2 – 3 дня. Кожная форма проявляется в виде сибиреязвенного карбункула, который локализуется обычно на открытых частях тела (лицо, шея, верхние конечности), реже – на участках тела, закрытых одеждой. Карбункул – своеобразный очаг геморрагического некроза, на верхушке которого образуется пузырек с серозно-кровянистым содержимым или плотный черно-бурого цвета струп. Кожа и подкожная клетчатка карбункула и вокруг него отечны, пропитаны серозно-кровянистым экссудатом, но нагноения и абсцессов обычно не наблюдается. В воспаленных тканях и экссудате – большое количество бацилл, окруженных капсулой.
При кишечной форме наблюдается общая интоксикация с катаральными и геморрагическими проявлениями со стороны желудочно-кишечного тракта (тошнота, рвота с примесью крови, кровяной понос, боли в животе и пояснице). Болезнь длится 2 – 4 дня и чаще всего заканчивается смертью.
Легочная форма сибирской язвы встречается исключительно редко и протекает по типу бронхо-пневмонии с глубокой общей интоксикацией, болью в груди, общим недомоганием, высокой температурой, кашлем с выделением мокроты, вначале слизистой, затем кровянистой. Смерть наступает на 2 – 3-й день. Как правило, все формы сибирской язвы сопровождаются высокой температурой (39 – 40 °C). Наиболее тяжело протекает сибирская язва в септической форме, которая может быть как первичной, так и следствием осложнения другой формы болезни. Она характеризуется обилием геморрагических проявлений и наличием большого количества возбудителя в крови, ликворе и в ряде органов больного человека. Заболевания сибирской язвой среди людей носят спорадический характер.
Постинфекционный иммунитет связан с появлением антитоксинов и антимикробных (протективных) антител.
Лабораторная диагностика. Материалом для исследования служат: при кожной форме – содержимое пузырьков, отделяемое карбункула или язвы; при кишечной – испражнения и моча; при легочной – мокрота; при септической – кровь. Исследованию могут подвергаться различные объекты внешней среды (почва, вода), пищевые продукты, сырье животного происхождения и прочий материал. Для обнаружения возбудителя используют бактериоскопический метод: обнаружение грамположительных палочек, окруженных капсулой (в материале от животных или человека) или содержащих споры (объекты внешней среды). Основной метод диагностики – бактериологический – выделение чистой культуры и ее идентификация, с обязательной проверкой на патогенность для лабораторных животных. В случаях, когда исследуемый материал сильно загрязнен сопутствующей, особенно гнилостной, микрофлорой, используют биологическую пробу: подкожно заражают белых мышей или морских свинок. При наличии B. anthracis мыши и морские свинки погибают через 24 – 26 ч, кролики – через 2 – 3 сут., при явлениях общего сепсиса; селезенка резко увеличена, в месте введения материала – инфильтрат. В препаратахмазках из крови и органов – капсульные палочки.
Из числа серологических реакций с диагностической целью применяется главным образом реакция термопреципитации Асколи. Ее используют в тех случаях, когда трудно рассчитывать на выделение чистой культуры возбудителя (в частности, при исследовании шерсти, шкур, щетины и прочих предметов). Реакция Асколи основана на обнаружении термостабильных антигенов возбудителя, которые сохраняются гораздо дольше, чем жизнеспособные вегетативные клетки и споры сибиреязвенной палочки. Для ретроспективной диагностики сибирской язвы используют аллергическую пробу с антраксином.
Лечение больных сибирской язвой носит комплексный характер. Оно направлено на обезвреживание токсина и против возбудителя: применяют противосибиреязвенный иммуноглобулин и антибиотики (пенициллины, тетрациклины, эритромицин и др.).
Специфическая профилактика. Впервые вакцина против сибирской язвы была получена Л. Пастером в 1881 г., в нашей стране – Л. С. Ценковским в 1883 г. из ослабленных штаммов B. anthracis. В настоящее время в России для профилактики сибирской язвы у людей и животных применяют живую споровую бескапсульную вакцину СТИ, которая готовится из авирулентного штамма сибиреязвенной палочки. Вакцина высоко эффективна. Прививки проводят однократно накожно или внутрикожно тем лицам, у которых в силу их профессии существует возможность заражения сибирской язвой. Ревакцинацию проводят через год.
Микробиология сапа и мелиоидоза
Сап – острое инфекционное заболевание зоонозной природы, протекающее по типу септикопиемии в острой или хронической форме с образованием пустул, язв, множественных абсцессов в различных тканях и органах. Возбудитель сапа – Burkholderia mallei (по старой классификации – Pseudomonas mallei) был впервые выделен в чистой культуре Ф. Леффлером и Х. Шутцем в 1882 г.
Род Burkholderia отнесен к классу Betaproteobacteria. B. mallei – тонкая прямая или слегка изогнутая палочка с закругленными концами, имеет размеры 2 – 3 мкм в длину и 0,5 – 1,0 мкм в ширину. Жгутиков не имеет, спор и капсул не образует, грамотрицательна. При выращивании на питательных средах склонна к полиморфизму – в препарате могут встречаться колбовидные, нитевидные формы, контуры клеток могут быть неровными. Хорошо окрашивается всеми анилиновыми красителями, при этом часто выявляется биполярность или неравномерность окраски в связи с наличием включений полигидроксимасляной кислоты. Содержание Г + Ц в ДНК составляет 69 мол %. Строгий аэроб, оптимальная температура для роста 35 – 37 °C, рН 6,8. Хорошо растет на обычных средах с добавлением 4 – 5 % глицерина. В МПБ с глицерином в начале роста образуется равномерное помутнение, на второй день – пристеночный рост, превращающийся в пленку, от которой вниз спускаются нити. На агаре с глицерином при 37 °C уже через сутки появляются плоские полупрозрачные колонии, которые затем сливаются и образуют густые налеты слизистой тягучей массы янтарного цвета. На картофеле через сутки образуются нежные полупрозрачные колонии, которые через неделю сливаются и образуют налет желто-бурого цвета, похожий на мед.
Биохимические свойства выражены слабо и нестабильны. Обычно ферментирует глюкозу, маннит, ксилозу с образованием кислоты, желатин не разжижает. Не образует индола и не восстанавливает нитраты в нитриты. На жидких средах образует сероводород и аммиак. Обладает каталазной активностью. Свертывает, но не пептонизирует молоко. Тест на β-галактозидазу положительный; имеет фермент аргининдигидролазу.
В антигенном отношении родствен возбудителю мелиоидоза и некоторым другим псевдомонадам; в то же время установлено, что различные штаммы возбудителя сапа не однородны по антигенной структуре, содержат специфические полисахаридные и неспецифические нуклеопротеидные антигенные фракции.
Экзотоксина возбудитель сапа не образует. При нагревании возбудителя в течение 1 – 2 ч при 60 °C выделяется эндотоксин, активно действующий на клетки гладких мышц изолированных органов и оказывающий общетоксическое действие.
Эпидемиология. Источник инфекции – больные лошади, иногда мулы, ослы, верблюды, которые заражаются путем прямого контакта. Особо заразны животные с острой формой сапа. Возбудитель содержится в выделениях из кожных повреждений и дыхательной системы. Заражение человека происходит при уходе за больными животными, при контакте с трупами животных или вторично инфицированными объектами (солома, фураж, сбруя и пр.). Возможно внутрилабораторное аэрогенное заражение. Передача инфекции от человека к человеку маловероятна. В России сап уже давно не регистрируется. Заболевание встречается очень редко и ограничено частью Африки и Средним Востоком.
Во внешней среде возбудитель сапа малоустойчив. При температуере 100 °C погибает в течение нескольких минут, при 70 °C – в течение 1 ч. Под действием солнечного света в чистой культуре погибает в течение суток, в выделениях животных сохраняется несколько недель.
Патогенез и клиника. Возбудитель сапа проникает в организм человека через поврежденную кожу, слизистую носа, глаз, а также перорально и аэрогенно. Проникшие палочки сапа сначала размножаются в лимфатических узлах, затем проникают в кровь и распространяются по всему организму. Процесс принимает септикопиемический характер с образованием множественных рассеянных очагов гнойного расплавления, формируются язвы и абсцессы. Реже наблюдается хроническое течение в виде хрониосепсиса с полиартритами и множественными абсцессами в различных органах, в коже, подкожной клетчатке, мышцах, на слизистых оболочках, с явлениями рубцевания и инкапсуляции. Инкубационный период при сапе от 1 до 5 сут., реже 2 – 3 нед. Летальность при острой форме в случае позднего диагноза или отсутствия лечения достигает 100 %, при хронических формах – 50 % и выше.
Иммунитет. В случае перенесенного заболевания формируется кратковременный, преимущественно гуморальный иммунитет. В сыворотке крови больных и реконвалесцентов обнаруживаются агглютинины, преципитины и комплементсвязывающие антитела.
Лабораторная диагностика. Включает в себя микроскопическое исследование (РИФ, окраска по Граму или Романовскому – Гимзе) отделяемого материала из язв, полости носа, пунктата из лимфатического узла или абсцесса, а также бактериологический, серологический, биологический и аллергический методы. Для выделения чистой культуры сеют патологический материал на питательные среды, содержащие картофель и агар, и в бульон с 3 % глицерина. С помощью РПГА и РСК в парных сыворотках больного обнаруживают нарастание титра антител, или с помощью РПГА обнаруживают антиген возбудителя в исследуемом материале.
Для заражения используют морских свинок или хомячков; заражают подкожно, если материал загрязнен сопутствующей микрофлорой; или внутрибрюшинно, если это чистая культура возбудителя сапа. Характерны развитие у зараженных самцов поражения яичек, а также кожные гнойники и язвы. Аллергическая диагностика сапа осуществляется путем внутрикожного введения маллеина, получаемого из возбудителя сапа при его разрушении. В основе пробы лежит реакция гиперчувствительности замедленного типа, результат учитывается через 24 – 48 ч; положительна с 10 – 15-го дня заболевания.
Специфическая профилактика и лечение не разработаны. Для лечения используют антибиотики (тетрациклины, аминогликозиды, рифампицин).
Мелиоидоз – так же, как и сап, протекает по типу тяжелой септикопиемии в острой или хронической форме с образованием абсцессов в различных органах и тканях. Возбудитель был выделен и описан А. Уитмором и К. Кришнасвами в 1912 г.
Возбудитель мелиоидоза – Burkholderia pseudomallei (по старой классификации – Pseudomonas pseudomallei) – грамотрицательная палочка с закругленными концами, размером 0,3 – 0,6 × 3 – 6 мкм, располагается поодиночке или в виде коротких цепочек. В старых культурах встречаются нитевидные, короткие и толстые палочки, коккобактерии и т. д. Спор не образует, свежевыделенные бактерии часто имеют псевдокапсулу. Микроб подвижен; лофотрих, в молодых культурах – монотрих. Как и возбудитель сапа, часто дает биполярное окрашивание, так как имеются расположенные по полюсам включения полигидроксимасляной кислоты. Содержание Г + Ц в ДНК – 69 мол %. Строгий или факультативный аэроб, растет на среде, в которой единственным источником азота является сульфат аммония, а углерода – глюкоза. Оптимальная температура для роста 37 °C, рН среды нейтральная. На МПА с 3 – 5 % глицерина через сутки вырастают блестящие, гладкие S-колонии; в дальнейшем возможна диссоциация, колонии приобретают желтовато-коричневую окраску, становятся складчатыми. В МПБ с глицерином через сутки появляется равномерное помутнение, в последующем образуется осадок без просветления среды, а на 2 – 3-й день на поверхности появляется нежная пленка, прилегающая к стенке пробирки. Затем пленка утолщается и становится складчатой. Многие штаммы возбудителя мелиоидоза при росте на средах вначале издают неприятный гнилостный запах, который затем сменяется приятным ароматом трюфелей. На кровяном агаре иногда дает гемолиз. Ферментирует с образованием кислоты глюкозу, лактозу и другие углеводы. По мере старения культуры ферментативная активность падает. Разжижает желатин и свернутую сыворотку. Молоко пептонизирует, но не свертывает. Индола не образует. Обладает денитрифицирующим свойством и лецитиназной активностью.
В антигенном отношении возбудитель мелиоидоза довольно однороден. У него обнаружены соматический (О), оболочечный (К), слизистый (М) и жгутиковый (Н) антигены, причем соматический О-антиген родствен О-антигену возбудителя сапа. Возбудитель мелиоидоза образует два термолабильных токсина. Один из них обусловливает геморрагические и некротические поражения, второй – вызывает гибель лабораторных животных (летальный токсин) без повреждения тканей в месте введения.
Эпидемиология. Источником возбудителя инфекции являются грызуны (крысы, мыши), кошки, собаки, козы, овцы, свиньи, коровы, лошади, среди которых могут возникать эпизоотии. В эндемичных районах возбудитель обнаруживают в почве, воде открытых водоемов, загрязненных испражнениями больных животных. Не исключается возможность заражения человека не только контактным, но и алиментарным путем. Больной человек для окружающих не заразен. В России в течение многих десятилетий случаев мелиоидоза среди людей не наблюдается. Заболевание встречается в ряде стран Юго-Восточной Азии, Европы, Африки, Северной и Южной Америки, Австралии.
Возбудитель погибает при температуре 56 °C в течение 30 мин, 1 % раствор фенола или 0,5 % раствор формалина убивают его в течение 10 мин. В воде и почве сохраняется до 1,5 мес., в трупах животных – до 12 дней.
Патогенез и клиника. Заражение человека происходит преимущественно через поврежденную кожу или слизистые оболочки при контакте с водой или почвой, в которых содержится возбудитель мелиоидоза. Инкубационный период от 4 дней до нескольких месяцев. Возбудитель размножается в крови, разносится по всему организму, что приводит к образованию абсцессов в различных органах и тканях.
Течение может быть острым и хроническим. Прогноз всегда серьезный, заболевание может тянуться месяцами и даже годами.
Иммунитет. В крови переболевших мелиоидозом людей обнаруживаются специфические антитела; заболевание протекает на фоне выраженной инфекционной аллергии (ГЧЗ).
Лабораторная диагностика. Используют бактериологический, серологический и биологический методы. Для выделения чистой культуры берут кровь, мокроту, гной из абсцессов, отделяемое из носа и мочу, а также трупный материал. Кровь больных засевают на глицериновый МПБ, любой другой материал – на глицериновый агар. Возбудитель, в отличие от других псевдомонад, устойчив к полимиксину в концентрации 400 мкг/мл.
Наряду с посевом материала на среды заражают морских свинок или хомячков: кровь больных вводят внутрибрюшинно, другой материал – подкожно или путем втирания в скарифицированную кожу. При положительном результате в месте введения развивается отек, некроз, язва, в лимфатических узлах появляются абсцессы. При вскрытии погибшего животного обнаруживаются множественные абсцессы во внутренних органах; из них легко выделить чистую культуру.
Для обнаружения специфических антител в крови больных или переболевших используют РСК, РПГА и реакцию агглютинации. Нарастание титров антител в этих реакциях является важным диагностическим признаком, но и в этом случае не всегда удается дифференцировать мелиоидоз от сапа.
Специфическая профилактика и лечение. Специфическая профилактика не разработана. Общая профилактика сводится к проведению дератизационных мероприятий в местностях, не благополучных по мелиоидозу, предотвращению доступа грызунов к источникам водоснабжения, жилищам и продуктам. Запрещают купание в стоячих водоемах, употребление необеззараженной воды. Больных домашних животных изолируют, проводят лечение (или уничтожают). Для лечения людей используют антибиотики (тетрациклины, левомицетин, канамицин, рифампицин) в сочетании с хирургическим лечением (например, дренирование абсцессов).
Возбудители кишечных инфекций
Общая характеристика семейства Enterobacteriaceae
Острые бактериальные кишечные инфекции – диареи – относятся к числу наиболее распространенных болезней. Их возбудителями являются многие виды бактерий, но наиболее часто – представители семейства Enterobacteriaceae. Оно объединяет бактерии, которым присущи следующие признаки:
1) единство морфологии – короткие, не образующие спор палочки с закругленными концами, подвижные (перитрихи) или неподвижные, не образующие или образующие капсулы; 2) отрицательная окраска по Граму; 3) ферментация глюкозы (и ряда других углеводов) с образованием кислоты и газа или только кислоты; 4) отсутствие, как правило, протеолитических свойств; 5) факультативные анаэробы или аэробы; 6) хорошо растут на обычных питательных средах; 7) место обитания – кишечный тракт и дыхательные пути; 8) фекально-оральный (в некоторых случаях – воздушно-капельный) путь заражения; 9) отсутствие цитохромоксидазы; 10) каталазопозитивны; 11) восстанавливают нитраты в нитриты; 12) хемоорганотрофы; 13) сумма Г + Ц в ДНК – 39 – 59 мол %; 14) обладают пиразинамидазой.
Семейство насчитывает более 30 родов и более 100 видов. Наиболее важными для человека являются роды: Escherichia, Citrobacter, Enterobacter, Hafnia, Klebsiella, Salmonella, Erwinia, Serratia, Edwardsiella, Shigella, Yersinia, Proteus, Morganella, Providencia. Для дифференциации родов используют в основном биохимические признаки. Каждый род представляет собой компактную группу бактерий со сходными биохимическими свойствами. В свою очередь деление на виды внутри родов также производят по биохимическим признакам и с учетом степени гомологии ДНК между представителями данного вида и у бактерий, представляющих разные виды. В общей сложности для дифференциации родов и видов семейства используют более 40 различных признаков, в том числе: ферментация глюкозы, маннита, лактозы, сахарозы, рамнозы, образование H2S, индола, рост на голодной среде с цитратом натрия, гидролиз мочевины, декарбоксилирование орнитина, дегидрирование аргинина, дезаминирование фенилаланина, подвижность, образование ацетоина при ферментации глюкозы (реакция Фогеса – Проскауэра), проба с метиловым красным (MR) и др.
Большое значение для классификации внутри родов и видов имеет изучение антигенного строения. В основу серологической классификации энтеробактерий положено изучение их О-, Н– и К-антигенов.
Основной представитель рода Escherichia – E. coli – был впервые обнаружен в 1885 г. Т. Эшерихом, в честь которого этот род бактерий и получил свое название. Ключевые признаки этого рода: перитрихи (или неподвижные), ферментируют лактозу с образованием кислоты и газа (или лактозонегативны), на голодной среде с цитратом не растут, реакция Фогеса – Проскауэра отрицательна, проба с MR положительна, не имеют фенилаланиндезаминазы, не растут на среде с KCN, содержание Г + Ц в ДНК – 50 – 51 мол %.
Род Escherichia включает не менее 7 видов; особое значение в медицине имеет вид E. coli, в частности те его варианты, которые вызывают заболевания человека. Их подразделяют на 2 основные группы: вызывающие внекишечные заболевания и возбудители острых кишечных заболеваний (ОКЗ). Представители первой подразделяются на три патогруппы: 1) менингеальные (MENEC – meningitis E. coli); 2) септицемические (SEPEC – septicemia E. coli) и 3) уропатогенные (UPEC – uropathogenic E. coli). В свою очередь варианты E. coli, вызывающие ОКЗ, вначале были подразделены на 4 следующие категории: энтеротоксигенные E. coli (ETEC); энтероинвазивные E. coli (EIEC); энтеропатогенные E. coli (EPEC) и энтерогеморрагические E. coli (EHEC). Впоследствии были выделены еще две категории: энтероагрегативные E. coli (EAEC) и диффузноагрегативные E. coli (DAEC).
Кроме того, E. coli используется в международных стандартах как показатель степени фекального загрязнения воды, особенно питьевой, и пищевых продуктов (глава 16, с. 154).
Стандартный штамм E. coli (E. coli K-12) широко используется в лабораториях многих стран мира для изучения генетики бактерий.
Культуральные свойства. E. coli – факультативный анаэроб, хорошо растет на обычных питательных средах – колонии на агаре круглые, выпуклые, полупрозрачные. Рост на бульоне в виде диффузного помутнения. Температурный оптимум для роста 37 °C, растет в диапазоне от 10 до 45 °C, оптимальная рН 7,2 – 7,5. На всех дифференциально-диагностических средах колонии E. coli, разлагающей лактозу, окрашены в цвет индикатора (на среде Эндо – темно-малиновые с металлическим блеском, см. цв. вкл., рис. 99, а).
Биохимические свойства. Кишечная палочка в большинстве случаев способна ферментировать следующие углеводы с образованием кислоты и газа: глюкозу, лактозу, маннит, арабинозу, галактозу, иногда сахарозу и некоторые другие углеводы;
образует индол; как правило, не образует H2S; восстанавливает нитраты в нитриты, не разжижает желатин, не растет на голодной среде с цитратом, дает положительную реакцию с MR и отрицательную – Фогеса – Проскауэра. По этим признакам ее легко можно отличить от возбудителей ряда заболеваний (дизентерии, брюшного тифа, сальмонеллезов и др.). Однако патогенные E. coli ни по культуральным, ни по биохимическим свойствам очень часто не отличаются от непатогенных.
Антигенное строение. E. coli является представителем нормальной микрофлоры кишечного тракта всех млекопитающих, птиц, рептилий и рыб. Поэтому для выяснения вопроса, какие варианты E. coli и почему вызывают эшерихиозы, потребовалось изучить антигенное строение, разработать серологическую классификацию, необходимую для идентификации патогенных серовариантов, и выяснить, какими факторами патогенности они обладают, т. е. почему они способны вызывать различные формы эшерихиозов.
У E. coli обнаружен 171 вариант О-антигенов (О1 – О171), 57 вариантов Н-антигенов (Н1 – Н57) и 90 вариантов поверхностных (капсульных) К-антигенов. Однако в действительности существует 164 группы по О-антигену и 55 серовариантов по Н-антигену, так как некоторые из прежних О: Н-серогрупп были исключены из вида E. coli, но порядковые номера О– и Н-антигенов сохранились неизменными. Антигенная характеристика диареегенных E.coli включает в себя номера О– и Н-антигенов, например, О55:Н6; О157:Н7; О-антиген означает принадлежность к определенной серогруппе, а Н-антиген – ее серовариант. Кроме того, при более углубленном изучении О– и Н-антигенов выявлены так называемые факторные О– и Н-антигены, т. е. их антигенные субварианты, например: H2a, H2b, H2c или O20, O20а, O20ab и т. п. Всего в список диареегенных E. coli включено 43 О-серогруппы и 57 ОН-серовариантов. Список этот (табл. 32) пополняется все новыми серовариантами.
Таблица 32
Классификация диареегенных Escherichia coli

Факторы патогенности E. coli. Способность E. coli вызывать различные заболевания обусловлена наличием у нее следующих факторов патогенности:
1. Факторы адгезии и колонизации. Они необходимы для прикрепления к клеткам ткани и их колонизации. Обнаружено три варианта фактора колонизации: а) CFA/I-CFA/VI (англ. colonization factor) – они имеют фимбриальную структуру; б) EAF (англ. enteropathogenic E. coli adherence factor) – интимин – белок наружной мембраны, кодируется геном eaeA. Обнаружен у EPEC и EHEC, выявляется по способности бактерий прикрепляться к клеткам Hep-2; в) Adhesion Henle-407 – фимбриальные структуры, выявляются по способности бактерий прикрепляться к клеткам Henle-407. Все они кодируются плазмидными генами. Помимо них описаны и другие факторы колонизации, в роли которых могут выступать также бактериальные липополисахариды.
2. Факторы инвазии. С их помощью EIEC и EHEC, например, проникают в эпителиоциты кишечника, размножаются в них и вызывают их разрушение. Роль факторов инвазии выполняют белки наружной мембраны.
3. Экзотоксины. У патогенных E. coli обнаружены экзотоксины, повреждающие мембраны (гемолизин), угнетающие синтез белка (токсин Шига), активизирующие вторичные мессенджеры (англ. messenger – связной) – токсины CNF, ST, CT, CLTD, EAST.
Гемолизины продуцируют разные патогены, в том числе E. coli. Гемолизин – порообразующий токсин. Он вначале связывается с мембраной клетки-мишени, а затем формирует в ней пору, через которую происходит вход и выход небольших молекул и ионов, что ведет к гибели клеток и лизису эритроцитов.
Токсин Шига (STX) был обнаружен вначале у Shigella dysenteriae, а затем сходный токсин (шигаподобный токсин) был обнаружен у EHEC. Токсин (N-гликозидаза) блокирует синтез белка, взаимодействуя с 28S pРНК, в результате чего клетка гибнет (цитотоксин). Различают два типа шигаподобного токсина: STX-1 и STX-2. STX-1 по антигенным свойствам почти идентичен токсину Шига, а STX-2 отличается от токсина Шига по антигенным свойствам и, в отличие от STX-1, не нейтрализуется антисывороткой к нему. Синтез цитотоксинов STX-1 и STX-2 контролируется у E. coli генами умеренных конвертирующих профагов 9331 (STX-1) и 933W (STX-2).
Токсин L (термолабильный токсин) – АДФ-рибозилтрансфераза; связываясь с Gбелком, вызывает диарею.
Токсин ST (термостабильный токсин), взаимодействуя с рецептором гуанилатциклазы, стимулирует ее активность и вызывает диарею.
CNF (цитотоксический некротический фактор) – белок деамидаза, повреждает так называемые RhoG-белки. Этот токсин обнаружен у UPEC, вызывающих инфекции мочевыводящих путей.
CLTD-токсин – цитолетальный разрыхляющий токсин. Механизм действия изучен слабо.
Токсин EAST – термостабильный токсин энтероагрегативных E. coli (EAEC), вероятно, подобен термостабильному токсину (ST).
4. Эндотоксины-липополисахариды. Они определяют антигенную специфичность бактерий (которая детерминируется повторяющейся боковой цепочкой сахаров) и форму колоний (утрата боковых цепочек приводит к превращению S-колоний в R-колонии).
Таким образом, факторы патогенности E. coli контролируются не только хромосомными генами клетки-хозяина, но и генами, привносимыми плазмидами или умеренными конвертирующими фагами. Все это свидетельствует о возможности возникновения патогенных вариантов E. coli в результате распространения среди них плазмид и умеренных фагов. Ниже дана краткая характеристика 4 категорий E. coli, вызывающих ОКЗ; сведений о недавно выделенных категориях DAEC и EAEC в доступных нам источниках не найдено.
ETEC включает 17 серогрупп. Факторы адгезии и колонизации фимбриальной структуры типа CFA и энтеротоксины (LT или ST, или оба) кодируются одной и той же плазмидой (плазмидами). Колонизируют ворсинки без их повреждения. Энтеротоксины вызывают нарушение водно-солевого обмена. Локализация процесса – область тонкой кишки. Заражающая доза 108– 1010 клеток. Заболевание протекает по типу холероподобной диареи. Тип эпидемий – водный, реже пищевой. Болеют дети в возрасте от 1 года до 3 лет и взрослые.
EIEC включает 9 серогрупп, патогенность связана со способностью внедряться в эпителиальные клетки слизистой оболочки кишечника и размножаться внутри них, вызывая их разрушение. Эти свойства кодируются, помимо хромосомных генов, генами плазмиды (140 МД). Плазмида кодирует синтез белков наружной мембраны, которые и определяют инвазию. Как сама плазмида, так и белки, которые она кодирует, родственны таковым у возбудителей дизентерии, чем и объясняется сходство EIEC с шигеллами. Заражающая доза 105 клеток. Локализация процесса – нижний отдел подвздошной и толстая кишка. Заболевание протекает по типу дизентерии: вначале водянистая диарея, затем колитический синдром. Болеют дети 1,5 – 2 лет, подростки и взрослые. Тип вспышек – пищевой, водный.
EPEC. Группа включает 9 серогрупп класса 1 и четыре серогруппы класса 2. У серогрупп класса 1 имеется плазмида (60 МД), которая контролирует синтез фактора адгезии и колонизации типа EAF. Он представлен белком, локализованным в наружной мембране, и выявляется по способности бактерий прикрепляться к клеткам HЕp-2. Белок имеет м. м. 94 кД. У серогрупп класса 2 эта плазмида отсутствует, их патогенность обусловлена какими-то иными факторами. У некоторых штаммов EPEC обоих классов обнаружена способность синтезировать STX. EPEC колонизируют плазмолемму энтероцитов, вызывают повреждение поверхности эпителия с образованием эрозий и умеренного воспаления. Заражающая доза 105– 1011 клеток. Процесс локализуется в области тонкой кишки. Для заболевания характерны водянистая диарея и выраженное обезвоживание. Болеют в основном дети первого года жизни. Способ заражения – контактно-бытовой, реже пищевой.
Серогруппы EIEC и EPEC – наиболее частые виновники внутрибольничных вспышек.
ЕНЕС продуцируют цитотоксины STX-1 и STX-2. Вызывают у людей геморрагический колит с тяжелыми осложнениями в виде гемолитической уремии и тромботической тромбоцитопенической пурпуры. Токсины разрушают клетки эндотелия мелких кровеносных сосудов. Образование сгустков крови и выпадение фибрина приводят к нарушению кровотока, кровотечению, ишемии и некрозу в клеточной стенке. Уремический гемолитический синдром может привести к летальному исходу. ЕНЕС представлены многими серотипами (~150), но главную эпидемиологическую роль играют E. coli O157:H7 и ее безжгутиковый мутант E. coli O157:NM, так как только они образуют STX. Эти штаммы бактерии могут выделять только один из цитотоксинов или оба одновременно. Полагают, что естественным резервуаром сероваров ЕНЕС, в том числе E. coli O157:H7, являются крупный рогатый скот и овцы. Наиболее частый путь заражения – пищевой (мясо, особенно фарш; молоко). E. coli O157:H7 необычайно устойчива к неблагоприятным факторам. Это способствует ее выживанию и размножению в разных продуктах. Возможно заражение контактно-бытовым путем. Начало болезни острое: возникают кишечные спазмы, затем понос, вначале водянистый, потом – с кровью. Болеют дети и взрослые. Больной человек заразен.
Лабораторная диагностика эшерихиозов основана на выделении чистой культуры возбудителя и его идентификации, а также на тестировании токсинов с помощью
ПЦР. Возбудителя эшерихиозов идентифицируют с помощью набора поливалентных OK-сывороток и набора адсорбированных сывороток, содержащих антитела только к определенным антигенам. Для идентификации EIEC можно использовать кератоконъюнктивальную пробу. Некоторые представители EIEC неподвижны, не ферментируют лактозы и салицина. Идентификации E. coli О157:H7 помогает ее неспособность ферментировать сорбит (применяют среду Эндо с сорбитом вместо лактозы). Но лучше всего для идентификации и дифференциации возбудителей ОКЗ (всех категорий) использовать тест-системы ПЦР. При необходимости у выделенных возбудителей определяют чувствительность к антибиотикам.
Лечение. Используют различные антибиотики. Для восстановления нарушенного водно-солевого обмена применяют оральные солевые растворы. Их выпускают в целлофановых пакетах в виде порошков, содержащих NaCl – 3,5 г; NaHCO3 – 2,5 г; KCl – 1,5 г и глюкозы – 20,0 г и растворяемых в 1 литре воды.
Брюшной тиф – тяжелое острое инфекционное заболевание, характеризующееся глубокой общей интоксикацией, бактериемией и специфическим поражением лимфатического аппарата тонкого кишечника. Интоксикация проявляется сильной головной болью, помрачением сознания, бредом (тиф от греч. typhos – туман). Брюшной тиф как самостоятельную нозологическую единицу впервые попытался выделить русский врач А. Г. Пятницкий еще в 1804 г., но окончательно это сделал в 1822 г. Р. Бретонно, который дифференцировал эту болезнь от туберкулеза кишечника и высказал предположение о контагиозной природе брюшного тифа.
Возбудитель брюшного тифа – Salmonella typhi – был обнаружен в 1880 г. К. Эбертом, а выделен в чистой культуре в 1884 г. К. Гаффки. Вскоре были выделены и изучены возбудители паратифов А и В – S. paratyphi A и S. paratyphi B. Род Salmonella включает в себя большую группу бактерий, но только три из них – S. typhi, S. paratyphi A и S. paratyphi B – вызывают заболевание у человека с клинической картиной брюшного тифа. Морфологически они неразличимы – короткие грамотрицательные палочки с закругленными концами, длиной 1 – 3,5 мкм, диаметром 0,5 – 0,8 мкм (см. цв. вкл., рис. 100.2); спор и капсул не образуют, обладают активной подвижностью (перитрихи). Содержание Г + Ц в ДНК составляет 50 – 52 мол %.
Возбудители брюшного тифа и паратифов – факультативные анаэробы, температурный оптимум для роста 37 °C (но могут расти в диапазоне от 10 до 41 °C), рН 6,8 – 7,2; не требовательны к питательным средам. Рост на бульоне сопровождается помутнением, на МПА образуются нежные круглые, гладкие, полупрозрачные колонии диаметром 2 – 4 мм. Однако колонии S. typhi, имеющие Vi-антиген, мутные. Колонии S. paratyphi B более грубые, через несколько дней у них по периферии формируются своеобразные валики. На средах Эндо колонии всех трех сальмонелл бесцветны (см. цв. вкл., рис. 99б), на висмут-сульфит-агаре – черного цвета. В случае диссоциации на плотных средах вырастают колонии R-формы. Избирательной средой для возбудителей брюшного тифа и паратифов является желчь или желчный бульон.
Биохимические свойства. Возбудители брюшного тифа и паратифов дают положительную реакцию с MR, не образуют индола, не разжижают желатин, восстанавливают нитраты в нитриты, не образуют ацетоина. S. typhi не растет на голодном агаре с цитратом. Основные биохимические различия между возбудителями брюшного тифа и паратифов заключаются в том, что S. typhi ферментирует глюкозу и некоторые другие углеводы с образованием только кислоты, а S. paratyphi A и S. paratyphi B – с образованием и кислоты, и газа (табл. 33).
Таблица 33
Биохимические свойства E. coli, S. typhi, S. paratyphi A и S. paratyphi B
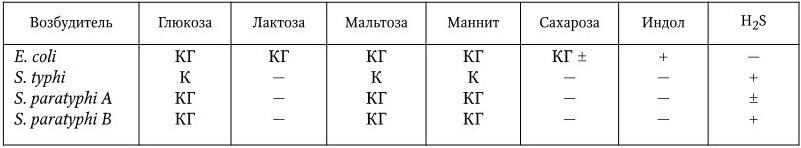
Примечание.К – образование кислоты; КГ – образование кислоты и газа; (+) – признак постоянный; (±) – признак непостоянный; ( – ) – признак отсутствует.
S. typhi по способности ферментировать ксилозу и арабинозу подразделяют на четыре биохимических типа:

Антигенное строение. Сальмонеллы имеют О– и Н-антигены. По О-антигенам они разделяются на большое количество серогрупп, а по Н-антигенам – на серотипы (подробнее о серологической классификации сальмонелл см. в следующем разделе). S. typhi, S. paratyphi A и S. paratyphi B отличаются друг от друга как по О-антигенам (относятся к разным серогруппам), так и по Н-антигенам.
В 1934 г. А. Феликс и Р. Питт установили, что S. typhi помимо О– и Н-антигенов имеет еще один поверхностный антиген, который они назвали антигеном вирулентности (Vi-антигеном). По химической природе Vi-антиген отличается от О– и Н-антигенов, он состоит из трех различных фракций, но его основу составляет сложный полимер N-ацетилгалактозаминоуроновая кислота с м. м. 10 МД. Vi-антиген, как правило, обнаруживается у свежевыделенных культур, но он легко утрачивается под влиянием различных факторов (в частности, при выращивании при температуре выше 40 °C и ниже 20 °C, на средах с карболовой кислотой и т. п.), при длительном хранении культур, разрушается при температуре 100 °C в течение 10 мин. Поскольку он располагается более поверхностно, чем О-антиген, его наличие препятствует агглютинации культуры S. typhi О-специфической сывороткой, поэтому такую культуру обязательно проверяют в реакции агглютинации с Vi-сывороткой. Напротив, утрата Vi-антигена ведет к освобождению О-антигена и восстановлению О-агглютинации, но при этом утрачивается Vi-агглютинация. Количественное содержание Vi-антигена у S. typhi может сильно варьировать, поэтому Ф. Кауффманн предложил классифицировать S. typhi по содержанию Vi-антигена на три группы:
1) чистые v-формы (нем. viel – много);
2) чистые w-формы (нем. wenig – мало);
3) промежуточные vw-формы.
Обнаружены 3 необычных мутанта S. typhi: Vi-I – R-форма, клетки лишены Ни О-антигенов, но стойко сохраняют Vi-антиген; О-901 – лишен Н– и Vi-антигенов; Н-901 – содержит О– и Н-антигены, но лишен Vi-антигена. Все три антигена: О-, Ни Vi– имеют выраженные иммуногенные свойства. Наличие Vi-антигенов позволяет подвергать культуры S. typhi фаготипированию. Есть 2 типа фагов, лизирующих только те культуры, которые содержат Vi-антиген: Vi-I – универсальный фаг, лизирует большинство Vi-содержащих культур S. typhi; и набор Vi-II-фагов, лизирующих избирательно культуры S. typhi. Впервые это было показано в 1938 г. Дж. Крейджем и К. Иеном. С помощью Vi-фагов II типа они разделили S. typhi на 11 фаготипов. К 1987 г. было выявлено уже 106 различных Vi-фаготипов S. typhi. Чувствительность их к соответствующим фагам является стабильным признаком, поэтому фаготипирование имеет важное эпидемиологическое значение.
Разработаны также схемы фаготипирования S. paratyphi A и S. paratyphi B, по которым они разделяются на десятки фаготипов. Существенно, что фаготипы сальмонелл могут ни по каким другим признакам не отличаться друг от друга.
Резистентность. Возбудители брюшного тифа и паратифов во внешней среде (вода, почва, пыль) сохраняются, в зависимости от условий, от нескольких дней до нескольких месяцев. В проточной воде могут выживать до 10 дней, в застойной – до 4 нед., на овощах и фруктах – 5 – 10 дней, на посуде – до 2 нед., в масле, сыре – до 3 мес., во льду – до 3 мес. и больше; нагревание при температуре 60 °C убивает через 30 мин, а кипячение – мгновенно. Обычные химические дезинфектанты убивают их через несколько минут. Содержание в водопроводной воде активного хлора в дозе 0,5 – 1,0 мг/л или озонирование воды обеспечивают ее надежное обеззараживание как от сальмонелл, так и от других патогенных кишечных бактерий.
Факторы патогенности. Важнейшей биологической особенностью возбудителей брюшного тифа и паратифов А и В является их способность противостоять фагоцитозу и размножаться в клетках лимфоидной системы. Экзотоксинов они не образуют. Основным фактором патогенности их, помимо Vi-антигена, является эндотоксин, отличающийся необычно высокой токсичностью. Такие факторы патогенности, как фибринолизин, плазмокоагулаза, гиалуронидаза, лецитиназа и т. п., обнаруживаются у возбудителей брюшного тифа и паратифов очень редко. С наибольшей частотой встречается ДНК-аза (у 75 – 85 % изученных культур S. typhi и S. paratyphi B). Установлено, что штаммы S. typhi, имеющие плазмиду с м. м. 6 МД, обладают более высокой вирулентностью. Поэтому вопрос о факторах патогенности этих сальмонелл остается еще мало изученным.
Эпидемиология. Источником брюшного тифа и паратифа А является только человек, больной или бактерионоситель. Источником паратифа В, кроме человека, могут быть и животные, в том числе птицы. Механизм заражения – фекальнооральный. Заражающая доза S. typhi 105 клеток (вызывает заболевание 50 % добровольцев), заражающие дозы сальмонелл паратифов А и В значительно выше. Заражение происходит главным образом в результате прямого или непрямого контакта, а также через воду или пищу, особенно молоко. Наиболее крупные эпидемии вызывало инфицирование возбудителями водопроводной воды (водные эпидемии).
Особенности патогенеза и клиники. Инкубационный период при брюшном тифе 15 дней, но он может варьировать от 7 до 25 дней. Это зависит от заражающей дозы, вирулентности возбудителя и иммунного статуса больного. Патогенез и клиническая картина брюшного тифа и паратифов А и В очень сходны. В развитии болезни четко выявляются следующие стадии:
1) стадия вторжения. Возбудитель через рот проникает в тонкий кишечник;
2) через лимфатические пути сальмонеллы проникают в лимфоидные образования подслизистой оболочки тонкого кишечника (пейеровы бляшки и солитарные фолликулы) и, размножаясь в них, вызывают лимфангоит и лимфаденит (своеобразные брюшно-тифозные гранулы);
3) бактериемия – выход возбудителя в большом количестве в кровь. Стадия бактериемии начинается в конце инкубационного периода и может (в отсутствие эффективного лечения) продолжаться в течение всей болезни;
4) стадия интоксикации наступает вследствие распада бактерий под действием бактерицидных свойств крови и высвобождения эндотоксинов;
5) стадия паренхиматозной диффузии. Из крови сальмонеллы поглощаются макрофагами костного мозга, селезенки, лимфатических узлов, печени и других органов. В большом количестве возбудитель брюшного тифа накапливается в желчных ходах печени и в желчном пузыре, где он находит благоприятные условия для своего размножения и где бактерицидные свойства крови ослаблены влиянием желчи;
6) выделительно-аллергическая стадия. По мере формирования иммунитета начинается процесс освобождения от возбудителя. Этот процесс осуществляют все железы: слюнные, кишечника, потовые, молочные (во время кормления ребенка), мочевыделительная система и особенно активно – печень и желчный пузырь. Выделяющиеся из желчного пузыря сальмонеллы опять поступают в тонкий кишечник, откуда часть их выделяется с испражнениями, а часть вторгается вновь в лимфатические узлы. Вторичное внедрение в уже сенсибилизированные узлы вызывает в них гиперергическую реакцию, которая проявляется в виде некроза и образования язв (см. цв. вкл., рис. 100.1). Эта стадия опасна возможностью прободения стенки кишечника (язв), внутреннего кровотечения и развития перитонита;
7) стадия выздоровления. Процесс заживления язв происходит без возникновения обезображивающих рубцов на местах, очистившихся от некротических налетов. В свою очередь, в клинической картине болезни различают следующие периоды:
I – начальная стадия – stadium incrementi (1-я неделя): постепенное повышение температуры до 40 – 42 °C, нарастание интоксикации и других проявлений болезни.
II – стадия максимального развития всех симптомов – stadium acme (2 – 3-я недели болезни): температура держится на высоком уровне;
III – стадия спада болезни – stadium decrementi (4-я неделя болезни): постепенное снижение температуры и ослабление проявления других симптомов;
IV – стадия выздоровления.
На 8 – 9-й день болезни, а иногда и позднее, у многих больных появляется розеолезная сыпь на коже живота, груди и спины. Появление сыпи (мелких красных пятен) является следствием местных продуктивно-воспалительных процессов аллергической природы в поверхностных слоях кожи около лимфатических сосудов, которые в изобилии содержат возбудителя болезни. Клиническое выздоровление не всегда совпадает с бактериологическим. Примерно 5 % переболевших становятся хроническими носителями сальмонелл тифа или паратифов. Причины, лежащие в основе длительного (более 3 мес., а иногда многие годы) носительства сальмонелл, остаются неясными. Известное значение в формировании носительства играют местные воспалительные процессы в желчевыводящих (иногда в мочевыводящих) путях, которые часто возникают в связи с тифо-паратифозными инфекциями или обостряются в результате этих инфекций. Однако не менее важную роль в формировании длительного носительства сальмонелл брюшного тифа и паратифов А и В играет L-трансформация их. L-формы сальмонелл утрачивают Н-, частично Ои Vi-антигены, располагаются, как правило, внутриклеточно (внутри макрофагов костного мозга), поэтому становятся не доступными ни для химиопрепаратов, ни для антител и могут длительно персистировать в организме переболевшего человека. Возвращаясь в исходные формы и полностью восстанавливая свою антигенную структуру, сальмонеллы вновь становятся вирулентными, вновь проникают в желчные ходы, вызывают обострение процесса бактерионосительства, выделяются с испражнениями, а такой носитель становится источником заражения для окружающих. Не исключено также, что формирование бактерионосительства зависит от какого-то дефицита иммунной системы.
Постинфекционный иммунитет прочный, продолжительный, повторные заболевания брюшным тифом и паратифами бывают редко. Иммунитет обусловлен появлением антител к Vi-, O– и H-антигенам, клеток иммунной памяти и повышением активности фагоцитов. Поствакцинальный иммунитет, в отличие от постинфекционного, непродолжителен (около 12 мес.).
Лабораторная диагностика. Самым ранним и основным методом диагностики брюшного тифа и паратифов является бактериологический – получение гемокультуры или миелокультуры. С этой целью исследуют кровь или пунктат костного мозга. Кровь лучше засевать на среду Рапопорт (желчный бульон с добавлением глюкозы, индикатора и стеклянного поплавка) в соотношении 1: 10 (на 10 мл среды 1 мл крови). Посев следует инкубировать при температуре 37 °C не менее 8 дней, а с учетом возможного наличия L-форм – до 3 – 4 нед. Для идентификации выделенной культуры сальмонелл используют (с учетом их биохимических свойств) диагностические адсорбированные сыворотки, содержащие антитела к антигенам О2 (S. paratyphi A), О4 (S. paratyphi B) и О9 (S. typhi). Если выделенная культура S. typhi не агглютинируется О9-сывороткой, ее необходимо проверить с Vi-сывороткой.
Для выделения S. typhi можно использовать экссудат, полученный путем скарификации розеол – вырастают розеолокультуры.
Бактериологическое исследование испражнений, мочи и желчи проводят для подтверждения диагностики, контроля бактериологического выздоровления при выписке реконвалесцентов и для диагностики бактерионосительства. В этом случае материал предварительно засевают на среды обогащения (среды, содержащие химические вещества, например селенит, которые угнетают рост E. coli и других представителей микрофлоры кишечника, но не угнетают роста сальмонелл), а затем со среды обогащения – на дифференциально-диагностические среды (Эндо, висмут-сульфит-агар) с целью выделения изолированных колоний и получения из них чистых культур, идентифицируемых по указанной выше схеме. Для обнаружения О– и Viантигенов в сыворотке крови и испражнениях больных могут быть использованы РСК, РПГА с антительным диагностикумом, реакции коагглютинации, агрегат-гемагглютинации, ИФМ. Для ускоренной идентификации S. typhi перспективно применение в качестве зонда фрагмента ДНК, несущего ген Vi-антигена (время идентификации 3 – 4 ч).
С конца 1-й недели болезни в сыворотке больных появляются антитела, поэтому для диагностики брюшного тифа в 1896 г. Ф. Видалем была предложена реакция развернутой пробирочной агглютинации. Динамика содержания антител к S. typhi своеобразна: раньше всего появляются антитела к О-антигену, но титр их быстро снижается после выздоровления; Н-антитела появляются позднее, но зато сохраняются после болезни и прививок годами. С учетом этого обстоятельства реакцию Видаля ставят одновременно с раздельными О– и Н-диагностикумами (а также с паратифозными А– и В-диагностикумами) для исключения возможных ошибок, связанных с прививками или ранее перенесенным заболеванием. Однако специфичность реакции Видаля недостаточно высока, поэтому более предпочтительным оказалось применение РПГА, в которой эритроцитарный диагностикум сенсибилизирован либо О– (для обнаружения О-антител), либо Vi-антигеном (для обнаружения Vi-антител). Наиболее надежной и специфической является последняя реакция (Vi-гемагглютинации).
Диагностика бактерионосительства. Единственным доказательством бактерионосительства является выделение от носителя культур S. typhi, S. paratyphi A, S. paratyphi B. Материалом для исследования являются дуоденальное содержимое, испражнения и моча. Сложность проблемы заключается в том, что у носителей возбудитель не всегда выделяется с этими субстратами, бывают паузы, и довольно продолжительные. В качестве вспомогательных методов, которые позволяют сузить круг обследуемых лиц, используют серологические реакции (одновременное обнаружение О-, Н-, Vi– или О-, Vi-антител говорит о возможном присутствии возбудителя в организме) и аллергическую кожную пробу с Vi-тифином. Последний содержит Vi-антиген, который при взаимодействии с Vi-антителами дает местную аллергическую реакцию в виде покраснения и припухлости в течение 20 – 30 мин. Положительная реакция с Vi-тифином свидетельствует о наличии в организме Vi-антител и о возможном присутствии S. typhi. Для идентификации L-форм S. typhi предложены специальные иммунофлуоресцирующие антитела (к антигенам L-форм возбудителя). Оригинальный метод выявления бактерионосителей был предложен В. Муром. Он заключается в исследовании тампонов, одновременно забрасываемых в канализационные люки на всем протяжении канализационной сети населенного пункта.
Лечение. Для лечения больных брюшным тифом применяют различные антибиотики, к которым возбудители проявляют высокую чувствительность (левомицетин, ампициллин, тетрациклины и др.). Антибиотики снижают тяжесть течения болезни и сокращают ее продолжительность. Однако перенос R-плазмид сальмонеллам от E. coli или других энтеробактерий может привести к появлению среди них опасных эпидемических клонов.
Специфическая профилактика. Вместо семи различных брюшно-тифозных вакцин, применявшихся ранее, с 1978 г. в нашей стране выпускается только одна – химическая сорбированная брюшно-тифозная моновакцина. Однако в связи с тем, что брюшной тиф из эпидемического заболевания перешел в разряд спорадических (а это стало возможным, прежде всего, благодаря улучшению систем водоснабжения и канализации и повышению санитарной культуры населения), необходимость массовой иммунизации против него отпала. Поэтому прививки проводят только в случае эпидемических показаний.
Микробиология пищевых токсикоинфекций
Пища нередко является причиной отравлений, природа которых может быть самой различной.
Наиболее простая классификация пищевых отравлений такова: различают пищевые отравления немикробного и микробного происхождения (табл. 34).
Пищевые отравления немикробного происхождения могут быть связаны с употреблением продуктов, ядовитых по своей природе, растительного (грибы, ягоды и т. п.) или животного (например, рыбы фугу, маринка и др.) происхождения, а также при попадании в организм с пищей ядовитых неорганических или органических веществ, ядохимикатов, радионуклидов. Острые отравления этого типа протекают без повышения температуры с разнообразной клинической картиной, инкубационный период отсутствует, заболевание начинается через 1 – 1,5 ч. Однако отравления неорганическими и органическими ядами и радионуклидами могут иметь и хронический характер.
Пищевые отравления микробного происхождения подразделяют на 2 группы: пищевые интоксикации и пищевые токсикоинфекции.
Пищевые интоксикации – отравления, обусловленные исключительно токсинами микроорганизмов. Они могут возникать и в тех случаях, когда живые возбудители в пищевом продукте, подвергнутом термической обработке, отсутствуют.
Пищевые токсикоинфекции возникают только в связи с употреблением в пищу продуктов, обильно зараженных бактериями. Пищевые токсикоинфекции имеют обычно характер групповых заболеваний и отличаются коротким инкубационным периодом, острым непродолжительным течением и отсутствием, как правило, контагиозных случаев заболеваний, так как заражающие дозы их возбудителей велики.
Таблица 34
Классификация пищевых отравлений
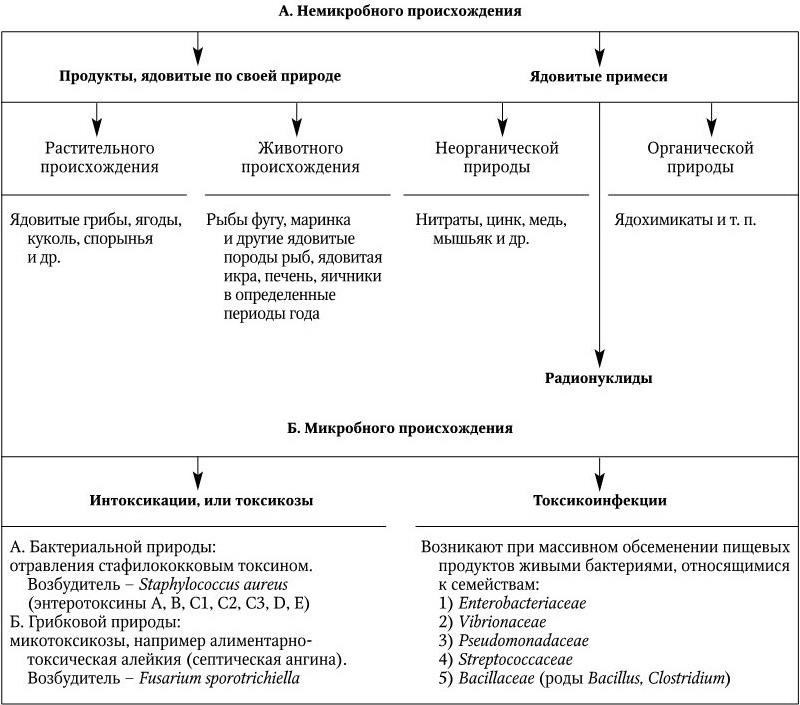
Токсикоинфекции являются следствием массивного обсеменения пищевого продукта живыми возбудителями. Через пищу возможно заражение различными возбудителями (брюшного тифа, дизентерии, холеры, бруцеллеза и др.), для которых алиментарный способ заражения не является единственным. Передача возбудителей в этих случаях происходит также контактно-бытовым и другими путями.
Для пищевых токсикоинфекций существует только один путь передачи – через пищу.
Кроме того, пищевые токсикоинфекции отличаются от других инфекций, при которых заражение происходит также через пищу, течением по типу острого токсикоза: на первый план выступают симптомы интоксикации; у разных лиц во время одной и той же вспышки наблюдаются различные клинические проявления, патологоанатомические изменения выражены слабо и не соответствуют тяжести заболевания. Для пищевых инфекций (брюшной тиф, дизентерия и др.) характерными являются относительно продолжительный инкубационный период, отличительные для каждой болезни клинические проявления и типичные патологоанатомические изменения, т. е. на первый план выступают инвазивные (инфекционные) свойства возбудителей, которые также могут сопровождаться сильным токсикозом.
Пищевые токсикоинфекции известны с давних пор. Долгое время их называли «мясными отравлениями», так как связывали с употреблением в пищу мяса. Однако выяснилось, что такие заболевания могут вызывать и другие продукты – рыба, молоко, яйца, птицепродукты, консервы, а природа их – бактериальная.
Своеобразный характер этих заболеваний и дал основание назвать их пищевыми токсикоинфекциями.
Впервые бактериальная природа пищевых токсикоинфекций была установлена в 1888 г. А. Гертнером, который выделил во время большой вспышки мясного отравления из селезенки умершего человека и из мяса вынужденно убитой коровы одну и ту же бактерию – Bacterium enteritidis. В 1893 г. К. Кенте и Ф. Флюгге выделили другого возбудителя пищевой токсикоинфекции – B. typhi murium. Как было установлено позднее, такими же свойствами обладает и B. cholerae suis, которую выделил в 1886 г. Д. Сальмон; в честь него в 1934 г. этому роду бактерий было дано название Salmonella. Пищевые токсикоинфекции могут вызывать представители по крайней мере пяти семейств бактерий: Enterobacteriaceae (роды – Escherichia, Salmonella, Shigella, Proteus, Serratia, Hafnia, Enterobacter, Citrobacter и др.), Vibrionaceae (V. parahaemolyticus), Pseudomonadaceae, Streptococcaceae (протеолитические варианты стрептококков серогруппы D), Bacillaceae – роды Bacillus (B. cereus), Clostridium (C. perfringens, серотипы A, D, F; C. botulinum, серотипы A, B, C, E, F).
Особенности биологии ряда этих возбудителей изложены в соответствующих разделах. Способность вызывать пищевые интоксикации связывают с наличием эндотоксинов (у грамотрицательных бактерий), различных ферментов (в том числе протеолитических у стрептококков) и экзотоксинов у некоторых грамотрицательных и грамположительных бактерий родов Bacillus и Clostridium. В частности, патогенные штаммы B. cereus синтезируют два типа экзотоксинов. Один из них – комплекс из трех белков – вызывает диарею, летальный эффект и нарушает проницаемость сосудов, а другой – цереолизин – обладает летальным и цитолитическим действием и нарушает проницаемость сосудов.
Все пищевые токсикоинфекции возникают, когда в пищевом продукте происходит размножение бактерий в большом количестве. Отравление наступает в результате накопления в пищевом продукте большого количества живых бактерий, образуемых ими токсинов, а также токсаминов, которые возникают за счет катаболизма размножающихся возбудителей. Проникнув в большом количестве в кишечник, бактерии затем попадают в кровь, разрушаются, а освобождающийся в большом количестве эндотоксин (а в ряде случаев и внутриклеточный энтеротоксин) вызывает острый токсикоз, который может усугубляться действием токсаминов.
Клиника пищевых токсикоинфекций, обусловленных токсигенными грамположительными бактериями, определяется биологическими свойствами их токсинов и токсаминов.
Основным методом диагностики пищевых токсикоинфекций является бактериологический. Он применяется с учетом биологии возможного возбудителя (грамотрицательные и грамположительные палочки, стрептококки, бациллы, клостридии). Материалом для исследований служат испражнения, рвотные массы, промывные воды желудка, кровь, продукты, послужившие причиной отравления. Обращают внимание на обнаружение большого количества бактерий в продукте (105– 106 клеток/мл), таких же бактерий в выделениях из кишечника и желудка, в том числе от нескольких человек при групповом отравлении. Подтверждением диагноза является обнаружение в сыворотке крови переболевших людей (через 1 – 2 нед.) антител к возбудителю.
Методы диагностики стафилококковых интоксикаций и ботулизма изложены в соответствующих разделах.
Сальмонеллы являются не только основными возбудителями пищевых токсикоинфекций, но и часто причиной своеобразных диарей – сальмонеллезов.
Ключевые признаки рода Salmonella следующие: короткие грамотрицательные палочки с закругленными концами, длиной 1,5 – 4,0 мкм, в большинстве случаев подвижные (перитрихи), спор и капсул не имеют, образуют при ферментации глюкозы (и ряда других углеводов) кислоту и газ (за исключением S. typhi и некоторых других серотипов), имеют лизин– и орнитиндекарбоксилазы, не имеют фенилаланиндезаминазы, образуют H2S (некоторые не образуют), дают положительную реакцию с MR, растут на голодном агаре с цитратом (кроме S. typhi), не ферментируют лактозу (кроме S. arizonae и S. diarizonae), не образуют индола, не имеют уреазы и дают отрицательную реакцию Фогеса – Проскауэра. Содержание Г + Ц в ДНК составлят 50 – 52 мол %. Культуральные свойства такие же, как у возбудителей тифа и паратифов А и В.
Классификация. Род Salmonella включает единственный вид S. enteritica (ранее – S. choleraesuis) с семью основными подвидами: S. choleraesuis, S. salamae, S. arizonae, S. diarizonae, S. houtenae, S. bongori, S. indica, которые различаются по ряду биохимических признаков (табл. 35).
Серологическая классификация сальмонелл по Уайту и Кауффманну.
У сальмонелл имеются О-, Н– и К-антигены. Обнаружено 65 различных О-антигенов. Они обозначаются арабскими цифрами от 1 до 67. По О-антигену сальмонеллы разделены на 50 серологических групп (A – Z, 51 – 65). Некоторые О-антигены встречаются у сальмонелл двух групп (О6, О8); антигены О1 и О12 – у представителей многих серогрупп, но представители каждой серогруппы имеют один главный, общий для всех О-антиген, по которому они и разделяются на серогруппы (в табл. 35 эти антигены выделены жирным шрифтом). Специфичность О-антигенов определяется полисахаридом ЛПС. У всех сальмонелл полисахариды обладают общим внутренним ядром, к которому прикрепляются О-специфические боковые цепи, состоящие из повторяющегося набора олигосахаров. Различия в связях и композициях этих сахаров обеспечивают химическую основу серологической специфичности. Например, специфичность О2-антигена определяется сахаром паратозой, О4 – абеквозой, О9 – тивелозой и т. д.
Таблица 35
Дифференциация подвидов S. enteritica

Примечание. (+) – признак положительный; ( – ) – признак отсутствует; (×) – ферментация поздняя и нерегулярная; (?) – неизвестно.
У сальмонелл различают два типа Н-антигенов: I фаза и II фаза. Обнаружено более 80 вариантов Н-антигенов I фазы. Они обозначаются строчными латинскими буквами (a – z) и арабскими цифрами (z1– z59). Н-антигены I фазы встречаются только у определенных серотипов, иначе говоря, по Н-антигенам серогруппы разделяют на серотипы. Нантигены II фазы имеют в своем составе общие компоненты, они обозначаются арабскими цифрами и встречаются у разных серовариантов. Обнаружено 9 Н-антигенов II фазы.
К-антигены сальмонелл представлены разными вариантами: Vi– (S. typhi, S. paratyphi C, S. dublin), M-, 5-антигены. О значении Vi-антигена сказано выше.
Современная серологическая классификация сальмонелл насчитывает уже свыше 2200 серовариантов. В табл. 36 перечислены сальмонеллы, которые чаще всего вызывают заболевания людей и животных.
Для серологической идентификации сальмонелл выпускают диагностические адсорбированные моно– и поливалентные О– и Н-сыворотки, содержащие агглютинины к О– и Н-антигенам тех серотипов сальмонелл, которые чаще всего вызывают заболевания людей и животных.
Бо́льшая часть сальмонелл (около 98 %) чувствительна к сальмонеллезному фагу О1. Кроме того, разработана схема фаготипирования наиболее частого возбудителя сальмонеллезов – S. typhimurium, она позволяет дифференцировать более 120 его фаготипов.
Резистентность. Устойчивость сальмонелл по отношению к некоторым физическим и химическим факторам довольно высока. Нагревание при температуре 70 °C выдерживают в течение 30 мин. Устойчивость к высокой температуре повышается, когда сальмонеллы находятся в пищевых продуктах, особенно в мясе. При варке в течение 2,5 ч мясо, зараженное сальмонеллами и заложенное в холодную воду, становится стерильным в кусках весом не более 400,0 г при толщине кусков 6 см; а при закладке в кипяток стерильность за тот же срок варки достигается лишь в кусках весом до 200,0 г, при толщине их 5,0 – 5,5 см. Соление и копчение мяса оказывают относительно слабое действие на сальмонеллы. При содержании NaCl 12 – 20 % в соленом и копченом мясе сальмонеллы выживают при комнатной температуре до 1,5 – 2 мес. Обычные химические дезинфектанты убивают сальмонеллы за 10 – 15 мин.
Факторы патогенности. У сальмонелл имеются факторы адгезии и колонизации, факторы инвазии; они имеют эндотоксин и, наконец, они, по крайней мере S. typhimurium и некоторые другие серотипы, могут синтезировать два типа экзотоксинов:
а) термолабильные и термостабильные энтеротоксины типа LT и ST;
б) шигаподобные цитотоксины.
Особенностью токсинов является внутриклеточная локализация и выделение после разрушения бактериальных клеток. LT сальмонелл имеет структурное и функциональное сходство с LT энтеротоксигенных E. coli и с холерогеном. Его м. м. 110 кД, он устойчив в диапазоне рН 2,0 – 10,0. Токсинообразование у сальмонелл сочетается с наличием у них двух факторов кожной проницаемости:
а) быстродействующего – продуцируется многими штаммами сальмонелл, термостабилен (при 100 °C сохраняется в течение 4 ч), действует в течение 1 – 2 ч;
б) замедленного – термолабилен (разрушается при 75 °C в течение 30 мин), вызывает эффект (уплотнение кожи кролика) через 18 – 24 ч после введения.
Молекулярные механизмы диареи, вызываемой LT и ST сальмонелл, по-видимому, также связаны с нарушением функции аденилат– и гуанилатциклазных систем энтероцитов. Цитотоксин, продуцируемый сальмонеллами, термолабилен, его цитотоксическое действие проявляется в угнетении синтеза белка энтероцитами. Обнаружено, что отдельные штаммы сальмонелл могут одновременно синтезировать LT, ST и цитотоксин, другие – только цитотоксин.
Вирулентность сальмонелл зависит также от обнаруженной у них плазмиды с м. м. 60 МД, утрата ее значительно снижает вирулентность бактерий. Предполагается, что появление эпидемических клонов сальмонелл связано с приобретением ими плазмид вирулентности и R-плазмид.
Особенности эпидемиологии. Из числа известных сальмонелл лишь S. typhi и S. paratyphi A вызывают заболевание только у человека – брюшной тиф и паратиф А. Все остальные сальмонеллы патогенны также для животных. Первичным источником сальмонелл являются животные: крупный рогатый скот, свиньи, водоплавающие птицы, куры, синантропные грызуны и большое число других животных. Заболевания животных, вызываемые сальмонеллами, подразделяются на 3 основные группы: первичные сальмонеллезы, вторичные сальмонеллезы и энтерит крупного рогатого скота. Первичные сальмонеллезы (паратиф телят, тиф поросят, тиф кур, дизентерия цыплят и т. д.) вызываются определенными возбудителями и протекают с характерной клиникой. Вторичные сальмонеллезы возникают при условиях, когда организм животного в результате каких-то причин (нередко различных болезней) резко ослаблен; они не связаны с конкретными типами сальмонелл у определенных животных, вызываются различными их серотипами, но чаще всего – S. typhimurium.
Таблица 36
Сокращенная схема серологической классификации сальмонелл
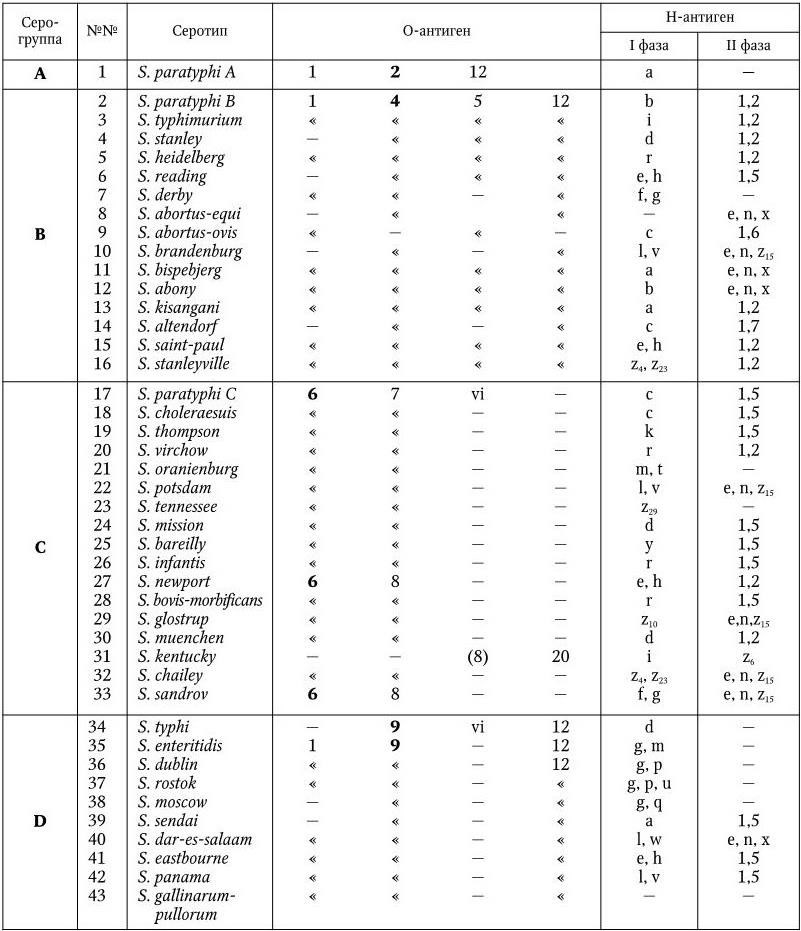
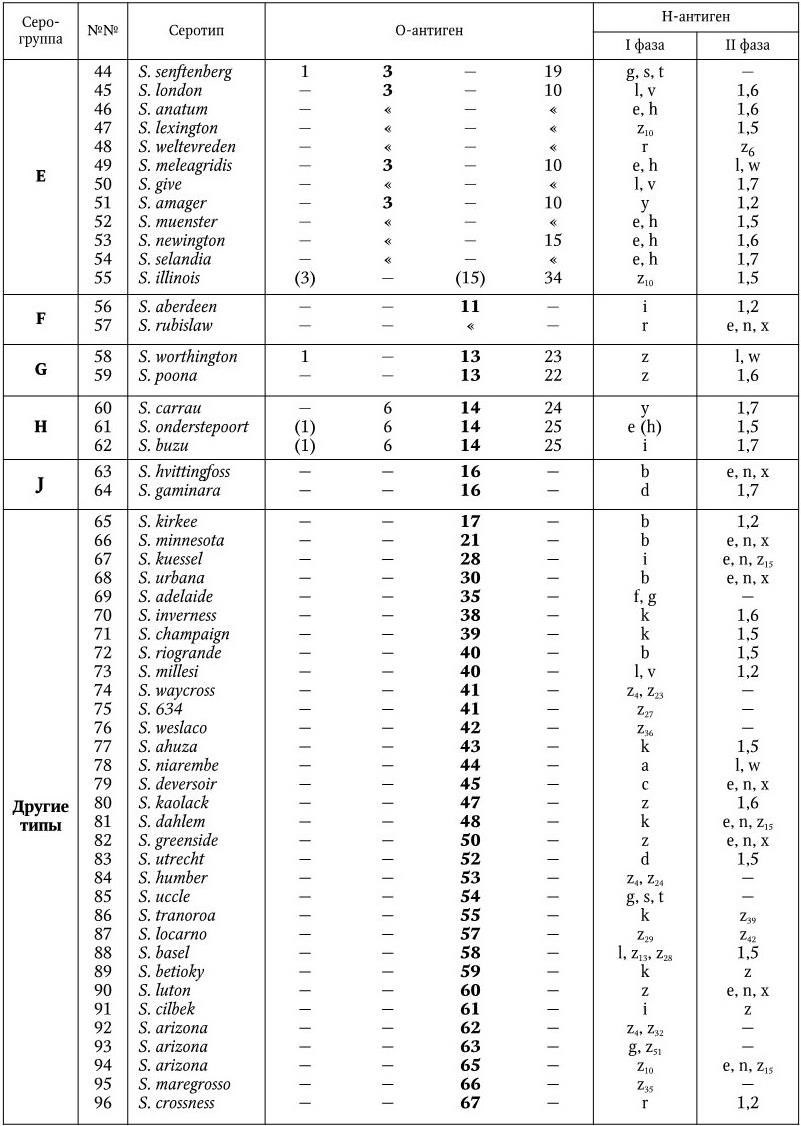
Энтерит крупного рогатого скота характеризуется определенной клинической картиной и в этом отношении сходен с первичным сальмонеллезом. Однако энтерит в данном случае является вторичным проявлением, первичную же роль играют различные предрасполагающие обстоятельства. Возбудителями его чаще всего бывают S. enteritidis и S. typhimurium.
Наиболее опасными источниками пищевых токсикоинфекций являются животные, страдающие вторичным сальмонеллезом и энтеритом крупного рогатого скота. Большую роль в эпидемиологии сальмонеллезов играют водоплавающие птицы и их яйца, а также куры, их яйца и другие птицепродукты. Сальмонеллы могут попасть в яйцо непосредственно во время его развития, но могут легко проникнуть и через неповрежденную скорлупу. Вспышки токсикоинфекций чаще всего связаны с употреблением мяса, инфицированного сальмонеллами, – до 70 – 75 %, в том числе до 30 % мяса скота вынужденного забоя. Вынужденному забою часто подвергают животных, находящихся в агональном состоянии. У ослабленных животных сальмонеллы легко проникают из кишечника в кровь, а через нее – в мышцы, обусловливая прижизненное инфицирование мяса. На долю яиц и птицепродуктов приходится более 10 %, на долю молока и молочных продуктов – около 10 %, и на долю рыбопродуктов – около 3 – 5 % всех вспышек сальмонеллезов.
Современная эпидемиология сальмонеллезов характеризуется постоянным ростом заболеваемости людей и животных и увеличением числа серотипов сальмонелл, вызывающих эти заболевания. С 1984 по 1988 г. в Англии число случаев сальмонеллезов возросло в 6 раз. Однако специалисты ВОЗ полагают, что истинное число случаев сальмонеллезов остается неизвестным. По их мнению, выявляется не более 5 – 10 % инфицированных лиц. Одной из основных причин роста заболеваемости сальмонеллезом является инфицирование пищевых продуктов при их производстве в результате широкого распространения сальмонелл на объектах внешней среды и на обрабатывающих предприятиях, куда поступают животные, у которых сальмонеллез протекает в скрытой форме. Одной из главных причин широкой циркуляции сальмонелл среди животных является применение корма, содержащего переработанные побочные продукты животного происхождения и очень часто зараженного сальмонеллами.
Несмотря на постоянное увеличение числа серотипов сальмонелл, выделяемых от людей и животных, по-прежнему до 98 % всех случаев сальмонеллезов обусловлено сальмонеллами групп A, B, C, D и E, в первую очередь S. typhimurium и S. enteritidis (до 70 – 80 % случаев заболеваний).
Другой немаловажной особенностью современной эпидемиологии сальмонеллезов является установление роли человека как источника заражения сальмонеллами. Заражение человека от больного или бактерионосителя возможно не только через пищу, в которой сальмонеллы находят хорошие условия для размножения, но и контактно-бытовым путем. Этот способ заражения приводит к широкому распространению бессимптомного бактерионосительства.
Крупная водная эпидемия сальмонеллезной инфекции в 1965 г. в Риверсайде (США), обусловленная S. typhimurium (заболело около 16 тыс. человек), показала, что заражение сальмонеллами возможно не только через пищу, но и через воду.
К особенностям эпидемиологии сальмонеллезов за последние годы следует отнести также повышение этиологической роли S. enteritidis, активизацию пищевого пути передачи возбудителей инфекции с преобладанием роли птицы и птицепродуктов, увеличение числа групповых заболеваний, в том числе внутрибольничных, рост заболеваемости среди детей до 14 лет (более 60 % всех случаев заболеваний).
Особенности патогенеза и клиники. Сальмонеллезы могут протекать с различной клинической картиной: в виде пищевой токсикоинфекции, сальмонеллезной диареи и генерализованной (тифозной) формы, – все зависит от величины заражающей дозы, степени вирулентности возбудителей и иммунного статуса организма. Массивное обсеменение сальмонеллами пищевого продукта обусловливает пищевую токсикоинфекцию, при которой основные симптомы связаны с поступлением возбудителя в кровь в большом количестве, его распадом и высвобождением эндотоксина. В основе сальмонеллезной диареи лежит колонизация сальмонеллами энтероцитов. После прикрепления к гликокаликсу тонкого кишечника сальмонеллы внедряются между ворсинками и, прикрепляясь к плазмолемме энтероцитов, колонизируют ее, повреждают микроворсинки, вызывают слущивание энтероцитов и умеренное воспаление слизистой оболочки. Освобождающийся энтеротоксин вызывает диарею, а цитотоксин – гибель клеток. Сальмонеллы размножаются на плазмолемме, но не в энтероцитах, а происходит их инвазия через эпителий в подлежащие ткани слизистой оболочки, они транспортируются через нее в макрофагах, поступают в лимфу и кровь, вызывая бактериемию и генерализацию инфекционного процесса.
Постинфекционный иммунитет изучен недостаточно. Судя по тому, что сальмонеллезом болеют главным образом дети, постинфекционный иммунитет достаточно напряженный, но является, по-видимому, типоспецифическим.
Лабораторная диагностика. Основной метод диагностики сальмонеллезной инфекции – бактериологический. Материалом для исследования служат испражнения, рвотные массы, кровь, промывные воды желудка, моча, послужившие причиной отравления продукты. Особенности бактериологической диагностики сальмонеллезов:
1) использование сред обогащения (селенитовой, магниевой), в особенности при исследовании испражнений;
2) для обнаружения сальмонелл пробы следует брать из последней, более жидкой, части испражнений (верхнего отдела тонкого кишечника);
3) соблюдать соотношение 1: 5 (одна часть испражнений на 5 частей среды);
4) в связи с тем, что S. arizonae и S. diarizonae ферментируют лактозу, использовать в качестве дифференциально-диагностической не только среду Эндо, но и висмут-сульфит-агар, на котором колонии сальмонелл приобретают черный (некоторые – зеленоватый) цвет;
5) для посева крови использовать среду Рапопорт;
6) использование для предварительной идентификации колоний О1-сальмонеллезного фага, к которому чувствительны до 98 % сальмонелл;
7) для окончательной идентификации выделенных культур вначале используют поливалентные адсорбированные О– и Н-сыворотки, а затем – соответствующие моновалентные О– и Н-сыворотки.
Для быстрого обнаружения сальмонелл могут быть использованы поливалентные иммунофлуоресцентные сыворотки. Для выявления антител в сыворотке крови больных и переболевших используется РПГА с применением поливалентных эритроцитарных диагностикумов, содержащих полисахаридные антигены серогрупп A, B, C, D и E.
Лечение. В случае пищевой токсикоинфекции – промывание желудка, применение антибактериальных препаратов, общеукрепляющих средств. При сальмонеллезных диареях – восстановление нормального водно-солевого обмена, антибиотикотерапия.
Специфическая профилактика не применяется, хотя предложены различные вакцины из убитых и живых (мутантных) штаммов S. typhimurium.
Важную роль в этиологии пищевых отравлений играет Bacillus cereus. B. cereus – грамположительные, не образующие капсулы палочки размером 1,0 – 1,2 × 3 – 5 мкм, подвижные (перитрихи) или неподвижные. Клетки имеют тенденцию располагаться в виде цепочек, от стабильности которых во многом зависит форма колонии, – она сильно варьирует у различных штаммов. Образуют эллипсоидной формы споры, которые располагаются центрально, но не расширяют клетки. Бактерии, выросшие на агаре с глюкозой, на ранней стадии роста содержат липидные включения в виде капель (поли-β-гидроксимасляная кислота), а также часто зерна волютина.
B. cereus хемоорганотрофы, аэробы или факультативные анаэробы, способны расти в столбике анаэробного агара. Содержание Г + Ц в ДНК составляет 32 – 37 мол %. Они обычно каталазопозитивны, восстанавливают нитраты в нитриты; ферментируют глюкозу, мальтозу, часто сахарозу с образованием только кислоты, без газа; не ферментируют маннит; образуют ацетоин (положительная проба Фогеса – Проскауэра), лецитиназу, растут на цитратной среде, а также в присутствии 0,001 % лизоцима. Температурный оптимум для их роста 35 – 45 °C, температурный диапазон роста 10 – 45 °C. Синтезируют и секретируют гемолизин, экзотоксины; ферменты, лизирующие бактериальные клетки, протеолитические ферменты, фосфолипазу С, некоторые штаммы на среде с крахмалом и железом образуют красный пигмент, некоторые – на различных средах флуоресцирующие желтовато-зеленого цвета пигменты. Для роста различные штаммы нуждаются в одной или нескольких аминокислотах. На желточно-солевом агаре с полимиксином B. cereus образует восковидные колонии с изрезанными краями, окруженные радужным венчиком (положительная проба на лецитиназу).
B. cereus очень похожа по своим признакам на B. thuringiensis и отличается от нее отсутствием в клетках кристаллов токсических белков. По O-антигенам в группе B. cereus – B. thuringiensis выделено 13 серотипов, эти два вида бактерий различаются также по своим H-антигенам.
B. cereus – условно-патогенная бактерия, способная вызывать различные заболевания у человека и животных. Помимо пищевых отравлений у людей, она может быть причиной пневмонии, сепсиса, менингита, миокардита, заболеваний почек и мочевыводящих путей, остеомиелита и др. Во многом это зависит от факторов патогенности, которыми обладают различные варианты B. cereus. Места обитания ее – почва, вода, растительные субстраты. Большую роль B. cereus в этиологии пищевых отравлений обусловлена тем, что различные штаммы ее способны продуцировать не менее 5 различных типов энтеротоксинов: термолабильный энтеротоксин (ТЛЭ), обладающий гемолитической активностью; ТЛЭ, не обладающий гемолитической активностью; цитотоксин-К; Т-энтеротоксин и термостабильный энтеротоксин (ТСЭ). Пищевые отравления, вызываемые теми штаммами B. cereus, которые продуцируют 3 типа ТЛЭ и цитотоксин-К, клинически протекают в виде токсикоинфекции, главным проявлением которой выступает диарея (диарейный тип). Они обычно связаны с употреблением мясных продуктов, рыбы, овощей, супов и молочных продуктов и по симптомам напоминают пищевые отравления, вызванные Clostridium perfringens. Пищевые отравления, причиной которых становится ТСЭ, протекают в виде интоксикации, для них характерен рвотный синдром (рвотный тип отравлений). Они напоминают отравления, вызванные энтеротоксинами стафилококка, и связаны в основном с употреблением блюд из риса, макарон и других мучных продуктов.
При бактериологической диагностике таких пищевых отравлений очень важно учитывать количественное содержание B. cereus в исследуемом материале (выделения больных, пищевые продукты и т. п.) – чем больше в нем бактерий, тем вероятнее их роль в отравлении. Для более точного диагноза предложены специальные методы обнаружения ТЛЭ и ТСЭ B. cereus, применение ПЦР и моноклональных антител, а также генотипирование.
Дизентерия – инфекционное заболевание, характеризующееся общей интоксикацией организма, поносом и своеобразным поражением слизистой оболочки толстого кишечника. Она является одним из наиболее частых острых кишечных заболеваний в мире. Заболевание известно с давних времен под названием «кровавого поноса», однако природа его оказалась различной. В 1875 г. русский ученый Ф. А. Леш выделил от больного кровавым поносом амебу Entamoeba histolytica, в последующие 15 лет была установлена самостоятельность этой болезни, за которой сохранилось название амебиаза.
Возбудителями собственно дизентерии является большая группа биологически сходных бактерий, объединенных в род Shigella. Впервые возбудитель был обнаружен в 1888 г. А. Шантемесом и Ф. Видалем; в 1891 г. он был описан А. В. Григорьевым, а в 1898 г. К. Шига с помощью полученной им от больного сыворотки идентифицировал возбудителя у 34 больных дизентерией, окончательно доказав этиологическую роль этой бактерии. Однако в последующие годы были обнаружены и другие возбудители дизентерии: в 1900 г. – С. Флекснером, в 1915 г. – К. Зонне, в 1917 г. – К. Штуцером и К. Шмитцем, в 1932 г. – Дж. Бойдом, в 1934 г. – Д. Ларджем, в 1943 г. – А. Саксом. В настоящее время род Shigella включает более 40 серотипов. Все они представляют собой короткие неподвижные грамотрицательные палочки, не образующие спор и капсул, которые хорошо растут на обычных питательных средах, не растут на голодной среде с цитратом или малонатом в качестве единственного источника углерода; не образуют H2S, не имеют уреазы; реакция Фогеса – Проскауэра отрицательна; глюкозу и некоторые другие углеводы ферментируют с образованием кислоты без газа (кроме некоторых биотипов Shigella flexneri: S. manchestеr и S. newcastle); как правило, не ферментируют лактозу (за исключением шигелл Зонне), адонит, салицин и инозит, не разжижают желатин, обычно образуют каталазу, не имеют лизиндекарбоксилазы и фенилаланиндезаминазы. Содержание Г + Ц в ДНК составляет 49 – 53 мол %. Шигеллы – факультативные анаэробы, температурный оптимум для роста 37 °C, при температуре выше 45 °C не растут, оптимальная рН среды 6,7 – 7,2. Колонии на плотных средах – круглые, выпуклые, полупрозрачные, в случае диссоциации образуются шероховатые колонии R-формы. Рост на МПБ в виде равномерного помутнения, шероховатые формы образуют осадок. Свежевыделенные культуры шигелл Зонне обычно образуют колонии двух типов: мелкие круглые выпуклые (I фаза), крупные плоские (II фаза). Характер колонии зависит от наличия (I фаза) или отсутствия (II фаза) плазмиды с м. м. 120 МД, которая определяет также вирулентность шигелл Зонне.
Международная классификация шигелл построена с учетом их биохимических признаков (маннит-неферментирующие, маннит-ферментирующие, медленно ферментирующие лактозу шигеллы) и особенностей антигенной структуры (табл. 37).
У шигелл обнаружены различные по специфичности О-антигены: общие для семейства Enterobacteriaceae, родовые, видовые, групповые и типоспецифические, а также К-антигены; Н-антигенов у них нет.
Таблица 37
Классификация бактерий рода Shigella
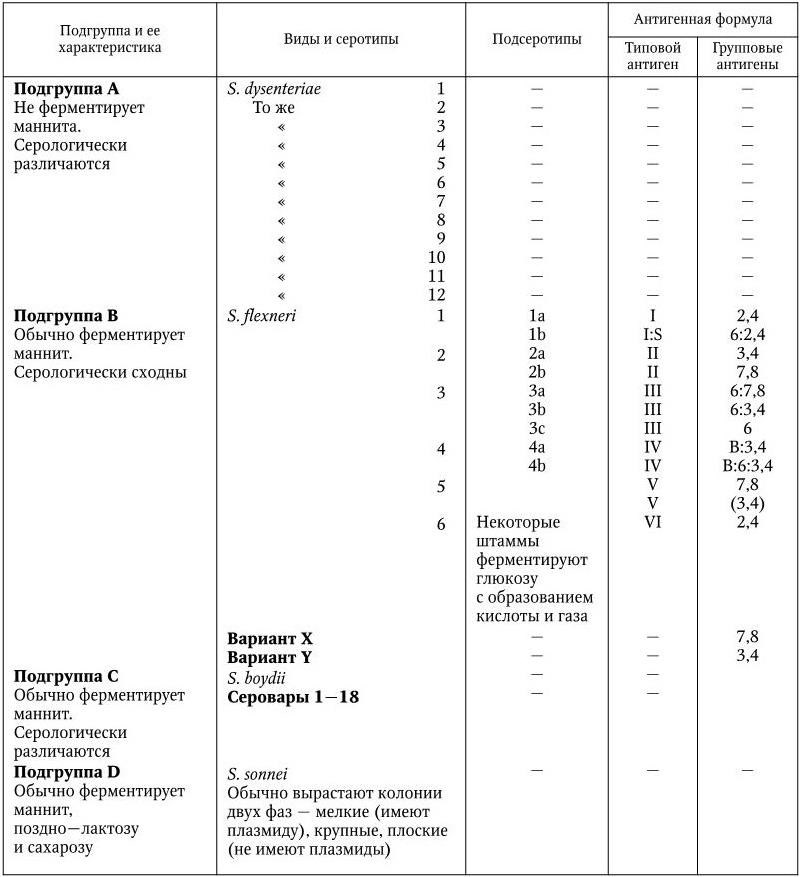
В классификации учитываются только групповые и типоспецифические О-антигены. В соответствии с этими признаками род Shigella подразделяется на 4 подгруппы, или 4 вида, и включает 44 серотипа. В подгруппу А (вид Shigella dysenteriae) включены шигеллы, не ферментирующие маннита. Вид включает в себя 12 серотипов (1 – 12). Каждый серотип имеет свой особый типовой антиген; антигенные связи между серотипами, а также с другими видами шигелл выражены слабо. К подгруппе В (вид Shigella flexneri) относятся шигеллы, обычно ферментирующие маннит. Шигеллы этого вида серологически родственны друг другу: они содержат типоспецифические антигены (I – VI), по которым подразделяются на серотипы (1 – 6), и групповые антигены, которые обнаруживаются в разных составах у каждого серотипа и по которым серотипы подразделяются на подсеротипы. Кроме того, этот вид включает два антигенных варианта – X и Y, у которых нет типовых антигенов, они различаются по наборам групповых антигенов. Серотип S. flexneri 6 не имеет подсеротипов, но его разделяют на 3 биохимических типа по особенностям ферментации глюкозы, маннита и дульцита (табл. 38).
Таблица 38
Биотипы S. flexneri 6
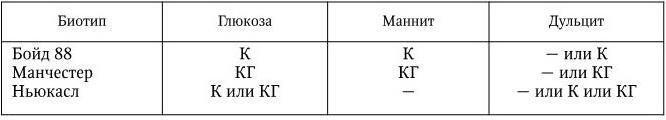
Примечание. К – ферментация с образованием только кислоты; КГ – ферментация с образованием кислоты и газа; ( – ) – ферментация отсутствует.
Липополисахаридный антиген О у всех шигелл Флекснера содержит групповой антиген 3, 4 как главную первичную структуру, его синтез контролируется хромосомным геном, локализованным около his-локуса. Типоспецифические антигены I, II, IV, V и групповые антигены 6, 7, 8 являются результатом модификации антигенов 3, 4 (гликозилирования или ацетилирования) и определяются генами соответствующих конвертирующих профагов, место интеграции которых располагается в районе lac – pro хромосомы шигелл.
Появившийся на территории страны в 80-х гг. ХХ в. и получивший широкое распространение новый подсеротип S. flexneri 4 (IV:7, 8) отличается от подсеротипа 4a (IV:3, 4) и 4b (IV:3, 4, 6), возник из варианта S. flexneri Y (IV:3, 4) вследствие лизогенизации его конвертирующими профагами IV и 7, 8.
К подгруппе С (вид Shigella boydii) относятся шигеллы, обычно ферментирующие маннит. Члены группы серологически отличаются друг от друга. Антигенные связи внутри вида выражены слабо. Вид включает 18 серотипов (1 – 18), каждый из которых имеет свой главный типовой антиген.
В подгруппу D (вид Shigella sonnei) включены шигеллы, обычно ферментирующие маннит и способные медленно (через 24 ч инкубации и позже) ферментировать лактозу и сахарозу. Вид S. sonnei включает один серотип, однако колонии I и II фаз обладают своими типоспецифическими антигенами. Для внутривидовой классификации шигелл Зонне предложено два метода:
1) деление их на 14 биохимических типов и подтипов по способности ферментировать мальтозу, рамнозу и ксилозу; 2) деление на фаготипы по чувствительности к набору соответствующих фагов.
Эти способы типирования имеют главным образом эпидемиологическое значение. Кроме того, шигеллы Зонне и шигеллы Флекснера с этой же целью подвергают типированию по способности синтезировать специфические колицины (колициногенотипирование) и по чувствительности к известным колицинам (колицинотипирование). Для определения типа продуцируемых шигеллами колицинов Дж. Абботом и Р. Шеноном предложены наборы типовых и индикаторных штаммов шигелл, а для определения чувствительности шигелл к известным типам колицинов используют набор эталонных колициногенных штаммов П. Фредерика.
Резистентность. Шигеллы обладают достаточно высокой устойчивостью к факторам внешней среды. Они выживают на хлопчатобумажной ткани и на бумаге до 30 – 36 дней, в высохших испражнениях – до 4 – 5 мес., в почве – до 3 – 4 мес., в воде – от 0,5 до 3 мес., на фруктах и овощах – до 2 нед., в молоке и молочных продуктах – до нескольких недель; при температуре 60 °C погибают через 15 – 20 мин. Чувствительны к растворам хлорамина, активному хлору и другим дезинфектантам.
Факторы патогенности. Важнейшее биологическое свойство шигелл, обусловливающее их патогенность, – способность внедряться в эпителиальные клетки, размножаться в них и вызывать их гибель. Этот эффект может быть обнаружен с помощью кератоконъюнктивальной пробы (введение под нижнее веко морской свинки одной петли культуры шигелл (2 – 3 млрд бактерий) вызывает развитие серозногнойного кератоконъюнктивита), а также путем заражения культур клеток (цитотоксическое действие) или куриных эмбрионов (их гибель), или интраназально белых мышей (развитие пневмонии). Основные факторы патогенности шигелл можно разбить на три группы:
1) факторы, определяющие взаимодействие с эпителием слизистой оболочки;
2) факторы, обеспечивающие устойчивость к гуморальным и клеточным механизмам защиты макроорганизма и способность шигелл размножаться в его клетках;
3) способность продуцировать токсины и токсические продукты, которые обусловливают развитие собственно патологического процесса.
Первая группа включает в себя факторы адгезии и колонизации: их роль выполняют пили, белки наружной мембраны и ЛПС. Адгезии и колонизации способствуют ферменты, разрушающие слизь, – нейраминидаза, гиалуронидаза, муциназа. Вторая группа включает факторы инвазии, которые способствуют проникновению шигелл в энтероциты и их размножению в них и в макрофагах с одновременным проявлением цитотоксического и (или) энтеротоксического эффекта. Эти свойства контролируются генами плазмиды с м. м. 140 МД (она кодирует синтез белков наружной мембраны, обусловливающих инвазию) и хромосомными генами шигелл: kcp A (обусловливает кератоконъюнктивит), cyt (отвечает за разрушение клеток), а также другими генами, еще не идентифицированными. Защита шигелл от фагоцитоза обеспечивается поверхностным К-антигеном, антигенами 3, 4 и липополисахаридом. Кроме того, липид А эндотоксина шигелл обладает иммуносупрессивным действием: подавляет активность клеток иммунной памяти.
К третьей группе факторов патогенности относятся эндотоксин и обнаруженные у шигелл два типа экзотоксинов – экзотоксины Шига и шигаподобные (SLT-I и SLT-II), цитотоксические свойства которых наиболее сильно выражены у S. dysenteriae 1. Шига– и шигаподобные токсины обнаружены и у других серотипов S. dysenteriae, их образуют также S. flexneri, S. sonnei, S. boydii, EНEC и некоторые сальмонеллы. Синтез этих токсинов контролируется tox-генами конвертирующих фагов. Энтеротоксины типа LT обнаружены у шигелл Флекснера, Зонне и Бойда. Синтез LT у них контролируется плазмидными генами. Энтеротоксин стимулирует активность аденилатциклазы и отвечает за развитие диареи. Токсин Шига, или нейротоксин, не реагирует с аденилатциклазной системой, а оказывает прямое цитотоксическое действие. Токсины Шига и шигаподобные (SLT-I и SLT-II) имеют м. м. 70 кД и состоят из субъединиц А и В (последние из 5 одинаковых малых субъединиц). Рецептором для токсинов служит гликолипид мембраны клетки.
Вирулентность шигелл Зонне зависит также от плазмиды с м. м. 120 МД. Она контролирует синтез около 40 полипептидов наружной мембраны, семь из них связаны с вирулентностью. Шигеллы Зонне, имеющие эту плазмиду, образуют колонии I фазы и обладают вирулентностью. Культуры, утратившие плазмиду, образуют колонии II фазы и лишены вирулентности. Плазмиды с м. м. 120 – 140 МД обнаружены у шигелл Флекснера и Бойда. Липополисахарид шигелл является сильным эндотоксином.
Особенности эпидемиологии. Источником инфекции является только человек. Никакие животные в природе дизентерией не болеют. В экспериментальных условиях дизентерию удается воспроизвести только у обезьян. Способ заражения – фекально-оральный. Пути передачи – водный (преобладающий для шигелл Флекснера), пищевой, особенно важная роль принадлежит молоку и молочным продуктам (преобладающий путь заражения для шигелл Зонне), и контактно-бытовой, особенно для вида S. dysenteriae.
Особенностью эпидемиологии дизентерии является смена видового состава возбудителей, а также биотипов Зонне и серотипов Флекснера в определенных регионах. Например, до конца 30-х гг. XX в. на долю S. dysenteriae 1 приходилось до 30 – 40 % всех случаев заболеваний дизентерией, а затем этот серотип стал встречаться все реже и реже и почти исчез. Однако в 1960 – 1980-е гг. S. dysenteriae вновь появилась на исторической арене и вызвала серию эпидемий, которые привели к формированию трех гиперэндемических очагов ее – в Центральной Америке, Центральной Африке и Южной Азии (Индия, Пакистан, Бангладеш и другие страны). Причины смены видового состава возбудителей дизентерии, вероятно, связаны с изменением коллективного иммунитета и с изменением свойств дизентерийных бактерий. В частности, возвращение S. dysenteriae 1 и широкое распространение ее, послужившее причиной формирования гиперэндемических очагов дизентерии, связывают с приобретением ею плазмид, обусловивших множественную лекарственную устойчивость и повышенную вирулентность.
Особенности патогенеза и клиники. Инкубационный период при дизентерии 2 – 5 дней, иногда меньше суток. Формирование инфекционного очага в слизистой оболочке нисходящего отдела толстого кишечника (сигмовидная и прямая кишка), куда проникает возбудитель дизентерии, носит циклический характер: адгезия, колонизация, внедрение шигелл в цитоплазму энтероцитов, их внутриклеточное размножение, разрушение и отторжение эпителиальных клеток, выход возбудителей в просвет кишечника; вслед за этим начинается очередной цикл – адгезия, колонизация и т. д. Интенсивность циклов зависит от концентрации возбудителей в пристеночном слое слизистой оболочки. В результате повторяющихся циклов воспалительный очаг разрастается, образующиеся язвы, соединяясь, увеличивают обнаженность кишечной стенки, вследствие чего в испражнениях появляются кровь, слизисто-гнойные комочки, полиморфноядерные лейкоциты. Цитотоксины (SLT-I и SLT-II) обусловливают разрушение клеток, энтеротоксин – диарею, эндотоксины – общую интоксикацию. Клиника дизентерии во многом определяется тем, какой тип экзотоксинов в большей степени продуцируется возбудителем, степенью его аллергизирующего воздействия и иммунным статусом организма. Однако многие вопросы патогенеза дизентерии остаются еще не выясненными, в частности: особенности течения дизентерии у детей первых двух лет жизни, причины перехода острой дизентерии в хроническую, значение сенсибилизации, механизм местного иммунитета слизистой кишечника и др. Наиболее типичными клиническими проявлениями дизентерии служат понос, частые позывы: в тяжелых случаях до 50 и более раз в сутки, тенезмы (болезненные спазмы прямой кишки) и общая интоксикация. Характер стула определяется степенью поражения толстого кишечника. Наиболее тяжело протекает дизентерия, вызванная S. dysenteriae 1, наиболее легко – дизентерия Зонне.
Постинфекционный иммунитет. Как показали наблюдения над обезьянами, после перенесенной дизентерии остается прочный и достаточно длительный иммунитет. Он обусловлен антимикробными антителами, антитоксинами, повышением активности макрофагов и Т-лимфоцитами. Значительную роль играет местный иммунитет слизистой оболочки кишечника, опосредуемый IgAs. Однако иммунитет носит типоспецифический характер, прочного перекрестного иммунитета не возникает.
Лабораторная диагностика. Основной метод – бактериологический. Материалом для исследования служат испражнения. Схема выделения возбудителя: посев на дифференциально-диагностические среды Эндо и Плоскирева (параллельно на среду обогащения с последующим посевом на среды Эндо, Плоскирева) для выделения изолированных колоний, получение чистой культуры, изучение ее биохимических свойств и, с учетом последних, идентификация при помощи поливалентных и моновалентных диагностических агглютинирующих сывороток. Выпускают следующие коммерческие сыворотки.
1. К шигеллам, не ферментирующим маннит:
к S. dysenteriae 1 и 2 (поливалентные и моновалентные),
к S. dysenteriae 3 – 7 (поливалентные и моновалентные),
к S. dysenteriae 8 – 12 (поливалентные и моновалентные).
2. К шигеллам, ферментирующим маннит:
к типовым антигенам S. flexneri I, II, III, IV, V, VI,
к групповым антигенам S. flexneri 3, 4, 6, 7, 8 – поливалентная,
к антигенам S. boydii 1 – 18 (поливалентная и моновалентные), к антигенам S. sonnei I фазы, II фазы,
к антигенам S. flexneri I – VI + S. sonnei – поливалентная.
Для быстрой идентификации шигелл рекомендуется следующий метод: подозрительную колонию (лактозонегативная на среде Эндо) пересевают на среду TSI (англ. triple sugar iron) – трехсахарный агар (глюкоза, лактоза, сахароза) с железом для определения продукции H2S; или на среду, содержащую глюкозу, лактозу, сахарозу, железо и мочевину. Любой организм, который расщепляет мочевину через 4 – 6 ч инкубирования, вероятнее всего, относится к роду Proteus и может быть исключен. Микроорганизм, образующий H2S или имеющий уреазу, или образующий кислоту на косячке (ферментирует лактозу или сахарозу), может быть исключен, хотя штаммы, образующие H2S, должны быть исследованы как возможные члены рода Salmonella. Во всех других случаях культура, выросшая на этих средах, должна быть исследована и, если ферментирует глюкозу (изменение цвета столбика), выделена в чистом виде. Одновременно она может быть исследована в реакции агглютинации на стекле с соответствующими антисыворотками к роду Shigella. При необходимости проводят другие биохимические тесты, проверяющие принадлежность к роду Shigella, а также изучают подвижность.
Для обнаружения антигенов в крови (в том числе в составе ЦИК), моче и испражнениях могут быть использованы следующие методы: РПГА, РСК, реакция коагглютинации (в моче и испражнениях), ИФМ, РАГА (в сыворотке крови). Эти методы высокоэффективны, специфичны и пригодны для ранней диагностики.
Для серологической диагностики могут быть использованы: РПГА с соответствующими эритроцитарными диагностикумами, иммунофлуоресцентный метод (в непрямой модификации), метод Кумбса (определение титра неполных антител). Диагностическое значение имеет также аллергическая проба с дизентерином (раствор белковых фракций шигелл Флекснера и Зонне). Реакцию учитывают через 24 ч. Она считается положительной при наличии гиперемии и инфильтрата диаметром 10 – 20 мм.
Лечение. Основное внимание уделяется восстановлению нормального водно-солевого обмена, рациональному питанию, дезинтоксикации, рациональной антибиотикотерапии (с учетом чувствительности возбудителя к антибиотикам). Хороший эффект дает раннее применение поливалентного дизентерийного бактериофага, особенно таблетированного с пектиновым покрытием, которое предохраняет фаг от действия HCl желудочного сока; в тонком кишечнике пектин растворяется, фаги освобождаются и проявляют свое действие. С профилактической целью фаг следует давать не реже одного раза в три дня (срок его выживания в кишечнике).
Проблема специфической профилактики. Для создания искусственного иммунитета против дизентерии были использованы различные вакцины: из убитых бактерий, химические, спиртовая, но все они оказались малоэффективными и сняты с производства. Созданы вакцины против дизентерии Флекснера из живых (мутантных, стрептомицинзависимых) шигелл Флекснера; рибосомальные вакцины, но они также не нашли широкого применения. Поэтому проблема специфической профилактики дизентерии остается нерешенной. Основной путь борьбы с дизентерией заключается в улучшении системы водоснабжения и канализации, обеспечении строгих санитарно-гигиенических режимов на предприятиях пищевой, в особенности молочной промышленности, в детских учреждениях, местах общественного пользования и в соблюдении личной гигиены.
По определению ВОЗ, холера – это болезнь, для которой типичен острый тяжелый обезвоживающий понос с испражнениями в виде рисового отвара, являющийся следствием заражения Vibrio cholerae. В связи с тем, что для нее характерны резко выраженная способность к широкому эпидемическому распространению, тяжелое течение и высокая летальность, холера относится к числу особо опасных инфекций.
Исторической родиной холеры является Индия, точнее, дельта рек Ганг и Брахмапутра (ныне Восточная Индия и Бангладеш), где она существует с незапамятных времен (эпидемии холеры в этом районе наблюдали еще за 500 лет до н. э.). Длительное существование здесь эндемического очага холеры объясняется многими причинами. Холерный вибрион может не только долго сохраняться в воде, но и размножаться в ней при благоприятных условиях – температуре выше 12 °C, наличии органических веществ. Все эти условия в Индии налицо: тропический климат (среднегодовая температура от 25 до 29 °C), обилие осадков и заболоченность, высокая плотность населения, особенно в дельте реки Ганг, большое количество органических веществ в воде, непрерывное круглогодичное загрязнение воды сточными водами и испражнениями, низкий материальный уровень жизни и своеобразные религиозно-культовые обряды населения.
В истории холерных эпидемий можно выделить четыре периода.
I период – до 1817 г., когда холера была сосредоточена только в Восточной и Южной Азии, главным образом в Индии, и не выходила за ее пределы.
II период – с 1817 по 1926 г. С установлением широких экономических и иных связей Индии с европейскими и другими странами холера вышла за пределы Индии и, распространяясь по путям экономических и религиозных связей, вызвала 6 пандемий, которые унесли миллионы человеческих жизней. Россия была первой из европейских стран, куда проникла холера. За период с 1823 по 1926 г. Россия пережила 57 холерных лет. За это время переболело холерой более 5,6 млн человек и умерло от нее 2,14 млн человек (≈ 40 %).
III период – с 1926 по 1961 г. Холера вернулась в свой основной эндемический очаг, и наступил период относительного благополучия. Казалось, что с развитием современных систем очистки питьевой воды, выведения и обеззараживания сточных вод и разработки специальных противохолерных мер, включая создание карантинной службы, страны мира будут надежно защищены от очередного нашествия холеры.
IV период начался в 1961 г. и продолжается до сих пор. Седьмая пандемия началась не в Индии, а в Индонезии, быстро охватила Филиппины, Китай, страны Индокитая, а затем другие страны Азии, Африки и Европы. Особенности этой пандемии заключаются в том, что она, во-первых, вызвана особым вариантом холерного вибриона – V. cholerae eltor, который до 1961 г. официально даже не признавали возбудителем холеры; во-вторых, по продолжительности она превзошла все предшествующие пандемии; в-третьих, она протекала в виде двух волн, первая из которых продолжалась до 1990 г., а вторая началась в 1991 г. и охватила многие страны Южной и Северной Америки, включая США, которые не знали холерных эпидемий с 1866 г.
С 1961 по 1996 г. холерой в 146 странах переболело 3 943 239 человек.
Возбудитель холеры Vibrio cholerae был открыт в 1883 г. во время пятой пандемии Р. Кохом, однако впервые вибрион в испражнениях больных диареей был обнаружен еще в 1854 г. Ф. Пацини.
V. cholerae относится к семейству Vibrionaceae, которое включает в себя несколько родов (Vibrio, Aeromonas, Plesiomonas, Photobacterium). Род Vibrio с 1985 г. насчитывает более 25 видов, из которых наибольшее значение для человека имеют V. cholerae, V. parahaemolyticus, V. alginolyticus, V. vulnificus и V. fluvialis.
Ключевые признаки рода Vibrio. Короткие, не образующие спор и капсул, изогнутые или прямые грамотрицательные палочки, диаметром 0,5 мкм, длиной 1,5 – 3,0 мкм (см. цв. вкл., рис. 101.1), подвижные (V. cholerae – монотрих, у некоторых видов два и большее число полярно расположенных жгутиков); хорошо и быстро растут на обычных средах, хемоорганотрофы, ферментируют углеводы с образованием кислоты без газа (глюкозу ферментируют по пути Эмбдена – Мейергофа). Оксидазоположительны, образуют индол, восстанавливают нитраты в нитриты (V. cholerae дает положительную нитрозо-индоловую реакцию), расщепляют желатин, часто дают положительную реакцию Фогеса – Проскауэра (т. е. образуют ацетилметилкарбинол), уреазы не имеют, не образуют H2S, имеют декарбоксилазы лизина и орнитина, но не имеют аргининдигидролазы. Характерным признаком рода Vibrio является чувствительность большинства штаммов к препарату О/129 (2,4-диамино-6,7-диазопропилптеридин), в то время как представители семейств Pseudomonadaceae и Enterobacteriaceae к этому препарату устойчивы. Вибрионы – аэробы и факультативные анаэробы, температурный оптимум для роста 18 – 37 °C, рН 8,6 – 9,0 (растут в диапазоне рН 6,0 – 9,6), некоторые виды (галофилы) не растут в отсутствие NaCl. Содержание Г + Ц в ДНК составляет 40 – 50 мол % (для V. cholerae около 47 мол %). Для дифференциации внутри семейства Vibrionaceae от морфологически сходных родов Aeromonas и Plesiomonas, а также для отличия от семейства Enterobacteriaceae используются биохимические тесты (табл. 39).
Таблица 39
Дифференциация Vibrio cholerae от родственных грамотрицательных палочек
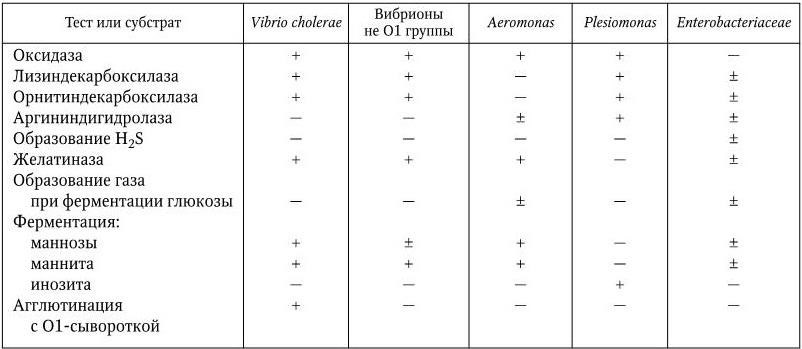
От семейства Pseudomonadaceae холерный вибрион отличается тем, что ферментирует глюкозу только по пути Эмбдена – Мейергофа (без участия О2), в то время как первые потребляют глюкозу только в присутствии О2. Это различие между ними легко выявляется на среде Хью – Лейфсона. Среда содержит питательный агар, глюкозу и индикатор. Посев делают в два столбика со средой Хью – Лейфсона, один из них заливают вазелином (для создания анаэробных условий). В случае роста холерного вибриона цвет среды изменяется в обеих пробирках, в случае роста псевдомонад – только в пробирке без вазелина (аэробные условия роста).
Холерный вибрион очень неприхотлив к питательным средам. Он хорошо и быстро размножается на 1 %-ной щелочной (рН 8,6 – 9,0) пептонной воде (ПВ), содержащей 0,5 – 1,0 % NaCl, обгоняя рост других бактерий. Для подавления роста протея к 1 %-ной ПВ рекомендуется добавлять теллурит калия (в конечном разведении 1: 100 000). 1 %-ная ПВ является наилучшей средой обогащения для холерного вибриона. При росте он образует через 6 – 8 ч на поверхности ПВ нежную рыхлую сероватого цвета пленку, которая при встряхивании легко разрушается и падает на дно в виде хлопьев, ПВ умеренно мутнеет. Для выделения холерного вибриона предложены различные избирательные среды: щелочной агар, желчно-солевой агар, щелочной альбуминат, щелочной агар с кровью, лактозо-сахарозные и другие среды. Наилучшей является среда TCBS (тиосульфатцитрат-бромтимоловый сахарозный агар) и ее модификации. Однако чаще всего используют щелочной МПА, на котором холерный вибрион образует гладкие стекловидно-прозрачные с голубоватым оттенком дисковидные колонии вязкой консистенции.
При посеве уколом в столбик желатина вибрион через 2 сут. при температуре 22 – 23 °C вызывает разжижение с поверхности в виде пузырька, затем воронкообразное и, наконец, послойное.
В молоке вибрион быстро размножается, вызывая через 24 – 48 ч свертывание, а затем наступает пептонизация молока, и через 3 – 4 дня вибрион погибает из-за сдвига рН молока в кислую сторону.
Б. Хейберг по способности ферментировать маннозу, сахарозу и арабинозу распределил все вибрионы (холерные и холероподобные) на ряд групп, количество которых ныне составляет 8 (табл. 40).
Таблица 40
Биохимическая характеристика вибрионов по Хейбергу
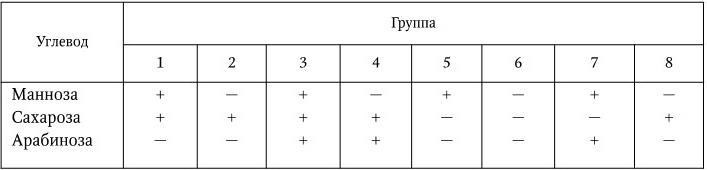
Холерный вибрион относится к первой группе Хейберга.
Вибрионы, сходные по морфологическим, культуральным и биохимическим признакам с холерным, называли и называют по-разному: парахолерными, холероподобными, НАГ-вибрионами (неагглютинирующиеся вибрионы); вибрионами, не относящимися к О1-группе. Последнее название наиболее точно подчеркивает их отношение к холерному вибриону. Как было установлено А. Гарднером и К. Венкатраманом, холерные и холероподобные вибрионы имеют общий Н-антиген, но различаются по О-антигенам. По О-антигену холерные и холероподобные вибрионы к настоящему времени распределяют на 139 О-серогрупп, но их количество все время пополняется. Холерный вибрион относится к О1 группе. Он имеет общий А-антиген и два типоспецифических антигена – В и С, по которым и различают три серотипа V. cholerae – серотип Огава (АВ), серотип Инаба (АС) и серотип Гикошима (АВС). Холерный вибрион в стадии диссоциации имеет OR-антиген. В связи с этим для идентификации V. cholerae используют О-сыворотку, OR-сыворотку и типоспецифические сыворотки Инаба и Огава.
В 1992 – 1993 гг. в Бангладеш, Индии, Китае, Малайзии и других странах началась крупная эпидемия холеры, возбудителем которой оказался новый, ранее не известный серовариант вида Vibrio cholerae. Он отличается от V. cholerae O1 по антигенным признакам: имеет антиген О139 и полисахаридную капсулу и не агглютинируется никакими другими О-сыворотками. Все остальные его морфологические и биологические свойства, включая способность вызывать холеру, т. е. синтезировать экзотоксин-холероген, оказались сходными со свойствами V. cholerae O1. Следовательно, возник, видимо, вследствие мутации, изменившей О-антиген, новый возбудитель холеры – V. cholerae O139. Он получил название V. cholerae O139 bengal.
Вопрос об отношении так называемых холероподобных вибрионов к V. cholerae долгое время был не ясен. Однако сопоставление V. cholerae и холероподобных (НАГ-вибрионов) более чем по 70 признакам выявило их сходство на 90 %, а степень гомологии ДНК V. cholerae и изученных НАГ-вибрионов составляет 70 – 100 %. Поэтому холероподобные вибрионы объединены в один вид с холерным вибрионом, от которого отличаются главным образом по своим О-антигенам, в связи с чем их называют вибрионами не О1-группы – V. cholerae non O1.
Вид V. cholerae подразделяют на 4 биотипа: V. cholerae, V. eltor, V. proteus и V. albensis. В течение многих лет обсуждался вопрос о природе вибриона Эль-Тор. Этот вибрион был выделен в 1906 г. Ф. Готшлихом на карантинной станции Эль-Тор из трупа паломника, погибшего от дизентерии. Ф. Готшлих выделил несколько таких штаммов. По всем свойствам они не отличались от холерного вибриона и агглютинировались холерной О-сывороткой. Но поскольку среди паломников в это время холеры не было, а длительное носительство холерного вибриона считалось мало вероятным, вопрос о возможной этиологической роли V. eltor при холере надолго остался дискуссионным. К тому же вибрион Эль-Тор, в отличие от V. cholerae, обладал гемолитическим действием. Однако в 1937 г. этот вибрион вызвал крупную и тяжелую эпидемию холеры на острове Сулавеси (Индонезия) с летальностью свыше 60 %. Наконец, в 1961 г. он стал виновником 7-й пандемии, и в 1962 г. вопрос о его холерной природе был решен окончательно. Различия между V. cholerae и V. eltor касаются лишь некоторых признаков (табл. 41). По всем другим свойствам V. eltor принципиально не отличается от V. cholerae. Кроме того, теперь уже установлено, что биотип V. proteus (V. finklerpriori) включает в себя всю группу вибрионов, кроме О1-группы (а ныне и О139), называвшихся ранее НАГ-вибрионами. Биотип V. albensis был выделен из реки Эльбы и обладает способностью к фосфоресценции, однако утратив ее, он ничем не отличается от V. proteus. В связи с этими данными в настоящее время вид Vibrio cholerae подразделяют на 4 биотипа: V. cholerae O1 cholerae, V. cholerae eltor, V. cholerae O139 bengal и V. cholerae non О1. Первые три относятся к двум сероварам О1 и О139. По решению ВОЗ, к возбудителям холеры отнесены три группы: 1) Vibrio cholerae О1 (классический и эльтор); 2) Vibrio cholerae О139 и 3) все серогруппы (их теперь 206) так называемых НАГ-вибрионов (вибрионов, не относящихся к группам О1 и О139), а также нетоксигенные О1 и О139 вибрионы. Вибрионы 3-й группы вызывают только одиночные или групповые вспышки, но не вызывают ни эпидемий, ни пандемий.
Таблица 41
Основные различия между V. cholerae и V. eltor
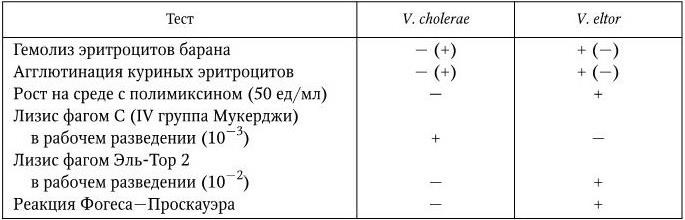
Факторы патогенности V. cholerae.
1. Подвижность. 2. Хемотаксис. С помощью этих свойств вибрион вступает во взаимодействие с эпителиоцитами. У мутантов Che– (утративших способность к хемотаксису) вирулентность значительно снижается, у мутантов Mob– (утративших подвижность) либо полностью исчезает, либо резко снижается. 3. Факторы адгезии и колонизации, с помощью которых вибрион прилипает к микроворсинкам и колонизирует слизистую оболочку тонкого кишечника. К факторам адгезии относятся муциназа, растворимая гемагглютинин/протеаза, нейраминидаза и др. Они способствуют адгезии и колонизации, так как разрушают вещества, входящие в состав слизи. Растворимая гемагглютинин/протеаза способствует отделению вибрионов от рецепторов эпителиоцитов и их выходу из кишечника во внешнюю среду, обеспечивая им эпидемическое распространение. Нейраминидаза укрепляет связь холерогена с эпителиоцитами и облегчает проникновение токсина внутрь клеток, что усиливает тяжесть диареи. 4. Холерный токсин – холероген. 5. Так называемые новые токсины, которые способны вызывать диарею, но не имеют генетического и иммунологического родства с холерогеном. 6. Дермонейротические и геморрагические факторы. Природа этих токсических факторов и их роль в патогенезе холеры изучены недостаточно. 7. Эндотоксин. Липополисахариды V. cholerae обладают сильным эндотоксическим свойством и вызывают общую интоксикацию организма.
Главный из перечисленных факторов патогенности холерного вибриона – экзотоксин холероген (CTX AB), который и обусловливает патогенез этой болезни. Молекула холерогена состоит из двух фрагментов – A и B. Фрагмент A состоит из двух пептидов – A1 и A2, он обладает специфическим свойством холерного токсина и наделяет его качествами суперантигена. Фрагмент B состоит из 5 одинаковых субъединиц. Он выполняет две функции: 1) распознает рецептор (моносиалоганглиозид) энтероцита и связывается с ним; 2) формирует внутримембранный гидрофобный канал для прохождения субъединицы A. Пептид A2 служит для связывания фрагментов A и B. Собственно токсическую функцию выполняет пептид A1 (АДФ-рибозилтрансфераза). Он взаимодействует с НАД, вызывает его гидролиз; образующаяся при этом АДФ-рибоза связывается с регуляторной субъединицей аденилатциклазы. Это ведет к угнетению гидролиза ГТФ. Возникающий комплекс ГТФ + аденилатциклаза вызывает гидролиз АТФ с образованием цАМФ. (Другой путь накопления цАМФ – подавление холерогеном фермента, гидролизующего цАМФ до 5-АМФ). Проявление функции гена ctxAB, кодирующего синтез экзотоксина, зависит от функции ряда других генов патогенности, в частности генов tcp (кодирующих синтез токсин-контролируемых пилей адгезии – ТКПА), регуляторных генов toxR, toxS и toxT, генов hap (растворимой гемагглютенин/протеазы) и neu (нейраминидазы). Поэтому генетический контроль патогенности V. cholerae имеет сложный характер.
Как выяснилось, в хромосоме V. cholerae имеются два острова патогенности. Один из них представляет собой геном нитевидного умеренного конвертирующего фага CTXϕ, а другой – геном тоже нитевидного умеренного конвертирующего фага VPIϕ. Каждый из этих островов патогенности содержит кассеты генов указанных профагов, которые и определяют патогенность возбудителя холеры. Профаг CTXϕ несет гены CTX, гены новых токсинов zot и ace, ген cep (синтез адгезина), ген ortU (синтез продукта с неизвестной функцией). В эту же кассету входят ген neu и область фага RS2, которая кодирует репликацию, а также интеграцию профага в хромосомы. Гены zot, ace и ortU необходимы для формирования фаговых вирионов при исключении профага из хромосомы возбудителя.
Профаг VPIϕ несет гены tcp (кодируют продукцию пилей (белок ТКПА)), гены toxT, toxR, act (дополнительный фактор колонизации, гены мобильности (интегразы и транспозазы)). Транскрипцию генов вирулентности регулируют три гена-регулятора: toxR, toxS и toxT. Эти гены координированно, на уровне транскрипции, изменяют активность более 20 генов вирулентности, включая гены ctxAB, tcp и др. Главным геном-регулятором служит ген toxR. Его повреждение или отсутствие приводят к авирулентности или к снижению продукции холерного токсина CTX и ТКПА более чем в 100 раз. Возможно, таким образом регулируется координированное выражение генов вирулентности в островах патогенности, образуемых умеренными конвертирующими фагами и у других видов бактерий. Установлено, что в хромосоме V. cholerae eltor присутствует еще один профаг К139, но его геном мало изучен.
Ген hap локализован на хромосоме. Таким образом, вирулентность (патогенность) и эпидемическую способность V. cholerae определяют 4 гена: ctxAB, tcp, toxR и hap.
Для обнаружения способности V. cholerae продуцировать холероген можно использовать различные методы.
1. Биологическая проба на кроликах. При внутримышечном введении холерных вибрионов кроликам-сосункам (возраст не более 2 нед.) у них развивается типичный холерный синдром: диарея, обезвоживание и гибель кролика.
2. Непосредственное обнаружение холерогена с помощью ПЦР, ИФМ или реакции пассивного иммунного гемолиза (холероген связывается с Gm1 эритроцитов, и они при добавлении антитоксических антител и комплемента лизируются). Однако обнаружения только способности продуцировать токсин недостаточно для определения эпидемической опасности таких штаммов. Для этого необходимо выявить наличие гена hap, поэтому лучше и надежнее всего дифференцировать токсигенные и эпидемические штаммы холерных вибрионов серогрупп О1 и О139 с помощью ПЦР с применением специфических праймеров для обнаружения всех 4 генов патогенности: ctxAB, tcp, toxR и hap.
Способность V. cholerae, не относящихся к серогруппам О1 или О139, вызывать спорадические или групповые диарейные заболевания у людей может быть связана либо с наличием у них энтеротоксинов типа LT или ST, стимулирующих аденилатили гуанилатциклазные системы соответственно, либо с наличием только генов ctxAB, но отсутствием гена hap.
Во время седьмой пандемии выделялись штаммы V. cholerae с различной степенью вирулентности: холерогенные (вирулентные), слабо холерогенные (маловирулентные) и нехолерогенные (невирулентные). Нехолерогенные V. cholerae, как правило, проявляют гемолитическую активность, не лизируются холерным диагностическим фагом ХДФ(5) и не вызывают заболевания человека.
Для фаготипирования V. cholerae О1 (в том числе и эльтор) С. Мукерджи были предложены наборы фагов, которые затем в России были дополнены другими фагами. Набор таких фагов (1 – 7) позволяет выделить среди V. cholerae О1 16 фаготипов. Для идентифицирования токсигенных и нетоксигенных V. cholerae эльтор вместо ХДФ-3, ХДФ-4 и ХДФ-5 теперь в России предложены фаги CTX+ (лизируют токсигенные вибрионы эльтор) и CTX– (лизируют нетоксигенные вибрионы эльтор).
Резистентность возбудителей холеры. Холерные вибрионы хорошо выживают при низкой температуре; во льду сохраняют жизнеспособность до 1 мес.; в морской воде – до 47 сут., в речной – от 3 – 5 дней до нескольких недель, в кипяченой минеральной воде сохраняются более 1 года, в почве – от 8 дней до 3 мес., в свежих испражнениях – до 3 сут., на вареных продуктах (рис, лапша, мясо, каши и др.) выживают 2 – 5 дней, на сырых овощах – 2 – 4 дня, на фруктах – 1 – 2 дня, в молоке и молочных продуктах – 5 дней; при хранении на холоде срок выживания увеличивается на 1 – 3 дня; на полотняном белье, загрязненном испражнениями, сохраняются до 2 сут., а на влажном материале – неделю. Холерные вибрионы при температуре 80 °C погибают через 5 мин, при 100 °C – моментально; высокочувствительны к кислотам;
под влиянием хлорамина и других дезинфектантов погибают через 5 – 15 мин. Они чувствительны к высушиванию и действию прямых солнечных лучей, но хорошо и долго сохраняются и даже размножаются в открытых водоемах и сточных водах, богатых органическими веществами, имеющих щелочную рН и температуру выше 10 – 12 °C. Высокочувствительны к хлору: доза активного хлора 0,3 – 0,4 мг/л воды за 30 мин вызывает надежное обеззараживание от холерного вибриона.
Особенности эпидемиологии. Основным источником инфекции является только человек – больной холерой или вибриононоситель, а также загрязненная ими вода. Никакие животные в природе холерой не болеют. Способ заражения – фекально-оральный. Пути заражения: а) основной – через воду, используемую для питья, купания и хозяйственно-бытовых нужд; б) контактно-бытовой и в) через пищу. Все крупные эпидемии и пандемии холеры были связаны с водой. Холерные вибрионы обладают такими приспособительными механизмами, которые обеспечивают существование их популяций как в организме человека, так и в определенных экосистемах открытых водоемов. Обильная диарея, которую вызывает холерный вибрион, приводит к очищению кишечника от конкурирующих бактерий и способствует широкому распространению возбудителя в окружающей среде, прежде всего в сточных водах и в открытых водоемах, куда их сбрасывают. Человек, больной холерой, выделяет возбудителя в огромном количестве – от 100 млн до 1 млрд на 1 мл испражнений, вибриононоситель выделяет 100 – 100 000 вибрионов в 1 мл, заражающая доза составляет около 1 млн вибрионов. Продолжительность выделения холерного вибриона у здоровых носителей составляет от 7 до 42 дней и 7 – 10 дней у переболевших. Более продолжительное выделение наблюдается крайне редко.
Особенностью холеры является то, что после нее, как правило, не остается длительного носительства и не формируется стойких эндемических очагов. Однако, как уже указывалось выше, в связи с загрязнением открытых водоемов сточными водами, содержащими в большом количестве органические вещества, моющие средства и поваренную соль, в летнее время холерный вибрион в них не только долго выживает, но даже и размножается.
Важное эпидемиологическое значение имеет тот факт, что холерные вибрионы О1-группы, как нетоксигенные, так и токсигенные, могут длительно сохраняться в различных водных экосистемах в виде некультивируемых форм. С помощью цепной полимеразной реакции при отрицательных бактериологических исследованиях на ряде эндемичных территорий СНГ в различных водоемах были обнаружены vctгены некультивируемых форм V. cholerae.
Эндемическим очагом холерного вибриона Эль-Тор является Индонезия, выход из нее этого виновника седьмой пандемии связан, как полагают, с расширением экономических связей Индонезии с внешним миром после приобретения ею независимости, а на продолжительность и молниеносное развитие пандемии, особенно ее второй волны, решающее влияние оказали отсутствие иммунитета к холере и различные социальные потрясения в странах Азии, Африки и Америки.
При возникновении заболеваний холерой осуществляют комплекс противоэпидемических мероприятий, среди которых ведущим и решающим является активное своевременное выявление и изоляция (госпитализация, лечение) больных в острой и атипичной форме и здоровых вибриононосителей; принимаются меры по пресечению возможных путей распространения инфекции; особое внимание уделяется водоснабжению (хлорирование питьевой воды), соблюдению санитарно-гигиенического режима на пищевых предприятиях, в детских учреждениях, местах общественного пользования; осуществляется строгий контроль, в том числе бактериологический, за открытыми водоемами, проводится иммунизация населения и т. п.
Особенности патогенеза и клиники. Инкубационный период при холере варьирует от нескольких часов до 6 сут., чаще всего – 2 – 3 дня. Попав в просвет тонкого кишечника, холерные вибрионы за счет подвижности и хемотаксиса к слизистой оболочке направляются к слизи. Чтобы проникнуть через нее, вибрионы вырабатывают ряд ферментов: нейраминидазу, муциназу, протеазы, лецитиназу, которые разрушают вещества, содержащиеся в слизи, и облегчают продвижение вибрионов к эпителиальным клеткам. Путем адгезии вибрионы прикрепляются к гликокаликсу эпителия и, теряя подвижность, начинают интенсивно размножаться, колонизируя микроворсинки тонкого кишечника (см. цв. вкл., рис. 101.2), и одновременно вырабатывать большое количество экзотоксина-холерогена. Молекулы холерогена связываются с моносиалоганглиозидом Gm1 и проникают в мембрану клетки, где активируют аденилатциклазную систему, а накапливающийся цАМФ вызывает гиперсекрецию жидкости, катионов и анионов Na+, HCO3—, K+, Cl— из энтероцитов, что и приводит к холерной диарее, обезвоживанию и обессоливанию организма. Различают три типа течения болезни:
1) бурное, тяжелое обезвоживающее диарейное заболевание, приводящее к смерти больного через несколько часов;
2) менее тяжелое течение, или понос без обезвоживания;
3) бессимптомное течение заболевания (вибриононосительство).
При тяжелой форме холеры у больных появляется понос, стул учащается, испражнения становятся все более обильными, принимают водянистый характер, утрачивают фекальный запах и имеют вид рисового отвара (мутная жидкость с плавающими в ней остатками слизи и клетками эпителия). Затем присоединяется изнурительная рвота, сначала содержимым кишечника, а затем рвотные массы приобретают вид рисового отвара. Температура у больного падает ниже нормы, кожа становится синюшной, морщинистой и холодной – холерный алгид. В результате обезвоживания происходит сгущение крови, развивается цианоз, кислородное голодание, резко страдает функция почек, появляются судороги, больной теряет сознание и наступает смерть. Летальность от холеры во время седьмой пандемии варьировала от 1,5 % в развитых странах до 50 % в развивающихся странах.
Постинфекционный иммунитет прочный, длительный, повторные заболевания наблюдаются редко. Иммунитет антитоксический и антимикробный, обусловлен антителами (антитоксины сохраняются дольше, чем антимикробные антитела), клетками иммунной памяти и фагоцитами.
Лабораторная диагностика. Основным и решающим методом диагностики холеры является бактериологический. Материалом для исследования от больного служат испражнения и рвотные массы; на вибриононосительство исследуют испражнения; у лиц, погибших от холеры, для исследования берут лигированный отрезок тонкого кишечника и желчный пузырь; из объектов внешней среды чаще всего исследуют воду открытых водоемов и сточные воды.
При проведении бактериологического исследования необходимо соблюдать следующие три условия:
1) как можно быстрее произвести посев материала от больного (холерный вибрион сохраняется в испражнениях короткий срок);
2) посуда, в которую берут материал, не должна обеззараживаться химическими веществами и не должна содержать их следы, так как холерный вибрион к ним очень чувствителен;
3) исключить возможность загрязнения и заражения окружающих.
Выделение культуры проводят по схеме: посев на ПВ, одновременно на щелочной МПА или какую-либо избирательную среду (лучше всего TCBS). Через 6 ч исследуют пленку, образующуюся на ПВ, и в случае необходимости делают пересев на вторую ПВ (высеваемость холерного вибриона в этом случае повышается на 10 %). С ПВ делают пересев на щелочной МПА. Подозрительные колонии (стекловидно-прозрачные) пересевают для получения чистой культуры, которую идентифицируют по морфологическим, культуральным, биохимическим свойствам, подвижности и окончательно типируют с помощью диагностических агглютинирующих сывороток О-, ОR-, Инаба и Огава и фагов (ХДФ). Предложены различные варианты ускоренной диагностики, наилучшим из них является люминесцентносерологический метод. Он позволяет обнаружить холерный вибрион непосредственно в исследуемом материале (или после предварительного подращивания в двух пробирках с 1 %-ной ПВ, в одну из которых добавляют холерный фаг) в течение 1,5 – 2 ч. Для ускоренного обнаружения холерного вибриона Нижегородским ИЭМ предложен набор бумажных индикаторных дисков, состоящих из 13 биохимических тестов (оксидаза, индол, уреаза, лактоза, глюкоза, сахароза, манноза, арабиноза, маннит, инозит, аргинин, орнитин, лизин), которые позволяют дифференцировать представителей рода Vibrio от родов Aeromonas, Plesiomonas, Pseudomonas, Comamonas и от семейства Enterobacteriaceae. Для быстрого обнаружения холерного вибриона в испражнениях и в объектах внешней среды может быть использована РПГА с антительным диагностикумом. С целью выявления некультивируемых форм холерного вибриона в объектах внешней среды применяют только метод цепной полимеразной реакции.
В тех случаях, когда выделяются V. cholerae не О1-группы, они должны быть типированы с помощью соответствующих агглютинирующих сывороток других серогрупп. Выделение от больного диареей (в том числе холероподобной) V. cholerae не О1-группы требует проведения таких же противоэпидемических мероприятий, как и в случае выделения V. cholerae О1-группы. При необходимости у таких вибрионов с помощью ПЦР определяют наличие генов патогенности ctxAB, tcp, toxR и hap.
Серологическая диагностика холеры имеет вспомогательный характер. С этой целью может быть использована реакция агглютинации, но лучше – определение титра вибриоцидных антител или антитоксинов (антитела к холерогену определяют иммуноферментным или иммунофлуоресцентным методами).
Лечение больных холерой должно заключаться прежде всего в регидратации и восстановлении нормального водно-солевого обмена. С этой целью рекомендуется использовать солевые растворы, например такого состава: NaCl – 3,5; NaHCO3 – 2,5; KCl – 1,5 и глюкоза – 20,0 г на 1 л воды. Такое патогенетически обоснованное лечение в сочетании с рациональной антибиотикотерапией позволяет снизить летальность при холере до 1 % и менее.
Специфическая профилактика. Для создания искусственного иммунитета были предложены различные вакцины, в том числе из убитых штаммов Инаба и Огава; холероген-анатоксин для подкожного применения и энтеральная химическая бивалентная вакцина, состоящая из анатоксина и соматических антигенов серотипов Инаба и Огава, так как перекрестный иммунитет не формируется. Однако продолжительность поствакцинального иммунитета составляет не более 6 – 8 мес., поэтому прививки проводят только по эпидемическим показаниям. В очагах холеры неплохо зарекомендовала себя антибиотикопрофилактика, в частности тетрациклином, к которому холерный вибрион проявляет высокую чувствительность. С такой же целью могут быть использованы и другие эффективные против V. cholerae антибиотики.
Патогенные для человека вибрионы, не относящиеся к виду V. cholerae
К роду Vibrio относится более 25 видов, из которых помимо V. cholerae по крайней мере следующие восемь способны вызывать заболевания у людей: V. parahaemolyticus, V. alginolyticus, V. vulnificus, V. fluvialis, V. furnissii, V. mimicus, V. damsela и V. hollisae. Признаки, по которым они различаются между собой, представлены в табл. 42. Все эти вибрионы являются обитателями морей и заливов. Заражение ими происходит либо при купании, либо при употреблении в пищу продуктов морского происхождения. Как выяснилось, холерные и нехолерные вибрионы могут вызывать не только гастроэнтериты, но и раневые инфекции. Эта способность обнаружена у V. cholerae O1– и не О1-групп, у V. parahaemolyticus, V. alginolyticus, V. mimicus,
Таблица 42
Дифференциальные признаки патогенных видов рода Vibrio
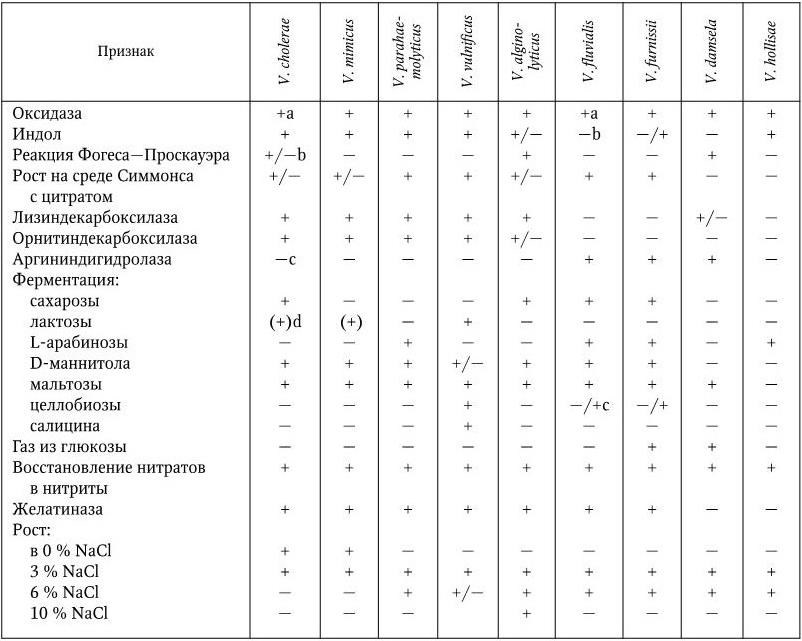
Примечание. +a – более чем 90 % штаммов позитивны; +/ – b – преобладающие реакции указаны в числителе; +c – более чем 90 % штаммов позитивны; – c – более чем 90 % штаммов негативны; (+)d – положительная реакция происходит в течение 3 дней.
V. damsela и V. vulnificus. Они вызывают воспалительные процессы в мягких тканях при повреждении их панцирем морских животных или при прямом контакте с инфицированной морской водой.
Из числа перечисленных патогенных нехолерных вибрионов наибольший практический интерес представляют V. parahaemolyticus, V. alginolyticus, V. vulnificus и V. fluvialis.
V. parahaemolyticus – парагемолитический вибрион – впервые был выделен в Японии в 1950 г. во время большой вспышки пищевой токсикоинфекции, вызванной употреблением полувысушенных сардин (летальность составила 7,5 %). Принадлежность возбудителя к роду Vibrio была установлена Р. Саказаки в 1963 г. Он разделил изученные штаммы на 2 вида: V. parahaemolyticus и V. alginolyticus. Оба вида обнаруживаются в прибрежной морской воде и у ее обитателей, они являются галофилами (греч. hals – соль); в отличие от обычных вибрионов, галофильные не растут на средах без NaCl и хорошо размножаются при высоких концентрациях ее. Видовую принадлежность галофильных вибрионов определяют по их способности ферментировать сахарозу, образовывать ацетилметилкарбинол, размножаться в ПВ с 10 % NaCl. Все эти признаки присущи виду V. alginolyticus, но отсутствуют у V. parahaemolyticus.
Парагемолитический вибрион имеет три типа антигенов: термолабильные жгутиковые Н-антигены, термостабильные, не разрушающиеся при нагревании до 120 °C в течение 2 ч О-антигены и поверхностные К-антигены, разрушающиеся при нагревании. Свежевыделенные культуры V. parahaemolyticus имеют хорошо выраженные К-антигены, которые предохраняют живые вибрионы от агглютинации гомологичными О-сыворотками. Н-антигены у всех штаммов одинаковы, но Н-антигены монотрихов отличаются от Н-антигенов перитрихов. По О-антигену V. parahaemolyticus разделяют на 14 серогрупп. Внутри серогрупп вибрионы подразделяют на серотипы по К-антигенам, общее количество которых составляет 61. Антигенная схема V. parahaemolyticus разработана применительно только к его штаммам, выделяемым от людей.
Патогенность V. parahaemolyticus связана с его способностью синтезировать гемолизин, обладающий энтеротоксическим свойством. Последнее выявляется с помощью метода Канагавы. Сущность его заключается в том, что патогенные для человека V. parahaemolyticus вызывают четкий гемолиз на кровяном агаре, содержащем 7 % NaCl. На кровяном агаре, содержащем менее 5 % NaCl, гемолиз вызывают многие штаммы V. parahaemolyticus, а на кровяном агаре с 7 % NaCl – только штаммы с энтеропатогенными свойствами. Парагемолитический вибрион обнаружен на побережьях Японского, Каспийского, Черного и других морей. Он вызывает пищевые токсикоинфекции и дизентериеподобные заболевания. Заражение происходит при употреблении в пищу сырых или полусырых морских продуктов, инфицированных V. parahaemolyticus (морская рыба, устрицы, ракообразные и т. п.).
Среди выше указанных восьми видов нехолерных вибрионов наиболее патогенным для человека является V. vulnificus, который впервые был описан в 1976 г. как Beneckea vulnificus, а затем в 1980 г. переклассифицирован в Vibrio vulnificus. Он часто обнаруживается в морской воде и ее обитателях и служит причиной различных заболеваний человека. Штаммы V. vulnificus морского и клинического происхождения не отличаются друг от друга ни фенотипически, ни генетически.
Раневые инфекции, вызываемые V. vulnificus, быстро прогрессируют и ведут к образованию опухолей с последующим некрозом ткани, сопровождаются лихорадкой, ознобом, иногда сильными болями, в некоторых случаях требуют ампутации. У V. vulnificus обнаружена способность продуцировать экзотоксин. В опытах на животных установлено, что возбудитель вызывает сильные местные повреждения с развитием отека и некроза ткани с последующим летальным исходом. Роль экзотоксина в патогенезе болезни изучается.
Помимо раневых инфекций, V. vulnificus может вызывать пневмонию у тонувших людей и эндометриты у женщин после пребывания их в морской воде. Наиболее тяжелой формой инфекции, вызываемой V. vulnificus, является первичная септицемия, связанная с употреблением в пищу сырых устриц (возможно, и других морских животных). Это заболевание развивается очень быстро: у больного появляются недомогание, лихорадка, озноб и прострация, затем сильная гипотония, являющаяся главной причиной смерти (летальность около 50 %).
V. fluvialis впервые как возбудитель гастроэнтерита был описан в 1981 г. Он относится к подгруппе нехолерных патогенных вибрионов, у которых есть аргининдигидролаза, но нет орнитин– и лизиндекарбоксилаз (V. fluvialis, V. furnissii, V. damsela, т. е. фенотипически сходных с Aeromonas). V. fluvialis – частый возбудитель гастроэнтеритов, которые сопровождаются сильной рвотой, поносом, абдоминальными болями, повышением температуры и сильной или средней тяжести дегидратацией. Главным фактором патогенности является энтеротоксин.
Лабораторная диагностика. Основным методом диагностики заболеваний, вызываемых нехолерными патогенными вибрионами, является бактериологический с использованием таких селективных сред, как TCBS, Мак-Конки и др. Принадлежность выделенной культуры к роду Vibrio определяют на основании ключевых признаков бактерий этого рода. Видовую принадлежность устанавливают с учетом признаков, указанных в табл. 39.
Микробиология кампилобактериозов
К семейству Campylobacteriaceae относятся аэробные или микроаэрофильные подвижные вибриоидные не образующие спор грамотрицательные бактерии трех родов: Campylobacter, Helicobacter и Arcobacter. Состав родов по мере получения новых данных постоянно уточняется.
Кампилобактериоз – инфекционное заболевание, характеризующееся острым началом, лихорадкой, поражением желудочно-кишечного тракта. Исследования, проведенные в последние годы, показали, что в ряде стран кампилобактерии вызывают от 3 до 15 % всех случаев острых кишечных заболеваний.
В инфекционной патологии человека и животных важнейшую роль играют виды C. jejuni, C. coli и C. lari, вызывающие ОКЗ сходного клинического течения. На основании способности к росту при относительно высокой температуре инкубации (42 °C) они объединены в одну группу термофильных кампилобактерий. Среди прочих мезофильных видов кампилобактерий, предпочитающих умеренную температуру инкубации (37 °C), известную роль в патологии человека играет C. fetus, зачастую являющийся возбудителем артритов, менингитов, васкулитов; виды C. concisus и C. sputorum расцениваются как комменсалы полости рта, возможно, играющие роль в патогенезе пародонтита, а виды C. fennelliae, C. cinaedi и C. hyointestinalis встречаются в толстом кишечнике при иммунодефицитах различного генезиса.
Кампилобактерии – грамотрицательные, тонкие, спирально изогнутые палочки размером 0,2 – 0,3 × 0,5 – 5,0, иногда до 8,0 мкм. Они могут образовывать один полный (или чуть больше) виток спирали, могут быть С– или S-образной формы или напоминать крылья чайки при соединении двух клеток в короткую цепочку. В старых культурах клетки могут иметь кокковидную или гиперспирализованную форму. Спор и капсул не образуют, имеют 1 или 2 (иногда до 5) полярно расположенных жгутика, обеспечивающих им высокую подвижность со стремительным штопорообразным или винтообразным поступательным движением. Жгутики могут быть в 2 – 3 раза длиннее клетки. Подвижность лучше видна при темнопольной или фазовоконтрастной микроскопии. Содержание Г + Ц в ДНК – 30 – 38 мол %.
Кампилобактерии являются хемоорганотрофами. Будучи термофилами, способны к росту при температуре 37 – 44 °C, но не при 25 °C. Большинство кампилобактерий – микроаэрофилы и капнофилы, оптимальная атмосфера для культивирования патогенных видов имеет состав: О2 – 5 %, СО2 – 10 %, N2 – 85 %. Некоторые кампилобактерии при выращивании могут проявлять себя как облигатные анаэробы. Энергию освобождают из аминокислот и трикарбоновых кислот, но не из углеводов, к окислению и ферментации которых не способны.
Для культивирования кампилобактерий чаще используют специальные питательные среды, в основу которых положены среды для выделения бруцелл. Однако в эти среды необходимо добавлять вещества, повышающие аэротолерантность кампилобактерий и снижающие редокс-потенциал среды (кровь, тиогликолат натрия, метабисульфит натрия, пируват натрия, сульфат Fe2+). Обычно используют мясные, печеночные, кровяные среды, часто в них добавляют антибиотики (новобиоцин, циклогексамид, бацитрацин, триметоприм) для подавления сопутствующей микрофлоры. На питательных средах рост кампилобактерий наблюдается обычно через 2 – 4 сут. На жидких питательных средах наблюдается диффузное помутнение с трудно разбиваемым выраженным осадком. На полужидких средах они вырастают в виде диффузного мутного кольца толщиной 1 – 4 мм под поверхностью среды. Если кампилобактерии растут в условиях строгого анаэробиоза, отмечается помутнение всей среды.
На плотных средах с кровью кампилобактерии образуют два типа колоний: а) округлые неправильной формы, с ровными краями, диаметром 2 – 8 мм, бесцветные или светло-серые, прозрачные, гомогенные (напоминают капли воды); при длительном культивировании могут приобретать серебристо-матовый оттенок; б) колонии правильной округлой формы, с ровными краями и диаметром 1 – 2 мм, с блестящей выпуклой поверхностью, прозрачные, гомогенные; в старых колониях центр более плотный, чем периферия, и может образовываться желтоватый пигмент. Консистенция колоний невязкая, зона гемолиза отсутствует.
Кампилобактерии оксидазоположительны, желатин и мочевину не гидролизуют, реакции с метиловым красным и Фогеса – Проскауэра отрицательны. Они продуцируют цитохромоксидазу, не растут на среде Ресселя; по способности образовывать каталазу делятся на две группы: каталазопозитивные (С. fetus, С. jejuni, С. coli) и каталазонегативные (С. sputorum и С. concisus). Некоторые их виды могут образовывать сероводород, расти в присутствии 1 и 3,5 % NaCl, бриллиантового зеленого, налидиксовой кислоты, цефалотина, гидролизовать гиппурат натрия, образовывать пигмент желтого цвета. На этих свойствах основана межвидовая дифференциация (табл. 43).
Таблица 43
Свойства некоторых видов родов Campylobacter и Helicobacter

Примечание.(+) – положительный признак; ( – ) – отрицательный признак; (?) – непостоянный признак; У – устойчив; Ч – чувствителен.
Кампилобактерии имеют О-, Н– и К-антигены. С. jejuni и С. coli, наиболее часто вызывающие заболевания у человека, серологически гетерогенны. В зарубежной литературе описано 55 серогрупп, различающихся по термостабильному О-антигену. Установлено, что штаммы, выделенные от человека, дают реакцию агглютинации только с сывороткой от людей, а сывороткой от иммунизированных животных они не агглютинируются. Можно предположить, что идет формирование штаммов, специфичных для человека.
Кампилобактерии имеют целый комплекс факторов вирулентности, в том числе липополисахарид, энтеротоксин (вызывает диарею), цитотоксин, повреждающий слизистую оболочку толстой кишки у человека, и др.
При комнатной и, в особенности, при пониженной температурах резистентность кампилобактерий к действию факторов внешней среды весьма высока: в пищевых продуктах, водопроводной и сточных водах, молоке, моче, испражнениях они могут сохранять жизнеспособность в течение 1 – 5 нед. Кампилобактерии очень чувствительны к нагреванию свыше 50 °C, действию прямого солнечного и ультрафиолетового света и воздуха, высыханию, низким и высоким значениям рН среды, чувствительны к действию дезинфицирующих веществ в рабочих концентрациях.
Эпидемиология. Кампилобактерии (особенно термофильные) обнаруживаются у всех видов диких и домашних зверей и птиц, многие из которых являются их естественными резервуарами (крупный и мелкий рогатый скот, куры, скворцы, воробьи, попугаи и др.). Основным резервуаром кампилобактерий следует считать сельскохозяйственных животных, дополнительными – больных людей и домашних животных, диких городских птиц и грызунов. Основной путь передачи инфекции – пищевой (сырое молоко, битая птица, говядина, свинина), дополнительные – водный (речная и морская вода, загрязненная испражнениями животных) и бытовой (грубые нарушения санитарно-гигиенических норм при уходе за больными людьми и животными, а также при кулинарной обработке мясных продуктов). Кампилобактериозу свойственна выраженная летняя сезонность с почти полным отсутствием заболеваемости в зимние месяцы. Чаще заболевание регистрируется в виде спорадических случаев («диарея путешественников»), изредка – в виде более или менее крупных вспышек. После перенесенного заболевания у людей, не леченных антибиотиками, бактерии с испражнениями выделяются достаточно долго, в течение 2 – 5 нед., а иногда до 10 нед.
Патогенез и клиника. У людей кампилобактериоз протекает в основном в виде энтеритов и энтероколитов, хотя описаны заболевания и другой локализации: септицемия, эндокардит, перикардит, менингит; поражения внекишечной локализации чаще отмечаются у людей старшего возраста или у больных со сниженной резистентностью организма.
Инкубационный период 1 – 10 дней, чаще 1 – 5 дней. Начало заболевания чаще острое, реже – подострое. Обычно наблюдаются умеренно выраженная интоксикация и диарея (до 10 – 20 раз в сутки), боли в нижней части живота. В половине случаев отмечается наличие крови в испражнениях, реже – обезвоживание. Чаще возникает и тяжелее протекает заболевание у детей в возрасте от 1 до 3 лет. Патогенез и степень тяжести находятся в прямой зависимости от факторов патогенности, имеющихся у данного штамма кампилобактерии, а также от количества бактерий, попавших в организм.
Иммунитет. Кампилобактерии высокоиммуногенны. Антитела появляются в крови в ранние сроки заболевания и в достаточно высоких титрах. Титр до 1: 5000 бывает уже на 5-й день заболевания; достигнув максимума, титры антител (IgG) в течение длительного времени медленно снижаются и через месяц могут быть еще достаточно высокими.
Лабораторная диагностика. Для диагностики кампилобактериозов используют микроскопический, бактериологический и серологический методы. Микроскопический метод используется в качестве ориентировочного. Тонкий мазок испражнений, зафиксированный на огне, окрашивают 1 %-ным водным раствором основного фуксина в течение 10 – 20 с, затем промывают водой. Поскольку для окрашивания большинства других бактерий требуется 2 – 5 мин, в мазке за 10 – 20 с обычно успевают окраситься только кампилобактерии. В нативном материале они имеют характерную форму (S-образные короткие цепочки в виде крыльев чайки, реже – С-образные с оттянутыми концами).
Основной метод диагностики – бактериологический. Материал для посева – испражнения или содержимое прямой кишки, иногда кровь, а также вода, молоко, другие пищевые продукты, смывы с предметов и т. д. Посевы делают на специальные питательные среды, создают микроаэрофильные условия и инкубируют при температуре 37 и 42 °C. После получения типичных колоний культуру идентифицируют по совокупности признаков.
Серологический метод исследования играет весьма важную роль при широкомасштабных эпидемиологических исследованиях, но в диагностике кампилобактериозов его роль невелика. Реакция агглютинации ставится с аутоштаммами, можно с живой музейной культурой, но с формалинизированной культурой результаты получаются более четкими. Наиболее чувствительные методы РИФ и ИФМ. Могут также использоваться РСК, латекс-агглютинация, иммуноэлектрофорез, РПГА.
Специфическая профилактика и лечение. Специфическая профилактика не разработана; другие профилактические мероприятия включают строгое соблюдение норм переработки, транспортировки и хранения пищевых продуктов, правил личной гигиены, защиту водоемов от загрязнения сточными водами (особенно животноводческих хозяйств).
Для лечения кампилобактериозов используют антибиотики; наиболее эффективны гентамицин и эритромицин, менее эффективны канамицин, левомицетин и полусинтетические пенициллины.
Хеликобактеры. Helicobacter pylori был открыт в 1982 г. Б. Маршаллом и Р. Уорреном при исследовании биоптатов слизистой желудка. К роду Helicobacter в настоящее время относят уже более 10 видов, часть которых ранее включали в род Campylobacter. H. pylori несколько крупнее других видов (0,5 – 1,0 × 2,5 – 5 мкм) и имеет форму палочки, спирали или «дуги вола». Лофотрих (до 5 жгутиков) или монотрих, иногда в популяции присутствуют обе формы. На агаровых средах малоподвижен или неподвижен. Растет на средах для кампилобактерий, но лучше растет на «шоколадном» агаре, образуя на нем через 2 – 7 сут. колонии диаметром 0,5 – 1,0 мм. На 10 %-ном кровяном агаре отмечается слабый α-гемолиз. Для роста требуются микроаэрофильные условия или атмосфера, обогащенная СО2. В аэробных или анаэробных условиях не растет.
Н. pylori оксидазо– и каталазопозитивен; сероводород не образует, гиппурат не гидролизует, обладает высокой уреазной активностью. Устойчив к хлориду трифенилтетразолия в концентрации 0,4 – 1,0 мг/мл; устойчив к 0,1 % раствору селенита натрия, в меньшей степени – к 1 %-ному глицину.
Факторами вирулентности Н. pylori служат подвижность; уреаза (нейтрализует HCl и повреждает эпителиоциты); протеиновый цитотоксин, вызывающий вакуолизацию эпителиальных клеток и повреждающий межклеточные мостики; липополисахарид; протеиназа; липаза; каталаза, гемолизин и др.
Заражение людей, вероятнее всего, происходит по фекально-оральному механизму. Возбудитель, проникая через муцин в подслизистую желудка, колонизирует эпителиоциты, нередко внедряясь в них. Прогрессирующее очаговое воспаление приводит к развитию гастрита, пептических язв желудка и двенадцатиперстной кишки. В дальнейшем может происходить развитие аденокарциномы или лимфомы желудка (MALT'омы – Mucosa Associated Lymphoid Tissue Lymphoma).
Наиболее эффективным препаратом для лечения хронического гастрита и язвенной болезни желудка или двенадцатиперстной кишки является ДеНол (коллоидный субцитрат висмута), избирательно действующий только на Н. pylori, который сочетают с трихополом (метронидазолом) и амоксициллином (или кларитромицином) для усиления терапевтического действия.
Возбудители капельных инфекций
Дифтерия – острое инфекционное заболевание преимущественно детского возраста, которое проявляется глубокой интоксикацией организма дифтерийным токсином и характерным фибринозным воспалением в месте локализации возбудителя. Название болезни происходит от греческого слова diphthera – кожа, пленка, так как в месте размножения возбудителя образуется плотная, серовато-белого цвета пленка.
Возбудитель дифтерии – Corynebacterium diphtheriae – был обнаружен впервые в 1883 г. Э. Клебсом в срезах из пленки, получен в чистой культуре в 1884 г. Ф. Леффлером. В 1888 г. Э. Ру и А. Иерсен обнаружили его способность продуцировать экзотоксин, играющий главную роль в этиологии и патогенезе дифтерии. Получение в 1892 г. антитоксической сыворотки Э. Берингом и использование ее с 1894 г. для лечения дифтерии позволило значительно снизить летальность. Успешное наступление на эту болезнь началось после 1923 г. в связи с разработкой Г. Рамоном метода получения дифтерийного анатоксина.
Возбудитель дифтерии относится к роду Corynebacterium (класс Actinobacteria). В морфологическом отношении характеризуется тем, что клетки булавовидно утолщены на концах (греч. coryne – булава), образуют ветвление, особенно в старых культурах, и содержат зернистые включения.
Установлена этиологическая роль коринебактерий, не относящихся к коринебактерии дифтерии, так называемых Corynebacterium non diphtheriae, которые способны вызывать не только заболевания верхних дыхательных путей, но и отиты, эндокардиты, бронхиты, пневмонии, уретриты, пиелонефриты и др. Возбудителями таких заболеваний чаще всего бывают Corynebacterium pseudodiphtheriticum, C. xerosis, C. pseudotuberculosis и C. urealyticum.
C. diphtheriae – прямые или слегка изогнутые неподвижные палочки длиной 1,0 – 8,0 мкм и диаметром 0,3 – 0,8 мкм, спор и капсул не образуют. Очень часто они имеют вздутия на одном или обоих концах, часто содержат метахроматические гранулы – зерна волютина (полиметафосфаты), которые при окрашивании метиленовым синим приобретают голубовато-пурпурный цвет. Для их обнаружения предложен особый метод окрашивания по Нейссеру. При этом палочки окрашиваются в соломенно-желтый, а зерна волютина – в темно-коричневый цвет, и располагаются обычно по полюсам (см. цв. вкл., рис. 102.2 и 3). C. diphtheriae хорошо окрашивается анилиновыми красителями, грамположительна, но в старых культурах нередко обесцвечивается и имеет отрицательную окраску по Граму. Для нее характерен выраженный полиморфизм, особенно в старых культурах и под влиянием антибиотиков (см. рис. 102.1). Содержание Г + Ц в ДНК около 60 мол %.
Дифтерийная палочка является аэробом или факультативным анаэробом, температурный оптимум для роста 35 – 37 °C (границы роста 15 – 40 °C), оптимальная рН 7,6 – 7,8. К питательным средам не очень требовательна, но лучше растет на средах, содержащих сыворотку или кровь. Избирательными для дифтерийных бактерий являются свернутые сывороточные среды Ру или Леффлера, рост на них появляется через 8 – 12 ч в виде выпуклых, величиной с булавочную головку колоний серовато-белого или желтовато-кремового цвета. Поверхность их гладкая или слегка зернистая, на периферии колонии несколько более прозрачные, чем в центре. Колонии не сливаются, вследствие чего культура приобретает вид шагреневой кожи. На бульоне рост проявляется в виде равномерного помутнения, либо бульон остается прозрачным, а на его поверхности образуется нежная пленка, которая постепенно утолщается, крошится и хлопьями оседает на дно.
Особенностью дифтерийных бактерий является их хороший рост на кровяных и сывороточных средах, содержащих такие концентрации теллурита калия, которые подавляют рост других видов бактерий. Это связано с тем, что C. diphtheriae восстанавливают теллурит калия до металлического теллура, который, откладываясь в микробных клетках, придает колониям характерный темно-серый или черный цвет. Применение таких сред повышает процент высеваемости дифтерийных бактерий (рис. 103).
C. diphtheriae ферментируют глюкозу, мальтозу, галактозу с образованием кислоты без газа, но не ферментируют (как правило) сахарозу, имеют цистиназу, не имеют уреазы и не образуют индола. По этим признакам они отличаются от тех коринеформных бактерий (дифтероидов), которые чаще других встречаются на слизистой оболочке глаза (C. xerosus) и носоглотки (C. pseudodiphtheriticum) и от других дифтероидов (табл. 44).
В природе существуют три основных варианта (биотипа) дифтерийной палочки: gravis, intermedius и mitis. Они различаются по морфологическим, культуральным, биохимическим и другим свойствам (табл. 45).
Деление дифтерийных бактерий на биотипы было произведено с учетом того, при каких формах течения дифтерии у больных они выделяются с наибольшей частотой. Тип gravis чаще выделяется от больных с тяжелой формой дифтерии и вызывает групповые вспышки. Тип mitis вызывает более легкие и спорадические случаи заболеваний, а тип intermedius занимает промежуточное положение между ними. C. belfanti, ранее относимый к биотипу mitis, выделен в самостоятельный, четвертый, биотип. Его главное отличие от биотипов gravis и mitis – способность восстанавливать нитраты в нитриты. Штаммы C. belfanti обладают выраженными адгезивными свойствами, и среди них обнаруживаются как токсигенные, так и нетоксигенные варианты.

Рис. 103. Рост биотипов Corynebacterium diphtheriae на среде с теллуритом:
1 – gravis; 2 – intermedius; 3 – mitis
Таблица 44
Дифференциальные признаки, отличающие C. diphtheriae от некоторых дифтероидов
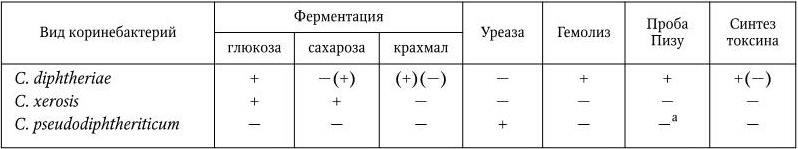
Примечание.(+) – признак положительный; ( – ) – признак отрицательный; (+)( – ) – признак иногда положительный, иногда отрицательный; а – проба Пизу выявляет наличие цистиназы.
Таблица 45
Дифференциальные признаки биотипов gravis, intermedius и mitis
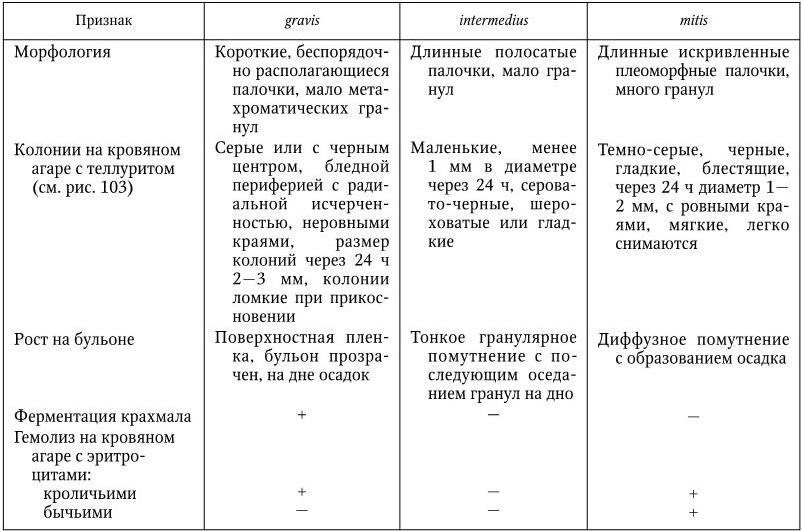
Антигенная структура коринебактерий очень гетерогенна и мозаична. У возбудителей дифтерии всех трех типов обнаружено несколько десятков соматических антигенов, по которым их делят на серотипы. В России принята серологическая классификация, по которой различают 11 серотипов дифтерийных бактерий, из них 7 основных (1 – 7) и 4 дополнительных, редко встречающихся серотипов (8 – 11). Шесть серотипов (1, 2, 3, 4, 5, 7) относятся к типу gravis, а пять (6, 8, 9, 10, 11) – к типу mitis. Недостатком метода серотипирования является то, что многие штаммы, особенно нетоксигенные, обладают спонтанной агглютинацией или полиагглютинабельностью.
Фаготипирование C. diphtheriae. Для дифференциации дифтерийных бактерий предложены различные схемы фаготипирования. По схеме М. Д. Крыловой с помощью набора из 9 фагов (A, B, C, D, F, G, H, I, K) удается типировать большинство токсигенных и нетоксигенных штаммов типа gravis. С учетом чувствительности к указанным фагам, а также культуральных, антигенных свойств и способности синтезировать корицины (бактерицидные белки) М. Д. Крылова выделила 3 самостоятельные группы коринебактерий типа gravis (I – III). В каждой из них имеются подгруппы токсигенных и их нетоксигенных аналогов возбудителей дифтерии.
Резистентность возбудителей дифтерии. C. diphtheriae проявляет большую устойчивость к низким температурам, но быстро погибает при высокой температуре: при 60 °C – в течение 15 – 20 мин, при кипячении – через 2 – 3 мин. Все дезинфицирующие вещества (лизол, фенол, хлорамин и др.) в обычно применяемой концентрации уничтожают ее за 5 – 10 мин. Однако возбудитель дифтерии хорошо переносит высушивание и может долго сохранять жизнеспособность в высохшей слизи, слюне, в частичках пыли. В мелкодисперсном аэрозоле дифтерийные бактерии сохраняют жизнеспособность в течение 24 – 48 ч.
Факторы патогенности. Патогенность C. diphtheriae определяется наличием ряда факторов:
1. Факторов адгезии, колонизации и инвазии. Структуры, ответственные за адгезию, не идентифицированы, однако без них дифтерийная палочка не смогла бы колонизировать клетки. Их роль выполняют какие-то компоненты клеточной стенки возбудителя. Инвазивные свойства возбудителя связаны с гиалуронидазой, нейраминидазой и протеазой.
2. Токсического гликолипида, содержащегося в клеточной стенке возбудителя. Он представляет собой 6,6'-диэфир трегалозы, содержащий коринемиколовую кислоту (С32Н64О3) и коринемиколиновую кислоту (С32Н62О3) в эквимолярных отношениях (трегалозо-6,6'-дикоринемиколат). Гликолипид оказывает разрушающее действие на клетки ткани в месте размножения возбудителя.
3. Экзотоксина, обусловливающего патогенность возбудителя и характер патогенеза заболевания. Нетоксигенные варианты C. diphtheriae дифтерии не вызывают.
Экзотоксин синтезируется в виде неактивного предшественника – единой полипептидной цепи с м. м. 61 кД. Его активация осуществляется собственной бактериальной протеазой, которая разрезает полипептид на два связанные между собой дисульфидными связями пептида: А (м. м. 21 кД) и В (м. м. 39 кД). Пептид В выполняет акцепторную функцию – он распознает рецептор, связывается с ним и формирует внутримембранный канал, через который проникает в клетку пептид А и реализует биологическую активность токсина. Пептид А представляет собой фермент АДФрибозилтрансферазу, который обеспечивает перенос аденозиндифосфатрибозы из НАД на один из аминокислотных остатков (гистидина) белкового фактора элонгации EF-2. В результате модификации EF-2 утрачивает свою активность, и это приводит к подавлению синтеза белка рибосомами на стадии транслокации. Токсин синтезируют только такие C. diphtheriae, которые несут в своей хромосоме гены умеренного конвертирующего профага. Оперон, кодирующий синтез токсина, является моноцистронным, он состоит из 1,9 тыс. пар нуклеотидов и имеет промотор toxP и 3 участка: toxS, toxA и toxB. Участок toxS кодирует 25 аминокислотных остатков сигнального пептида (он обеспечивает выход токсина через мембрану в периплазматическое пространство бактериальной клетки), toxA – 193 аминокислотных остатка пептида А, и toxB – 342 аминокислотных остатка пептида В токсина. Утрата клеткой профага или мутации в tox-опероне делают клетку малотоксигенной. Напротив, лизогенизация нетоксигенных C. diphtheriae конвертирующим фагом превращает их в токсигенные бактерии. Это доказано однозначно: токсигенность дифтерийных бактерий зависит от лизогенизации их конвертирующими tox-коринефагами. Коринефаги интегрируются в хромосому коринебактерий с помощью механизма сайт-специфической рекомбинации, причем штаммы дифтерийных бактерий могут содержать в своих хромосомах по 2 сайта рекомбинации (attB), и коринефаги интегрируются в каждый из них с одинаковой частотой.
Генетический анализ ряда нетоксигенных штаммов дифтерийных бактерий, проведенный с помощью меченых ДНК-зондов, несущих фрагменты tox-оперона коринефага, показал, что в их хромосомах имеются последовательности ДНК, гомологичные tox-оперону коринефага, но они либо кодируют неактивные полипептиды, либо находятся в «молчащем» состоянии, т. е. неактивны. В связи с этим возникает очень важный в эпидемиологическом отношении вопрос: могут ли нетоксигенные дифтерийные бактерии превращаться в токсигенные в естественных условиях (в организме человека), подобно тому, как это происходит in vitro? Возможность подобного превращения нетоксигенных культур коринебактерий в токсигенные с помощью фаговой конверсии была показана в опытах на морских свинках, куриных эмбрионах и белых мышах. Однако происходит ли это в ходе естественного эпидемического процесса (и если происходит, то как часто), пока установить не удалось.
В связи с тем, что дифтерийный токсин в организме больных оказывает избирательное и специфическое воздействие на определенные системы (поражаются в основном симпатико-адреналовая система, сердце, сосуды и периферические нервы), то очевидно, он не только угнетает биосинтез белка в клетках, но и вызывает другие нарушения их метаболизма.
Для обнаружения токсигенности дифтерийных бактерий можно использовать следующие способы:
1. Биологические пробы на животных. Внутрикожное заражение морских свинок фильтратом бульонной культуры дифтерийных бактерий вызывает у них некроз в месте введения. Одна минимальная смертельная доза токсина (20 – 30 нг) убивает морскую свинку весом 250 г при подкожном введении на 4 – 5-й день. Наиболее характерным проявлением действия токсина является поражение надпочечников, они увеличены и резко гиперемированы (см. цв. вкл., рис. 102.4).
2. Заражение куриных эмбрионов. Дифтерийный токсин вызывает их гибель.
3. Заражение культур клеток. Дифтерийный токсин вызывает отчетливый цитопатический эффект.
4. Метод твердофазного иммуноферментного анализа с использованием меченных пероксидазой антитоксинов.
5. Использование ДНК-зонда для непосредственного обнаружения tox-оперона в хромосоме дифтерийных бактерий.
Однако наиболее простым и распространенным способом определения токсигенности дифтерийных бактерий является серологический – метод преципитации в геле. Суть его состоит в следующем. Полоску стерильной фильтровальной бумаги размером 1,5 × 8 см смачивают антитоксической противодифтерийной сывороткой, содержащей 500 АЕ в 1 мл, и наносят на поверхность питательной среды в чашке Петри. Чашку подсушивают в термостате 15 – 20 мин. Исследуемые культуры засевают бляшками по обе стороны от бумажки. На одну чашку засевают несколько штаммов, один из которых, заведомо токсигенный, служит контролем. Чашки с посевами инкубируют при 37 °C, результаты учитывают через 24 – 48 ч. Вследствие встречной диффузии в геле антитоксина и токсина в месте их взаимодействия образуется четкая линия преципитации, которая сливается с линией преципитации контрольного токсигенного штамма (см. рис. 73, с. 288). Полоски неспецифической преципитации (они образуются, если в сыворотке кроме антитоксина присутствуют в небольшом количестве другие антимикробные антитела) появляются поздно, выражены слабо и никогда не сливаются с полоской преципитации контрольного штамма.
Эпидемиология. Единственным источником заражения является человек – больной, выздоравливающий или здоровый бактерионоситель. Заражение происходит воздушно-капельным, воздушно-пылевым путем, а также через различные предметы, бывшие в употреблении у больных или здоровых бактерионосителей: посуда, книги, белье, игрушки и т. п. В случае инфицирования пищевых продуктов (молоко, кремы и т. п.) возможно заражение алиментарным путем. Наиболее массивное выделение возбудителя имеет место при острой форме заболевания. Однако наибольшее эпидемиологическое значение имеют лица со стертыми, нетипичными формами заболевания, так как они часто не госпитализируются и выявляются далеко не сразу. Больной дифтерией заразен в течение всего периода болезни и части периода выздоровления. Средний срок бактерионосительства у выздоравливающих варьирует от 2 до 7 нед., но может продолжаться и до 3 мес.
Особую роль в эпидемиологии дифтерии играют здоровые бактерионосители. В условиях спорадической заболеваемости именно они являются основными распространителями дифтерии, способствуя и сохранению возбудителя в природе. Средняя продолжительность носительства токсигенных штаммов несколько меньше (около 2 мес.), чем нетоксигенных (около 2 – 3 мес.).
Причина формирования здорового носительства токсигенных и нетоксигенных дифтерийных бактерий раскрыта не до конца, так как даже высокий уровень антитоксического иммунитета не всегда обеспечивает полное освобождение организма от возбудителя. Возможно, определенное значение имеет уровень антибактериального иммунитета. Первостепенное эпидемиологическое значение имеет носительство токсигенных штаммов дифтерийных бактерий.
Особенности патогенеза и клиники. К дифтерии восприимчивы люди любого возраста. Возбудитель может проникнуть в организм человека через слизистые оболочки различных органов или через поврежденную кожу. В зависимости от локализации процесса различают дифтерию зева, носа, гортани, уха, глаза, половых органов и кожи. Возможны смешанные формы, например дифтерия зева и кожи и т. п. Инкубационный период – 2 – 10 дней. При клинически выраженной форме дифтерии в месте локализации возбудителя развивается характерное фибринозное воспаление слизистой оболочки. Токсин, вырабатываемый возбудителем, сначала поражает эпителиальные клетки, а затем близлежащие кровеносные сосуды, повышая их проницаемость. В выходящем экссудате содержится фибриноген, свертывание которого приводит к образованию на поверхности слизистой оболочки серовато-белого цвета пленчатых налетов, которые плотно спаяны с подлежащей тканью и при отрыве от нее вызывают кровотечение. Следствием поражения кровеносных сосудов может быть развитие местного отека. Особенно опасной является дифтерия зева, так как она может стать причиной дифтерийного крупа вследствие отека слизистой оболочки гортани и голосовых связок, от которого раньше погибало в результате асфиксии 50 – 60 % больных дифтерией детей. Дифтерийный токсин, поступая в кровь, вызывает общую глубокую интоксикацию. Он поражает преимущественно сердечно-сосудистую, симпатико-адреналовую системы и периферические нервы. Таким образом, клиника дифтерии складывается из сочетания местных симптомов, зависящих от локализации входных ворот, и общих симптомов, обусловленных отравлением токсином и проявляющихся в виде адинамии, вялости, бледности кожных покровов, понижения кровяного давления, миокардита, паралича периферических нервов и других нарушений. Дифтерия у привитых детей, если и наблюдается, протекает, как правило, в легкой форме и без осложнений. Летальность в период до применения серотерапии и антибиотиков составляла 50 – 60 %, ныне – 3 – 6 %.
Постинфекционный иммунитет прочный, стойкий, фактически пожизненный, повторные случаи заболевания наблюдаются редко – у 5 – 7 % переболевших. Иммунитет носит главным образом антитоксический характер, меньшее значение имеют антимикробные антитела.
Для оценки уровня противодифтерийного иммунитета ранее широко применялась проба Шика. С этой целью внутрикожно детям вводилась 1/40 Dlm токсина для морской свинки в объеме 0,2 мл. При отсутствии антитоксического иммунитета через 24 – 48 ч на месте введения появляется краснота и припухлость диаметром более 1 см. Такая положительная реакция Шика свидетельствует либо о полном отсутствии антитоксина, либо о том, что его содержание составляет менее 0,001 АЕ/мл крови. Отрицательная реакция Шика наблюдается, когда содержание антитоксина в крови выше 0,03 АЕ/мл. При содержании антитоксина ниже 0,03 АЕ/мл, но выше 0,001 АЕ/мл реакция Шика может быть или положительной, или, иногда, отрицательной. Кроме того, сам токсин обладает выраженным аллергенным свойством. Поэтому для определения уровня противодифтерийного иммунитета (количественное содержание антитоксина) лучше пользоваться РПГА с эритроцитарным диагностикумом, сенсибилизированным дифтерийным анатоксином.
Лабораторная диагностика. Единственным методом микробиологической диагностики дифтерии является бактериологический, с обязательной проверкой выделенной культуры коринебактерий на токсигенность. Бактериологические исследования на дифтерию проводят в трех случаях:
1) для диагностики дифтерии у детей и взрослых с острыми воспалительными процессами в области зева, носа, носоглотки;
2) по эпидемическим показаниям лиц, находившихся в контакте с источником возбудителя дифтерии;
3) лиц, вновь поступающих в детские дома, ясли, школы-интернаты, другие специальные учреждения для детей и взрослых, с целью выявления среди них возможных бактерионосителей дифтерийной палочки.
Материалом для исследования служат слизь из зева и носа, пленка с миндалин или других слизистых оболочек, являющихся местом входных ворот возбудителя. Посевы производят на теллуритовые сывороточные или кровяные среды и одновременно на свернутые сывороточные среды Ру (свернутая лошадиная сыворотка) или Леффлера (3 части бычьей сыворотки + 1 часть сахарного бульона), на которых рост коринебактерий появляется уже через 8 – 12 ч. Выделенную культуру идентифицируют по совокупности морфологических, культуральных и биохимических свойств, по возможности используют методы серо– и фаготипирования. Во всех случаях обязательна проверка на токсигенность одним из указанных выше методов. Морфологические особенности коринебактерий лучше изучать, используя три метода окрашивания препарата-мазка: по Граму, Нейссеру и метиленовым синим (или толуидиновым синим).
Лечение. Специфическим средством лечения дифтерии является применение противодифтерийной антитоксической сыворотки, содержащей не менее 2000 МЕ в 1 мл. Сыворотку вводят внутримышечно в дозах от 10 000 до 400 000 МЕ в зависимости от тяжести течения болезни. Эффективным методом лечения является применение антибиотиков (пенициллины, тетрациклины, эритромицин и др.) и сульфаниламидных препаратов. С целью стимулирования выработки собственных антитоксинов можно использовать анатоксин. Для освобождения от бактерионосительства следует использовать те антибиотики, к которым данный штамм коринебактерий высокочувствителен.
Специфическая профилактика. Основным методом борьбы с дифтерией является массовая плановая вакцинация населения. С этой целью используют различные варианты вакцин, в том числе комбинированные, т. е. направленные на одновременное создание иммунитета против нескольких возбудителей. Наибольшее распространение в России получила вакцина АКДС. Она представляет собой адсорбированную на гидроокиси алюминия взвесь коклюшных бактерий, убитых формалином или мертиолятом (20 млрд в 1 мл), и содержит дифтерийный анатоксин в дозе 30 флоккулирующих единиц и 10 единиц связывания столбнячного анатоксина в 1 мл. Вакцинируют детей с 3-месячного возраста, а затем проводят ревакцинации: первую через 1,5 – 2 года, последующие в возрасте 9 и 16 лет, а далее через каждые 10 лет.
Благодаря массовой вакцинации, начатой в СССР в 1959 г., заболеваемость дифтерией в стране к 1966 г. по сравнению с 1958 г. была снижена в 45 раз, а ее показатель в 1969 г. составил 0,7 на 100 000 населения. Последовавшее в 80-х гг. ХХ в. снижение объема прививок привело к тяжелым последствиям. В 1993 – 1996 гг. Россию охватила эпидемия дифтерии. Болели взрослые, в основном не получившие прививок, и дети. В 1994 г. было зарегистрировано почти 40 тыс. больных. В связи с этим была возобновлена массовая вакцинация. В этот период были привиты 132 млн человек, в том числе 92 млн взрослых. В 2000 – 2001 гг. охват детей прививками в установленный срок составил 96 %, а ревакцинацией – 94 %. Благодаря этому уровень заболеваемости дифтерией в 2001 г. снизился по сравнению с 1996 г. в 15 раз. Однако для того чтобы довести уровень заболеваемости до единичных случаев, необходимо охватить вакцинацией не менее 97 – 98 % детей первого года жизни и обеспечить в последующие годы массовую ревакцинацию. Добиться полной ликвидации дифтерии в ближайшие годы вряд ли возможно из-за распространенного носительства токсигенных и нетоксигенных дифтерийных бактерий. Для решения этой проблемы также потребуется определенное время.
Микробиология коклюша и паракоклюша
Коклюш – острое инфекционное заболевание преимущественно детского возраста, характеризующееся циклическим течением и приступообразным спазматическим кашлем.
Возбудитель – Bordetella pertussis – впервые был обнаружен в 1900 г. в мазках из мокроты ребенка и затем выделен в чистой культуре в 1906 г. Ж. Борде и О. Жангу. Возбудитель сходного с коклюшем, но протекающего более легко заболевания – Bordetella parapertussis – был выделен и изучен в 1937 г. Г. Эльдерингом и П. Кендриком и независимо от них в 1937 г. У. Брэдфордом и Б. Славиным. Bordetella bronchiseptica, возбудитель редко встречающегося у человека коклюшеподобного заболевания, был выделен в 1911 г. у собак Н. Ферри, а у человека – в 1926 г. Брауном. В 1984 г. был выделен новый вид – Bordetella avium, патогенность которого для человека пока не установлена.
Бордетеллы относятся к классу Betaproteobacteria, грамотрицательны, хорошо окрашиваются всеми анилиновыми красителями. Иногда выявляется биполярная окраска за счет зерен волютина на полюсах клетки. Возбудитель коклюша имеет форму овоидной палочки (коккобактерии) размером 0,2 – 0,5 × 1,0 – 1,2 мкм. Паракоклюш-
ная палочка имеет такую же форму, но несколько крупнее (0,6 × 2 мкм). Расположены чаще поодиночке, но могут располагаться попарно. Спор не образуют, у молодых культур и у бактерий, выделенных из макроорганизма, обнаруживается капсула. Бордетеллы неподвижны, за исключением B. bronchiseptica, которая является перитрихом. Содержание Г + Ц в ДНК составляет 61 – 70 мол %. Относятся к гемофильным бактериям. Бордетеллы – строгие аэробы, хемоорганотрофы. Оптимальная температура роста – 35 – 36 °C. Возбудитель коклюша в гладкой S-форме (так называемая фаза I), в отличие от двух других видов бордетелл, не растет на МПБ и МПА, так как его размножению мешают накопление в среде ненасыщенных жирных кислот, образующихся в процессе роста, а также возникающая при росте коллоидная сера и другие продукты метаболизма. Для их нейтрализации (или адсорбции) в среду выращивания коклюшных бактерий необходимо добавлять крахмал, альбумин и древесный уголь или ионообменные смолы. Микроб требует наличия в среде выращивания 3 аминокислот – пролина, цистеина и глутаминовой кислоты, источником которых служат гидролизаты казеина или фасоли. Традиционная среда для выращивания коклюшной палочки – среда Борде – Жангу (картофельно-глицериновый агар с добавлением крови), на ней она растет в виде гладких, блестящих, прозрачных куполообразных с жемчужным или металлическим ртутным оттенком колоний диаметром около 1 мм, которые вырастают на 3 – 4-й день. На другой среде – казеиново-угольном агаре (КУА) – также на 3 – 4-й день вырастают гладкие выпуклые колонии диаметром около 1 мм, имеющие серовато-кремовый цвет и вязкую консистенцию. Колонии паракоклюшных бактерий по внешнему виду не отличаются от коклюшных, но крупнее и выявляются на 2 – 3-й день, а колонии B. bronchiseptica выявляются уже на 1 – 2-й день.
Характерной особенностью коклюшных бактерий является их наклонность к быстрому изменению культуральных и серологических свойств при изменении состава питательной среды, температуры и других условий выращивания. В процессе перехода от S-формы (фаза I) к стабильной шероховатой R-форме (фаза IV) через промежуточные фазы II и III наблюдаются плавные изменения антигенных свойств;
патогенные свойства теряются.
Паракоклюшные бактерии и B. bronchiseptica, а также фазы II, III и IV коклюшных бактерий растут на МПА и МПБ. При выращивании на жидкой среде наблюдается диффузное помутнение с придонным плотным осадком; клетки могут быть несколько крупнее и полиморфными, иногда образуют нити. В R-форме и промежуточных формах бактерии проявляют выраженный полиморфизм.
На среде Борде – Жангу все бордетеллы образуют вокруг колоний нерезко ограниченную зону гемолиза, распространяющуюся диффузно в среду.
Бордетеллы не ферментируют углеводов, не образуют индола, не восстанавливают нитраты в нитриты (за исключением B. bronchiseptica). Паракоклюшные бактерии выделяют тирозиназу, образуя пигмент, окрашивающий среду и культуру в коричневый цвет. Дифференциальные признаки бордетелл приведены в табл. 46.
Бордетеллы содержат несколько антигенных комплексов. Соматический О-антиген видоспецифичен (см. табл. 43); родовым антигеном является агглютиноген 7. Главные агглютиногены у возбудителя коклюша – 7-й (родовой), 1-й (видовой) и наиболее часто обнаруживаемые типоспецифические 2-й и 3-й. В зависимости от их сочетания у Bordetella pertussis выделяют четыре сероварианта: 1, 2, 3; 1, 2, 0; 1, 0, 3 и 1, 0, 0.
Факторы патогенности. Фимбрии (агглютиногены), белок наружной мембраны пертактин (69 кД) и филаментозный гемагглютинин (поверхностный белок) отвечают за адгезию возбудителя на цилиарном эпителии средних отделов респираторного тракта (трахея, бронхи). Капсула защищает от фагоцитоза. Часто присутствуют гиалуронидаза, лецитиназа, плазмокоагулаза, аденилатциклаза. В составе эндотоксина
Таблица 46
Дифференциальные признаки бордетелл
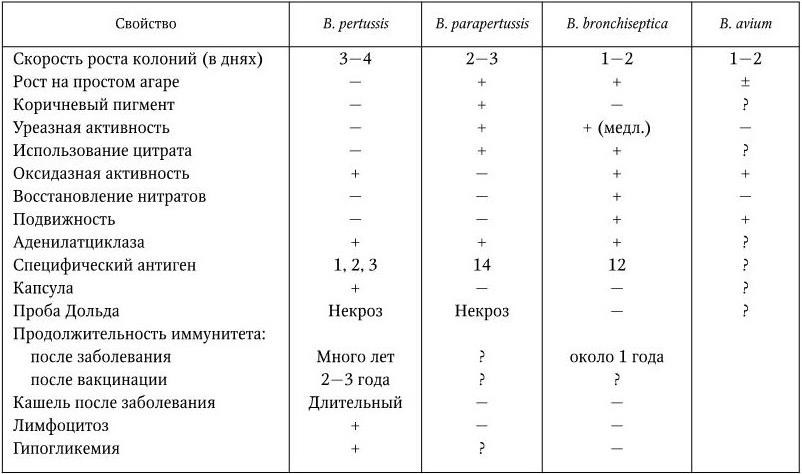
Примечание. (+) – признак положительный; ( – ) – признак отрицательный; (±) – признак иногда положительный, иногда отрицательный; (?) – нет данных.
(ЛПС) два липида: А и Х. Биологическая активность ЛПС определяется липидом Х, липид А обладает низкой пирогенностью и нетоксичен. ЛПС обладает иммуногенностью (цельноклеточная вакцина), но вызывает сенсибилизацию. Имеются три экзотоксина. Коклюшный токсин (117 кД) по структуре и функции подобен холерогену, проявляет активность АДФ-рибозилтрансферазы (рибозилирует трансдуцин – белок мембраны клетки-мишени, являющийся частью системы, ингибирующей клеточную аденилатциклазу), сильный иммуноген, повышает лимфоцитоз и выработку инсулина. Трахеальный цитотоксин представляет собой фрагмент пептидогликана, обладает пирогенностью, артритогенностью, индуцирует медленноволновой сон и стимулирует продукцию IL-1, в ответ на который синтезируется оксид азота (цитотоксический фактор). Повреждает эпителиальные клетки трахеи и вызывает цилиостаз. Термолабильный дермонекротоксин обладает нейротропностью, сосудосуживающей активностью, гомологичен цитотоксическому некротизирующему фактору 1 (CNF1) кишечной палочки. Мишенью его являются Rho-белки мембран клеток. Обнаруживают дермонекротоксин внутрикожной пробой на кроликах (проба Дольда).
Эпидемиология. Источник инфекции при коклюше и паракоклюше – больной типичной или стертой формой, особенно в период до появления спазматического кашля. При коклюшеподобном заболевании, вызванном B. bronchiseptica, источником инфекции могут быть домашние и дикие животные, среди которых иногда наблюдаются эпизоотии (свиньи, кролики, собаки, кошки, крысы, морские свинки, обезьяны), при этом чаще всего у животного поражается респираторный тракт. Механизм заражения – воздушно-капельный. Бордетеллы обладают специфическим тропизмом к цилиарному эпителию респираторного тракта хозяина. К инфекции восприимчивы люди всех возрастов, но более всего дети от 1 года до 10 лет.
Патогенез и клиника. Инкубационный период при коклюше от 3 до 14 дней, чаще 5 – 8 дней. Возбудитель, попавший на слизистую оболочку верхних дыхательных путей, размножается в клетках цилиарного эпителия и далее бронхогенным путем распространяется в более низкие отделы (бронхиолы, альвеолы, мелкие бронхи). При действии экзотоксина эпителий слизистой оболочки некротизируется, в результате чего раздражаются кашлевые рецепторы и создается постоянный поток сигналов в кашлевой центр продолговатого мозга, в котором формируется стойкий очаг возбуждения. Это приводит к возникновению спазматических приступов кашля. Бактериемии при коклюше не бывает. Вторичная бактериальная флора может приводить к осложнениям.
В течении заболевания выделяют следующие стадии: 1) катаральный период, длящийся около 2 нед. и сопровождающийся сухим кашлем; состояние больного постепенно ухудшается; 2) конвульсивный (судорожный), или спазматический, период, длящийся до 4 – 6 нед. и характеризующийся возникающими до 20 – 30 раз в сутки приступами неукротимого «лающего» кашля, причем приступы могут быть спровоцированы даже неспецифическими раздражителями (свет, звук, запах, медицинские манипуляции, осмотр и т. д.); 3) период разрешения, когда приступы кашля становятся реже и все менее продолжительными, отторгаются некротизированные участки слизистой оболочки верхних дыхательных путей, часто в виде «слепков» с трахеи и бронхов; продолжительность – 2 – 4 нед.
Иммунитет. После перенесенного заболевания формируется стойкий пожизненный иммунитет; поствакцинальный иммунитет сохраняется всего 3 – 5 лет.
Лабораторная диагностика. Основными методами диагностики являются бактериологический и серологический; для ускоренной диагностики, особенно на ранней стадии болезни, может быть использована реакция иммунофлуоресценции. Для выделения чистой культуры в качестве материала используют слизь из носоглотки или мокроту, которые высевают на КУА или среду Борде – Жангу. Посев также может быть сделан методом «кашлевых пластинок». Выросшую культуру идентифицируют по совокупности культуральных, биохимических и антигенных свойств. Серологические реакции – агглютинации, связывания комплемента, пассивной гемагглютинации – ставятся в основном для ретроспективной диагностики коклюша или в тех случаях, когда не выделена чистая культура. Антитела к возбудителю появляются не ранее 3-й нед. заболевания, диагноз подтверждается возрастанием титра антител в сыворотках, взятых с 1 – 2-недельным интервалом. У детей первых двух лет жизни серологические реакции часто бывают отрицательными.
Специфическая профилактика и лечение. Для плановой профилактики коклюша у детей используют адсорбированную коклюшно-дифтерийно-столбнячную вакцину (АКДС), содержащую 20 млрд убитых коклюшных бактерий в 1 мл. На этом же компоненте основана выпускаемая отдельно убитая коклюшная вакцина, применяемая в детских коллективах по эпидемиологическим показаниям. Этот компонент реактогенен (нейротоксическое свойство), поэтому сейчас активно изучаются бесклеточные вакцины, содержащие от 2 до 5 компонентов (коклюшный анатоксин, филаментозный гемагглютинин, пертактин и 2 агглютиногена фимбрий). Для лечения применяют антибиотики (гентамицин, ампициллин), эффективные в катаральном и бесполезные в судорожном периоде заболевания.
Палочка инфлюэнцы – Haemophilus influenzae – часто присутствует на слизистой оболочке верхних дыхательных путей здорового человека. При ослаблении устойчивости организма она может вызвать менингит (особенно у ослабленных детей), бронхит, пневмонию, гнойный плеврит, трахеит, ларингит, конъюнктивит, отит и другие заболевания.
Возбудитель был открыт М. И. Афанасьевым (1891) и описан Р. Пфейффером и С. Китазато в 1892 г. во время пандемии гриппа, причиной которого палочка инфлюэнцы ошибочно считалась более 40 лет.
Род Haemophilus входит в состав семейства Pasteurellaceae и состоит из 16 видов. Для человека патогенны два вида: H. influenzae – возбудитель воспалительных процессов дыхательных путей, и H. ducreyi – возбудитель мягкого шанкра; эта болезнь в России с 1961 г. не обнаруживается.
Гемофилы – короткие палочки кокковидной формы размерами 0,3 – 0,4 × 1,0 – 1,5 мкм (см. цв. вкл., рис. 104). Иногда располагаются короткими цепочками, чаще – поодиночке. Они очень полиморфны, могут образовывать нити, что зависит от условий культивирования; неподвижны, спор не имеют. Палочка инфлюэнцы в организме и в первых генерациях на питательных средах может иметь капсулу. Бактерии медленно окрашиваются анилиновыми красителями: фуксином Пфейффера прокрашиваются в течение 5 – 15 мин.
Бактерии рода Haemophilus относятся к группе гемофильных. Они требуют для культивирования богатые питательные среды, обычно содержащие кровь или ее препараты. Для их роста требуется наличие в среде гемина или некоторых других порфиринов (Х-фактор) и (или) никотинамидадениндинуклеотида (V-фактор). Установлено, что из 16 известных представителей рода Haemophilus 2 вида (H. influenzae и H. haemolyticus) требуют наличия одновременно Х-фактора и V-фактора, 4 вида требуют только Х-фактора и 10 видов – только V-фактора. Х-фактор термостабилен, и в качестве его источников используют кровь различных животных или водный раствор хлористого гематина. V-фактор термолабилен и содержится в тканях растений, животных, вырабатывается многими бактериями.
Палочка инфлюэнцы – факультативный анаэроб, оптимальная температура для ее роста 37 °C. Содержание Г + Ц в ДНК составляет 39 – 42 мол %. На «шоколадном» агаре (агаре с прогретой кровью) колонии палочки инфлюэнцы вырастают через 36 – 48 ч и достигают диаметра 1 мм. На кровяном агаре с добавлением сердечно-мозгового экстракта через сутки вырастают мелкие, округлые, выпуклые колонии с радужными переливами. Гемолиз отсутствует. У колоний бескапсульных вариантов радужная расцветка отсутствует. На жидких средах с добавлением крови наблюдается диффузный рост, иногда образуются белесые хлопья и осадок на дне.
Специфической особенностью палочек инфлюэнцы является способность их колоний вырастать гораздо быстрее и быть крупнее вблизи колоний стафилококков или других бактерий («спутниковый», или сателлитный, рост). Пневмококки же являются ингибиторами роста палочки инфлюэнцы.
Сахаролитические свойства выражены слабо и непостоянны. Обычно ферментирует с образованием кислоты рибозу, галактозу и глюкозу, обладает уреазной активностью, имеет щелочную фосфотазу, восстанавливает нитраты в нитриты. По способности образовывать уреазу, индол и орнитиндекарбоксилазу H. influenzae подразделяют на шесть биотипов (I – VI).
Капсульные штаммы палочки инфлюэнцы по специфичности полисахаридного антигена делятся на 6 серовариантов: a, b, c, d, e, f. Этот антиген иногда дает перекрестную реакцию с антигенами капсульных пневмококков. Капсульный полисахаридный антиген обнаруживается по реакции набухания капсулы, РИФ, реакции преципитации в агаре. От больных людей чаще выделяется серовар b. Кроме капсульного антигена у возбудителя инфлюэнцы имеется соматический антиген, в составе которого обнаружены термостабильный и термолабильный протеины.
Экзотоксинов палочка инфлюэнцы не продуцирует, патогенность ее связана с термостабильным эндотоксином, выделяющимся при разрушении бактериальных клеток. Инвазивность и подавление фагоцитоза связаны с наличием капсулы.
Во внешней среде возбудитель малоустойчив, быстро погибает под действием прямых солнечных и ультрафиолетовых лучей и дезинфицирующих веществ в обычных рабочих концентрациях. При температуре 60 °C он погибает в течение 5 – 10 мин.
Эпидемиология. Источником инфекции при заболеваниях, вызванных палочкой инфлюэнцы, служат больные люди; капсульные штаммы в этом случае передаются от человека к человеку воздушно-капельным путем. Часто заболевание развивается как проявление аутоинфекции при снижении реактивности организма на фоне какого-либо другого заболевания, например гриппа. Палочка инфлюэнцы у здоровых людей обнаруживается не только на слизистой оболочке верхних дыхательных путей, но и в полости рта, среднего уха, иногда на слизистой оболочке влагалища.
Патогенез и клиника связаны прежде всего с особенностями возбудителя (имеется капсула или нет), а также с основным заболеванием, на фоне которого снижается резистентность макроорганизма. Палочка инфлюэнцы может размножаться на слизистых оболочках как вне-, так и внутриклеточно, иногда проникая в кровь. В этом случае возбудитель может далее проникнуть через гематоэнцефалический барьер и вызвать менингит. Палочка инфлюэнцы, наряду с менингококками и пневмококками, относится к наиболее частым возбудителям менингита. Летальность при таком нелеченном менингите может достигать 90 %. Клиника определяется доминирующими в каждом конкретном случае симптомами в зависимости от степени поражения того или иного органа.
Иммунитет. Дети первых трех месяцев жизни мало восприимчивы к возбудителю инфлюэнцы, так как у них в сыворотке присутствуют антитела, переданные через плаценту от матери. Впоследствии они исчезают, и ребенок становится восприимчив к возбудителю. Инфекция может протекать бессимптомно или с поражением респираторного тракта. Менингиты чаще всего развиваются у детей в возрасте от 6 мес. до 3 лет. К 3 – 5 годам у многих детей появляются комплементсвязывающие и бактерицидные антитела к капсульному полисахаридному антигену (полирибозофосфату).
Лабораторная диагностика. Для диагностики заболеваний, вызванных палочкой инфлюэнцы, используют РИФ, бактериологический метод и серологические реакции. При достаточной концентрации возбудителя в исследуемом материале (гной, слизь, ликвор) он легко и быстро может быть обнаружен с помощью реакции набухания капсулы и РИФ; ликвор можно также исследовать с помощью метода встречного иммуноэлектрофореза. Чистую культуру выделяют посевом материала на специальные питательные среды («шоколадный» агар, среда Левинталя, сердечно-мозговой агар); типичные колонии идентифицируют по реакции набухания капсулы, потребности в факторах роста и другим тестам (биохимические свойства, реакции преципитации в агаре и др.). Для серологической диагностики могут быть использованы реакции агглютинации и преципитации.
Специфическая профилактика и лечение. Для профилактики используют вакцину из капсульного полисахарида (полирибозофосфата). В настоящее время болезни, вызываемые Haemophilus influenzae типа b, рассматривают в качестве кандидатов на искоренение. Для лечения наиболее эффективны аминогликозиды, левомицетин, сульфаниламиды, однако у выделенных возбудителей необходимо определять степень чувствительности к антибиотикам.
Листерии, легионеллы и вызываемые ими болезни
Листерии были открыты в 1926 г. Э. Мюрреем, а название Listeria monocytogenes было дано в 1940 г. Ж. Пири из-за того, что возбудитель вызывает у зараженных животных резкое увеличение количества моноцитов в крови. У человека листериоз – заболевание, характеризующееся пестрой клинической картиной, в том числе поражением нервной системы, лимфатических узлов и септицемией. Листерии по новой классификации относят к классу Bacilli.
Листерия – прямая или слегка изогнутая коккобактерия размером 0,3 – 0,5 × 1 – 2 мкм, спор и капсул не образует, грамположительна. В старых культурах могут встречаться более длинные палочки и нити. В препаратах они часто располагаются параллельно или под углом друг к другу, группами или одиночно. Палочки имеют 1 – 4 жгутика, прикрепленных к боковой поверхности клетки, реже к ее концу. Подвижность листерий лучше выражена при культивировании в условиях комнатной температуры. Листерии легко культивируются на обычных слабощелочных питательных средах, но рост получается необильный. Суточные колонии на питательном агаре мелкие, круглые, слабовыпуклые, с ровным краем, полупрозрачные, слабоокрашенные в проходящем свете. На бульоне рост в виде слабого помутнения среды. Лучше растут на средах с добавлением крови, при этом вокруг колоний образуется узкая зона β-гемолиза. Селективная среда для выделения листерий – кровяной агар с трипафлавином и налидиксовой кислотой. Они хорошо растут при низких температурах, оптимальная температура 37 °C, рН 7,0 – 7,2. При культивировании на искусственных питательных средах происходит диссоциация листерий и превращение их из вирулентной S-формы в маловирулентную R-форму. При этом палочки становятся несколько длиннее и грубее, среди них часто обнаруживаются нитевидные формы; колонии становятся более крупными и менее прозрачными, с шероховатой или бугристой поверхностью и неровным с зубцевидными выступами или ветвистым краем. Отдельные штаммы могут утратить подвижность.
Листерии ферментируют до молочной кислоты без газа глюкозу, мальтозу, рамнозу, левулезу, салицин, медленно – сахарозу, глицерин, лактозу (не все штаммы); не потребляют маннит (за исключением представителей вида L. grayi), дульцит, арабинозу, сорбит; индола не образуют, молоко не свертывают, желатин не разжижают, сероводорода не образуют на обычных средах, но выделяют его на среде с достаточным количеством серусодержащих аминокислот (например, на бульоне Хоттингера); нитраты в нитриты не восстанавливают.
Известны 7 серовариантов листерий, различающихся набором жгутиковых Н– и соматических О-антигенов. Среди сероваров 1, 3 и 4 выделено несколько подсероваров, особенно много их выделено у серовара 4. Наиболее часто встречаются серовар 1 и подсеровар 4b. Один и тот же серовар может обнаруживаться у самых различных животных, а также у человека без какой-либо специфичности для определенного вида хозяина. В составе листерий имеются перекрестно реагирующие антигены, родственные антигенам стафилококков и стрептококков.
У листерий известно явление бактериофагии. Фаги избирательно лизируют штаммы, относящиеся к разным сероварам.
Важнейшими факторами патогенности листерий являются β– и α-гемолизины и моноцитозстимулирующий фактор. β-Гемолизин – термолабильный секретируемый белок, чувствительный к кислороду, вызывает лизис эритроцитов человека и кролика в толще питательной среды (аналогичен О-стрептолизину стрептококка); α-гемолизин – термостабильный секретируемый белок, вызывает гемолиз эритроцитов человека и лошади, обладает функцией лецитиназы. Моноцитозстимулирующий фактор – термостабильный белок, связанный с клеточной стенкой листерий, выделяется при разрушении бактерий. Листерии могут также продуцировать плазмокоагулазу, фибринолизин, протеазы и некоторые другие ферменты.
Резистентность. Термическая обработка кипячением убивает листерии в течение 3 мин. Во внешней среде они довольно устойчивы. В почве или в воде сохраняются при умеренных или низких температурах месяцами и даже годами, а при благоприятных условиях даже размножаются. На зерне листерии могут сохраняться при низких температурах до 3 лет. Бактерии интенсивно размножаются в молоке и мясе, причем размножение может происходить и при низких (4 – 6 °C) температурах хранения этих продуктов. При температуре 70 °C погибают через 20 – 30 мин. В зимнее время листерии могут длительно сохраняться в замороженных трупах грызунов, в соломе и других объектах. Дезинфицирующие химические вещества – диоцид, хлоргексидин, фенол – в обычных концентрациях действуют на листерии губительно. Этанол, 5 % раствор лизола и 2,5 % раствор формалина малоэффективны.
Эпидемиология. Листериями могут быть инфицированы домашние и дикие животные различных видов, в том числе мыши, крысы, кролики, куры, кошки, собаки, свиньи, коровы, овцы. У животных листериоз может протекать латентно, но возбудитель выделяется в больших количествах с мочой, испражнениями, носовой слизью, молоком, околоплодной жидкостью. Человек заражается при употреблении мяса (особенно свинины) и молока больных животных, а также загрязненной пищи и воды. Заражение возможно и при контакте с больными животными; при вдыхании пыли, содержащей листерии (при обработке шкур, шерсти, уходе за животными). Возможен и половой путь передачи при листерийных уретритах у мужчин.
Распространены листерии повсеместно, во всех природных зонах. Листерии относятся к категории факультативных паразитов (т. е. могут существовать и как сапрофиты, и как паразиты). Для вызываемых ими болезней предложен термин «сапрозоонозы» (Г. П. Сомов). Наиболее восприимчивы к заболеванию дети, а среди взрослых – лица с иммунодефицитами.
Патогенез и клиника. Листерии проникают в организм человека через слизистые оболочки полости рта, глаз, носа, поврежденную кожу. Далее по лимфатическим путям они попадают в лимфатические узлы, затем в кровь и различные органы (печень, головной мозг, селезенку, через плаценту в плод). В местах скопления листерий образуются гранулемы с участками некроза в центре. Инкубационный период 3 – 45 дней, чаще 18 – 20 дней. В зависимости от преобладающего поражения тех или иных органов выделяют висцеральную, железистую, нервную, смешанную формы заболевания. Чаще встречается висцеральная форма; железистая протекает в двух вариантах – глазо-железистая или ангинозно-железистая форма. Тяжелее всего протекает нервная форма, сопровождающаяся явлениями менингита, менингоэнцефалита, энцефалита; летальность при ней достигает 50 % (при отсутствии лечения). При заболевании у беременных происходит трансплацентарное инфицирование плода, что приводит к прерыванию беременности, мертворождению, уродствам плода.
Иммунитет после перенесенного заболевания имеет клеточный (Т-киллеры, макрофаги) и гуморальный характер (IgM и IgG), непрочный. При заболевании наблюдается аллергизация организма.
Лабораторная диагностика. Основу диагностики листериоза составляют бактериологический, серологический методы и реакция иммунофлуоресценции.
Материалом для исследования являются слизь из зева, кровь, пунктат из лимфатического узла, гнойное отделяемое глаз, ликвор, секционный материал. Выделение чистой культуры проводят на простых питательных средах (МПА с 0,05 % теллурита калия или МПБ с 1 – 5 мкг/мл полимиксина). Если материал сильно загрязнен посторонней микрофлорой, сначала заражают белых мышей или морских свинок, а затем после их гибели из внутренних органов (печень, селезенка) делают посевы. Листерии легче выделяются, если до посева исследуемый материал хранится несколько недель при температуре 4 °C. Идентификацию свежевыделенной культуры осуществляют на основании совокупности следующих признаков: бактерии в виде коротких грамположительных палочек, подвижны; ферментируют углеводы с образованием кислоты; положительная проба на каталазу и другие типичные биохимические тесты; положительная конъюнктивальная проба на морской свинке; агглютинация специфической сывороткой.
Для серологической диагностики используют реакции агглютинации, РПГА, РСК, которые становятся положительными со 2-й нед. заболевания. При низком титре антител реакцию следует повторить для установления нарастания их титра. При постановке реакции агглютинации следует предварительно сыворотку больного истощить культурами стафилококков и стрептококков (энтерококков) для адсорбции перекрестно реагирующих антител.
Для диагностики листериоза может использоваться аллергическая проба со стандартным корпускулярным антигеном или антигеном, полученным путем кислотного гидролиза. Внутрикожно вводят 0,1 мл антигена, результат учитывают через 24 – 48 ч; в основе пробы лежит ГЧЗ. Эта проба обычно ставится больным со слабоположительными серологическими реакциями.
Специфическая профилактика и лечение. Специфическая профилактика не разработана. Общая профилактика включает: раннее выявление, изоляцию и лечение больных листериозом домашних животных, захоронение их трупов; дезинфекцию и дератизацию в очаге; соблюдение правил личной гигиены, особенно людьми, работающими в животноводстве и пищевой промышленности; употребление только кипяченого молока, а мяса – после тщательной термической обработки; раннюю диагностику листериоза у беременных и полноценное их лечение. Для лечения используют антибиотики широкого спектра действия (тетрациклин, эритромицин, левомицетин) при всех клинических формах. При листериозном менингите и для лечения беременных и новорожденных хороший эффект дает применение антибиотиков пенициллинового ряда.
Заслуга выделения возбудителя болезни легионеров (легионеллеза) и доказательства его этиологической роли принадлежит сотрудникам Центра по контролю заболеваемости в г. Атланта (США) Дж. Мак-Дейду и С. Шепарду, которым в 1977 г. удалось из легочной ткани умерших от специфической пневмонии людей выделить неизвестный ранее микроб. Открытие нового широко распространенного инфекционного заболевания и еще не известного науке возбудителя само по себе является фактом в достаточной мере сенсационным. Легионеллы отнесены к классу Gammaproteobacteria, выделены в семейство Legionellaceae с двумя родами – Legionella и Tatlockia. В роде Legionella известно около 40 видов, разделенных более чем на 60 серологических групп. Они различаются по пигментообразованию, способности размножаться в определенных питательных средах, продуцировать β-лактамазу, вызывать аутофлуоресценцию, по наличию оксидазы.
Легионеллез – острое инфекционное заболевание, проявляющееся интоксикацией, лихорадкой, пневмонией, а также поражением дыхательных путей, желудочно-кишечного тракта, почек и центральной нервной системы.
Возбудитель легионеллеза – Legionella pneumophilia – грамотрицательная палочка размерами 0,3 – 0,4 × 2 – 3 мкм, иногда до 8 – 20 и даже до 50 мкм. Имеются липидные включения. Характерной особенностью легионелл является резко выраженная в ряде случаев заостренность концов их клеток. Они подвижны, несколько жгутиков располагаются полярно, биполярно или перитрихиально; спор и капсул не образуют, склонны к полиморфизму, иногда красятся грамположительно. Размер геномной ДНК легионелл составляет 2,5 · 103 МД, содержание Г + Ц составляет 39 мол %. Легионеллы – факультативные внутриклеточные паразиты.
Условия культивирования легионелл имеют ряд особенностей. На простых средах они не растут, требуют создания специальных условий. Их можно культивировать на средах с добавлением биологических жидкостей, гемоглобина, пирофосфата железа, изовиталекса; лучше растут в присутствии 5 % СО2; температурные границы роста 25 – 42 °C, оптимальная температура 35 – 37 °C. Видимые колонии на плотной питательной среде вырастают на 3-и сут., достигают диаметра 3 – 4 мм на 5 – 7-е сут. инкубации при 35 °C. Колонии округлые, выпуклые, сероватого оттенка, блестящие, имеют ровные края. На 4-е сут. колонии легионелл могут иметь пигмент коричневого цвета. Для культивирования легионелл может быть использовано заражение куриных эмбрионов, морских свинок и культур клеток.
Из биохимических свойств легионелл следует отметить способность продуцировать оксидазу, каталазу, ферментировать крахмал, а также гидролизовать желатин и гиппурат натрия. В то же время легионеллы не способны продуцировать уреазу, восстанавливать нитраты в нитриты, ферментировать другие углеводы.
Исследования химического состава легионелл показали ряд особенностей: в клеточной стенке разных штаммов преобладают жирные кислоты с разветвленными цепями, что характерно больше для грамположительных бактерий; и в большом количестве содержится диаминопимелиновая кислота.
Антигенная структура. У легионелл установлено наличие типо– и группоспецифических антигенов. Серогруппы определяют с помощью реакции прямой иммунофлуоресценции.
Факторы патогенности легионелл изучены сравнительно мало. Важнейшими из них являются липополисахаридный эндотоксин, несколько экзоферментов (протеазы), гемолизины, а также токсины. Один из них нарушает окислительные процессы, протекающие в полиморфно-ядерных лейкоцитах при фагоцитозе, летален для куриных эмбрионов, проявляет цитотоксическое действие в разных культурах клеток. Этот токсин представляет собой термостабильный пептид (ТС-токсин) с молекулярной массой 1,3 кД, состоящий из 6 аминокислотных остатков. Обнаружен также термолабильный цитотоксин (ТЛ-токсин), являющийся высокомолекулярным белком, теряющим свои токсические свойства при нагревании до 60 °C. Продукция этого токсина зависит от фазы роста бактериальной популяции, рН среды, температуры и ряда других условий.
Возбудитель вызывает быструю гибель макрофагов, давая основание полагать, что причина ее – не размножение возбудителя в макрофагах, а выход внутриклеточного токсина при разрушении бактериальных клеток. Наличие у легионелл внутриклеточной токсической активности подтверждается результатами, полученными при действии фильтрата разрушенных клеток вирулентной культуры на монослой макрофагов и при заражении им белых мышей.
Длительное инкубирование легионелл на искусственных питательных средах приводит к резкому снижению вирулентности культуры. Штамм, утративший свою вирулентность, может восстановить ее при переменном пассировании через куриные эмбрионы и организм морской свинки. Умеренная вирулентность сохраняется при постоянном пассировании легионелл на куриных эмбрионах.
Эпидемиология. Места естественного обитания легионелл – открытые водоемы. Источник инфекции – вода систем кондиционирования воздуха рециркуляторного типа, душевые установки, ванны для бальнеопроцедур и т. п. Механизм передачи – аспираторный. Большинство вспышек связано с замкнутыми системами охлаждения воды и технологическими циклами, при функционировании которых образуется высокодисперсный аэрозоль, содержащий легионеллы. Заражение возможно при участии в земляных работах. При групповых и спорадических случаях заболевания источником распространения возбудителя могут быть душевые установки, бытовые увлажнители воздуха, медицинское и лабораторное оборудование. Установлен факт внутриклеточного развития легионелл в амебах, обитающих в открытых водоемах и почве, в одной амебе может находиться более 1000 микробных клеток. Благоприятные условия для жизни и размножения легионелл обнаружены в открытых теплых водоемах с сине-зелеными водорослями, показана зависимость их роста от фотосинтетической активности водорослей. К инфекции восприимчивы все возрастные группы населения. Заболевают чаще люди, занятые земляными работами, а также лица, находившиеся в помещениях, где действуют системы кондиционирования воздуха или имеются устройства с указанными выше источниками инфекции. Для эпидемических вспышек характерна сезонность (июль, август, сентябрь), спорадические случаи регистрируются в течение всего года, но чаще летом. Из животных к возбудителю чувствительны крысы, сирийские хомячки, кролики, морские свинки. Наличие антител в сыворотках крови домашних животных и обезьян говорит также о возможном заражении их в естественных условиях.
Легионеллез зарегистрирован практически на всех континентах; первый случай в России описан в 1980 г. С. В. Прозоровским.
Легионеллы длительно сохраняются и размножаются в водной среде, во влажной почве, образуют пленки и осадок на различных поверхностях, паразитируют не только в амебах, но и в других простейших. Они выдерживают температуру до 70 °C, высокие концентрации хлора; чувствительность к другим дезинфицирующим веществам такая же, как и у большинства бактерий, не образующих спор.
Патогенез и клиника. По-видимому, все виды легионелл патогенны для человека, хотя клинические проявления могут быть различными. Ведущим моментом в патогенезе заболевания является токсическое действие возбудителя на организм. В пользу этого свидетельствует синдром общей интоксикации в начале заболевания, а в дальнейшем и характер патологических изменений в легких. Существенную роль в патогенезе играет бактериемия, которая приводит к развитию сосудистых нарушений, образованию участков некроза в печени и лимфатических узлах. Описаны несколько клинических форм заболевания: собственно болезнь легионеров с преобладанием синдрома пневмонии; респираторное заболевание без пневмонии (лихорадка Понтиак); лихорадка Форт-Брагг, сопровождающаяся кожными высыпаниями. При пневмонической форме инкубационный период от 2 до 11 дней, при лихорадке Понтиак – 6 – 24 ч, иногда 11 – 28 дней. Течение может быть субклиническим, легким, средним, тяжелым и крайне тяжелым (молниеносным). Пневмоническая форма обычно протекает тяжело, нарастает дыхательная и сердечно-сосудистая недостаточность, нарушается микроциркуляция, определяется диссеминированный внутрисосудистый синдром с развитием инфаркта или отека легких, инфарктов во внутренних органах, появляются кровотечения, может наступать почечная недостаточность, развивается шок. Летальность при этой форме во время вспышек, по данным различных авторов, варьирует от 8 до 38 %.
По данным американских исследователей, частота случаев легионеллеза в структуре острых пневмоний составляет от 2 до 5 %, а среди атипичных пневмоний неясной этиологии – от 15 до 20 %. Клиническое течение лихорадки Понтиак соответствует типу острой респираторной вирусной инфекции, начало острое, специфическая симптоматика отсутствует. Возможны рецидивы. Летальные исходы не зарегистрированы.
Иммунитет. Сведения об иммунитете при легионеллезе скудны и порою противоречивы. Установлено, что антитела в сыворотке крови появляются к концу 1-й недели заболевания, титр их существенно повышается на 2 – 3-й нед. и достигает максимума спустя 4 – 5 нед. с последующим снижением. Повторные заболевания не известны.
Лабораторная диагностика. Для диагностики легионеллеза используются бактериологический и серологический методы. Серологический метод используется чаще, так как дает более стабильные результаты. Для определения уровня антител в сыворотке крови применяется в основном реакция непрямой иммунофлуоресценции. Диагностически значимым считается титр 1: 128 и выше в одиночной сыворотке (при соответствующей клинической картине) или нарастание титра антител в динамике не менее чем в 4 раза. Используют также РПГА, ИФМ, РСК. Чистая культура из материала от больного (кровь) выделяется с трудом, лучше из трупного материала (легочная ткань, печень, селезенка). Для выделения чистой культуры из сильно загрязненного материала пользуются угольно-дрожжевым агаром с добавлением L-цистеина, пирофосфата железа, полимиксина В и ванкомицина. К ванкомицину легионеллы проявляют полную резистентность, что, по-видимому, является их видовым, а может даже и родовым признаком. Выделение возбудителя от больных возможно также при заражении морских свинок с последующим заражением куриных эмбрионов. В препаратах-мазках легионеллы обнаруживаются при использовании окраски по Гименсу и импрегнацией серебром. Возбудителя можно обнаружить с помощью реакции прямой иммунофлуоресценции в мазках мокроты из зева, в препаратах из экссудатов, из органов и в образцах внешней среды.
Профилактика и лечение. Специфическая профилактика легионеллеза не разработана. Отсутствие данных о контагиозности больных делает нецелесообразной изоляцию лиц, общавшихся с больным, и медицинского персонала. Основные профилактические и противоэпидемические мероприятия носят неспецифический характер и связаны с химической и термической дезинфекцией водных резервуаров, мест возможного обитания легионелл. На промышленных предприятиях, в учреждениях, больницах при наличии замкнутых систем водоснабжения, используемых для кондиционирования воздуха или охлаждения, при обнаружении в них легионелл необходимо ежеквартально проводить дезинфекционные мероприятия с обязательным бактериологическим контролем воды. Основным препаратом для лечения легионеллеза является эритромицин, при тяжелом течении заболевания его сочетают с рифампицином.
Патогенные анаэробы
В отличие от аэробов и факультативных анаэробов, строгие (облигатные) анаэробы живут только в условиях либо полного отсутствия кислорода, либо при незначительном его содержании. Однако они столь же широко распространены в природе, как и первые. Естественной средой их обитания являются почва, особенно ее глубокие слои, ил различных водоемов, сточные воды, кишечный тракт млекопитающих животных, птиц, рыб и человека. Анаэробы встречаются всюду, где есть органические или неорганические вещества и нет кислорода. Им принадлежит важная роль в процессах круговорота веществ в природе, в особенности азота и углерода, так как они обусловливают процессы соответственно гниения и брожения. Вместе с тем строгие анаэробы составляют основную массу нормальной микрофлоры кишечника человека и млекопитающих животных, играют важную роль в обеспечении их видового иммунитета и поддержании нормальной жизнедеятельности.
Строгие анаэробы можно разбить на 2 основные группы – спорообразующие и не образующие спор. Первую группу относят к роду Clostridium (класс Clostridia)а не образующие спор грамотрицательные бактерии – к родам Bacteroides (класс Bacteroidetes), Fusobacterium, Porphyromonas, Prevotella, Selenomonas. Грамположительные не образующие спор бактерии относят к роду Bifidobacterium (класс Actinobacteria) и Lactobacillus (класс Bacilli). Существуют другие анаэробы и среди грамположительных семейства Micrococcaceae и Streptococcaceae), и грамотрицательных (род Veilonella, класс Cloctridia) кокков.
К строгим анаэробам относятся также метанообразующие (Methanobacteriaceae) и некоторые другие бактерии. В патологии человека и животных основную роль играют анаэробные спорообразующие бактерии, относящиеся к роду Clostridium, а также неспорообразующие бактерии, принадлежащие к родам Bacteroides, Fusobacterium, Campylobacter и Helicobacter.
Бактерии рода Clostridium образуют овальные или круглые споры, располагающиеся субтерминально, центрально или терминально. Как правило, споры имеют диаметр больше диаметра вегетативной клетки, поэтому палочка со спорой приобретает сходство с веретеном, отсюда и произошло название рода Clostridium (веретеноподобные). Клостридии чрезвычайно широко распространены в природе. Естественной средой их обитания служит кишечник травоядных животных и человека, а также почва, куда они поступают с испражнениями. В кишечнике человека и животных клостридии появляются вскоре после рождения. Удобренная навозом земля полей, пастбищ, огородов и садов всегда содержит споры клостридий, которые при благоприятных условиях могут прорастать, а клостридии – размножаться (в летнее время и при наличии в почве необходимых питательных веществ). Для некоторых видов клостридий именно почва, содержащая органические вещества, является естественной средой обитания. Проникнув вместе с кормом и пищей, загрязненными почвой, в кишечник животных и человека, клостридии обычно не вызывают заболевания. Патогенные клостридии вызывают заболевание в тех случаях, когда они проникают в раны, т. е. являются возбудителями раневых инфекций – газовой гангрены и столбняка; или когда они попадают в пищевые продукты, размножаются в них, выделяют экзотоксины и вызывают пищевые токсикоинфекции (например, ботулизм). В иных случаях клостридиальная инфекция может иметь эндогенную природу, например, псевдомембранозный колит возникает как следствие нерациональной антибиотикотерапии, в результате которой в кишечнике начинает интенсивно размножаться Clostridium difficile, вызывая эту тяжелую болезнь.
Ключевые признаки рода Clostridium: крупные палочки с закругленными концами, обычно подвижные, с перитрихиальными жгутиками, иногда неподвижные. Они образуют овоидные или круглые споры, которые расширяют клетку; грамположительны, по крайней мере, в течение ранней стадии роста; хемоорганотрофы, не восстанавливают сульфаты. Некоторые виды обладают сахаролитическими, другие – протеолитическими свойствами; некоторые виды – обоими, некоторые – ни теми, ни другими. Ферментируют глюкозу и другие углеводы с образованием кислоты и газа, некоторые штаммы не ферментируют глюкозу. Большинство штаммов является строгими анаэробами, хотя некоторые могут расти в присутствии воздуха. Некоторые виды фиксируют азот; каталазы обычно не образуют, а когда она есть, то в небольшом количестве. Содержание Г + Ц в ДНК варьирует в пределах 23 – 43 мол %.
Род Clostridium включает большое количество видов. Для удобства идентификации род поделен на четыре группы по локализации спор и способности разжижать желатин.
I. Споры располагаются субтерминально:

Виды, требующие специальных условий роста, выделены в группу V (виды 57 – 61).
По крайней мере еще 36 видов клостридий были выделены из клинического материала от людей и 24 вида – от больных животных. Однако лишь для немногих доказана патогенность для человека и животных. К их числу относятся следующие виды: C. tetani – споры располагаются терминально, гидролизуют желатин – группа IV; C. botulinum, C. perfringens, C. novyi, C. septicum, C. sordellii, C. histolyticum, C. difficile, C. sporogenes (расположение спор субтерминальное, желатин гидролизуют, относятся к группе II). Основные различия между этими видами представлены в табл. 47.
Таблица 47
Дифференциальная характеристика некоторых видов клостридий
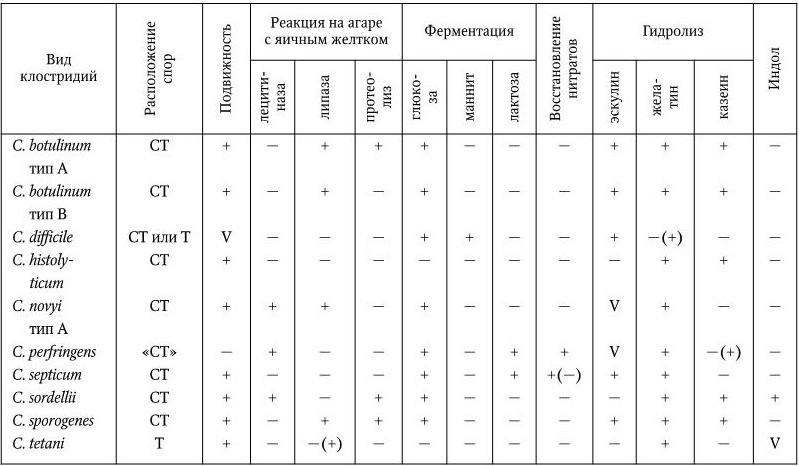
Примечание. СТ – субтерминальное; «СТ» – субтерминальные споры редко; Т – терминальное; (+) – тест положительный; ( – ) – тест отрицательный; V – тест вариабельный; (+)( – ) – реакция проявляется у 11 – 25 % изученных штаммов.
Микробиология газовой гангрены
Газовая гангрена – тяжелая раневая инфекция, для которой характерны глубокая общая интоксикация и прогрессирующее омертвение тканей, сопровождающееся их отеком и газообразованием. В литературе известно несколько десятков названий этой болезни, общепризнанными являются «газовая гангрена» и «анаэробная инфекция». Заболевание известно с древних времен. Первое описание сделал в 1562 г. А. Паре под названием «госпитальная гангрена». Классическое описание симптомов газовой гангрены дал в 1864 г. Н. И. Пирогов. Он же отметил связь этой болезни с войной и произвел анализ условий, способствующих ее возникновению и распространению. Газовая гангрена является полимикробной инфекцией. К ее возбудителям относят: C. perfringens, C. novyi, C. septicum, C. histolyticum, C. sordellii, C. difficile и C. sporogenes. Первое место в этиологии газовой гангрены принадлежит C. perfringens, второе – C. novyi, однако нередко анаэробы – возбудители газовой гангрены – обнаруживаются в ранах в стойких ассоциациях не только друг с другом, но и с аэробными гноеродными кокками и гнилостными анаэробными бактериями. Различные сочетания возбудителей газовой гангрены с аэробными и анаэробными гноеродными и гнилостными бактериями могут значительно усугубить тяжесть течения анаэробной инфекции.
Основные свойства возбудителей газовой гангрены. Clostridium perfringens открыт в 1892 г. М. Уэлчем и Г. Натталом. Нормальный обитатель кишечника человека и животных, в почве в виде спор сохраняется годами и обнаруживается почти в 100 % ее образцов. Представляет собой толстую неподвижную грамположительную палочку со слегка закругленными концами, длиной 3,0 – 9,0 мкм и диаметром 0,9 – 1,3 мкм. Споры овальные, располагаются субтерминально или, чаще, центрально, образуются лучше в щелочной среде. В материале из ран и на среде с сывороткой образуют капсулу. Температурный оптимум для роста 45 °C, растет в диапазоне 20 – 50 °C. Содержание Г + Ц в ДНК – 24 – 27 мол %.
На жидких средах C. perfringens быстро растет, вызывая помутнение и энергичную ферментацию глюкозы с образованием кислоты и газа; ферментирует также лактозу, мальтозу и сахарозу, но не ферментирует маннит; молоко створаживает через 3 – 5 ч с образованием рыхлого сгустка и с отделением прозрачной сыворотки; разжижает желатин; на кровяном агаре образует колонии диаметром 2 – 5 мм с зоной гемолиза и приподнятым центром. В столбике агара образуются дисковидные колонии.
C. perfringens обладает высокой инвазивностью и сильной токсигенностью. Первая связана со способностью возбудителя вырабатывать гиалуронидазу и другие ферменты, которые оказывают также и разрушающее действие на клетки соединительной ткани и мышцы. Главным фактором патогенности C. perfringens является вырабатываемый им сложного состава экзотоксин. Гемотоксическое, некротоксическое, нейротоксическое, лейкотоксическое и летальное действия связаны с различными компонентами экзотоксина. Отдельные штаммы C. perfringens синтезируют экзотоксины разного состава и разной антигенной специфичности, в соответствии с которой различают 6 серологических типов этого возбудителя: A, B, C, D, E, F.
Серотип А – один из главных возбудителей газовой гангрены у людей. Его токсин содержит не менее 6 компонентов: альфа, эта, тэта, каппа, мю, ню (α, η, θ, χ, μ, ν), главным из которых является альфа-лецитиназа С. Способность других серотипов C. perfringens вызывать газовую гангрену зависит также во многом от продукции ими различных компонентов экзотоксина, в том числе альфа-, бета-, тэта-, эпсилон– и др.
При заражении животных C. perfringens наблюдается обширное отслоение кожных покровов, распад мышечной ткани, кровянистый экссудат, пузырьки газа в подкожной клетчатке; мышцы дряблые, серого цвета, имеют вид вареного мяса. Некоторые серотипы C. perfringens (A, C, D, F) являются виновниками пищевых токсикоинфекций и тяжелых энтеритов, в патогенезе которых установлена ведущая роль некротоксинов и энтеротоксинов. Они продуцируются наиболее активно во время споруляции клостридий. C. perfringens типа D вырабатывает энтеротоксин в виде неактивного протоксина, активацию которого осуществляет протеаза.
Clostridium novyi открыт в 1894 г. Ф. Нови. Грамположительная полиморфная толстая палочка с закругленными концами, диаметром 0,8 – 1,4 мкм и длиной 1,6 – 2,5 мкм, нередко располагается в виде цепочек из 2 – 5 клеток. Капсулы не образует, подвижный перитрих (серотип С неподвижен). Споры овальные или круглые, располагаются субтерминально, редко – центрально. Наиболее строгий анаэроб, на жидких средах растет в виде легкого помутнения, дает большой осадок, наблюдается умеренная ферментация глюкозы с образованием газа. Молоко свертывает медленно, желатин разжижает. На кровяном агаре она образует серые бугристые колонии с приподнятым центром, отходящими отростками и зоной гемолиза;
в столбике с агаром дает хлопьевидные колонии; ферментирует глюкозу, мальтозу, не ферментирует лактозу. Патогенность C. novyi обусловлена его способностью продуцировать очень сильный экзотоксин сложного состава, вызывающий при заражении животных характерный бесцветный или розового цвета отек желеобразной консистенции. Токсин обладает также гемолитическим и летальным свойствами. Различают 3 основных типа C. novyi – A, B и C. Тип А продуцирует альфа-, гамма-, дельта-, эпсилон-экзотоксины, с которыми связана его способность вызывать заболевание у людей. Оптимальная температура для роста 40 – 45 °C. Содержание Г + Ц в ДНК – 23 мол %. Тип В продуцирует альфа-, бета-, дзэта– и эта-токсины. Оптимальная температура для роста C. novyi 37 °C, растет в диапазоне 25 – 45 °C. Он вызывает газовую гангрену у людей и заболевания животных. Тип С продуцирует небольшое количество гамма-токсина. Температурный оптимум для роста 45 °C. Выделен при остеомиелите у буйволов.
Clostridium septicum выделен в 1877 г. Л. Пастером и Ж. Жубером из трупа коровы. Вызванные возбудителем изменения Л. Пастер рассматривал как септицемию, в связи с чем он и был назван вначале Vibrio septique. C. septicum – тонкая длинная полиморфная палочка диаметром 1,1 – 1,6 мкм, длиной 3,1 – 14,1 мкм, нередко образует нити длиной до 50 мкм, грамположительна, перитрих, капсулы не образует. Споры овальные, располагаются субтерминально или центрально, образуются быстро, уже через 24 ч. На жидкой среде вызывает помутнение, молоко свертывает медленно, гидролизует желатин, ферментирует глюкозу, лактозу, мальтозу с образованием кислоты и газа, не ферментирует маннит и сахарозу. На кровяном агаре колонии окружены зоной гемолиза и имеют тонкие многочисленные отростки; в столбике агара колонии имеют вид пушинок с уплотненным центром.
C. septicum патогенна для человека и домашних животных. Продуцируемый экзотоксин обладает некротическим, гемолитическим и летальным действием. При заражении животных вызывает кровянисто-серозный отек, мышцы имеют темнокрасный цвет, в подкожной клетчатке и в мышцах – пузырьки газа.
Clostridium histolyticum открыт в 1916 г. М. Вейнбергом и Е. Сегеном. Прямая палочка длиной 1,6 – 3,1 мкм, диаметром 0,6 – 1,0 мкм, подвижна (перитрих), капсул не образует, споры овальные, располагаются субтерминально, углеводы не ферментирует. Молоко быстро пептонизирует. На жидких средах дает общее помутнение.
Колонии в столбике агара компактные, мохнатые, неправильной формы. На кровяном агаре колонии мелкие, прозрачные, как капельки росы, с узкой зоной гемолиза. C. histolyticum обладает сильными протеолитическими ферментами, быстро разжижает желатин; при заражении животных происходит протеолиз мягких тканей с обнажением костей и отпаданием конечностей. Продуцируемый экзотоксин при внутривенном введении животным вызывает быструю смерть. C. histolyticum в природе распространен сравнительно мало, встречается в почве, в сточных водах, иногда в кишечнике человека.
Clostridium sordellii обнаружен в 1922 г. Р. Сорделли. Прямая грамположительная толстая палочка диаметром 1,1 – 1,6 мкм, длиной 3,1 – 4,5 мкм, иногда образует цепочки из 3 – 4 клеток, подвижна (перитрих), капсулы не образует, споры овальные, располагаются субтерминально или центрально; обладает сильными протеолитическими свойствами, быстро разжижает желатин; ферментирует глюкозу, левулезу, мальтозу с образованием кислоты и газа, медленно свертывает молоко. Температурный оптимум для роста 37 °C. Содержание Г + Ц в ДНК – 26 мол %.
Clostridium sporogenes открыт в 1908 г. И. И. Мечниковым. Прямая палочка диаметром 0,3 – 0,4 мкм и длиной 1,4 – 6,6 мкм, грамположительна, подвижна (перитрих), капсулы не образует, споры овальные, располагаются субтерминально. Рост на жидкой среде с глюкозой сопровождается помутнением и энергичным газообразованием. На плотных средах колонии диаметром 2 – 6 мм имеют характерную форму, напоминающую голову Медузы, полупрозрачные, с матовой поверхностью. Оптимальная температура для роста 30 – 40 °C, диапазон роста 25 – 45 °C. Содержание Г + Ц в ДНК – 26 мол %. C. sporogenes обладает сильными протеолитическими свойствами, вызывает в ранах протеолиз мертвых тканей, обусловливая гнилостный запах.
Clostridium difficile впервые был описан в 1935 г. И. Холлом и Е. О’Тулом как представитель нормальной микрофлоры кишечника. Он обнаруживается у 3 % здоровых людей. Позднее был выделен из огнестрельных ран, при газовой гангрене, из различных абсцессов, плевральной жидкости, при неспецифических уретритах. Кроме того, установлена его этиологическая роль при антибиотико-ассоциированных псевдомембранозных колитах. С. difficile – палочка длиной 3,1 – 6,4 мкм, диаметром 1,3 – 1,6 мкм, грамположительна, подвижна (перитрих), капсулы не образует, споры овальные, располагаются субтерминально. Оптимальная для роста температура 30 – 37 °C (диапазон роста 25 – 45 °C). Содержание Г + Ц в ДНК – 28 мол %. Колонии на плотных средах круглые, диаметром 3 – 5 мм, с ровными краями, слегка выпуклые, серовато-белого цвета с матовой поверхностью. На питательном бульоне C. difficile дает умеренный рост с ферментацией или без ферментации глюкозы, на дне зернистый осадок; молоко не створаживает; на кровяном агаре большинство штаммов не дает гемолиза.
Основным фактором патогенности Clostridium difficile служит токсический комплекс, состоящий как минимум из двух токсинов: энтеротоксина (A) и цитотоксина (B). Комплекс в различных биологических тест-системах показывает диареегенную, цитотоксическую и летальную активность. Clostridium difficile является возбудителем псевдомембранозного колита в 90 – 100 % случаев. Для диагностики этого заболевания прибегают как к выделению возбудителя из испражнений, так и к обнаружению токсина. Токсин обнаруживают по его цитопатическому действию (ЦД), проявляемому на различных культурах клеток. Его специфичность устанавливают по реакции нейтрализации ЦД антитоксической сывороткой. Для обнаружения и идентификации токсина (токсинов) может быть использована ПЦР.
Особенности патогенеза газовой гангрены. Газовая гангрена – это своеобразный патологический процесс, который дает различные клинические проявления в зависимости от места локализации. Различают следующие формы этой болезни: анаэробная инфекция мягких тканей конечностей и туловища; анаэробная инфекция мозга; послеродовая или послеабортная анаэробная инфекция; анаэробная инфекция органов брюшной полости и брюшины; анаэробная инфекция органов грудной полости и анаэробный остеомиелит. Все они характеризуются единством патогенеза. Анаэробная инфекция в отличие от гнойных заболеваний, вызываемых аэробными бактериями, протекает без ярко выраженного воспаления. Для нее характерны: прогрессирующий некроз тканей, отек, газообразование в тканях и отравление организма токсинами возбудителя и продуктами распада тканей. Газовая гангрена встречается как в мирное, так и, в особенности, в военное время. Во время Великой Отечественной войны 1941 – 1945 гг. она наблюдалась у 1 – 14 % раненых. В военное время чаще всего наблюдается газовая гангрена мягких тканей конечностей, особенно нижних. Надо иметь в виду, что патогенные анаэробы очень часто обнаруживаются в ранах, но для развития анаэробной инфекции необходимы определенные условия. Клостридии – некропаразиты, благоприятной средой для их размножения служат мертвые или поврежденные ткани. Поэтому наиболее опасны тяжелые повреждения с обширной раневой поверхностью, нарушением кровообращения, гематомами, размозжением мышц, раздроблением костей, образованием слепых ходов и т. п. Попадая в такие раны, клостридии начинают быстро размножаться в глубине поврежденной ткани (анаэробные условия) и выделять экзотоксины. Обладая высокой инвазивностью, они проникают и в здоровую ткань, вначале повреждая ее, а затем и некротизируя своими токсинами и ферментами. Особенно бурно процесс протекает в мышечной ткани, содержащей гликоген и являющейся хорошей питательной средой для клостридий. В патогенном действии клостридий и их токсинов различают две стадии:
1. Образование отека. Вследствие действия токсина повышается проницаемость кровеносных сосудов для плазмы и клеток крови. Развитие отека приводит к сдавливанию ткани; кроме того, с отечной жидкостью поступает токсин. Все это приводит к повреждению тканей и делает их доступными для размножения клостридий.
2. Развитие газовой гангрены, т. е. некроз мышечной и соединительной тканей. Газообразование является результатом ферментативной активности клостридий, а некроз – следствием некротоксического действия токсинов и ферментов. Токсины не только действуют местно, но и вызывают сильнейшую общую интоксикацию (нейротоксическое действие). К специфической бактериальной интоксикации присоединяется отравление продуктами тканевого разложения. Чем больше зона поражения, тем сильнее и разнообразнее интоксикация организма. Таким образом, клиника газовой гангрены определяется общим и местным действием токсинов и ферментов клостридий, а также отравлением продуктами тканевого распада.
Инкубационный период длится от нескольких часов до 5 дней, иногда дольше. В зависимости от свойств и ассоциации клостридий, вызвавших анаэробную инфекцию, клиника ее может быть разной: эмфизематозная, токсическая (отечная), смешанная и т. п. Анаэробная инфекция продолжается 5 – 6 дней, и эти дни решают исход заболевания. Летальность во время первой мировой войны достигала 60 %.
Постинфекционный и поствакцинальный иммунитет в основном опосредуется антитоксинами. Роль антимикробных антител второстепенна. Продолжительность и напряженность иммунитета после перенесенной инфекции изучены недостаточно.
Лабораторная диагностика. Материалом для исследования служат кусочки пораженных тканей (некротизированная и пограничные с ней участки) и отечная жидкость. Кроме того, исследованию в случае необходимости подвергают перевязочный и шовный материал (шелк, кетгут), одежду, образцы почвы; при пищевых интоксикациях, вызванных клостридиями, – испражнения и продукты. Микробиологическая диагностика заключается в выделении из исследуемого материала возбудителя и его идентификации, основанной на изучении морфологических, культуральных, биохимических свойств и определении токсигенности. Исследование состоит из нескольких этапов:
1) бактериоскопия отделяемого раны или экссудата;
2) выделение возбудителя и его идентификация;
3) заражение белых мышей исследуемым материалом, фильтратом бульонной культуры или кровью больных для обнаружения токсина;
4) идентификация токсина клостридий с помощью реакций нейтрализации специфическими антитоксическими сыворотками в биологических пробах на белых мышах или культурах клеток (C. difficile).
Для выделения клостридий используют следующие среды: А. Жидкие накопительные (казеиновые или мясные, содержащие 1 % глюкозы и кусочки печени, перед посевом кипятят и заливают вазелиновым маслом для создания анаэробных условий), молоко. Б. Плотные – кровяной агар Цейсслера (15 % дефибринированной крови + 2 % глюкозы); кровяной агар с бензидином (колонии C. novyi на такой среде чернеют на воздухе); cреда Вильсона – Блера в длинных стеклянных трубочках (C. perfringens в такой среде уже через 3 – 4 ч вызывает почернение в месте своего размножения за счет образования сернистого железа из Na2S и FeCl3 и бурное газообразование за счет ферментации глюкозы); среда Виллиса – Хоббса (содержит, кроме питательного агара, лактозу, индикатор, яичный желток и обезжиренное молоко). На этой среде колонии C. perfringens окрашены в цвет индикатора (ферментируют лактозу), имеют ореол опалесценции (наличие лецитиназы); колонии C. novyi бесцветные (не ферментируют лактозу), окружены зоной опалесценции (лецитиназа); колонии C. septicum окрашены в красный цвет (ферментируют лактозу), но не имеют зоны опалесценции; колонии C. histolyticum – бесцветны, окружены зоной просветления; колонии C. sordellii, C. sporogenes и C. difficile – бесцветные (не ферментируют лактозу), но колонии C. sordellii имеют ореол опалесценции (имеют лецитиназу).
Материал для исследования делят на две части. Одну часть засевают на плотные дифференциально-диагностические (Виллиса – Хоббса и др.) и жидкие среды без прогревания, а другую – после прогревания при 80 °C 15 мин и при 100 °C (5 мин, 10 мин, 20 мин) засевают в жидкие мясные или казеиновые среды и инкубируют при 37 °C от 16 ч до 15 сут. (для прогретых проб). Выросшие культуры, содержащие массу грамположительных палочек, пересевают на плотные дифференциально-диагностические среды (Виллиса – Хоббса, Вильсона – Блера и др.) для получения изолированных колоний, а затем чистых культур и их идентификации.
При посеве исходного материала на дифференциально-диагностические среды после инкубации при 37 °C в течение 1 – 7 сут. колонии, вызвавшие соответствующие изменения на одной из этих сред и состоящие из грамположительных палочек, пересевают на мясные или казеиновые среды для дальнейшей идентификации. Для ускоренной диагностики газовой гангрены О. А. Комковой предложен следующий метод: посев производится в столбик полужидкого агара, к которому добавляется антитоксическая сыворотка. В такой среде с гомологичной антитоксической сывороткой клостридии вместо диффузного помутнения образуют изолированные колонии, а в препаратах-мазках из них имеют вид стрептобацилл (располагаются цепочками).
Лечение и профилактика. Главный метод предупреждения газовой гангрены – своевременная и правильная хирургическая обработка ран. В случае особо тяжелых ранений, которые могут повлечь развитие газовой гангрены, больному с профилактической целью вводят по 10 000 МЕ антитоксических сывороток против наиболее частых возбудителей – C. perfringens, C. novyi и C. septicum. С лечебной целью вводят те же сыворотки по 50 000 МЕ. При отсутствии эффекта сыворотки вводят повторно. Серотерапия должна обязательно сочетаться с эффективной антибиотикотерапией и соответствующим общеукрепляющим лечением.
Специфическая профилактика. Для создания искусственного иммунитета против анаэробной инфекции созданы препараты из различных анатоксинов, однако широкого применения они не получили.
Столбняк – острая токсическая раневая инфекция, характеризующаяся поражением нейротоксином двигательных клеток спинного и головного мозга, которое проявляется в виде судорог поперечнополосатой мускулатуры.
Столбняком болеют люди и различные виды сельскохозяйственных животных. Наиболее восприимчивы к нему в естественных условиях лошади и мелкий рогатый скот. Возбудитель столбняка – Clostridium tetani – был открыт в 1883 г. Н. Д. Монастырским и в 1884 г. А. Николайером. Оба они сообщили о своих открытиях в 1885 г. В чистой культуре возбудитель был получен в 1889 г. С. Китазато. C. tetani – прямая палочка длиной 2,4 – 5,0 мкм, диаметром 0,5 – 1,1 мкм, иногда образующая длинные нити. Большинство штаммов подвижно (перитрихи). Споры круглые, располагаются терминально, придавая возбудителю вид булавки или барабанной палочки (см. цв. вкл., рис. 105). Грамположительна, но в старых культурах становится грамотрицательной. Капсулы не образует. Содержание Г + Ц в ДНК – 25 мол %. Оптимальная температура для роста 37 °C (диапазон роста 14 – 45 °C). На питательном бульоне (среде Китта – Тароцци) рост медленный с равномерным помутнением и редким газообразованием (сахаролитическими свойствами не обладает, лишь редкие штаммы ферментируют глюкозу). Культура издает своеобразный неприятный запах выгребной ямы. На кровяном агаре колонии размером 4 – 6 мм, круглые, плоские, с неровными краями, полупрозрачные, серые, нередко в виде переплетающихся нитей, напоминающих паучков; вокруг колоний – зона гемолиза. В столбике агара колонии в виде комочков ваты. C. tetani обладает слабыми протеолитическими свойствами, медленно гидролизует желатин, молоко свертывает к 4 – 7-му дню в виде мелких хлопьев, затем наступает его пептонизация; не образует индола, восстанавливает нитраты в нитриты.
Антигенное строение. Возбудитель столбняка имеет О– и Н-антигены. По Н-антигену различают более 10 серотипов, однако все они образуют одинаковый экзотоксин.
Факторы патогенности. Главным фактором патогенности C. tetani, определяющим патогенез и клинику столбняка, является вырабатываемый им сильнейший экзотоксин. Смертельная доза его для человека составляет менее 2 нг/кг массы тела. Экзотоксин состоит из двух фракций – тетаноспазмина (нейротоксина) и тетанолизина (разрушает эритроциты).
Тетанолизин выделяется из клеток с первых дней развития культуры с помощью механизма активного транспорта. Тетаноспазмин через клеточную стенку клостридий не проходит, а выделяется в культуральную жидкость лишь при распаде микробных клеток, главным образом в фазе их ускоренной гибели, поэтому он накапливается в бульонной культуре к 5 – 7-му дню инкубации.
Тетаноспазмин синтезируется внутриклеточно в виде неактивного протоксина – одноцепочечного полипептида, имеющего м. м. 150 кД. Превращение протоксина в активный нейротоксин происходит после лизиса микробной клетки и осуществляется бактериальной протеазой, которая разрезает полипептид на две части. Активный внеклеточный нейротоксин («разрезанный» токсин) состоит из двух связанных между собой дисульфидными связями цепей: легкой – L (около 50 кД) и тяжелой – Н (около 100 кД). Н-цепь, по-видимому, выполняет акцепторную роль рецепторами для токсина являются три– и дисиалоганглиозиды мембран аксонных окончаний. Предполагается, что по аналогии с дифтерийным экзотоксином, состоящим также из Н– и L-цепей, которые образуются при разрезании исходной полипептидной цепи токсина, L-цепь обладает какими-то ферментативными свойствами, опосредующими биологическую активность нейротоксина. Взятые сами по себе L– и Н-цепи не токсичны, но после реассоциации молекулы токсина его токсичность восстанавливается. Мишенью токсина служит везикулоассоциированный мембранный белок синаптобревин.
Непосредственно из крови в центральную нервную систему из-за наличия гематоэнцефалического барьера столбнячный токсин проникнуть не может. Он специфически связывается с нервными клетками в области их мионевральных синапсов. Его взаимодействие с нервной клеткой происходит через четыре стадии: 1) связывание с рецептором; 2) связывание с мембранами нервных клеток, которое заключается в том, что вначале токсин фиксируется ганглиозидом, а затем комплекс токсин + ганглиозид латерально перемещается к белковому рецептору и связывается с ним; 3) энергозависимый процесс проникновения токсина в цитозоль клетки, осуществляемый опосредованным рецептором эндоцитозом; 4) продвижение по аксону со скоростью ≈ 1 см/ч. Продвижение токсина вверх по спинному или продолговатому мозгу может происходить от нейрона к нейрону только в области синапсов, так как оболочка нейронов практически непроницаема для молекул токсина. Кроме того, нейроны изолированы друг от друга клетками глии. Токсин накапливается в центральной нервной системе в основном в двигательных зонах спинного и головного мозга, за исключением переднего мозга и мозжечка. Конечный результат действия столбнячного токсина заключается в том, что он блокирует синаптическую передачу: тормозит освобождение таких медиаторов, как глицин, ацетилхолин, норадреналин, γ-аминомасляная кислота, и вызывает нервно-мышечную патологию. Возможно также, что повреждаются и иные, а не только синаптические структуры.
Тетанолизин – мембранотропный токсин, он разрушает эритроциты и, возможно, другие клетки. Штаммы C. tetani отличаются выраженной гетерогенностью по признаку гемолитической активности. Роль тетанолизина в патогенезе столбняка до сих пор не имеет однозначного объяснения. Однако, вызывая гемолиз и подавляя фагоцитоз, тетанолизин, несомненно, способствует распространению возбудителя в организме и продукции им токсинов.
Резистентность. Вегетативные формы C. tetani не отличаются особой устойчивостью. При кипячении они разрушаются в течение 5 мин. Напротив, споры C. tetani обладают исключительно высокой резистентностью к различным физическим и химическим воздействиям. Для их разрушения требуется кипячение в течение 1 – 3 ч;
автоклавирование при температуре 120 °C они переносят до 40 мин. Споры не чувствительны к низким температурам, к рассеянному солнечному свету. 1 % раствор сулемы, формалина, 5 % раствор фенола уничтожают их через 12 – 14 ч, они практически не чувствительны к химиотерапевтическим препаратам. В высушенном состоянии споры cохраняют жизнеспособность несколько десятков лет, в почве сохраняются длительное время, а при благоприятных условиях могут в ней прорастать и размножаться. Поэтому почва, особенно загрязненная испражнениями животных и человека, является неиссякаемым резервуаром C. tetani и постоянным потенциальным источником заражения людей и животных столбняком.
Особенности эпидемиологии. Возбудитель столбняка распространен повсеместно в почве и других объектах внешней среды на различных территориях Земного шара, поэтому проблема столбняка имеет глобальное значение. Больной столбняком человек неконтагиозен – передачи возбудителя столбняка от больного не происходит. Основным путем заражения столбняком является проникновение возбудителя через поврежденные кожные покровы и слизистые оболочки. Местом входных ворот служат различные раны: огнестрельные, колотые, резаные, занозы, потертости, ожоги, обморожения, травмированные родовые пути (послеродовый или послеабортный столбняк), операционные раны при инфицировании их руками, инструментами или перевязочным материалом и т. п. Иногда травма настолько ничтожна, что входные ворота остаются необнаруженными (криптогенный столбняк). Особенно серьезную глобальную проблему представляет столбняк новорожденных (tetanus neonatorum). Он связан с тем, что в целом ряде развивающихся стран при обработке пуповины применяют такие традиционные методы (при родах на дому), как использование золы, земли, глины, навоза, помета птиц, порошков, приготовленных из различных растительных продуктов и других субстратов, которые часто содержат споры C. tetani. Попадая через пупочный канатик, они и служат причиной столбняка новорожденных. Летальность при этой форме столбняка составляет в среднем 85 % и достигает максимальных значений на 6 – 8-й день жизни больного ребенка. По оценке ВОЗ, в 1980-х гг. ХХ в. ежегодно в развивающихся странах от столбняка новорожденных умирало более 1 млн детей, а общее число случаев столбняка в них составляло более 2,5 млн.
Патогенез и клиника. Столбняк представляет собой классическую токсическую инфекцию, патогенез и клиника которой обусловлены действием экзотоксина возбудителя. При заражении лабораторных животных чистым токсином развивается такая же болезнь, как и при инфицировании возбудителем. В клинической картине столбняка ведущими симптомами являются: 1) тоническое сокращение поперечнополосатой мускулатуры и 2) повышенная рефлекторная возбудимость от внешних раздражений. Картина столбняка у человека и крупных животных отличается от таковой у мелких лабораторных животных – белых мышей и морских свинок. Инкубационный период после заражения белых мышей в среднем составляет 24 – 36 ч, а морских свинок – 48 ч. Заболевание у них развивается по типу восходящего столбняка (tetanus ascendens): при подкожном заражении в область задних конечностей у них отмечаются сначала местные явления (нога держится в вытянутом положении, при движении беспомощно волочится, хвост изогнут и ригидный), потом спастические сокращения охватывают мускулатуру одноименной половины туловища, а затем противоположную, и животное погибает при явлениях общего столбняка.
В противоположность этому у человека и крупных животных последовательность поражения мышечных групп не связана с местом локализации входных ворот, болезнь протекает по типу нисходящего столбняка (tetanus descendens).
Инкубационный период при столбняке у человека составляет в среднем 6 – 14 дней, но может варьировать от 1 – 3 дней до месяца и более, и чем короче инкубационный период, тем тяжелее протекает болезнь. Раньше всего наступает спазм жевательной мускулатуры (тризм) и затылочных мышц. Затем поражаются мышцы лица, – у больного появляется вынужденная («сардоническая») улыбка. Далее наступает спазм мускулатуры туловища и конечностей. Вследствие того что спастическое сокращение разгибательной мускулатуры спины выражено сильнее, чем сгибательных мышц живота, больной лежит, опираясь только на затылок и таз. В связи с повышенной рефлекторной возбудимостью пораженных токсином двигательных центров малейшее раздражение вызывает тетанические (клонические) судороги по-
перечно-полосатой мускулатуры, в результате чего тело приобретает «столбообразное состояние» с выгибанием позвоночника дугой (опистотонус). Больной находится в ясном сознании. Смерть наступает от паралича сердца либо от асфиксии вследствие поражения мышц гортани, межреберных мышц и диафрагмы. Повышение температуры бывает не всегда. При столбняке новорожденных первым симптомом является отказ ребенка от груди в связи с сокращением челюстных мышц, затем у ребенка возникает типичная «поза лягушонка»: он лежит на спине с запрокинутой головой, с согнутыми и подтянутыми к туловищу ногами, на лице – страдальческое выражение. При послеоперационном и послеабортном столбняке нередко наблюдается молниеносное течение заболевания, при котором смерть наступает от паралича дыхательного центра или сердечной недостаточности раньше, чем успевают развиться характерные симптомы болезни. Летальность при этих формах и столбняке новорожденных наиболее высока – до 90 %.
Постинфекционный иммунитет стойкий и длительный, опосредуется главным образом, судя по эффективности искусственной иммунизации, антитоксинами, клетками иммунной памяти и повышением фагоцитарной активности.
Лабораторная диагностика. При типичной клинической картине лабораторную диагностику можно не проводить. Необходимость в ней возникает при спорных и неясных случаях, а также в случаях, когда требуется подтверждение диагноза после операций, абортов, родов на дому без медицинской помощи, при обследовании перевязочного и шовного материала, образцов почвы и т. п. Бактериологическая диагностика столбняка заключается в выделении и идентификации возбудителя и в обнаружении его токсина в исследуемом материале. Для исследования берут от больных кусочки ткани из мест проникновения возбудителя в организм, экссудат, инородное тело, тампоны из раны. При послеродовом или послеабортном столбняке исследуют выделения и ткани из влагалища и матки, при столбняке новорожденных – выделения из пупочного канатика. При исследовании умерших берут материал из раны, воспалительных очагов, старых рубцов, а также кровь, печень, селезенку и легкие, куда возбудитель может быть занесен кровью.
Микробиологическая диагностика включает в себя следующие этапы:
1) бактериоскопия исходного материала;
2) посев для выделения возбудителя и его идентификации;
3) обнаружение столбнячного токсина.
Выделение C. tetani из патологического материала или других образцов проводят по обычной для строгих анаэробов схеме, используя различные плотные и жидкие среды, а идентификацию – на основе морфологических, культуральных, биохимических и токсигенных свойств. Специально для выделения C. tetani П. Филдсом предложен следующий метод: исследуемый материал засевают в каплю конденсационной жидкости на дне пробирки с косячком из кровяного или сывороточного агара. Обычно через 18 – 24 ч инкубации при температуре 37 °C в анаэробных условиях C. tetani благодаря своему ползучему росту, обусловленному жгутиками, образуют тонкую пленку по всей скошенной поверхности среды. Для получения чистой культуры производят 3 – 5 таких пересевов.
Наиболее простым и эффективным методом микробиологической диагностики столбняка является биологическая проба на белых мышах. С этой целью исследуемый материал (растертые в физиологическом растворе кусочки некротизированной ткани, гной и иной материал) или фильтрат изучаемой культуры делят на две фракции. Одну из них смешивают с антитоксической сывороткой и оставляют смесь при комнатной температуре на 40 мин (для нейтрализации токсина). После этого заражают белых мышей нативным материалом и смесью его с антитоксической сывороткой. При наличии в нативном материале столбнячного токсина опытные мыши погибают; контрольные мыши, которым вводят смесь нативного материала с антитоксином, остаются живыми. Для обнаружения столбнячного токсина может быть использована РПГА с антительным эритроцитарным диагностикумом.
Лечение. Для специфического лечения столбняка применяют противостолбнячную антитоксическую сыворотку, получаемую путем гипериммунизации лошадей столбнячным анатоксином и токсином. Сыворотка применяется в дозе 350 МЕ/кг веса больного. Сыворотку вводят после десенсибилизации внутримышечно (или внутривенно, это должно быть указано в инструкции). Лечение начинают при появлении первых симптомов столбняка, сыворотку вводят повторно до исчезновения рефлекторных судорог. Получен иммунохимически чистый столбнячный антитоксин, который, благодаря более высокой удельной активности и более длительной персистенции в организме, обеспечивает терапевтический эффект лучше, чем антитоксическая сыворотка, очищенная методом Диаферм-3. Хороший терапевтический эффект дает и гомологичный иммуноглобулин, т. е. иммуноглобулин людей, иммунизированных против столбняка. Серотерапию необходимо сочетать с антибиотикотерапией (пенициллины, цефалоспорины).
Специфическая профилактика столбняка включает два вида мероприятий.
1. Проведение плановой активной иммунизации детей и взрослых против столбняка.
2. Экстренная иммунопрофилактика в связи с травмами.
Активная иммунизация населения. Ее начинают с детей 3 – 5-месячного возраста столбнячным анатоксином, чистым или в комбинации с другими иммунопрепаратами, чаще всего в виде вакцины АКДС (анатоксины столбняка, дифтерии и убитые коклюшные палочки) по соответствующей схеме, а затем через каждые 5 – 10 лет проводят ревакцинацию. Прививки по этой схеме обеспечивают иммунитет против столбняка на протяжении всей жизни и избавляют от необходимости вводить при травмах антитоксическую сыворотку. По расширенной программе иммунизации (РПИ) ВОЗ все дети на первом году жизни должны быть обязательно привиты против столбняка и ряда других инфекций, а столбняк новорожденных должен был быть ликвидирован к 1995 г. благодаря иммунизации женщин детородного возраста, в первую очередь беременных, в развивающихся странах столбнячным анатоксином (2 – 3 прививки).
Экстренная иммунопрофилактика столбняка производится при травмах и, в зависимости от предшествующих прививок анатоксином, осуществляется в виде либо пассивной иммунизации (вводится однократно 3000 МЕ антитоксической сыворотки); либо активно-пассивной иммунизации (вводится столбнячный анатоксин и через 30 мин другим шприцем и в другой участок тела 3000 МЕ сыворотки или 950 МЕ гомологичного иммуноглобулина); либо экстренной ревакцинации столбнячным анатоксином. Пассивная серопрофилактика ненадежна, так как защитный уровень введенного антитоксина (0,01 МЕ/мл крови) сохраняется меньше, чем может быть срок инкубационного периода при столбняке.
Лица, которые прошли полный курс иммунизации против столбняка любым препаратом, содержащим столбнячный анатоксин, при травмах подлежат только экстренной ревакцинации анатоксином без одновременного введения антитоксической сыворотки или гомологичного иммуноглобулина. Лицам, которые не получили полного курса иммунизации против столбняка или вообще не прививались против него, при травмах проводят активно-пассивную профилактику.
Ботулизм – тяжелая форма пищевой токсикоинфекции, связанная с употреблением продуктов, зараженных Clostridium botulinum, и характеризующаяся специфическим поражением центральной нервной системы.
Возбудитель болезни был впервые обнаружен в 1896 г. Э. ван Эрменгемом в остатках колбасы (лат. botulus – колбаса), а также в селезенке и толстой кишке людей, погибших от ботулизма. Это открытие было подтверждено С. В. Констансовым, который выделил C. botulinum из красной рыбы, послужившей причиной отравления.
C. botulinum – довольно крупные полиморфные палочки с закругленными концами, длиной 4 – 9 мкм, диаметром 0,5 – 1,5 мкм, иногда образуются укороченные формы; располагаются беспорядочно, иногда парами или в виде коротких цепочек; в старых культурах могут образовывать длинные нити; грамположительны, подвижны, имеют перитрихиальные жгутики. Капсулы не образуют, споры овальные, располагаются субтерминально, придавая палочке форму, напоминающую теннисную ракетку (рис. 106). Споры в культурах появляются через 24 – 48 ч от начала инкубации. C. botulinum не размножается в продуктах при кислой реакции (рН 3,0 – 4,0) и при концентрации NaCl выше 10 %.
C. botulinum образует 8 типов токсинов: A, B, C1, C2, D, E, F, G, различающихся по антигенной специфичности. Соответственно различают 8 типов возбудителя, одним из важных признаков которых является наличие или отсутствие протеолитических свойств. Эти свойства определяются по способности гидролизовать казеин и продуцировать H2S. В соответствии с этим различают протеолитическую группу, к которой относятся все штаммы типа А и часть штаммов B и F, и непротеолитическую группу, к которой относят все штаммы типа Е и некоторые штаммы типов B и F. Возбудители типов С и D занимают промежуточное положение между этими группами, так как часть из них продуцирует протеолитические ферменты, но многие штаммы С и D не образуют их (табл. 48). Серотип G отличается от всех других серотипов тем, что он, обладая протеолитическими свойствами, не ферментирует углеводы.

Рис. 106. Clostridium botulinum
Чистая культура
Таблица 48
Дифференциальные признаки протеолитических и непротеолитических штаммов C. botulinum

Примечание. (+) – признак положительный; ( – ) – признак отрицательный; надстрочный знак ( – ) – некоторые штаммы желатин не гидролизуют. а Этот серотип выделен в самостоятельный вид C. argentinense.
Некоторые особенности различных типов C. botulinum. Тип А и протеолитические штаммы типов B, C, D и F – прямые или слегка изогнутые палочки длиной 4,4 – 8,6 мкм, диаметром 0,8 – 1,3 мкм, подвижны (перитрихи). Споры овальные, субтерминальные. Обильно растут на питательном бульоне. На кровяном агаре с 0,5 – 1,0 % глюкозы образуют гладкие или шероховатые колонии диаметром 3 – 8 мм, окруженные зоной гемолиза. В начале роста колонии очень мелкие, блестящие, в виде капелек росы. Затем они увеличиваются, становятся сероватыми с ровными или неровными краями. В агаре столбиком колонии дискообразные или в виде «пушинок». Молоко пептонизируют. Температурный оптимум для роста 30 – 40 °C. Содержание Г + Ц в ДНК – 26 – 28 мол %.
Тип Е и непротеолитические штаммы типов В и F. Прямые палочки, диаметр 0,3 – 0,7 мкм, длина 3,4 – 7,5 мкм; грамположительны, но в старых культурах становятся грамотрицательными, подвижны (перитрихи). Споры овальные, субтерминальные. Обильный рост на среде Китта – Тароцци с газообразованием. Колонии на кровяном агаре 1 – 3 мм в диаметре, с неровными краями, матовой поверхностью, мозаичной структурой, с зоной гемолиза. Некоторые штаммы типа Е не гидролизуют желатин. Молоко свертывают, но не пептонизируют. Температурный оптимум для роста 25 – 37 °C. Содержание Г + Ц в ДНК составляет 26 – 28 мол %.
Непротеолитические штаммы типов C и D. Прямые палочки, диаметр 0,5 – 0,7 мкм, длина 3,4 – 7,9 мкм, подвижные (перитрихи), споры овальные, субтерминальные; желатин гидролизуют, молоко не свертывают и не пептонизируют; рост на среде Китта – Тароцци с умеренным газообразованием. На кровяном агаре колонии круглые, с неровными краями, слегка приподняты, гладкие, серовато-белого цвета, полупрозрачные, окружены зоной гемолиза. Температурный оптимум для роста 30 – 37 °C, содержание Г + Ц в ДНК – 26 – 28 мол %.
Тип G. Прямые палочки, диаметр 1,3 – 1,9 мкм, длина 1,6 – 9,4 мкм, подвижны (перитрихи), споры овальные, субтерминальные, грамположительны. На кровяном агаре колонии круглые, диаметром 0,5 – 1,5 мм, с ровными краями, приподнятые, полупрозрачные, серые, гладкие, с блестящей поверхностью; на среде Китта – Тароцци рост умеренный, без ферментации глюкозы; молоко пептонизируют медленно. Температурный оптимум для роста 30 – 37 °C. Обнаружен в почве. Случаи заболевания людей, вызванных этим типом, не известны.
Резистентность. Длительное сохранение C. botulinum в природе и в различных пищевых продуктах связано с их спорообразованием. Споры сохраняются в почве долгое время, а при благоприятных условиях в летнее время могут прорастать и размножаться. Они хорошо переносят низкие температуры (не погибают даже при –190 °C). В высушенном состоянии сохраняют жизнеспособность десятилетиями. Споры устойчивы и к нагреванию (особенно типа А). Споры типов А и В переносят кипячение в течение 5 ч, при температуре 105 °C погибают через 1 – 2 ч, при 120 °C – через 20 – 30 мин. Встречаются штаммы, споры которых переносят температуру 120 °C в течение нескольких часов. Споры C. botulinum устойчивы ко многим бактерицидным веществам: 20 % раствор формалина убивает их через 24 ч; этиловый спирт – через 2 мес.; 10 %-ная HCl убивает их лишь через 1 ч.
Токсины C. botulinum также весьма устойчивы к действию физических и химических факторов. Они не разрушаются протеолитическими ферментами кишечного тракта. В кислой среде (рН 3,5 – 6,8) они более устойчивы, чем в нейтральной или щелочной среде, разрушаются от действия 2 – 3 %-ной щелочи, но высокие концентрации NaCl в пищевых продуктах их не разрушают; в консервах токсины сохраняются длительное время. Токсины C. botulinum обладают и определенной термоустойчивостью: при 58 °C разрушаются через 3 ч; при 80 °C – через 30 мин; а при 100 °C – в течение нескольких минут. Наиболее устойчивы токсины типа С, менее устойчивы токсины типов D и E, а токсины типов А и В занимают промежуточное положение. Устойчивость токсинов к высокой температуре зависит от вида продукта, его рН и других условий. В частности, при наличии жиров, высокой концентрации сахарозы устойчивость токсинов к высокой температуре возрастает.
Факторы патогенности. Главный фактор патогенности возбудителя ботулизма – экзотоксины. Хотя они отличаются по антигенным свойствам, их биологическая активность одинакова. Все они – варианты одного нейротоксина. Антигенная специфичность и летальная активность определяются различными детерминантами экзотоксина. Токсины всех типов продуцируются в виде токсических белковых комплексов (прогениторных токсинов). В зависимости от молекулярной массы и структуры эти комплексы делят соответственно константам седиментации на 3 группы: 12S– (300 кД), 16S– (500 кД) и 19S– (900 кД) токсины. Недавно у типов А и В обнаружены сверхтоксичные сверхкомплексы токсинов.
12S-токсины (М-токсины) состоят из молекулы нейротоксина, ассоциированной с молекулой нетоксического белка, который не обладает гемагглютинирующими свойствами. 16S-токсины (L-токсины) – структуры, состоящие из М-комплекса и нетоксического белка, который отличается от белка М-комплекса и обладает гемагглютинирующими свойствами. 19S-токсины (LL-токсины) – наиболее крупные структуры, включаюшие в себя нейротоксин и нетоксический белок со свойствами гемагглютинина.
Клостридии ботулизма типа А могут продуцировать токсические комплексы трех вариантов: M, L и LL, типов B, C и D – в виде L– и M-токсинов, а типов E и F – только в виде М-токсинов. Таким образом, одна и та же культура C. botulinum может продуцировать несколько типов токсических комплексов. Функции нетоксических негемагглютинирующих, как и гемагглютинирующих белков (их идентифицировано три типа: 15 кД, 35 кД и 70 кД), пока не установлены. Нейротоксические компоненты любого серотипа ботулинических токсинов и любого типа токсического комплекса имеют сходную структуру и биологические свойства. Они синтезируются в виде единой полипептидной цепи с м. м. 150 кД (7S-токсин), которая не обладает значительной токсической активностью. Эта полипептидная цепь превращается в активный нейротоксин только после ее разрезания бактериальной протеазой или протеазами кишечного тракта человека. В результате точечного гидролиза возникает структура, состоящая из двух связанных между собой дисульфидными связями цепей – тяжелой, с м. м. 100 кД (Н-цепь), и легкой, с м. м. 50 кД (L-цепь). Н-цепь ответственна за прикрепление нейротоксина к рецепторам мембраны клеток, а L-цепь осуществляет специфическое блокирующее действие нейротоксина на холинергическую передачу возбуждения в синапсах. Токсины типов С1 и С2 отличаются друг от друга не только серологически, но еще и тем, что токсина С2 вегетативные формы культур не образуют. Он образуется лишь в период спорообразования, а его активация обеспечивается микробной протеазой.
Способность возбудителя ботулизма продуцировать протеолитические ферменты играет важную роль в токсинообразовании. Протеолитические группы возбудителей обеспечивают активацию протоксинов своими эндогенными протеазами, а активация нейротоксинов, продуцируемых непротеолитическими вариантами серотипов C. botulinum, осуществляется экзогенным путем, т. е. с помощью протеаз желудочнокишечного тракта при заражении или in vitro – трипсином.
Помимо выраженной нейротоксической активности, различные типы C. botulinum обладают лейкотоксической, гемолитической и лецитиназной активностью. Особенность лейкотоксина заключается в том, что он подавляет фагоцитоз без разрушения лейкоцитов. Различные сроки накопления в культуральной среде лейкотоксинов, гемотоксинов и лецитиназы при инкубации C. botulinum указывают на то, что они имеют, по-видимому, разную химическую природу.
Локус генов токсических комплексов содержит гены нейротоксинов (bont), гены нетоксического негемагглютинирующего белка (ntnh), гены гемагглютининов (ha+ или ha—) и ген botR, продукт которого выполняет роль позитивного регулятора.
Особенности эпидемиологии. Естественной средой обитания C. botulinum является почва, откуда они попадают в воду, на пищевые продукты, фураж, в кишечник человека, млекопитающих, птиц и рыб, где размножаются. В ряде стран мира (США, Канада и др.) ботулизм существует в виде природных очагов: в местах, где почва, растения и вода содержат много C. botulinum, неоднократно наблюдалась массовая гибель диких водоплавающих птиц и иных животных (ондатры, лягушки и др.), играющих важную роль в эпидемиологии ботулизма. Установлено носительство C. botulinum в кишечнике у лошадей, рогатого скота, свиней, кур, грызунов. Загрязняя своими испражнениями продукты, фураж, почву, они способствуют широкому обсеменению клостридиями окружающей среды.
Заражение красной и частиковой рыбы возбудителем ботулизма может быть эндогенным – из их кишечника, и экзогенным – из внешней среды (при неправильных транспортировке и хранении).
Все сельскохозяйственные продукты, загрязненные почвой, испражнениями человека и животных, могут быть заражены возбудителями ботулизма и стать причиной заболевания человека.
Ботулизм встречается во всех регионах Земного шара, но чаще регистрируется в странах, где население употребляет большое количество различных консервированных продуктов. В каждой стране источником отравления служат консервы, пользующиеся наибольшим спросом: в Германии, Франции и других европейских странах – мясные консервы, колбаса, ветчина и т. п.; в США – растительные консервы; в России – рыба и рыбные консервы. Ботулизм не контагиозен. Заболевание наступает лишь при употреблении пищи, содержащей возбудителя и его токсины. Поскольку C. botulinum – строгий анаэроб, наилучшие условия для его размножения и продукции токсина создаются в консервированных продуктах, куда споры могут попасть с частичками почвы. Они могут выдерживать термическую обработку консервов, а затем прорастать и продуцировать токсин, чему способствует длительное хранение консервов. Заболеваемость ботулизмом невысока, он встречается чаще как спорадическое заболевание. Однако известны и групповые вспышки, например вспышка в 1933 г. в городе Днепропетровске, когда в результате отравления кабачковой икрой заболело 230 человек, 26 из них умерли. Крайне редко заражение происходит при ранениях.
Особенности патогенеза и клиники. Ботулизм протекает как токсикоинфекция. Организм поражается не только токсином, содержащимся в пищевом продукте, но и токсином, который образуется в пищеварительном тракте и тканях в связи с проникновением туда возбудителя. Люди чрезвычайно чувствительны к ботулиническим токсинам типов A, B, C, E и F. Заболевания наблюдались даже тогда, когда человек брал в рот зараженный продукт, но не проглатывал его. Смертельная доза токсина для человека составляет 1 нг/кг массы тела. Ботулинический токсин быстро всасывается в желудке и кишечнике, проникает в кровь и избирательно действует на ядра продолговатого мозга и ганглиозные клетки спинного мозга. Следует отметить, что, попадая в пищеварительный тракт человека или животного, клостридии ботулизма размножаются, проникают в кровь и оттуда во все органы, продуцируя при этом токсины. Инкубационный период у людей варьирует от двух часов до 10 дней, но чаще всего он составляет 18 – 24 ч. Чем больше инфицирующая доза, тем короче инкубационный период и тем тяжелее протекает заболевание.
Клиническая картина ботулизма обычно складывается из сочетания различных мионеврологических синдромов, из которых раньше всего проявляется офтальмоплегический: у больного нарушается аккомодация, неравномерно расширяются зрачки, появляется косоглазие, двоение в глазах, опущение век, а иногда и слепота. Эти симптомы связаны с поражением глазодвигательных нервов. Затем присоединяется парез мускулатуры языка (афония), глотание затрудняется, мышцы шеи, туловища и кишечника ослабевают (парезы, запоры, метеоризм), наблюдается выделение густой тягучей слизи. Температура может быть нормальной, иногда повышается. Сознание сохраняется. Как правило, никаких острых явлений воспаления со стороны желудочно-кишечного тракта не отмечается. В заключительной стадии болезни основную роль играет расстройство дыхания, смерть наступает от паралича дыхания и сердца. Летальность составляет 35 – 85 %.
Постинфекционный иммунитет. Перенесенное заболевание, очевидно, оставляет типоспецифический антитоксический иммунитет, перекрестный иммунитет не формируется. Продолжительность и напряженность постинфекционного иммунитета и роль в нем антимикробных антител и фагоцитов изучены недостаточно.
Лабораторная диагностика. Материалом для исследования служат: от больного – промывные воды желудка, испражнения, кровь, моча, рвотные массы; от трупа – содержимое желудка, тонких и толстых кишок, лимфатические узлы, а также головной и спинной мозг. Исследованию подвергают и продукт, послуживший причиной отравления. Исследования проводят с целью обнаружения и идентификации C. botulinum или, чаще всего, с целью обнаружения ботулинического токсина и установления его серотипа. Для выделения культуры C. botulinum материал засевают на плотные среды и накопительную среду Китта – Тароцци (часть пробирок при этом прогревают при температуре 85 °C в течение 20 мин для уничтожения неспорогенных бактерий). Из жидких культур после инкубирования делают посевы на плотные среды с целью получения изолированных колоний, а затем и чистых культур, которые идентифицируют по морфологическим, культуральным, биохимическим и токсигенным свойствам. Для обнаружения ботулинического токсина в исследуемом материале или в фильтрате полученной культуры можно использовать следующие три способа.
1. Биологическая проба на мышах. Для этого берут не менее 5 мышей. Одну из них заражают только исследуемым материалом, а каждую из остальных четырех – смесью материала с 200 АЕ антитоксической сыворотки соответствующего типа – А, В, С и Е. Смесь при комнатной температуре выдерживают 40 мин для нейтрализации токсина антитоксином. При наличии в исследуемом материале ботулинического токсина погибают все мыши, кроме той, которой была введена смесь материала с антитоксической сывороткой, нейтрализовавшей действие гомологичного типа токсина.
2. Использование РПГА с антительным диагностикумом, т. е. эритроцитами, сенсибилизированными антитоксинами соответствующих типов.
3. Высокочувствительный и специфический метод обнаружения ботулинического токсина основан на его способности подавлять активность фагоцитов. В присутствии соответствующей антитоксической сыворотки лейкотоксическое свойство токсина нейтрализуется.
Лечение. Наиболее эффективным методом лечения ботулизма является раннее применение антитоксических сывороток. Пока не установлен тип токсина, вызвавшего ботулизм, больному вводят внутримышечно по 10 000 МЕ антитоксической сыворотки типов А, С и Е и 5000 МЕ сыворотки типа В (всего 35 000 МЕ). В первые сутки сыворотку вводят повторно через каждые 5 – 10 ч, в тяжелых случаях – внутривенно. Всем лицам, которые употребляли пищу, ставшую причиной отравления, но не заболели, с профилактической целью вводится антитоксическая сыворотка по 2000 МЕ тех же типов. После установления типа токсина вводят только гомологичную антисыворотку. С целью стимулирования выработки активного иммунитета больному вводят также анатоксины типов А, В, С и Е, а после определения типа токсина только гомологичный анатоксин. Промыванием желудка и дачей слабительного добиваются скорейшего удаления токсина и возбудителя из кишечника. Серотерапию дополняют антибиотикотерапией, а также симптоматическим и общеукрепляющим лечением.
Профилактика. Для создания искусственного антитоксического иммунитета против ботулизма получены анатоксины, однако широкого применения они не нашли. В основе профилактики ботулизма лежит строгое соблюдение санитарно-гигиенического режима при обработке продуктов на предприятиях пищевой промышленности, особенно связанных с изготовлением консервов, ветчины, колбас, а также при копчении, солении рыбы и приготовлении из нее балыков. Изготовленные консервы после термической обработки должны подвергаться термостатному контролю (их выдерживают в термостате при 37 °C в течение определенного времени): клостридии, сохранившиеся в консервах, вызывают бомбаж (вздутие) банок, а содержимое их издает запах прогорклого масла. Такие консервы подлежат изъятию и тщательному бактериологическому исследованию. Для соления рыбы необходимо использовать крепкие солевые растворы – тузлуки, содержащие 10 – 12 % NaCl. Особенно опасными могут быть консервы домашнего приготовления, прежде всего грибные, изготовленные без соблюдения необходимого режима.
Патогенные бактероиды, превотелла и фузобактерии
Эту группу возбудителей ранее часто под общим названием «бактероиды» относили к одному семейству Bacteroidaceae. Теперь в составе этого семейства остался лишь род Bacteroides. Bacteroides melaninogenicus перенесен в род Prevotella, выделенный в семейство Prevotellaceae, а вид этот стал называться Prevotella melaninogenica. Род Fusobacterium также выделен в отдельное семейство Fusobacteriaceae, которое отнесено даже к другому типу – Fusobacteria. Бактероиды, превотелла и фузобактерии – анаэробные грамотрицательные прямые и изогнутые палочки, широко распространенные в природе. Основной средой их обитания являются слизистые оболочки ротовой полости, желудочно-кишечного тракта, мочеполовых путей человека и животных. При определенных условиях эти бактерии могут стать причиной гнойно-воспалительных заболеваний различной локализации: аппендицита, перитонита, сепсиса, парапроктита, гангрены отдельных органов, раневой инфекции и т. п. Очень часто эти процессы вызываются бактероидами, превотеллой и фузобактериями (аспорогенная анаэробная микрофлора) в ассоциации с другими микроорганизмами (факультативные анаэробы и облигатные спорогенные анаэробы). Особенностью течения заболевания при такой микст-инфекции являются быстрота развития процесса, некротизация тканей, признаки выраженной интоксикации, трудности диагностики и лечения. Все это – следствие синергизма, когда патогенные свойства различных микроорганизмов взаимно усиливаются. Довольно редко бактероиды, превотелла и фузобактерии выделяются из патологического материала в чистой культуре, обычно рост наблюдается в ассоциации с другими бактериями. В чистой культуре эти возбудители чаще выделяются посевом крови при сепсисе и посевом спинномозговой жидкости – при менингите.
Важным условием для развития инфекции, вызываемой бактероидами, превотеллой или фузобактериями, служит наличие предрасполагающих факторов, приводящих к снижению уровня кислорода или окислительно-восстановительного потенциала в тканях. Такими факторами могут быть травма, спазмы и сужения сосудов, некроз, сопутствующие инфекции, вызванные другими бактериями. Общими предрасполагающими факторами следует считать также хирургические вмешательства (особенно при операциях на кишечнике или в полости рта), лейкозы, злокачественные новообразования, диабет, артериосклероз, алкоголизм, использование антибиотиков, иммунодепрессантов и кортикостероидов, рентгеновское и гамма-облучение.
Род Bacteroides включает 26 видов облигатных анаэробов, большинство из которых может быть причиной заболеваний человека. По морфологии это прямые или слегка изогнутые палочки размером 0,5 – 0,8 × 1 – 2 мкм, могут располагаться поодиночке, парами или короткими цепочками из 3 – 4 клеток, грамотрицательны, спор не образуют, некоторые виды образуют капсулы, некоторые – подвижны (перитрихи). По последним двум свойствам и требовательности к питательным средам и особенностям роста все виды можно условно разделить на 3 группы (по Prevot, 1966). 1. Неподвижные, иногда образующие капсулы бактероиды (B. fragilis и другие виды). Представители именно этой группы, а также Prevotella melaninogenica чаще всего бывают причиной заболеваний человека. 2. Неподвижные, образующие капсулу, нуждающиеся при росте на средах в нативной сыворотке или асцитической жидкости. 3. Подвижные, не образующие капсул, образующие газ или не образующие газа при ферментации.
B. fragilis растет медленно (5 – 7 сут.) на плотных и жидких средах, добавление свежей крови или сыворотки необязательно, но значительно ускоряет рост. Колонии на кровяном агаре появляются на 3 – 5-й день, их диаметр меньше 1 мм, гемолиза нет. На мясном бульоне через 48 ч B. fragilis дает диффузное помутнение; ферментирует некоторые сахара с образованием кислоты и небольшого количества газа; желатин не разжижает, индола и сероводорода не образует. Имеется несколько подвидов этого микроба. Содержание Г + Ц в ДНК составляет 40,5 – 42,0 мол %.
Род Prevotella включает 24 вида, в том числе P. melaninogenica (= Bacteroides melaninogenicus). Этот вид хорошо растет на кровяном агаре, образуя гладкие или шероховатые колонии диаметром 1 – 3 мм, иногда наблюдается гемолиз. Культура обычно имеет неприятный гнилостный запах. Для роста требуется гемин и витамин К. На кровяном агаре образует черный пигмент, представляющий собой комплекс гематина с бактериальным протеином; пигментирован обычно центр колонии. Непостоянно ферментирует некоторые углеводы с образованием кислоты и газа.
Оптимальная температура роста бактероидов и превотеллы 37 °C при рН 7,6 – 7,8. Рост некоторых видов стимулируется не только кровью, но и добавлением в среду глюкозы, цистеина, иногда желчи.
Биохимические свойства (протеолитические и сахаролитические) зависят, прежде всего, от вида и подвида бактероида и превотеллы и могут быть использованы для дифференциации выделенной культуры. Для этих же целей используют определение конечных кислых продуктов брожения на специальной среде (пептонно-дрожжевой бульон с глюкозой), которыми могут быть летучие и нелетучие органические кислоты (пропионовая, уксусная, бутиловая, янтарная, молочная и др.).
В антигенном отношении бактероиды и превотеллы неоднородны, их серологическая классификация пока только уточняется. Установлено, что, например, у вида B. fragilis имеется свыше 20 сероваров, у B. melaninogenicus – 4 сероварианта. Факторами патогенности бактероидов являются некоторые ферменты (нейраминидаза, нуклеазы, фибринолизин). Капсульный полисахарид у B. fragilis способен подавлять фагоцитоз. У других бактероидов и превотелл в качестве факторов патогенности выступают белки наружной мембраны и липополисахарид клеточной стенки. При септицемии и тяжелых воспалительных процессах, вызванных бактероидами и превотеллами, в сыворотке крови больных в довольно высоких титрах появляются антитела, сохраняющиеся в течение нескольких месяцев. Они могут быть обнаружены в реакциях агглютинации, преципитации в геле, РПГА.
Единственным эффективным методом диагностики заболеваний, вызванных бактероидами и превотеллами, является бактериологический. Материал для посева – кровь, мокрота, гной из абсцессов и других полостей, испражнения – засевают на специальные питательные среды; инкубируют в анаэробных условиях при 37 °C. Следует учитывать, что многие штаммы анаэробов чрезвычайно чувствительны к кислороду и при последующих пересевах быстро теряют жизнеспособность. Идентификация патогенных бактероидов основана на изучении культуральных, биохимических признаков, толерантности к кислороду и СО2 и некоторых других свойств. Специфическая профилактика не разработана. Лечение антибиотиками проводят в соответствии с индивидуальной чувствительностью конкретного штамма-возбудителя при изучении выделенной чистой культуры. Хороший эффект дает сочетание антибиотиков с метронидазолом.
Род Fusobacterium включает 16 видов, многие из которых являются естественными обитателями организма теплокровных животных и человека. Наиболее частыми возбудителями воспалительно-некротических заболеваний человека (устаревшее название заболевания – некробациллез) являются два вида – F. necrophоrum и F. nucleatum.
Эти бактерии грамнегативны, чрезвычайно склонны к полиморфизму. Чаще имеют вид прямых или слегка изогнутых веретенообразных палочек с заостренными концами размером 0,5 – 1,5 × 2 – 3 мкм, но в чистой культуре могут встречаться нитевидные формы до 80 – 100 мкм и ветвящиеся формы. В старых культурах преобладают короткие палочки, которые на средах бывают значительно толще, чем в патологическом материале. Бактерии неподвижны, спор и капсул не образуют; по Леффлеру и разведенным фуксином красятся неравномерно: слабо окрашенные участки бывают значительно толще, чем хорошо окрашенные, и располагаются на одинаковом расстоянии по длине микроба, имитируя присутствие спор.
Температурный оптимум для их роста 37 °C, рН 7,6. Фузобактерии хорошо растут на мясных жидких средах, печеночном бульоне, сердечно-мозговом бульоне с глюкозой под вазелиновым маслом. Рост сопровождается помутнением среды, образованием газа и запаха, напоминающего сыр, добавление к среде бычьей сыворотки или асцитической жидкости значительно ускоряет рост. В строго анаэробных условиях на сывороточном агаре фузобактерии образуют маленькие, круглые с ровными или неровными краями, непрозрачные, грязновато-белые с желтоватым центром колонии. На кровяных средах обычно вызывают гемолиз.
Желатин и свернутую сыворотку не разжижают, обычно не восстанавливают нитраты в нитриты. Как правило, выделяют индол и сероводород, не растут в присутствии желчи и желчных солей.
Биохимические свойства могут быть использованы для дифференциально-диагностических целей: в зависимости от вида фузобактерии могут или не могут ферментировать глюкозу, левулезу, маннозу, гидролизовать эскулин и крахмал, выделять липазу, образовывать летучие органические кислоты на пептонно-дрожжевом бульоне с глюкозой. Антигенное строение фузобактерий, как и постинфекционный иммунитет, мало изучены. Патогенные свойства связаны с эндотоксином – липополисахаридом клеточной стенки, а также с ферментами агрессии и защиты: плазмокоагулазой, фибринолизином, нуклеазами. Некоторые штаммы вырабатывают гемотоксин; такие штаммы обладают значительной вирулентностью и иногда могут вызвать внутрилабораторное заражение.
Фузобактерии при температуре 65 °C погибают в течение 15 мин, при кипячении – моментально. При высушивании на воздухе погибают через 24 – 48 ч. Рабочие растворы дезинфицирующих веществ убивают их в течение 10 – 20 мин. В испражнениях животных и человека фузобактерии могут сохраняться до 30 – 50 сут.
При лабораторной диагностике заболеваний, вызванных фузобактериями, можно использовать микроскопический, бактериологический и биологический методы. Микроскопический метод применяют для диагностики поражений кожи и слизистых оболочек. Материал для приготовления мазка берут на границе живой и некротизированной ткани, мазок фиксируют и окрашивают по Граму, Леффлеру или водным фуксином. Возбудитель имеет вид зернистоокрашенных длинных нитей и палочек. Для бактериологического исследования берут гной из язв на поверхности тела или из полостей при поражении внутренних органов, трупный материал. Посев чаще всего делают на кровяной агар, инкубируют в анаэробных условиях. Чистую культуру идентифицируют по биохимическим свойствам. Биологический метод используют параллельно с бактериологическим и чаще применяют при работе с сильно загрязненным посторонней флорой патологическим материалом. Белым мышам материал вводят у основания хвоста, где развивается некроз, и они погибают на 8 – 10-е сут.; при посеве материала, взятого на границе живой и пораженной ткани, легко можно выделить возбудителя. Кроликов заражают подкожно в область брюшных мышц или под кожу уха и внутривенно. Некротический процесс захватывает большие участки кожи, где на 4 – 5-е сутки можно легко обнаружить возбудителя или выделить чистую культуру.
Специфическая профилактика не разработана. Лечение проводят антибиотиками, к которым данный штамм чувствителен, в сочетании с парентеральным введением метронидазола (метрогила).
Микобактериозы
Туберкулез (лат. tuberculum – бугорок) – инфекционное заболевание человека и животных с наклонностью к хроническому течению, характеризующееся образованием специфических воспалительных изменений, часто имеющих вид маленьких бугорков, с преимущественной локализацией в легких и лимфатических узлах. Туберкулез распространен повсеместно. В заболеваемости туберкулезом и его распространении решающее значение имеют социально-бытовые условия жизни, так как и врожденная устойчивость, и приобретенный к нему иммунитет определяются этими условиями.
Возбудитель туберкулеза – Mycobacterium tuberculosis – был открыт в 1882 г. Р. Кохом. Он относится к роду Mycobacterium семейства Mycobacteriaceae. Микобактерии широко распространены в природе: они встречаются в почве, воде, в организме теплокровных и холоднокровных животных. Морфологически характеризуются способностью образовывать нитевидные и ветвящиеся формы, особенно в старых культурах. Кроме того, они отличаются от других микроорганизмов более высокой устойчивостью к кислотам, щелочам и спирту, что связано с особенностями химического состава их клеток.
M. tuberculosis имеет форму тонких, стройных, коротких или длинных, прямых или искривленных палочек, длиной 1,0 – 4,0 мкм и диаметром 0,3 – 0,6 мкм; неподвижны; спор, капсул не образуют, грамположительны; обладают большим полиморфизмом. В старых культурах наблюдаются нитевидные, ветвящиеся формы, нередко зернистые формы (зерна Муха), как в виде свободно лежащих зерен, так и в виде зерен, содержащихся внутриклеточно. В организме больных под влиянием химиопрепаратов часто образуются ультрамалые формы, способные проходить через мелкопористые бактериальные фильтры («фильтрующиеся формы»). M. tuberculosis – аэроб, оптимальная температура для роста 37 °C, оптимальная рН – в пределах 6,4 – 7,0. Содержание Г + Ц в ДНК – 62 – 70 мол % (для рода). Рост при температуре 37 °C стимулируется инкубацией в воздухе, содержащем 5 – 10 % CO2, и добавлением к среде 0,5 % глицерина. Микобактерии туберкулеза способны синтезировать ниацин; каталазная активность относительно слабая и утрачивается при 68 °C. Многие биологические свойства микобактерий объясняются высоким содержанием липидов, составляющих до 40 % сухого остатка клеток. Обнаружены три фракции липидов: фосфатидная (растворимая в эфире), жировая (растворимая в эфире и ацетоне) и восковая (растворимая в эфире и хлороформе). В составе липидов имеются различные кислотоустойчивые жирные кислоты, в том числе туберкулостеариновая, фтиоидная, миколовая и др. Высокое содержание липидов определяет следующие свойства туберкулезных палочек.
1. Устойчивость к кислотам, щелочам и спирту.
2. Трудная окрашиваемость красителями. Для их окрашивания применяют интенсивные методы. Например, по способу Циля – Нильсена окрашивают концентрированным раствором карболового фуксина при подогревании. Восприняв окраску, туберкулезные бактерии, в отличие от других клеток, не обесцвечиваются ни спиртом, ни кислотой, ни щелочью, поэтому при докрашивании метиленовым синим в мазке все бактерии, клеточные элементы и слизь окрашиваются в синий цвет, а туберкулезные палочки сохраняют исходную красную окраску (см. цв. вкл., рис. 107.1). Этот метод позволяет дифференцировать их от некоторых непатогенных микобактерий, например M. smegmatis, содержащихся на слизистой оболочке уретры, но обесцвечивающихся спиртом. Вместе с тем необходимо иметь в виду, что встречаются и кислотоподатливые («синие» при окрашивании по Цилю – Нильсену) формы туберкулезных бактерий (в том числе палочковидные, нитевидные и зернистые).
3. Относительно высокая устойчивость к высушиванию и действию солнечных лучей. Рассеянный солнечный свет убивает их лишь через 8 – 10 сут. В мокроте при кипячении гибель наступает через 5 – 7 мин. В высохшей мокроте жизнеспособность сохраняется в течение многих недель.
4. Устойчивость к действию обычных дезинфицирующих веществ: 5 % раствор фенола при добавлении в равном объеме к мокроте вызывает гибель туберкулезных палочек через 6 ч, однако 0,05 % раствор бензилхлорфенола убивает через 15 мин.
5. Высокая гидрофобность, которая находит свое отражение в культуральных свойствах: на глицериновом бульоне рост в виде пленки желтоватого цвета, которая постепенно утолщается, становится ломкой и приобретает бугристо-морщинистый вид, при этом бульон остается прозрачным. На глицериновом агаре через 7 – 10 дней образуется сухой чешуйчатый налет, постепенно переходящий в грубые бородавчатые образования (см. цв. вкл., рис. 107.2 и см. рис. 107.3). На щелочном альбуминате (или на стекле, помещенном в цитратную лизированную кровь) рост туберкулезных бактерий, содержащих поверхностный гликолипид – корд-фактор, змеевидный: размножающиеся клетки располагаются, образуя структуру, напоминающую змею, жгут, веревку или женскую косу.
6. С высоким содержанием липидов связана и патогенность туберкулезных бактерий. Содержащиеся в липидах фтиоидная, миколовая и другие жирные кислоты оказывают своеобразное токсическое действие на клетки тканей. Например, фосфатидная фракция, наиболее активная из всех липидов, обладает способностью вызывать в нормальном организме специфическую тканевую реакцию с образованием эпителиоидных клеток, жировая фракция – туберкулоидной ткани. Эти свойства указанных липидных фракций связаны с наличием в их составе фтиоидной кислоты. Восковая фракция, содержащая миколовую кислоту, вызывает реакции с образованием многочисленных гигантских клеток. Таким образом, с липидами, состоящими из нейтральных жиров, восков, стеринов, фосфатидов, сульфатидов и содержащими такие жирные кислоты, как фтиоидная, миколовая, туберкулостеариновая, пальмитиновая и др., связаны патогенные свойства туберкулезной палочки и те биологические реакции, которыми ткани отвечают на их внедрение. Главным фактором патогенности является токсический гликолипид (корд-фактор), который располагается на поверхности и в толще клеточной стенки. По химической природе он представляет собой полимер, состоящий из одной молекулы дисахарида трегалозы и связанных с ней в эквивалентных соотношениях миколовой и миколиновой высокомолекулярных жирных кислот, – трегалоза-6,6'-димиколат (С186Н366О117). Корд-фактор не только оказывает токсическое действие на ткани, но и защищает туберкулезные палочки от фагоцитоза, блокируя окислительное фосфорилирование в митохондриях макрофагов. Будучи поглощенными фагоцитами, они размножаются в них и вызывают их гибель. Корд-фактор обладает двумя характерными свойствами, указывающими на его важную роль как основного фактора патогенности.
1. При внутрибрюшинном заражении белых мышей он вызывает их гибель (после нескольких повторных инъекций по 0,005 мг) через 1 – 2 нед. после первой инъекции с явлениями распространенной легочной гиперемии. Подобным действием не обладает ни одна другая фракция туберкулезной палочки.
2. Он подавляет миграцию лейкоцитов больного туберкулезом человека (in vivo и in vitro).
M. tuberculosis, лишенные корд-фактора, являются непатогенными или слабопатогенными для человека и морских свинок. С необычным химическим составом туберкулезных клеток связана также способность их вызывать характерную для туберкулеза реакцию гиперчувствительности замедленного типа, выявляемую с помощью туберкулиновой пробы.
Помимо M. tuberculosis, заболевания людей могут вызывать M. bovis – возбудитель туберкулеза крупного рогатого скота, и M. avium – возбудитель туберкулеза птиц.
M. bovis – короткие и умеренно длинные толстые палочки. M. avium отличаются большим полиморфизмом (короткие и длинные палочки, иногда нити), оптимальная температура для их роста 42 – 43 °C.
Основное отличие M. bovis от M. tuberculosis заключается в их высокой патогенности для кроликов и других млекопитающих. При внутривенном заражении M. bovis в дозах 0,1 и 0,01 мг культуры кролики погибают от генерализованного туберкулеза через 3 – 6 нед. Заражение кроликов M. tuberculosis даже в дозе 0,1 мг не вызывает их гибели, у них развиваются местные доброкачественные, непрогрессирующие очаги в легких. При внутривенном заражении кроликов M. avium животные погибают через 1,5 – 2 нед. от септикопиемии.
Род Mycobacterium включает более 40 видов. Как оказалось, многие из них нередко выделяются в различных странах мира от людей, теплокровных и холоднокровных животных, страдающих заболеваниями легких, кожи, мягких тканей и лимфатических узлов. Эти заболевания получили название микобактериозов. Различают три типа микобактериозов, зависящих от вида микобактерий и иммунного статуса организма.
I. Генерализованные инфекции с развитием видимых невооруженным глазом патологических изменений, внешне напоминающих туберкулезные, но гистологически несколько отличающиеся от них.
II. Локализованные инфекции, характеризующиеся наличием макро– и микроскопических поражений, выявляемых в определенных участках тела.
III. Инфекции, протекающие без развития видимых поражений; возбудитель обнаруживается в лимфатических узлах внутриклеточно или внеклеточно.
По патогенным свойствам род Mycobacterium подразделяют на две группы: 1) патогенные и условно-патогенные (потенциально патогенные) и 2) сапрофиты. Для их ускоренной предварительной дифференциации учитывают прежде всего три признака: а) скорость и условия роста; б) способность к пигментообразованию; в) способность синтезировать никотиновую кислоту (ниацин).
По скорости роста род Mycobacterium подразделяют на три группы:
1. Быстрорастущие – крупные видимые колонии появляются ранее 7-го дня инкубации (18 видов).
2. Медленнорастущие – крупные видимые колонии появляются после 7 и более дней инкубации (20 видов).
3. Микобактерии, которые требуют специальных условий для роста или не растут на искусственных питательных средах. К этой группе относятся два вида: M. leprae и M. lepraemurium.
Дифференциация видов микобактерий среди быстро– и медленнорастущих проводится с учетом ряда их биохимических признаков: восстановление нитратов, теллурита; наличие каталазы, уреазы, никотин– и пиразинамидазы, способность синтезировать ниацин; а также пигментообразование (см. табл. 46).
По способности к пигментообразованию микобактерии также делят на 3 группы:
1. Фотохромогенные – образуют пигмент лимонно-желтого цвета при росте на свету.
2. Скотохромогенные – образуют пигмент оранжево-желтого цвета при инкубировании в темноте.
3. Нефотохромогенные – пигмента не образуют (независимо от наличия света), иногда культуры имеют светло-желтоватую окраску.
К патогенным и потенциально патогенным относится 24 вида.
1. Медленнорастущие:

3. Не растущие внеклеточно или требующие специальных условий для роста:

К наиболее частым возбудителям туберкулеза и микобактериозов относятся:
M. tuberculosis M. bovis M. ulcerans

Все они медленнорастущие, нефотохромогенные (кроме M. kansasii) микобактерии. Основные различия между ними указаны в табл. 49.
В России главную роль в этиологии и эпидемиологии туберкулеза играет M. tuberculosis, на долю M. bovis приходится 2 – 3 % (в мире на долю этого возбудителя приходилось 4 – 20 %) заболеваний. Однако в африканских странах, США и ряде других стран микобактериозы, вызванные иными видами, составляют до 30 % всех заболеваний, относимых к туберкулезным.
Таблица 49
Дифференциальные признаки некоторых медленнорастущих видов рода Mycobacterium
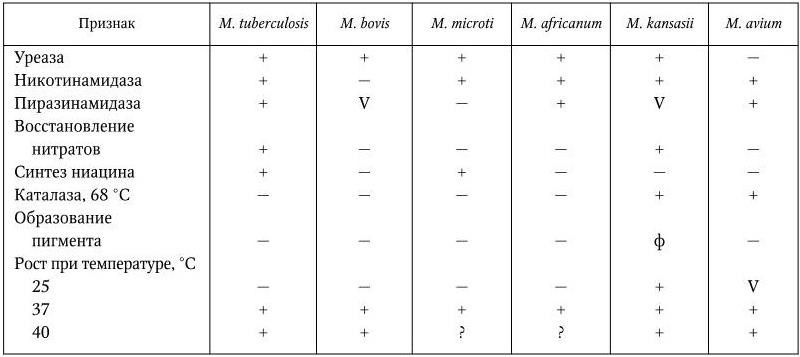
Примечание. (+) – признак положительный; V – признак непостоянный; ( – ) – признак отрицательный; ф – фотохромогенный.
Для культивирования туберкулезных бактерий предложены различные питательные среды: глицериновые, картофельные с желчью, яичные, полусинтетические и синтетические. Наилучшей считается яичная среда Левенштейна – Иенсена. Кроме того, предложена специальная полужидкая среда для выделения L-форм M. tuberculosis. Эффективность получения культур микобактерий зависит от строгого соблюдения ряда условий: кислая рН, оптимальная температура, высокое качество питательной среды, достаточное обеспечение О2, соответствующая посевная доза, особенно с учетом возможного наличия измененных форм возбудителя.
Антигенная структура M. tuberculosis. В антигенном отношении этот вид однороден (сероваров не выявлено), имеет большое сходство с M. bovis и M. microti, но существенно отличается от других видов. Однако микробная клетка имеет сложный и мозаичный набор антигенов, способных вызывать в организме человека и животных образование антиполисахаридных, антифосфатидных, антипротеиновых и иных антител, различающихся по своей специфичности. Живые и убитые бактерии способны индуцировать развитие гиперчувствительности замедленного типа. Этим свойством не обладают ни белки, ни одна из липидных фракций микобактерий.
Для внутривидовой дифференциации M. tuberculosis разработана система классификации, основанная на фаготипировании штаммов с помощью набора из десяти микобактериофагов: 4 основных и 6 вспомогательных.
Патогенность для лабораторных животных. Наиболее восприимчивы к M. tuberculosis морские свинки. При любом способе заражения туберкулезная палочка вызывает у них генерализованную форму туберкулеза, от которой свинка погибает через 4 – 6 нед. При подкожном заражении через 1,5 – 2 нед. на месте введения образуется инфильтрат, переходящий в язву, которая не заживает до гибели животного. Регионарные лимфатические узлы увеличиваются, становятся плотными и подвергаются казеозному распаду. В печени, селезенке, легких и других органах образуются многочисленные бугорки, в которых при бактериоскопии обнаруживаются M. tuberculosis.
Эпидемиология. Источником заражения являются больной туберкулезом человек, реже животные. От больного человека возбудитель выделяется главным образом с мокротой, а также с мочой, испражнениями и гноем. Туберкулезная палочка проникает в организм чаще всего через дыхательные пути – воздушно-капельным и, особенно часто, воздушно-пылевым путем. Однако входными воротами могут быть любые слизистые оболочки и любой поврежденный участок кожи. Заражение M. bovis от крупного рогатого скота происходит в основном алиментарным путем через инфицированные молоко и молочные продукты. Туберкулез, вызванный M. bovis, наблюдается чаще всего у детей, поскольку молоко для них служит основным продуктом питания. Однако заражение M. bovis от больных животных возможно и аэрогенным путем.
Особенности патогенеза. В зависимости от двух основных способов заражения первичный туберкулезный очаг локализуется или в легких, или в мезентеральных лимфатических узлах. Однако некоторые специалисты считают, что вначале происходит лимфогематогенное распространение возбудителя в обоих случаях заражения, а потом он избирательно поражает легкие или другие органы и ткани. При попадании через дыхательные пути (или другим способом) в альвеолы и бронхиальные железы туберкулезные палочки вызывают образование первичного аффекта в виде бронхопневмонического фокуса, из которого они по лимфатическим сосудам проникают в регионарный лимфатический узел, вызывая специфическое воспаление. Все это вместе: бронхопневмонический фокус + лимфангоит + лимфаденит – и образует первичный туберкулезный комплекс (первичный очаг туберкулеза). Туберкулезная палочка, благодаря наличию в ее клетках различных жирных кислот и других антигенов, вызывает в тканях определенную биологическую реакцию, которая приводит к формированию специфической гранулемы – бугорка. В центре его обычно располагаются гигантские клетки Пирогова – Лангганса со множеством ядер. В них обнаруживаются туберкулезные палочки. Центр бугорка окружен эпителиоидными клетками, которые составляют главную массу бугорка. По периферии его располагаются лимфоидные клетки. Судьба первичного очага может быть различной. В тех случаях, когда общая резистентность ребенка в силу ряда причин снижена, очаг может увеличиваться и подвергаться творожистому (казеозному) распаду в результате действия токсических продуктов туберкулезной палочки и отсутствия в бугорках кровеносных сосудов. Такая казеозная пневмония может стать причиной тяжелой первичной легочной чахотки, а при попадании возбудителя в кровь – генерализованного туберкулеза, приводящего ребенка к смерти. В большинстве же случаев при наличии достаточно высокой естественной резистентности организма первичный очаг через некоторое время окружается соединительнотканной капсулой, сморщивается и пропитывается солями кальция (обызвествляется), что рассматривается как завершение защитной реакции организма на внедрение туберкулезной палочки и означает формирование уже приобретенного нестерильного (инфекционного) иммунитета к туберкулезу, так как микобактерии могут сохранять жизнеспособность в первичном очаге многие годы.
В случае заражения алиментарным путем туберкулезные палочки попадают в кишечник, захватываются фагоцитами слизистой оболочки и заносятся по лимфатическим путям в регионарные кишечные лимфатические узлы, вызывая их характерные поражения. По мнению некоторых специалистов, туберкулезные палочки в этом случае через ductus thoracicus и правые отделы сердца также могут проникнуть в легкие и стать причиной туберкулеза легких.
Туберкулезная палочка может поражать практически любой орган и любую ткань с развитием соответствующей клиники заболевания.
Для клиники туберкулеза легких характерно чередование периодов выздоровления, наступающих после эффективной химиотерапии, и частых рецидивов, причиной которых являются сохранение в организме туберкулезных палочек, особенно в виде L-форм, и изменение иммунного статуса больного. L-формы микобактерий мало вирулентны, но, возвращаясь в исходную форму, они восстанавливают вирулентность и способны вновь и вновь вызывать обострения процесса.
Особенности иммунитета. Организм человека обладает высокой естественной резистентностью к возбудителю туберкулеза. Она и является причиной того, что в большинстве случаев первичное заражение приводит не к развитию заболевания, а к формированию очага, его отграничению и обызвествлению. Естественная резистентность во многом определяется социально-бытовыми условиями жизни, поэтому у детей, находящихся в тяжелых бытовых условиях, она может быть легко подорвана, и тогда первичное заражение приведет к развитию тяжелого туберкулезного процесса. Ухудшение условий жизни взрослых людей также может привести к ослаблению и естественной резистентности, и приобретенного иммунитета. С 1991 по 1996 г. показатель заболеваемости туберкулезом в России вырос с 30,6 до 42,2, а смертность возросла с 7,9 до 15,0 на 100 000 населения.
Приобретенный постинфекционный иммунитет при туберкулезе имеет ряд особенностей. Хотя у больных и переболевших обнаруживаются антитела к различным антигенам туберкулезной палочки, не они играют решающую роль в формировании приобретенного иммунитета. Для понимания его природы при туберкулезе очень важными были следующие наблюдения Р. Коха. Он показал, что если ввести здоровой морской свинке туберкулезные палочки, в месте заражения через 10 – 14 дней формируется отграниченный инфильтрат, а затем – упорно не заживающая до самой смерти свинки язва. Одновременно идет распространение возбудителя по лимфатическим путям, которое и приводит к генерализованному процессу и гибели животного. Если же ввести живые туберкулезные палочки морской свинке, зараженной за неделю до этого туберкулезом, то реакция развивается быстрее: воспаление появляется через 2 – 3 дня, приводит к некрозу, а образующаяся язва быстро заживает. При этом процесс ограничивается местом нового заражения и распространения возбудителя из него не происходит. Феномен Коха свидетельствует о том, что инфицированный туберкулезной палочкой организм отвечает на повторное заражение совершенно иначе, чем здоровый, так как у него к возбудителю сформировалась повышенная чувствительность (сенсибилизация), благодаря чему он приобрел способность быстро связывать новую дозу возбудителя и удалять ее из организма. Сенсибилизация проявляется в виде гиперчувствительности замедленного типа, она опосредуется системой Т-лимфоцитов. Т-лимфоциты с помощью своих рецепторов и при участии белков МНС класса I распознают клетки, инфицированные туберкулезными палочками, атакуют их и разрушают. Специфические антимикробные антитела, связываясь с различными микробными антигенами, образуют циркулирующие иммунные комплексы (ЦИК) и способствуют удалению антигенов из организма. Вместе с тем, взаимодействуя с микробными клетками, антитела к корд-фактору и другим факторам вирулентности могут оказывать токсическое действие на микобактерии; антитела к полисахаридным антигенам – усиливать фагоцитоз, активировать систему комплемента и т. д.
Аллергическая перестройка организма играет большую роль в патогенезе туберкулеза. Заболевание у взрослых людей, уже инфицированных туберкулезной палочкой, в большинстве случаев протекает в относительно доброкачественной форме местного процесса в легких, а не в виде генерализованного процесса, как у детей при первичном заражении. Появление реакции гиперчувствительности замедленного действия к туберкулезной палочке свидетельствует о формировании к ней приобретенного постинфекционного (и поствакцинального) иммунитета. Этот тип гиперчувствительности замедленного типа и был впервые выявлен Р. Кохом с помощью туберкулиновой пробы.
Туберкулиновая проба и ее значение. Свой препарат туберкулина Р. Кох получил следующим образом. Он стерилизовал текучим паром при 100 °C в течение 30 мин 5 – 6-недельную культуру туберкулезной палочки на глицериновом бульоне, а затем выпаривал ее при температуре 70 °C до 1/10 объема и фильтровал. Лица, инфицированные туберкулезной палочкой, на введение небольших доз туберкулина отвечают характерной реакцией: на месте внутрикожного введения не ранее чем через 6 – 8 ч появляется небольшое уплотнение, максимальное развитие реакции происходит в течение 24 – 48 ч, – образуется хорошо отграниченная папула диаметром не менее 0,5 см с геморрагическим или некротическим центром. Туберкулиновая аллергическая реакция является очень специфической. Подобную сенсибилизацию можно вызвать только цельными живыми или убитыми туберкулезными палочками, она выявляется туберкулином, но он сам по себе не вызывает такой сенсибилизации. Положительная туберкулиновая проба специфически свидетельствует об инфицировании организма туберкулезной палочкой и, следовательно, о наличии к ней приобретенного иммунитета. Туберкулиновая проба имела важное диагностическое значение для выявления первичного заражения туберкулезом детей в то время, когда не проводилась обязательная массовая вакцинация их против туберкулеза, но не взрослых, так как они в большинстве случаев инфицированы туберкулезной палочкой. Ныне туберкулиновая проба повсеместно используется для контроля эффективности противотуберкулезной вакцинации. В связи с тем, что старый коховский туберкулин содержит различные посторонние вещества и трудно стандартизуется, с 1934 г. для туберкулиновых проб используется высокоочищенный препарат туберкулина, полученный Ф. Зейбертом – PPD-S (purified protein derivative-Seibert). Международная стандартная единица туберкулина 0,000028 мг сухого порошка. Для определения туберкулиновой чувствительности используется 0,0001 мг PPDS. В нашей стране выпускают старый коховский туберкулин (АТК – альт-туберкулин Коха), содержащий 10 000 ТЕ (туберкулиновых единиц) в 1 мл (он применяется для накожной пробы и градуированной накожной пробы по Пирке), и очищенный препарат PPD, содержащий или 5 ТЕ в 0,1 мл или 100 ТЕ в 0,1 мл. Очищенный препарат PPD, содержащий 5 ТЕ/0,1 мл, используется для внутрикожной пробы Манту с целью отбора лиц, подлежащих ревакцинации. Ревакцинации подлежат лица, отрицательно реагирующие на внутрикожное введение 5 ТЕ PPD. Кроме того, имеются препараты-сенситины для выявления повышенной чувствительности к другим патогенным микобактериям.
Лабораторная диагностика. Для диагностики туберкулеза применяют все методы: бактериоскопический, бактериологический, серологический, биологический, аллергические пробы, ПЦР. При бактериоскопическом исследовании исходного материала (мокрота, моча, гной, спинномозговая жидкость, испражнения) необходимо учитывать, что содержание в нем микобактерий может быть незначительным, выделение их эпизодическим и в нем могут быть измененные варианты возбудителя, в том числе L-формы. Поэтому для повышения вероятности обнаружения микобактерий туберкулеза используют методы концентрирования их с помощью центрифугирования или флотации, а также фазово-контрастной (для обнаружения L-форм) и люминесцентной микроскопии (в качестве флуорохромов используют аурамин, аурамин-родамин, акридиновый оранжевый и др.).
Биологический метод – заражение морских свинок – является одним из наиболее чувствительных. Считается, что заражающая доза возбудителя для них составляет несколько клеток. Морские свинки могут быть использованы и для обнаружения L-форм туберкулезных бактерий, но в этом случае необходимо сделать несколько последовательных заражений, так как L-формы обладают меньшей вирулентностью и вызывают у свинок доброкачественную форму туберкулеза, которая в случае реверсии L-форм в исходное состояние может перейти в генерализованный процесс.
О значении туберкулиновой пробы сказано выше.
Из числа серологических реакций для диагностики туберкулеза предложены РСК, РПГА, реакции преципитации, методы иммуноферментного анализа (в том числе точечного), радиоиммунный метод, иммуноблотинг, реакция агрегат-гемагглютинации (для обнаружения ЦИК) и др. Использование различных антигенов позволяет обнаруживать наличие определенных антител. Для совершенствования серологических методов диагностики туберкулеза важное значение имеет получение моноклональных антител к различным антигенам микобактерий. Это позволит выявить те специфические эпитопы туберкулезных бактерий и соответственно те антитела к ним, обнаружение которых имеет наибольшее диагностическое значение, а также позволит создать коммерческие тест-системы для иммунодиагностики туберкулеза.
Среди всех методов микробиологической диагностики туберкулеза решающим все же остается бактериологический. Он необходим не только для постановки диагноза болезни, но и для контроля эффективности химиотерапии, своевременной оценки чувствительности микобактерий к антибиотикам и химиопрепаратам, диагноза рецидивов туберкулеза, степени очищения больного организма от возбудителя и выявления его измененных вариантов, особенно L-форм. Исследуемый материал перед посевом необходимо обрабатывать слабым раствором серной кислоты (6 – 12 %) для устранения сопутствующей микрофлоры. Выделение чистых культур микобактерий ведут с учетом скорости их роста, пигментообразования и синтеза ниацина. Дифференциацию между отдельными видами микобактерий осуществляют на основании их биологических свойств, как указано выше. Вопрос о вирулентности микобактерий решается с помощью биологических проб и на основании обнаружения корд-фактора. Для этой цели предложены цитохимические реакции. Они основаны на том, что вирулентные микобактерии (содержащие корд-фактор) прочно связывают красители – нейтральный красный или нильский голубой – и при добавлении щелочи сохраняют цвет краски, а раствор и невирулентные микобактерии изменяют свою окраску.
Для более быстрого выделения возбудителя туберкулеза предложен метод микрокультур. Суть его состоит в том, что на предметное стекло наносят исследуемый материал, обрабатывают его серной кислотой, отмывают, стекло помещают в цитратную лизированную кровь и инкубируют при температуре 37 °C. Уже через 3 – 4 сут. рост микобактерий на стекле проявляется в виде микроколоний, которые к 7 – 10-му дню достигают максимального развития, а микобактерии хорошо выявляются при микроскопии. При этом вирулентные микобактерии образуют змеевидные колонии, а невирулентные растут в виде аморфных скоплений.
Для обнаружения L-форм используют культуральный, биологический и иммунофлуоресцентный методы. В связи с широким распространением лекарственноустойчивых штаммов микобактерий возникла необходимость усилить контроль за этим процессом. С этой целью, а также для более точной идентификации и дифференциации микобактерий используют молекулярно-генетические методы, в частности, метод типирования штаммов, основанный на выявлении различий в структуре генома микобактерий – геномная дактилоскопия. Метод заключается в обнаружении в геноме микобактерии ряда повторяющихся нуклеотидных последовательностей и анализе полиморфизма длин фрагментов рестрикции. В качестве зонда (праймера) обычно используют IS6110 (англ. insertion sequence – вставочная последовательность). В хромосоме микобактерии, как правило, имеется несколько копий элемента IS6110, которые отличаются высокой стабильностью своего местоположения, что позволяет точно идентифицировать различные штаммы.
Биологический способ обнаружения L-форм заключается в серии последовательных пассажей на морских свинках.
Для иммунофлуоресцентного метода используют диагностические сыворотки, содержащие меченные флуорохромом антитела к антигенам L-форм.
Лечение. Консервативное лечение туберкулеза проводят с помощью антибиотиков и химиопрепаратов. Препараты I ряда (более ранние) включают производные парааминосалициловой кислоты (ПАСК), гидразида изоникотиновой кислоты (ГИНК) – изотиазид (тубазид), фтивазид и др. и препараты группы стрептомицина. Препараты II ряда – циклосерин, канамицин, флоримицин, рифампицин и другие антибиотики. У микобактерий к химиопрепаратам, в особенности I ряда, часто наблюдается устойчивость, поэтому лечение должно сопровождаться контролем степени чувствительности их к применяемым препаратам.
Профилактика. Помимо проведения широких социально-экономических мероприятий, направленных на улучшение жизни населения, раннего и своевременного выявления больных туберкулезом и оказания им эффективной лечебной помощи, большое значение имеет плановая массовая вакцинация против туберкулеза. Она осуществляется вакциной БЦЖ, полученной А. Кальметтом и Ш. Гереном из ослабленного многолетними пересевами штамма M. bovis. Вакцинации подлежат все новорожденные дети на 5 – 7-й день жизни. Вакцину, содержащую 0,05 мг сухих живых бактерий в объеме 0,1 мл, вводят внутрикожно. Ревакцинацию проводят в возрасте 7 – 12 – 17 – 22 и 27 – 30 лет только лицам, отрицательно реагирующим на внутрикожную пробу Манту (5 ТЕ/0,1 мл).
Большую роль в общей системе мер борьбы с туберкулезом в стране сыграло создание специализированной противотуберкулезной службы, включающей различные лечебные учреждения, в том числе диспансеры, санатории и т. п., а также проведение массового флюорографического обследования населения.
Лепра (греч. название этой болезни – lepra) – высококонтагиозное и одновременно низкопатогенное хроническое заболевание, при котором субклиническая инфекция – обычное явление, в то время как клинические проявления отмечаются только у небольшого числа инфицированных лиц. Характеризуется длительным течением, специфическим поражением кожи, слизистых оболочек, периферических нервов и различных внутренних органов. Возбудитель – Mycobacterium leprae – был открыт в 1874 г. А. Хансеном. До сих пор никому не удавалось получить рост возбудителя проказы на искусственных питательных средах. Палочка лепры является строгим внутриклеточным паразитом тканевых макрофагов (гистиоцитов), мононуклеарных фагоцитов и других клеток. Ее удается культивировать только в организме мышей, крыс и особенно при внутривенном заражении большими дозами (до 108 клеток) броненосцев (армадиллов), у которых она вызывает специфический генерализованный процесс и накапливается в огромном количестве в пораженных тканях (лимфатические узлы, печень, селезенка). В связи с этим морфологические свойства возбудителя лепры описаны по его картине в лепрозных тканях.
M. leprae – прямая или слегка изогнутая палочка с закругленными концами, диаметром 0,3 – 0,5 мкм и длиной 1,0 – 8,0 мкм. Спор, капсул не образует, жгутиков не имеет, грамположительна. По химическому составу сходна с M. tuberculosis, обладает спирто– и кислотоустойчивостью, поэтому ее окрашивают по методу Циля – Нильсена. M. leprae обладает большим полиморфизмом: в лепромах (лепрозных бугорках) встречаются зернистые, кокковидные, булавовидные, нитевидные, ветвящиеся и другие необычные формы. В пораженных клетках они образуют шаровидные плотные скопления, в которых микобактерии располагаются параллельно друг другу, напоминая расположение сигар в пачке (см. цв. вкл., рис. 108).
Главные особенности болезни во многом определяются следующими свойствами возбудителя:
1. Очень медленное размножение в организме является причиной продолжительного инкубационного периода (в среднем 3 – 7 лет, иногда до 15 – 20 и более лет) и хронического течения болезни у людей и подопытных животных.
2. M. leprae регулярно вовлекает в процесс нервную ткань и приводит к инвалидности, а это имеет большое экономическое значение для эндемичных регионов.
3. Оптимальная температура для размножения возбудителя менее 37 °C. Следовательно, наиболее поражаемы охлаждаемые ткани человека и подопытных животных (у броненосцев температура тела 30 – 35 °C).
4. M. leprae способны вызывать иммунологическую толерантность у людей с лепроматозной формой болезни, и такие больные являются главным источником заражения людей лепрой.
Биохимические свойства M. leprae, в связи с тем что ее не удается культивировать, изучены слабо. Однако у микобактерий, выделенных из тканей больного человека, обнаружены цитохромоксидаза, щелочная фосфатаза и фенолоксидаза.
Факторы патогенности M. leprae, очевидно, определяются химическим составом ее клеток, продукции экзотоксинов не установлено.
Резистентность. Вне организма человека возбудитель лепры быстро утрачивает жизнеспособность, но в трупах людей может сохраняться долгое время.
Лепроподобные заболевания наблюдаются у некоторых животных, но они существенно отличаются от лепры человека. Возбудитель лепры крыс – M. lepraemurium – был обнаружен В. К. Стефанским в 1903 г. Лепра крыс – хроническое заболевание, характеризующееся поражением лимфатических узлов, кожи, внутренних органов, образованием инфильтратов, изъязвлением и иными нарушениями. M. lepraemurium – палочка со слегка закругленными концами, длиной 3 – 5 мкм. Подобно M. leprae, не растет на питательных средах, но легко пассируется через организм крыс, мышей и хомячков. Микобактерии крыс в пораженных клетках не образуют таких скоплений, как M. leprae. Размножение M. lepraemurium в организме мышей угнетается изониазидом, стрептомицином, виомицином и, в меньшей степени, промином и диаминодифенилсульфоном. Это свидетельствует о том, что по своей биологии M. lepraemurium стоит ближе к туберкулезной группе микобактерий, чем к M. leprae. В клеточной стенке ее содержится много липидов, что характерно для других культивируемых микобактерий. Лепра крыс – эндемическое заболевание, наблюдается в различных районах мира (Одесса, Берлин, Лондон, Гавайские острова, Сан-Франциско и др.).
Эпидемиология. Единственным источником лепры является больной человек. Уже в отдаленные времена лепру признавали заразительной, так как во многих письменных памятниках указывалось, что прокаженных надо избегать. В средние века, во многом благодаря крестоносцам, лепра получила эпидемическое распространение в странах Европы. Число больных было столь велико, что пришлось создавать для них особые учреждения – лепрозории. С начала XIX в. эпидемического распространения лепры в Европе более не наблюдалось. Хотя лепра стала редким заболеванием в странах умеренного климата, она все еще является частой болезнью во многих тропических и развивающихся странах и поэтому представляет важную глобальную проблему. В мире насчитывается 10 – 15 млн больных проказой, главным образом в странах Юго-Восточной Азии, Шри-Ланке, Южной Америке и Африке. В СССР к началу 1990 г. на учете состояло 4200 таких больных.
Больной человек выделяет возбудителя лепры при кашле, чихании и даже при разговоре (он содержится почти всегда на слизистой оболочке носа) в большом количестве. Заражение человека происходит главным образом воздушно-капельным путем при постоянном тесном общении с больными лепрой. Однако микобактерии лепры могут проникать в организм и через поврежденную кожу. Существует предположение, что в распространении лепры могут играть определенную роль кровососущие насекомые.
Клинические типы и стадии развития лепры неравнозначны по эпидемиологической роли. В частности, от больных лепроматозным типом болезни опасность заразиться гораздо больше, чем от больных туберкулоидным типом лепры. Заболеваемость мужчин и женщин одинакова. У больных лепрой родителей дети рождаются здоровыми. В тех странах, где регулярному лечению подвергаются далеко не все больные, заболеваемость, в том числе и детей, остается высокой.
Патогенез и клиника. M. leprae проникает через слизистые оболочки и кожу в лимфатическую и кровеносную системы, в нервные окончания и медленно разносится по организму, не вызывая в месте входных ворот видимых изменений. Клинически, иммунологически и эпидемиологически выделяют следующие основные формы лепры: туберкулоидную и лепроматозную, а кроме того, так называемые пограничные с ними типы лепры – погранично-туберкулоидную, пограничную и погранично-лепроматозную.
Основные морфологические изменения при лепре проявляются в виде гранулем лепроматозного и туберкулоидного типов. При лепроматозной форме основными клеточными элементами гранулемы являются макрофаги. Для них характерен незавершенный фагоцитоз: в таких лепрозных клетках микобактерии лепры размножаются и накапливаются в большом количестве. При туберкулоидной форме лепры гранулема имеет сходство с туберкулезным бугорком, основную массу его составляют эпителиоидные клетки, расположенные в центре, а по периферии их окружают лимфоидные клетки. Для пограничных форм лепры характерны морфологические изменения, присущие обеим основным формам лепры и являющиеся как бы переходной стадией между ними.
Поражение внутренних органов (печень, селезенка, надпочечники, костный мозг, яички, лимфатические узлы) наиболее выражено при лепроматозной форме. В них появляются специфические гранулемы, состоящие из макрофагов, содержащих большое количество микобактерий лепры.
Туберкулоидная форма лепры характеризуется поражением кожи, периферических нервов и иногда некоторых внутренних органов. В зависимости от стадии болезни поражение кожи может проявляться в виде одиночных слегка пигментированных пятен, папулезных высыпаний или бляшек, размер которых может варьировать от 1,0 – 1,5 см до обширных очагов. Расположены высыпания обычно асимметрично. Поражение периферических нервов приводит к нарушению чувствительности, а крупных нервных стволов – к парезу, параличам, контрактуре пальцев, образованию трофических язв и т. п. Туберкулоидная форма лепры отличается более легким течением по сравнению с лепроматозной и легче поддается лечению. Микобактерии обнаруживаются при биопсии очагов поражения, а на слизистой оболочке носа отсутствуют.
Лепроматозная форма характеризуется большим разнообразием кожных проявлений, и во всех высыпаниях и на пораженной слизистой оболочке носа обнаруживается значительное количество микобактерий. В процесс довольно рано вовлекаются слизистые оболочки, внутренние органы, позднее – нервная система. Вначале высыпания на коже носят характер симметрично расположенных (на лице, разгибательных поверхностях кистей рук, предплечий, голеней и на ягодицах) пигментных пятен, которые в течение длительного времени остаются без изменений, но чаще превращаются в инфильтраты, или лепромы. Последние обычно локализованы на лице (надбровные дуги, лоб, крылья носа, подбородок, щеки), а также на кистях, голенях, бедрах, спине, ягодицах. При диффузной инфильтрации кожи лица формируется «львиная морда»: морщины и складки углубляются, нос утолщается; щеки, губы и подбородок приобретают дольчатый вид. На поздней стадии лепры у больного – множественные лепромы, выпадение бровей и ресниц, парезы, параличи, «львиная морда», изуродованные пальцы и другие нарушения.
Иммунитет при лепре имеет клеточный характер, его активность постепенно снижается от туберкулоидной формы к лепроматозной, причем при первой он отражает наивысшую, а при последней – минимальную степень иммунологической устойчивости к этой болезни. Активность иммунитета определяют с помощью лепроминовой пробы (реакция Мицуды). В качестве аллергена используют лепромин (антиген Мицуды). Его получают путем автоклавирования суспензии M. leprae, которую получают с помощью гомогенизации лепром, препарат содержит также остатки клеток ткани. Стандартный препарат лепромина содержит в 1 мл 160 млн микобактерий. Лепромин в дозе 0,1 мл вводят внутрикожно. Различают реакцию раннюю, которую учитывают через 48 ч (гиперемия, небольшая папула), и позднюю (реакцию Мицуды), которая появляется через 2 – 4 нед. в виде бугорка, узелка, иногда с некрозом. Положительная реакция Мицуды указывает на способность организма к развитию иммунной реакции на введение M. leprae, но не на его инфицирование, поэтому она имеет большое прогностическое значение. У больных лепроматозной формой лепры поздняя реакция всегда отрицательная, у больных туберкулоидной формой и у большинства здоровых людей она положительная. При различных формах пограничной лепры реакция Мицуды может быть как положительной, так и отрицательной.
Определяющим фактором формирования типа болезни и исхода первичного заражения служит степень напряженности естественного иммунитета против лепры, которая выявляется с помощью лепроминовой пробы. Положительная реакция на лепромин свидетельствует о наличии достаточно высокого естественного иммунитета к M. leprae. Нарушение клеточного иммунитета при лепроматозном типе болезни проявляется прежде всего в том, что фагоцитоз имеет незавершенный характер: микобактерии лепры не только не разрушаются макрофагами, но именно в них они активно размножаются. Кроме того, лимфоциты у таких больных не подвергаются бласттрансформации и не подавляют миграции макрофагов (у больных туберкулоидным типом эти реакции положительны). Иммунитет к лепре зависит от многих факторов, и при его снижении возможно обострение процесса и отягощение течения болезни.
Лабораторная диагностика. Из всех микробиологических методов диагностики используется главным образом бактериоскопический. Материалом для исследования являются слизь или соскобы со слизистой оболочки носа, скарификаты из пораженного участка кожи, кусочки пораженного органа или ткани, из которых готовят гистологические срезы. Мазки и срезы окрашивают по Цилю – Нильсену. Для дифференциации M. leprae от M. tuberculosis используют биологическую пробу на белых мышах, для которых M. leprae не патогенна.
Лечение. Больные лепрой, в зависимости от ее типа, подвергаются лечению или в специальных противолепрозных учреждениях (лепрозориях), или в амбулаториях по месту жительства. В лепрозории госпитализируют первично выявленных больных, у которых имеются распространенные кожные высыпания, возбудитель обнаруживается бактериоскопически; а также больных, находящихся на постоянном учете, в случае обострения или рецидива болезни. Амбулаторно можно лечить больных с ограниченными кожными проявлениями, у которых при бактериоскопии возбудитель не обнаруживается.
Лечение должно носить комплексный характер с одновременным использованием 2 – 3 различных антилепрозных химиопрепаратов, а также общеукрепляющих и стимулирующих иммунную систему средств. Наиболее активными химиопрепаратами являются: производные сульфонового ряда – диафенилсульфон, солюсульфон, диуцифон и др.; рифампицин, лампрен, этионамид и др. Курс химиотерапии должен быть не менее 6 мес., при необходимости проводят несколько курсов, чередуя препараты.
Профилактика складывается из социальных и индивидуальных мероприятий. Особенность ее определяется продолжительным инкубационным периодом. Социальные меры предупреждения лепры сводятся к повышению жизненного уровня населения, во многом определяющего напряженность естественного иммунитета. Индивидуальная профилактика в основном сводится к строгому соблюдению больным лепрой правил личной гигиены (отдельное белье, постель, посуда и т. п.). Наиболее древним методом профилактики лепры была полная изоляция больных в лепрозориях, которые ныне используются как лечебные учреждения диспансерного типа. Диспансерный метод, который предусматривает комплекс лечебных, профилактических и социальных мер, стал основным в борьбе с лепрой. Он предусматривает, в случае необходимости, и изоляцию больных на дому. Больные лепрой подлежат обязательному учету и диспансерному наблюдению, при необходимости – госпитализации в лепрозории. Члены семьи больного лепрой также должны находиться на диспансерном учете, при необходимости им проводят химиопрофилактику. Во многих странах мира больные лепрой не допускаются к работам, связанным непосредственно с обслуживанием населения. Детей, родившихся у больных лепрой родителей, оставляют с матерью в лепрозории до 2 – 3-летнего возраста (мать должна соблюдать меры личной гигиены). По достижении этого возраста их, как и детей старшего возраста, на период лечения матери в лепрозории, передают в специальные или обычные детские дома, а затем они находятся под специальным наблюдением. Если у них нет никаких проявлений лепры, они могут посещать школу и другие детские коллективы.
После многолетних и настойчивых усилий удалось получить вакцину против лепры. В связи с этим, по мнению ВОЗ, созданы предпосылки для значительного снижения заболеваемости лепрой в мире.
Риккетсии, ориенции, коксиеллы, эрлихии, бартонеллы, хламидии и вызываемые ими болезни
Общая характеристика риккетсий, ориенций, коксиелл, эрлихий, бартонелл и хламидий
В соответствии с новой классификацией роды Rickettsia, Coxiella, Ehrlichia и Orientia, ранее относимые к одному порядку Rickettsiales, теперь отнесены к типу Proteobacteria, но к разным классам. Роды Rickettsia и Orientia, а также Erlichia и Bartonella отнесены к классу Alphaproteobacteria, а род Coxiella – к классу Gammaproteobacteria. Однако представители перечисленных родов имеют много сходных свойств. Все они адаптированы к существованию в организме членистоногих и способны вызывать заболевания у соответствующих хозяев, включая человека. Большинство из этих микроорганизмов не растут на обычных питательных средах, имеют мелкие размеры, форму палочек, кокковидную, иногда нитевидную (см. цв. вкл., рис. 109). Жизненный цикл риккетсий зависит от жизнедеятельности клетки-хозяина и складывается из 2 стадий – вегетативной и покоящейся. Риккетсии, находящиеся в вегетативной стадии, имеют палочковидную форму, активно размножаются путем бинарного деления и обладают активной подвижностью, обусловленной, очевидно, жгутиковыми структурами. Риккетсии покоящейся стадии имеют сферическую форму и не размножаются. Риккетсии, эрлихии, бартонеллы и хламидии – прокариоты, у них имеется клеточная стенка и, как у всех грамотрицательных бактерий, наружная мембрана, цитоплазматическая мембрана, ядерный аппарат, не отграниченный от цитоплазмы никакими мембранами. Они обладают собственными системами биосинтеза белка и мобилизации энергии, однако их жизнедеятельность каким-то образом тесно связана с метаболизмом клетки-хозяина, они не способны размножаться вне ее. Поэтому для культивирования риккетсий прибегают либо к заражению животных (морские свинки, белые мыши), либо куриных эмбрионов (риккетсии хорошо размножаются в клетках стенки желточного мешка), либо культур клеток, в которых некоторые виды риккетсий образуют, как и вирусы, бляшки.
Заболевания, вызываемые риккетсиями, делят на следующие 3 группы: сыпного тифа, клещевой пятнистой лихорадки и тифа джунглей (табл. 50).
К ней относятся: эпидемический сыпной тиф и эндемический (крысиный) сыпной тиф и соответственно два вида возбудителей: R. prowazekii и R. typhi. В эту же группу риккетсий включен еще один вид – R. canada, обнаруженный у клещей, паразитирующих на кроликах и зайцах. Серологическими методами были выявлены случаи заболевания людей, вызванные R. canada, клинически не отличимые от лихорадки Скалистых гор, но R. canada не имеет антигенного родства с риккетсиями группы пятнистой лихорадки. Характерной особенностью риккетсий этой группы является то, что они размножаются в цитоплазме эукариотных клеток (см. цв. вкл., рис. 109.4), но не в вакуолях (R. canada также и в ядре) и имеют антигенное родство между собой. Содержание Г + Ц в ДНК ≈ 30 мол %.
Сыпной тиф – острое инфекционное заболевание, характеризующееся глубокой интоксикацией, характерным поражением прекапиллярных разветвлений артерий и сыпью. Возбудитель – R. prowazekii – палочки размером от 0,3 – 0,6 до 0,8 – 2,0 мкм, иногда до 4,0 мкм, располагающиеся одиночно или короткими цепочками. Хорошо размножаются в желточном мешке куриного эмбриона, оптимальная температура для их размножения 35 °C. Эмбрион погибает через 6 – 13 дней после заражения (в зависимости от величины заражающей дозы). Хороший рост наблюдается и в культурах клеток различных линий с образованием через 8 – 10 дней бляшек диаметром ≈ 1 мм. К возбудителю сыпного тифа очень чувствительны морские свинки, которые обычно используются для первичного выделения риккетсий. У свинок приблизительно через неделю появляется лихорадка и у самцов иногда наблюдается скротальный феномен (периорхит – воспаление оболочек яичек). Иногда у морских свинок риккетсиозная инфекция протекает бессимптомно. Риккетсии выделяются из крови, селезенки, надпочечников, почек, но особенно много их в мозге.
Антигенное строение. Возбудитель сыпного тифа имеет термостабильный групповой антиген, общий с антигенами R. typhi и R. canada, и термолабильный видоспецифический антиген, располагающийся в поверхностных структурах возбудителя. Штаммы R. prowazekii, выделенные из разных источников, по антигенной структуре существенно не отличаются друг от друга.
Таблица 50
Заболевания, вызываемые риккетсиями, ориенциями, коксиеллами и бартонеллами
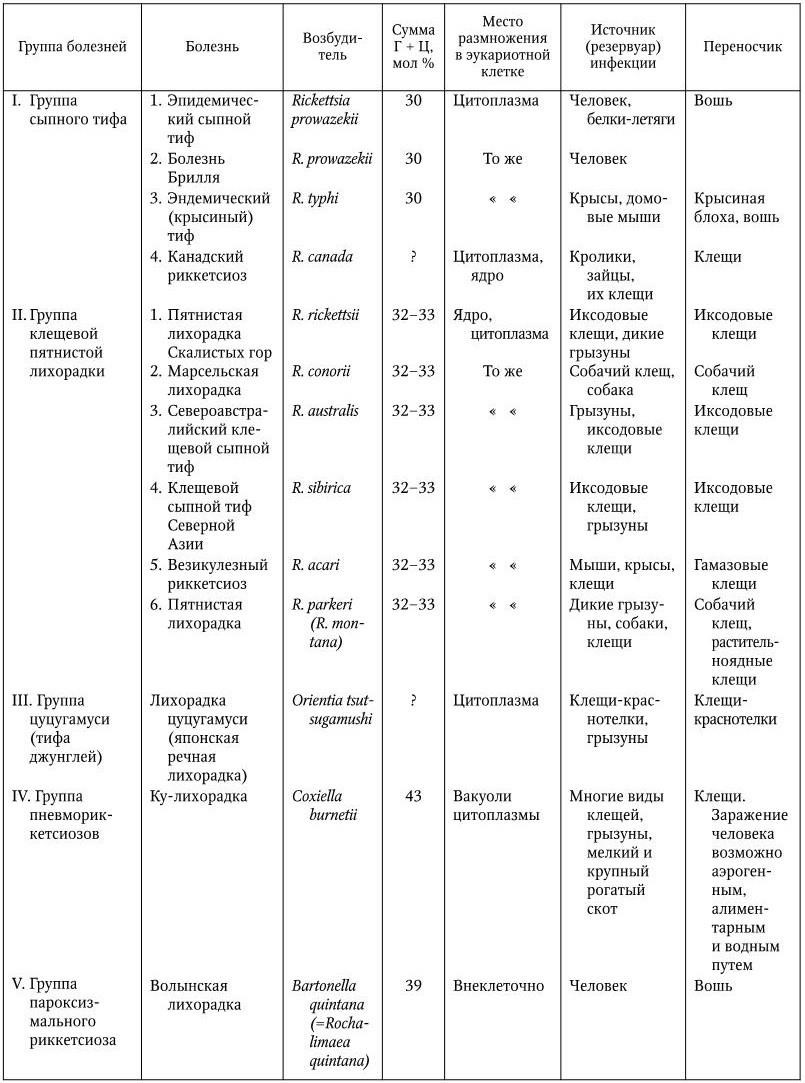
Резистентность. Как и другие представители этого рода, риккетсии сыпного тифа быстро погибают во внешней среде, при повышенной температуре (при 80 °C через 1 мин), под влиянием различных химических дезинфектантов, но они остаются жизнеспособными в течение 2 – 3 мес. в высохших испражнениях вшей при низкой температуре.
Факторы патогенности. Патогенность риккетсий связана с наличием у них пока не идентифицированных факторов адгезии и инвазии, с помощью которых они вначале прикрепляются к клеткам, а затем внедряются в них и размножаются. У риккетсий, как у всех грамотрицательных бактерий, имеется эндотоксин (ЛПС). Кроме того, у них обнаружен в капсулоподобном слое, покрывающем клетки, особый токсический термолабильный белок с м. м. 100 кД. Внутривенное введение взвеси риккетсий белым мышам вызывает их гибель через 4 – 24 ч от острой интоксикации. При интраназальном заражении риккетсиями белых мышей у них развивается смертельная пневмония.
Особенности эпидемиологии. Основным источником эпидемического (вшивого, европейского) сыпного тифа является человек. У него возбудитель находится в крови. Это было установлено опытом самозаражения в 1876 г. О. О. Мочутковским, а Г. Н. Минх еще в 1874 г. высказал предположение, что заражение сыпным и возвратным тифом происходит через укусы вшей и блох. Однако только в 1910 г. Ш. Николь окончательно доказал, что возбудитель сыпного тифа передается от больного человека здоровому через укусы вшей – Pediculus corporis (= Pediculus humanus), причем эту роль выполняют в основном платяные вши. Головная и лобковая вши также могут инфицироваться риккетсиями, но они реже покидают своего хозяина и их роль в эпидемиологии сыпного тифа гораздо меньше. Эта особенность передачи возбудителя делает сыпной тиф способным к широкому распространению всюду, где имеется вшивость. Вошь заражается при сосании крови больного, проявляя при этом одинаково высокую чувствительность к возбудителю во всех фазах своего метаморфоза после яйца. При этом вошь легче всего заражается при повторном сосании крови больного, особенно при тяжелых формах болезни и в первую неделю ее. Во время сосания вошь прокалывает кожу хоботком и потребляет около 1 мг крови сразу. Но для того чтобы ее всосать, она освобождает кишечник – выделяет экскременты. Кровь переваривается, а риккетсии проникают в эпителиальные клетки кишечника и размножаются в них в огромном количестве, так что клетки разрушаются, а риккетсии выделяются с экскрементами. Лишь после этого, через 4 – 5 дней, вошь способна заразить здорового человека. У вшей риккетсии вызывают смертельный риккетсиоз, они погибают через 2 – 2,5 нед. У зараженных вшей риккетсии размножаются только в кишечнике, в слюнных железах их нет. Поэтому сам по себе укус не заразен, но слюна вшей вызывает в месте укуса раздражение, и человек, почесывая, втирает риккетсии в ранку, нанесенную вошью. Являясь однохозяинным паразитом, вошь обитает на белье человека, переходя на его кожу через каждые 5 ч для питания. Оптимальная температура для ее существования – 30 °C, поэтому, когда у зараженного ею человека температура тела повышается до 39 – 41 °C, вошь возбуждается, стремится покинуть хозяина и поселяется на белье другого человека. Таким образом, эпидемиологическая цепь при сыпном тифе такова: больной человек – вошь – здоровый человек. Ликвидация вшивости – главное условие ликвидации эпидемии сыпного тифа.
Патогенез и клиника. Восприимчивость к болезни близка к 100 %. Риккетсии попадают в кровь и разносятся по всему организму, избирательно поражая эндоте-
лиальные клетки прекапиллярных разветвлений артерий различных органов, что проявляется в виде деструктивно-пролиферативного эндопериваскулита. Формирование своеобразных тромбоваскулитов приводит к резкому расстройству периферического кровообращения и глубоким нарушениям тканей; особенно тяжелые последствия наблюдаются при поражении мозговой ткани (продолговатый мозг), а также эндотелия капилляров надпочечников, сердечной мышцы и кожи. К этим нарушениям присоединяется сильная интоксикация, обусловленная эндотоксином и, особенно, токсическим белком с м. м. 100 кД. Инкубационный период составляет в среднем 10 – 12 дней. После небольшого продромального периода болезнь начинается сразу с повышения температуры до 39 – 40 °C и сильной головной боли. Больной может впадать в состояние бреда, иногда развиваются явления менингоэнцефалита и психоза. На 4 – 6-й день на боковых поверхностях груди, на спине и сгибательных поверхностях рук появляется характерная розеолезно-петехиальная сыпь. Лихорадка держится 1,5 – 2 нед., затем температура быстро снижается до нормы. Выздоровление происходит медленно вследствие глубоких нарушений со стороны сердечнососудистой и нервной систем. Летальность в прошлом составляла 20 – 40 %, сейчас, благодаря антибиотикотерапии, не превышает 1 %.
Постинфекционный иммунитет длительный, стойкий, но нестерильный: возбудитель сохраняется в организме в течение длительного времени в виде покоящихся форм. У лиц, перенесших сыпной тиф, нередко наблюдаются его повторные случаи через 10 – 15 – 20 и более лет, которые рассматриваются не как следствие повторного заражения (хотя оно и возможно), а чаще как рецидив, наступающий, очевидно, в результате ослабления иммунитета. Такой повторный сыпной тиф протекает значительно легче, без осложнений, наблюдается в отсутствие источника заражения и вшивости. Повторный сыпной тиф (рецидив сыпного тифа) получил название болезни Брилля – Цинссера.
Лабораторная диагностика. Для диагностики сыпного тифа могут быть применены различные методы: заражение кровью больного животных (морские свинки, белые мыши), куриных эмбрионов или культур клеток, серологические реакции и аллергическая проба. Однако чаще всего используют три серологические реакции – агглютинации, РСК и РПГА. Еще в 1916 г. Э. Вейль и А. Феликс установили, что выделенный ими штамм Proteus vulgaris OX19 (без жгутиков) способен давать положительную реакцию агглютинации, начиная с 10 – 12-го дня болезни, почти у 100 % больных сыпным тифом. Это свойство обусловлено наличием у риккетсий и протея общих полисахаридных антигенов. Поэтому реакция Вейля – Феликса применялась длительное время для диагностики сыпного тифа. Сыворотка больных различными формами клещевой пятнистой лихорадки давала положительную реакцию агглютинации с P. vulgaris OX19 и OX2, а больных тифом джунглей – с OXK. Однако для серологической диагностики сыпного тифа и всех других риккетсиозов ныне используют исключительно риккетсиозные антигены соответствующих видов. Это сделало серологические реакции более специфическими и надежными. Реакция агглютинации при сыпном тифе становится положительной (1: 100) с 4 – 5-го дня болезни, антитела достигают максимального титра к 12 – 16-му дню и держатся на этом уровне до 30-го дня, но через 3 – 5 мес. после болезни они исчезают. Комплементсвязывающие антитела обнаруживаются с 5 – 6-го дня болезни, достигают максимального титра к 14 – 16-му дню. Титр их через 1 – 1,5 мес. начинает снижаться, но эти антитела сохраняются в организме переболевших многие годы. РСК при сыпном тифе строго специфична (даже в разведении 1: 5 имеет диагностическое значение). Поэтому с помощью РСК диагноз сыпного тифа можно с уверенностью ставить ретроспективно у всех переболевших. РПГА при сыпном тифе позволяет отличить активную форму болезни и ближайшую реконвалесценцию, при которых она бывает положительной в разведении 1: 1000 и более, от ранее перенесенного заболевания. Для диагностики сыпного тифа предложены также реакции иммунофлуоресценции, непрямого гемолиза и иммуноферментный метод в модификации «захват» антител класса IgM, а также внутрикожная аллергическая проба, выявляющая аллергическую чувствительность замедленного типа.
Лечение. Наиболее эффективны для лечения сыпного тифа антибиотики – тетрациклины, макролиды, левомицетин и др.
Профилактика. В межэпидемическом периоде риккетсии сохраняются только в организме людей, переболевших сыпным тифом. Они являются главным источником и резервуаром возбудителя сыпного тифа. Существует, по-видимому, единственный природный очаг сыпного тифа в юго-восточном регионе США. Резервуаром риккетсий здесь являются белки-летяги, а переносчиком – их вши. Человек заражается от белок-летяг при переходе их вшей на него. Однако этот очаг существенного значения в эпидемиологии сыпного тифа не имеет. Поскольку заражение людей сыпным тифом происходит через вшей, основным условием успешной борьбы с сыпным тифом является ликвидация вшивости.
Для специфической профилактики, необходимость в которой может возникнуть только по эпидемическим показаниям, предложены различные вакцины: живая сыпнотифозная вакцина из ослабленного штамма риккетсии Провачека Е, живая комбинированная вакцина из штамма Е и антигенов риккетсий, химическая сыпнотифозная вакцина из антигенов клеточной стенки риккетсий.
Эндемический (крысиный) сыпной тиф. Крысиный тиф – относительно легкая лихорадочная болезнь продолжительностью 9 – 15 дней, которая характеризуется головной болью и пятнистой сыпью. Впервые заболевание было описано в 1922 г. Ф. Хоуном, а возбудитель – R. typhi (R. mooseri) – был обнаружен в 1931 г. Р. Диером и независимо от него Х. Музером.
R. typhi по своим размерам и форме очень сходна с R. prowazekii, но обладает меньшим полиморфизмом. По антигенной структуре риккетсии тифа отличаются от риккетсий группы клещевой пятнистой лихорадки, но сходны с R. prowazekii благодаря наличию общего с последними термостабильного антигена. В то же время они имеют свой специфический термолабильный антиген, что позволяет легко дифференцировать их серологически. R. typhi хорошо размножаются в желточных мешках куриных эмбрионов, вызывая их гибель через 6 – 8 дней после заражения. В желточных мешках обнаруживается обильное накопление мелких палочковидных риккетсий. Для этого вида риккетсий вообще характерно чрезвычайно интенсивное размножение их в цитоплазме поражаемых клеток мезотелия грызунов в виде кокковидных или мелких палочковидных форм. Они образуют огромные скопления, почти целиком замещающие цитоплазму разрушенных клеток, такие клетки получили название музеровских.
Подобно возбудителю сыпного тифа, патогенность риккетсии крысиного тифа связана с наличием у нее эндотоксина и своеобразного токсического поверхностного белка. Морские свинки проявляют к R. typhi примерно такую же восприимчивость, как и к риккетсиям сыпного тифа. Лихорадка у свинок появляется через 3 – 7 дней, кривая ее течения часто имеет седловидный характер. Наиболее характерным признаком для экспериментальной инфекции является скротальный феномен. Он воспроизводится только при внутрибрюшинном заражении и обнаруживается уже с первого дня лихорадки. Риккетсии находятся в большом количестве в воспаленных оболочках яичек (в музеровских клетках или внеклеточно), в мозге, почках, крови.
Мыши также очень чувствительны к возбудителю крысиного тифа как при парентеральном, так и при интраназальном заражении. Заражение через нос вызывает у них смертельную пневмонию с обильным накоплением риккетсий в легочной ткани.
Эпидемиология. Заболеваемость людей крысиным тифом связана с наличием эндемических очагов, которые распространены по всему свету, в основном в портовых городах теплых морей. Резервуаром возбудителя являются крысы и другие грызуны, главными переносчиками его – крысиная блоха (Xenopsylla cheopis) и крысиная вошь (Polyplax spinulosus). Крысиная блоха высокочувствительна к R. typhi, хотя инфекция у нее протекает скрытно; она выделяет риккетсии с экскрементами в большом количестве. Заражение человека происходит через укусы крысиной блохи так же, как при сыпном тифе. Блоха и вошь человека тоже высокочувствительны к R. typhi и могут выполнять роль его переносчика от человека к человеку. Заражение человека крысиным тифом возможно также алиментарным путем при употреблении продуктов, загрязненных мочой инфицированных грызунов. Допускается возможность распространения крысиного тифа среди грызунов и людей через укусы крысиного клеща.
Клиника крысиного тифа у человека в общем сходна с таковой при эпидемическом сыпном тифе, но отличается более доброкачественным течением, хотя наблюдались случаи тяжелых форм болезни. Инкубационный период обычно равен 8 – 12 дням. Болезнь, как правило, протекает благоприятно: осложнения, рецидивы и смертность практически отсутствуют.
Постинфекционный иммунитет стойкий, длительный, обусловлен антимикробными антителами и антителами, нейтрализующими токсический белок риккетсий. За счет общего с R. prowazekii антигена возникает перекрестный иммунитет между крысиным и сыпным тифом.
Для лечения крысиного тифа используют те же антибиотики, как и при лечении сыпного тифа.
Лабораторная диагностика. В связи с большим сходством клинической картины крысиного тифа с легкими формами сыпного тифа, основную роль в диагностике этого, как и других риккетсиозов, играют серологические реакции (агглютинации, РСК, РПГА, ИФМ и др.) с применением специфических антигенов риккетсий крысиного тифа.
Профилактика. Для специфической профилактики могут быть использованы вакцины из риккетсий крысиного тифа (убитая вакцина из риккетсий Провачека для этой цели не пригодна), но они применяются лишь по эпидемическим показаниям. Общие меры профилактики этого риккетсиоза сводятся к уничтожению крыс и мышей, охране пищевых продуктов от загрязнения мочой крыс, а также к предупреждению завоза крыс в портовые города прибывающими судами.
Недавно описан риккетсиоз у людей, вызываемый R. felis и протекающий очень сходно с сыпным тифом. Заражение происходит через укусы кошачьей блохи.
Группа клещевой пятнистой лихорадки
Сюда относятся шесть риккетсиозов, возбудителями которых являются разные виды риккетсий. Они объединены в одну группу по следующим признакам: их резервуаром и переносчиками являются иксодовые и гамазовые клещи; риккетсии размножаются в цитоплазме и в кариоплазме (ядре) эукариотных клеток; между риккетсиями, вызывающими эти риккетсиозы, существует антигенное родство, а сыворотки больных и переболевших дают перекрестные серологические реакции и положительную реакцию агглютинации с P. vulgaris OX19 и OX2. Содержание Г + Ц в ДНК риккетсий составляет 32 – 33 мол %.
Пятнистая лихорадка Скалистых гор. Этот риккетсиоз представляет собой заболевание, эндемичное для Северной и Южной Америки, протекающее в виде острой лихорадки, без первичного аффекта, но с появлением сыпи и отличающееся большим разнообразием тяжести течения в различных эндемических очагах. Свое название эта болезнь получила в связи с тем, что была обнаружена в США в районе Скалистых гор. Однако этот риккетсиоз обнаружен почти во всех штатах США, в Канаде, Мексике, Бразилии, Колумбии и других странах Центральной и Южной Америки.
Возбудитель – R. rickettsii – был обнаружен в 1909 г. Г. Риккетсом. Он представляет собой короткие палочки диаметром 0,2 – 0,3 мкм и длиной 1,5 – 2,0 мкм, менее полиморфные, чем R. prowazekii, обычно располагающиеся одиночно. Содержание Г + Ц в ДНК составляет 32,5 мол %. R. rickettsii имеют антигены, общие с антигенами риккетсий группы клещевой пятнистой лихорадки, но не имеют антигенного родства с риккетсиями других видов. Кроме того, они обладают антигенами, родственными полисахаридным антигенам P. vulgaris OX19 и OX2. Помимо указанных групповых антигенов, у риккетсий этого вида имеется и видоспецифический антиген, который позволяет дифференцировать их от всех других видов риккетсий.
Патогенность R. rickettsii связана с наличием у них, помимо эндотоксина, специфического термолабильного токсического белка. Однако штаммы R. rickettsii, выделяемые в разных географических районах Америки, сильно варьируют по своей вирулентности для человека. Для культивирования R. rickettsii используют 4 – 5-дневные куриные эмбрионы. При достаточной заражающей дозе они убивают эмбрионы через 4 – 5 дней. Оптимальная температура для культивирования 33,5 °C, после гибели эмбрионов их сохраняют еще в течение 24 ч при 32 °C. В желточном мешке эмбрионов риккетсий накапливается значительно больше, чем при заражении культур клеток. Размножение риккетсий вначале происходит в цитоплазме, а затем в ядре эукариотных клеток.
R. rickettsii менее устойчивы по сравнению с риккетсиями других видов. Их жизнеспособность выше в микроаэрофильных условиях или в присутствии восстановленного глютатиона или белка.
Морские свинки высокочувствительны к этому виду риккетсий, но вирулентность для них различных штаммов риккетсий сильно варьирует. Наиболее вирулентные штаммы вызывают у морских свинок лихорадку, скротальный феномен, кровоизлияния, некроз и смерть. Вирулентность риккетсий для человека не связана с вирулентностью их для свинок. Токсический белок риккетсий при внутривенном введении белым мышам вызывает их смерть от интоксикации.
Эпидемиология. Основным резервуаром возбудителя служат различные виды иксодовых клещей и их прокормители – дикие грызуны. Зараженные клещи являются основными хранителями риккетсий в природе, так как в их организме риккетсии сохраняются долгое время, и клещи передают их трансовариально своему потомству. В общей сложности круговорот риккетсий этого вида в разных очагах поддерживается примерно 14 видами клещей, из них 13 относятся к иксодовым: Dermacentor andersoni, D. variabilis, Ixodes dentatus и др., а один – к аргасовым (Argasidae). Питание клещей кровью на различных стадиях их развития, как правило, происходит с переменой хозяев: незрелые стадии нападают на мелких диких зверьков, а взрослые клещи – на крупных домашних животных. Человек заражается обычно через укусы взрослых инфицированных клещей на территории их природного обитания. В природных очагах пятнистой лихорадки циркулирует единый в антигенном отношении вид риккетсий, однако по степени вирулентности R. rickettsii подразделен на 4 типа: R, S, T и U, наиболее вирулентен тип R, наименее – U.
Клиника пятнистой лихорадки характеризуется большим разнообразием выраженности отдельных симптомов и различной тяжестью заболеваний. Инкубационный период в среднем 2 – 5 дней, но может варьировать от 3 до 14 дней. Болезнь начинается постепенно, иногда внезапно. Первичный аффект на месте укуса клеща отсутствует (в отличие от других клещевых риккетсиозов). Сыпь появляется на 2 – 4-й день болезни. Летальность варьировала от 5 – 10 до 80 % и выше. Применение антибиотиков для лечения существенно снизило летальность.
Постинфекционный иммунитет продолжительный и относительно стойкий. Поствакцинальный иммунитет сохраняется около года.
Лечение. Наиболее эффективны антибиотики: тетрациклины, хлорамфеникол, эритромицин и другие макролиды.
Лабораторная диагностика. Для выделения риккетсий прибегают к заражению кровью больного морских свинок (самцов), куриных эмбрионов или культур клеток. Однако основным методом диагностики пятнистой лихорадки является серологический. Применяют реакции агглютинации, РСК, РПГА, ИФМ и др. с использованием специфических риккетсиозных антигенов.
Профилактика пятнистой лихорадки Скалистых гор, как и других клещевых риккетсиозов, сводится к мерам личной защиты против нападения и присасывания клещей. Для создания искусственного иммунитета предложены различные вакцины, которые применяют по эпидемическим показаниям в эндемических очагах.
Марсельская лихорадка – одна из доброкачественных форм риккетсиозов из группы клещевых пятнистых лихорадок. Для нее характерно почти постоянное появление пятнистой сыпи на ладонях и подошвах и черных пятен, образующихся обычно на местах укуса клещей. Впервые эту болезнь описали А. Конор и А. Брух в 1910 г.
Возбудитель – R. conorii – был открыт в 1932 г. Дж. Каминопетросом и Е. Брумптом. Морфологически он сходен с R. rickettsii, но иногда наблюдаются нитевидные формы. Содержание Г + Ц в ДНК составляет 32,5 мол %. Характерной особенностью R. conorii является способность к внутриядерному размножению и более скудное размножение в цитоплазме клеток. Возбудитель хорошо размножается в культурах клеток, особенно почечного эпителия. При заражении куриных эмбрионов вызывает их гибель на 4 – 5-е сут. Иммунологически родствен R. rickettsii, R. sibirica и другим возбудителям клещевых пятнистых лихорадок, но серологически легко от них дифференцируется по видоспецифическому антигену. В организме больных индуцирует появление антител к антигенам Proteus vulgaris OX19 и OX2.
При внутрибрюшинном заражении морских свинок R. conorii вызывает у них лихорадку, которая у самцов осложняется скротальным феноменом, появляющимся с первых же дней лихорадки, но с различной степенью выраженности. Риккетсии в большом количестве обнаруживаются в клетках мезотелия влагалищной оболочки яичек.
Эпидемиология. R. conorii – первичный паразит собачьих клещей и собак. Марсельский риккетсиоз является эндемичным для стран, расположенных в бассейне Средиземного, Черного и Каспийского морей, а также для многих африканских стран. Эндемичность болезни связана с наличием в ее природных очагах спонтанно зараженных риккетсиями собачьих клещей Rhipicephalus sanguineus, которые одновременно являются и главными переносчиками возбудителя для человека. У клещей риккетсии вызывают бессимптомную длительную инфекцию и могут передаваться трансовариально. В организме клещей риккетсии обнаруживаются почти во всех тканях, а также в слюнных железах, поэтому заражение происходит и через укус, и при втирании коксальной жидкости. Поскольку основным прокормителем клещей R. sanguineus являются собаки, в эпидемиологии марсельской лихорадки особое значение имеет контакт человека с собаками (на юге Франции этот риккетсиоз называли «собачьей болезнью»). Однако естественными переносчиками R. conorii, помимо собачьего, могут быть и другие виды клещей, например R. simus, Hyalomma aegyptium, Haemaphysalis leachi и пр.
Клиника. Инкубационный период обычно составляет 5 – 7 дней, но может продолжаться до 18 дней. Заболевание начинается с озноба и повышения температуры, часто выше 40 °C. Через 3 – 4 дня после повышения температуры появляется макулопапулезная сыпь, которая быстро распространяется по всему телу, включая ладони, подошвы и лицо. Сыпь спустя некоторое время после снижения температуры исчезает, не оставляя следов, и не сопровождается шелушением. Весьма характерно для марсельской лихорадки появление к началу болезни маленькой язвы диаметром 2 – 5 мм на месте укуса клеща. Язва имеет черный некротический центр, окруженный темно-красной зоной различных размеров. Такой первичный аффект («черное пятно») может быть найден на любой части тела. Он всегда сопровождается увеличением регионарных лимфатических узлов. Общее состояние больного обычно удовлетворительное. Летальность не превышает 3 %.
Лабораторная диагностика. У больных марсельской лихорадкой возбудитель обнаруживается в течение всей болезни в крови, в язвенном поражении кожи («черном пятне») и в пятнах на коже. Для его обнаружения и выделения можно использовать заражение морских свинок, куриных эмбрионов и культур клеток. Возбудителя идентифицируют с помощью реакции нейтрализации риккетсий специфической антисывороткой. Наиболее простой, надежной и специфической является серологическая диагностика с помощью РСК. Для этих целей применяют специфические риккетсиозные антигены. РСК с антигеном из R. conorii всегда бывает положительной в более высоких титрах, чем с антигенами из риккетсий других видов этой группы.
Лечение. Наиболее эффективным является применение антибиотиков (тетрациклины, макролиды).
Профилактика. В эндемических регионах следует уничтожать бродячих собак и брать на учет всех дворовых и охотничьих собак, не реже двух раз в месяц подвергать их обработке для уничтожения клещей, проводить дезинфекцию дворов, где обитают собаки.
Клещевой сыпной тиф Северной Азии (сибирский риккетсиоз). Впервые описание этого заболевания было сделано в 1936 г. под названием «Клещевой лихорадки Приморья» (Е. М. Милль) и независимо – «Дальневосточной сыпной лихорадки» (Н. И. Антонов, А. Г. Найштат). Природа, эпидемиология, клиника и эндемические очаги североазиатского риккетсиоза были изучены в конце 30-х и в 40-х гг. ХХ в. многими отечественными учеными, в особенности П. Ф. Здродовским и М. К. Кронтовской. Эндемические очаги этого риккетсиоза охватывают Восточную, Центральную и Западную Сибирь до Урала; Забайкалье, Среднюю Азию, Армению, они имеются в Австрии, Чехии, Словакии, в Юго-Восточной Украине.
Возбудитель – R. sibirica – был открыт в 1938 г. П. Ф. Здродовским. Из всех видов риккетсий группы клещевой пятнистой лихорадки R. sibirica имеет наибольшее сходство с R. rickettsii, включая антигенное родство, однако они четко различаются с помощью серологических реакций, в частности РСК. Штаммы R. sibirica, выделенные в разных регионах, серологически однородны, но отличаются по степени своей патогенности. В частности, ряд штаммов, лишенных патогенности, был выделен на территории Австрии, Чехии, Словакии и в Юго-Восточной Украине. Их предложено объединить в новый вид – R. slovaca. R. sibirica хорошо размножаются в культурах клеток, особенно почечного эпителия. При заражении куриных эмбрионов вызывают их гибель на 4 – 5-й день, но размножение в желточном мешке относительно скудно. Морские свинки при внутрибрюшинном заражении отвечают развитием лихорадки и скротальным феноменом, который в хорошо выраженном случае сопровождается гиперемией и отеком мошонки. В клетках мезотелия влагалищной оболочки яичек свинки риккетсии обнаруживаются как внутри цитоплазмы, так и внутри ядра, но в умеренном количестве. Заражение свинок всегда разрешается их полным выздоровлением, а переболевшие свинки проявляют иммунитет не только к R. sibirica, но и к R. conorii и R. rickettsii.
Эпидемиология. Природные очаги этого риккетсиоза связаны с различными видами естественно инфицированных иксодовых клещей и их прокормителями: грызунами (для клещей, личинок и нимф), домашними и крупными дикими животными (для взрослых клещей). По крайней мере 9 видов иксодовых клещей являются носителями R. sibirica, и у большинства из них происходит трансовариальная передача возбудителя: Dermacentor nuttalli, D. marginatus, D. pictus, D. silvarum, Haemaphysalis punctata, H. concinna, Rhipicephalus sanguineus. Таким образом, спонтанно заражающиеся клещи, благодаря тому, что риккетсии у них сохраняются в период зимовки и передаются трансовариально, образуют резервуар возбудителя в природных очагах, а заражающиеся от них животные превращаются в его дополнительный резервуар.
Клещевой тиф сам по себе не контагиозен, он всегда связан с укусами инфицированных клещей. Это и определяет две основные особенности эпидемиологии риккетсиоза: обязательную связь заболеваемости людей с природными очагами и их сезонность, которая соответствует периоду активности взрослых клещей (апрель – октябрь). Заболевает преимущественно сельское население.
Клиника. Североазиатский риккетсиоз представляет собой доброкачественное острое лихорадочное заболевание с наличием первичного аффекта и макулопапулезной сыпи. Инкубационный период – от 2 до 7 дней, чаще равен 3 – 6 дням. Болезнь начинается с продромальных явлений (общее недомогание, познабливание), иногда внезапно, с повышением температуры за 3 – 4 дня до 40 °C и выше. Лихорадка держится 8 – 10 дней. Первичный аффект в месте укуса клеща наблюдается постоянно в виде небольшого плотного инфильтрата, который покрыт коричневой корочкой и окружен красноватой зоной. Регионарный лимфатический узел увеличен иногда до размера голубиного яйца. Сыпь розеолезно-папулезного характера с геморрагическими превращениями появляется обычно на 4 – 5-й день болезни, иногда покрывает все туловище и конечности, иногда менее обильна, часто она оставляет пигментацию. Выраженность симптомов варьирует, поэтому различают легкие, средние и тяжелые формы болезни.
Лабораторная диагностика. У больного человека возбудитель обнаруживается в крови. Для его выделения можно заражать морских свинок, куриные эмбрионы или культуру клеток, с последующей идентификацией в реакциях нейтрализации с использованием специфических антисывороток. Однако, как и при других риккетсиозах, наиболее приемлемыми являются серологические реакции (РСК, РПГА, агглютинации) с использованием специфических риккетсиозных антигенов. Титр комплементсвязывающих антител невысокий (1: 20 – 1: 160); РСК, как правило, положительна с 11-го дня болезни; она может быть использована и для ретроспективного диагноза североазиатского риккетсиоза. Положительная РПГА (титр 1: 200 и более) обнаруживается со 2-й нед. болезни и является показателем только свежего заболевания.
Лечение. Эффективно применение антибиотиков (тетрациклины, макролиды, левомицетин).
Профилактика: применение средств индивидуальной защиты от нападения клещей и уничтожение клещей во внешней среде. Специфическая профилактика не разработана.
Везикулезный риккетсиоз – доброкачественное заболевание, характеризующееся наличием первичного аффекта и своеобразной папулезно-везикулезной сыпи. Впервые оно было описано в 1946 г. Л. Суссманом и независимо от него рядом других авторов. Р. Хюбнер, П. Штампс и С. Армстронг предложили назвать эту болезнь (из-за сходства ее с ветряной оспой) риккетсиозной оспой. Аналогичное заболевание под названием везикулезный риккетсиоз было выявлено на юге Украины и подробно изучено в 1948 – 1950 гг. И. Р. Дробинским, С. М. Кулагиным и В. М. Ждановым.
Возбудитель риккетсиозной оспы – R. acari – был обнаружен в 1946 г. Р. Хюбнером, В. Джеллисоном и С. Армстронгом. Штаммы риккетсий, выделенные в 1950 г. В. М. Ждановым и С. М. Кулагиным из крови больных везикулезным риккетсиозом, получили название Dermacentroxenus murinus. Впоследствии оказалось, что риккетсиозная оспа и везикулезный риккетсиоз и соответственно их возбудители по всем своим проявлениям и свойствам тождественны, поэтому болезнь получила название везикулезного риккетсиоза, а возбудитель сохранил название R. acari. По морфологическим, тинкториальным и биологическим свойствам R. acari ничем не отличается от риккетсий других видов. По антигенной структуре очень близка к R. conorii и R. sibirica, но не имеет антигенного родства с R. prowazekii, R. typhi, Coxiella burnetii. Содержание Г + Ц в ДНК около 32,5 мол %. R. acari трудно культивируется в желточном мешке куриного эмбриона, но хорошо размножается в культурах клеток некоторых линий. Риккетсии располагаются преимущественно внутри ядер и менее интенсивно в цитоплазме.
Морские свинки легко восприимчивы к R. acari, заболевание у них проявляется в виде лихорадки длительностью 5 – 12 дней с одновременным скротальным феноменом у самцов. Инфекция у свинок протекает доброкачественно. Риккетсии обнаруживаются в крови, мозге и в мезотелии влагалищной оболочки яичек. К риккетсиям этого вида также высокочувствительны мыши. При интраназальном заражении у мышей развивается смертельная пневмония, при внутрибрюшинном – острого токсического эффекта не наблюдается, мыши погибают через 12 – 18 дней при явлениях перитонита с обильным слизистым или геморрагическим экссудатом.
Эпидемиология. Эндемические очаги везикулезного риккетсиоза связаны с циркуляцией возбудителя среди клещей-переносчиков и грызунов, на которых они паразитируют. Основным резервуаром риккетсий являются гамазовые клещи Allodermanyssus sanguineus, а также их прокормители – домовые мыши (Mus musculus) и крысы. У гамазовых клещей риккетсии сохраняются пожизненно и передаются трансовариально. Заражение человека происходит при нападении на него клещей (через укусы или при раздавливании). Очаги заболевания формируются в городах. На территории бывшего СССР природные очаги везикулезного риккетсиоза обнаружены в Молдавии, Прибалтийских странах, Белоруссии, Казахстане, на Украине и в приграничных с ней областях России.
Клиника. Инкубационный период длится 1 – 2 нед. Заболевание начинается с резкого повышения температуры до 39 – 40 °C. Лихорадка продолжается около недели, для нее характерны утренние ремиссии. Первичный аффект в месте укуса наблюдается постоянно (в виде уплотнения диаметром 1 – 2 см, в центре его – пузырек, затем некроз и образование черного струпа), сопровождается воспалением регионарного лимфатического узла. Первичный аффект появляется за 7 – 10 дней до лихорадки, а по заживлении нередко оставляет небольшой рубчик. Сыпь появляется на 2 – 3-й день болезни и характеризуется разнообразными проявлениями: пятна – папулы – везикулы – отпадающие корочки. Особенность высыпания, связанная с образованием пузырьков, дала основание для названия «везикулезный риккетсиоз». Общее течение болезни благоприятное, выздоровление наступает быстро, рецидивов не отмечено.
Лабораторная диагностика. Наиболее точным методом диагностики служит выделение возбудителя из крови больных. С этой целью заражают морских свинок и белых мышей. Характерным проявлением у мышей инфекции, вызванной R. acari, является своеобразный риккетсиозный перитонит. Для серологической диагностики используется РСК со специфическим риккетсиозным антигеном. Комплементсвязывающие антитела появляются с 6 – 10-го дня болезни у 53 % больных, с 11 – 15-го дня – более чем у 83 %, их титр в течение болезни нарастает, и они могут сохраняться длительное время. Сыворотки крови больных везикулезным риккетсиозом обычно показывают более высокий титр комплементсвязывающих антител, что используется для дифференциации этого риккетсиоза от других.
Лечение. Хороший терапевтический эффект дают тетрациклины, макролиды, левомицетин.
Профилактика должна быть направлена на истребление грызунов и паразитирующих на них гамазовых клещей. Специфическая профилактика не проводится.
Клещевой тиф Северного Квинсленда (Североавстралийский клещевой риккетсиоз). Заболевание было обнаружено в 1946 г. в Северном Квинсленде (Австралия). Протекает в виде доброкачественной лихорадки со средней продолжительностью около недели, сопровождается образованием первичного аффекта в месте укуса клещей, регионарным лимфаденитом и различной по характеру сыпью.
Возбудитель (R. australis) очень похож на R. conorii, но не вызывает острого токсикоза у мышей. Может быть дифференцирован от риккетсий других видов, в том числе от R. rickettsii, R. acari и R. conorii, серологически. Размножается в ядре и цитоплазме эукариотных клеток. У морских свинок при внутрибрюшинном заражении вызывает лихорадку и скротальный феномен. Заражение человека происходит через укусы иксодовых клещей (Ixodes holocylus), паразитирующих на диких зверьках.
К группе клещевой пятнистой лихорадки относится также риккетсиоз доброкачественной формы, вызываемый R. parkeri (R. montana), выделенной из клещей Amblyomma maculatum. R. parkeri могут быть дифференцированы от других риккетсий серологически.
Лихорадка цуцугамуси (тиф джунглей, японская речная лихорадка, кустарниковый тиф; тиф, передающийся клещами; сельский тиф) – заболевание, протекающее в виде острой лихорадки, сопровождающейся появлением первичного аффекта и макулопапулезной сыпи. Болезнь известна с древних времен под разными названиями, ее связывали с укусами клещей.
Впервые была описана в Японии в 1810 г. К. Хасимото, который использовал ее народное название цуцугамуси (клещевая болезнь). Заболевание распространено на огромной территории, включающей Японию, Корею, Китай, Тайвань, Вьетнам, Малайзию, Бирму, Индию, Шри-Ланку, Пакистан, Австралию, Сибирь, Дальний Восток России и другие регионы.
Возбудитель болезни – Orientia tsutsugamushi (O. tsutsugamushi) – был обнаружен в 1920 г. Н. Хаяши [и др.] и описан в 1930 г. М. Нагайо [и др.]. Риккетсии имеют форму коротких палочек длиной 1,2 мкм (редко превышают 1,5 мкм), часто форму диплобацилл. По методу Романовского – Гимзы окрашиваются в интенсивный пурпурно-голубой цвет. Другие методы, используемые для окрашивания риккетсий, мало пригодны. Риккетсии хорошо размножаются в желточном мешке куриных эмбрионов при температуре 34 °C и в культурах клеток различных линий, таких как лимфобласты и фибробласты, в эпителиальных клетках почек обезьян и т. п. Размножение происходит предпочтительно в околоядерной области клетки-хозяина, где они скапливаются в большом количестве, но никогда не размножаются в ядре. Находясь во внеклеточном окружении, более термолабильны, чем другие риккетсии: при 37 °C жизнеспособность сильно падает через 2 – 3 ч. В отношении антигенной структуры более разнородны по сравнению с другими риккетсиями. Помимо видоспецифического антигена, у O. tsutsugamushi обнаружено не менее 3 типоспецифических. Инфекция вызывает слабый иммунный ответ к видоспецифическому антигену и более сильный – к типоспецифическим антигенам. У риккетсий цуцугамуси патогенность связана, кроме эндотоксина, также с особым токсическим белком, свойства которого сходны со свойствами аналогичных токсических белков других риккетсий: он способен убивать мышей за несколько часов. Антитела против этого токсина очень специфичны, они отличаются от антитоксинов эпидемического и крысиного сыпного тифа и отсутствуют в сыворотках животных, переболевших инфекциями, вызванными иными штаммами этого вида, даже если в этих сыворотках имеются другие антитела против гомологичных риккетсий.
Белые мыши высокочувствительны к O. tsutsugamushi и поэтому широко используются для первичного выделения возбудителя. Однако штаммы риккетсий различного происхождения сильно различаются по вирулентности для мышей. Более вирулентные штаммы при внутрибрюшинном заражении вызывают смерть мышей через 7 – 14 дней, в увеличенной селезенке и в брюшной полости мышей обнаруживаются риккетсии. У морских свинок заражение риккетсиями не всегда вызывает заболевание и скротальный феномен не наблюдается.
Эпидемиология. Резервуаром возбудителя являются краснотелковые клещи – Trombicula akamushi, T. deliensis. Клещи заражаются в личиночной стадии при нападении на спонтанно болеющих животных (полевки, крысы и другие зверьки) или трансовариально. Для эпидемиологии имеет значение главным образом трансовариальная передача возбудителя у краснотелковых клещей, так как они лишь в стадии личинки и только однократно нуждаются в кровяном питании и нападают на человека и животных, заражая их. Следовательно, эпидемиология этого риккетсиоза определяется исключительно биологией краснотелковых клещей, которые и являются его главными распространителями в эндемических природных очагах.
Клиника. Инкубационный период составляет от 7 – 10 до 12 – 18 дней. Болезнь начинается с озноба и повышения температуры, которая на 3 – 4-й день достигает максимума и держится 2 – 3 нед. На месте укуса клеща образуется первичный аффект в виде язвы диаметром 0,3 – 2,0 см; он сопровождается регионарным лимфаденитом, однако возможно развитие распространенного лимфаденита. В конце 1-й нед. появляется макулезная или макулопапулезная сыпь различной выраженности. Нередко возникает гиперемия слизистой оболочки глаз. Общее течение болезни сильно варьирует в зависимости от степени вирулентности возбудителя в различных эндемических очагах. Возможны латентные формы инфекции с многомесячным (до 16 мес.) сохранением возбудителя. Летальность также сильно варьирует, например в Японии от 15 до 59 %, в зависимости от возраста больных.
Постинфекционный иммунитет связан с образованием антител, нейтрализующих токсин, и антимикробных антител. Сохраняется несколько лет, но только к гомологичному штамму, к гетерогенным – несколько месяцев.
Лабораторная диагностика. Самым надежным методом диагностики является выделение возбудителя от больного. С этой целью мышам внутрибрюшинно вводят 0,1 – 0,2 мл крови больного, взятой на высоте лихорадки. При наличии в ней возбудителя мыши погибают через 13 – 16 дней с явлениями характерного перитонита. Риккетсии обнаруживаются как в клетках брюшного экссудата, так и в соскобах с брюшины. Для выделения возбудителя можно воспользоваться также заражением 5 – 6-дневных куриных эмбрионов или культур клеток. Для серологической диагностики этого риккетсиоза применяют реакцию Вейля – Феликса с Proteus vulgaris ОХК, которая становится положительной на 2-й нед. заболевания. С диагностикумом ОХ19 и ОХ2 эта реакция у больных лихорадкой цуцугамуси отрицательная. Более надежной является РСК со специфическими антигенами, приготовленными из нескольких штаммов O. tsutsugamushi, поскольку эти риккетсии характеризуются антигенной неоднородностью. Перспективны и другие серологические реакции с хорошо очищенными риккетсиозными антигенами.
Лечение. Эффективными терапевтическими средствами являются антибиотики (тетрациклины, макролиды, левомицетин и др.).
Профилактика. Общая борьба с этим риккетсиозом сводится к ликвидации условий для выплода краснотелковых клещей, которая достигается агротехническими мерами в местах их обитания и уничтожением зарослей диких кустарников, а также к мерам личной защиты от нападения личинок клещей.
Проблема специфической профилактики лихорадки цуцугамуси остается пока не разрешенной в связи с тем, что географические варианты возбудителя в антигенном отношении разнородны. Убитые вакцины оказались неэффективными. Перспективны методы изыскания живых вакцин из ослабленных (например, антибиотиками) вариантов возбудителя (антибиовакцина) или создание химических вакцин, содержащих наиболее иммуногенные и общие для разных штаммов этого вида риккетсий антигены. Получена вакцина из инактивированных гамма-облучением риккетсий (США).
Заболевание было известно давно, но особенно большое распространение получило во время Первой мировой войны, когда им болели тысячи солдат. Тогда оно и получило такие названия, как волынская, пятидневная и окопная (траншейная) лихорадка.
Волынская лихорадка – доброкачественное инфекционное заболевание, характеризующееся короткими лихорадочными приступами (пароксизмальная лихорадка), разнообразием клинической картины и болями различной локализации, чаще в голенях. Впервые описана Х. Вернером и Х. Гисом в 1916 г. Возбудитель был открыт в том же году К. Гепфером, который назвал его Rickettsia wolhynica (quintana). Впоследствии для него был установлен новый род риккетсий, получивший название Rochalimaea. В отличие от всех риккетсий Rochalimaea quintana размножается на поверхности эукариотных клеток и может расти на искусственных питательных средах; кроме того, содержание Г + Ц в его ДНК значительно выше, чем у рода Rickettsia, и составляет 39 мол %, поэтому недавно было предложено исключить его из семейства Rickettsiaceae и включить в род Bartonella семейства Bartonellaceae. Таким образом, возбудитель волынской лихорадки должен называться Bartonella quintana.
B. quintana – короткие палочки диаметром 0,2 – 0,5 мкм и длиной 1,0 – 1,6 мкм, имеют типичные для грамотрицательных бактерий клеточную стенку, цитоплазматическую мембрану, ядерный и рибосомальный аппарат. Жгутиков и капсул не имеют, спор не образуют. Растут на агаре, содержащем 6 % инактивированной лошадиной сыворотки и 4 % лизированных лошадиных эритроцитов; а также на жидкой среде, содержащей вместо гемоглобина сыворотку коровьего эмбриона.
Рост происходит лучше в аэробных условиях с увеличенным содержанием СO2. На плотной среде колонии диаметром 0,07 – 0,20 мм, круглые, линзовидные, полупрозрачные, мукоидные; появляются на 12 – 14-й день инкубации при температуре 37 °C при первичном посеве и через 3 – 5 дней при пересевах. Куриные эмбрионы и культуры клеток менее пригодны для их выращивания. Покоящиеся клетки активно потребляют сукцинат и глутамин, глюкозу не усваивают, обладают глутаматоксалацетат-трансаминазной активностью. Относительно устойчивы к высоким температурам: обработку сухим жаром при 80 °C выдерживают в течение 20 мин. В высохших испражнениях сохраняют жизнеспособность в течение нескольких месяцев.
В антигенном отношении однородны, перекрестного антигенного родства с видами родов Rickettsia и Proteus не обнаружено. Морские свинки и белые мыши к B. quintana не восприимчивы. Экспериментальную инфекцию удается воспроизвести только у обезьян (Macaca rhesus).
Эпидемиология. Основным источником инфекции является человек. Заражение, как и в случае эпидемического сыпного тифа, происходит только через вшей человека (Pediculus corporis). Бартонеллы размножаются в просвете кишечника вшей внеклеточно и выделяются с их испражнениями. Заражение происходит путем втирания бартонелл в ранку на коже, образующуюся при укусе вшей и расчесывании. У вшей инфекция протекает бессимптомно, трансовариальной передачи бартонелл не происходит. Эпидемическое распространение возможно только при наличии завшивленности, скученности населения, что наблюдалось во время войны.
Клиника. Инкубационный период от 9 до 13 дней. Начало болезни острое.
Лихорадка может иметь различную форму:
а) пароксизмальную, при которой лихорадочные приступы сменяются безлихорадочными периодами;
б) тифоидную – высокая температура в течение 2 – 6 нед.;
в) абортивную – кратковременное повышение температуры;
г) смешанную – температурная кривая имеет неопределенный характер.
Иногда заболевание протекает без повышения температуры и бессимптомно. Розеолезная сыпь появляется далеко не у всех больных. Течение болезни в большинстве случаев благоприятное.
Постинфекционный иммунитет изучен недостаточно. Существует мнение, что он либо отсутствует, либо выражен очень слабо и сохраняется только на период носительства, которое довольно непродолжительно.
Лабораторная диагностика. Для диагностики можно использовать метод выделения возбудителя из крови больного путем посева ее на специальные питательные среды. Более простым является серологический метод с использованием бартонеллезных антигенов в реакциях агглютинации, РСК и РПГА. Высказано предположение о том, что B. quintana могут иметь отношение к этиологии некоторых хронических заболеваний (бациллярный ангиоматоз, эндокардиты).
Лечение. Наиболее эффективны антибиотики: тетрациклины, макролиды, левомицетин.
Профилактика. Специфическая – не разработана. Основное средство борьбы – ликвидация вшивости.
Этот род риккетсий также представлен одним видом – Coxiella burnetii, который является возбудителем Ку-лихорадки. Заболевание впервые было выявлено в 1935 г. в Австралии Е. Дерриком, который назвал ее Ку-лихорадкой, отмечая неизвестную этиологию болезни (буква Q – «ку» является первой англ. слова query – вопрос, неясный).
Ку-лихорадка – острое риккетсиозное лихорадочное заболевание, которое часто протекает с явлениями интерстициальной пневмонии (пневмориккетсиоз) и отличается от других риккетсиозов отсутствием сыпи. Ку-лихорадка эндемична для Австралии, Новой Зеландии, многих стран Северной, Центральной и Южной Америки, Азии, Европы и Африки.
Возбудитель болезни открыт в 1937 г. Е. Дерриком, а отождествлен с риккетсиями Ф. Бернетом, в честь которого Е. Деррик и предложил в 1939 г. назвать его Rickettsia burnetii. Впоследствии, в силу ряда биологических особенностей возбудителя, он был выделен в самостоятельный род Coxiella.
Coxiella burnetii отличается от всех других риккетсий по следующим свойствам: содержание Г + Ц в ДНК составляет 43 мол %; риккетсии размножаются в фаголизосомах (вакуолях) эукариотных клеток; в покоящейся стадии образуют эндоспоры; могут иметь настолько малые размеры, что проходят через бактериальные фильтры. Обычно имеют форму палочек диаметром 0,2 – 0,4 мкм и длиной 0,4 – 1,0 мкм; изредка шаровидную 0,3 – 0,4 мкм (фильтрующиеся формы); иногда – диплобактерий 1,0 – 1,6 мкм длиной. Риккетсии не образуют жгутиков и капсул; клеточная структура такая же, как и у других риккетсий; обычно грамотрицательны, иногда могут быть грамположительны. Жизненный цикл складывается из двух стадий – вегетативной и покоящейся. Хорошо размножаются в желточном мешке куриных эмбрионов при температуре 35 °C и в культурах клеток различных типов (куриные фибробласты, мышиные клетки L и др.). Риккетсии, отделенные от клетки-хозяина, способны потреблять пируват, глутамат, некоторые метаболиты цикла лимонной кислоты, но не усваивают глюкозу. Однако разрушенные клетки риккетсий фосфорилируют глюкозу в глюкозо-6-фосфат и окисляют в 6-фосфо-глюконат, способны синтезировать серин, цитруллин, включать аминокислоты в белки, имеют рибосомы, словом, обладают собственными системами биосинтеза белка и мобилизации энергии, но являются, как почти и все риккетсии, строгими внутриклеточными паразитами. По сравнению с другими риккетсиями, проявляют большую устойчивость к физическим и химическим факторам, они даже более устойчивы, чем не образующие спор бактерии. При температуре 4 °C сохраняют жизнеспособность в высохших испражнениях клещей, в шерсти или в нехлорированной воде в течение года и более, в мясе – около месяца. В высохших моче и крови животных сохраняют вирулентность в течение ряда недель. В масле, при хранении в холодильнике, остаются жизнеспособными до 40 дней. Нагревание при температуре 70 – 90 °C инактивирует их неполностью. В зараженном молоке после длительной пастеризации при температуре 60 °C риккетсии погибают частично, а полная их гибель наступает только после кипячения молока через 10 мин. Разрушаются при обработке инфицированного желточного мешка 0,3 %-ным формальдегидом и 1 %-ным фенолом через 24 ч. Однако риккетсии очень чувствительны к действию жирорастворителей (спирт, эфир и др.) – 70-градусный спирт убивает их через 1 мин.
У R. burnetii обнаружена фазовая вариация, аналогичная вариации S→R у других бактерий, которая выявляется с помощью иммунологических тестов. Все свежевыделенные риккетсии обладают антигенной специфичностью I фазы. Повторные пассажи в желточном мешке (8 – 20) вызывают превращение в фазу II, а единичные пассажи через морскую свинку достаточны для возвращения в фазу I. Клетки фазы II, в противоположность фазе I, легко агглютинируются в солевом растворе или нормальной сывороткой и фагоцитируются в отсутствие специфических антител.
Антигены фазы I связаны с поверхностными углеводами, которые отмываются при обработке трихлоруксусной кислотой или другими реагентами. Антигены фазы II этими реагентами не удаляются, их химический состав не известен. Антигены фаз I и II различаются и по иммунологическим свойствам. Антигены фазы II хорошо обнаруживаются в РСК с сыворотками животных и человека, перенесших инфекции, особенно недавно.
Иммунизация клетками фазы II приводит к образованию антител к антигенам фазы II. Антигены фазы I обладают более сильной иммуногенностью и вызывают образование антител к антигенам фаз I и II, причем к последним антитела появляются раньше и сохраняются дольше, чем при воздействии антигеном фазы II. Это позволяет полагать, что антиген фазы I содержит скрытый антиген фазы II и обладает адъювантными свойствами. Предполагается, что фазовая вариация риккетсий определяется плазмидой, которая есть у риккетсий фазы I, но отсутствует у риккетсий фазы II. За исключением фазовой вариации, штаммы C. burnetii в антигенном отношении однородны и мало отличаются друг от друга, не имеют перекрестных антигенов с другими риккетсиями и Proteus vulgaris. Из лабораторных животных к C. burnetii наиболее восприимчивы морские свинки, которые и используются для первичного выделения риккетсий. Хотя штаммы значительно различаются по вирулентности для свинок, их смерть обычно наступает при заражении большими дозами. Меньшие дозы вызывают лихорадку и увеличение селезенки, из которой риккетсии могут быть выделены в большом количестве. Кролики, хомячки и мыши также высокочувствительны, но у мышей острой токсической смерти C. burnetii не вызывают.
Эпидемиология. Ку-лихорадка имеет ряд особенностей. Они заключаются в том, что, помимо природных очагов этого риккетсиоза, обусловленного наличием естественно зараженных возбудителем клещей и их прокормителей, формируются дополнительные очаги среди домашних животных (мелкий и крупный рогатый скот), от которых чаще всего и заражаются люди. Спонтанную зараженность риккетсиями Ф. Бернет обнаружил более чем у 40 видов иксодовых, аргасовых и гамазовых клещей. В организме зараженных клещей риккетсии сохраняются долгое время и передаются трансовариально. Клещи заражают животных через укусы и выделяют риккетсии в огромном количестве во внешнюю среду с испражнениями. В эндемичных районах риккетсиоз обнаруживается у многих видов диких животных, в частности у грызунов и птиц. Нападая на животных и заражая их, клещи создают дополнительный мощный резервуар возбудителя во многих странах мира. Зараженные животные выделяют возбудителя с молоком, носовой слизью, мочой, испражнениями, но особенно много – с плацентой и околоплодной жидкостью. Таким образом, с учетом высокой устойчивости риккетсий во внешней среде и особенностями риккетсиозов у животных, заражение человека Ку-лихорадкой возможно самыми различными способами: аэрогенным, алиментарным (молоко и мясо), водным (при питье и купании в воде, инфицированной мочой больных животных) и через укусы клещей, что бывает значительно реже. Резервуары риккетсий среди мелкого и крупного рогатого скота играют основную роль в эпидемиологии Ку-лихорадки.
Клиника. Инкубационный период длится в среднем 19 дней (варьирует от 10 до 26 дней). Первичный аффект и сыпь, как правило, отсутствуют. Наиболее характерный симптом болезни – лихорадка. За 2 – 3 дня температура повышается до 39 – 40 °C и держится на этом уровне 8 – 10 дней почти с ежедневными ремиссиями. Особенно характерны поражения легких в виде интерстициальной пневмонии, но она развивается лишь при аэрогенном заражении и распознается при помощи рентгенографии. Течение Ку-лихорадки чрезвычайно разнообразно, диагноз клинически поставить бывает иногда очень трудно. В эндемических очагах заболевание людей иногда протекает бессимптомно и выявляется только серологическими методами. Болезнь протекает доброкачественно, летальность незначительная.
Постинфекционный иммунитет прочный, длительный, опосредуется антимикробными антителами. Вместе с тем после перенесенного заболевания к возбудителю возникает гиперчувствительность замедленного типа.
Лабораторная диагностика. Клиническая диагностика Ку-лихорадки затруднена, поэтому решающее значение имеет микробиологическая. Используют 3 метода: выделение и идентификацию возбудителя, серологические реакции со специфическими риккетсиозными антигенами (РСК, РПГА, реакция агглютинации, ИФМ и др.) и аллергическую внутрикожную пробу.
Материалом для выделения возбудителя служит кровь, которой внутрибрюшинно заражают морских свинок. Для обнаружения в биологических субстратах животных и человека C. burnetii и их растворимых антигенов используют тест-системы на основе ИФМ и ЦПР. Серологические реакции (РПГА, РА, РСК) для выявления нарастания титра антител ставят с парными сыворотками.
Лечение проводят с применением антибиотиков (тетрациклины, макролиды и др.).
Профилактика. Общие меры профилактики в эндемических очагах Ку-лихорадки такие же, как и при бруцеллезе. Для специфической профилактики применяют (по эпидемическим показаниям) сухую живую вакцину из ослабленного штамма риккетсий Бернета М-44.
Эрлихиозы – болезни, вызываемые эрлихиями, очевидно, существуют давно, но обнаружили их лишь недавно (проблема «старых» новых болезней). Первый случай эрлихиоза у человека был описан в США в 1987 г., в Европе – в 1991 г., а первые 4 случая в России (в Пермской области) – в 1999 г. Проведенными с тех пор исследованиями переносчиков возбудителя и определениями наличия антител к эрлихиям у людей было установлено, что трансмиссивные эрлихиозы распространены во многих странах мира.
В роде Ehrlichia известны 11 видов, в том числе не менее пяти патогенных для человека: E. chaffeensis, E. muris, E. microti, E. sennetsu; один вид, имеющий сходство с E. equi и E. phagocytophila, пока не получил собственного латинского названия и поэтому обозначается E. equi/phagocytophila.
Патогенные эрлихии локализуются у человека в цитоплазматических вакуолях лейкоцитов. Они вызывают два вида распространенных трансмиссивных заболеваний: моноцитарный эрлихиоз человека (МЭЧ) – возбудитель паразитирует в моноцитах; и гранулоцитарный эрлихиоз человека (ГЭЧ) – возбудитель паразитирует в нейтрофилах.
Возбудители МЭЧ – E. chaffeensis и E. muris, возбудители ГЭЧ – E. microti и E. equi/phagocytophila. Третье, менее распространенное заболевание – лихорадку Сеннетсу (инфекционный ангинозный мононуклеоз), – вызывает E. sennetsu (паразитирует в моноцитах). Это заболевание регистрируется в Японии и Малайзии. Путь заражения – алиментарный, источник заражения – рыба (сырая или недоваренная).
Морфологически разные виды эрлихий очень сходны: мелкие (0,5 – 1,5 мкм) полиморфные кокковидные или эллипсоидной формы грамотрицательные бактерии, неподвижны, спор и капсул не образуют. Культивирование удается пока в культурах клеток гистоцитомы собак и клеток линии HL-60 от больного лейкемией. Это обстоятельство затрудняет диагностику эрлихиозов.
Общие свойства эрлихий – высокая степень адаптации к организму членистоногих и выраженная природная очаговость вызываемых ими заболеваний, строго сопряженная с ареалами переносчиков и их прокормителей.
Переносчики возбудителей МЭЧ в США – клещи Amblyomma americanum, Dermacentor variabilis, Ixodes pacificus, a их прокормители – белохвостые олени, собаки, еноты, лошади. На значительной части Евразии E. muris переносят клещи Ixodes persulcatus, а их прокормители – мышевидные грызуны. Переносчики возбудителей ГЭЧ – клещи Ixodes scapularis, I. pacificus, I. ricinus, I. dammini; их прокормители – белохвостые олени, грызуны, лошади, собаки и жвачные.
Заражение трансмиссивными эрлихиозами происходит через укусы клещей, выделяющих возбудителя со слюной. Патогенез болезни определяется внутриклеточным способом паразитизма эрлихий. Размножаясь в цитоплазме моноцитов и нейтрофилов, они образуют колонии (скопления) в виде морулы (т. е. структуры типа тутовой ягоды). Размножение эрлихий приводит к гибели клеток и воспалительным процессам различного характера во внутренних органах, которые способствуют развитию оппортунистических грибковых и вирусных инфекций. Эрлихиозы у человека протекают по типу острых гриппоподобных лихорадок. Инкубационный период от 1 до 21 дня. Заболевание длится 2 – 3 нед., иногда затягивается до 6 нед. Клинические проявления болезни варьируют от бессимптомных и субклинических форм до тяжелых форм с летальным исходом (3 – 5 % при МЭЧ и 7 – 10 % при ГЭЧ). У больного развивается анемия, лейкопения, тромбоцитопения. Часто повышен уровень АсТ и АлТ (аспартатаминотрансферазы и аланинаминотрансферазы).
Лабораторная диагностика. Диагноз эрлихиозов может быть подтвержден микроскопически (электронно-микроскопически), серологически (непрямая РИФ, реже в иммуноблотинге со специфическими эрлихиозными антигенами) или методом ЦПР, а также прямым выделением возбудителя в культуре клеток.
Лечение МЭЧ и ГЭЧ идентично. Применяют тетрациклин или доксициклин в течение не менее чем 7 дней.
Бартонеллы относятся к семейству Bartonellaceae, которое включает два рода – Bartonella и Grahamella. Подобно риккетсиям и эрлихиям, бартонеллы представляют собой компактную группу микроорганизмов. Они также являются внутриклеточными паразитами, вызывают трансмиссивные инфекции и адаптированы к организму членистоногих. Однако бартонеллы имеют существенное отличие от риккетсий и эрлихий: они способны расти на искусственных питательных средах.
Возбудители бартонеллезов относятся к роду Bartonella, который содержит кроме уже описанного в разделе «Волынская лихорадка» вида B. quintana еще 4 патогенных для человека вида: Bartonella henselae (острая форма – болезнь кошачьих царапин;
хроническая – бациллярный ангиоматоз, эндокардит); B. claridgeae (бациллярный ангиоматоз, доброкачественная лимфаденопатия); B. elizabethae (эндокардит) и B. bacilliformis – возбудитель наиболее тяжелого бартонеллеза – болезни Карриона.
Бартонеллезы, как и эрлихиозы, являются трансмиссивными болезнями; резервуарами их служат москиты, блохи, кошки, мелкие грызуны; а для B. quintana – платяная вошь и, возможно, чесоточные клещи.
Бартонеллы – мелкие грамотрицательные бактерии, паразитирующие в эритроцитах человека и других позвоночных. Их размеры – 0,2 – 0,5 × 0,3 – 3,0 мкм. При окраске препаратов по Романовскому – Гимзе в эритроцитах и на их поверхности имеют форму пурпурно-голубых тонких прямых или изогнутых палочек, располагающихся одиночно или группами. Характерный их признак – расположение в виде цепочек из нескольких сегментированных клеток с полярным утолщением и гранулами на одном или обоих концах. Наблюдаются также округлые или эллипсоидные клетки. Обладают одним полярно расположенным жгутиком или пучком их, но у тканевых форм жгутики не обнаружены. Бартонеллы – строгие аэробы, растут на жидких и полужидких средах с добавлением свежей кроличьей сыворотки и кроличьего гемоглобина или крови человека, лошади, кролика; на агаровых средах, содержащих кровь, сыворотку или плазму; на глюкозо-кровяном агаре с цистином. Оптимальная температура для роста 29 °C, хотя они хорошо растут и при 37 °C. Рост медленный, колонии появляются на 5 – 8-й день инкубации, мелкие, мукоидные, слегка прилипающие к агару. В жидких средах сначала образуются гранулы, а затем – хлопьевидная пленка на поверхности бульона. Культуры при температуре – 70 °C сохраняют жизнеспособность в течение 5 лет. Хорошо размножаются в культурах клеток, в желточном мешке и в хорион-аллантоисной жидкости куриных эмбрионов. Бартонеллы не ферментируют глюкозу, сахарозу и другие сахара. Антигенные связи между бартонеллами разных видов изучены мало.
Болезнь Карриона – острое тяжелое трансмиссивное заболевание. Его возбудитель – Bartonella bacilliformis – был обнаружен в 1905 г. перуанским врачом А. Бартоном, в честь которого эти бактерии и получили свое название.
Эпидемиология. Заболевание эндемичное, наблюдается в Перу, Колумбии, Эквадоре, Боливии. Крупнейшая эпидемия в 1870 г. была описана как лихорадка Оройа (недалеко от г. Оройа). В Южной Америке было описано другое заболевание, которое характеризовалось появлением бородавок (verruga peruana). Однако в 1885 г. Д. А. Каррион опытом самозаражения доказал, что лихорадка Оройа и verruga peruana представляют собой две формы одной и той же болезни – острую и хроническую. Заражение людей происходит через укусы москитов рода Lutzomyia, которые вместе с прокормителями (мелкими грызунами и, возможно, домашними животными) служат резервуаром возбудителя и передают его от больных и переболевших здоровым.
Клиника. Инкубационный период 15 – 40 (чаще 20) дней. Болезнь начинается с повышения температуры до 39 – 40 °C, которая держится несколько недель, затем медленно снижается. Характерны резкие головные боли, боли в костях, суставах, мышцах. Быстро появляется и прогрессирует анемия, число эритроцитов снижается до 1 – 2 млн/мл, понижается содержание гемоглобина. У больных бартонеллы обнаруживаются в эритроцитах, в клетках селезенки, костного мозга, печени, лимфатических узлов, в эндотелиальных клетках сосудов почти всех внутренних органов и кожи. У некоторых больных заболевание протекает только в виде такой лихорадки Оройа. Однако чаще после нескольких недель или месяцев бессимптомного периода появляются кожные высыпания (verruga peruana), которые могут проявляться в одной или нескольких формах (узелковой, милиарной и т. п.). Возбудитель обнаруживается в эндотелиальных клетках сосудов пораженных участков кожи. Эти области похожи на гнойные гранулемы. У некоторых людей болезнь протекает только в форме лихорадки Оройа с гемолитической анемией, в то время как у других – только в форме кожных высыпаний. Первая форма протекает более тяжело, летальность составляет 40 – 48 %. У детей обычно болезнь протекает легко. Наблюдаются атипичные и бессимптомные формы болезни.
Постинфекционный иммунитет прочный, длительный, антимикробный.
Лабораторная диагностика осуществляется путем:
а) бактериоскопии мазков крови, окрашенных по Романовскому – Гимзе;
б) выделения возбудителя (посев крови больного на плотные, полужидкие или жидкие питательные среды);
в) с помощью различных серологических реакций – агглютинации, РСК, РПГА и др. Реакция агглютинации имеет диагностическое значение в титре 1: 20.
Лечение. Эффективны антибиотики: пенициллин (он может индуцировать образование L-форм, так как нарушает синтез клеточной стенки бартонелл), тетрациклины, левомицетин, макролиды.
Профилактика. Специфическая профилактика не разработана, неспецифическая сводится к уничтожению москитов и защите от их нападения.
Хламидии – уникальная группа мелких патогенных грамотрицательных неподвижных бактерий, являющихся возбудителями различных болезней человека и животных. В 1907 г. С. Провачек обнаружил возбудителя трахомы и назвал его «Chlamydozoa» в связи с тем, что образуемые им внутриклеточные микроколонии (тельца Гальберштедтера – Провачека) представляются окутанными мантией («хламидой»). Хламидии относятся к роду Chlamydia, семейству Chlamydiaсeae, классу Chlamydiaе. Их главная биологическая особенность заключается в том, что они размножаются только в цитоплазме эукариотных клеток по уникальному среди организмов циклу развития. В отличие от вирусов, хламидии содержат как ДНК (ядерный аппарат), так и рибосомы. Они имеют клеточную стенку, химический состав которой сходен с составом таковой у грамотрицательных бактерий, и размножаются путем поперечного деления. Вместе с тем, подобно вирусам и риккетсиям, хламидии – облигатные внутриклеточные паразиты, так как их метаболизм зависит от метаболизма клетки-хозяина. Эта зависимость проявляется в неспособности хламидий синтезировать свои собственные высокоэнергетические соединения, такие как АТФ, и отсутствии цитохромов, т. е. они являются «энергетическими паразитами» и потому не способны размножаться вне живой клетки. Основные стадии жизненного цикла хламидий следующие:
1) элементарные тельца – мелкие (0,2 – 0,5 мкм) электронно-плотные шаровидные структуры, имеющие компактный нуклеоид и ригидную трехслойную клеточную стенку;
2) инициальные (исходные), или ретикулярные, тельца – большие (0,8 – 1,5 мкм в диаметре) сферические образования, имеющие сетчатую структуру с тонкой клеточной стенкой и фибриллярным нуклеоидом;
3) промежуточные тельца – промежуточная стадия между элементарными и ретикулярными тельцами.
Элементарные тельца являются инфекционной, а ретикулярные – вегетативной формой хламидий. Вегетативные формы размножаются путем бинарного деления внутриклеточно, но не инфекционны, когда выделяются из клетки-хозяина. Жизненный цикл хламидий начинается с того, что элементарные тельца фагоцитируются клеткой-хозяином, а затем в течение нескольких часов реорганизуются, увеличиваются в размерах и превращаются в ретикулярные формы, которые размножаются путем поперечного деления. Образующиеся дочерние формы также размножаются путем бинарного деления. Жизненный цикл заканчивается, когда возникающие промежуточные формы реорганизуются (уплотняются), уменьшаются в размерах и превращаются в элементарные тельца. Размножаясь внутри цитоплазматических везикул, хламидии образуют микроколонии, окруженные мембраной, возникающей из впячивания мембраны клетки при фагоцитозе элементарного тельца. В составе микроколоний обнаруживаются все 3 стадии развития хламидий. В одной клетке может быть несколько микроколоний, образующихся в случае фагоцитоза нескольких элементарных телец. После разрыва стенки везикулы и мембраны клетки-хозяина вновь образовавшиеся хламидии высвобождаются, и элементарные тельца, инфицируя другие клетки, повторяют цикл развития. Для микроскопического обнаружения хламидий в инфицированных клетках (тканях) применяют различные способы окрашивания: Романовского – Гимзы, Кастенады, Маккиавелло и др. При окрашивании по Романовскому – Гимзе они приобретают голубой или фиолетовый цвет. Однако хламидии хорошо видны и в неокрашенном состоянии при микроскопии влажных препаратов под стеклом с помощью фазовоконтрастной оптической системы. В оптимальных условиях роста в эукариотных клетках жизненный цикл хламидий составляет 17 – 40 ч. Хламидии хорошо размножаются в желточном мешке куриных эмбрионов при температуре от 33 до 41 °C (в зависимости от вида), а также в культурах клеток различных позвоночных. Содержание Г+Ц в ДНК хламидий варьирует от 39 до 45 мол %, отношение РНК/ДНК в элементарных тельцах в 2 раза меньше, чем в ретикулярных. У C. trachomatis обнаружено два важных метаболических признака: способность синтезировать гликоген и предшественники фолиевой кислоты, по которым (с учетом других признаков) они легко дифференцируются от других видов – C. psittaci и C. pneumoniae (табл. 51).
Таблица 51
Дифференциальные признаки трех видов Chlamydia
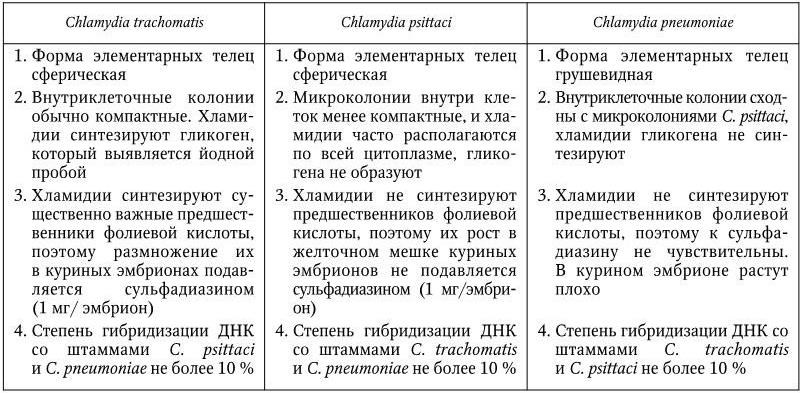
Хламидии имеют сложное антигенное строение. Они содержат общий для рода термостабильный антиген, носителем которого является ЛПС клеточной стенки, и термолабильные видоспецифические и типоспецифические антигены белковой природы. Хламидии – строгие внутриклеточные паразиты позвоночных, но они обнаружены и в (или на) эктопаразитических членистоногих. Многие штаммы вызывают генерализованные инфекции у различных хозяев, некоторые – резко выраженные воспаления в одной или нескольких тканях или органах только определенных видов позвоночных. Штаммы хламидий обнаружены у птиц, млекопитающих (включая приматов) и людей. У людей они вызывают заболевания глаз, мочеполовой и дыхательной систем; у птиц – респираторные болезни и генерализованную инфекцию; у млекопитающих – заболевания дыхательных путей, суставов, плаценты и кишечные болезни. Некоторые штаммы хламидий патогенны и для человека, и для птиц. Описан еще один вид – С. pecorum, его патогенность для людей изучена мало.
Морфологические и основные биологические свойства этого вида хламидий соответствуют характеристике рода. Микроколонии формируются в результате продолжительного размножения в везикулах цитоплазмы, в которых они компактно уложены. Хламидии образуют гликоген, который выявляется окраской раствором Люголя после фиксации клеток в метаноле. Оптимальная температура для их размножения в желточном мешке куриных эмбрионов 35 °C. Размножение в куриных эмбрионах подавляется сульфадиазином (1 мг/эмбрион). Они хорошо размножаются также в культурах клеток, особенно тканей мышей. Многие штаммы размножаются в легких белых мышей и морских свинок при интраназальном заражении их, в коже морских свинок, а также в конъюнктиве приматов. Длительно сохраняются в зараженных желточных мешках при температуре –20 °C или ниже, но легко инактивируются нагреванием до 80 °C, 0,2 %-ным фенолом и другими химическими дезинфектантами. C. trachomatis имеют родовой, видовой и типоспецифические антигены. Предполагается наличие токсического компонента. По типоспецифическим антигенам их подразделяют на 15 серологических типов: A, B, Ba, C, D, E, F, G, H, I, J, K, L1, L2 и L3. Вызывают у человека трахому (A, B, Ba, C); конъюнктивит с включениями, или бленнорею с включениями у новорожденных (D, E, F, G, H, I, J, K); уретриты, цервициты, сальпингиты, фарингиты (B, C, D, E, F, G, H, I, K, L3); венерический лимфогранулематоз, или паховый лимфогранулематоз (L1, L2, L3). Урогенитальный хламидиоз, передающийся половым путем и характеризующийся поражением мочеполовых органов, наиболее широко распространен в мире. В передаче возбудителя большую роль играют женщины, у которых эта инфекция часто протекает бессимптомно. Возбудителями различных форм урогенитального хламидиоза являются 8 серотипов (D, E, F, G, H, J, I и K) C. trachomatis.
Трахома (греч. trachys – шероховатый) – хроническое специфическое заболевание глаз (кератоконъюнктивит), характеризующееся воспалительным утолщением конъюнктивы и последующим образованием рубцовой ткани. Хламидии размножаются в эпителиальных клетках конъюнктивы, образуя в них микроколонии. В основе патогенеза болезни лежит повреждение клеток, наступающее вследствие размножения в них хламидий.
Эпидемиология. Заражение происходит путем передачи возбудителя с больных глаз на здоровые прямым контактом (занос грязными руками) либо через загрязненные (в том числе мухами) предметы: посуда, полотенца, носовые платки и др. Основную роль в распространении трахомы играют социально-бытовые факторы, экономический и культурный уровень и санитарно-гигиенические условия жизни населения. Особое значение в передаче возбудителя имеет пользование общим полотенцем и общими постельными принадлежностями, умывание в общем тазу и т. п. Трахома – «болезнь семьи»: при заражении одного из членов семьи обычно заболевают и другие ее члены. Больше всего трахомой болеет население стран Азии, Африки и Южной Америки (более 400 млн человек). Она является одной из причин слепоты. В России трахома как массовое заболевание ликвидирована.
Клиника. Инкубационный период – 1 – 2 нед. Обычно поражаются оба глаза. В течении болезни различают четыре стадии: I – воспалительная инфильтрация ткани конъюнктивы, появление в ней полупрозрачных фолликулов и слизисто-гнойных выделений; II – нарастание воспалительных явлений и появление первых признаков рубцевания; III – преобладание рубцовых явлений над воспалительными; IV – завершение рубцевания конъюнктивы; фолликулов и инфильтрации ткани нет.
Без лечения болезнь может длиться многие годы. Нередко поражается роговая оболочка (паннус), в результате вторичной инфекции может быть гнойная язва роговицы. Последствия трахомы – завороты или вывороты век, трихиазм, слепота.
Постинфекционный иммунитет слабый, непрочный и непродолжительный. Для лечения трахомы используют антибиотики (тетрациклины, макролиды) и сульфамиды. Лечение урогенитальных хламидиозов должно быть комплексным (этиологическое, патогенетическое и симптоматическое). Применяют совместно антибиотики и амиксин по специальной схеме. Лечение респираторного хламидиоза (непрерывно рецидивирующие фарингиты и трахеобронхиты, при которых в мазках из зева в 30 – 40 % случаев обнаруживают C. trachomatis) также проводят по специальной схеме с использованием амиксина.
Профилактика трахомы сводится к комплексу мероприятий по своевременному выявлению и эффективному лечению больных, улучшению социально-бытовых и санитарно-гигиенических условий жизни населения.
Конъюнктивит новорожденных (бленнорея новорожденных с включениями) – заболевание, вызываемое C. trachomatis и характеризующееся воспалительной инфильтрацией конъюнктивы по преимуществу нижнего века и имеющее тенденцию к спонтанному выздоровлению. Передача инфекции от глаза к глазу чрезвычайно редка. Заражение детей происходит во время родов от матерей, у которых хламидии сохраняются (часто без каких-либо клинических проявлений) в эпителиальных клетках слизистой оболочки мочеполовой системы. Заболевание у детей проявляется в виде доброкачественного фолликулярного конъюнктивита и продолжается около года. Заражение взрослых возможно при купании в бассейнах, вода которых не хлорирована и заражена хламидиями. Инкубационный период длится 5 – 12 дней. Заболевание выражается утолщением конъюнктивы и ярко-красной окраской нижнего свода. Острая стадия болезни продолжается 10 – 15 дней, но инфильтрация может сохраняться 2 – 3 мес., иногда в течение года.
Лечение. Используют антибиотики (тетрациклины, макролиды) и сульфаниламидные препараты.
Венерический лимфогранулематоз (паховый лимфогранулематоз) – болезнь Никола – Фавра – заболевание, передающееся половым путем, характеризующееся разнообразными проявлениями, острыми и хроническими изменениями тканей в области паховых, бедренных или тазовых лимфатических узлов.
Развитие болезни складывается из следующих стадий: 1) заражение; 2) первичная стадия – поражение в области половых органов или прямой кишки; 3) вторичная стадия – поражение лимфатических узлов; 4) поздние осложнения, обусловленные фиброзными изменениями лимфатических узлов и окружающих их тканей. Период между заражением и появлением первичных поражений (папулы, пузырьки, эрозии) длится 10 – 25 дней, иногда дольше. Первичные поражения обычно быстро заживают без лечения.
Вторичный период наступает через 5 – 30 дней, он характеризуется поражением лимфатических (чаще паховых) узлов. В последующем болезнь прогрессирует: наступают третья и четвертая стадии. Болезнь продолжается от 2 – 3 мес. до нескольких лет. Образующиеся рубцы могут стать причиной нарушения лимфообращения в половых органах, промежности, области заднего прохода. Могут появляться папилломатозные разрастания, абсцессы, язвы и другие осложнения.
Лечение – антибиотики (тетрациклины, макролиды), сульфаниламиды.
Морфологически и по механизму размножения подобна C. trachomatis. Структура внутриклеточных микроколоний отличается от таковой C. trachomatis тем, что окружающие их мембраны везикул разрушаются раньше и хламидии высвобождаются в цитоплазму клетки-хозяина на различных стадиях развития. Образования гликогена внутри микроколоний при этом не происходит. Хламидии пситтакоза хорошо размножаются в желточном мешке куриных эмбрионов, оптимальная температура для их размножения 39 °C. Размножение в эмбрионах не подавляется ни сульфадиазином (1 мг/эмбрион), ни стрептомицином, ни ванкомицином, ни канамицином в концентрации 1 мг/мл каждого из них. Эти антибиотики используют для подавления роста бактерий в культурах клеток. Хламидии хорошо размножаются в культурах клеток различных линий, особенно мышиных фибробластов, HeLa 229 и др., образуя бляшки. Они долго сохраняют жизнеспособность в гомогенатах желточных мешков при –20 °C и ниже, но инактивируются при 70 °C в течение 10 мин, а при обработке инфекционного материала 0,1 %-ным формалином или 0,5 %-ным фенолом – в течение 24 – 36 ч. 10 %-ный эфир при комнатной температуре убивает их через 30 мин. Содержание Г + Ц в ДНК около 41 мол %. C. psittaci имеет термостабильный родовой антиген с м. м. около 40 кД и типоспецифические термолабильные белковые антигены. Она также содержит токсический компонент: внутривенное введение содержащих его штаммов белым мышам вызывает гибель от интоксикации 50 % их в течение первых 16 ч. Серологическая классификация C. psittaci окончательно еще не разработана. Штаммы, выделяемые из разных источников, обладают перекрестным антигенным родством, но различаются по типоспецифическим антигенам. Хламидии пситтакоза являются паразитами клеток тканей позвоночных, они обнаружены у 170 видов диких и домашних птиц, многих домашних и диких млекопитающих. Обычно они вызывают инфекции у широкого круга хозяев, хотя некоторые штаммы поражают узкий их круг. При инфицировании Chlamydia psittaci развиваются пситтакоз, орнитоз; пневмония крупного рогатого скота, овец, коз, свиней, лошадей, кошек; полиартриты у овец, крупного рогатого скота и свиней; они поражают плаценту и вызывают аборты у крупного рогатого скота и овец; энтерит крупного рогатого скота и зайцев; широко распространенные субклинические кишечные инфекции у крупного рогатого скота и овец и другие болезни. У человека C. psittaci вызывает пситтакоз (орнитоз, болезнь попугаев).
Пситтакоз (орнитоз) (греч. psittakos – попугай) – острая инфекционная болезнь, встречающаяся в виде единичных, групповых заболеваний и эпидемических вспышек в результате заражения от птиц и протекающая с различной клинической картиной и тяжестью, нередко с явлениями атипичной (интерстициальной) пневмонии. Название болезни, возникающей при контакте с попугаями, предложил в 1895 г. А. Моранж. Однако в последующем было установлено, что заражение людей возможно также от птиц других групп. К 1942 г. спонтанная зараженность C. psittaci была установлена у 62 видов птиц. Поэтому К. Мейер предложил называть случаи заболеваний, связанные с заражением от птиц, орнитозом, а пситтакозом – только заболевания, возникающие при контакте с попугаями. Однако в связи с тем, что штаммы возбудителей, выделяемые от больных людей и от различных видов птиц, оказались очень сходными и относятся к одному и тому же виду C. psittaci, понятия «пситтакоз» и «орнитоз» стали синонимами.
Эпидемиология. Источником инфекции для человека служат птицы, больные или бессимптомные носители. Полагают, что человек, больной пситтакозом, мало опасен для окружающих. Однако описаны достоверные случаи передачи возбудителя от больных людей здоровым, в частности заражение медицинских работников в больницах. Наибольшее эпидемическое значение имеют домашние птицы – индейки, утки, гуси, реже куры, голуби и комнатные птицы – попугаи, канарейки.
Природные очаги возникают в местах скопления диких птиц, связанных с водой и обитающих стаями. Заражение среди них происходит алиментарным (загрязненные корм, вода) и аэрогенным путем. Чаще всего передача возбудителя от инфицированных самок птенцам происходит в гнезде при насиживании яиц, выводке и кормлении птенцов. Возможна и трансовариальная передача при заражении яйца в момент прохождения его через яйцепровод. Заболевание у птиц протекает в острой, хронической или бессимптомной форме. При острой форме оно может закончиться гибелью в течение первых суток, однако чаще болезнь затягивается на 8 – 9 дней, иногда дольше, после чего птица выздоравливает или болезнь переходит в хроническую форму. В последнем случае птица становится носителем возбудителя на длительный срок. Хламидии от птиц выделяются с экскрементами и носовой слизью. Заражение человека от птиц (больных и носителей) происходит при уходе за ними, а также при забое и при употреблении в пищу без достаточной термической обработки яиц, инфицированных хламидиями. Входными воротами являются слизистые оболочки глаза, дыхательных путей и пищеварительного тракта.
Клиника. Инкубационный период длится 1 – 2 нед., в среднем – 10 дней. Через входные ворота хламидии проникают в организм, поступают в кровь, бактериемия продолжается в течение недели, иногда дольше. В ретикулоэндотелиальных клетках хламидии проходят характерный цикл размножения, вызывая различной степени нарушения клеточного метаболизма, интоксикацию и сенсибилизацию. В типичных случаях заболевание начинается остро, протекает с высокой температурой, которая держится около 3 нед., сильными головными и мышечными болями, иногда тошнотой, рвотой, потерей аппетита. Уже в первые дни нередко появляются кашель со скудной мокротой, боли в груди, развивается атипичная интерстициальная пневмония, которая лучше распознается рентгенологически. Различают три клинических типа пситтакоза: 1) пневмонический, 2) гриппоподобный и 3) тифоподобный с выраженной интоксикацией и ограниченным процессом в легких. Течение болезни может быть тяжелым, средней тяжести, легким и бессимптомным.
Постинфекционный иммунитет нестойкий, возможны повторные заболевания. У переболевших в крови обнаруживают агглютинины, комплементсвязывающие и нейтрализующие хламидии антитела, повышается активность фагоцитов и формируется гиперчувствительность замедленного типа к возбудителю.
Лечение. Сульфаниламидные препараты не эффективны. Применяют антибиотики: тетрациклины, макролиды, рифампицин, пенициллин (под влиянием последнего могут возникнуть L-формы, служащие причиной рецидивов и бессимптомной инфекции).
Профилактика. Специфическая профилактика мало разработана; были предложены различные убитые вакцины, но они оказались слабо эффективными. Общая профилактика заключается в осуществлении комплекса ветеринарно-санитарных мер, направленных на обезвреживание источников инфекции среди домашних и ввозимых в страну птиц (особенно из семейства попугаев), а также медико-санитарных мероприятий (соблюдение режима в птицеводческих хозяйствах и правил личной гигиены, дезинфекция, ношение работниками специальной одежды, строгий контроль за реализацией птицепродуктов и т. п.).
Респираторный хламидиоз – инфекционное заболевание, вызываемое хламидиями, проявляющееся в виде пневмонии (хламидийная пневмония), катара верхних дыхательных путей и общей интоксикации.
Возбудитель – Chlamydia pneumoniae – имеет родовой антиген, общий с антигенами других видов, белковый видоспецифический и, возможно, типоспецифические антигены. Жизненный цикл аналогичен циклу других хламидий, но элементарные тельца имеют не сферическую, а грушевидную форму, образующуюся за счет расширенного периплазматического пространства. Кроме того, C. pneumoniae не синтезируют гликоген в своих микроколониях. Хламидии этого вида скудно размножаются в желточных мешках куриных эмбрионов и в культурах клеток HeLa, McCoy и L-929. Обладают выраженным тропизмом к эпителию дыхательных путей.
Болезнь широко распространена. Эпидемические вспышки отмечены во многих странах Западной Европы, Америки и в Австралии. Источником инфекции является больной человек. Возбудитель выделяется с отделяемым носоглотки. Механизм заражения – воздушно-капельный. Восприимчивость людей к возбудителю высокая, у детей и престарелых заболевание протекает в более тяжелой форме; у молодых людей – чаще в виде легких форм. Основная клиническая форма болезни – мелкоочаговая и (или) интерстициальная пневмония, выявляемая рентгенологически.
Лечение. Наиболее эффективны антибиотики: тетрациклины, макролиды, угнетающие размножение возбудителя.
Лабораторная диагностика хламидиозов
Поскольку хламидиозы распространены глобально, а их клинические проявления очень разнообразны, особое значение в диагностике этих заболеваний имеют лабораторные методы. В зависимости от формы болезни материалом для исследования служат: соскобы с конъюнктивы, экссудат из бубонов, смывы из носоглотки, уретры, материал, взятый тампоном со слизистой оболочки дыхательных, мочеполовых путей, мокрота, кровь (во время лихорадки), а также секционный материал (кусочки печени, селезенки, легких и других тканей).
Бактериологическая диагностика состоит из предварительного микроскопического исследования материала, выделения возбудителя и его идентификации. Предварительное исследование заключается в бактериоскопии с целью обнаружения хламидий в инфицированных клетках либо с помощью прямой или непрямой иммунофлуоресценции, либо с использованием фазово-контрастной оптики, либо с применением окраски по Романовскому – Гимзе. Для выделения возбудителя исследуемым материалом заражают культуры клеток (лучше всего L-929, McCoy, HeLa) или куриные эмбрионы. Для подавления роста бактерий исследуемый материал обрабатывают гентамицином, стрептомицином и канамицином. Зараженные культуры клеток инкубируют при 35 – 36 °C в течение 6 дней, а затем микроскопируют с помощью фазового контраста, иммунофлуоресценции, ставят пробу на гликоген и определяют принадлежность к роду Chlamydia с помощью РСК с групповым антигеном. РСК считается положительной в разведении 1: 8. При заражении куриных эмбрионов исследуют желточные мешки эмбрионов, погибших в течение 4 – 10 дней. При отсутствии бактериального загрязнения микроскопируют препараты, окрашенные по Романовскому – Гимзе, и определяют в суспензии из желточного мешка наличие группового антигена в РСК. Выделенную культуру идентифицируют по признакам, указанным в табл. 51. В случае выделения C. trachomatis производят определение серотипа. Для этой цели сыворотку морской свинки, от которой выделен данный штамм, испытывают с прототипными антигенами известных 15 серотипов с помощью метода непрямой иммунофлуоресценции.
Для обнаружения хламидий применяют также биологический метод: исследуемым материалом заражают белых мышей и морских свинок, так как некоторые штаммы C. psittaci патогенны для мышей, но не для свинок, и наоборот, некоторые штаммы C. trachomatis (серотипы А, В и С) не размножаются в организме мышей, но патогенны для свинок.
Новорожденные мыши погибают при внутримозговом их заражении через 5 – 10 дней от геморрагического менингита, при интраназальном – через 5 – 10 дней от пневмонии. У мышей и свинок при внутрибрюшинном заражении увеличиваются печень, селезенка, а в брюшной полости образуется фибринозный экссудат. При микроскопическом исследовании у животных, зараженных разными способами, обнаруживаются микроколонии хламидий в мононуклеарных клетках ликвора (при внутримозговом), легких (при интраназальном), селезенке, печени и в перитонеальном экссудате (при внутрибрюшинном заражении). В связи с тем что C. pneumoniae плохо размножаются в культурах клеток и в куриных эмбрионах, для их обнаружения и идентификации используют моноклональные антитела к видоспецифическому антигену в реакциях иммунофлуоресценции.
Для серологической диагностики пситтакоза (орнитоза) и венерического лимфогранулематоза применяют РСК и непрямую иммунофлуоресценцию. Комплементсвязывающие антитела появляются через 4 – 8 дней в небольшом количестве, затем титр их возрастает. Поэтому РСК лучше ставить с парными сыворотками. В связи с наличием у хламидий родового антигена специфичность и чувствительность серологических реакций может быть повышена на основе использования моноклональных антител и выявленных с их помощью наиболее специфических для каждого вида (и серотипа) антигенов-диагностикумов.
Для диагностики хламидиозов могут быть использованы и внутрикожные аллергические пробы, но степень их специфичности зависит от степени специфичности аллергенов, так как могут быть перекрестные реакции за счет общих групповых антигенов.
Патогенные микоплазмы
Микоплазмы – уникальная группа мелких плеоморфных широко распространенных в природе грамотрицательных микроорганизмов, отличающихся от остальных бактерий полным отсутствием клеточной стенки. Впервые с этой группой мельчайших бактерий столкнулся Л. Пастер, изучая плевропневмонию крупного рогатого скота. Его возбудитель имеет настолько малые размеры, что он не виден под микроскопом, к тому же он не растет на обычных питательных средах, поэтому Л. Пастеру не удалось его выделить. Лишь в 1898 г. Е. Нокар и Э. Ру, используя сложную питательную среду, смогли получить культуру возбудителя плевропневмонии, а в 1931 г. У. Эльфорд с помощью бактериальных фильтров определил размеры этого микроорганизма – 125 – 150 нм.
Аналогичные микроорганизмы были выделены из различных источников внешней среды, из многочисленных животных, а также из организма человека при различных заболеваниях. Ввиду их сходства с возбудителем плевропневмонии рогатого скота их стали называть организмами, подобными ему – PPLO (pleuropneumoniaelike organisms). Оказалось, что к группе PPLO относится и агент Итона – возбудитель атипичной пневмонии человека, обнаруженный М. Итоном в 1942 г. В связи с тем, что эти микроорганизмы существенно отличаются от других бактерий мелкими размерами и отсутствием клеточной стенки, они были выделены в отдельную группу. Название «микоплазмы» было предложено в 1929 г. К. Новаком, оно подчеркивает их пластичность и то, что они имеют гомогенную консистенцию, «не дифференцирующуюся на экто– и эндоплазму».
У микоплазм нет клеточной стенки. Они не способны синтезировать предшественников пептидогликана (мураминовую и диаминопимелиновую кислоты) и окружены лишь тонкой трехслойной мембраной толщиной 7,5 – 10,0 нм. Поэтому их выделили в особый класс Mollicutes («нежная кожа»), семейство Mycoplasmataceae. К этому семейству относятся патогенные микоплазмы (вызывают заболевания у людей, зверей и птиц), условно-патогенные (очень часто бессимптомными носителями их являются культуры клеток) и микоплазмы-сапрофиты. Микоплазмы – наиболее мелкие и просто организованные прокариоты, способные к автономному размножению, а минимальные элементарные тельца, например Acholeplasma laidlawii, по размерам сопоставимы с минимальной исходной клеткой-прогенотой. Согласно теоретическим расчетам, простейшая гипотетическая клетка, способная автономно размножаться, должна иметь диаметр около 500 ангстрем, содержать ДНК с м. м. 360 000 Д и около 150 макромолекул. Элементарное тельце A. laidlawii имеет диаметр около 1000 ангстрем, т. е. всего в 2 раза больше, чем гипотетическая клетка, содержит ДНК с м. м. 2 880 000 Д, т. е. осуществляет гораздо больше метаболических процессов, и содержит не 150, а около 1200 макромолекул. Можно полагать, что микоплазмы являются наиболее близкими потомками исходных прокариотных клеток.
Размер генома у микоплазм – самый маленький для прокариот, например у членов семейства Mycoplasmataceae он составляет 0,45 МД. В связи с этим микоплазмы имеют целый ряд особенностей: очень малые размеры (100 – 450 нм), благодаря чему многие микоплазмы могут проходить (фильтроваться) через бактериальные фильтры; наличие минимальных количеств органелл (цитоплазматическая мембрана, нуклеоид, рибосомы); отсутствие многих биосинтетических процессов, имеющихся у других бактерий; малые размеры колоний, образующихся на плотных средах (0,1 – 0,6 мм); нечувствительность к бета-лактамным антибиотикам и другим агентам, угнетающим синтез клеточной стенки (из-за ее отсутствия); плеоморфизм, высокая осмотическая чувствительность. Характерно для большинства микоплазм также сравнительно низкое суммарное содержание Г + Ц в ДНК (от 23 – 35 мол % – у некоторых видов, до 39 – 46 мол % – у других). Морфология их различна – шаровидные, вакуолизированные, нитевидные (нередко ветвящиеся), гранулярные (элементарные тельца) структуры. Обычно неподвижные, но некоторые виды обладают скользящей подвижностью. Размножаются путем бинарного поперечного деления шаровидных и нитевидных (фрагментация) клеток, почкования и высвобождения множества элементарных телец, образующихся в нитях. Большинство видов микоплазм для роста нуждаются в стеролах и включают их непосредственно в свою трехслойную мембрану, которая состоит главным образом из липидов и белков. Поэтому микоплазмы являются паразитами мембран эукариотных клеток и способны длительное время персистировать на мембранах различных клеток человека, млекопитающих, птиц, рыб, моллюсков, насекомых и растений.
Микоплазмы размножаются на бесклеточных питательных средах, но для своего роста большинство из них нуждается в холестерине, который является уникальным компонентом их мембраны (даже у микоплазм, не требующих для своего роста стеролов), в жирных кислотах и нативном белке. Для выделения культур могут быть использованы жидкие и плотные питательные среды. Рост в жидких средах сопровождается едва видимым помутнением, на плотных средах с дрожжевым экстрактом и лошадиной сывороткой формирование колоний происходит следующим образом (рис. 110). В связи с их малыми размерами и отсутствием ригидной клеточной стенки микоплазмы способны проникать с поверхности агара и размножаться внутри его – в промежутках между нитями агара. При нанесении капли материала, содержащего микоплазмы, она проникает через имеющуюся на поверхности агара водную пленку и адсорбируется агаром, образуя небольшое уплотнение между его нитями. В результате размножения микоплазм, приблизительно через 18 ч, внутри сплетенных нитей агара формируется маленькая сферическая колония под поверхностью агара; она растет и через 24 – 48 ч инкубации достигает поверхностной водной пленки, в результате чего образуются две зоны роста – мутный гранулярный центр, врастающий в среду, и плоская ажурная полупросвечивающая периферическая зона (вид глазуньи). Колонии мелкие, диаметром от 0,1 до 0,6 мм, но могут быть и меньшего (0,01 мм) и большего (4,0 мм) диаметра. На кровяном агаре очень часто вокруг колоний наблюдаются зоны гемолиза, обусловленного действием образующейся Н2О2. Колонии некоторых видов микоплазм способны адсорбировать на своей поверхности эритроциты, эпителиальные клетки различных животных, клетки культур тканей, сперматозоиды человека и некоторых животных. Адсорбция лучше происходит при 37 °C, менее интенсивно – при 22 °C и специфически угнетается антисыворотками. Температурный оптимум для роста микоплазм 36 – 37 °C (диапазон 22 – 41 °C), оптимальная рН 7,0 или слегка кислая, или слегка щелочная. Большинство видов – факультативные анаэробы, хотя лучше растут в аэробных условиях, некоторые виды – аэробы; немногие лучше растут в анаэробных условиях. Микоплазмы неподвижны, но отдельные виды обладают скользящей активностью; являются хемоорганотрофами, в качестве главного источника энергии используют либо глюкозу, либо аргинин, редко – оба вещества, иногда – ни то, ни другое. Они способны ферментировать галактозу, маннозу, гликоген, крахмал с образованием кислоты без газа; протеолитическими свойствами не обладают, лишь некоторые виды разжижают желатин и гидролизуют казеин. Антигенная специфичность микоплазм определяется антигенами цитоплазматической мембраны, в частности содержащимися в ней белками и гликопротеидами. Микоплазмы обладают родо-, видо– и типоспецифическими антигенами. Кроме того, они могут иметь антигены, общие с антигенами мембран клеток-хозяев или включают их в результате длительной персистенции на мембранах этих клеток, что может стать причиной антигенной мимикрии и привести к развитию аутоиммунной патологии.
Рис. 110. Формирование колонии микоплазмы на плотной среде (Прокариоты. 1981, т. II):
А. Вертикальный срез агара перед посевом (а – пленка воды, б – нити агара).
Б. Капля, содержащая жизнеспособные микоплазмы, нанесена на поверхность агара.
В. Через 15 мин после посева капля адсорбирована агаром.
Г. Приблизительно через 3–6 ч после посева. Жизнеспособная частица проникла в агар.
Д. Приблизительно через 18 ч после посева. Маленькая сферическая колония сформировалась ниже поверхности агара.
Е. Приблизительно через 24 ч после посева. Колония достигла поверхности агара.
Ж. Приблизительно через 24–48 ч после посева. Колония достигла свободной водной пленки, образуя периферическую зону (г – центральная зона, в – периферическая зона колонии)
Резистентность. Из-за отсутствия клеточной стенки микоплазмы более чувствительны, чем другие бактерии, к воздействию механических, физических и химических факторов (УФ-облучению, действию прямых солнечных лучей, рентгеновскому облучению, изменению рН среды, к действию высокой температуры, высушиванию). При нагревании до 50 °C погибают в течение 10 – 15 мин, очень чувствительны к обычным химическим дезинфектантам.
Семейство микоплазм насчитывает более 100 видов. Человек является естественным носителем не менее 13 видов микоплазм, которые вегетируют на слизистых оболочках глаза, дыхательных, пищеварительных и мочеполовых путей. В патологии человека наибольшую роль играют несколько видов Mycoplasma: M. pneumoniae, M. hominis, M. arthritidis, M. fermentans и, возможно, M. genitalium, и единственный вид рода Ureaplasma – U. urealyticum. Основное биохимическое отличие последнего от видов Mycoplasma заключается в том, что U. urealyticum обладает уреазной активностью, которой лишены все члены рода Mycoplasma (табл. 52).
Таблица 52
Дифференциальные признаки некоторых патогенных для человека микоплазм
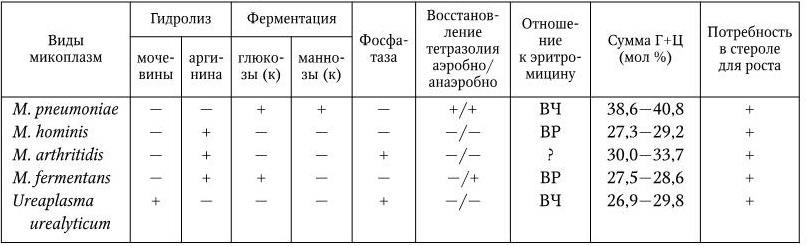
Примечание. (к) – образование кислоты; ВР – высокорезистентны; ВЧ – высокочувствительны; (+) – признак положительный; ( – ) – признак отрицательный.
Патогенные для человека микоплазмы вызывают у него заболевания (микоплазмозы) дыхательных, мочеполовых путей и суставов с разнообразными клиническими проявлениями.
Респираторный микоплазмоз имеет глобальное распространение. По данным ВОЗ (1985), ежегодно болеет 8 – 15 млн человек. Очень часто протекает в виде острой пневмонии (сегментарной, очаговой или интерстициальной). Основной возбудитель – M. pneumoniae, значительно реже – M. hominis, и очень редко заболевание дыхательных путей у детей в возрасте до 1 года вызывает U. urealyticum.
M. pneumoniae. Основные биологические и морфологические свойства типичны для рода Mycoplasma, однако имеется ряд отличительных признаков. По форме это короткие нити длиной 2 – 5 мкм, клетки обладают скользящей подвижностью. Размножаются путем бинарного деления и высвобождения элементарных телец из нитей. Свежеизолированные колонии часто лишены полупрозрачной периферической зоны, а имеют вид приподнятой кольцевидной гранулярной структуры диаметром 30 – 100 мкм. Растут медленнее, чем другие микоплазмы. Колонии появляются через 5 – 10 дней инкубации, иногда позднее. Требуется несколько последовательных пересевов, чтобы колонии приобрели вид «глазуньи». Колонии на плотной среде адсорбируют эритроциты, трахеальные эпителиальные клетки обезьян, крыс, морских свинок, кур, клетки некоторых культур (HeLa, куриных эмбриональных тканей и др.), а также сперматозоиды человека и быков. Рецепторы эритроцитов и эпителиальных клеток для M. pneumoniae разрушаются нейраминидазой; адсорбция клеток предотвращается, если микоплазмы обработать предварительно нейраминовой кислотой. M. pneumoniae вызывает гемагглютинацию эритроцитов человека и животных, обладает гемолитической активностью, обусловленной продукцией Н2О2; митогенным действием в отношении Т– и В-лимфоцитов и цитотоксическим действием; высокочувствительна к эритромицину. В антигенном отношении вид M. pneumoniae представляет собой однородную группу, типоспецифических антигенов не обнаружено.
Резистентность к действию физических и химических факторов невелика.
Факторы патогенности: высокое сродство к эпителиальным клеткам дыхательных путей, гемадсорбционные, гемолитические, цитотоксические свойства микоплазм, их подвижность.
Эпидемиология. Источником инфекции является больной человек, а также носители, в том числе перенесшие болезнь в бессимптомной форме. Заражение происходит воздушно-капельным путем, так как возбудитель локализуется главным образом на клетках реснитчатого эпителия дыхательных путей. Респираторный микоплазмоз – малоконтагиозное заболевание, что объясняется кратковременным сроком выживания возбудителя во внешней среде, поэтому для заражения требуется тесное и длительное общение с источником инфекции. Этим и обусловливается более высокая заболеваемость в организованных коллективах, в особенности во вновь организованных, где через 2 – 3 мес. заражается до 50 % его членов. Болеют чаще лица в возрасте от 1 года до 30 лет.
Патогенез и клиника. Инкубационный период длится 7 – 14 дней, иногда до 25 дней. Возбудитель адсорбируется на слизистой оболочке верхних дыхательных путей, размножается и активно распространяется по слизистой оболочке трахеи и бронхов, достигает альвеолоцитов, внедряется в межальвеолярные перегородки. В результате повреждения клеток возникают перибронхиальные, периваскулярные и интерстициальные инфильтраты. Для микоплазменной пневмонии, которая развивается обычно постепенно, типичен сухой или со скудной мокротой длительный изнуряющий кашель; физикальные изменения в легких выражены слабо или отсутствуют, поэтому пневмония выявляется при рентгенологическом исследовании. Воспалительные инфильтраты рассасываются медленно – в течение 3 – 4 нед., иногда дольше. У детей раннего возраста нередко наблюдается двустороннее поражение легких. Течение болезни, как правило, доброкачественное.
Постинфекционный иммунитет после острой инфекции сохраняется в течение 5 – 10 лет, иногда дольше. Он обусловлен как секреторными, так и гуморальными антимикробными антителами, а также сохраняющимися более продолжительный срок антителами, подавляющими метаболизм микоплазм, и клеточными элементами (макрофаги, Т-лимфоциты). После бессимптомных и стертых форм инфекции иммунитет кратковременный и слабо выражен.
Лабораторная диагностика. Поскольку атипические пневмонии имеют различную этиологию, решающая роль в их диагностике принадлежит лабораторным методам. Для диагностики респираторного микоплазмоза (микоплазменной пневмонии) используют бактериологические и серологические методы, а также выявление микоплазм и их идентификацию с помощью иммунологических приемов. Материалом для бактериологического исследования служат мокрота, слизь из глотки, плевральная жидкость, лаваж (франц. lavage – промывать), смывы с поверхности бронхиол и альвеолярных структур легких, полученные при бронхоскопии. Для получения культур посевы производят на среды, содержащие все необходимые для роста микоплазм питательные вещества. Для угнетения роста сопутствующих бактерий в питательную среду добавляют пенициллин и ацетат таллия, к которым M. pneumoniae устойчива. Выделенную культуру идентифицируют на основании морфологических, культуральных свойств, признаков, указанных в табл. 52, а также с помощью диагностических иммунных сывороток, полученных путем иммунизации кроликов препаратами цитоплазматических мембран M. pneumoniae.
Микоплазмы и их антигены могут быть обнаружены в исследуемом материале с помощью иммунофлуоресценции, РПГА, РАГА, ИФМ. Кроме того, для идентификации микоплазм используют еще 2 теста: угнетение роста и угнетение метаболизма, которые достигаются с помощью специфических антител.
Для серологической диагностики применяют РПГА, РСК, иммунофлуоресценцию, ИФМ с использованием специфической гликолипидной фракции мембран M. pneumoniae. Нарастание титра антител определяют в парных сыворотках. В качестве одного из ускоренных методов может быть использована и внутрикожная проба с аллергеном из M. pneumoniae. Для выявления M. pneumoniae разработана и предложена тест-система на основе ЦПР, позволяющая обнаружить носительство микоплазм даже в тех случаях, когда они не обнаруживаются никакими другими методами.
Лечение. При острой форме микоплазменной пневмонии наиболее эффективно применение эритромицина и тетрациклинов.
Профилактика. Неспецифическая профилактика такая же, как в отношении острых респираторных вирусных заболеваний. Для специфической профилактики разрабатываются инактивированные вакцины, химические вакцины (из антигенов цитоплазматической мембраны M. pneumoniae), а также живые вакцины из аттенуированных штаммов возбудителя.
Микоплазмы – возбудители урогенитальных заболеваний
Воспалительные болезни мочеполовой системы, такие как уретриты, циститы, гломерулонефриты, пиелонефриты, простатиты; у женщин – вагиниты, сальпингиты, кольпиты, цервициты, эндометриты, параметриты, этиологически очень часто связаны с микоплазмами, особенно с M. hominis и U. urealyticum. Этими видами микоплазм инфицировано не менее 50 % здоровых мужчин и женщин в возрасте 30 – 50 лет, причем до 30 % женщин являются носителями одновременно обеих микоплазм. Существует мнение, что уреаплазменная инфекция (уреаплазмоз) может быть причиной бесплодия: женского – вследствие воспалительных процессов гениталий; и мужского – в результате воздействия на сперматогенез и сперматозоиды (уреаплазмы адсорбируются на сперматозоидах, нарушают их подвижность и изменяют форму). Кроме того, M. hominis при внутриутробном заражении плода может быть причиной врожденных аномалий развития ребенка в связи с ее способностью воздействовать на хромосомы клетки.
M. hominis обычно имеет форму коротких нитей длиной 2 – 5 мкм, иногда до 30 мкм, не обладает протеолитической активностью, не восстанавливает ни тетразолия, ни метиленового синего ни в аэробных, ни в анаэробных условиях. В качестве источника энергии использует аргинин; глюкозу и маннозу не ферментирует. На плотных средах с дрожжевым экстрактом и лошадиной сывороткой образует характерные колонии типа «глазуньи», обладает гемолитическим действием, которое связано с продукцией Н2О2. Колонии на плотных средах адсорбируют клетки HeLa и клетки куриных эмбриональных тканей, но не адсорбируют эритроцитов и трахеальных эпителиальных клеток обезьян, крыс, морских свинок. Рецепторы на клетках HeLa и куриных фибробластах не разрушаются нейраминидазой. M. hominis высокорезистентны к эритромицину (минимальная бактериостатическая концентрация 500 – 1000 мкг/мл и выше). В антигенном отношении гетерогенны: различают 8 серотипов. В организме человека чаще всего паразитирует на слизистой оболочке нижних отделов мочеполовых путей (уретра, влагалище, шейка матки), реже – на слизистой оболочке зева и глотки.
Ureaplasma urealyticum. Первоначально в связи с очень маленькими колониями, которые они образуют (15 – 30 мкм в диаметре), были названы как Т-группа микоплазм (англ. tiny – мельчайшие). Но поскольку они отличаются от всех других видов микоплазм своей способностью гидролизовать мочевину, впоследствии были выделены в самостоятельный род Ureaplasma, представленный пока единственным видом U. urealyticum. Их морфология, ультраструктура и способ размножения такие же, как и у других микоплазм. Очевидно, мочевина, в дополнение к холестерину, является жизненно важным питательным веществом для этого вида микоплазм. Ее гидролиз сопровождается выделением аммиака. Глюкозу, маннозу и аргинин не потребляют, тетрозолия не восстанавливают, обладают протеолитической и фосфатазной активностью и вызывают гемолиз эритроцитов морской свинки. Высокочувствительны к эритромицину – минимальная ингибирующая доза 0,8 – 3,0 мкг/мл. На плотных средах образуют очень мелкие колонии, но на некоторых средах и более крупные, диаметром до 175 – 200 мкм. Хотя они обычно грубо гранулярные и не имеют или имеют едва заметный центральный бугорок, на соответствующих средах становятся гладкими и приобретают типичный вид «глазуньи». На дифференциально-диагностической среде А-7, содержащей кроме дрожжевого экстракта и лошадиной сыворотки мочевину и соли марганца, образуются псевдоколонии в виде коричневого преципитата непосредственно над колониями только Ureaplasma (но не других микоплазм). Псевдоколонии возникают в результате взаимодействия ионов Mn2+ c продуктами гидролиза уреаплазмой мочевины.
Температурный оптимум для роста 35 – 37 °C, оптимальная рН 6,0 – 6,5. Колонии на плотных средах, как правило, не адсорбируют эритроцитов человека и морской свинки. В антигенном отношении неоднородны: различают 8 серотипов штаммов человеческого происхождения и 8 серотипов животного происхождения. U. urealyticum обычно паразитирует на мембранах слизистой оболочки мочеполовой системы человека, а также крупного рогатого скота, собак и обезьян, иногда на слизистой оболочке зева и глотки человека и на слизистой оболочке зева и конъюнктиве крупного рогатого скота.
Роль M. genitalium в этиологии урогенитальных микоплазмозов требует выяснения.
Эпидемиология. Источник инфекции – инфицированный человек, в том числе, и очень часто, бессимптомный носитель микоплазм. Заражение происходит главным образом путем полового контакта. У инфицированных беременных женщин возможно внутриутробное заражение плода через околоплодные воды (возбудитель проникает восходящим путем из шейки матки), гематогенно или во время родов. При внутриутробном заражении поражаются органы дыхания, зрения, почки, печень, ЦНС, что может быть причиной гибели плода. Во время беременности уреаплазменная инфекция нередко активизируется и может также стать причиной преждевременных родов и спонтанных абортов.
Лабораторная диагностика играет решающую роль в распознавании урогенитальных микоплазмозов. Это тем более важно, что среди людей широко распространено бессимптомное носительство этих условно-патогенных микроорганизмов. Используются главным образом бактериологический и серологический методы. Материалом для выделения возбудителей служат слизь из уретры и влагалища, секрет простаты, сперма, моча. Посевы производят на селективные для микоплазм питательные среды, а для роста U. urealyticum – обязательно с мочевиной. Выделенные культуры идентифицируют по морфологическим, культуральным и иным признакам (см. табл. 52). Кроме того, для их типирования используют реакции угнетения роста или метаболизма специфическими иммунными сыворотками. Для обнаружения микоплазм или их антигенов используют непрямую иммунофлуоресценцию, РПГА с антительным диагностикумом, ИФМ, реакции преципитации, РАГА. Для серологической диагностики также могут быть использованы ИФМ, РПГА, РАГА. Однако серологическая диагностика недостаточно надежна, так как нет четкой зависимости между титром специфических антител и присутствием возбудителя.
Лечение. Если возбудителем острой инфекции является U. urealyticum, наиболее эффективно применение эритромицина, в случае M. hominis – тетрациклинов.
Профилактика урогенитальной инфекции должна быть такой же, как и других венерических заболеваний. Целесообразна организация диспансерного учета больных и носителей микоплазм в группах повышенного риска (проститутки, гомосексуалисты). Особого внимания требуют женщины детородного возраста, которые страдают хроническими урогенитальными заболеваниями неясной этиологии, для предупреждения внутриутробного микоплазмоза.
Микоплазмы – возбудители артритов
Ревматоидным артритом болеют около 1 – 2,5 % населения Европы и Америки, и приблизительно у 60 – 80 % таких больных обнаруживаются различные виды микоплазм или их антигены. Это обстоятельство, а также воспроизведение заболевания, сходного с ревматоидным артритом, при экспериментальном заражении животных дают основание рассматривать микоплазмы как возможных возбудителей ревматоидного артрита. Однако многие вопросы, касающиеся этиологии, способа заражения и механизма патогенеза ревматоидного артрита, требуют изучения.
Из синовиальной жидкости и ткани суставов при ревматоидном артрите выделяют M. arthritidis, M. fermentans, M. pneumoniae и U. urealyticum, дифференциальные признаки их представлены в табл. 52. Отличительной особенностью M. arthritidis является также то, что они способны разжижать желатин, но не свертывают сыворотку, не гидролизуют казеин. Данных о способности их колоний адсорбировать эритроциты опубликовано не было. Гемолизин идентифицирован как Н2О2.
Источником возбудителя ревматоидного артрита является больной человек или бессимптомный носитель микоплазм.
Лабораторная диагностика основана на выделении возбудителя из синовиальной жидкости, ткани суставных хрящей и последующей его идентификации или на обнаружении возбудителя (его антигенов) в исследуемых биосубстратах и в сыворотке крови (в том числе в составе циркулирующих иммунных комплексов) с помощью иммунофлуоресценции, РСК, РПГА, РАГА и ИФМ.
Для диагностики заболеваний, вызываемых микоплазмами и хламидиями, все шире используется метод ЦПР. В России создана и применяется тест-система «Полимик», содержащая реагенты, в том числе праймеры, для обнаружения ДНК Chlamydia trachomatis, Mycoplasma hominis и Ureaplasma urealyticum в биологических пробах.
Патогенные актиномицеты и нокардии
Актиномицеты – возбудители актиномикоза
Актиномикоз – хроническое гранулематозное гнойное поражение различных систем и органов с характерной инфильтрацией тканей, абсцессами и свищами, плотными зернами (друзами) в гное, вызываемое актиномицетами.
Заболевание у человека впервые было описано в 1845 г. Б. Лангенбеком. Возбудитель в чистой культуре был выделен в 1887 г. К. Гарцем и в 1888 г. М. Афанасьевым.
Возбудители актиномикоза относятся к роду Actinomyces, класс Actinobacteria, тип Actinobacteria. По уровню организации актиномицеты занимают промежуточное положение между бактериями и грибами (actinomyces – греч. aktis – луч и греч. mykes – гриб); иногда называются стрептомицетами. Наиболее частыми возбудителями актиномикоза у человека являются Actinomyces israelii, реже – A. albus, A. bovis, A. naeslundii и другие виды этого же рода, а также представители других родов, например Arachnia propionica.
Все актиномицеты имеют настоящий ветвящийся мицелий, субстратный или воздушный, у большинства с плодоносными ветками и спорами в воздушных частях колоний. Нити мицелия прямые или волокнистые, длиной от 50 до 600 мкм и диаметром от 0,2 до 1 – 2 мкм. Поперечные перегородки у актиномицетов обычно не обнаруживаются, т. е. мицелий у них несептированный, в отличие от многих нитчатых грибов (см. рис. 111.1, с. 596). Мицелий актиномицетов ветвистый, ветви развиваются из небольшой почки, которая постепенно вытягивается в палочку, а затем в короткую нить с боковыми ответвлениями. Являются грамположительными, кислотоподатливыми или кислотоустойчивыми организмами, морфологически сходны не только с нитчатыми грибами, но и с коринебактериями, микобактериями, пропионибактериями. Неподвижны, размножаются спорами, распадом мицелия на фрагменты и почкованием. Могут встречаться клетки V– и Y-образной формы. В составе клеточной стенки актиномицетов всегда присутствует лизин (или лизин и орнитин), отсутствуют диаминопимелиновая кислота, хитин и целлюлоза. Некоторые актиномицеты могут образовывать полисахаридную капсулу вокруг нитей мицелия, состоящую из гиалинизированного вещества.
В тканях пораженного организма актиномицеты образуют своеобразные морфологические структуры – друзы (см. рис. 111.2), представляющие собой беспорядочно переплетенные в центре нити мицелия с радиально отходящими на периферию колбовидно расширенными на концах нитями («дубинками»). Гомогенный центр друзы окрашивается грамположительно, в то время как периферия окружена слизеподобными эозинофильными скоплениями, которые являются, по-видимому, комплексами «антиген + антитело». Диаметр друзы – 5 мкм и более. В своем развитии друзы проходят несколько стадий, причем вначале они представлены мягкими конгломератами с обильно растущим мицелием, а на конечных стадиях – кальцинированными плотными тельцами, где в большинстве случаев жизнеспособный возбудитель отсутствует. «Дубинки» обычно появляются на более поздних этапах развития друзы. Образование друз свойственно не каждой разновидности лучистых грибов, и они развиваются в организме больных не на всех этапах заболевания.
Актиномицеты, как и бактерии, не имеют истинного ядра, у них имеется нуклеоид. Могут быть чувствительны к фагам, антибиотикам.
Мицелий актиномицетов подразделяют на воздушный и субстратный. Молодой воздушный мицелий бархатисто-пушистый, зрелый – спороносящий. Концевые нити мицелия волнистые или штопорообразные, количество завитков в спирали колеблется от одного, иногда неполного, до 3 – 10 на одной нити. Споры актиномицетов подразделяют на наружные, располагающиеся одиночно по бокам или небольшими группами на мицелии, и внутренние, развивающиеся в специальных спорангиях. Наружные споры круглые, у некоторых видов цилиндрические, размером от 0,8 до 1,2 мкм, поверхность спор гладкая или с различными выступами.
Форма, цвет и размеры колоний на питательных средах, требовательность к питательной среде у актиномицетов весьма вариабельны и видоспецифичны. Молодые колонии более тонкие, плоские и круглые, нередко целиком снимаются с поверхности среды петлей. Зрелые культуры гладкие или исчерченные, складчатые или бугристые, мягкой восковидной или крошковидной консистенции. Они более прочно спаяны своими длинными или короткими густыми или рыхлыми отростками с питательной средой. Размеры молодых колоний – 0,3 – 0,5 мм, напоминают бактериальные; зрелые колонии достигают размеров 1 – 1,5 мм. Поверхность колоний различная: у одних гладкая, у других бархатистая, пушистая или мучнистая. Последнее связано с образованием воздушного мицелия и спор. Пигментация колоний является весьма характерным признаком актиномицетов, могут встречаться колонии темно– и светло-фиолетового, синего, пурпурного, красного, оранжевого, желтого, зеленого, бурого, черного, серого и белого цвета с различными оттенками. Пигменты могут быть растворимы в воде и спирте, растворимы в воде и нерастворимы в спирте и, наконец, нерастворимы ни в воде, ни в органических растворителях. У хромофорных актиномицетов пигмент образуется в протопласте, располагаясь зернышками по всей нити, поэтому окрашена только колония, но не питательный субстрат под ней и вокруг нее. У двупигментных актиномицетов пигменты, секретируясь наружу, попадают в среду и окрашивают ее, если они растворимы в воде. Различные виды актиномицетов обладают одним – двумя пигментами и буро-окрашивающим веществом, свойственным многим актиномицетам.
Актиномицеты способны утилизировать разные вещества, недоступные многим другим организмам, т. е. в большинстве случаев неприхотливы при росте.
Среди актиномицетов встречаются как облигатные, так и факультативные анаэробы. Они способны расти при температуре от 3 – 7 до 40 °C, температурный оптимум 35 – 37 °C, оптимальная рН от 6,0 до 6,8.
Ферментативная активность актиномицетов разнообразна. Почти все патогенные актиномицеты обладают протеолитической и липолитической активностью, с разной глубиной и интенсивностью расщепляют белки крови и тканей. Многие образуют каталазу и фосфатазы. Почти все имеют амилазу, некоторые пептонизируют молоко, разжижают желатин. Многие актиномицеты образуют различные витамины группы В, обладают антагонистической активностью, продуцируя различные антибиотики. Это свойство используется в микробиологической промышленности: некоторые штаммы актиномицетов применяются в качестве суперпродуцентов антибиотиков. A. israelii не гидролизует крахмал, но ферментирует ксилозу и маннит, тогда как A. bovis вызывает гидролиз крахмала, но не ферментирует эти сахара. Углеводы актиномицеты ферментируют только с образованием кислоты без газа. Для межвидовой дифференциации актиномицетов используют культуральные, биохимические и другие признаки.
Антигенные свойства актиномицетов мало изучены; они обусловлены в основном полисахаридами клеточной стенки (видоспецифические антигены), а также цитоплазматическими компонентами. У A. israelii обнаружено несколько серовариантов, выявляемых в реакции преципитации в геле или в РИФ.
Вопрос о факторах патогенности актиномицетов также мало изучен, но экзотоксинов они не продуцируют. Фагоцитоз в очаге актиномикоза носит незавершенный характер, что можно объяснить наличием у возбудителей капсулы. Вероятно, многие ферменты актиномицетов можно рассматривать в качестве факторов агрессии и защиты.
Жизнеспособность актиномицетов во внешней среде довольно высокая. Они растут в широких пределах температуры, переносят рН от 5 до 9, многие растут при рН 4,5. Устойчивы к высушиванию, действию прямых солнечных лучей. Долго остаются жизнеспособными в дистиллированной воде, переносят повторное замораживание и оттаивание, годами сохраняют жизнеспособность в высушенном состоянии. Чувствительность к действию дезинфицирующих веществ в их рабочих концентрациях такая же, как у споровых патогенных микроорганизмов.
Эпидемиология. Актиномицеты распространены чрезвычайно широко в природе, встречаются в любых географических широтах, обитают в теплых и холодных морях и океанах, почве (особенно в богатой перегноем). Многие виды актиномицетов являются естественными обитателями организма человека и животных, заселяя слизистые оболочки. Особенно много их в строме зубного камня, десневых карманах, кариозных зубах, криптах миндалин, конкрементах (камнях) желчевыводящих и мочевых путей, слюнных железах. Мужчины болеют актиномикозом в 3 раза чаще, чем женщины, особенно в возрасте от 20 до 50 лет. Болеют сельскохозяйственные животные: крупный и мелкий рогатый скот, лошади, свиньи, кролики; собаки и дикие животные; иногда животные могут быть причиной инфицирования человека. Но в подавляющем большинстве случаев развитие актиномикоза следует рассматривать как проявление аутоинфекции, которая возникает и прогрессирует на фоне гнойно-воспалительных заболеваний, травм, различных иммунодефицитов. Среди всех актиномицетов наиболее патогенными являются облигатные анаэробы.
Патогенез и клиника. Возникновение актиномикоза связывают с экзогенным и, особенно, эндогенным поступлением возбудителя в ткани. Источником инфицирования могут быть актиномицеты, вегетирующие на злаках, в почве и попадающие в организм через поврежденную кожу или слизистые оболочки. Возможно также заражение аэрогенным путем. При эндогенном заражении возбудитель поступает в ткани из мест его сапрофитического обитания, главным образом из ротовой полости, пищеварительного тракта. В ряде случаев для развития заболевания необходимо наличие гиперсенсибилизации или ассоциации с другими бактериями, обитающими в организме (микст-инфекция). Первичный актиномикозный очаг чаще образуется в рыхлой соединительной ткани. Проникнув в ткани, актиномицеты образуют колонии (друзы), вокруг которых скапливаются лейкоциты и лимфоциты, а по периферии развивается грануляционная ткань с большим количеством сосудов, плазматических, эпителиоидных клеток и фибробластов. Встречаются также единичные гигантские многоядерные клетки, напоминающие клетки Пирогова – Лангганса при туберкулезе. В центре такой актиномикотической гранулемы наблюдается некроз клеток и их распад, во время которого макрофаги внедряются в друзы, захватывают кусочки мицелия актиномицета и с ними мигрируют в соседние ткани, где образуют вторичные, третичные и т. д. гранулемы. Далее в гранулеме уменьшается число сосудов и клеточных элементов, образуется фиброзная и затем плотная рубцовая ткань. Чаще всего актиномикозом поражается область лица, шеи, челюстей (примерно в 50 % случаев), реже наблюдаются легочная, абдоминальная, септическая и иные формы заболевания. Сначала образуется гиперемированная безболезненная плотная припухлость, при прогрессировании которой наблюдается размягчение, расплавление подлежащих тканей (флюктуация), и через сформировавшиеся свищи гной выходит наружу или в плевру, брюшную полость и т. д. в зависимости от локализации очага. Течение вялое, свищи самостоятельно не излечиваются. Очаги поражения распространяются «по продолжению». При метастазировании актиномицетов в средостение, головной мозг, другие внутренние органы заболевание часто заканчивается смертью.
У людей с первичными или вторичными иммунодефицитами актиномикоз вызывает снижение и извращение гуморальных и клеточных реакций иммунной системы.
Иммунитет. Неизвестно, образуются ли антитела и развивается ли клеточный иммунитет до инвазии тканей, так как актиномицеты составляют часть нормальной микрофлоры организма человека. Прочного иммунитета к актиномикозу после перенесенного заболевания не остается. Однако определенная иммунологическая перестройка в организме больного происходит: в сыворотке крови появляются агглютинины, преципитины, комплементсвязывающие антитела, появляется специфическая кожная аллергия замедленного типа.
Лабораторная диагностика. Наилучшие результаты дают микроскопический, бактериологический и некоторые иммунологические методы исследования, в то время как заражение животных и обычные серологические реакции практического значения не имеют, так как дают крайне нестабильные результаты. При микроскопическом исследовании в качестве материала используют гной из свищей, мокроту, мочу, биоптаты ткани, реже ликвор. Для обнаружения друз подозрительные комочки из патологического материала наносят на предметное стекло в каплю 10 – 20 %-ной щелочи, слегка подогревают, накрывают покровным стеклом и исследуют под микроскопом. Для актиномикоза характерны каменисто-плотные комочки, хрустящие, как песок, при надавливании на покровное стекло. Друзы можно обнаруживать как в «раздавленной» капле при малом и больших увеличениях, так и в препаратах, окрашенных по Граму, Цилю – Нильсену или Романовскому – Гимзе. В начальных периодах заболевания при абсцедирующих формах друзы обнаруживаются непостоянно, в этом случае ценным диагностическим признаком заболевания служит обнаружение тонкого несептированного ветвящегося мицелия.
Для выделения чистой культуры исследуемый материал засевают на кровяной и сывороточный МПА, глицериновый агар и бульон, на среды Сабуро и Чапека. Посевы инкубируют как в аэробных, так и в анаэробных условиях в течение 1 – 2 нед. Определение вида выделенного актиномицета проводится по совокупности культуральных, биохимических и других свойств.
Важное место занимает иммунологическое исследование: кожно-аллергическая проба с актинолизатом, реакция торможения миграции лейкоцитов с актинолизатом, количественные показатели иммунокомпетентных клеток и чувствительность их к актинолизату.
Специфическая профилактика и лечение. Специфическая профилактика не разработана. Для лечения используют хирургические методы: иссечение пораженных тканей, выскабливание грануляций, удаление гноя и дренирование абсцессов. Специфическое лечение проводят актинолизатом (лучше всего из аутоштамма) по определенной схеме, а также используют антибиотики (в том числе пенициллинового ряда), иммуностимуляторы (левамизол, пирогенал, продигиозан), общее стимулирующее воздействие (лазеротерапия, физиотерапия и т. д.).
Нокардиоз – острое или хроническое, нередко септикопиемическое заболевание внутренних органов, чаще легких, иногда кожи, подкожной клетчатки и слизистых покровов; характерно также поражение костей и образование свищей, может быть мицетома стопы.
Заболевание впервые описано Э. Нокардом в 1888 г. у быка, а в 1890 г. Г. Эппингер описал плевропневмонию с абсцессом мозга у человека. Позже было замечено, что заболевание сходно с актиномикозом или туберкулезом, но протекает без образования друз и зерен в тканях.
Нокардии отнесены к роду Nocardia, класс Actinobacteria, тип Actinobacteria. Род Nocardia включает более 10 видов. Наиболее частым возбудителем является Nocardia asteroides, реже N. brasiliensis, N. otitidis-caviarum и др. Нокардии по морфологии весьма сходны с микобактериями туберкулеза: кислотоустойчивы, грамположительны, диаметр нитей, образующих мицелий, 1 – 2 мкм. Мицелий может легко септироваться, при этом образуются кокковидные и бациллярные формы различной длины. Могут встречаться ветвящиеся, U-образные формы, палочки с булавовидным утолщением на одном конце, цепочки палочек различной длины. По сравнению с актиномицетами обладают более выраженным мицелием, а в тканях, при заболевании, зерен и друз не образуют. Капсул не имеют, неподвижны.
Аэробы, хорошо растут на простых питательных средах, но рост сравнительно медленный. Оптимум температуры 37 °C, оптимум рН 6,8 – 7,2. Колонии восковидные, цвет водонерастворимого пигмента – от желтого до оранжево-красного, на поверхности колонии может быть воздушный белесый мицелий. Могут размножаться путем образования артроспор, возникающих при фрагментации нитей, а также бинарным делением. Различные виды нокардий отличаются друг от друга в основном биохимическими свойствами (гидролиз казеина, желатина, свертывание и пептонизация молока, ферментация углеводов, деградация аминокислот и др.). Все нокардии образуют уреазу. Антигенные свойства нокардий изучены недостаточно, но установлено, что у нокардий и микобактерий имеется несколько общих антигенов. Факторы патогенности также мало изучены; считают, что ими являются белковые и полисахаридные компоненты клеточной стенки, а также миколовая кислота. Различные виды нокардий обладают разной степенью патогенности для человека и лабораторных животных. К нокардиозу восприимчивы морские свинки, кролики, особенно при внутрибрюшинном заражении. Мышей удается заразить только внутримозговым или внутривенным способом.
Нокардии весьма устойчивы во внешней среде, поэтому в почве способны сохраняться длительное время, устойчивы к прямым солнечным лучам.
Эпидемиология. Больные нокардиозом не заразны для окружающих. В России описаны единичные случаи заболевания. В основном нокардиоз регистрируется в странах тропического и субтропического поясов. Естественной средой обитания нокардий является почва, где этот микроорганизм размножается. Заражение происходит чаще аэрогенным путем (через пыль), реже алиментарным при употреблении сырого молока больных животных, через поврежденные слизистые покровы и кожу при попадании в них почвы и т. д.
Патогенез и клиника. Входные ворота инфекции – слизистая оболочка дыхательных путей, кишечника, конъюнктивы глаза, раны. Нокардиоз обычно развивается на фоне сниженной резистентности макроорганизма: при хронических заболеваниях крови, онкологических процессах, длительном лечении кортикостероидами, иммунодепрессантами, противоопухолевыми антибиотиками. Обычно нокардиоз начинается как легочная инфекция, для которой характерно образование мелких бугорков, напоминающих туберкулезные. Далее процесс может развиваться местно (образуются каверны, абсцессы, свищи) или происходит диссеминация возбудителя лимфогенным или гематогенным путем. В этом случае могут наблюдаться абсцессы мозга, почек, других органов и тканей.
Иммунитет после перенесенного заболевания нестерильный, имеет клеточный характер.
Лабораторная диагностика. Используются микроскопический и бактериологический методы. Материал для исследования – гной из свищей и абсцессов, мокрота, ликвор, биоптаты ткани. Препараты-мазки красят по Цилю – Нильсену, Граму и при микроскопии обнаруживают кокковидные и бациллярные структуры или скопления ветвящихся палочек. В тканях друзы отсутствуют. Для получения чистой культуры делают посев на плотные питательные среды и инкубируют при температуре 30 – 37 °C в течение 2 – 3 нед. до получения подозрительных колоний. В качестве экспресс-метода иногда используют реакцию иммунофлуоресценции.
Специфическая профилактика и лечение. Специфическая профилактика не разработана. Для лечения используют антибиотики (с учетом чувствительности возбудителя), сульфаниламиды, вакцины и аутовакцины, приготовленные из убитых нокардий. В ряде случаев требуется хирургическое лечение: дренирование абсцессов, удаление пораженных тканей. Используют также средства, стимулирующие иммунитет.
Патогенные спирохеты и спириллы
В новой классификации (Берги-2001) спирохеты выделены в новый тип Spirochaetes с единственным одноименным классом и единственным порядком Spirochaetales c тремя семействами – Spirochaetaceae (роды Borrelia, Cristispira, Spirochaeta, Treponema и др.), Serpulinaceae (роды Serpulina и Brachyspira) и Leptospiraceae (роды Leptospira и Leptonema). Для человека патогенны боррелии, трепонемы и лептоспиры.
Спирохеты (греч. speira – завиток, chaite – волосы) – спиралевидной формы подвижные бактерии размером 0,1 – 3,0 × 5 – 250 мкм; одноклеточные, возможно, за исключением Spirochaeta plicatilis. Все спирохеты грамотрицательны.
Центральной структурой клетки (см. рис. 111.6) является протоплазматический цилиндр, в котором содержатся цитоплазма, нуклеоид, рибосомы 70S и различные комплексы ферментов. Протоплазматический цилиндр окружен комплексом цитоплазматическая мембрана + клеточная стенка, содержащая пептидогликан. Протоплазматический цилиндр имеет постоянную спиралевидную форму, благодаря пептидогликану, образуя первичные завитки. Их число, тип, шаг, высота, угол наклона варьируют у разных видов и играют важную систематическую роль. Вторичные завитки у спирохет образуются в результате изгиба всего тела. Вокруг спиралевидного цитоплазматического цилиндра располагается периплазматический жгутик (жгутики). Один конец каждого жгутика прикреплен к одному из полюсов протоплазматического цилиндра, а другой – к последнему примерно посередине клетки. Общее количество периплазматических жгутиков на клетку варьирует от двух до ста и более. Во всех случаях половина из них прикреплена к одному полюсу, а другая половина – к другому полюсу. Периплазматические жгутики спиралевидно обвивают протоплазматический цилиндр. Их совокупность образует так называемую осевую нить. Поверх жгутиков (осевой нити) располагается многослойная наружная мембрана, которую часто называют наружной оболочкой спирохеты. Наружная мембрана полностью окружает спиралевидный протоплазматический цилиндр, так что жгутик окружен наружной мембраной и расположен между ней и цилиндром; поэтому он и получил название периплазматического жгутика, или эндожгутика. Он является важным компонентом аппарата подвижности спирохет. Основные отличия периплазматических жгутиков от экзоцеллюлярных жгутиков других бактерий в том, что они, во-первых, постоянно обвиваются вокруг тела клетки (ее протоплазматического цилиндра) и, во-вторых, полностью расположены внутри клетки, будучи окружены наружной мембраной. Вследствие этого подвижность спирохет отличается от подвижности других бактерий, у которых она осуществляется в жидкой среде за счет вращения жгутиков в направлении по часовой или против часовой стрелки, в зависимости от хемотаксических сигналов. Спирохеты обладают тремя основными типами движения в жидкой среде: вращательным вокруг своей оси, поступательным и сгибательным. Клетки спирохет сохраняют подвижность в среде с относительно высокой вязкостью, при которой другие жгутиковые бактерии утрачивают подвижность.
Рис. 111. Морфология актиномицетов и спирохет:
1 – актиномицеты; 2 – друза патогенного актиномицета; 3 – боррелии; 4 – трепонемы; 5 – лептоспиры; 6 – схематическое строение спирохеты. Объяснение в тексте
По типу дыхания спирохеты – анаэробы, факультативные анаэробы, микроаэрофилы и аэробы. Хемоорганотрофы. Источниками углерода и энергии для них служат углеводы, аминокислоты, жирные кислоты. Встречаются в природе как свободноживущие в воде и почве или паразитирующие в организме животных и человека. Различные виды непатогенных или условно-патогенных спирохет постоянно присутствуют в полости рта человека.
Содержание Г + Ц в ДНК спирохет варьирует от 32 до 66 мол %.
Размножаются спирохеты путем бинарного деления. Подобно другим бактериям, они обладают механизмами, позволяющими им переживать неблагоприятные условия. Под влиянием антибиотиков или иных факторов спирохеты претерпевают различные морфологические изменения: они могут превращаться в цисты (свертываются в клубок, выделяют слизь, которая, уплотняясь, образует оболочку цисты), коккоподобные тельца, гранулы, пузырьки, везикулы и сходные структуры и сохраняться в таком виде. При устранении неблагоприятных факторов эти структуры способны восстанавливаться в извитые подвижные спирохеты.
Боррелии – возбудители возвратных тифов
Возвратный тиф – трансмиссивное заболевание, характеризующееся общей интоксикацией, волнообразной лихорадкой, различной степени поражением печени и селезенки, иногда желтухой, менингитом, поражением других органов. Возбудитель эпидемического возвратного тифа – Borrelia recurrentis – был обнаружен в 1868 г. О. Обермейером в крови больного; в 1874 г. Г. Минх и в 1881 г. И. И. Мечников в опытах на себе доказали заразность крови больных возвратным тифом.
B. recurrentis – нитевидный спирально изогнутый микроорганизм размерами 0,2 – 0,5 × 3 – 20 мкм, имеющий 3 – 8, иногда до 10 – 12 завитков, концы возбудителя заострены (рис. 111.3). Завитки неравномерные, могут быть глубокими и мелкими, расстояние между ними варьирует от 2 до 4 мкм. Боррелии очень подвижны: могут совершать сгибательные, вращательные, поступательные движения. На каждом конце клетка содержит 7 – 30 фибрилл, которые обвиваются вокруг тела и частично перекрываются в середине организма с фибриллами, начинающимися от другого конца. Таким образом формируется осевая нить.
Данные о химическом составе боррелий скудные. Известно, что некоторые из них содержат лецитин, холестерол и некоторые другие неидентифицированные липиды. В клеточной стенке боррелий имеются мураминовая кислота и L-орнитин, так же как у представителей родов Treponema и Spirochaeta. Род Leptospira, наоборот, лишен L-орнитина, но содержит диаминопимелиновую кислоту, которая отсутствует у других родов спирохет. Спор и капсул не образуют.
Боррелии удлиняются и размножаются поперечным делением. Они грамнегативны, хорошо окрашиваются различными красителями и легко наблюдаемы в сравнении с другими спирохетами, которые тоньше и поэтому видны с трудом. По Романовскому – Гимзе красятся в сине-фиолетовый цвет. Боррелии, растущие in vitro, – микроаэрофилы, растут при 20 – 37 °C (оптимум 28 – 30 °C) и рН 7,2 – 7,4 на специальных средах, содержащих кровь, сыворотку или ткани животного происхождения. Хорошо размножаются в куриных эмбрионах. При выращивании боррелий на средах или в эмбрионах их патогенность для животных быстро утрачивается. Биохимические свойства боррелий практически не изучены. Известно, что глюкоза усваивается ими гликолитическим путем с образованием молочной кислоты. Для многих боррелий существенными факторами роста являются длинноцепочечные жирные кислоты, и установлено, что лизолецитин гидролизуется фосфолипазой В на альфа-глицерофосфорилхолин и одну жирную кислоту. Альфа-глицерофосфорилхолин затем расщепляется на холин и альфа-глицерофосфат под действием специфической диэстеразы. Кислая фосфатаза расщепляет альфа-глицерофосфат под действием специфической диэстеразы до глицерина и неорганического фосфата.
Имеются данные, что во время заболевания антигенная структура боррелий может меняться. Продуцируемые в начале заболевания антитела действуют как селективный фактор, в результате чего в организме сохраняются только варианты, имеющие антигенные отличия.
Таксономия боррелий разработана недостаточно глубоко. В основе деления боррелий на виды лежат учет вида их переносчика и географическое распространение (табл. 53). Cуществующую в настоящее время некоторую путаницу в названиях боррелий можно объяснить тем, что выделенные в различных регионах мира от разных хозяев и разных переносчиков боррелии при более подробном изучении оказываются антигенными вариантами одного и того же вида.
Таблица 53
Классификация боррелий
Патогенность боррелий связана с эндотоксином, освобождающимся при разрушении возбудителя под действием антител. Рецидивирующий характер заболевания связан с размножением таких антигенных вариантов, против которых макроорганизм еще не имеет антител. Полное выздоровление после 3 – 10 рецидивов наступает тогда, когда в организме появляются антитела ко всем соответствующим антигенным вариантам возбудителя.
Во внешней среде боррелии мало устойчивы: при температуре 50 °C погибают в течение 20 – 30 мин. В питательных средах в зависимости от температуры могут сохраняться от нескольких дней до нескольких месяцев. В крови при низкой температуре (4 °C) могут также сохраняться несколько месяцев.
Эпидемиология. Боррелии, патогенные для человека, переносятся платяными, реже головными, вшами (при эпидемическом возвратном тифе), аргасовыми клещами рода Alectorobius (прежнее название рода – Ornithodorus) при эндемическом возвратном тифе, иксодовыми клещами при болезни Лайма. При эпидемическом возвратном тифе источником инфекции является человек, особенно заразный в период лихорадочного приступа. Вошь становится заразной через 4 дня, а спирохеты сохраняются в организме вшей в течение 28 дней после сосания крови больного. Заражение человека происходит через поврежденную при укусе вшей кожу или через расчесы при втирании в них гемолимфы раздавленной вши, содержащей B. recurrentis. При эндемическом возвратном тифе источником инфекции являются животные – грызуны, хищники, обитающие в степях, пустынях и полупустынях, а также сами клещи-переносчики, у которых может наблюдаться трансовариальная передача возбудителя из поколения в поколение. Многие клещи приспособились к обитанию вблизи жилья человека, что приводит к возникновению антропургических (греч. anthropurgia – человеческая деятельность) очагов клещевого возвратного тифа.
Патогенез и клиника. Инкубационный период – 3 – 10 дней. Через кожу боррелии попадают в лимфатическую систему, захватываются клетками системы мононуклеарных фагоцитов, где и размножаются. Затем они поступают в кровь, что клинически проявляется ознобом, лихорадкой. Через несколько дней вырабатываются антитела, вызывающие гибель большей части спирохет, они перестают обнаруживаться в крови, и лихорадка прекращается. Гибель спирохет сопровождается освобождением эндотоксина, вызывающего интоксикацию, а также действующего на клетки эндотелия сосудов, в результате чего появляются геморрагические инфаркты во внутренних органах (печень, селезенка). Возможно наличие признаков менингита. Первый лихорадочный приступ продолжается 3 – 7 дней, затем сменяется периодом нормальной температуры, длящимся 4 – 10 дней. Потом развивается 2-й приступ лихорадки. Обычно наблюдается 3 таких приступа, редко количество их достигает 7 – 10, причем их интенсивность и продолжительность снижаются, а продолжительность периодов нормальной температуры увеличивается. Главное отличие клиники клещевого возвратного тифа от эпидемического – наличие первичного аффекта в месте укуса клеща. Сначала появляется розовое пятно, затем узелок с геморрагическим ободком. Кроме того, отмечается большее число приступов лихорадки и их меньшая продолжительность. Боррелии – возбудители клещевого возвратного тифа – могут быть обнаружены в крови больного как во время лихорадки, так и при нормальной температуре.
Иммунитет после перенесенной инфекции обычно непродолжительный.
Лабораторная диагностика. Основной метод диагностики возвратного тифа – микроскопический. Материалом для исследования служит кровь больного, взятая в лихорадочный период; в период ремиссии можно брать костный мозг. Препараты-
мазки окрашивают по Романовскому – Гимзе и под микроскопом обнаруживают на фоне клеточных элементов крови располагающиеся внеклеточно сине-фиолетового цвета боррелии (см. рис. 111.3). Иногда для диагностики возвратных тифов используют заражение белых мышей или молодых крыс. Через 2 – 4 дня для выявления спирохет используют кровь, взятую из хвостовой вены. Морские свинки не чувствительны к возбудителю эпидемического возвратного тифа, но чувствительны к другим патогенным боррелиям. Серологические реакции (лизиса, связывания комплемента, нагрузки боррелий тромбоцитами и др.) для диагностики используют редко.
Специфическая профилактика и лечение. Специфическая профилактика возвратных тифов не разработана, неспецифическая – предусматривает борьбу со вшивостью и предохранение от укусов клещей. Лечение проводится антибиотиками (тетрациклины, левомицетин, иногда пенициллины).
Болезнь Лайма (от названия города Лайм в штате Коннектикут, США, где впервые было описано заболевание) относится к группе иксодовых клещевых боррелиозов (ИКБ) – хронических рецидивирующих трансмиссивных природно-очаговых инфекций, поражающих ЦНС, сердечно-сосудистую и суставную системы, а также кожу. Заболевания этой группы называются также хронической мигрирующей эритемой.
Спирохетозную природу болезни Лайма установил в 1981 г. У. Бургдорфер, в честь которого возбудитель и получил название Borrelia burgdorferi. К настоящему времени установлено, что иксодовые клещевые боррелиозы вызывает целая группа близких видов боррелий, объединенных под названием B. burgdorferi sensu lato (т. е. в широком смысле), в которой различают более 10 самостоятельных видов. Пять из них циркулируют на территории России и других стран Европы: B. afzelii, B. garinii, B. lusitaniae, B. burgdorferi sensu stricto (т. е. в узком смысле, или собственно боррелия Бургдорфера – возбудитель истинной болезни Лайма) и B. valaisiana. Патогенность последней не доказана. Природные очаги ИКБ обнаружены во многих странах. По широте распространения и уровню заболеваемости ИКБ занимают одно из ведущих мест в мире среди природно-очаговых инфекций и представляют большую опасность для здоровья людей, поскольку болезнь часто приводит к длительной утрате трудоспособности и инвалидности. Очаги ИКБ в Евразии совпадают с ареалами основных переносчиков возбудителей – иксодовых клещей Ixodes ricinus в Европе и I. persulcatus – в Европе и Азии. Эти виды клещей служат также важнейшими резервуарами и переносчиками вируса клещевого энцефалита и некоторых видов эрлихий. Прокормителями этих клещей, а следовательно, и резервуарами возбудителей ИКБ, служит широкий круг поражаемых ими хозяев (птицы, грызуны, олени, собаки, лошади, другие домашние и дикие животные). Очаги ИКБ выявлены к 2000 г. на 50 административных территориях России. В Санкт-Петербурге регистрируется 250 случаев ИКБ в год (5 случаев на 100 000 жителей). В Пермской области уровень заболеваемости в 4 – 5 раз превышает средние показатели по стране.
Генетическая особенность B. burgdorferi состоит в наличии у нее как линейной, так и кольцевой ДНК, что сообщил в 1999 г. У. Бургдорфер. По другим данным, обнаружена также линейная плазмида, кодирующая синтез белков наружной мембраны, с которыми связаны патогенные свойства возбудителя. Заражение ИКБ происходит через укусы клещей. Со слюной клеща боррелии проникают в кожу в месте укуса, где часто, но не всегда, развивается первичная эритема диаметром от 3 – 5 до 15 – 20 см, центр которой бледнее периферии. После лимфогенной или гематогенной диссеминации возбудителя поражается кожа (вторичная эритема), развиваются невриты черепно-мозговых нервов, менингит, энцефалит, кардиты, артриты, акродерматит. При заражении возбудителем нейроборрелиоза (B. garinii) эритема может отсутствовать.
Для первичного обнаружения живых боррелий у клещей используют метод темнопольной микроскопии, который, с целью идентификации возбудителя, должен быть дополнен более точными методами диагностики, включая ЦПР. Из крови, ликвора или тканей больного боррелии выделяются с трудом. Для обнаружения IgM (ранние стадии заболевания) и IgG (спустя несколько месяцев) используют непрямую реакцию иммунофлуоресценции и ИФМ со специфическим антигеном.
Специфическая профилактика не разработана. Для лечения используют тетрациклины и бета-лактамные антибиотики.
Бледная трепонема – возбудитель сифилиса
Сифилис – циклически протекающее венерическое заболевание человека, вызываемое бледной спирохетой; I стадия проявляется твердым шанкром (фр. chancre – язва), II стадия – поражением стенки сосудов и различными сыпями, III – гуммами в различных органах с поражением нервной системы. Гумма (лат. gummi – камедь) – хронический инфильтрат в виде узла, склонный к распаду и изъязвлению. Сифилитическая гумма (син.: сифилитическая гранулема, сифилид гуммозный, сифилома третичная) – безболезненная полушаровидная гумма, являющаяся проявлением третичного активного сифилиса. Возбудитель – Treponema pallidum – был открыт в 1905 г. Ф. Шаудином и Э. Гофманом.
T. pallidum – микроорганизм спиралевидной формы, размерами 0,09 – 0,18 × 6 – 20 мкм. Число завитков спирали от 8 до 12, завитки равномерны, расположены друг от друга на одинаковом расстоянии около 1 мкм, высота по направлению к концам уменьшается. В электронном микроскопе имеет вид змеи или дождевого червя. На обоих концах трепонемы расположены блефаропласты с прикрепленными к ним жгутиками, число которых варьирует от двух до нескольких, они образуют осевую нить, закрученную вокруг протоплазматического цилиндра спирохеты. При неблагоприятных условиях может образовывать цисты. В организме животных может возникать мукополисахаридной природы капсулоподобный чехол.
Трепонема плохо окрашивается анилиновыми красителями, в связи с чем возбудитель сифилиса и получил название бледной спирохеты. Восстанавливает нитрат серебра в металлическое серебро, которое откладывается на поверхности микроба и делает его видимым в тканях: при окраске по Морозову трепонемы выглядят коричневыми или почти черными. При окраске по Романовскому – Гимзе приобретают бледно-розовый цвет.
Трепонемы обычно размножаются поперечным делением, при этом разделившиеся клетки могут в течение некоторого времени прилегать друг к другу. Время деления – около 30 ч.
Живые трепонемы очень подвижны, совершают движения вокруг собственной продольной оси, а также сгибательное, волнообразное и поступательное движение.
До настоящего времени пока нет такого метода, при котором бы удавалось стабильно получать культуры трепонем. Патогенные для человека бледные трепонемы никогда не удавалось культивировать на искусственных питательных средах, в куриных эмбрионах или культурах клеток. Те разновидности их штаммов, которые растут в анаэробных условиях, являются, вероятно, сапрофитными спирохетами, близкими к возбудителю сифилиса. Физиология их остается мало изученной. Трепонемы относятся к хемоорганотрофам, не имеют каталазы и оксидазы, могут сбраживать углеводы. Они растут на очень богатых средах, содержащих до 11 аминокислот, витамины, соли, сывороточный альбумин. Наилучшим способом выращивания патогенных спирохет является заражение кролика в яичко (экспериментальный орхит). Высказано предположение о существовании у T. pallidum жизненного цикла, включающего, помимо спиралевидной формы, зернистую стадию и стадию кистоподобных сферических тел. Именно зернистые формы этих микроорганизмов способны проходить через бактериальные фильтры.
Антигены трепонем плохо изучены. Установлено, что в составе трепонем имеются белковые, полисахаридные и липидные комплексы. Антигенный состав культуральных и тканевых трепонем настолько близок, что антигены, приготовленные из культуральных трепонем, можно использовать для РСК при диагностике сифилиса. В организме человека трепонемы стимулируют выработку антител, которые вызывают иммобилизацию и гибель живых подвижных трепонем, связывают комплемент в присутствии суспензии T. pallidum или родственных спирохет, а также выявляются в непрямой РИФ.
Возбудитель сифилиса не образует экзотоксинов. К внешним воздействиям бледные трепонемы относительно малоустойчивы. Быстро погибают при высушивании и при повышенных температурах (при 55 °C в течение 15 мин). В 0,3 – 0,5 % растворе HCl моментально утрачивают свою подвижность; так же быстро утрачивают ее и погибают в присутствии препаратов мышьяка, висмута, ртути. В цельной крови или в сыворотке при 4 °C сохраняют жизнеспособность в течение 24 ч, что следует учитывать при переливании крови.
Эпидемиология. Сифилис – типичное венерическое заболевание. Источник инфекции – больной человек, обычно заразен в течение 3 – 5 лет; больные с поздними формами сифилиса не заразны. Заражение в подавляющем большинстве случаев происходит при различных видах половых и бытовых контактов, редко трансплацентарным путем от больной матери ребенку (врожденный сифилис) или как профессиональное заражение контактным путем у медицинского персонала. В естественных условиях сифилисом болеет только человек, в эксперименте возможно заражение обезьян, хомячков и кроликов. У обезьян в месте введения трепонем развивается твердый шанкр, у кроликов и хомячков инфекция протекает бессимптомно.
Патогенез и клиника. Инкубационный период при приобретенном сифилисе варьирует от 2 до 10 нед., обычно 20 – 28 дней. Входными воротами инфекции чаще всего являются слизистые оболочки половых органов, реже – полости рта, а также поврежденная кожа. В месте внедрения возбудитель размножается, формируется первичная сифилома (твердый шанкр) – эрозия или язва с уплотненным основанием. Далее возбудитель попадает в лимфатическую систему, развивается лимфангоит и регионарный лимфаденит. Это типичная клиника первичного сифилиса, который продолжается 1,5 – 2 мес. Потом эти признаки исчезают. Вторичный период сифилиса связан с генерализацией процесса, когда увеличиваются многие лимфатические узлы, а на коже и слизистых оболочках появляются высыпания; могут наблюдаться поражения внутренних органов и нервной системы. Различают вторичный свежий и вторичный рецидивирующий сифилис. При каждом последующем рецидиве интенсивность сыпи становится все менее выраженной, а периоды между рецидивами увеличиваются. В элементах сыпи содержится большое количество живых трепонем, в этот период больной наиболее заразен. Продолжительность вторичного сифилиса – до 4 лет и более. Далее болезнь вступает в длительный бессимптомный период, по прошествии которого, через несколько лет, развивается третичный сифилис. При этом наблюдаются грубые органические поражения внутренних органов, сердечно-сосудистой системы, ЦНС, костей, формируются гуммы, сопровождающиеся распадом ткани и дегенеративными изменениями. Характерной клинической особенностью сифилиса является отсутствие каких-либо субъективных жалоб со стороны больного (боль, зуд, жжение и т. д.).
Иммунитет. Против сифилиса ни естественного, ни искусственного иммунитета не возникает; есть только инфекционный иммунитет, и пока он существует, человек практически не восприимчив к новому заражению. Инфекционный иммунитет развивается через 10 – 11 дней после появления твердого шанкра (шанкерный иммунитет), в этот период повторное заражение или не наблюдается, или новый образовавшийся шанкр протекает абортивно (суперинфекция). В дальнейшем при суперинфицировании характер возникающих поражений соответствует стадии болезни в момент повторного заражения. Суперинфекция объясняется временным ослаблением или «срывом» инфекционного иммунитета. От суперинфекции необходимо отличать реинфекцию, т. е. новое, повторное заражение человека, ранее болевшего сифилисом (излечившегося) и, следовательно, утратившего инфекционный иммунитет. Описаны случаи даже трехкратного заболевания сифилисом. Инкубационный период у таких больных короче, чаще развиваются множественные язвенные шанкры с лимфаденитом, серологические реакции становятся положительными раньше. Во вторичном периоде папулы на коже нередко эрозируются. Это объясняется тем, что при сифилисе развивается реакция гиперчувствительности замедленного типа, после излечения в организме длительно сохраняются сенсибилизированные лимфоциты. Инфекционный иммунитет имеет нестерильный характер и обусловлен гуморальными факторами: в сыворотке больного обнаруживаются иммуноглобулины классов G, A и М.
Лабораторная диагностика. Для диагностики сифилиса оптимален комплексный подход, предполагающий одновременное использование нескольких методов. Их традиционно подразделяют на прямые, позволяющие доказать наличие возбудителя в исследуемом материале (заражение животных, различные виды микроскопии и молекулярно-генетические методы детекции ДНК T. pallidum – ПЦР и ДНК-зондирование), и непрямые – серологические тесты для выявления антител. В свою очередь, серологические тесты представлены нетрепонемными и трепонемными.
Исследуемым материалом для обнаружения трепонем в прямых методах является отделяемое твердого шанкра или его пунктат, пунктат лимфатического узла, соскоб из розеолы, ликвор. Лучше всего в нативном материале возбудитель выявляется темнопольной (см. рис. 111.4) или фазово-контрастной микроскопией, что позволяет наблюдать разные типы движения живого возбудителя. Если уже начато лечение антибиотиками, возбудителя в патологическом материале обнаружить невозможно. При необходимости проводят прямую (или непрямую) РИФ или окрашивают препарат по Романовскому – Гимзе. Эти методы используют только для ранней диагностики сифилиса.
Серологические тесты можно использовать на различных стадиях заболевания, кроме серонегативного первичного сифилиса. Обычно применяют комплекс серологических реакций. К нетрепонемным тестам с визуальным определением результатов относятся: реакция связывания комплемента (реакция Вассермана = РСКк = RW) с кардиолипиновым антигеном сердечной мышцы быка (перекрестно реагирующий антиген), реакция микропреципитации (МР, или РМП) – микрореакция с плазмой и инактивированной сывороткой; RPR – тест быстрых плазменных реагинов, и другие реакции. Специалисты считают, что для массового обследования лучше всего применять два теста: RPR и РПГА или ИФА, так как RPR более чувствителен при первичном сифилисе, РПГА – на более поздних стадиях заболевания, а ИФА – на всех стадиях. К нетрепонемным тестам с микроскопическим считыванием результатов относятся VDRL-тест и USR-тест. Нетрепонемные тесты используют в качестве отборочных (скрининговых), так как они могут давать ложноположительные результаты. В трепонемных тестах используют антигены трепонемного происхождения. Их применяют для подтверждения результатов нетрепонемных тестов (ложноположительны?) при клиническом, эпидемиологическом и анамнестическом подозрении на сифилис, для диагностики скрытых и поздних форм, для ретроспективного диагноза. К трепонемным тестам относят: РСКт (РСК с трепонемным антигеном), РИБТ (или РИТ) – реакция иммобилизации бледных трепонем, РИФ (одна из лучших реакций), РПГА, ИФА, иммуноблотинг.
Специфическая профилактика и лечение. Специфическая профилактика не разработана. Неспецифическая профилактика предусматривает воздержание от случайных половых связей, раннее выявление больных, особенно со скрытой формой заболевания, и их своевременное и эффективное лечение. Для лечения сифилиса используют антибиотики: пенициллин и его производные (водорастворимые и дюрантные формы), иногда эритромицин. Используют также препараты висмута, мышьяка, ртути.
Возбудителями этих заболеваний являются трепонемы, неотличимые от T. pallidum — T. pertenue, T. carateum, T. bejel. При этих заболеваниях наблюдаются положительные биологические реакции на сифилис; перекрестный иммунитет установлен как в опытах на животных, так и у человека. Эти заболевания не являются венерическими, передача возбудителя обычно происходит контактным путем. Ни один из возбудителей трепонематозов не растет на искусственных питательных средах. В настоящее время известны четыре трепонематоза: сифилис, фрамбезия, пинта и беджел, хотя самостоятельность последнего оспаривается, многие авторы считают его тождественным сифилису. Все эти заболевания вызываются родственными трепонемами. О близком родстве возбудителей свидетельствуют не только их принадлежность к одному роду, сходство патогенеза и клиники заболеваний, но также биологическая и иммунологическая близость трепонем, в связи с чем серологические реакции при сифилисе применяются и для диагностики других трепонематозов, а методы их лечения почти одинаковы.
Фрамбезия – эндемическое заболевание, встречающееся в странах с жарким и влажным тропическим климатом. Возбудитель – T. pertenue – по своим морфологическим, культуральным, тинкториальным свойствам и подвижности неотличим от бледной трепонемы. Болеют преимущественно дети до 15 лет, передача инфекции происходит путем прямого контакта. Первичный очаг – изъязвляющаяся папула – локализуется обычно на конечностях. Типично образование рубцов на месте поражений кожи и разрушение костей; осложнения со стороны внутренних органов и ЦНС наблюдаются крайне редко. Трансплацентарной передачи инфекции не бывает.
Пинта – заболевание эндемично среди населения всех возрастов в Мексике, Центральной и Южной Америке, на Филиппинах и некоторых островах Тихого океана. Болеют преимущественно лица с темным цветом кожи. Первичный очаг – неизъязвляющаяся папула – возникает в месте внедрения возбудителя, которым является T. carateum. Через несколько месяцев на коже появляется плоский гиперпигментированный участок, впоследствии развиваются депигментация и гиперкератоз. На более поздних стадиях могут развиваться поражения сердечно-сосудистой и нервной систем. Иногда передача возбудителя может осуществляться при помощи мух рода Hippelates.
Беджел распространен преимущественно в странах Аравийского полуострова, изредка встречается в Африке, Юго-Восточной Азии. Возбудитель – T. bejel – практически идентичен бледной трепонеме. Чаще болеют дети, и заболевание характеризуется поражениями кожи и слизистых оболочек, позднее иногда развиваются поражения, очень сходные с гуммозными проявлениями сифилиса.
Лептоспиры – возбудители лептоспирозов
Лептоспироз – природно-очаговое инфекционное заболевание, характеризующееся поражением капилляров, почек, печени, мышц, сердечно-сосудистой и нервной систем, сопровождающееся или не сопровождающееся желтухой.
Возбудитель лептоспироза впервые был описан и изучен Р. Инадо и У. Идо в 1915 г. и назван Leptospira icterohaemorrhagiae. Позднее были открыты другие лептоспиры.
Лептоспиры имеют вид плотно закрученной пружины, состоящей из 12 – 18 завитков (завитки первого порядка). Осевую нить образуют два или большее число периплазматических жгутиков, каждый из которых одним своим концом прикреплен к одному из полюсов протоплазматического цилиндра, и они редко перекрываются в центральной части клетки. Средняя длина лептоспир от 7 до 15 мкм, но может варьировать от 3 до 30 мкм. Диаметр лептоспир 0,07 – 0,14 мкм, амплитуда первичного завитка около 0,25 мкм. Мелкие завитки спирали тесно примыкают друг к другу (в среднем на 9 мкм 18 завитков), что придает лептоспирам при темнопольной микроскопии вид нитки жемчуга (см. рис. 111, 5) или гирлянды роз, они могут выглядеть и как цепочки мелких кокков. Один конец лептоспиры, а иногда и оба могут быть загнуты в виде крючка (завитки второго порядка), образуя С– или S-образные структуры. Живые лептоспиры очень подвижны, совершают вращательные, скользящие и маятникообразные движения. Спор и капсул не образуют.
Анилиновые красители воспринимают с трудом, по Романовскому – Гимзе окрашиваются в бледно-розовый цвет. Легко импрегнируются серебром.
Патогенные лептоспиры хорошо растут в аэробных условиях на жидких и полужидких средах, обязательно содержащих 5 – 10 % кроличьей сыворотки. Оптимальная температура роста 28 – 30 °C, но могут расти в пределах от 22 до 37 °C. Оптимальная для роста рН 7,1 – 7,4. Растут лептоспиры сравнительно медленно, рост обнаруживается не ранее 5 – 8 сут. В полужидких средах образуются колонии округлой формы диаметром 1 – 3 мм. В молодых культурах в области наиболее пышного роста в 1,5 – 2 см от поверхности наблюдается легкое помутнение в виде кольца. В жидких средах культуры прозрачны, не имеют запаха, при пышном росте определяется опалесценция, заметная в проходящем свете при легком встряхивании пробирки. Рост лептоспир в культурах контролируют с помощью микроскопии в темном поле.
Лептоспиры получают энергию путем окисления длинноцепочечных (не менее 14 атомов углерода) жирных кислот и не могут использовать в качестве источников энергии аминокислоты или углеводы. Основным источником азота для них являются соли аммония. В воде, особенно при щелочной реакции среды, лептоспиры могут сохранять жизнеспособность в течение нескольких недель.
Все патогенные лептоспиры объединены в один вид – Leptospira interrogans, в который входят различные серологические варианты. Известно более 200 сероваров, объединенных в 38 серогрупп. На территории СНГ выделены 27 сероваров, относящихся к 13 серогруппам (табл. 54). Основные штаммы лептоспир, выделенные от животных и человека в разных странах, имеют сходную антигенную структуру и при постановке серологических реакций дают положительные перекрестные результаты. Поэтому для специфической серологической диагностики необходимо использовать количественное определение антител к различным сероварам лептоспир. Из многих штаммов лептоспир выделен антиген липополисахаридной природы, дающий групповые реакции.
Таблица 54
Лептоспиры, выделенные от людей и животных в СНГ
Основным фактором патогенности лептоспир является эндотоксин, выделяющийся при разрушении возбудителя и вызывающий общую интоксикацию, а также кровоизлияния за счет повышения проницаемости сосудов, разрушения эндотелия и выпотевания крови из сосудов в ткани.
Лептоспиры устойчивы в окружающей среде, сохраняются в воде открытых водоемов до 30 дней и более, во влажной почве – до 270 дней, на пищевых продуктах – от нескольких часов до нескольких дней. Дольше сохраняются во влажной среде при рН 7,0 – 7,4 и при низких температурах. Погибают при высушивании и действии прямых солнечных лучей. При кипячении гибнут мгновенно, быстро инактивируются дезинфицирующими веществами в рабочих концентрациях.
Эпидемиология. Различают природные и антропоургические очаги лептоспироза. Источниками инфекции в природных очагах являются грызуны, насекомоядные, парнокопытные, хищные млекопитающие многих видов, реже птицы. Наибольшее значение имеют мыши, полевки, ондатры. В антропоургических очагах источники инфекции – крупный и мелкий рогатый скот, лошади, свиньи, собаки, домовые мыши и крысы. У животных лептоспироз может протекать бессимптомно, а лептоспиры могут выделяться с мочой в течение нескольких месяцев. Заражение людей происходит при купании и использовании для бытовых нужд воды из открытых водоемов, инфицированных мочой больных животных, при контакте с сырьем, употреблении продуктов, содержащих живые лептоспиры. Больные лептоспирозом люди не опасны для окружающих. Заболевание носит сезонный характер (пик – июль – август). Наиболее частыми в России возбудителями лептоспироза являются L. pomona, L. monijakov, L. grippotyphosa, L. tarassovi, L. canicola, L. icterohaemorrhagiae.
Патогенез и клиника. Возбудитель проникает в организм через слизистые оболочки и поврежденную кожу; с током крови попадает в печень, почки, селезенку, проникает через гематоэнцефалический барьер в ЦНС; в тканях этих органов лептоспиры размножаются. Затем они опять поступают в кровь, обусловливая генерализацию инфекции, лихорадку и интоксикацию. Бывают желтушные и безжелтушные формы лептоспироза. Инкубационный период в среднем 7 – 10 дней. Начало заболевания острое: озноб, высокая температура, характерны головная и мышечная боли, особенно в икроножных мышцах. Возможны сыпь, диспептические явления, признаки менингита. Позже или почти сразу начинают нарастать явления почечной (при безжелтушной форме) или почечно-печеночной (при желтушной форме) недостаточности. Летальность составляет 3 – 4 %.
Иммунитет. После перенесенной лептоспирозной инфекции формируется длительный стойкий иммунитет, имеющий типоспецифический характер. Во время болезни появляются агглютинины, комплементсвязывающие антитела и лизины. Сыворотка переболевших лептоспирозом людей защищает лабораторных животных от гибели при заражении их заведомо смертельной дозой возбудителя.
Лабораторная диагностика. Для диагностики лептоспироза используют микроскопический, бактериологический, серологический и биологический методы. Для микроскопии в начале заболевания (на фоне лихорадки) в качестве исследуемого материала используют кровь, при явлениях менингита – ликвор, в более поздние сроки заболевания (с 10 – 12-го дня) – центрифугат мочи. Эффективнее всего лептоспиры обнаруживаются в «раздавленной» капле при темнопольной микроскопии, реже препараты красят по Романовскому – Гимзе или методом серебрения в фиксированном состоянии. Для выделения чистой культуры тот же материал засевают на жидкие и полужидкие питательные среды. Идентифицируют лептоспиры при помощи реакции агглютинации с типовыми сыворотками. При биологическом методе заражают свежей плазмой или мочой больного молодых кроликов или хомячков, которые при внутрибрюшинном заражении погибают через 10 – 14 дней, во многих органах обнаруживаются геморрагические очаги, содержащие лептоспиры. Эти исследования должны проводиться только в специализированных лабораториях. Для обнаружения специфических антител проводят исследование парных сывороток крови больного в реакциях микроагглютинации и лизиса. Для постановки реакции микроагглютинации используют живые культуры лептоспир; агглютинацию выявляют при микроскопии. Перекрестная адсорбция сывороток позволяет производить определение типоспецифических антител. При использовании живых лептоспир вслед за агглютинацией может произойти их лизис. Применяют также РПГА, в которой используют диагностикум из эритроцитов с адсорбированными на них лептоспирами.
Специфическая профилактика и лечение. Вакцинация проводится по эпидемиологическим показаниям. Для этой цели в России недавно предложена в дополнение к вакцине А. А. Варфоломеевой и Г. Н. Ковальского более эффективная и менее реактогенная концентрированная инактивированная стандартизованная поливалентная вакцина. Она содержит антигены наиболее распространенных в стране серогрупп лептоспир. Для специфического лечения применяют гамма-глобулин из крови гипериммунизированных волов, содержащий антитела к различным сероварам лептоспир. В качестве этиотропных препаратов эффективны также антибиотики (пенициллин, тетрациклины).
Единственной патогенной для человека спириллой является Spirillum minus, представитель рода Spirillum, который вместе с родом Campylobacter и другими 17 родами по классификации Берги-9 отнесен в группу аэробных (или микроаэрофильных) подвижных, вибриоидных грамотрицательных бактерий. S. minus – толстая изогнутая палочка размером 0,2 – 0,5 × 3 – 5 мкм с 2 – 3 изгибами, имеет биполярно расположенные жгутики (одиночные или множественные), грамотрицательна. По мнению ряда авторов, целесообразно S. minus включить в род Campylobacter. Аэроб или микроаэрофил, на искусственных средах не растет. Хемоорганотроф. Является естественным паразитом ротовой полости, иногда крови крыс. Патогенен также для морских свинок и мышей. Биологические свойства и факторы патогенности мало изучены.
У человека S. minus вызывает болезнь сод]оку (лихорадка укуса крыс). Заражение происходит при укусе крыс и приводит к развитию местного очага поражения с последующим вовлечением в процесс регионарных лимфатических узлов, появлению высыпаний на коже и лихорадки рецидивирующего типа. Летальность до 10 %. Диагностика основана на обнаружении возбудителя в патологическом материале при микроскопии в темном поле или на заражении чувствительных животных кровью больного, взятой во время лихорадки.
В настоящее время содоку встречается крайне редко.
Патогенные грибы
К грибам относится большая группа одно– или многоклеточных организмов, которым присущи как признаки растений (неподвижность, неограниченный верхушечный рост, способность к синтезу витаминов, наличие клеточных стенок), так и животных (тип питания, наличие хитина в клеточных стенках, запасных углеводов в форме гликогена, образование мочевины, структура цитохромов). Различают грибы-паразиты, грибы-сапрофиты и грибы-симбионты. Грибы-паразиты поражают живые ткани растений, животных и человека, вызывая различные заболевания, называемые микозами. Из ныне известных свыше 100 000 видов грибов для человека патогенны не более 400. Грибы-сапрофиты питаются органическими веществами мертвых тканей или экскрементами. Примерами сапрофитов являются дрожжевые и плесневые грибы; последние также могут быть причиной микозов человека. Грибы-симбионты могут вступать в симбиотические отношения с корнями высших растений, в эту группу входят многие шляпочные грибы (базидиомицеты), в том числе и употребляемые в пищу, и ядовитые.
Грибы, паразитирующие в организме человека, вызывают микозы, протекающие с поражениями кожи, ее придатков или внутренних органов.
Единой общепринятой классификации грибов пока нет. Патогенные грибы, их роды и виды распределяются в различных семействах, подклассах и классах грибов: классе Deyteromycetes, или Fungi imperfecti (несовершенные грибы), классе Ascomycetes и классе Zygomycetes. Возбудитель криптококкоза относится к классу Basidiomycetes. В основе классификации грибов, которая более всего удобна для практики, лежат морфологические особенности и характер размножения.
Клетки грибов покрыты плотной клеточной оболочкой, состоящей из полисахаридов, близких к целлюлозе, и азотистых веществ, подобных хитину. У большинства грибов вегетативное тело (мицелий) состоит из системы тонких ветвящихся нитей, называемых гифами. Переплетаясь, мицелий образует грибницу. Гифы способны расти в длину и развиваются на поверхности или внутри питательного субстрата. Соответственно различают мицелий субстратный (вегетативный), врастающий в питательную среду, и воздушный. Концы нитей мицелия могут быть закручены в виде спиралей, завитков и т. д.
Грибы размножаются с помощью различных структур. При образовании половых спор имеет место мейоз, а конидии являются неполовыми репродуктивными органами. Половые стадии обнаружены у многих патогенных грибов, принадлежащих к классам Ascomycetes и Zygomycetes. У других патогенных грибов, которые относятся к дейтеромицетам, половые формы размножения не выявлены. У грибов, имеющих медицинское значение, существуют следующие разновидности половых спор:
а) зигоспоры – у некоторых зигомицетов верхушки расположенных близко друг к другу гиф сливаются, происходит мейоз, и образуются крупные зигоспоры с толстыми стенками (рис. 112, а);
б) аскоспоры – в специальных клетках, называемых асками (сумками), в которых произошел мейоз, образуется 4 – 8, иногда 16 и более спор, размеры, форма и поверхность которых могут быть весьма разнообразными у разных видов грибов (рис. 112, б);
в) базидиоспоры – после мейоза на поверхности особой клетки, называемой базидиумом, на вершине каждой из четырех стеригм развивается по одной круглой или слегка удлиненной базидиоспоре различных размеров (рис. 112, в).
У большинства грибов, имеющих медицинское значение, обнаруживаются разнообразные конидии (или экзоспоры), являющиеся формами неполового размножения. Если у гриба не известны половые стадии, классификация основывается на морфологических особенностях конидий. Они могут образовываться на специальных конидиофорах (конидиеносцах), по бокам или на концах обычных неспециализированных гиф или из гифальных клеток. В одной и той же колонии гриба может происходить образование нескольких типов конидий; в этом случае мелкие одноклеточные конидии называются микроконидиями, а крупные, часто многоклеточные, – макроконидиями.
Рис. 112. Половые споры грибов:
а – зигоспоры; б – аскоспоры; в – базидиоспоры
Наиболее частыми типами конидий являются следующие виды спор:
а) бластоспоры – простые структуры, которые образуются в результате почкования с последующим отделением почки от родительской клетки, например у дрожжевых и дрожжеподобных грибов (рис. 113, а);
б) хламидоспоры – гифальные клетки увеличиваются, у них образуется толстая оболочка. Эти структуры высокоустойчивы к действию неблагоприятных факторов внешней среды и прорастают, когда условия становятся более благоприятными (рис. 113, б);
в) артроспоры – структуры, которые образуются в результате фрагментации гиф на отдельные клетки (рис. 113, в). Встречаются у дрожжеподобных грибов, возбудителя кокцидиоидоза, тканевых форм дерматофитов в волосе, кожных чешуйках и в ногте;
г) конидиоспоры – зрелые наружные споры – образуются на мицелии и не являются следствием превращения каких-либо других клеток грибницы. Они или возникают на дифференцированных конидиофорах, отличающихся от других нитей грибницы по размерам и форме (аспергилл, пеницилл, рис. 113, г, д), или располагаются по бокам и на концах любой ветви мицелия, прикрепляясь к ней непосредственно либо тонкой ножкой (рис. 113, е).

Рис. 113. Неполовое размножение грибов, морфология спор:
а – бластоспоры; б – интеркаларные (промежуточные) и терминальные (концевые) хламидоспоры; в – артроспоры; г – конидии аспергилла; д – конидии пеницилла; е – конидии споротрихума; ж – алейрии; з – спорангии с эндоспорами у мукора; и – сферулы кокцидиоидного гриба
Алейрии (рис. 113, ж) отличаются от обычных конидий тем, что при их образовании протоплазма соответствующих нитей целиком идет на формирование спор, от мицелия остаются нежизнеспособные фрагменты. С обилием алейрий связан мучнистый характер культур дерматофитов на плотных средах.
К эндоспорам совершенных грибов относятся спорангиоспоры мукоровых грибов; они развиваются в специальных органах, располагающихся на вершине спорангиеносца. Споры освобождаются при разрыве стенки спорангия и, попадая в благоприятные условия, прорастают и дают грибницы с соответствующими органами спороношения (рис. 113, з). Эндоспоры обнаруживаются также у тканевых форм возбудителей кокцидиоидоза и риноспоридиоза. Они развиваются в круглых образованиях – сферулах. В процессе созревания последних в них развиваются многочисленные округлые или яйцевидные тонкостенные эндоспоры (рис. 113, и). При разрыве стенки зрелой сферулы эндоспоры освобождаются и, попадая в благоприятные условия, повторяют жизненный цикл, постепенно превращаясь в зрелые сферулы.
Ни один из описанных выше морфологических элементов не является абсолютно характерным для того или иного вида гриба, так как в культурах разных грибов можно встретить одинаковые клеточные формы, различающиеся в деталях на разных этапах их созревания. Комплексом разнообразных клеточных элементов определяется большой полиморфизм грибов в культурах на различных питательных средах. В паразитарном состоянии тканевые формы многих грибов очень резко отличаются от культуральных. Морфологические черты тканевых форм более однообразны и более характерны для возбудителей соответствующих заболеваний.
Почти все патогенные грибы – аэробы: широкий приток кислорода способствует развитию грибницы и накоплению продуктов жизнедеятельности. Для питания грибов необходимы азотистые и углеродсодержащие вещества (а также минеральные соединения), причем эти вещества могут быть довольно простыми: аминокислоты, соли азота, ди– и моносахара и т. д. Этим объясняется свойство многих патогенных грибов легко развиваться в организме человека и животных, где возбудитель находит среду, богатую источниками питательных веществ. Патогенные грибы способны размножаться в диапазоне рН от 3,0 до 10,0; оптимальное значение рН 6,0 – 6,5. Оптимальная температура для развития мицелиальных форм 25 – 33 °C, для дрожжевых и дрожжеподобных форм – 36 – 37 °C. Споруляции грибов способствует понижение влажности питательной среды и уменьшенное содержание в среде белков и углеводов.
Ферментативная активность патогенных грибов очень разнообразна, интенсивность ее широко варьирует как у различных грибов, так и у одного и того же гриба в разных условиях существования. У одних грибов более выражена протеолитическая активность, у других – сахаролитическая, а у некоторых – липолитическая. Одни грибы обладают обширным рядом ферментов и усваивают самые разнообразные углеводы, другие, наоборот, способны потреблять лишь очень ограниченный ряд азотистых веществ и углеводов. Различна и глубина разложения питательных субстратов грибами: одни из них разлагают белки лишь до аминокислот, другие – до аммиака и сероводорода. Потребление углеводов одними грибами сопровождается только образованием органических кислот, тогда как другие окисляют их до воды и углекислоты.
Витамины, некоторые аминокислоты и микроэлементы для различных грибов являются важными факторами роста.
На жидких питательных средах многие грибы растут в виде войлоковидного осадка, вначале на дне, а затем в виде пристеночного кольца или сплошной пленки. По характеру роста на плотных питательных средах колонии грибов подразделяются на несколько типов:
1) кожистые, гладкие, плотной консистенции, с трудом отделяемые от поверхности среды;
2) пушистые, рыхлые, ватообразной консистенции, легко пригибаемые к субстрату при прикосновении, с большим трудом снимаются петлей;
3) бархатисто-ворсистые колонии, покрытые очень коротким густым мицелием, напоминающим бархат;
4) хрупкие, пленчатые, по консистенции напоминающие ломкий картон, с очень коротким газоном воздушного мицелия, густомучнистые при спорообразовании;
5) гипсовидно-мучнистые поверхностные колонии порошковидной консистенции; мучнистость сплошь или звездчатыми очагами покрывает колонию и легко отделяется от поверхности культуры;
6) мелкозернистые или бугристые, кожистой консистенции, тесно спаянные со средой, нередко с глубокими отпрысками в среду;
7) крупнобугристые, строчковидные, очень хрупкой консистенции, легко отделяемые от субстрата;
8) блестящие, сальные или матовые, сливкообразной консистенции, иногда слизисто-тягучие, довольно легко эмульгируются в физиологическом растворе.
Многим патогенным грибам свойственны различные оттенки в окраске воздушного мицелия, более ярко выраженные на высоте споруляции. Большое разнообразие оттенков имеется у аспергиллов, пенициллов и некоторых дерматофитов. Наряду с яркими белыми, желтыми, коричневыми, черными, синими, зелеными, красными и малиновыми культурами встречаются беловато-желтые, розоватооранжевые, золотисто-желтые, охряно-ржавые культуры грибов. Химическая природа и растворимость пигментов различны. Одни из них растворимы в воде, другие – в спирте, ацетоне, дихлорэтане, четыреххлористом углероде. Водорастворимые пигменты довольно быстро окрашивают питательные субстраты в соответствующие оттенки.
Более четко цвет пигмента выявляется на кислых питательных средах с углеводами; стимулируют пигментообразование интенсивная аэрация и добавление в среду солей магния, железа, а для некоторых грибов и солей лития. Тканевые формы грибов в патологическом материале окрашены только у возбудителей хромомикоза и различных мицетом. Субстратный мицелий и обратная сторона колоний остаются бесцветными или серовато-желтыми, иногда наблюдаются более темные оттенки.
Среди продуктов жизнедеятельности и экстрактов из клеток некоторых грибов выявлены вещества, обладающие токсическими свойствами. С ними связано растворение эритроцитов, повреждение эпителия кожи и ее придатков и слизистых, клеток различных органов. Многие грибы обладают гиалуронидазной активностью. Важную патогенетическую роль играют полисахариды некоторых дерматофитов в развитии васкулитов, доказана токсичность некоторых липидов из культур дрожжеподобных грибов.
Устойчивость грибов к воздействию факторов внешней среды зависит от вида гриба, причем различные клеточные элементы его по-разному противостоят неблагоприятным воздействиям. Молодые клетки грибов, заключенные в специальных органах плодоношения, более устойчивы, чем свободно лежащие споры. Слизистые капсулы, окружающие грибы (криптококки, дрожжеподобные грибы) в патологическом материале и в культурах, также обеспечивают относительно большую устойчивость их к внешним факторам. Кипячение в течение нескольких минут приводит к гибели грибов в тканевой и культуральной форме. Прямые солнечные лучи и ультрафиолетовый свет действуют на грибы губительно лишь при длительной экспозиции и во влажной среде.
Выраженным фунгицидным действием обладает 3 – 7 %-ная уксусная кислота, салициловая и бензойная кислоты (1 – 2 %-ные), 1 – 10 %-ный формалин, 0,1 %-ная сулема, 5 %-ная хлорная известь.
Заболевания, вызываемые патогенными грибами, условно можно разделить на две группы: системные, или глубокие, микозы и поверхностные микозы. Микозы, вызываемые условно-патогенными грибами, могут иметь смешанное клиническое течение.
Патогенные грибы обычно не продуцируют экзотоксинов. В организме хозяина они, как правило, вызывают развитие гиперсенсибилизации к их различным антигенам. При системных микозах типичной тканевой реакцией является развитие хронической гранулемы с различной степенью некроза и образованием абсцесса. Кроме того, существует группа заболеваний, называемых микотоксикозами, которые обусловлены попаданием в организм микотоксинов, образующихся в процессе жизнедеятельности ряда микроскопических плесневых грибов. Выделено более 300 видов микотоксинов, продуцируемых представителями 350 видов грибов, однако практическое значение как загрязнители пищевых продуктов имеют лишь около 20. Среди них наиболее распространены и опасны для здоровья человека афлатоксины В1, В2, G1, G2, M1 (продуценты – грибы рода Aspergillus), трихотеценовые микотоксины (в том числе дезоксиниваленол и зеараленон, продуценты – грибы рода Fusarium), охратоксины, цитринин, цитреовиридин (продуценты – грибы родов Aspergillus и Penicillium), алкалоиды спорыньи (Claviceps purpurea), в том числе лизергиновая кислота и агроклавин.
Микотоксикозы являются разновидностью пищевых отравлений – пищевых интоксикаций, и причиной их являются, как правило, зерно и зерновые продукты. Зерно поражается грибами в период созревания и уборки урожая при неблагоприятных метеорологических условиях и неправильном хранении.
Патогенез микозов весьма сложен и складывается, как правило, из нескольких факторов. При наличии благоприятных условий патогенный гриб в виде спор или фрагментов мицелия внедряется и размножается в ткани, давая начало микотическому процессу. После инкубационного периода, длящегося от нескольких дней до нескольких месяцев, наблюдаются поражения определенных систем органов и тканей; при многих микозах одновременно поражаются внутренние органы и кожные покровы. При гематогенной диссеминации возбудителя могут возникать септикопиемические процессы. Некоторые грибы могут проникать и развиваться внутри кровеносных сосудов, вызывая тромбозы с последующим развитием инфарктных поражений органов. В развитии микозов наиболее важную роль играют следующие патогенетические факторы:
1) нарушение обмена веществ и функции эндокринной системы (гипо– и диспротеинемии; гипергликемия; грубые длительные погрешности в питании; хронические заболевания желудочно-кишечного тракта; дисфункция щитовидной и половых желез, надпочечников и т. д.);
2) возрастная предрасположенность к некоторым микозам (дошкольный и школьный возраст – к дерматофитиям, ранний возраст и новорожденные – к кандидозам);
3) гипо-, авитаминозы, нарушения витаминного баланса – при большинстве микозов;
4) нерациональное применение антибиотиков, сульфаниламидов и других препаратов, приводящее к развитию дисбактериоза, а также дисбактериоз на фоне хронических заболеваний, нарушений диеты;
5) иммунодефициты, развившиеся на фоне инфекционного или гематологического заболевания, онкологического процесса, интоксикации и т. д.;
6) при микозах наблюдается гиперсенсибилизация макроорганизма антигенами грибов, обычно по типу ГЧЗ;
7) профессиональная предрасположенность к некоторым микозам при нерациональных условиях труда: плесневые микозы у мукомолов, работников микологических лабораторий, в производстве антибиотиков, при вдыхании спор грибов и др.;
8) чрезмерная потливость, связанная с дисфункцией вегетативной нервной системы, способствует развитию микозов складок кожи, стоп за счет мацерации;
9) травмы часто открывают входные ворота для проникновения грибов в ткани, одновременно снижая местные защитные реакции.
Возбудителями глубоких микозов служат микроорганизмы, свободно обитающие в почве или на разрушающихся органических субстратах и встречающиеся только в определенных географических зонах. В этих зонах многие люди инфицированы данными возбудителями. У большинства инфицированных симптомы заболевания отсутствуют или выражены слабо, и только в очень небольшой части случаев заболевание прогрессирует и приводит к развитию тяжелых форм или смерти за счет системных поражений. Сходно может протекать актиномикоз, но возбудителем его является не гриб, а нитчатые ветвящиеся бактерии. К глубоким микозам также относится мицетома стопы (мадуромикоз). По некоторым классификациям споротрихоз и хромомикоз относят к так называемым субкутанным (подкожным) микозам.
Возбудителем этого системного микоза является почвенный гриб Coccidioides immitis. Инфекция эндемична и встречается в некоторых засушливых районах югозапада США и Латинской Америки. Гриб относится к классу фикомицетов и встречается в тканевой, паразитарной форме в организме больных и в мицелиальной, весьма контагиозной форме в почве и в культуре на искусственных питательных средах. Заболевание от человека к человеку не передается.
В патологическом материале (гной, мокрота, гистологические препараты) возбудитель имеет вид сферул диаметром 15 – 60 мкм, иногда до 120 мкм, с толстой двойной оболочкой; сферула заполнена эндоспорами (см. рис. 113, и). При разрыве ее оболочки эндоспоры выходят в окружающие ткани, где они увеличиваются в размере и образуют новые сферулы или фагоцитируются гигантскими клетками.
Культуры C. immitis довольно хорошо растут на плотных и жидких средах с углеводами и с кровью, на овощах и синтетических средах. При температуре 37 °C и рН 7,2 – 7,4 на богатых белками средах вырастают кожистые, почти лишенные воздушного мицелия мягкие желтовато-коричневые дрожжеподобные колонии. На более кислых средах при температуре 27 – 30 °C хорошо развивается воздушный мицелий; колонии при этом пушистые, беловатые, на высоте спорообразования – мучнистые с характерными артроспорами. В некоторых колониях наблюдаются концентрические зоны пушистого мицелия. В молодых культурах на плотных средах преобладает мицелий с интеркаларными хламидоспорами (см. рис. 113, б). Старые культуры богаты хламидоспорами, артроспорами, обрывками мицелия. Артроспоры освобождаются при разрыве гифов, легко переносятся током воздуха и являются высококонтагиозными. При введении животным или вдыхании людьми они трансформируются в тканевые сферулы.
Кокцидиоидный гриб является аэробом, окисляет моно-, ди– и полисахара, обладает выраженной протеолитической активностью. Способен разжижать желатин и казеин, свернутую лошадиную сыворотку, пептонизирует и коагулирует молоко. Не восстанавливает нитраты в нитриты, не образует индола и сероводорода.
Хорошо переносит замораживание и оттаивание, длительно сохраняется на холоде (до 4 месяцев) и выдерживает прогревание до 60 – 65 °C в течение 3 ч. Гибнет при кипячении в течение 20 мин в 2 %-ной хлорной извести или 10 %-ном формалине в течение 2 – 3 ч.
Патогенез и клиника. Инфицирование происходит при вдыхании артроспор, находящихся в воздухе. Возникающая респираторная инфекция может протекать бессимптомно или проявляться только возникновением преципитинов и положительной кожной ГЧЗ через 2 – 3 нед. после заражения. Может наблюдаться также гриппоподобное заболевание с лихорадкой, общей слабостью, кашлем и болями. В последнем случае у 5 – 10 % больных через 1 – 2 нед. развивается ГЧЗ в виде узловатой или многоформенной эритемы («долинная лихорадка», или «пустынный ревматизм»). У половины больных в легких формируются каверны с тонкими стенками, которые в дальнейшем рубцуются или процесс становится хроническим. Диссеминированная форма, при которой наблюдается очень высокая летальность, развивается менее чем у 1 % инфицированных. Это значительно чаще происходит у выходцев из Филиппин, Африки и у мексиканцев, а также у беременных женщин. При генерализации инфекции могут развиваться менингит, поражения костей, в различных органах обнаруживаются типичные гранулемы и рассеянные очаги нагноения.
Лабораторная диагностика. Материалом для исследования являются гной, мокрота, кровь, ликвор, кусочки ткани из органов, в которых при микроскопии обнаруживают характерные сферулы, легче различимые в неокрашенных препаратах. Всегда четкие, достоверные результаты дает получение чистой культуры при посеве на среды Сабуро, МПА и МПБ с глюкозой. Посевы инкубируют при 27 и 37 °C от 3 нед. до 2 мес. Работа с культурами требует соблюдения особо строгого режима во избежание ингаляторного заражения. Чистая культура хорошо выделяется при заражении белых мышей или самцов морской свинки при развитии у животного прогрессирующих очагов поражения. Серологическая диагностика осуществляется посредством реакции агглютинации, преципитации, РСК, так как через 2 – 4 нед. после заражения появляются антитела классов IgM и IgG. При диссеминации процесса нарастание титра комплементсвязывающих антител является плохим прогностическим признаком. Аллергические кожные пробы ставят с кокцидиоидным аллергеном в разведении 1: 1000, при отрицательном результате – 1: 100. Результат учитывают через 48 ч. При положительной пробе отмечаются гиперемия, припухлость, папула в месте введения. При диссеминированной форме кожные пробы иногда бывают отрицательными.
Специфическая профилактика не разработана. Неспецифическая профилактика кокцидиоидоза сводится к борьбе с запыленностью; проводятся асфальтирование дорог; увлажнение почвы при земляных работах; мелиоративные мероприятия; покрытие почвы, инфицированной грибом, густым растительным газоном; применение противопылевых масок и т. д.
Для лечения кокцидиоидоза, а также микозов, вызванных грибами Candida, Cryptococcus, Microsporum, Trichophyton, Blastomyces, Coccidioides immitis, Histoplasma capsularum предложен препарат широкого спектра действия флюкостат, производное триазола. Он подавляет синтез эргостерола, в результате чего нарушается проницаемость клеточной стенки грибов. Рекомендуются также амфотерицин В или его производные.
Бластомикозы – группа глубоких неконтагиозных грибковых заболеваний кожи и внутренних органов, вызываемых дрожжевыми и дрожжеподобными грибами, размножающимися почкованием. Различают североамериканский, келоидный, европейский и южноамериканский бластомикозы.
Североамериканский бластомикоз (болезнь Гилкриста). Заболевание эндемично для США, Канады, встречается в странах Африки, иногда в Австралии, Индии, Латинской Америке, Европе, в том числе России. Возбудитель – Blastomyces dermatitidis – диморфный гриб, который в тканях развивается в виде дрожжеподобных почкующихся клеток, а в культурах при температуре 20 °C – в мицелиальной и дрожжевой формах. В тканях имеет вид округлых и овальных клеток диаметром 8 – 10 мкм, иногда до 20 мкм, с двойной оболочкой, размножается почкованием, причем дает единственную почку, располагающуюся на широком основании. В ряде случаев вместо образования почки клетка вытягивается и принимает вид языка колокола. Мицелиальная форма образуется на питательных средах при комнатной температуре. Колонии вначале круглые и гладкие, дрожжеподобные. Позднее они покрываются белым, затем желтовато-буроватым воздушным пушком с короткими шипами. Под микроскопом в таких культурах наряду с круглыми почкующимися дрожжевыми клетками в изобилии встречаются длинные и короткие септированные нити с обильными боковыми конидиями круглой, овальной, иногда грушевидной формы диаметром 3 – 5 мкм. В старых культурах встречаются обильные хламидоспоры диаметром 7 – 18 мкм. Мицелиальная форма легко превращается в дрожжеподобную при выращивании при температуре 37 °C, а дрожжевая при 20 °C – в мицелиальную. На кислых средах вырастает мицелиальная, а на щелочных – дрожжевая форма гриба. Аскомицетная совершенная стадия гриба обозначается Ajellomyces dermatitidis.
Резервуаром возбудителя является почва; заражение происходит при вдыхании спор грибка с пылью. Болеют чаще мужчины; кроме человека, болеют лошади и собаки.
Патогенез и клиника. Первичный очаг локализуется в легких; кожа и внутренние органы вовлекаются в процесс вторично. Обычно заболевание развивается на фоне сниженной резистентности макроорганизма. При генерализации инфекции гематогенным путем характерно образование абсцессов в пораженных тканях в сочетании с картиной хронического воспаления, гигантоклеточной реакцией и некрозом. Различают легочную, диссеминированную и кожную формы заболевания.
Лабораторная диагностика основывается на обнаружении характерных дрожжеподобных двухконтурных клеток с одной почкой в гное, мокроте, биопсийном материале. Обычно легко удается выделить чистую культуру возбудителя при посеве материала на плотные среды; при выращивании при температуре 20 – 25 и 37 °C вырастают характерные колонии, в которых гриб имеет также характерную морфологию. В отдельных случаях можно исследуемый материал вводить внутрибрюшинно белым мышам, а затем исследовать пораженные органы. Довольно эффективны серологические реакции (РСК, агглютинации) и внутрикожные пробы с аллергеном. Специфическая профилактика не разработана. Для специфической терапии используют амфотерицин В в сочетании с хирургическим лечением или электрокоагуляцией очагов при кожной форме заболевания.
Южноамериканский бластомикоз (паракокцидиоидоз) распространен только в странах Южной Америки, и возбудителем его является двухфазный гриб Paracoccidioides brasiliensis. В пораженных тканях человека и животных он имеет сферическую или овальную форму, размеры клеток от 30 до 60 мкм. При почковании образуется одна крупная или несколько мелких дочерних клеток. Характерны крупные круглые клетки с двойной оболочкой, на поверхности которых располагаются мелкие (от 1 до 5 мкм) почки в виде венца или «короны», что является важным дифференциальнодиагностическим признаком для данного возбудителя. Почки овальные или круглые, диаметром от 0,5 до 6 – 10 мкм. Гриб растет на обычных средах с углеводами, кровью, сывороткой. Дрожжевая форма наблюдается при выращивании гриба при 37 °C, колонии гладкие или церебриформные (похожие на головной мозг) и сходны с колониями дрожжеподобных грибов. Под микроскопом видны овальные и круглые клетки крупного размера, с единичными или множественными почками или без них. Они напоминают тканевые формы гриба. Мицелиальная форма возникает при выращивании культуры при комнатной температуре (до 25 °C). Колонии складчатые, в центре покрыты беловато-сероватым, в дальнейшем желтоватым пушком. Под микроскопом видны ветвящийся мицелий и овальные конидии, располагающиеся по бокам мицелиальных клеток; их диаметр 3,0 – 3,5 мкм, иногда конидии группируются кучками.
Возбудитель заболевания обитает на растениях и в почве. Чаще болеют сельские жители. Заражение происходит при травмировании полости рта при чистке зубов веточкой растения или ингаляторным путем. Заболевание от человека человеку не передается.
В пораженных органах обнаруживаются гранулемы с центральной зоной казеозного некроза или нагноением; имеется большое количество гигантских клеток и крупных почкующихся клеток возбудителя. Эти поражения вначале отмечаются на слизистой носа, рта, гортани, реже на коже. Затем в процесс вовлекаются лимфатические узлы, могут образовываться свищи, и происходит генерализация инфекции гематогенным и лимфогенным путем. Возникает поражение внутренних органов.
Лабораторная диагностика. Используются те же методы диагностики, что и при североамериканском бластомикозе. Заражение животных производят внутрь яичка, затем выделяют возбудителя из развивающихся очагов поражения.
Специфическая профилактика не разработана. Для лечения эффективен амфотерицин В, в отдельных случаях благоприятный результат дает длительное лечение сульфаниламидами.
Келоидный бластомикоз (болезнь Лобо). Заболевание встречается в Бразилии, реже в других странах Латинской Америки. Возбудитель – Blastomyces loboi. Гриб двухфазный и по морфологии близок к B. dermatitidis. В патологическом материале представляет собой яйцевидные или овальные клетки диаметром 8 – 16 мкм, имеющие двухконтурную оболочку и 1 – 2 почки. На питательной среде при комнатной температуре культуры гриба растут медленно в виде дисков белого цвета, которые покрыты бархатистым пушком воздушного мицелия. При температуре 37 °C вырастают сероватые дрожжевидные колонии.
Эпидемиология заболевания не изучена. Внедрению возбудителя способствуют травмы кожи, укусы насекомых. Поражается только кожа, где развивается хроническое воспаление, характеризующееся большим количеством гигантских клеток и гистиоцитов. Поражается кожа голеней, стоп, предплечий, ушных раковин, ягодиц, где появляются бугристые, подобные рубцам или опухолям, узлы и бородавчатые разрастания розово-коричневой окраски с лоснящейся поверхностью. При их слиянии образуются инфильтраты. Обычно наблюдается хроническое доброкачественное течение.
Лабораторная диагностика. Основные методы диагностики – микроскопический и посев с целью получения чистой культуры.
Специфическая профилактика не разработана. Для лечения проводят возможно раннее удаление или электрокоагуляцию узлов в пределах здоровой ткани.
Европейский бластомикоз (криптококкоз). Заболевание встречается редко, но распространено повсеместно, возбудитель – Cryptococcus neoformans. Тканевая форма криптококка морфологически мало отличается от культуральной. Гриб имеет форму круглых, реже овальных, клеток с двухконтурной оболочкой, диаметром 2 – 5, реже 10 – 12 мкм, с одной слегка удлиненной почкой. При неблагоприятных условиях развития могут наблюдаться удлиненные и нитчатые формы клеток. Самым характерным для криптококка признаком является наличие толстой слизистой капсулы, толщина которой иногда значительно превосходит размеры самой клетки (до 50 мкм). Она состоит из длинных извитых нитей полисахаридной природы, диаметром 3 – 4 нм, переплетающихся между собой. Криптококк – аэроб, хорошо растет на простых, сахарных средах, среде Сабуро и др. На среде Сабуро при комнатной температуре вырастают блестящие, слизисто-сальные, тягучей консистенции колонии беловатого или желтоватого оттенка с куполообразной гладкой поверхностью, реже – морщинистые или мелкозернистые. На овощных средах наблюдается образование коричневого пигмента. В отличие от непатогенных криптококков, C. neoformans хорошо растет при температуре 37 °C на большинстве сред, в состав которых не входит циклогексимид. Углеводы не ферментирует, но окисляет глюкозу, мальтозу, сахарозу и галактозу; обладает уреазой.
Выявлено 4 серогруппы криптококков по капсульному полисахариду: A, B, C, D. При скрещивании штаммов, относящихся к серогруппам A и D или В и С, образуются мицелий и базидиоспоры; при такой морфологии гриб называется Filobasidiella neoformans и Filobasidiella bacillispora. Помимо специфических, криптококки могут давать перекрестные реакции с дрожжеподобными грибами и пневмококками. Чаще всего обнаруживается серогруппа А. Антитела против криптококковых полисахаридов выявляются с помощью различных серологических реакций, наличие антител не означает повышенной сопротивляемости к рецидивам заболевания.
Возбудитель обнаруживается в почве и присутствует в больших количествах в помете голубей. Последнее объясняется наличием в моче голубей ксантина и гуанина, ассимилируемых криптококком. Заражение происходит при вдыхании грибка с пылью.
Патогенез и клиника. Патогенез мало изучен. В пораженных тканях образуются гранулемы с некротическими казеозными изменениями, при поражении головного мозга преобладает хроническое воспаление с наличием гигантских и эпителиоидных клеток, макрофагов и лимфоцитов. Инфекция длительное время может оставаться скрытой, наиболее частое клиническое проявление криптококкоза – медленно развивающийся хронический менингит с частыми ремиссиями и обострениями. Возможно развитие энцефалита, отмечаются изменения в легких, на коже, в других внутренних органах. При генерализации процесса прогноз обычно неблагоприятный.
Лабораторная диагностика основана на обнаружении гриба в исследуемом материале (ликвор, гной из свищей, биоптаты ткани и др.) и выделении чистой культуры. Хорошее стимулирующее действие на рост гриба оказывает желчь. С помощью различных серологических реакций можно обнаружить специфические антитела
(РПГА, реакции агглютинации, преципитации, РСК) или антигены (латекс-агглютинация и иммуноэлектрофорез). В ряде случаев полезным оказывается внутрибрюшинное заражение белых мышей патологическим материалом для последующего выделения чистой культуры.
Специфическая профилактика не разработана. Для лечения бластомикозов применяют амфотерицин B, фторцитозин и флюкостат по специальным схемам. Показано хирургическое удаление криптококковых очагов (в легких, на коже, в лимфатических узлах). Есть данные о положительном эффекте от применения антикриптококкового гамма-глобулина в сочетании с химиопрепаратами.
Заболевание эндемично для США и стран Южной Америки, во многих других странах, в том числе в России, встречается в виде спорадических случаев. Возбудителем является диморфный гриб Histoplasma capsulatum. Аскомицет – совершенная стадия возбудителя гистоплазмоза – имеет название Emmonsiella capsulata. В зависимости от условий окружающей среды может иметь дрожжевую и мицелиальную форму. Мицелиальная форма свойственна природным и лабораторным штаммам, дрожжевая – паразитарная – встречается в организме человека и животных или развивается на соответствующих искусственных средах. В тканях и патологическом материале имеет вид одноядерных клеток округлой или грушевидной формы, размером 2 – 4 мкм, с почкой, которая развивается на более узком конце клетки и имеет узкое основание. Ядро почти вдвое меньше клетки; имеются также клеточная оболочка и капсула. Характерным для тканевой формы является расположение внутри макрофагов, гигантских клеток и клеток ретикулоэндотелиальной системы; реже клетки гриба лежат свободно и напоминают тканевые формы лейшманий.
На среде Сабуро при комнатной температуре развиваются пушистые колонии от белого до коричневого цвета с темной, иногда складчатой, подкладкой, с некоторым врастанием в толщу среды. Мицелий в таких колониях септированный, ветвистый, многоядерный, диаметром до 5 мкм. Часто встречаются хламидоспоры. Макроконидии крупные, круглые или грушевидные, диаметром 10 – 25 мкм, имеют шиповидные выросты длиной 1 – 5 мкм, располагаются на концах воздушных нитей мицелия. Микроконидии обычно гладкостенные, округлые или грушевидные, иногда сигарообразные, размером 2 – 6 мкм. На жидких средах гриб растет в виде бархатистой беловатой пленки.
Дрожжевая форма гистоплазмы вырастает на кровяных средах с глюкозой при температуре 35 – 37 °C и рН 7,2 – 7,6. Колонии мелкие, блестяще-сальные, выпуклые, иногда складчатые, плотной консистенции, прочно связанные со средой, окраска – от беловато-сероватой до коричневатой, иногда с оранжевым оттенком. Клетки гриба овальной формы, размером 1,5 – 3,5 мкм, размножаются только почкованием; почки образуются на одном или на двух полюсах, иногда аполярно. Может образовываться псевдомицелий: почкующиеся дрожжеподобные клетки располагаются цепочками и нитями.
Мицелиальная форма гриба – аэроб, дрожжевая – факультативный анаэроб и микроаэрофил. Выращивают посевы до 3 нед.
Гистоплазма обитает в почве, загрязненной пометом птиц и летучих мышей. Заражение происходит аэрогенным путем при вдыхании пыли со спорами гриба, наиболее инфекционны микроконидии мицелиальной фазы. Больной гистоплазмозом не опасен для людей.
Патогенез и клиника. Споры гриба, попадая в легкие, в альвеолах и бронхиолах превращаются в паразитическую дрожжеподобную форму. Далее поражаются лимфатические узлы, последующая диссеминация осуществляется лимфо– и гематогенным путем. Гистоплазмы избирательно поражают клетки системы мононуклеар-
ных фагоцитов, размножаясь внутриклеточно. Разрушая их, гриб способствует формированию очагов некроза, состоящих из эпителиоидных, гигантских клеток, клеток типа Пирогова – Лангганса, в которых обнаруживаются элементы гриба. Процесс может сопровождаться казеозным распадом ткани, фиброзом и кальцинацией. При генерализации процесса могут поражаться различные органы, течение может быть быстротекущим (у детей) и медленно прогрессирующим. Заболевание протекает на фоне сенсибилизации по типу ГЧЗ, в крови больных накапливаются комплементсвязывающие антитела, агглютинины, преципитины. После перенесенного гистоплазмоза остается длительный иммунитет.
Лабораторная диагностика. Материалом для исследования служат отделяемое язв, гной, мокрота, ликвор, кровь, костный мозг, моча. Препараты окрашивают по Граму, Цилю – Нильсену, Романовскому – Гимзе. Внутри цитоплазмы клеток или внеклеточно видны мелкие круглые почкующиеся дрожжеподобные клетки, окруженные светлым ореолом. Микологическое исследование имеет значительное преимущество перед микроскопическим: выделение культуры гриба свидетельствует о заболевании гистоплазмозом, так как носительство гриба у здоровых не обнаружено. Лучше делать посевы на среды с антибиотиками. Материал можно также вводить внутрибрюшинно белым мышам, которых через 4 нед. забивают и из печени и селезенки выделяют чистую культуру. Вспомогательное значение имеют аллергический метод (кожная проба с гистоплазмином) и серологические реакции (РСК, агглютинации, преципитации). Возрастание титра антител, выявляемых в РСК, свидетельствует о генерализации процесса.
Специфическая профилактика и лечение. Имеются сообщения о положительном эффекте использования живых клеток дрожжевой фазы для иммунизации. Иммунизация подавляет развитие гриба в организме, снижает количество тканевых форм, но не освобождает полностью от возбудителя. Для лечения используют флюкостат, нистатин, леворин, сульфамиды, а также низорал, амфотерицин B.
Встречается почти во всех странах мира, чаще во Франции и США. Возбудитель – Sporotrichum schencki – гриб, обладающий диморфизмом, относится к нитчатым грибам, гифомицетам. Описаны его совершенные формы, названные Seratocystis ctenoceus. Тканевые формы нечасто обнаруживаются в срезах тканей и в патологическом материале, имеют вид мелких грамположительных почкующихся клеток округлой или сигарообразной формы («челночки») размерами 2 – 5 мкм, покрытых небольшим слоем слизи. Они обычно находятся внутри макрофагов. Иногда встречаются дрожжеподобные почкующиеся клетки диаметром 2 – 8 мкм и так называемые «астроидные» тела – грибковые клетки, окруженные эозинофильными комплексами антиген + антитело.
В культурах споротрихум встречается в мицелиальной и дрожжевой формах. Дрожжевые формы развиваются при температуре 37 °C на богатых белками и витаминами средах в виде овальных и удлиненных клеток размером 1 – 2 × 4 – 8 мкм;
встречаются круглые клетки, почкующиеся, иногда связанные друг с другом длинной клеткой. Колонии их мягкие, гладкие, желтоватого цвета, появляются на 4 – 6-й день. Позднее колонии увеличиваются в размерах, становятся сероватыми, складчатыми или церебриформными, медленно растут и редко сливаются.
Колонии мицелиальной формы на разных средах различные: некоторые растут ровным газоном, у других выражена бугристость в центре. Встречаются складчатые, крупнобугристые или многопетлистые, возвышающиеся колонии светло-желтого или шоколадного, почти черного цвета. Пигмент водонерастворимый. На жидких средах гриб растет войлокообразным комочком на дне и в виде складчатой серобелой пленки на поверхности. Мицелий ветвистый, септированный, диаметром
1,0 – 2,5 мкм, длиной от 10 до 30 мкм и больше. Конидии гриба овальные, круглые, грушевидные или цилиндрические, некоторые с заостренными концами, длиной от 2 – 4 до 6 – 8 мкм, шириной 1,5 – 3,0 мкм; располагаются обычно попарно одна против другой по бокам мицелия или группами по 5 – 10 спор на конце, иногда в виде розетки. В мицелиальных культурах встречаются так называемые коремии, представляющие собой тесно прилегающие, нередко анастомозирующие нити с микроконидиями на воздушных концах. Нити иногда искривленные, заканчиваются тонкими усиками и завитками. В зрелых формах и старых культурах можно видеть хламидоспоры, обычно интеркаларные, реже терминальные.
Факторами, способствующими распространению гриба и развитию инфекции, являются тепло и влажность, поэтому споротрихоз регистрируется преимущественно в странах с тропическим и субтропическим климатом, а в зоне умеренного климата – в теплое время года. У человека отмечается носительство гриба после перенесенного заболевания. Источником инфекции являются почва, некоторые растения, так как споротрихум живет в природе как сапрофит или вегетирует на растениях.
Патогенез и клиника. Грибы проникают в кожу конечностей при травме (в 80 % случаев) или через слизистые оболочки, дыхательные пути, желудочно-кишечный тракт. Обычно инфекция развивается на фоне ослабленной резистентности (туберкулез, алкоголизм, нарушения обмена веществ). В месте повреждения развивается поражение в виде пустулы, абсцесса или язвы, лимфатические сосуды утолщаются и уплотняются. Вдоль лимфатических сосудов, отходящих от первичного очага, образуются множественные подкожные узлы и абсцессы. Обычно системное заболевание при таких поражениях не развивается, однако иногда может происходить диссеминация возбудителя, и поражаются внутренние органы и кости. В очагах поражения обнаруживаются хроническая воспалительная реакция и гранулемы с некротическими изменениями и «астероидными» телами.
Лабораторная диагностика. При микроскопии исследуют гной или биоптаты для обнаружения характерных клеток возбудителя, но эти находки непостоянны. Хорошие результаты обычно дает посев для выделения чистой культуры возбудителя;
посев делают на богатые среды и на среду Сабуро и инкубируют при 37 °C и комнатной температуре в течение 20 – 25 дней, затем грибы микроскопируют для обнаружения дрожжевой и мицелиальной форм. Для выделения культуры гриба используют также внутрибрюшинное, подкожное или интратестикулярное заражение животных (мыши, крысы, хомячки, морские свинки). Из серологических методов используют реакции агглютинации, РСК, преципитации, латекс-агглютинации; антитела обычно обнаруживаются в высоких титрах.
Специфическая профилактика не разработана. При лечении хороший эффект дает использование препаратов йода (йодид калия) и амфотерицина В.
Заболевание встречается повсеместно в виде спорадических случаев, преимущественно в тропической и субтропической зонах (Куба, Бразилия, Гвинея). Хромомикоз вызывается несколькими видами «черных плесеней», чаще всего Phialophоra verrucosa, Fonsecaea pedrosoi, F. dermatitidis, Cladosporium carrionii. Это диморфные грибы, относящиеся к дейтеромицетам.
В патологическом материале возбудитель чаще всего представлен темно-коричневыми округлыми клетками диаметром 5 – 15 мкм, иногда многоугольными или неправильной формы, расположенными среди эритроцитов и лейкоцитов. Клетки имеют толстую двухконтурную оболочку и разделены поперечной или продольной перегородкой. Располагаются отдельно или небольшими группами. Часто между такими клетками, эритроцитами и лейкоцитами обнаруживаются нити мицелия. Вокруг крупных клеток гриба иногда обнаруживаются зерна, сходные с актиномикотическими. При окраске по Граму гриб выявляется плохо, по Романовскому – Гимзе стенки клеток гриба окрашиваются в зеленоватый цвет, а по Цилю – Нильсену – в темно-красный.
Гриб хорошо растет как при комнатной температуре, так и при 26 – 28 °C; на 3 – 5-й день колонии имеют вид темно-серых пушистых точек. К 10 – 17-му дню колония становится зрелой: она округлая, конусовидная, ворсистая или пушистая, имеет зеленовато-сероватый цвет. Отдельные колонии могут сливаться в сплошную массу, окруженную мелкими пушистыми разбросанными колониями темного цвета. На жидких средах растут на дне округлыми комочками черноватого цвета.
Культура представлена мицелием, от которого отходят вторичные ответвления. Мицелий редко септированный и может быть двух типов: вегетативный и конидиеносцы. Конидиеносцы более септированы, на их несколько расширенных концах располагаются конидии. Встречаются кистеподобные скопления спор, а также одиночно или группами расположенные желтовато-буроватые хламидоспоры диаметром 10 – 12 мкм, с толстыми темными стенками. Различают следующие типы споруляции этих грибов: hormodendrum, acrotheca, phialophora.
Тип hormodendrum характеризуется концевыми конидиофорами с усеченными мелкими выпуклостями, к которым прикрепляются споры оливкового цвета, яйцевидные, одно– или двухклеточные, размерами 1,5 – 3,0 × 3,0 – 5,0 мкм, расположены цепочками. Тип acrotheca представлен концевыми или боковыми конидиофорами, напоминающими по форме дубинку и образующими латеральные конидии диаметром 2 – 3 мкм. Тип phialophora характеризуется овальными или удлиненными конидиями, расположенными на бутылкообразных конидиофорах.
Возбудители хромомикоза могут расти без добавления углеводов и азотистых веществ на увлажненном гнилом дереве, соломе, различных злаках, гнилых листьях, бумаге, в почве. Хромомикоз – неконтагиозное заболевание, больной не заразен для окружающих.
Патогенез и клиника. Грибы проникают в поврежденную при травме кожу с гниющим деревом или почвой. Медленно (несколько месяцев или лет) развиваются бородавчатые разрастания, распространяющиеся от очага поражения вдоль лимфатических сосудов. Поврежденная зона покрывается разрастаниями, напоминающими цветную капусту, с абсцессами и корками; в результате закупорки и фиброза лимфатических сосудов развивается слоновость. Диссеминация наблюдается редко, может поражаться головной мозг. При гистологическом исследовании в очагах поражения обнаруживают гранулемы. Внутри лейкоцитов или гигантских клеток могут располагаться округлые грибковые клетки темно-коричневого цвета.
Лабораторная диагностика. Особо ценным методом является микроскопическое исследование гистологических образцов пораженных тканей. Материал помещают в 10 %-ную KOH и исследуют под покровным стеклом для выявления округлых грибковых клеток. В посевах материала на среды обнаруживаются характерные типы спороношения. Иногда используют интратестикулярное заражение морских свинок.
Специфическая профилактика не разработана. Для лечения используют амфотерицин В (внутривенное и внутриочаговое введение), препараты йода, витамин D, флуцитозин.
При поверхностных микозах (дерматомикозах, дерматофитиях) патологический процесс локализуется преимущественно в коже и ее придатках (волосах, ногтях). К ним относятся кератомикозы, эпидермомикозы, трихомикозы. Возбудители кератомикозов паразитируют в поверхностных отделах рогового слоя эпидермиса, при этом они не вызывают видимой воспалительной реакции со стороны нижележащих слоев дермы (лишай отрубевидный, тропические микозы). Возбудители эпидермомикозов паразитируют в роговом слое эпидермиса, в ногтевых пластинках. Они вызывают выраженное воспаление со стороны нижележащих слоев кожи, обычно сопровождающееся аллергическими воспалениями на коже (рубромикоз, эпидермофития паховая, эпидермофития стоп). Возбудители трихомикозов паразитируют в волосах, эпидермисе, дерме, вызывая выраженную воспалительную реакцию, а также в ногтях. Выделяют истинные трихомикозы (пьедра, подмышечный трихонокардиоз) и трихоэпидермомикозы (микроспория, трихофития, фавус).
Лишай разноцветный (лишай отрубевидный). Возбудитель – дрожжеподобный гриб Pityrosporum orbiculare (Malasseria furfur). В чешуйках рогового слоя, обработанных едкой щелочью, элементы гриба представляют собой короткие, слегка изогнутые нити мицелия и скопления сферических толстостенных почкующихся клеток до 8 мкм в диаметре (фиалофоры). На среде Сабуро при температуре 37 °C на 4 – 8-й день появляются беловато-кремовые колонии с блестящей поверхностью, состоящие из почкующихся дрожжеподобных клеток. Заболевание мало контагиозно, наблюдается чаще у лиц молодого возраста при чрезмерной потливости, а также на фоне сахарного диабета, ожирения, длительных лихорадочных состояний. Очаги поражения локализуются на груди, спине, животе, шее и плечах, проявляясь в виде пятен (от пигментированных до коричнево-красных), сопровождаются шелушением.
Диагностика проводится микроскопическим методом. Лечение – местное.
Черный микоз (кладоспориоз). Возбудитель – Cladosporium werneckii – обнаруживается в роговом слое эпидермиса в виде коричневатого ветвящегося септированного мицелия и почкующихся клеток. Заболевание выражается в появлении на ладонной или подошвенной поверхности кожи пятен от светло-коричневого до почти черного цвета. Шелушение отсутствует.
Пьедра. Заболевание кутикулы волоса, характеризующееся образованием на волосе узелков белого или черного цвета.
Белая пьедра (трихоспороз), распространенная в виде спорадических случаев в Англии, Италии, Франции, США, Японии и других странах умеренного климата, вызывается Trichosporon beigelii (Trichosporon cutaneum). Этот гриб в узелках на волосах представляет собой мицелий шириной 4 – 8 мкм, образует артроспоры, имеющие прямоугольную, овальную или круглую форму, а также споры, располагающиеся скоплениями. Узелки локализуются на волосах подмышечной и паховой областей, на бороде и волосистой части головы.
Черная пьедра, наоборот, встречается в странах с жарким климатом; поражается волосистая часть головы. Возбудитель – Piedraia hortai – имеет аски, в которых находятся от 2 до 8 аскоспор размером от 5 до 80 мкм.
Лечение пьедры – местное (мытье головы раствором сулемы, мылом, вычесывание волос частым гребнем, сбривание волос и т. д.).
Рубромикоз (руброфития). Возбудитель этого микоза – Trichophyton rubrum – поражает кожу стоп, ногтевые пластинки пальцев стоп и кистей, крупные складки, кожу туловища и конечностей. На среде Сабуро вначале образуются белые пушистые колонии (реже кожистые, фиолетового цвета). Через 1 – 2 нед. на обратной стороне колоний появляется пигмент ярко-красного цвета, диффундирующий в питательную среду. Рост колоний может быть пушистым с пигментом или без пигмента и мучнистым без пигмента. При микроскопии культуры обнаруживаются тонкий мицелий, микроконидии грушевидной формы, реже овальные и палочковидные. Редко встречаются рудиментарные макроконидии.
Это один из наиболее частых возбудителей дерматомикозов, распространен в большинстве стран мира. Источник инфекции – больной, заболевание может носить семейный характер. Весьма часты ассоциации красного трихофитона с плесневыми грибами, кандидами, бактериальной флорой. Основной препарат для лечения – гризеофульвин, на фоне применения которого проводится местное лечение.
Эпидермофития паховая. При этом заболевании поражается кожа крупных складок поверхности тела, в процесс могут вовлекаться кожа стоп и ногтевые пластинки. Возбудитель – Epidermophyton floccosum. При микроскопическом исследовании чешуек пораженных участков кожи обнаруживаются переплетенный разветвляющийся короткий (2 – 4 мкм) мицелий и артроспоры прямоугольной формы, располагающиеся цепочками. На среде Сабуро вырастают колонии округлые, куполообразные или плоские, часто с углублением в центре. Их поверхность мучнистая, имеется радиальная складчатость, цвет – серый или желтовато-зеленый. При микроскопии культуры виден септированный мицелий с характерными тупоконечными макроконидиями, располагающимися в виде гроздей бананов или дубинок.
Возбудитель и заболевание распространены повсеместно, заболевание весьма контагиозно, чаще болеют мужчины. Поражается кожа паховых и межъягодичных складок, реже подмышечных складок и под молочными железами. Диагностика проводится микроскопическим методом и выделением культуры гриба. Лечение, в основном, местное (клотримазол, микозолон, низорал), а также гризеофульвин внутрь.
Эпидермофития стоп. Наряду с двумя выше названными возбудителями микоз стоп может вызывать Trichophyton interdigitale (T. mentagrophytes var. interdigitale). Он образует быстро растущие колонии, бархатисто-мучнистые, по периферии окруженные узким ободком из стелющихся по субстрату молодых побегов. Зрелые культуры густомучнистые, центр их куполообразный, складчатый или бугристый. Культуры могут быть очень разнообразны: пушистые, ровные и складчатые, бархатисто-мучнистые, иногда церебриформные. Цвет обычно белый, реже желтоватый, розоватый, красноватый, коричневатый. Под микроскопом в культурах виден длинный ветвистый септированный мицелий, на концах которого часто имеются длинные завитки и спирали, полиморфные интеркаларные хламидоспоры. Обильные микроконидии диаметром 2 – 3 мкм располагаются по бокам мицелия и на его концах. Нередко они располагаются гроздьями, чаще в гипсовидно-мучнистых культурах. Макроконидии довольно характерны: длина 20 – 30 мкм, ширина 5 – 7 мкм, поперечными перегородками разделены на 5 – 6 клеток, средние из них наиболее широкие.
Заболевание распространено повсеместно, передается от человека человеку чешуйками с пораженных участков кожи или ногтей больного. Диагностика проводится микроскопическим методом и посевом на среды с целью выделения чистой культуры гриба.
Лечение – в основном местное (клотримазол, микозолон, низорал и др.).
Трихофития – заболевание распространено практически повсеместно и может вызываться антропофильными и зоофильными трихофитонами различных видов. Важнейшими из них являются антропофилы Trichophyton tonsurans и T. violaceum. T. tonsurаns начинает расти на среде Сабуро на 4 – 5-й день, культура развивается медленно. Взрослая колония плотная, морщинистая, крупноскладчатая с пупкообразным или вдавленным центром, напоминающим кратер вулкана; или плоская, сухая с большим количеством трещин. Поверхность колонии может быть мелкопорошковатой, слегка припудренной, иметь различные оттенки окраски – от бело-серой до желтой и коричневой. При микроскопии культуры обнаруживаются обильные микроконидии длиной 3 – 7 мкм и мицелий. В молодых культурах иногда встречаются макроконидии. Проба на уреазу положительная.
T. violaceum на среде Сабуро дает колонии диаметром 2,5 – 3,0 см лишь к концу месяца. Поверхность колонии складчатая, кожистая, слегка маслянистая или матовая с хорошо ограниченными краями. Цвет колонии варьирует от насыщенного фиолетового до бледно-сиреневого, иногда окраска отсутствует вовсе. При микроскопии: мицелий длиной 2 – 4 мкм; в молодых культурах ветвистый мицелий редко септирован, но с возрастом нити приобретают частые перегородки. Клетки становятся более толстыми и короткими. В более старых культурах определяются свободно лежащие и интеркаларные хламидоспоры. Тест на уреазу положительный.
Из зоофильных трихофитонов наибольшее значение имеет T. mentagrophytes. Его рост на среде Сабуро начинается через 2 – 3 дня после посева, колония плоская, поверхность порошковатая, часто с сильно выраженной зернистостью. Цвет колонии белый, кремовый, иногда с нижней стороны коричнево-красный. Края колонии могут быть лучистыми. Иногда имеются мелкие морщинки. При микроскопии ветвящиеся нити мицелия имеют перегородки, часто закрученные в спирали. Микроконидии в основном круглые, реже грушевидные, располагаются по бокам гиф гроздьями. Макроконидии многокамерные (2 – 8 камер), размером от 8 до 40 – 50 мкм. В старых культурах обнаруживаются интеркаларно или терминально расположенные хламидоспоры. Одной из особенностей мицелия является образование штопорообразных гиф, реже спиралей. Проба на уреазу положительная.
Источником заражения антропофильными видами трихофитонов является больной человек, зоофильными – животные, реже человек. Инфицирование происходит через пораженные грибами волосы, чешуйки кожи и разрушающиеся ногтевые пластинки. Чаще болеют дети младшего и среднего возраста.
Патогенез и клиника. Развитию процесса способствуют мелкие повреждения рогового слоя кожи, повышенная потливость, длительный контакт с заразным материалом, ослабленный иммунитет, эндокринные нарушения. Поражаться может гладкая кожа, волосистая часть головы (поверхностная трихофития), при хронической трихофитии дополнительно могут поражаться ногти, глубокие слои кожи и даже внутренние органы. Пораженные трихофитонами волосы короткие (1 – 2 мм и короче), беловатые, сухие, ломкие, иногда в виде черной точки или запятой, находятся в мелкой чешуйке. Это главный признак заболевания.
Лабораторная диагностика. Патологический материал микроскопируют в капельке щелочи в неокрашенном препарате. Гриб в пораженном волосе встречается в виде спор и мицелия. Размеры и расположение их учитывают при дифференциальной диагностике. По отношению к волосу трихофитоны подразделяют на 3 группы: endothrix, у которых споры расположены только в волосе, это обычно антропофильные трихофитоны; ectothrix, когда обильные споры окружают волос и его основание (обычно зоофильные трихофитоны); neoendothrix, когда гриб располагается и в волосе, и вне его. По размерам спор различают крупноспоровые (диаметром 5 – 7 мкм) и мелкоспоровые (3 – 5 мкм) трихофитоны. У эндотриксов крупные круглые споры сплошь заполняют содержимое волоса, не выходят за его пределы, волос напоминает мешок с орехами. У эктотриксов крупные или мелкие споры несколькими слоями окружают основание волоса, создавая широкий (у крупноспоровых) или более узкий (у мелкоспоровых) футляр. Наряду со спорами, особенно в периферических частях волоса, можно встретить короткие или длинные цепочки из округлых спор, изредка обрывки распадающегося на споры мицелия.
В чешуйках кожи среди клеток эпидермиса отчетливо видны нити мицелия, разделенные перегородками на квадратные, прямоугольные и округлые сегменты размером 3 – 5 × 2 – 3 мкм; наряду с ними встречаются цепочки и кучки круглых или овальных спор диаметром 4 – 5 мкм. В ногтевых пластинках трихофитоны имеют вид ветвящегося мицелия, цепочек из округлых и многогранных спор, а также отдельных довольно крупных (5 – 8 мкм) двухконтурных клеток.
При необходимости для выделения культуры пораженный грибом материал высевают на среду Сабуро.
Специфическая профилактика не разработана. Для лечения применяют флюкостат, гризеофульвин, низорал (кетоконазол).
Микроспория. Возбудителями микроспории чаще всего являются зоофильный гриб Microsporum canis, вызывающий заболевание у кошек, собак и человека, и антропофильный гриб M. ferrugineum.
Колонии первично выделенной M. canis мощные, серовато-белые, в центре мучнистые, к периферии рыхло-пушистые. Музейные культуры – равномерно пушистые. Мицелий бамбуковидный, состоящий из утолщенных на одном конце ракетообразных клеток; крупные многоклеточные макроконидии в форме веретена одеты зубчато-ворсистой оболочкой; округлые хламидоспоры и мицелий, заканчивающийся в виде «гребешковых органов»; микроконидии немногочисленны. Патогенен для кроликов и морских свинок. Совершенные формы гриба не описаны.
M. ferrugineum имеет довольно широкие колонии, плоские или бугристые, кожистые, в центре куполообразные, редкими бороздками разделены на ряд выпуклых секторов. По цвету колонии желтоватые, коричневые, реже красноватые. Встречаются желтоватые строчковидные, восковидные, а также беловато-мучнистые мелкобугристые или складчатые колонии. В зрелых культурах мицелий широкий, имеются терминальные и интеркаларные хламидоспоры диаметром до 30 мкм, цепочки из полиморфных клеток. Макроконидии обычно отсутствуют, округлые микроконидии встречаются редко, главным образом в культурах мучнистых вариантов. Совершенная форма гриба называется Nannizia otae.
Люди, чаще дети, заражаются от больных бродячих животных или больных людей.
Патогенез и клиника. Поражаются кожа, волосы и очень редко ногти. Могут наблюдаться микроспорийные поражения бороды, бровей, ресниц; процесс начинается с поражения гладкой кожи. Распространению процесса по коже способствует мытье мочалкой, губкой. При зоонозной микроспории на волосистой части головы возникает один крупный очаг, в котором волосы обломаны на высоте 5 – 8 мм над поверхностью кожи. Пеньки волос покрыты чехлом из спор гриба. Вокруг такого очага могут быть множественные мелкие очажки. При антропонозной микроспории на гладкой коже появляются четко отграниченные множественные шелушащиеся округлые очаги розового цвета, иногда в виде вписанных друг в друга колец. В очагах поражения наряду с обломанными волосами имеются и непораженные.
Лабораторная диагностика. При микроскопии пораженный микроспорией волос имеет довольно характерный вид: многочисленные мелкие круглые споры гриба (диаметр 2 – 3 мкм) сплошь окружают волос в основании, тесно прилегая друг к другу в виде мозаики. Внутри волоса, в фолликулярной его части, можно обнаружить септированный мицелий, довольно густо заполняющий периферическую часть волоса. Иногда видна рыхлая мицелиальная бахромка, выступающая на периферическом конце волоса. В чешуйках гриб имеет вид тонких ветвящихся нитей с редкими, но отчетливо выраженными перегородками. Встречаются также цепочки мицелия, распадающиеся на споры. Споры гриба в пушковом волосе располагаются мозаично, вне волоса или же по типу эндотрикса, сплошь заполняя волос параллельными цепочками из мелких спор. Элементы гриба в ногте несколько более широкие, но в основном сходные с таковыми в кожной чешуйке.
Из материала, посеянного на среду Сабуро, получают культуру возбудителя и устанавливают вид гриба. Характерным признаком микроспории является зеленое свечение пораженных волос при люминесцентном освещении очага поражения в темном помещении.
Специфическая профилактика не разработана. Для лечения широко используются гризеофульвин, низорал (кетоконазол).
Фавус (парша). Заболевание распространено повсеместно, но в настоящее время встречается весьма редко. Возбудителем в подавляющем большинстве случаев является гриб Trichophyton schhnleini (Achorion schhnleini). Молодые колонии на среде Сабуро гладкие, голые, желтовато-белые, позднее становятся высокими, похожими на строчок или губку, крошковидной консистенции. Старые культуры сухие, морщинистые, высокие, темно-коричневые, иногда окружены белым лучистым ободком по периферии. Встречаются кратерообразные, гипсовидные, церебриформные, бархатисто-мучнистые варианты, а также культуры с глубокими отпрысками в питательную среду по краям и под самой колонией. При микроскопии в типичных культурах можно наблюдать широкий, отчетливо септированный мицелий с ветвлениями в виде рогов северного оленя или канделябров. На концах мицелия имеются крупные округлые хламидоспоры, а также тупоконечные длинные и широкие образования, напоминающие крупные веретена. Нередко видны булавовидные вздутия и широкие, слегка сплющенные клетки, похожие на шляпку гвоздя – «фавозные гвозди». В мучнистых колониях встречаются крупные грушевидные микроконидии, располагающиеся по бокам и на концах мицелия или вне его кучками.
При заражении лабораторных животных типичными культурами заболевание развивается лишь в 15 – 20 % случаев. Мучнистые варианты более патогенны.
Источником заражения людей, чаще всего ребенка, является больной фавусом человек; заражение происходит как при прямом контакте, так и через загрязненные предметы (расческа, полотенце).
Патогенез и клиника. Возбудитель поражает гладкую кожу, волосы и ногти. Характерным элементом служат скутулы – круглые, плоские или блюдечковидные, плотно спаянные с кожей образования желтого цвета, 2 – 3 см в диаметре, крошковидной консистенции, состоящие почти исключительно из грибных элементов и поврежденных эпидермальных клеток. Скутулы склонны сливаться друг с другом, образуя корки «канареечного», иногда зеленовато-желтого или желто-бурого цвета. Почти постоянным признаком фавозных скутул, особенно при обширных поражениях, является их характерный «амбарный», или «мышиный», запах, зависящий от присутствия в скутулах сопутствующих микроорганизмов. Пораженные грибом волосы продолжают длительное время оставаться длинными, сухими, мутными, сероватого цвета, прочно спаянными в толще скутулы.
Крайне редко поражаются лимфатические узлы, легкие, слизистая кишечника, кости и мозг.
Лабораторная диагностика. Характерным для возбудителя фавуса в волосе является полиморфизм элементов гриба: наряду с тонким (2 – 3 мкм) редко септированным мицелием попадается более широкий (4 – 6 мкм) мицелий, распадающийся на прямоугольные клетки с двухконтурной оболочкой. Одновременно с этим в волосе встречаются цепочки и кучки из круглых и многогранных спор, видны пузырьки воздуха и капельки жира. Волосы при фавусе никогда не заполняются сплошь элементами гриба. Для зрелой скутулы характерно обилие крупных многогранных и округлых спор, располагающихся беспорядочно кучками, реже короткими цепочками. Клеточных элементов кожи почти не видно. В пораженных ногтевых пластинках элементы гриба лежат неравномерно: одиночными клетками или короткими веточками мицелия, или весьма обильно в виде ветвящегося мицелия с цепочками полиморфных спор и кучками спор.
Выделение чистой культуры производится при посеве на среду Сабуро.
Специфическая профилактика и лечение. См. «Трихофития» в разделе «Трихомикозы».
Микозы, вызываемые условно-патогенными грибами
Условно-патогенные грибы относятся к различным родам и видам и обычно являются сапрофитами, обитающими в почве, воде, воздухе, на растениях, сырых стенах помещений, сельскохозяйственных продуктах, а также на коже и слизистых человека. Плесневые грибы, например, могут обитать на слизистой дыхательных путей, на коже наружного слухового прохода; дрожжеподобные грибы рода Candida входят в состав микрофлоры толстого кишечника, влагалища и дыхательных путей. К причинам, предрасполагающим к развитию таких микозов, можно отнести длительный контакт человека с возбудителем (сырое жилое помещение), иммунодепрессивные состояния, нерациональная антибиотико– и химиотерапия, приводящие к дисбактериозу и т. д. Такие микозы могут протекать как остро, так и хронически, в локальных формах и в генерализованных, приводя к летальному исходу. При возникновении условий, благоприятных для развития некоторых грибов в пищевых продуктах (злаках), в последних накапливаются токсины различной химической природы, обладающие выраженной термостабильностью (до 200 °C), способные вызвать пищевые (алиментарные) микотоксикозы (см. раздел «Биология патогенных грибов»).
Грибы рода Aspergillus развиваются на органических субстратах в почве, на растениях. Споры их постоянно попадают в воздух, а из него на продукты питания, предметы обихода, наружные покровы и слизистые человека.
Наиболее частыми возбудителями аспергиллеза являются следующие виды: A. fumigatus, A. flavus, A. niger, A. nidulans. При микроскопическом исследовании патологического материала обнаруживается характерный для гриба септированный мицелий толщиной 4 – 6 мкм. При исследовании ушной серы и мокроты можно обнаружить характерные конидиальные головки.
При исследовании культур аспергиллов виден септированный мицелий. От него в перпендикулярном направлении отходят ответвления – конидиеносцы, на концах которых имеются вздутия с выростами – стеригмами, продуцирующими конидии. Конидии могут быть гладкими или шероховатыми, округлой или овальной формы, светлых или темных тонов, что определяет цвет колонии. Совокупность везикулы со стеригмами и цепочками конидий называется головкой. У видов аспергилл, имеющих половой цикл развития, образуются аскоспоры, заключенные по 4 – 6 клеток в специальных сумках – асках, группирующихся внутри клейстокарпиев (клейстоцетиев) – замкнутых образований округлой формы, диаметром 80 – 350 мкм, светло-желтого, оранжевого или ржаво-коричневого цвета, лежащих на поверхности или внутри субстрата.
Характер строения головки, конидиеносца, стеригм, асков и аскоспор лежит в основе характеристики и классификации аспергиллов.
Аспергиллы – аэробы, хорошо растут на средах Сабуро и Чапека, температурный оптимум роста 23 – 26 °C. Морфология и динамика развития колонии зависят, прежде всего, от вида аспергилла, но колонии обычно бархатистые и пигментированные за счет воздушного мицелия.
Больные аспергиллезом люди не заразны для окружающих. Инфицирование происходит почти исключительно ингаляторным и реже алиментарным путем, изредка контактным путем при повреждении кожи и слизистых оболочек и попадании на них спор гриба. Важное место занимает также аутоинфекция в результате биологической активации аспергиллов, обитающих на покровах организма. При использовании пищевых продуктов или кормов, содержащих токсины-метаболиты – афлатоксины, продуцируемые некоторыми штаммами A. flavus и A. parasiticus, возникают афлатоксикозы. Токсичность афлатоксинов исключительно высока.
Патогенез и клиника. Аспергиллез развивается чаще вторично на фоне какоголибо хронического заболевания, у здорового человека первичный аспергиллез развивается лишь при введении массивных доз возбудителя. При благоприятных условиях аспергиллы внедряются в ткани, где, размножаясь, дают начало развитию микотического процесса. Чаще поражается бронхолегочная система, реже – наружное ухо, слизистая и придаточные пазухи носа, миндалины. Патологический процесс может быть локальным (аспергиллома легких) и распространенным (трахеобронхит). Иногда наблюдается гематогенное распространение инфекции, и возможно развитие генерализованной формы, при которой поражаются различные внутренние органы (головной мозг, печень) и глаза.
Лабораторная диагностика. Убедительным основанием для установления диагноза является обнаружение мицелия и характерных органов спороношения гриба (конидиеносцев) в биоптатах тканей, особенно если они взяты из закрытых полостей, невскрывшихся абсцессов. Тем более доказательным является получение чистой культуры гриба при высеве материала на питательные среды. В ряде случаев для уточнения диагноза прибегают к аллергической (кожной и ингаляционной) пробе, реакции преципитации по Оухтерлоню с аспергиллезным антигеном. Диагностическое значение имеет также резко повышенный титр IgE в сыворотке больного.
Специфическая профилактика не разработана. Для лечения используют амфотерицин В, амфоглюкамин, интраконазол.
Кандидоз (кандидомикоз) – инфекционное заболевание кожи, слизистых оболочек и внутренних органов, вызываемое дрожжеподобными грибами рода Candida. Распространен повсеместно, чаще встречается в тропиках и субтропиках.
В подавляющем большинстве случаев возбудителем является C. albicans, гораздо реже C. tropicalis и другие виды. Род Candida включает свыше 100 видов, имеющих округлые, овоидные, цилиндрические или удлиненные, иногда неправильной формы клетки, размножающиеся обычно многополюсным почкованием. Псевдомицелий – цепочки из удлиненных клеток – встречается у большинства видов, некоторые из них (C. albicans) образуют терминальные хламидоспоры. Род объединяет гетерогенную группу аспорогенных дрожжей, стабилизировавшихся в гаплоидном состоянии и потерявших способность к спариванию с последующим образованием половых спор. Они являются аэробами, для питания используют белки, пептоны и аминокислоты. Они хорошо растут на кровяных и сывороточных средах, на гидролизате дрожжей. Усваивают углеводы (глюкозу, левулозу, лактозу, мальтозу); пентозы малопригодны. Хорошо растут на отварах из картофеля и моркови, риса и кукурузы, на пивном сусле. Чаще всего выращивают на среде Сабуро. Лучше всего растут при температуре 30 – 37 °C и рН 6,0 – 6,8. Колонии C. albicans на сусло-агаре круглые, сметанообразные, беловатые, диаметром до 1 см, выпуклые, блестящие, обычно гладкие, с ровными краями и глубоким врастанием в среду ветвистого древовидного псевдомицелия. Бластоспоры (почки) располагаются нерегулярно по обеим сторонам мицелия. Хламидоспоры круглые, крупные (10 – 20 мкм), двухконтурные. C. albicans сбраживает глюкозу, мальтозу, левулезу и частично галактозу; молоко не изменяет. Патогенна для лабораторных животных.
Патогенез и клиника. Как правило, кандидоз развивается как типичная аутоинфекция и является сопутствующим заболеванием или осложнением при любой патологии, приводящей к иммунодефициту. Дисбактериоз, как следствие нерациональной антибиотикотерапии, лечения кортикостероидами, часто проявляется в форме кандидоза. Сахарный диабет и другие эндокринопатии, гиповитаминозы могут сопровождаться кандидозом. Наиболее подвержены кандидозу дети и пожилые люди.
Различают поверхностный кандидоз слизистых оболочек, кожи, ногтевых валиков и ногтей; хронический генерализованный (гранулематозный) и висцеральный кандидоз, а также аллергические формы кандидоза. Кандидоз слизистых оболочек (полости рта, влагалища) называют молочницей, так как на слизистой возникает налет, напоминающий свернутое молоко. Хронический генерализованный кандидоз обычно развивается у детей с иммунодефицитными состояниями, постепенно прогрессирует, возникают пневмонии, гастриты, гепатиты и др. При висцеральном кандидозе страдают желудочно-кишечный тракт, органы дыхания, мочевыделительная система, ЦНС. На фоне имеющегося первичного очага кандидомикоза развивается сенсибилизация всего организма, и при этом могут возникать аллергические формы кандидоза, когда появляются новые очаги воспаления, но возбудитель в них отсутствует (левуриды, или кандидамикиды).
Лабораторная диагностика. При поверхностных формах кандидоза диагноз подтверждается неоднократным обнаружением возбудителя в патологическом материале (наличие псевдомицелия) и выделением его в чистой культуре. При висцеральном кандидозе применяют серологические реакции (агглютинации и РСК) и кожную аллергическую пробу с кандида-аллергеном.
Специфическая профилактика не применяется. Для лечения всех форм кандидоза используют флюкостат по специальным схемам. Применяют также нистатин, леворин, амфоглюкамин, амфотерицин B, флуцитозин, низорал. В ряде случаев эффективна аутовакцинотерапия.
Возбудителями фикомикоза являются различные виды грибов родов Rhizopus, Mucor, Absidia, объединенных в семейство Mucoraceae класса Phycomycetes (Zygomycetes). Они широко распространены в природе, выделяются из почвы, навоза, воздуха, с гниющих частей растений, плодов и др.
При микроскопии патологического материала (мокроты, гноя) обнаруживаются разветвленные широкие несептированные нити мицелия, лишь в мокроте и отделяемом из ушей можно обнаружить спорангии. Для этих грибов характерно наличие хорошо развитого мицелия, не разделенного перегородками. К субстрату мицелий прикрепляется специальными ответвлениями – ризоидами. Спорообразование эндогенное, споры образуются в шаровидных (грушевидных) спорангиях диаметром до 200 мкм, они одноклеточные, обычно шаровидные или овальные. Спорангий находится на конце спорангиеносца (ножки), от которого отделяется перегородкой, от последней внутрь спорангия отходит выпячивание – столбик. Он бывает шаровидным, грушевидным и яйцевидным. У некоторых грибов этого семейства воздушный мицелий имеет вид дугообразно изогнутых пучков гиф – столонов. Наличие и форма столонов, ризоидов и столбиков положены в основу характеристики рода. Описаны более 200 видов семейства Mucoraceae, однако лишь немногие из них известны как возбудители фикомикоза.
Грибы этого семейства – аэробы, хорошо растут при температуре 22 – 37 °C на простых питательных средах и среде Сабуро. Колонии обычно пушистые, вначале белые, затем темно-серые (Absidia corymbifera); на поверхности субстрата образуется обильный темно-бурый мицелий в виде длинных (до 3 см) столонов, от которых пучками (по 2 – 3) отходят длинные (до 5 мм) спорангиеносцы и ризоиды (Rhizopus nigricans); образуются внутрисубстратный мицелий, длинные (до 15 мкм), сплетающиеся в виде войлока спорангиеносцы (Mucor mucedo).
Фикомикоз считается сравнительно редким заболеванием. В организм человека споры проникают аэрогенным, реже алиментарным путем, их можно обнаружить на слизистой носа, на коже. Фикомикоз не контагиозен, от человека человеку не передается.
Патогенез и клиника. Заболевание, как правило, развивается вторично у лиц со сниженной реактивностью (иммунодефициты), при тяжелом сахарном диабете, при обширных ожогах, лейкозе, лимфомах. Зигомицеты проникают через стенки кровеносных сосудов и размножаются внутри сосудов, вызывая развитие тромбоза. Это происходит чаще всего в легких, пазухах носа, желудочно-кишечном тракте и приводит к возникновению ишемического некроза в окружающих тканях с образованием интенсивного полиморфноядерного инфильтрата. При гематогенной диссеминации может развиваться менингоэнцефалит. Прогноз серьезный.
Лабораторная диагностика проводится микроскопическим методом. В гистологических препаратах грибы имеют вид широких несептированных нитей мицелия неравномерной толщины, которые располагаются в тромбированных сосудах или синусах, и окружены зоной скопления лейкоцитов и гигантских клеток. В ряде случаев полезным может оказаться выделение чистой культуры при посеве материала из глубоких слоев тканей.
Специфическая профилактика не разработана. Для лечения используют хирургическое вмешательство в сочетании с амфотерицином В, интраконазолом, нистатином.
Еще до недавнего времени возбудителя – Pneumocystis carinii – относили к простейшим, сейчас установлено, что он является дрожжевым грибом класса Blastomycetes.
Наиболее характерной структурой является «розетка», состоящая из 8 грушевидных спорозоитов, каждый из которых имеет размеры 1 – 2 мкм, объединенных в цистоподобную структуру диаметром 7 – 10 мкм. Более ранние стадии развития представлены 1 – 4 ядрами в слизистом шаровидном образовании, которые при интенсивной окраске по Романовскому – Гимзе окрашиваются соответственно в красный (ядро) и голубой цвет (цитоплазма) и окружены красно-фиолетовой оболочкой. Пневмоцисты находятся в большом количестве в легочных альвеолах и бронхиолах (в трупном материале), где они окружены пенистым веществом и скоплениями плазматических клеток и эозинофилов. Некоторые микроорганизмы могут находиться внутри гистиоцитов.
Возбудитель не растет на искусственных питательных средах. Делались попытки выделить возбудителя с помощью легочной модели на мышах или крысах, которым предварительно вводится кортизон.
Пневмоцисты широко распространены в природе среди животных (крысы, мыши, собаки), но обычно не вызывают заболеваний. У людей они могут вызывать интерстициальную пневмонию. Заражение происходит в результате вдыхания цист, поступающих в воздух от домашних животных, грызунов и от взрослых людей, которые являются носителями данных микроорганизмов. В большинстве случаев инфекция у людей протекает бессимптомно.
Патогенез и клиника. Заболевание развивается на фоне резко ослабленного иммунитета, что, например при ВИЧ-инфекции, и служит одной из главных причин смерти больных. Часто заболевают лица, длительное время принимающие цитостатики, иммунодепрессанты, кортикостероиды, антибиотики, а также страдающие агаммаглобулинемией. В результате развивается интерстициальная плазмоклеточная пневмония (подтверждаемая рентгенологически), при этом альвеолы заполнены пневмоцистами и пенистым материалом, что приводит к блокированию дыхательной поверхности альвеол.
Лабораторная диагностика основана на обнаружении возбудителя в легочной ткани, полученной при пункционной биопсии или (чаще) в секционном материале.
Специфическая профилактика не разработана. Для лечения используются пириметамин и изотионат пентамидина.
Патогенные простейшие
Простейшие, или протисты, являются наиболее примитивно организованными, состоящими из единственной клетки животными, относящимися к эукариотам. Они достаточно подробно изучаются в курсе медицинской биологии. Простейшие имеют микроскопические размеры и могут вызывать различные паразитарные заболевания у человека, поэтому они являются предметом изучения и медицинской микробиологии. В настоящей главе основное внимание уделено особенностям морфологии возбудителя и лабораторной диагностике протозойных инфекций.
Простейшие представляют собой как гетеротрофные, так и аутотрофные одноклеточные организмы, которые могут быть одноядерными или многоядерными (иногда только на определенных стадиях их жизненного цикла) и в ряде случаев образуют колонии. В настоящее время известно около 30 000 видов простейших. Они обитают повсюду, где есть влажная среда. Около 3500 видов простейших ведут паразитический образ жизни, обитая в различных тканях и органах человека, животных и растений, и способны вызывать тяжелые заболевания.
Простейшие устроены в основном так же, как и любые эукариотические клетки. Хотя у них встречаются различные отклонения в морфологии клеточных органелл, форма и число их такие же или близкие к наблюдаемым в клетках многоклеточных. Лишь немногие специализированные органеллы простейших не встречаются у более высокоразвитых организмов.
Как и в любой животной клетке, обязательной и важнейшей составной частью клетки простейших является ядро. Оно слагается из тех же компонентов, что и ядра клеток многоклеточных организмов, окружено типичной двуслойной мембраной, пронизанной многочисленными порами. В цитоплазме сосредоточены все жизненно необходимые органеллы. Обычно в цитоплазме простейших обособляются два слоя: тонкий наружный слой – эктоплазма, более плотная и гомогенная, и внутренний, или эндоплазма, имеющая более жидкую консистенцию. Нередко самый поверхностный слой эктоплазмы еще более плотный и образует периферическую пленку, или пелликулу. Она представляет собой мембрану, утолщенную и усложненную дополнительными структурами, что придает ей механическую прочность, позволяя выполнять защитную функцию и придавать клетке более или менее постоянную форму. Кроме того, у некоторых простейших имеются парные фибриллы и минеральный скелет.
Передвигаются простейшие либо с помощью псевдоподий – временных выростов цитоплазмы, либо с помощью жгутиков или ресничек. Размножаются половым или бесполым путем: в основе того и другого лежит деление ядра. В основе бесполого размножения лежит митоз; половое размножение сводится к слиянию двух генеративных ядер, прошедших редукционное деление и содержащих гаплоидный набор хромосом.
При неблагоприятных условиях простейшие перестают питаться, теряют органеллы, округляются и покрываются толстой оболочкой, что сопровождается затуханием жизненных процессов: образуется циста. Процесс инцистирования является защитной реакцией, возникшей в ходе эволюции. Именно цисты играют большую роль в распространении протозойных инфекций.
До недавнего времени простейшие рассматривались как один из типов животного мира. Сейчас царство животных подразделяют на два подцарства: одноклеточных и многоклеточных. В свою очередь, одноклеточных (простейших) подразделяют на 5 самостоятельных типов, отличающихся по внутренней организации: саркожгутиконосцы (Sarcomastigophora), споровики (Sporozoa), книдоспоридии (Cnidosporidia), микроспоридии (Microsporidia) и реснитчатые, или инфузории (Ciliophora). Термин Protozoa означает подцарство. Следует подчеркнуть, что эта классификация также далека от совершенства, так как не учитывает в полной мере, например, характер размножения или особенности строения органелл движения, что учитывалось в предыдущей классификации, по которой тип простейших делили на 4 класса (споровики, жгутиковые, саркодовые и инфузории). Видимо, по мере накопления новых данных о простейших их классификация в будущем значительно изменится.
Entamoeba histolytica относится к типу Sarcomastigophora, классу Sarcodina (корненожек), была открыта Ф. Лешем и Ф. Шаудином в 1875 г., вызывает типичную кишечную инфекцию – амебиаз. Известно, что в кишечнике человека паразитируют шесть видов амеб. Пять видов обитают в просвете кишечника, питаются бактериями и не оказывают патогенного действия на организм человека. Один же вид – патогенная (ранее называемая дизентерийной) амеба – при определенных условиях может вызывать довольно тяжелое заболевание. У человека патогенная амеба может существовать в трех формах.
1. Вегетативная малая форма (просветная) – forma minuta.
2. Вегетативная крупная форма (тканевая) – forma magna.
3. Циста (рис. 114).
У большинства заразившихся амебы обитают в просвете толстой (слепой) кишки в виде вегетативной просветной формы, которая в нижних отделах кишечника превращается в цисту и выводится с испражнениями наружу. У незначительного числа инфицированных амеба проникает в слизистую толстой кишки, превращается в крупную тканевую форму, способную фагоцитировать эритроциты и ими питаться. Крупная вегетативная форма (эритрофаг) имеет размер 30 – 40 мкм, толчкообразно движется с помощью тупых широких эктоплазматических псевдоподий (ложноножек), которые возникают внезапно. Псевдоподии могут увеличиваться в одном направлении за счет непрерывного поступления, как бы переливания в них цитоплазмы (амеба принимает форму языка), в результате чего осуществляется поступательное движение. Ядро сферическое, размером 3 – 7 мкм. На свежих препаратах ядро видно лишь при фазово-контрастной микроскопии. При окрашивании гематоксилином хроматин ядра в виде мелких глыбок темно-бурого цвета сконцентрирован на внутренней поверхности ядерной оболочки, так что при микроскопии представляется в виде сплошного зубчатого кольца. В центре ядра – маленькая кариосома. В цитоплазме может быть обнаружено до 20 эритроцитов и более, которые гематоксилином окрашиваются в черный цвет. Бактерии эта форма не фагоцитирует. Способность патогенной амебы фагоцитировать эритроциты в кишечнике является характерным признаком и позволяет отличать ее от других видов амеб кишечника.
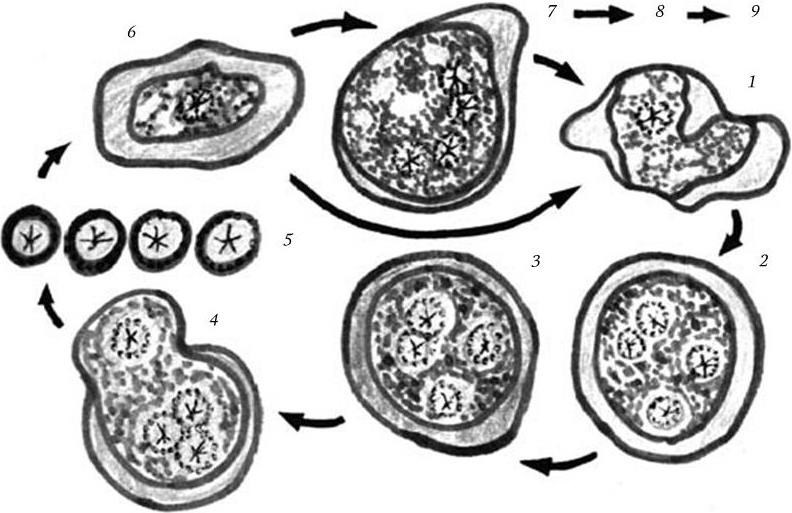
Рис. 114. Цикл развития патогенной амебы:
1 – в просвете кишки; 2 – циста; 3 – цисты во внешней среде; 4 – эксцистирование; 5, 6 – вегетативные формы амебы (5 – forma minuta; 6 – forma magna); 7 – амеба в стенке кишки; 8 – амеба в токе крови; 9 – абсцесс печени
Малая (просветная) форма имеет размеры 15 – 20 мкм, и общее ее строение аналогично строению большой вегетативной формы, основные отличия – меньшая активность и отсутствие фагоцитированных эритроцитов. Иногда в цитоплазме можно обнаружить небольшое число бактерий. При сгущении испражнений подвижность прекращается, амебы округляются и напоминают одноядерные цисты без оболочки (предцистные формы).
Цисты правильной шаровидной формы, иногда слегка вытянуты, диаметр 8 – 15 мкм. Хорошо заметна бесцветная оболочка. Зрелые цисты содержат 4 ядра, имеющих такое же строение, как ядра вегетативной формы. Незрелые цисты имеют одно, два, три ядра и вакуоль, содержащую гликоген. В свежем препарате ядра едва заметны; они хорошо выявляются при обработке препарата раствором Люголя и при окраске гематоксилином. У некоторой части цист содержится одно или несколько хроматоидных телец, имеющих вид коротких толстых палочек с тупыми концами, слабо заметных в свежем препарате и окрашивающихся гематоксилином в черный цвет.
Просветная и тканевая формы очень нестойки во внешней среде и в испражнениях погибают через 20 – 30 мин. Цисты сохраняют жизнеспособность в течение 1 мес. в испражнениях и во влажной среде, на продуктах – в течение нескольких дней. Погибают при кипячении.
При выращивании на искусственных средах удается получить рост вегетативных форм. Интенсивный рост происходит на средах, богатых питательными веществами, при частичном анаэробиозе при температуре 37 °C и рН 7,0.
Источник инфекции – человек, выделяющий с испражнениями цисты (больной в стадии ремиссии, реконвалесцент, носитель). Выделение цист может продолжаться годами. Механизм заражения – фекально-оральный, цисты попадают в организм здорового через питьевую некипяченую воду, продукты, грязные руки, предметы обихода.
Патогенез и клиника. После эксцистирования амебы неопределенно долго могут обитать в толстом кишечнике. Патологический процесс возникает в результате проникновения в стенку толстой кишки. Переход носительства в болезнь определяется нарушением иммунного статуса организма, изменениями состава бактериальной флоры, а также вирулентностью штамма возбудителя. Поражается преимущественно слепая кишка, реже сигмовидная и прямая кишка. Гематогенным путем амебы попадают в печень и другие органы, вызывая образование абсцессов. Для типичного течения заболевания характерны понос с примесями слизи и крови, схваткообразные боли в животе, болезненные тенезмы, стул – до 15 раз в сутки. Возможна перфорация кишечника с последующим развитием перитонита.
Лабораторная диагностика основана на обнаружении тканевой формы с эритроцитами (патогномоничный признак) или характерных четырехъядерных цист в испражнениях больного. В качестве консерванта испражнений при их пересылке для исследования используют поливиниловый спирт. Изредка для подтверждения диагноза используют серологический метод (латекс-агглютинация, встречный иммуноэлектрофорез и др.).
Специфическая профилактика не разработана. Для лечения используют метронидазол (трихопол, метрогил), делагил, тетрациклин, мономицин, эмитин, аминарсон, осарсол, энтеросептол.
Возбудитель лямблиоза – Lamblia intestinalis (Giardia lamblia) – был открыт в 1859 г. Д. Ф. Лямблем. Лямблии относятся к типу жгутиконосцев. В организме человека обитают в двенадцатиперстной и тощей кишке в вегетативной форме (трофозоит) (рис. 115, 4) и в виде цисты. Вегетативная форма плоская, грушевидная или сердцевидная с округлым передним и заостренным хвостовым концом, обладает билатеральной симметрией, имеет размеры в длину 9 – 18 мкм и в ширину 5 – 10 мкм. Тело покрыто пелликулой. На брюшной стороне расширенной части тела имеется присасывательный диск, служащий для прикрепления к клеткам кишечного эпителия. Посередине тела до самого заднего конца проходит двойной аксостиль, состоящий из двух эластичных нитей, начинающихся от базальных телец. В средней, широкой части расположены два ядра с четко различимыми центральными кариосомами (ядрышками). Имеются одно или два парабазальных тельца.
Очень характерны колебательные, или танцующие, движения лямблии в свежих препаратах. Органами движения служат 4 пары жгутиков: одна пара отходит от заднего конца тела, остальные – снизу и с боков.
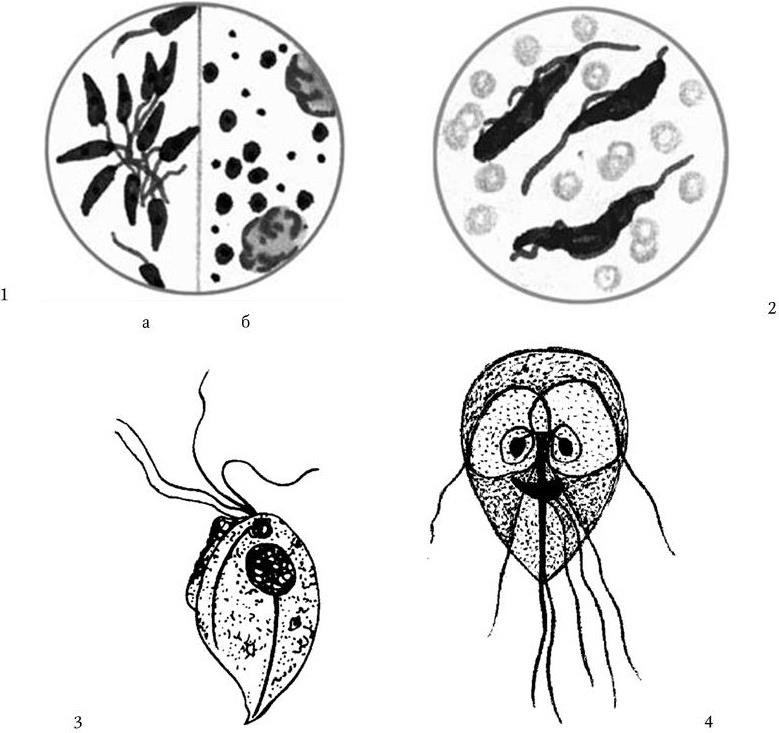
Рис. 115. Морфология простейших:
1. Лейшмании (а – промастигота в культуре, б – амастигота в тканях). 2. Trypanosoma gambiense, мазок крови. 3. Trichomonas vaginalis. 4. Lamblia intestinalis, вегетативная форма
Специализированных органов питания нет, лямблии питаются через оболочку клетки.
При попадании паразитов в толстый кишечник происходит их дегидратация, и они превращаются в цисты: утрачиваются жгутики, форма становится овальной, образуется плотная оболочка, происходит деление ядра. Цисты лямблий имеют размеры 8 – 16 мкм и два (незрелые цисты) или четыре (зрелые цисты) ядра, смещенные к одному из полюсов. Лямблии не растут на искусственных питательных средах. Лямблии могут паразитировать в кишечнике человека, обезьян и свиней. Обычно источник инфекции – больной человек или паразитоноситель, которые с испражнениями в течение суток могут выделять несколько миллиардов цист.
Лямблиоз встречается повсеместно, лямблии выявляются у 10 – 12 % практически здорового взрослого населения и у 50 – 80 % детей. Заражение здоровых людей происходит фекально-оральным путем, факторами передачи являются вода, пища, предметы обихода, грязные руки. Инвазивны только цисты лямблий, довольно устойчивые во внешней среде.
Патогенез и клиника. Лямблии, попавшие в организм человека, размножаются в огромных количествах и заселяют слизистую двенадцатиперстной и тощей кишки, иногда полностью покрывая ворсинки. Это приводит к нарушению перистальтики, процессов пристеночного пищеварения и всасывания. При этом выделяются эндогенные факторы воспаления (гистамин, серотонин, простагландины) и аллергические продукты метаболизма возбудителя. Развивается дисфункция кишечника (жгутиковая, или лямблиозная, диарея), испражнения обильные, имеют крайне неприятный запах, могут иметь примесь крови. В процесс могут вовлекаться желчевыделительные пути и желчный пузырь (холангит и холецистит), а также поджелудочная железа. В нарушении секреторной и двигательной функции кишечника, поджелудочной железы и желчного пузыря играет роль расстройство их регуляции пептидными гормонами (секретин, панкреозимин). У лиц с дефицитом IgA заболевание протекает хронически, с обострениями и ремиссиями. В большинстве случаев лямблиоз может протекать бессимптомно. При лямблиозе развивается клеточный и гуморальный иммунитет, сохраняющийся 2 – 6 мес. после излечения.
Лабораторная диагностика. Диагноз основывается на обнаружении цист в оформленных испражнениях или цист и вегетативных форм в жидких испражнениях. Препараты рассматривают в микроскопе в нативном виде или после обработки раствором Люголя. При наличии признаков холангита и холецистита наилучший результат дает микроскопия дуоденального содержимого, полученного при зондировании; обнаруживаются вегетативные формы. Следует учитывать, что в испражнениях выделение паразита может быть непостоянным, поэтому требуются повторные их исследования. Иногда используют серологическое исследование: титры специфических антител, выявляемых в непрямой РИФ, выше при клинически выраженном лямблиозе.
Специфическая профилактика не разработана. Для лечения используют трихопол (метронидазол), тинидазол (фазижин), хинакрина гидрохлорид (атабрин), фуразолидон, аминохинол, акрихин.
Лейшмании были открыты в 1898 г. русским военным врачом П. Ф. Боровским (возбудитель кожного лейшманиоза) и в 1903 г. У. Лейшманом и Ш. Донованом (возбудитель висцерального лейшманиоза). В настоящее время известны около 20 видов и подвидов лейшманий. Они относятся к типу Sarcomastigophora, для них характерен сложный жизненный цикл, проходящий в организме двух хозяев, одним из которых является позвоночное (в том числе человек), второй хозяин и переносчик – москиты родов Phlebotomus (Европа, Азия, Африка) и Lutzomyia (Америка). В организме человека и позвоночных лейшмании развиваются внутриклеточно в виде амастиготы (безжгутиковая, или лейшманиальная, или тканевая, форма, см. рис. 115, 1б) в свободных макрофагах или клетках системы мононуклеарных фагоцитов. Амастиготы представляют собой мелкие овальные клетки размером 1 – 3 × 2 – 6 мкм с расположенным сбоку овальным ядром и хорошо видимым палочковидной формы кинетопластом. В просвете кишечника переносчика-москита и в культуре на питательной среде безжгутиковые формы превращаются в подвижные жгутиковые промастиготы (лептомонадная форма, см. рис. 115, 1а). Они имеют веретенообразную вытянутую форму, размеры 4 – 6 × 10 – 20 мкм и жгутик, отходящий от кинетопласта. При окраске по Романовскому – Гимзе цитоплазма амастиготы и промастиготы окрашивается в голубой или голубовато-фиолетовый цвет, а ядро, кинетопласт и жгутик – в красный или красно-фиолетовый цвет.
Лейшмании могут быть выращены на питательных средах (например, на среде NNN, содержащей дефибринированную кровь), на хорион-аллантоисной оболочке куриного эмбриона, а также в культуре клеток. На питательной среде через 3 – 4 дня при температуре 23 °C образуются мелкие прозрачные колонии, состоящие из промастигот. В старых культурах жгутик утрачивается.
Различают кожный и висцеральный лейшманиозы и несколько их разновидностей. Патогенез и особенно клиника могут иметь существенные отличия. При этом практически отсутствует разница в морфологии возбудителя, хотя обнаружены значительные штаммовые различия в вирулентности, тропизме к тканям, а также в биологических, эпидемиологических свойствах и чувствительности к антипротозойным препаратам.
Антропонозный кожный лейшманиоз Старого Света (поздно изъязвляющийся кожный лейшманиоз, ашхабадка, сухая форма, городская форма, «годовик»). Возбудитель – L. tropica minor. Встречается на севере Африки, юге Европы, на Ближнем Востоке, в Средней Азии, Индии, Пакистане. Источник инфекции – больной человек, заражение происходит трансмиссивным путем при укусе москитов рода Phlebotomus. Инкубационный период до 3 – 15 мес. Возбудитель размножается в месте внедрения, вначале образуется папула, которая увеличивается, через 3 – 6 мес. покрывается корочкой и изъязвляется. Далее язва покрывается грануляциями и к концу 12 мес. рубцуется. Язвы чаще локализуются на лице и конечностях, их количество от 1 – 3 до 8 – 10. Общая реакция организма выражена слабо. После перенесенной болезни остается стойкий иммунитет.
Зооантропонозный кожный лейшманиоз Старого Света (рано изъязвляющийся кожный лейшманиоз, острая мокнущая, некротизирующая форма; пендинская язва; пустынно-сельский кожный лейшманиоз). Встречается в Южной и Средней Азии, иногда в Африке. Возбудитель – L. tropica major. Переносчик – Phlebotomus papatasi; резервуаром возбудителя является большая песчанка, заболевание имеет выраженный природно-очаговый характер. Инкубационный период 7 – 45 дней. Появляется воспалительный инфильтрат, через 1 – 2 нед. он изъязвляется. Вокруг него часто отмечаются вторичные множественные бугорки со склонностью к изъязвлению. Рубцевание начинается через 2 – 4 мес. и заканчивается через 6 – 7 мес. Процесс локализуется чаще на нижних конечностях, реже на туловище и лице. Остается стойкий иммунитет.
Кожно-слизистый лейшманиоз Нового Света (эспундия). Мексиканский лейшманиоз вызывается L. mexicana, бразильский – L. brasiliensis, перуанский – L. peruviana. Резервуар возбудителя инвазии – грызуны, многие дикие и домашние животные; заболевание – типичный природно-очаговый зооантропоноз. Переносчики – москиты рода Lutzomyia. Инкубационный период – от 2 нед. до 3 мес. На месте укуса образуются глубокие язвы, в процесс вовлекаются слизистые, лимфатические сосуды и узлы. Могут развиваться грубые рубцовые изменения носа, ушных раковин, носоглотки, гортани, половых органов, часты бактериально-септические осложнения. Течение длительное, прогноз серьезный.
Индийский висцеральный лейшманиоз (кала-азар). Регистрируется в Индии, Пакистане, Бангладеш, Китае, Непале. Возбудитель – L. donovani. Источник инфекции – больной человек, переносчики – москиты рода Phlebotomus. Из места укуса возбудитель гематогенным путем проникает в селезенку, печень, костный мозг, лимфатические узлы, размножается в клетках системы мононуклеарных фагоцитов. В пораженных органах развиваются воспалительные, дистрофические и некротические изменения. При гибели лейшманий и в процессе их метаболизма образуются токсические вещества, обусловливающие общую интоксикацию и специфическую сенсибилизацию. Инкубационный период 6 – 8 мес. У заболевшего увеличивается селезенка, нарастает слабость, отмечается длительная волнообразная лихорадка, кожные покровы приобретают темный цвет. Прогрессирует похудание, нарастают анемия и агранулоцитоз, развиваются отеки и асцит, кровоизлияния, появляются кожные высыпания – лейшманоиды. На фоне кахексии наступает смерть. Прогноз серьезный. После перенесенного заболевания развивается стойкий иммунитет.
Средиземноморский висцеральный лейшманиоз. Встречается на Ближнем Востоке, в Казахстане, Средней Азии, Закавказье, странах Средиземноморья. Возбудитель – L. donovani infantum. В городах источник инфекции – собаки, в природных очагах – лисы, шакалы. Переносчики – москиты рода Phlebotomus. К этой форме лейшманиоза очень близок американский висцеральный лейшманиоз, возбудителем которого является L. donovani chagasi. Распространен в странах Южной Америки, источник инфекции – человек, собаки и хищники. Инкубационный период 20 – 180 дней, на месте укуса москита иногда появляется папула. Клиника болезни напоминает кала-азар, но кожа никогда не темнеет, нет кожных лейшманоидов, иногда заболевание протекает остро.
Восточно-африканский висцеральный лейшманиоз. Регистрируется в Кении и Судане, возбудитель – L. donovani archibaldi, переносчики – москиты рода Phlebotomus, источник инфекции – человек, хищники и грызуны. Клинической особенностью является частое развитие папулы на месте укуса москита, позднее – появление кожных лейшманоидов, рецидивирующее течение заболевания.
Лабораторная диагностика. При кожных формах лейшманиоза исследуют соскобы с очагов поражения, биоптаты ткани, пунктат лимфатических узлов. При висцеральном лейшманиозе исследуют кровь, пунктаты костного мозга, печени, селезенки, лимфатических узлов, иногда корочки со слизистой оболочки носа. В препаратах, окрашенных по Романовскому – Гимзе, обнаруживают внутриклеточно расположенные амастиготы. Используют также выделение чистой культуры, заражение лабораторных животных (белые мыши, хомячки). В ряде случаев прибегают к серологическому исследованию (РПГА, непрямая РИФ и др.). Эти реакции недостаточно специфичны и могут давать перекрестные реакции при инфекции, вызванной Trypanosoma cruzi. Реакция Напье является неспецифическим тестом при кала-азаре и обусловлена повышением уровня сывороточных глобулинов: при добавлении 1 капли формалина к 1 мл сыворотки больного образуется опалесцирующий гель (альдегидная реакция). При эпидемиологических исследованиях широко применяют кожные аллергические тесты, положительные результаты которых указывают на наличие в прошлом контакта с лейшманиями (реакция Монтенегро).
Специфическая профилактика и лечение. Для профилактики зооантропонозного кожного лейшманиоза иногда используется живая культуральная вакцина, которая вводится не позднее чем за 3 мес. до выезда в эндемичные районы. Для лечения используют антибиотики (мономицин), солюсурьмин, акрихин, аминохинол, пентамидина изотионат.
Род Trichomonas, относящийся к жгутиконосцам, насчитывает большое количество видов, из них 3 вида могут быть обитателями организма человека: T. elongata (T. tenax) – обитатель ротовой полости; T. hominis (T. intestinalis) – обитатель тонкого и толстого кишечника; и T. vaginalis – паразит мочеполовых путей женщин и реже – мужчин. Ротовая и кишечная трихомонады иногда могут вызывать воспалительные заболевания ротовой полости и кишечника, и они обычно служат проявлением дисбактериоза или микст-инфекции и отягощают течение основного заболевания. Наибольшее значение в патологии человека играет влагалищная трихомонада, вызывающая у мужчин и женщин трихомоноз (трихомониаз, трихомонадоз); открыта в 1836 г. А. Донне.
T. vaginalis имеет грушевидную форму и размеры 10 – 20 мкм, иногда до 30 мкм; это самая крупная из всех трихомонад человека. Для трихомонад характерны вращательные или колебательные движения. Они имеют четыре расположенных спереди жгутика (см. рис. 115, 3), один из жгутиков проходит вдоль тела к заднему концу клетки и образует вместе со складкой плазмолеммы ундулирующую мембрану, причем у влагалищной трихомонады она доходит только до середины тела, а у кишечной выходит за границы тела, заканчиваясь свободным жгутиком. Под ундулирующей мембраной внутри клетки находится сократимая палочка – коста, служащая опорой для движения. Аксостиль (осевой тяж) у трихомонад не совершает активных движений. У влагалищной трихомонады постоянный клеточный рот (цитостом) отсутствует, но при некоторых условиях на передней части тела может дифференцироваться участок, через который внутрь путем фагоцитоза проникают частички пищи, бактерии, эритроциты. В основном питание осуществляется через оболочку клетки. Размножение происходит путем продольного деления.
Трихомонады можно культивировать на жидких и плотных питательных средах. Для влагалищной трихомонады необходимо использовать среды более богатого состава (печеночная среда с цистеином, пептоном, мальтозой и др.). Она лучше растет в анаэробных условиях, при рН 5,5 – 6,0 и температуре 35 – 37 °C. Через 2 – 3 дня на средах, содержащих около 0,1 % агара, обнаруживается четкий рост трихомонад на дне пробирки в виде придонного осадка.
T. vaginalis не образуют цист и поэтому малоустойчивы во внешней среде. Быстро гибнут при низких и особенно при высоких температурах, высыхании, действии солнечных лучей. В морской воде гибнут в течение 10 – 60 мин. В моче могут сохраняться в течение суток.
Трихомоноз – типичный антропоноз, распространен повсеместно, передается в большинстве случаев половым путем.
Патогенез и клиника. Попавшие на слизистую мочеполовых органов, трихомонады могут вызвать выраженную воспалительную реакцию, особенно при наличии большого количества паразитов. У женщин может поражаться влагалище, уретра, шейка матки, вульва, редко – прямая кишка. У мужчин развиваются уретрит, простатит, орхоэпидидимит. Заболевание может протекать бессимптомно, особенно у женщин, при выраженной клинике наблюдается появление гнойного отделяемого, зуд, болезненность или чувство жжения на слизистой мочеполовых путей.
Лабораторная диагностика. Применяют неоднократное микроскопическое исследование отделяемого уретры, влагалища, сока простаты. Изучают фиксированные мазки, окрашенные по Романовскому – Гимзе, по Граму или метиленовым синим. Трихомонады выглядят как округлые клетки с вытянутыми или треугольными ядрами; размер паразитов в 2 раза больше, чем лейкоцитов, которые присутствуют в мазке в больших количествах. Если проводилось лечение или хотя бы попытка лечения противотрихомонадными препаратами, трихомонады отсутствуют или имеют атипичную морфологию. При смешанной инфекции (гонорея + трихомоноз) в мазках можно обнаружить фагоцитированные трихомонадами гонококки. Хороший результат дает также микроскопия свежего нативного материала, смешанного с физиологическим раствором, в препарате «раздавленная капля». Особенно удобна в этом случае фазово-контрастная микроскопия, позволяющая наблюдать движение живых трихомонад.
Надежным методом диагностики является посев исследуемого материала на питательные среды. Этот метод особенно ценен при обследовании мужчин, а также для установления наступившего освобождения от трихомонад после лечения.
Специфическая профилактика не проводится. Для лечения используют различные препараты: метронидазол (трихопол, флагил), фуразолидон и др., часто в сочетании с препаратами, обладающими трихомонацидным эффектом при местном применении.
К роду Trypanosoma относятся жгутиконосцы, являющиеся паразитами крови позвоночных, в том числе млекопитающих. Несколько видов трипаносом могут инвазировать человека, однако патогенны только три. Возбудители африканского трипаносомоза были открыты в 1902 г. Д. Даттоном (T. gambiense) и в 1910 г. Г. Фантемом (T. rhodesiense). Возбудитель американского трипаносомоза (T. cruzi) был открыт в 1909 г. Ш. Шагасом в Бразилии.
Трипаносомы проходят определенный цикл развития, который, как правило, характеризуется сменой хозяев и жизненных форм. Различные формы обозначаются в зависимости от места отхождения жгутика как крипто– или амастиготы (не имеющие жгутика); промастиготы (имеют жгутик на переднем конце клетки); эпимастиготы (криптидиальные формы, жгутик отходит от середины клетки перед ядром) и трипомастиготы (трипаносомные формы со жгутиком на заднем конце клетки). В крови млекопитающих, в том числе у человека, трипаносомы находятся в виде зрелых трипомастигот. Африканские трипаносомы при микроскопии крови не отличаются от других и могут иметь размеры 15 – 30 мкм в длину и 1,4 – 3,0 мкм в ширину, длина жгутика колеблется от 12 до 42 мкм. Удлиненноовальное ядро лежит почти в середине клетки, на заднем конце располагается блефаропласт, от которого отходит жгутик. Последний волнообразно изогнут, между ним и телом трипаносомы натянута прозрачная ундулирующая мембрана. От противоположного конца клетки жгутик продолжается на некотором расстоянии свободно. Трипаносомы передвигаются благодаря колебаниям жгутика, ундулирующей мембраны и изгибанию тела. Питание у них осуществляется через оболочку клетки. Размножаются трипаносомы продольным делением: сначала делится ядро и наступает деление протоплазмы, начиная с переднего конца тела. При окраске по Романовскому – Гимзе цитоплазма трипаносом окрашивается в голубой цвет; ядро, блефаропласт и жгутик – в красный. Цист трипаносомы не образуют (см. рис. 115, 2).
Патогенные для человека трипаносомы можно культивировать на различных средах, в том числе на кровяных (см. раздел «Лейшмании»). В культурах преобладают эпимастиготы.
Трипаносомоз является типичным трансмиссивным заболеванием. Африканский трипаносомоз, или сонная болезнь, протекающая хронически, вызывается T. gambiense; более тяжелая и остро протекающая – T. rhodesiense. Эти заболевания распространены в странах соответственно Западного и Восточного побережья Африки. Многие авторы считают этих возбудителей подвидами T. brucei, которая не патогенна для человека, но поражает многих диких животных (антилопы, зебры), не вызывая у них клинической картины заболевания. У домашнего скота она вызывает смертельную инфекцию – нагану. Африканский трипаносомоз передается кровососущей мухой цеце рода Glossina, причем гамбийский вариант болезни является зоонозом, а родезийский вариант – зооантропонозом. Источник инфекции – рогатый скот и дикие травоядные животные.
Американский трипаносомоз (болезнь Шагаса) вызывается T. cruzi, источником инфекции служат больные люди и домашние животные. Переносчик – триатомовые клопы родов Triatoma и Rhodnius. Инфицировать человека может и T. rangeli, обычно не вызывающая развития заболевания.
Патогенез и клиника. Африканские трипаносомы проникают в организм при укусе мухи цеце и размножаются в месте входных ворот, образуя первичный очаг уплотнения, превращающийся в трипаносомный шанкр. В дальнейшем инфекция распространяется в лимфатические сосуды и узлы, в кровяное русло, где возбудитель внеклеточно размножается, а в заключительной стадии заболевания – в ЦНС, вызывая развитие специфического синдрома сонной болезни: утомляемость, похудание, неспособность принимать пищу, нарушения сознания, сопор и смерть.
Возбудитель американского трипаносомоза проникает в организм человека при попадании инфицированных экскрементов триатомовых клопов на слизистую глаза или через поврежденную кожу, но не при укусе клопа (при укусе могут попасть T. rangeli). В месте проникновения происходит развитие амастигот в промастиготы и эпимастиготы и их размножение. Образуется уплотнение, может развиться поражение кожи («шагома»). Затем повышается температура, развивается лимфаденит, происходит диссеминация возбудителя в кровь и ткани, где он продолжает размножаться в клетках системы мононуклеарных фагоцитов, образуя вначале крупные скопления амастигот.
Фазы размножения в тканях сменяются фазами паразитемии с последующим разрушением кровяных форм паразитов, освобождением их токсинов, что сопровождается характерными приступами перемежающейся лихорадки, интенсивность которых постепенно снижается. Под действием образующихся антител наступает гибель трипаносом, но те, в которых произошло изменение антигенной структуры, становятся источником развития новых популяций. С этим связаны новые приступы лихорадки.
Лабораторная диагностика. Для микроскопического исследования используют кровь больного во время повышения температуры, ликвор, пунктат лимфатического узла. Возбудителя обнаруживают при окраске по Романовскому – Гимзе в мазке или в толстой капле. Можно также в свежей крови обнаружить подвижные трипаносомы. При американском трипаносомозе делают посевы крови или пунктатов лимфатических узлов для выделения чистой культуры. Используют заражение лабораторных животных (мыши, щенки, котята), в крови которых через несколько дней появляются трипаносомы. При наличии возбудителя в крови больного появляются антитела (IgM и IgG), которые могут быть определены с помощью РСК или РИФ. В некоторых случаях при американском трипаносомозе прибегают к ксенодиагностике: несколько «чистых» выращенных в лаборатории триатомовых клопов используют для кормления на больном, после чего каждые 7 – 10 дней исследуют их экскременты для выявления различных стадий развития трипаносом.
Специфическая профилактика не разработана. Для лечения используют пентамидина изотионат (ломидин), сурамин натрия (германин), при поражениях ЦНС – сурамин и меларсопрол. Более эффективен нифуртимокс. Следует отметить низкую степень эффективности проводимой терапии, особенно при американском трипаносомозе.
Балантидиаз – протозойное заболевание, характеризующееся лихорадкой, болями в животе, поносом и язвенным поражением толстого кишечника.
Возбудитель – Balantidium coli – относится к типу Ciliophora, был открыт в 1856 г. П. Мальмстеном. Это единственная патогенная для человека инфузория и самое крупное простейшее из паразитов человека (рис. 116). Тело балантидии имеет овальную форму, размеры 30 – 200 × 20 – 110 мкм. Характерны движения: сочетание вращения вокруг продольной оси и непрерывного «ввинчивания». Тело усеяно ресничками, располагающимися спиральными рядами. Близ переднего конца тела имеется углубление в виде неглубокой щели – цитостом, ведущий в короткую глотку. По краю ротовой щели располагаются особые сильно развитые реснички, направляющие пищу внутрь балантидии. На заднем конце тела находится анальная по́ра, или цитопрокт. Под пелликулой лежит тонкий слой прозрачной эктоплазмы. В зернистой эндоплазме располагаются 2 ядра – крупный бобовидный макронуклеус и рядом с ним значительно меньший сферический микронуклеус, а также 2 сократительных вакуоли, частички пищи и пищеварительные вакуоли.

Рис. 116. Balantidium coli, вегетативная форма
При инцистировании у паразита формируется двуслойная оболочка, циста имеет правильную сферическую или округлую форму и диаметр 45 – 70 мкм. Под оболочкой скрыт ресничный покров. В цистах видны макронуклеус и иногда сократительные вакуоли. Инцистирование происходит в нижних отделах толстого кишечника. Размножаются балантидии путем поперечного деления. При быстрых повторных делениях в толще кишечника могут образовываться гнезда мелких балантидий.
Балантидии можно выращивать на простых питательных средах (например, в разбавленном в 5 раз физиологическим раствором МПБ).
Источником возбудителей инвазии являются домашние и дикие свиньи, почти поголовно зараженные балантидиями и постоянно выделяющие цисты во внешнюю среду с испражнениями. Вегетативные формы сохраняются во внешней среде 3 – 5 ч, цисты – 3 – 4 нед. Не исключена вероятность заражения от больных людей и носителей. Передача возбудителя происходит через пищу, воду, загрязненные руки. Заболевание встречается преимущественно в виде спорадических случаев, главным образом в районах свиноводства, расположенных в зоне теплого и влажного климата.
Патогенез и клиника. При проглатывании цист их оболочка растворяется, при этом освобождаются вегетативные формы, которые перемещаются с пищевыми массами в толстый кишечник, где они питаются за счет бактерий и содержимого кишки, размножаются и образуют цисты, которые выходят во внешнюю среду с испражнениями. В большинстве случаев паразиты не причиняют никакого вреда макроорганизму. Однако изредка балантидии инвазируют слизистую и подслизистую оболочки толстой кишки и терминальные отделы тонкого кишечника. В результате их размножения образуются абсцессы, а затем язвы неправильной формы с нависающими краями. Клинически отмечается понос, чередующийся с запорами. Характерны слизистый стул с кровью, тенезмы и колики.
Лабораторная диагностика основана на обнаружении балантидий или цист паразита в жидких или в оформленных испражнениях. Достоверным признаком заболевания служит обнаружение возбудителя в материале, полученном при сигмоидоскопии. К выделению чистой культуры прибегают очень редко.
Специфическая профилактика не разработана. Для лечения используют тетрациклины, аминарсон, дийодогидрохинон.
Малярия – острая протозойная трансмиссивная инфекция, характеризующаяся периодическими приступами лихорадки, увеличением печени и селезенки, анемией, рецидивирующим течением.
Возбудители малярии относятся к типу споровиков, подотряду гемоспоридий, роду Plasmodium. Открыты впервые в 1880 г. А. Лавераном. В организме человека паразитируют четыре вида плазмодиев: P. vivax – возбудитель чрезвычайно широко распространенной трехдневной малярии, P. malariae – возбудитель четырехдневной малярии; P. falciparum – тропической малярии и P. ovale – тропической трехдневной малярии (Западная Африка). Они являются двухозяинными пигментообразующими амебовидными внутриклеточными паразитами, размножающимися в эритроцитах и клетках других тканей.
Плазмодии малярии имеют сложный цикл развития, складывающийся из спорогонии, проходящей в организме переносчика – самки комара рода Anopheles, и шизогонии, проходящей в организме человека. Человек является промежуточным, а комар основным хозяином паразита.
При сосании крови больного в желудок самки комара попадают находящиеся в эритроцитах гаметоциты и претерпевают ряд изменений, в результате которых происходит оплодотворение. Образуется зигота, превращающаяся в оокинету, которая из просвета желудка проникает в стенку желудка, округляется и инцистируется; образуется ооциста (через 2 – 7 дней после заражения комара). Содержимое каждой ооцисты начинает делиться, образуются споробласты, затем спорозоиты (до 10 тысяч в 1 ооцисте). Обладающие подвижностью спорозоиты покидают ооцисту, проникают в гемолимфу, разносятся по всем тканям, примерно 2 % их накапливается в слюнных железах. С этого момента самка комара на протяжении всей своей жизни заразна для человека, так как при кровососании с ее слюной в кровь проникают инвазивные для человека спорозоиты.
Из крови спорозоиты попадают в гепатоциты, округляются и превращаются во внеэритроцитарные (тканевые) трофозоиты, которые растут, превращаются в шизонты и делятся, при этом образуются мерозоиты, выходящие в плазму крови. Продолжительность тканевой фазы – 6 – 15 сут. При трехдневных маляриях возможно длительное (месяцы и даже годы) пребывание паразитов в печени, после чего они выходят в кровь. На этом заканчивается внеэритроцитарная (тканевая) шизогония, и начинается эритроцитарная шизогония.
Мерозоиты проникают путем эндоцитоза в эритроциты, где образуется паразитофорная вакуоль. Этот процесс занимает 30 с. Далее мерозоиты превращаются в бесполые формы растущих плазмодиев, когда паразит питается гемоглобином и в нем накапливается пигмент. В случаях трехдневных малярий увеличиваются размеры и самого пораженного эритроцита. В развитии паразита различают следующие стадии (см. цв. вкл., рис. 117): перстневидный юный, полувзрослый, взрослый шизонт; наступает деление его ядра – меруляция, при этом образуется 7 – 30 мерозоитов. При разрыве эритроцита они выходят в плазму и внедряются в новые эритроциты. Эритроцитарная шизогония у P. vivax, P. falciparum и P. ovale занимает 48 ч, у P. malariae – 72 ч. Результатом эритроцитарной шизогонии некоторое время спустя является образование половых форм паразита – мужских и женских гаметоцитов. Главное диагностическое значение в дифференциации видов малярийных плазмодиев имеет их морфология в пораженных эритроцитах.
Малярия является типичным антропонозом, источник инфекции – больной или паразитоноситель. Заболевание распространено по всей тропической, субтропической и умеренной зонах Земного шара. Однако внутри ареала существуют участки, свободные от малярии (пустыни, высокогорья, некоторые острова в Тихом океане) вследствие отсутствия переносчиков или невозможности завершения спорогонии в них из-за недостатка тепла.
Патогенез и клиника. Клинические проявления малярии связаны с эритроцитарной шизогонией. Малярийный приступ возникает в ответ на выброс в плазму пирогенных веществ: остатков разрушенных эритроцитов, погибших мерозоитов, продуктов метаболизма мерозоитов. При тропической малярии эритроцитарная шизогония проходит в мелких сосудах внутренних органов, вызывая нарушения микроциркуляции крови. Если процесс локализуется в головном мозге, развивается малярийная кома. При тропической малярии в результате иммунопатологического процесса может возникать острый гемолиз эритроцитов, не пораженных плазмодием. Массивный гемолиз приводит к острой почечной недостаточности. При всех формах малярии могут наблюдаться ранние рецидивы, связанные с развитием сохранившихся эритроцитарных форм паразита при снижении иммунитета.
Иммунитет. Новорожденные от матерей, переболевших малярией, получают пассивный иммунитет, сохраняющийся 3 – 6 мес. Врожденной невосприимчивостью к P. vivax обладают коренные жители Западной Африки. Устойчивость к P. falciparum свойственна лицам с врожденными гемоглобинопатиями. Например, при серповидно-клеточной анемии зараженные эритроциты удаляются из кровотока до завершения в них шизогонии. Приобретенный иммунитет непродолжителен, возникает к определенному виду возбудителя и поддерживается повторными заражениями. Развитием иммунитета объясняется самопроизвольное излечение. Механизмы иммунного ответа сложны и включают как клеточный, так и гуморальный компоненты, причем клеточный компонент имеет более выраженную протективную значимость. На ранних стадиях малярии большую роль играет фагоцитоз.
Лабораторная диагностика. Важнейшим методом является микроскопическое исследование препаратов крови: толстой капли и мазка, окрашенных по Романовскому – Гимзе. Кровь берут из пальца, начиная со стадии предвестников приступа. Толстая капля обладает значительным преимуществом перед мазком: за одно и то же время можно просмотреть в 20 – 50 раз большее количество крови. Толстую каплю окрашивают в нефиксированном состоянии, при этом эритроциты разрушаются, а плазмодии деформируются. Ядро плазмодия окрашивается в вишнево-рубиновый цвет, цитоплазма – в сине-голубой. При всех видах малярии, кроме тропической, в толстой капле и мазке обнаруживаются все стадии развития возбудителя. При неосложненной тропической малярии в периферической крови обнаруживаются лишь юные шизонты в форме перстней (иногда одновременно 2 – 3 в одном эритроците) и через 8 – 10 дней после начала заболевания – гаметоциты полулунной, или серповидной, формы.
Серологические реакции (РИФ, ИФМ и др.) имеют ограниченное применение, так как дают положительную реакцию лишь со второй недели заболевания; чаще используются при обследовании доноров или в серологических эпидемиологических исследованиях. Разработан новый метод диагностики – ДНК-зонды с различными метками. Метод чувствительный, основан на обнаружении в лизированной крови высокоспецифических для возбудителя фрагментов ДНК.
Специфическая профилактика и лечение. ВОЗ проводятся изыскания по созданию антиспорозоитной, антимерозоитной и антигаметной вакцин с использованием генно-инженерных методов. Вакцины уже созданы в Колумбии, США и Швейцарии, их эффективность изучается.
Для лечения используют многочисленную группу противомалярийных препаратов: производные 4-аминохинолина (хлорохин, плаквенил), 8-аминохинолина (примахин), хинин, пириметамин, сульфаниламиды и др.
Единственной патогенной для человека токсоплазмой является Toxoplasma gondii, открытая в 1908 г. Ш. Николем и Л. Мансо. Она относится к типу споровиков, отряду Coccidia, обладает широко развитыми приспособительными механизмами, которые позволяют ей обитать на разных континентах и широтах, паразитировать и размножаться в сотнях видов млекопитающих и птиц, поражать различные клетки и ткани хозяина. При всем этом токсоплазма относительно безвредный паразит, так как заражение ею не всегда ведет к каким-либо заметным вредным последствиям. Основным хозяином служат кошки (домашняя или дикие кошачьи), в которых наряду с бесполыми фазами протекают и половые стадии развития. Любое теплокровное животное, а также человек потенциально являются промежуточным хозяином, в котором развитие токсоплазмы может доходить до образования тканевых цист. В цистах идет бесполое размножение. В результате формируются цистозоиты (мерозоиты), которые, заглатываясь с мясом другим промежуточным хозяином, начинают размножаться и могут вызывать у него острую форму болезни. На этой фазе T. gondii инвазивна для многих хозяев, в том числе и для человека. Так же заражаются и кошки. Характерной особенностью паразита является внутриклеточное прохождение цикла развития. Детерминированный только в мужскую сторону гамонт претерпевает множественное деление, в результате чего образуются многочисленные микрогаметы, в то время как гамонт, детерминированный в женскую сторону, развивается в единственную крупную макрогамету. Размножаются токсоплазмы только в цитоплазме живой клетки-хозяина.
Жизненный цикл токсоплазмы включает в себя четыре основных этапа развития: шизогонию, эндодиогению (внутреннее почкование), гаметогонию, спорогонию. Шизогония, гаметогония и начало спорогонии протекает только в клетках эпителия кишечника представителей семейства кошачьих, спорогония завершается во внешней среде, а эндодиогения осуществляется в клетках тканей промежуточного хозяина (и человека) и в клетках кошачьих. Гаметогония – половая стадия, остальные – стадии бесполого размножения.
В органах экспериментально зараженных мышей токсоплазмы имеют форму полумесяца или дольки апельсина (рис. 118) размерами 2 – 4 × 4 – 7 мкм (при внутриклеточном расположении) или чуть крупнее – до 10 мкм (при разрушении клеткихозяина). По Романовскому – Гимзе протоплазма паразита окрашивается в голубой цвет, в ней часто выявляются гранулы и небольшие вакуоли. Полюса окрашиваются несколько интенсивнее. Ядро имеет рубиново-красный цвет и расположено немного ближе к более закругленному полюсу клетки, имеет зернистую или дольчатую структуру. Органом движения у них служит сеть из 12 – 16 тончайших волокон, отходящих от заостренного конца тела к центру по поверхности пелликулы; сеть видна только в электронном микроскопе. Помимо единичных паразитов в препаратах могут встречаться скопления токсоплазм – псевдоцисты и цисты. Псевдоцисты образуются в активной фазе заболевания и представляют собой временные скопления токсоплазм в вакуолях цитоплазмы клетки-хозяина, в которой они размножались. Эти скопления не имеют собственной оболочки. Цисты токсоплазм встречаются в организме чаще при затухающем процессе и обнаруживаются преимущественно в мозге, сетчатке глаза, матке, миокарде и скелетных мышцах. Цисты окружены двуслойной оболочкой. Они образуются в вакуоле цитоплазмы клетки-хозяина, но имеют собственную оболочку. Когда клетка разрушается, циста оказывается свободно лежащей на фоне ткани. Размеры цист – 20 – 100 мкм.
Токсоплазмы можно культивировать только в присутствии живых клеток – в тканевых культурах или в эмбрионах, где они и размножаются внутриклеточно при температуре 37 – 39 °C.
Рис. 118. Toxoplasma gondii
Мазок крови
Токсоплазмоз для человека является природно-очаговой зооантропонозной инфекцией. Восприимчивость людей к токсоплазмам высока. Заражение происходит либо плацентарным путем от больной матери плоду, либо алиментарным путем при попадании цист с пищей, водой, через грязные руки и т. д. В соответствии с этим различают врожденный (фетальный) и приобретенный токсоплазмоз.
Патогенез и клиника. Гибель клеток хозяина связана непосредственно с эндодиозоитами (трофозоитами), которые обладают тропизмом в отношении паренхиматозных клеток и клеток системы мононуклеарных фагоцитов. Люди относительно резистентны к инвазии, поэтому клиника может быть весьма вариабельной: от незаметных форм до поражений лимфатических узлов, пневмонии, энтероколита, хориоретинита, гепатита, нефрита и т. д. Часто появляется пятнисто-папулезная сыпь. При врожденном токсоплазмозе отмечаются такие поражения со стороны плода, как гидро– или микроцефалия, хориоретинит, обызвествления в мозге. Такие последствия наступают, только если мать сама впервые заражается во время беременности. Если инфекция была у нее еще до этого, мать оказывается иммунной, и заболевания плода не наступает.
Лабораторная диагностика. Для исследования используют костный мозг, кровь, ликвор, различные экссудаты, биоптаты тканей, кусочки плаценты, соскоб полости матки, пунктат лимфатического узла и т. д. В этих материалах возбудитель обнаруживается в мазках и срезах тканей при окраске по Романовскому – Гимзе. Выявление цист или псевдоцист, нафаршированных паразитами, преимущественно в головном мозге или других тканях ЦНС свидетельствует в пользу хронической инфекции. При биологическом методе здоровым животным вводится исследуемый материал (внутрибрюшинно или в головной мозг). Если животные (белые мыши, хомячки, кролики) погибают, в их органах обнаруживаются токсоплазмы. Если не погибают, то за ними ведут наблюдение в течение 6 нед., после чего ставят серологические реакции для выявления специфических антител. Можно забивать зараженное животное и материалом от него заражать новое животное. Обычно в брюшной полости зараженного животного скапливается экссудат, содержащий большое количество токсоплазм. Для биологической пробы могут быть использованы 7 – 8-дневные куриные эмбрионы, которых обычно заражают на хорион-аллантоисную оболочку. Для диагностики и эпидемиологических целей используется серологическая реакция с красителем Себина – Фельдмана. Механизм этой реакции связан с появлением у больных через 2 – 3 нед. антител, которые воздействуют на наружную мембрану выращенных в лабораторных условиях живых токсоплазм, делая ее непроницаемой для щелочного раствора метиленового синего. Поэтому в присутствии «положительной» сыворотки паразиты не окрашиваются. Могут быть использованы также непрямая РИФ, РСК и РПГА, но иногда при хроническом заболевании они бывают отрицательными. При аллергическом методе делают пробу с токсоплазмином, в основе которой лежит ГЧЗ.
Специфическая профилактика не разработана. Для лечения используют хлоридин в сочетании с сульфаниламидами, пириметамин и трисульфапиримидиновые препараты.
Внутрибольничные (госпитальные) инфекции
К внутрибольничным, или госпитальным, или нозокомиальным (греч. nosokomeo – ухаживать за больным), инфекциям относят такие заболевания микробной этиологии, которые возникают либо у больных людей в результате пребывания их в больнице или обращения в нее за лечебной помощью, либо у сотрудников больницы, заражающихся во время своей работы в ней. Внутрибольничные инфекции широко распространены в лечебных учреждениях, по-видимому, всех стран мира и представляют очень серьезную проблему для здравоохранения. Это определяется прежде всего тем, что такие инфекции отягощают течение основного заболевания, нередко создают угрозу для жизни больного, удлиняют сроки пребывания больных в госпиталях и наносят большой дополнительный экономический ущерб. В России от внутрибольничных инфекций ежегодно страдает около 2 млн человек, а летальность от них составляет более 15 %, что во много раз превосходит общую летальность в стационарах (около 0,4 – 0,5 %). В различных странах Европы частота госпитальных инфекций варьирует от 6 до 27 %, в США – около 7 – 8 %; экономический ущерб, причиняемый ими ежегодно, составляет несколько миллиардов долларов.
Этиология. Возбудителями внутрибольничных инфекций служат представители разных видов бактерий, вирусов, грибов и простейших. Однако ведущая роль принадлежит бактериям, как патогенным, так и условно-патогенным. Список их очень обширен. Он включает различные виды стафилококков, в первую очередь Staphylococcus aureus и S. epidermidis; стрептококки серогрупп A, B, C, D, F, G, пептострептококки, различных представителей семейства Neisseriaceae (нейссерии, моракселлы, ацинетобактерии, кингеллы), семейства Enterobacteriaceae (кишечная палочка, клебсиеллы, сальмонеллы, шигеллы, протей, серрации и др.), псевдомонады, коринебактерии, легионеллы, клостридии, бактероиды, кампилобактерии, фузобактерии, актиномицеты, нокардии, микоплазмы и др. Среди грибов чаще всего возбудителями внутрибольничных инфекций служат представители рода Candida, а также пневмоцисты. Существенную роль в этиологии госпитальных инфекций играют вирусы, особенно ортомиксовирусы, аденовирусы, различные энтеровирусы, вирусы гепатита В, С, дельта, а также ВИЧ.
Конкретная роль тех или иных видов микроорганизмов в этиологии госпитальных инфекций зависит от различных причин, в том числе от профиля лечебного учреждения, характера и объема проводимых в нем обследований больных, количества их в палате, общего уровня и состояния санитарно-гигиенического режима и т. п. Однако многочисленные исследования, проведенные в различных странах, показывают, что за последние годы в этиологии внутрибольничных инфекций наряду с грамположительными кокками все большую роль играют грамотрицательные бактерии. Так, например, по данным ВОЗ, среди возбудителей госпитальных инфекций, поражающих мочевыводящие пути, на долю кишечной палочки приходится до 38 %, протея – 17,5 %, синегнойной палочки – 11,6 %, клебсиелл – 8,5 % и энтеробактеров – 6,4 %. При госпитальных инфекциях, поражающих нижние дыхательные пути, преобладают синегнойная палочка и пневмококк (17,1 %); на долю стафилококка приходилось 12,4 %; у 31 % больных были выделены различные грамотрицательные бактерии. При почечных инфекциях у 41 % больных был выделен золотистый стафилококк, у 7,2 % – стрептококки; у 31 % – грамотрицательные палочки.
Заметно возросла роль грамотрицательных бактерий в качестве виновников септицемий. Особенно часто они связаны с протеем, кишечной палочкой и клебсиеллами.
Возбудителями внутрибольничных инфекций все чаще оказываются бактерии, которые раньше рассматривались как условно-патогенные или даже непатогенные. Энтерококки признаны возбудителями раневых инфекций, различных гнойных хирургических заболеваний, гнойных осложнений у родильниц и гинекологических больных. Энтерококки могут вызывать сепсис, эндокардит, они инфицируют почки и мочевые пути. Большую роль в этиологии различных заболеваний новорожденных стал играть Streptococcus agalactiae. Частота заболеваний, вызываемых им у новорожденных, составляет 1: 500 – 1: 900. Наиболее часто в первые сутки после рождения S. agalactiae вызывает заболевания дыхательных путей, септицемию, менингит. Основным источником заражения этим возбудителем являются матери, у которых он часто обнаруживается на слизистой родовых путей, а также персонал родильных домов, от которых заражение может происходить контактно-бытовым путем.
Основные свойства S. agalactiae. Имеет вид шаровидных или овоидных клеток диаметром 0,6 – 1,2 мкм, располагающихся в виде цепочек, часто очень длинных, которые состоят как бы из парных кокков. Относится к серогруппе В, по антигену S клеточной стенки различают не менее 5 серотипов. Антиген S является фактором патогенности и обладает иммунопротективным свойством. S. agalactiae не растет при температуре 10 °C, 40 °C, на среде с рН 9,6; в молоке с 0,1 % метиленового синего; на среде, содержащей 6,5 % NaCl; на среде с 40 % желчи и после прогревания при температуре 60 °C в течение 30 мин; не образует фибринолизина, не гидролизует желатин, крахмал и эскулин, но вызывает гидролиз гиппурата и аргинина. Ферментирует глюкозу, мальтозу и трегалозу с образованием только кислоты. Ксилозу, арабинозу, инулин, маннит и сорбит не ферментирует. Глицерин ферментирует только в аэробных условиях. Для своего роста нуждается в 6 витаминах и 9 аминокислотах. Около 50 % выделенных штаммов образуют на кровяном агаре узкую зону β-гемолиза, другие штаммы вызывают типичный α– или β-гемолиз или не обладают гемолитической активностью. Гемолитические штаммы образуют растворимый гемолизин, отличающийся от О– и S-стрептолизинов. Большинство штаммов образуют гиалуронидазу.
Особенности внутрибольничных инфекций определяются следующими обстоятельствами.
1. Как правило, они присоединяются к основному заболеванию или впервые поражают организм новорожденного.
2. Не существует строгой этиологии чисто госпитальных инфекций. При соответствующих условиях госпитальную инфекцию может вызвать любой патогенный или условно-патогенный микроорганизм.
3. Поскольку возбудителями госпитальных инфекций очень часто бывают условно-патогенные бактерии, возможность возникновения их во многом зависит от иммунного состояния макроорганизма, величины заражающей дозы, степени вирулентности возбудителя и путей проникновения его в организм. Различные формы иммунодефицита – одно из главных условий, способствующих развитию оппортунистических инфекций. Оппортунистическими инфекциями называют заболевания, вызываемые условно– или слабопатогенными микроорганизмами у людей с пониженной иммунореактивностью (страдающих иммунодефицитами).
4. Патогенез и клиническая картина госпитальных инфекций крайне разнообразны и не всегда специфичны.
С учетом перечисленных обстоятельств, способа заражения, локализации патологического процесса, особенностей патогенеза и клинической картины внутрибольничные инфекции можно условно разделить на следующие группы:
1. Септицемии и бактериемии. Их наиболее частые возбудители – золотистый и эпидермальный стафилококки, протей, кишечная палочка, клебсиеллы, энте-
робактеры, псевдомонады, серрации, бактероиды, стрептококки (энтерококки и S. agalactiae), грибы кандида и др.
2. Гнойно-воспалительные инфекции: острые и хронические; местные с различной локализацией и генерализованные. Частота послеоперационных гнойных осложнений в разных клиниках варьирует от 2 до 20 %. Более 40 % послеоперационной летальности обусловлены внутрибольничными гнойно-септическими инфекциями. Возбудители: стафилококки, стрептококки, грамотрицательные бактерии, клостридии, бактероиды, фузобактерии и др. При этом гнойно-воспалительные процессы почек и мягких тканей чаще всего вызывают золотистый и эпидермальный стафилококки и грамотрицательные палочки. Острый гнойный отит – стафилококки, пневмококки, клебсиеллы и др. Послеродовый мастит – золотистый и эпидермальный стафилококки. Омфалиты – золотистый и эпидермальный стафилококки. Гнойный аппендицит – кишечная палочка, бактероиды, протей, часто в ассоциации. Острый гематогенный остеомиелит чаще всего вызывает золотистый стафилококк. Гнойные перитониты развиваются или при заносе гематогенным или лимфогенным путем возбудителей из других органов, или в результате прободения кишечника, или после оперативного вмешательства, или после ранения. Возбудителями перитонита служат кишечная палочка, протей, бактероиды, энтеробактеры, клебсиеллы, энтерококки в различных сочетаниях и часто в ассоциациях со стафилококком. Послеоперационный перитонит чаще всего вызывают госпитальные штаммы стафилококка и грамотрицательные бактерии.
3. Раневые и ожоговые инфекции. Раневые инфекции могут иметь эндогенное и экзогенное происхождение. В первом случае возбудители проникают в рану с ближайших соседних участков ткани. Экзогенные раневые инфекции возникают либо в результате заноса возбудителя при оперативном вмешательстве, либо на более поздних этапах лечения. Их возбудителями также нередко являются госпитальные штаммы бактерий, особенно стафилококков, которые обладают более высокими вирулентными свойствами и, как правило, множественной лекарственной устойчивостью. К раневым госпитальным инфекциям следует отнести также пуэрперальный и послеабортный сепсис, возбудителями которых служат стрептококки, стафилококки и грамотрицательные палочки как постоянно обитающие на слизистых оболочках мочеполовых путей, так и заносимые экзогенным путем.
Ожоговые инфекции чаще всего связаны с инфицированием ран стафилококками и грамотрицательными бактериями, являющимися обитателями кожи или слизистых оболочек больных, а также бактериями, содержащимися на одежде больного, медицинского персонала, в воздухе и на окружающих предметах. Причиной ожоговых инфекций нередко служат госпитальные штаммы бактерий. Ожоговые инфекции часто осложняются тяжело протекающими септицемиями.
4. Заболевания дыхательных путей. Они могут протекать в форме ринитов, фарингитов, конъюнктивитов, бронхитов, бронхиолитов, пневмоний, абсцессов и гангрены легких, атипических пневмоний и т. п. Их возбудители: риновирусы, коронавирусы, аденовирусы, парамиксовирусы, респираторно-синтициальный вирус, вирусы гриппа, другие вирусы, а также пневмококки, палочка инфлюэнцы, микоплазмы, пневмоцисты и другие микроорганизмы.
5. Урогенитальные инфекции – пиелонефриты, уретриты, гломерулонефриты и др. Тяжелым осложнением этих инфекций является уросепсис. Возбудители: стрептококки различных серологических групп, стафилококки и грамотрицательные палочки (протей, синегнойная палочка, кишечная палочка и др.).
6. Острые кишечные инфекции. Они могут носить характер пищевых интоксикаций, токсикоинфекций или пищевых инфекций. Возбудителями пищевых интоксикаций служат стафилококки, продуцирующие энтеротоксины; пищевых токсикоинфекций – представители семейств Enterobacteriaceae, Pseudomonadaceae, Vibrionaceae, Bacillaceae и Streptococcaceae; пищевых инфекций – эшерихии (главным образом энтеропатогенные и энтероинвазивные, реже энтеротоксигенные кишечные палочки), шигеллы, кампилобактерии, сальмонеллы и др. Особенно часто наблюдаются внутрибольничные вспышки сальмонеллезов. Эпидемиологически их можно разделить на три группы.
1. Сальмонеллезы, обусловленные употреблением в больничных учреждениях пищевых продуктов (птицепродуктов, яиц, молочных, мясных и других продуктов), инфицированных возбудителями и не подвергшихся необходимой термической обработке.
2. Заболевания, связанные с появлением среди больных или персонала лечебного учреждения бактерионосителя и последующим заражением от него контактнобытовым путем. Распространение таких заболеваний обычно связано с инфицированием предметов обихода, окружающей среды и рук обслуживающего персонала.
3. Заболевания, связанные с пероральным употреблением жидких лекарственных препаратов. Они часто наблюдаются в родовспомогательных учреждениях и больницах для детей раннего возраста. Например, заражение сцеженного грудного молока сальмонеллами (а также другими грамотрицательными палочками и стафилококками) может стать причиной групповых заболеваний среди новорожденных. Пищевые вспышки антропонозных кишечных инфекций (эшерихиозы, дизентерия, кампилобактериозы) в больничных учреждениях обычно связаны с нарушением правил приготовления, хранения, термической обработки пищевых продуктов и с несоблюдением правил личной гигиены.
7. Посттрансфузионные инфекции и заболевания, связанные с различными диагностическими (бронхоскопия, гастроскопия, цистоскопия) и лечебными процедурами (гемодиализ, интубация, применение наркозной аппаратуры и пр.). Обычно они возникают в тех случаях, когда стерилизация инструментов связана с большими трудностями или когда для инъекций используют нестерильные шприцы или один шприц с заменой игл. Таким путем происходит заражение ВИЧ, вирусами гепатита В, С, D, G, TT, цитомегаловирусами, эпидермальным стафилококком и, возможно, другими возбудителями. К таким же последствиям приводит переливание донорской крови или ее препаратов, не проверенных на возможное присутствие в них соответствующих возбудителей.
8. Особую группу внутрибольничных инфекций составляют заболевания, связанные с длительным лечением антибиотиками, особенно широкого спектра действия. Они возникают как следствие нарушения баланса нормальной микрофлоры организма. Такой дисбаланс возможен в результате того, что применяемые для лечения больного антибиотики действуют не только на возбудителя соответствующего заболевания, но и подавляют жизнедеятельность чувствительных к антибиотикам представителей нормальной микрофлоры. Их место начинают занимать микроорганизмы, резистентные к данным антибиотикам, которые размножаются в большом количестве и вызывают дисбактериоз. Например, размножение антибиотикоустойчивых стафилококков может стать причиной стафилококкового колита, стафилококковой пневмонии; размножение грибов кандида – причиной местного или генерализованного кандидоза, трудно поддающегося лечению.
В иных случаях это может привести к развитию так называемых антибиотикоассоциированных колитов, например псевдомембранозного колита, возбудителем которого служит Clostridium difficile. С применением антибиотиков в клинических условиях связано еще одно важное обстоятельство, которое также способствует возникновению и распространению внутрибольничных инфекций. Именно в стационарах, где начинают впервые применять новый антибиотик (антибиотики), создаются необходимые условия для отбора устойчивых к нему штаммов бактерий, т. е. для появления нового эпидемического клона данного вида бактерий. Устойчивость к антибиотикам в большинстве случаев обеспечивается конъюгативными и неконъюгативными R-плазмидами, которые одновременно могут контролировать и синтез каких-либо факторов патогенности. Благодаря этому могут возникать клоны бактерий, обладающих множественной антибиотикоустойчивостью и более высокой вирулентностью. Возникающие таким путем новые эпидемические клоны бактерий, в том числе и условно-патогенных, начинают играть ключевую роль и в эпидемиологии данного заболевания, и в этиологии внутрибольничных инфекций, так как они приобретают мощные селективные преимущества перед теми клонами бактерий данного вида, которые такими свойствами не обладают.
Нозологические формы наиболее частых внутрибольничных инфекций и их кодовые наименования приведены в табл. 55.
Таблица 55
Внутрибольничные инфекции и их кодовые наименования
Основные причины внутрибольничных инфекций
Внутрибольничные инфекции характеризуются не только своей полиэтиологией, но и многообразием причин, которые способствуют их возникновению и распространению. К важнейшим из них можно отнести следующие.
1. Формирование и естественная селекция в больничных учреждениях так называемых госпитальных штаммов стафилококков и различных грамотрицательных бактерий, обладающих высокими вирулентными свойствами и обычно множественной лекарственной устойчивостью. Отбор таких госпитальных штаммов – неизбежное следствие постоянного пребывания в стационарах больных с тяжелыми формами гнойно-воспалительных и иных инфекционных заболеваний.
2. Формирование среди медицинского персонала, особенно хирургических, гинекологических и родовспомогательных учреждений, постоянных носителей патогенных стафилококков (их доля иногда составляет более 40 % всего персонала) и других видов бактерий.
3. Нарушение принципов асептики: пользование нестерильным инструментарием, отсутствие (недостаток) разовых шприцев. Одно из свойств эпидермального стафилококка заключается в том, что в силу своей гидрофобности он активно прилипает к поверхности полимерных материалов и поэтому служит одним из наиболее частых возбудителей стафилококковых инфекций, связанных с применением в лечебных учреждениях пластических материалов (внутрисосудистые катетеры, эндоскопы, искусственные клапаны сердца и т. п.). Такому прикреплению способствует также вырабатываемое многими штаммами эпидермального стафилококка слизистое вещество, которое располагается на поверхности его клеточной стенки.
4. Использование готовых лекарственных форм, антисептиков и дезинфектантов, которые нередко загрязнены различными видами бактерий и грибов, способных вызывать оппортунистические инфекции.
5. Нарушение санитарно-гигиенического режима в больничных учреждениях, особенно связанного с питанием, соблюдением чистоты воздуха в операционных, перевязочных, реанимационных и других помещениях, а также правил личной гигиены.
6. Занос в лечебные учреждения вирусов, возбудителей острых респираторных или острых кишечных заболеваний.
7. Появление в больничном учреждении бактерионосителей или больных со скрытыми, трудно выявляемыми формами инфекционных заболеваний.
8. Нарушение принципов рациональной антибиотико– и химиотерапии и отсутствие постоянного контроля за распространением лекарственно-устойчивых форм патогенных и условно-патогенных бактерий.
9. Действие иных факторов, которые не всегда могут быть определены.
Пути передачи возбудителей. Возбудители внутрибольничных инфекций могут передаваться всеми возможными путями: воздушно-капельным, воздушно-пылевым, алиментарным, половым, с помощью прямого и непрямого контакта, трансфузионно, через кровь и ее препараты, от матери к ребенку, во время родов и после родов (ВИЧ, вирусы гепатита В, С, D, G, TT).
Микробиологическая диагностика внутрибольничных инфекций имеет свои сложности и особенности. Они проистекают прежде всего из большого разнообразия возбудителей, поэтому диагностика их требует сочетания различных методов с учетом возможных видов возбудителей (разные виды бактерий, вирусов, грибов). При бактериологической диагностике гнойно-воспалительных заболеваний могут быть одновременно обнаружены ассоциации стафилококков с различными грамотрицательными бактериями или ассоциации разных видов грамотрицательных бактерий. В случаях выделения условно-патогенных бактерий важное значение имеет определение количественного содержания их в исследуемом материале: чем выше концентрация того или иного вида бактерий в нем, тем вероятнее его этиологическая роль. Например, при исследовании мокроты больных, страдающих заболеваниями дыхательных путей, вызываемыми условно-патогенными бактериями, концентрация истинного возбудителя, как правило, составляет 105– 106 клеток на 1 мл. Однако содержание бактерий в исследуемом материале может сильно варьировать в зависимости от ряда условий. Поэтому важно осуществить видовую идентификацию бактерий, чтобы определить их потенциальные патогенные свойства. С этой целью целесообразно производить посевы исследуемого материала на различные питательные среды. Выделение возбудителей, которые относятся к известным видам бактерий, облегчает бактериологическую диагностику. В случае выделения условно-патогенных бактерий бактериологическую диагностику желательно сочетать с серологическими исследованиями. Различные серологические реакции позволяют выявить специфические антигены в крови больного, обнаружить специфические антитела (нарастание их титра) к предполагаемому возбудителю и, таким образом, обоснованно подтвердить диагноз.
Профилактика. Для предупреждения внутрибольничных инфекций и борьбы с ними большое внимание уделяют разработке специальной системы эпидемиологического надзора. Основные принципы его заключаются прежде всего в организации систематического учета и регистрации госпитальных инфекций; в определении их структуры по локализации патологического процесса; в определении состава возбудителей и в изучении их биологических свойств, в том числе отношения к антибиотикам, степени вирулентности. Необходимо следить за циркуляцией госпитальных штаммов в лечебном учреждении, выявлять причины, которые способствуют формированию постоянных носителей таких штаммов и т. п. Важная роль в профилактике внутрибольничных инфекций принадлежит также разработке эффективных методов контроля за поддержанием эпидемиологического благополучия лечебнопрофилактических учреждений.
Микроорганизмы полости рта и вызываемые ими болезни
Ротовая полость топографически делится на два отдела: передний – преддверие рта, и собственно полость рта. Они широко сообщаются друг с другом при открытом рте. При закрытом – полость рта представляет собой узкую горизонтальную щель, образуемую сводом твердого нёба и языком; боковые края языка в таком положении почти плотно прикасаются к челюстям и язычной поверхности зубов. Полость рта выстлана слизистой оболочкой, в толще которой расположены многочисленные мелкие слюнные, слизисто-слюнные и сальные железы. Кровоснабжение, лимфоток и иннервация стенок полости рта тесно связаны с сосудистой и нервной системами челюсти. Щелевидное пространство между пришеечной поверхностью зуба и прилегающим к нему свободным краем десны называют зубодесневым, или десневым, карманом.
Полость рта участвует в акте дыхания, образовании голоса и артикуляции речи. Но одна из главных ее функций – прием, размельчение пищи и проталкивание ее в глотку. В полости рта начинаются и первые этапы пищеварения. Это обусловлено наличием в слюне ферментов, расщепляющих углеводы, а также ряда анализаторов, рецепторные отделы которых располагаются в слизистой оболочке и перицементе. Анализаторы позволяют отличать пригодную пищу от ненужных и вредных для организма веществ и судить о вкусовых и физических качествах пищи. Слизистая оболочка полости рта и зубы обладают различными типами поверхностной чувствительности. В полости рта постоянно содержится жидкость – слюна. Она состоит из секрета трех пар больших слюнных желез (околоушных, подъязычных и подчелюстных) и большого количества содержащихся в полости рта слизистых желез. Слюна содержит муцин, белок, различные ферменты (в том числе птиалин), секреторные иммуноглобулины IgAs, другие органические и неорганические вещества, остатки пищи.
Благодаря постоянному наличию питательных веществ и оптимальным для размножения многих микроорганизмов температуре (37 °C) и рН (слабощелочная, около 6,9 – 7,0) полость рта является средой, исключительно благоприятной для существования и размножения самых различных видов микроорганизмов. В больших количествах они постоянно обнаруживаются на слизистой оболочке щек, десен, языка, в десневых карманах и на зубах. В слюне количество их может достигать 108 клеток на 1 мл, что соответствует количеству хорошо размножающихся бактерий в 1 мл МПБ. Эти микроорганизмы в известной мере представляют смешанную флору из различных областей полости рта, однако большинство из них присутствует на поверхности зубов. Накапливаясь на зубах, они образуют так называемые бактериальные, или зубные, бляшки. Содержание бактерий в них достигает 1011 клеток на 1 г сухого веса, что соответствует количеству бактерий в колонии, выросшей на плотной среде.
Микрофлора полости рта подразделяется на постоянную и случайную. Постоянная, нормальная, специфическая микрофлора сформировалась благодаря определенным, эволюционно выработанным отношениям симбиоза и антагонизма между различными видами микроорганизмов, с одной стороны, и между ними и защитными механизмами макроорганизма, с другой.
Постоянная, нормальная микрофлора ротовой полости представлена в основном комменсалами. Она, несомненно, выполняет ряд важных для организма функций: стимулирует развитие лимфоидной ткани и играет важную защитную роль. Представители нормальной микрофлоры, благодаря антагонистическому воздействию на представителей различных патогенных видов бактерий, попадающих в полость рта, подавляют их размножение. Нормальная микрофлора во многом обеспечивает самоочищение ротовой полости. Как и другие представители нормальной микрофлоры кишечного тракта, микроорганизмы полости рта способствуют снабжению организма ценными аминокислотами и витаминами, которые секретируются ими в процессе метаболизма. Наконец, продукты жизнедеятельности этих микроорганизмов могут стимулировать секрецию слюнных и слизистых желез, выделение слюны, необходимой для постоянного обмывания слизистой полости рта и осуществления актов приема пищи, жевания и глотания.
Микрофлора полости рта представляет собой сложнейшую форму биоценоза, в котором постоянно сосуществуют аэробы, факультативные и облигатные анаэробы, представленные многочисленными и разнообразными видами грамположительных и грамотрицательных бактерий. Исторически между ними в соответствии с имеющимися в полости рта условиями сложились определенные сбалансированные взаимоотношения. Нарушение этого баланса, например в результате нерационального применения антибиотиков, – частая причина дисбактериоза оральной микрофлоры. В этих случаях возникают «лекарственные» поражения слизистой оболочки (стоматиты, глосситы, ангины и т. п.). Их возбудителями чаще всего оказываются грибы рода Candida, энтерококки, различные грамотрицательные палочки (протей, кишечная палочка и др.).
Наиболее значительную часть нормальной оральной микрофлоры в различных областях полости рта представляют α-, β– и γ-стрептококки: факультативно-анаэробные (в том числе S. salivarius, S. mitis, кариесогенные и др.) и облигатные анаэробы (Peptostreptococcus), а также грамположительные нитевидные микроорганизмы (Actinomyces). В составе микрофлоры полости рта обнаруживаются такие организмы, как лактобациллы и грамнегативные кокки, относящиеся к родам Neisseria и Veillonella, а также грамотрицательные бактерии, строгие анаэробы из семейства Bacteroidaceae (Bacteroides, Fusobacterium, Leptotrichia). К постоянной микрофлоре полости рта следует отнести различные виды спирохет (Treponema denticola, T. orale, T. macrodentium, Borrelia buccalis), микоплазмы (M. salivarium, M. orale), нокардии, а также другие такие микроорганизмы, которые пока не удается культивировать, так как условия их роста слабо изучены.
К случайной микрофлоре полости рта относятся комменсалы, обитающие на других слизистых оболочках и коже, сапрофиты внешней среды и различные патогенные микроорганизмы, которые попадают в полость рта в результате аэрогенного или алиментарного заражения от больных или бактерионосителей. Очень высокой способностью адаптироваться к существованию в ротовой полости обладают стафилококки, стрептококки серологических групп A, C, D, F, G; коринебактерии; грибы кандида; вирусы герпеса, эпидемического паротита и др. В связи со сложным видовым составом оральной микрофлоры не всегда легко определить, какой (какие) специфический патоген является возбудителем того или иного патологического процесса в полости рта человека. Определенные виды возбудителей или их группы могут оказывать существенное влияние своими метаболическими процессами на развитие болезни. Оральные бактерии обладают многими токсическими факторами, с помощью которых они опосредуют свое патогенное действие. Например, активность таких бактериальных ферментов, как гиалуронидаза, нейраминидаза, коллагеназа, муциназа, протеазы и т. п., может оказать существенное воздействие на формирование и развитие патологического очага. Другим примером веществ, способных оказывать пагубные действия на ткани организма, являются кислые метаболиты и конечные продукты, особенно органические кислоты, образующиеся при потреблении бактериями углеводов.
Болезни зубов протекают обычно в виде хронических инфекций. В табл. 56 представлены наиболее важные сведения о них и микроорганизмах, которые можно рассматривать в качестве их потенциальных возбудителей.
Таблица 56
Основные болезни зубов и микроорганизмы, потенциально участвующие в их развитии

В связи с тем, что свойства ряда этих микроорганизмов выше не были рассмотрены, ниже приводится характеристика наиболее важных представителей микрофлоры полости рта.
Peptostreptococcus. Этот род включает 5 видов: P. anaerobius, P. productus, P. lanceolatus, P. micros и P. parvulus. Пептострептококки имеют форму шаровидных или овальных клеток диаметром 0,7 – 1,0 мкм, иногда 0,3 – 0,5 мкм. Располагаются парами в виде коротких или длинных цепочек, жгутиков не имеют, спор не образуют, грамположительны, строгие анаэробы. Хемоорганотрофы. Сбраживают углеводы (за одним исключением) с образованием кислоты или газа либо того и другого. Некоторые виды образуют газ в пептонной воде без углеводов. При ферментации углеводов и пептона образуют следующие кислоты (по отдельности или в сочетаниях): уксусную, муравьиную, пропионовую, масляную, изомасляную, валериановую, капроновую, янтарную. Нитраты не восстанавливают, каталазы не имеют, индола обычно не образуют, желатин не разжижают. Редко обладают гемолитическими свойствами. Не образуют лецитиназы, липазы и ацетоина. Не сбраживают адонита, эритрита и гликогена. Выделены из нормальных и инфицированных женских половых путей, из дыхательных путей и кишечника здоровых людей и животных, из септических ран, при аппендиците, а также из ротовой полости при гноеродных инфекциях. Дифференциальные признаки, по которым различают виды этого рода, представлены в табл. 57.
Помимо пептострептококков, в полости рта обитают факультативные анаэробные оральные стрептококки. По своим общим биологическим свойствам оральные стрептококки соответствуют характеристике рода Streptococcus, к которому они относятся.
Основные свойства кариесогенных стрептококков приведены ниже. Дифференциальные признаки некоторых видов оральных стрептококков представлены в табл. 58.
Таблица 57
Дифференциальные признаки видов рода Peptostreptococcus
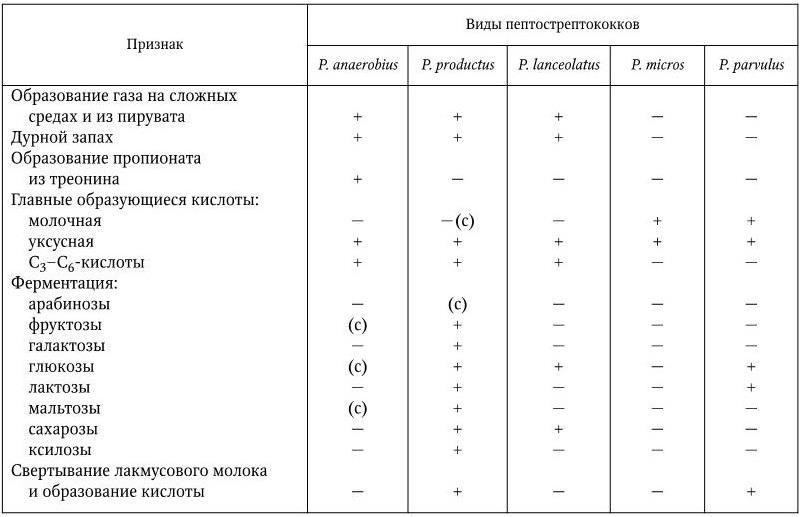
Примечание. (+) – признак положительный; ( – ) – признак отсутствует; (с) – наблюдается слабая положительная реакция.
Таблица 58
Дифференциальные признаки некоторых видов оральных стрептококков
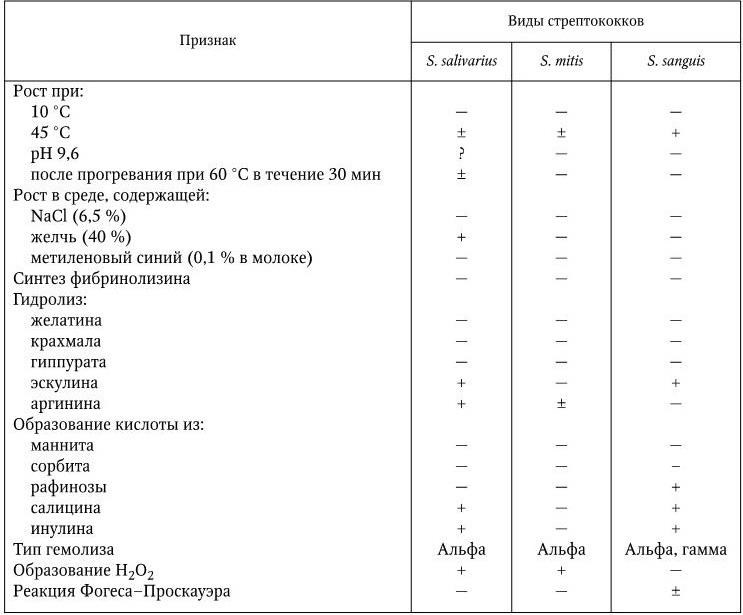
Примечание.(+) – признак положительный; ( – ) – признак отсутствует; (±) – признак непостоянный, у одних штаммов положительный, у других – отсутствует.
Veillonella. К роду Veillonella (семейство Veillonellaceae) относятся мелкие (0,3 – 0,5 мкм в диаметре), грамотрицательные, неподвижные, не образующие спор анаэробные кокки. При светооптической микроскопии они выглядят в виде диплококков, скопления клеток или в виде коротких цепочек. При электронной микроскопии одиночные клетки имеют шаровидную форму, а диплококки уплощены в месте соединения клеток. Содержание Г + Ц в ДНК составляет 40 – 44 мол %. Оптимальная температура для их роста 30 – 37 °C, ниже 18 °C и выше 45 °C не растут. Диапазон рН для роста 6,5 – 8,0. Хемоорганотрофы со сложными питательными потребностями. Углеводы и многоатомные спирты не ферментируют. Желатин не разжижают, индола не образуют, гемолитическими свойствами не обладают, восстанавливают нитраты в нитриты, образуют сероводород из серусодержащих аминокислот. Из лактата образуют ацетат, пропионат, СО2 и Н2. Для выделения культур используют агаровые среды, содержащие лактат и ванкомицин (7,5 мкг/мл), к которому вейллонеллы устойчивы в концентрации 500 мкг/мл. Колонии на плотной среде мелкие (1 – 3 мм), гладкие, чечевицеобразные, ромбовидные или сердцевидной формы, серовато-белые и маслянистые, непрозрачные.
Семейство Bacteroidaceae. В полости рта обитают представители главным образом следующих родов этого семейства: Bacteroides, Fusobacterium, Leptotrichia.
Bacteroides. Род включает более 45 видов. К нему относятся грамотрицательные, не образующие спор, подвижные (перитрихи) или неподвижные палочки, строгие анаэробы. Основное отличие бактероидов от рода фузобактерий состоит в том, что они образуют из глюкозы и пептона в качестве одного из главных продуктов масляную кислоту (без изомасляной и изовалериановой кислот). Бактероиды – хемоорганотрофы. В процессе метаболизма углеводов или пептона продуктами брожения, кроме масляной кислоты, являются также комбинации янтарной, молочной, уксусной, муравьиной и пропионовой кислот. Каталазу, лецитиназу и липаз обычно не образуют. Гиппурат не гидролизуют. Оптимальная температура для роста 37 °C, рН 7,0. Содержание Г + Ц в ДНК составляет 40 – 55 мол%.
Для дифференциации на виды учитывают комплекс признаков, в том числе образование черного пигмента на агаре с лаковой кровью или желатином, степень сбраживания углеводов, рост в 20 % желчи, образование индола, потребность в гемине, образование кислот при ферментации ряда углеводов, форма клеток, подвижность, образование газа, восстановление нитратов в нитриты, гидролиз желатина, эскулина и др.
Отличительные признаки Bacteroides melaninоgenicus: образуют черный пигмент на агаре с лаковой кровью. Колонии на такой среде через 2 – 3 дня инкубации серые или коричневые, или черные, диаметром 0,5 – 3,0 мм, чернеют при более продолжительной инкубации (5 – 14 дней). На бульоне с глюкозой при росте образуют диффузное помутнение и осадок. Большинство штаммов для роста нуждается в гемине (1 мкг/мл) или в менадионе (0,1 мкг/мл), или в обоих. Растут при температуре 25 °C и рН 8,5; некоторые штаммы растут при 45 °C. Выделены из слюны, мочи, испражнений, а также при инфекционных заболеваниях полости рта, мягких тканей, дыхательных путей, кишечного и урогенитального трактов.
По степени ферментативной активности B. melaninogenicus подразделяют на три подвида: сильно ферментирующие, слабо ферментирующие и неферментирующие. Подвиды различаются по сахаролитической, протеолитической активности и по образованию кислоты из глюкозы.
1. Сильно сахаролитический, непротеолитический B. melaninogenicus subsp. melaninogenicus – из глюкозы образует кислоту, протеолитическими свойствами не обладает.
2. Умеренно сахаролитический, умеренно протеолитический B. melaninogenicus subsp. intermedius.
3. Не ферментирующий глюкозы B. melaninogenicus subsp. asaccharolyticus.
Отличительные признаки B. oralis: черного пигмента не образует; углеводы сбраживает интенсивно, один из главных продуктов сбраживания – янтарная кислота. Гемин для роста не требуется. Из арабинозы кислоты не образует. Длинных и тонких клеток не образует. Колонии на плотной среде через два дня круглые, гладкие, выпуклые, полупрозрачные, диаметром 0,5 – 2,0 мм. Гемолитическими свойствами, как правило, не обладает. На сахарном бульоне рост сопровождается помутнением, без осадка или с образованием осадка. Декарбоксилаз лизина, орнитина, аргинина и глутаминовой кислоты, а также уреазы и сероводорода не образует. Выделены из десневых карманов у людей и при инфекциях полости рта, верхних дыхательных и половых путей.
Fusobacterium включает 16 видов. К роду относятся грамотрицательные, не образующие спор бактерии, неподвижные или подвижные (перитрихи). Хемоорганотрофы. Ферментируют ряд углеводов. Продуктами сбраживания углеводов или пептона являются молочная, уксусная, масляная кислоты, меньше образуется пропионовой, янтарной и муравьиной кислот. Пируват превращают в ацетат и бутират.
Каталазу обычно не образуют. Строгие анаэробы. Оптимальная температура для роста – 37 °C, рН 7,0. Содержание Г + Ц в ДНК составляет 26 – 34 мол %. Виды дифференцируют по следующим признакам: образование индола, пропионата из лактата или треонина; гидролиз эскулина; образование кислоты из лактозы, маннозы, мальтозы, маннита, сахарозы; образование газа в глубине глюкозного агара; форма клеток; восстановление нитратов, подвижность.
К виду F. plauti относятся подвижные (перитрихи) палочки длиной около 10 мкм, не образующие индола; не образующие (или почти не образующие) газа в глубине глюкозного агара; не восстанавливающие нитраты и не гидролизующие эскулин.
Leptotrichia. Лептотрихии имеют вид прямых или слегка изогнутых грамотрицательных палочек диаметром 1,0 – 1,5 мкм и длиной 5,0 – 15,0 мкм, с одним или двумя закругленными или, чаще, заостренными концами. Две или больше клеток объединяются в септированные, различной длины нити, которые в старых культурах достигают длины 200 мкм и чаще переплетаются друг с другом. При лизисе клеток в нитях появляются круглые шаровидные или луковицеобразные вздутия. Ветвящихся и булавовидных клеток не образуют. Неподвижны. Строгие анаэробы. Гетеротрофы со сложными питательными потребностями. Глюкозу ферментируют с образованием кислоты без газа. Главные продукты брожения – молочная и уксусная кислоты, масляной кислоты не образуют. Реакция Фогеса – Проскауэра отрицательная. Желатин не разжижают, нитраты обычно не восстанавливают. Индола, H2S и каталазы не образуют. Оптимальная температура для роста 37 °C, ниже 25 °C и выше 45 °C не растут; оптимальная рН 7,2 – 7,4. Содержание Г + Ц в ДНК составляет 32 – 34 мол %. Место обитания – ротовая полость человека.
Leptotrichia buccalis – типовой вид рода. Отличительные признаки: в столбике агара образуют дольчатые, свернутые, извилистые колонии, которые напоминают голову Медузы; на среде, содержащей кристаллический фиолетовый, колонии имеют радужный вид. Поверхность колоний по консистенции варьирует от маслянистой до хрупкой. L. buccalis лучше растет в атмосфере, содержащей 5 % СО2, и на средах с добавлением сыворотки, асцитической жидкости или крахмала. Рост в глубине агарового столбика начинается обычно на 1 см ниже его поверхности. Роста не происходит в отсутствие 2 % NaCl. Хорошо растет в среде, содержащей 0,001 % кристаллического фиолетового или 10 мкг/мл стрептомицина. Ферментирует глюкозу, фруктозу, мальтозу, маннозу и сахарозу с образованием кислоты без газа. Обычно ферментирует также салицин, трегалозу, галактозу, лактозу, рафинозу и крахмал. Не образует кислоты из арабинозы, дульцита, инулина, глицерина, маннита, рамнозы, сорбита и ксилозы; не ферментирует лактаты.
Род Lactobacillus включает в себя не менее 25 видов. Бактерии имеют вид палочек от длинных и тонких до коротких типа коккобактерий. Нередко образуют цепочки, особенно в поздней стадии log-фазы. Как правило, неподвижные, редко встречаются подвижные (перитрихи). Спор не образуют, в молодых культурах грамположительны; в старых культурах и при повышенной кислотности становятся грамотрицательными. У некоторых штаммов обнаруживаются зернистость, биполярные включения или полосатость при окраске по Граму или метиленовым синим. Метаболизм бродильный, но могут расти и на воздухе; некоторые – строгие анаэробы. Одно из важнейших свойств – способность ферментировать сахара с образованием молочной кислоты, но лактата не сбраживают. Дополнительные продукты брожения – уксусная и янтарная кислоты, СО2 и этанол. Желатин не разжижают, индола и сероводорода не образуют, каталазо– и цитохромотрицательны. Нитраты восстанавливают редко и только при рН выше 6,0. Редко образуют пигмент от желтого или оранжевого до ржавого или кирпично-красного цвета. Обладают сложными питательными потребностями, специфическими для каждого вида. Содержание Г + Ц в ДНК составляет 35 – 54 мол %. Температурные границы роста от 5° до 53 °C, оптимальная температура обычно 30 – 40 °C. Кислотолюбивы – оптимальная рН 5,5 – 5,8. Обычно растут при рН 5,0 и ниже. Встречаются в различных молочных продуктах, в воде, сточных водах, пиве, вине, на фруктах и в фруктовых соках, в солениях, маринадах, закваске для теста. Являются обитателями ротовой полости, кишечного тракта и влагалища многих теплокровных животных и человека.
Отличительные признаки Lactobacillus casei: короткие или длинные палочки диаметром менее 1,5 мкм, очень часто имеют уплощенные концы и образуют цепочки, неподвижны. Колонии на плотной среде гладкие, имеют форму чечевицы или алмаза, беловатого или светло-желтого цвета. Рост на бульоне сопровождается помутнением. Обычно ферментирует сорбит; мальтозу и сахарозу часто ферментирует медленнее; гликоген и крахмал не расщепляет. Основной продукт брожения – молочная кислота. Рибозу ферментирует с образованием молочной и уксусной кислот без газа. Для роста нуждается в рибофлавине, фолиевой кислоте, пантотенате кальция и ниацине.
Три подвида L. casei дифференцируют по следующим признакам (табл. 59).
Таблица 59
Подвиды L. casei

От всех других лактобацилл L. casei отличается тем, что до 90 % штаммов всех трех подвидов хорошо растут на среде с пируватом и ферментируют его. Остальные виды лактобацилл этим свойством не обладают. Содержание Г + Ц в ДНК L. casei около 46 мол %. L. casei – постоянный обитатель полости рта, кишечного тракта и слизистой влагалища человека.
Род Actinomyces. К нему относятся грамположительные, неравномерно окрашивающиеся, не образующие спор и неподвижные бактерии. Они не обладают кислотоустойчивостью. Могут образовывать, особенно в 48-часовых микроколониях, нити с истинным ветвлением.
Имеют форму дифтероидных или ветвящихся палочек, нередко в виде V-, Y– или Т-образных форм. Хемоорганотрофы. Сбраживают углеводы с образованием кислоты без газа. Конечные продукты брожения глюкозы – уксусная, муравьиная, молочная и янтарная кислоты, но не пропионовая. Протеолитическая активность наблюдается редко и слабая. Индола не образуют, уреазы не имеют. Факультативные анаэробы. Лучше растут в присутствии СО2. Для роста нуждаются в органическом азоте. Виды дифференцируются по характеру микроколоний (гладкие или нитевидные) и по биохимическим признакам.
Actinomyces viscosus. Отличается от остальных видов тем, что образует каталазу, у остальных видов этот признак отсутствует. Другие отличительные признаки A. viscosus: микроколонии нитевидные; восстанавливает нитраты; не ферментирует арабинозу, рибозу и ксилозу; реакция с метиловым красным положительна; реакция Фогеса – Проскауэра отрицательна; на агаре с тремя сахарами и железом (среда TSI)
образует H2S; гидролизует эскулин, не гидролизует желатин. Различают два серотипа. Выделены из ротовой полости человека, крыс и хомячков. У крыс и хомячков вызывают болезни периодонта, спонтанные и при экспериментальном заражении.
Семейство Spirochaetaceae. В полости рта у человека обнаруживаются следующие виды спирохет: Treponema denticola, T. macrodentium, T. orale и Borrelia buccalis.
Treponema denticola имеет вид тонких спиральных клеток длиной 6,0 – 16,0 мкм и диаметром 0,10 – 0,25 мкм. Концы клеток слегка изогнуты. Две осевые нити (фибриллы) присоединены к каждому концу клетки. Очень немногие осевые нити как бы протянуты между концами клеток. Подвижны. Молодые клетки быстро вращаются вокруг своей оси. Растут хорошо на среде с пептоном, дрожжевым экстрактом и сывороткой в анаэробных условиях. Колонии через две недели культивирования белые, диффузные, размером 0,3 – 1,0 мм. Растут при температуре от 25 до 45 °C. Оптимальная температура 37 °C. Оптимальная для роста рН 7,0; могут расти в диапазоне рН от 6,5 до 8,0. Рост угнетается в присутствии 3 % и более NaCl или 1 % желчи. Для роста обязательно требуется добавление сыворотки животных. Рост стимулирует добавление кокарбоксилазы. Углеводы не ферментирует. Гидролизует крахмал, гликоген, декстрин, эскулин, желатин, но не гиппурат. Большинство штаммов образует индол и H2S. Проба с метиловым красным отрицательная. Содержание Г + Ц в ДНК составляет 37 – 38 мол %. Обнаруживается в полости рта людей и шимпанзе, обычно в местах соединения зубов с деснами.
Treponema orale – тонкие спиральные клетки длиной 6 – 16 мкм и диаметром 0,10 – 0,25 мкм. Обычно образуют цепочки. Одна осевая нить прикреплена к каждому концу клетки. В бульонной культуре концы клеток часто зернисты. Обладают активной подвижностью. Растут на среде, содержащей пептон и дрожжевой экстракт, а также на среде, применяемой для выращивания микоплазм (PPLO) без кристаллического фиолетового. Каждая из этих сред содержит глюкозу, цистеин, никотинамид, кокарбоксилазу, тетрагидрохлорид спермина, натрий изобутират, а также 10 % инактивированной кроличьей сыворотки или 0,05 % α2-глобулина. В жидкой среде дает равномерное помутнение. Углеводы не ферментирует, но ферментирует аминокислоты; образует индол и H2S. Гидролизует желатин, но не крахмал. Оптимальная для роста температура 37 °C, рН 7,0. Содержание Г + Ц в ДНК составляет 37 мол %. Обнаруживается в десневых карманах у людей.
Treponema macrodentium – тонкие спиральные клетки длиной 5 – 16 мкм и диаметром 0,10 – 0,25 мкм. Концы клеток заострены. Одна осевая нить прикреплена к каждому концу клетки. Очень подвижны, молодые клетки обладают быстрым вращательным движением. Растут на среде, содержащей пептон, дрожжевой экстракт, 10 % сыворотки или асцитической жидкости, кокарбоксилазу, глюкозу и цистеин. Для роста обязательно требует добавления животной сыворотки, которая может быть заменена изобутиратом, спермином и никотинамидом. Углеводы ферментирует и использует как источники энергии. Ферментирует с образованием кислоты без газа глюкозу, фруктозу, мальтозу, ксилозу, сахарозу, галактозу и рибозу. Не ферментирует маннозу, рамнозу, лактозу, арабинозу, маннит, инулин, сорбит и салицин. Крахмал не гидролизует, но гидролизует желатин. Индола не образует, образует сероводород. Оптимальная для роста температура 37 °C, рН 7,0. Содержание Г + Ц в ДНК составляет 39 мол %. Обнаруживается в десневых карманах у людей.
Borrelia buccalis – извитые клетки длиной 7 – 20 мкм и диаметром 0,3 – 0,4 мкм. Это одна из наиболее крупных оральных спирохет, вяло подвижная: обладает извивающейся, сгибательной и слабой вращательной подвижностью. Этот вид боррелий мало изучен, однако он был выделен из полости рта человека.
Халитозис (лат. halitus – дыхание + osis – нездоровое состояние) – дурной запах изо рта – одно из наиболее распространенных неблагоприятных состояний полости рта, которым страдают около 70 % людей. Причиной его могут быть различные обстоятельства, привычки и болезни. Поэтому плохой запах изо рта служит потенциальным показателем плохого здоровья.
Халитозис может быть при диабете, заболевании печени, десен, почечной недостаточности, при синусите, туберкулезе, эмпиеме, хроническом гастрите, грыже пищевода, бронхите и других заболеваниях. Он часто возникает при курении табака, употреблении спиртных напитков. Халитозис обусловлен тем, что в выдыхаемом воздухе содержатся вещества, имеющие неприятный запах. Установлено, что в обычном выдохе человека содержится около 400 эфирных соединений, но далеко не все из них имеют неприятный запах. Чаще всего он связан с наличием в выдыхаемом воздухе метилмеркаптана и сероводорода. Они образуются во рту в результате гниения остатков пищи – органических соединений – и распада микробных клеток.
В полости рта обитает более 300 видов микроорганизмов, главным образом бактерий, а общее количество их во рту может достигать, особенно когда нарушена функция слюноотделения, более 1,5 триллионов.
В процессе своей жизнедеятельности они образуют и выделяют различные вещества, в том числе и с неприятным запахом. Кроме того, огромное количество микроорганизмов во рту постоянно разрушается под действием неблагоприятных для них факторов, включая секреторные IgAs, при этом также высвобождаются органические и неорганические соединения. В большинстве случаев халитозис обусловлен, по-видимому, изменением нормального состава микрофлоры полости рта – дисбактериозом: в ней возрастает количество тех видов микроорганизмов, которые участвуют в процессах гниения, сопровождающихся образованием меркаптанов, сероводорода и других дурно пахнущих соединений. Процессы гниения органических соединений во рту в основном связаны с активностью всегда имеющихся на слизистой рта и десен нескольких видов строгих анаэробов: Veillonella alcalescens, Peptostreptococcus anaerobius, P. productus, P. lanceolatus, Bacteroides melaninogenicus, Fusobacterium nucleatum, а также факультативного анаэроба Klebsiella pneumoniae. Последствием такого дисбактериоза могут быть заболевания десен и зубов.
Лечение халитозиса, если он обусловлен какой-то болезнью, сводится к лечению этого заболевания. Устранение халитозиса, обусловленного дисбактериозом микрофлоры полости рта, – тщательный уход за зубами, деснами и языком (на бороздках языка обитают миллионы бактерий, поэтому его следует также чистить), своевременное удаление зубного камня, употребление жевательной резинки без сахара и других веществ, способствующих слюноотделению (слюна – зубной эликсир, она удаляет бактерии и губительно действует на многие из них). Применение различных зубных эликсиров дает лишь кратковременный эффект. Главное – постоянный и тщательный уход за ртом и зубами.
Кариес зубов. Кариес (лат. caries – гниение) зубов – прогрессирующее разрушение твердых тканей зуба с образованием дефекта в виде полости. Древнее и наиболее распространенное поражение зубов. В основе его лежит поражение эмали, дентина, цемента. В зависимости от степени поражения твердых тканей зуба выделяют следующие стадии развития болезни.
1. Кариес в стадии пятна. Появление пятна на зубе происходит незаметно для больного.
2. Поверхностный кариес – поражена эмаль, но дентин не затронут.
3. Средний кариес – поражена эмаль и периферическая часть дентина.
4. Глубокий кариес – поражение, охватившее глубокую часть дентина.
Для объяснения кариеса были предложены различные теории: химико-бактериальная, физико-химическая, биологическая (биотрофическая) и бактериальная. За последние годы накопилось достаточно данных, свидетельствующих о том, что в этиологии кариеса зубов ведущую роль играют оральные кариесогенные стрептококки группы Streptococcus mutans. Впервые S. mutans был выделен от больного кариесом в 1924 г. Дж. Кларком. Но прошло много лет, прежде чем его роль в этиологии кариеса была достаточно обоснована. Этот стрептококк обнаруживается в зубных бляшках, в слюне, в испражнениях и в крови. S. mutans отличается от других стрептококков по морфологии колоний, его способности ферментировать маннит, сорбит;
некоторым другим биохимическим признакам (ферментирует рамнозу, салицин и инулин; не образует перекиси водорода, дает положительную реакцию Фогеса – Проскауэра); способностью клеток прилипать к гладкой поверхности в присутствии сахарозы и антигенными свойствами. Изучение антигенного строения позволило выявить 8 серотипов S. mutans: a, b, c, d, e, f, g, h. Изучение других свойств S. mutans показало, что существует несколько видов кариесогенных стрептококков: S. mutans, S. macacae, S. sobrinus, S. rattus, S. ferus, S. cricetus. В зубных бляшках человека чаще всего обнаруживается серовар с. Основные различия между кариесогенными стрептококками представлены в табл. 60.
Факторы патогенности S. mutans. Патогенность S. mutans связана прежде всего с его способностью прикрепляться к гладкой поверхности зубов и формировать кариесогенные бляшки. Это свойство опосредуется синтезом полимеров из сахарозы, которая присутствует в пище. У S. mutans обнаружен фермент глюкозилтрансфераза, которая расщепляет сахарозу на фруктозу и глюкозу и осуществляет синтез глюкановых полимеров. Образующийся при этом нерастворимый глюкан играет ключевую роль в прикреплении и агрегации S. mutans и в формировании зубных бляшек. Глюкозилтрансфераза обладает двумя активностями: декстрансахаразы и мутансинтетазы. Оба фермента необходимы для синтеза глюкана из сахарозы. На клеточной стенке S. mutans имеются рецепторы полисахаридной и белковой природы, с которыми соединяется глюкозилтрансфераза. Этот фермент не только обеспечивает синтез глюкана из сахарозы, но и служит посредником, с помощью которого нерастворимый глюкан прикрепляется к поверхности клеток стрептококка. В дополнение к глюканам S. mutans синтезируют из сахарозы фруктаны с помощью особого фермента – фруктозилтрансферазы. Фруктаны, как и глюканы, участвуют в формировании зубной бляшки, которая состоит из полисахаридного матрикса, связанного с различными видами бактерий. Благодаря образованию глюканов и фруктанов S. mutans вызывает межклеточную агрегацию как самого S. mutans, так и других видов бактерий, колонизирующих бляшки (Neisseria, Nocardia, Actinomyces viscosus, Candida). Формирование бляшки складывается из двух отдельных событий: а) прилипание бактерий к поверхности зуба; б) агрегация клеток, из которых формируется бактериальный матрикс бляшки. Глюкан стабилизирует бляшку и препятствует диффузии молочной кислоты, которую в большом количестве образует S. mutans. В результате этого молочная кислота оказывает продолжительное воздействие на поверхность зуба, следствием чего является растворение эмали. Таким образом, вирулентность S. mutans определяется его способностью прикрепляться к поверхности зубов благодаря образованию нерастворимых глюканов и фруктанов, формировать зубные бляшки и продуцировать молочную кислоту, отвечающую за деминерализацию зуба, которая и приводит к возникновению кариеса. Между кариесогенностью, адгезивностью in vitro и синтезом нерастворимого глюкана существует четкая корреляция. У мутантов S. mutans, утративших способность синтезировать нерастворимый глюкан, кариесогенные свойства значительно снижены.
Таблица 60
Дифференциальные признаки кариесогенных стрептококков

Примечание. (+) – признак положительный; ( – ) – признак отрицательный;? – не определено; * – штаммы серовара h ферментируют инулин, не образуют Н2О2, чувствительны к бацитрацину.
В последние годы уделяется большое внимание изучению генетики кариесогенных стрептококков. Проведено клонирование их генов, которые кодируют синтез глюкозилтрансферазы, фруктозилтрансферазы и декстраназы, необходимых для колонизации стрептококками поверхности зубов и десен. Установлено, что штаммы S. mutans синтезируют бактериоцины. Этот признак может быть использован для их идентификации.
В связи с широким распространением кариеса серьезное внимание уделяется разработке методов активной иммунизации. Возможность создания вакцины против кариеса подтверждается тем, что, во-первых, у больных, страдающих кариесом, в сыворотке крови обнаруживаются антитела к различным антигенам кариесогенных стрептококков. Во-вторых, в опытах по иммунизации хомячков и крыс вакцинами из S. mutans установлено, что они вызывают появление антител, обеспечивающих снижение кариеса. Этот иммунный эффект опосредуется как сывороточными IgG, так и секреторными IgAs, которые появляются в слюне и жидкости десневой щели, препятствуя взаимодействию S. mutans с поверхностью зуба и образованию зубной бляшки. Созданию вакцин из цельных клеток S. mutans, убитых или живых, препятствует то обстоятельство, что у некоторых серотипов S. mutans имеются антигены, общие антигенам тканей сердца, почек и скелетных мышц человека и животных, которые могут вызывать серьезные аутоиммунные нарушения. Проблема состоит в том, что для создания эффективной вакцины против кариеса зубов необходимо выявить у кариесогенных стрептококков такие антигены, которые обладали бы максимальными иммуногенными (протективными) свойствами и были бы безвредными для организма.
Лечение кариеса зависит от стадии развития патологического процесса. При начальном кариесе (пятно на эмали) применяют местное лечение препаратами фтора, кальция и реминерализующей жидкостью. В последние годы широко используют фторсодержащий лак. Лечение поверхностного кариеса – оперативное с последующим пломбированием. Лечение среднего кариеса – оперативное с последующим устранением дефекта и пломбированием. При глубоком кариесе большое внимание уделяют состоянию пульпы, от нее зависит метод лечения: применяют пломбирование с наложением под пломбу одонтотропных паст, которые уплотняют подлежащий дентин и оказывают противовоспалительное действие.
Пульпит (воспаление пульпы) возникает в большинстве случаев как осложнение кариеса в результате воздействия микроорганизмов, продуктов их жизнедеятельности и распада органических веществ дентина. Возникновению пульпита способствуют различные травмы зуба; воздействие некоторых химических веществ, содержащихся в пломбировочных материалах (фосфорная кислота, фтористый натрий, тимол и др.); неблагоприятные температурные влияния; оперативные и лечебные вмешательства на пародонте и т. п. Непосредственными виновниками воспаления пульпы чаще всего служат различные микроорганизмы: стрептококки (особенно группы D, реже групп C, A, F, G и др.); лактобациллы и их ассоциации со стрептококками; стафилококки и др. Проникают они в пульпу чаще всего из кариозной полости по дентинным канальцам, иногда ретроградно через одно из апикальных отверстий или дельтовидных ответвлений корневого канала. Источником инфекции служат патологические зубодесневые карманы, остеомиелитические очаги, гаймориты, другие воспалительные инфекционные очаги. Редко наблюдается гематогенный занос возбудителя (при значительной бактериемии). Механизмы защиты от воспаления связаны с активностью макрофагов, фибробластов и других клеточных элементов.
В основе патогенеза пульпита лежит комплекс структурных и функциональных нарушений, связанных между собой и проявляющихся в определенной последовательности. Степень этих нарушений зависит от вирулентности бактерий, вызывающих воспаление; действия их токсинов; продуктов метаболизма клеток, а также от реактивности пульпы и организма. Для острого пульпита характерно развитие экссудативных проявлений, так как воспаление протекает по типу гиперергической реакции, способствующей резкому отеку ткани пульпы. Ее объем увеличивается, и это вызывает болевой синдром. Спустя несколько часов от начала обострения воспаление принимает характер гнойного процесса, образуются инфильтраты и абсцессы. Исход острого пульпита – некроз пульпы, или процесс принимает одну из форм хронического пульпита, протекающего с обострениями.
В соответствии с особенностями течения пульпитов предложена следующая их классификация.
I. Острые формы воспаления.
1. Острые пульпиты (открытые и закрытые формы).
II. Хронические формы воспаления (открытые и закрытые формы).
1. Хронический пульпит простой.
2. Хронический пульпит гангренозный.
3. Хронический гипертрофический пульпит.
III. Обострившийся хронический пульпит.
Лечение. Существует два вида специализированного лечения пульпита: девитальный (удаление зуба) и витальный (с сохранением зуба) методы. Витальный подразделяется на консервативный и оперативные. Консервативный метод включает ряд последовательных этапов: обезболивание пульпы; удаление некротического дентина; формирование полости, антисептическая обработка ее, наложение лечебных смесей и пломбирование зуба.
Оперативные методы различаются по способу обезболивания пульпы. Если при этом используются девитализирующие пасты, то такие методы носят название девитальных. Если для обезболивания пульпы применяют препараты, которые не лишают ее жизненных свойств, то такие методы называют витальными. Оба способа подразумевают методы частичного удаления пульпы (ампутация) или ее полного удаления (экстирпация). Оперативные методы включают ряд последовательно проводимых этапов.
1. Оказание первой помощи (применяется только при острых формах пульпита).
2. Обезболивание или девитализация пульпы.
3. Вскрытие и препарирование полости зуба.
4. Ампутация или экстирпация пульпы.
5. Антисептическая обработка зубных тканей.
6. Наложение лечебных смесей.
7. Пломбирование корневых каналов.
8. Пломбирование зуба.
Профилактика пульпита заключается в применении средств, которые повышают устойчивость тканей зуба к действию кариесогенных факторов; в проведении периодических осмотров и санации полости рта, определяемой степенью активности кариеса.
Пародонт – комплекс тканей, состоящий из десны, альвеолярной кости, периодонта и зубов. Система входящих в пародонт тканей имеет близкую структуру, общее происхождение (за исключением эпителия слизистой оболочки десны), выполняет однотипные функции, имеет общую систему кровоснабжения и иннервации. Слизистая оболочка десны плотная по структуре и имеет бледно-розовую окраску. Снаружи она покрыта эпителием, остальные ее отделы представлены сосочковым слоем и собственно слизистой оболочкой. Подслизистого слоя десна, как правило, не имеет и плотно сращена с подлежащей надкостницей. Эпителий десны подходит к зубным тканям не в виде прямой линии, а под некоторым углом, образуя неглубокую складку – физиологический десневой карман. При заболеваниях пародонта дно физиологического кармана разрушается, и образуется патологический десневой карман, который служит одним из симптомов заболевания. Розовый цвет слизистой оболочки десны обусловлен наличием в ней огромного количества кровеносных сосудов. Пародонт выполняет следующие функции: 1) трофическую; 2) барьерную; 3) пластическую; 4) амортизирующую; 5) регуляции жевательного давления.
Заболевания пародонта, по данным ВОЗ (1978), наблюдаются у 80 % детей и почти у 100 % взрослого населения большинства стран мира. К этой категории болезней относятся все патологические процессы, поражающие пародонт. Они могут либо затрагивать одну ткань, либо поражать несколько или все ткани пародонта; возникают самостоятельно либо на фоне других заболеваний органов и систем организма. Патологические процессы в пародонте носят воспалительный, дистрофический или атрофический характер, либо имеет место их сочетание. В результате заболеваний пародонта существенно страдает жевательная функция, происходит потеря большого количества зубов, наблюдается интоксикация организма и изменение его реактивности.
Классификация заболеваний пародонта.
По существующей ныне классификации заболеваний пародонта их подразделяют на следующие основные формы:
I. Гингивит – воспаление десны, обусловленное неблагоприятным воздействием местных и общих факторов и протекающее без нарушения целостности зубодесневого прикрепления. Формы: катаральный, гипертрофический, язвенный. Течение: острый, хронический, обострившийся, ремиссия. Тяжесть процесса: легкий, средней тяжести, тяжелый. Распространенность процесса: локализованный, генерализованный.
II. Пародонтит – воспаление тканей пародонта, характеризующееся прогрессирующей деструкцией периодонта и кости. Течение: острый, хронический, обострившийся (в том числе абсцедирование), ремиссия. Тяжесть процесса: легкий, средней тяжести, тяжелый. Распространенность процесса: локализованный, генерализованный.
III. Пародонтоз – дистрофическое поражение пародонта. Течение: хронический, ремиссия. Тяжесть процесса: легкий, средней тяжести, тяжелый. Распространенность процесса: локализованный, генерализованный.
IV. Идиопатические заболевания пародонта с прогрессирующим лизисом тканей. По клиническим проявлениям, течению и прогнозу не укладываются в приведенные выше нозологические формы.
V. Пародонтомы – опухоли и опухолеподобные процессы в пародонте.
Этиология болезней пародонта. Этиологию и патогенез следует рассматривать применительно к каждой форме этой болезни с учетом ведущей роли местных или общих факторов, или их сочетания. Локализованные формы заболевания пародонта развиваются в результате действия местных факторов (травма, зубной камень, зубной налет), функциональной недостаточности и др. Среди общих факторов большое значение имеют гипо– и авитаминозы, особенно недостаток витаминов С, А, Е и группы В, которые влияют на функции клеточных элементов пародонта; нарушение обмена веществ; заболевания сосудистой, нервной и эндокринной систем организма. Большую роль в развитии воспаления пародонта играет зубной налет, который чаще всего образуется в области шейки зуба, в непосредственной близости ее десневого края. В зубном налете содержится большое количество микробных клеток, которые там размножаются, секретируют биологически активные вещества, экзотоксины и ферменты, а при разрушении микроорганизмов выделяются эндотоксины и различные антигены, которые обладают сильными токсическими и аллергенными свойствами. Все это обусловливает постоянное воздействие микробных факторов на слизистую оболочку десны. Зубной налет и факторы ротовой жидкости представляют собой сбалансированную биологическую систему. Нарушение равновесия между микробным биоценозом и состоянием слизистой оболочки полости рта – одна из важных причин заболевания пародонта. Поэтому в развитии воспалительных явлений в пародонте большую роль играют зубные бляшки, которые содержат огромное количество микроорганизмов. Благодаря их ферментативной активности происходят дегенеративные изменения соприкасающихся с ними клеток эпителиального покрова. В результате деполимеризации межклеточного вещества эпителия и основного вещества в соединительной ткани под действием бактериальных ферментов (гиалуронидаза, коллагеназа и др.) нарушается проницаемость эпителия; повышение проницаемости капилляров приводит к повреждению основного вещества и коллагена стромы; все это вместе способствует развитию воспалительных процессов в пародонте. В свою очередь воспаление способствует еще большему образованию зубных отложений. В образующихся патологических зубодесневых карманах формируются поддесневые бляшки и зубной камень, которые усиливают интоксикацию нервных окончаний пародонта. Формирование патологических зубодесневых карманов создает благоприятные условия для размножения микрофлоры полости рта. В содержимом зубодесневых карманов обнаруживаются в большом количестве нейтрофилы, меньше – других фагоцитов и лимфоцитов и большое количество грамположительных и грамотрицательных кокков (анаэробных и факультативно анаэробных) в ассоциации с бактероидами, фузобактериями, лептотрихами, спирохетами и простейшими. Эти микроорганизмы могут играть роль как первичного, так и вторичного звена в патогенезе заболеваний пародонта. В зависимости от вида, степени и продолжительности патогенного действия внешних факторов, а также от иммунного статуса организма возникают разные по характеру патологического процесса и клиники заболевания пародонта.
Общая симптоматика заболеваний пародонта. Заболевания пародонта развиваются медленно, в течение ряда лет. Вначале у больного появляются жалобы на чувство онемения в зубах, покалывание и зуд в области десен, неприятный привкус во рту. Потом появляются жалобы на кровоточивость десен, наличие зубных отложений, неприятный запах изо рта. Появляется подвижность зубов, вначале временная, а затем постоянная. Она неуклонно прогрессирует и постепенно заканчивается полной утратой зубов. В результате обнажения шеек и частично корней зубов возникают боли от температурных и химических раздражителей. Из-за нарушения статики зубов и их перемещения развиваются явления травматической артикуляции и окклюзии.
Гингивит. Заболевание, характеризующееся воспалением десен и протекающее без образования зубодесневых карманов, т. е. без нарушения целости зубоэпителиального прикрепления. Чаще всего имеет форму катарального (серозного) и гипертрофического гингивита. Острый гингивит обычно возникает на фоне общих заболеваний организма (инфекционно-аллергических, обусловленных вирусами, бактериями, грибами) и сопровождается поражениями других слизистых оболочек полости рта; либо вследствие повреждения десен механическими, физическими и химическими факторами. Хронический катаральный генерализованный гингивит развивается при заболеваниях сердечно-сосудистой системы, пищеварительного тракта, гормональных нарушениях, болезнях системы крови, иммунодефицитных болезнях, а также при приеме лекарственных веществ. Ведущая роль в патогенезе хронического локализованного катарального гингивита принадлежит зубным бляшкам с их сложной микробной флорой. Существенную роль в развитии гингивита играют эндотоксины и антигены грамотрицательных бактерий и различные ферменты микробного происхождения.
Лечение гингивита основано на принципе строго индивидуального подхода к больному с учетом его общего и стоматологического статуса. Оно носит комплексный характер с применением местного воздействия (консервативные, хирургические, ортопедические и физиотерапевтические методы) и общеукрепляющей терапии с использованием витаминов.
Пародонтит характеризуется воспалением всего комплекса тканей пародонта, сопровождается разрушением периодонта и костной ткани альвеолы и образованием патологических зубодесневых карманов. Пародонтит развивается обычно после гингивита и сопровождается воспалительными и дистрофическими изменениями в тканях. В ходе развития болезни происходит нарушение эпителиального прикрепления десны к зубу, разрушение связочного аппарата зуба, резорбция костной ткани цемента и дентина корня зуба. Пародонтит нередко вызывает тяжелые осложнения как в челюстно-лицевой области, так и во внутренних органах.
Патогенез и клиника пародонтита определяются структурными и функциональными особенностями пародонта, сенсибилизацией его тканей, нарушением трофики, а также рядом других факторов, в том числе патогенностью и антибиотикоустойчивостью микрофлоры полости рта. Острые локализованные пародонтиты встречаются очень редко. В патогенезе хронического локализованного пародонтита определяющую роль играют те же факторы, которые служат причиной хронических локализованных гингивитов.
Инфекционный пародонтит возникает как следствие непосредственного проникновения в пародонт микроорганизмов из канала зуба. Реже они заносятся гематогенным или лимфогенным путем. Воспаление пародонта может переместиться из патологического процесса в альвеолярном отростке челюсти, из рядом расположенных патологических очагов у соседних зубов (остеомиелит, гайморит и т. п.). При пародонтите, как и при гингивитах, обнаруживаются, как правило, не отдельные виды микроорганизмов, а их различные ассоциации, состоящие из стрептококков, пептострептококков, стафилококков, коринебактерий, бактероидов (особенно B. melaninogenicus), фузобактерий, лептотрих, нокардий, актиномицетов, лактобацилл, вейллонелл, спирохет и др.
Синдром пародонтального альвеолярного гноеистечения из десневого кармана. Основной симптом этого заболевания – образование кармана, выделяющего гнойную жидкость. Развитие десневого кармана происходит следующим образом.
1. В воспаленном участке десны эпителий десневого кармана опускается, обнажая шейку зуба.
2. Нарастание десквамативных процессов на внутренней поверхности десневого кармана приводит к появлению очагов микронекроза эпителия.
3. Деструктивные процессы в десневом кармане ведут к нарушению целости эпителиального покрова и изъязвлению кармана.
4. Одновременно с этими явлениями продолжается погружение эпителия вдоль корня и разрушение костных элементов, в результате чего образуется костный карман. Таким образом, возникает более стойкое и глубокое нарушение пародонта, которое распространяется не только на десну, но и на альвеолу.
Пародонтальное гноеистечение часто вызывается долго длящимся гингивитом. В некоторых случаях образование кармана может быть связано с нарушением физиологического перемещения зубов. При бактериологическом исследовании содержимого десневого кармана обнаруживаются различные виды микроорганизмов (грамположительные и грамотрицательные кокки, лактобациллы, спирохеты, амебы). Основная масса их обнаруживается главным образом в верхних слоях кармана; в более глубоких отделах десневых и костных карманов их содержится меньше. Хотя какого-либо специфического возбудителя этой болезни не обнаружено, все же возникновение пародонтального гноеистечения несомненно связано с действием тех или иных микроорганизмов, способных вызывать гнойно-воспалительные процессы. Поэтому для лечения болезни используют различные антисептические вещества и антибиотики.
Лечение пародонтита сводится к применению комплекса лечебных воздействий, которые включают в себя местные консервативные, физиотерапевтические, хирургические и ортопедические процедуры и применение средств, оказывающих общеукрепляющее влияние на весь организм.
Пародонтоз в чистом виде встречается редко, характеризуется генерализованным дистрофическим поражением всех тканей пародонта. Ведущими и определяющими факторами в патогенезе изменений десны и костной ткани при пародонтозе служат нарушения обмена, первичные явления гипоксии, обусловленные сосудистыми изменениями, которые приводят к нарушению синтеза белка, с чем и связана тканевая дистрофия. Наряду с дистрофией эпителия десны в соединительной ткани происходит отчетливая коллагенизация структур, дегенерация нервных окончаний, склероз сосудов. В костной ткани наблюдается уменьшение костно-мозговых пространств, склероз сосудов и утолщение компактной пластинки. Для клинической картины пародонтоза характерны медленное прогрессирующее течение, снижение высоты альвеолярного отростка и ретракция десны. Воспалительные явления, как правило, отсутствуют. Десна анемична и плотная на всем протяжении. Имеет место атрофия межзубных сосочков. Глубина зубодесневых карманов в пределах нормы. Эпителиальное прикрепление смещается на цемент корня. Нередко наблюдаются сужение периодонтальной щели и гиперцементоз, а также внутризубные дентикулы и петрификаты.
По степени клинических проявлений различают легкую, средней тяжести и тяжелую формы пародонтоза. Пародонтоз легкой степени не сопровождается выраженными субъективными ощущениями. Только некоторые больные жалуются на чувство жжения, зуда в деснах, преимущественно фронтальных зубов нижней челюсти. Иногда наблюдается боль в интактных зубах от температурных и химических воздействий. Десна бледная, истонченная, при прикосновении не кровоточит. Имеется незначительное количество зубного камня. Карманов нет, подвижности зубов также нет. Рентгенологически отмечается снижение высоты межальвеолярных перегородок до одной четверти, явлений остеопороза и расширения периодонтальной щели не наблюдается.
При пародонтозе средней тяжести субъективные расстройства выражены сильнее, при осмотре наблюдается значительная ретракция десны. Подвижности зубов и воспалительных изменений десны, а также карманов нет. Нередко имеются клиновидные дефекты. Вследствие ретракции десны межзубные промежутки зияют. Рентгенологически наблюдается снижение высоты межальвеолярных перегородок на 1/2 длины корня.
При пародонтозе тяжелой степени больные жалуются на повышенную чувствительность от температурных раздражителей. Воспалительных явлений в десне нет. Из-за ретракции десны корни обнажаются на 1/2 длины и более. Может быть подвижность зубов I – II степени. Карманы, как правило, отсутствуют. Рентгенологически наблюдается резорбция альвеолы на 1/2 и более длины корня, атрофия идет по горизонтальному типу.
Лечение пародонтоза носит комплексный характер, включает в себя меры местного и общего воздействия и при необходимости – ортопедическое лечение. Принимаются меры, направленные на улучшение кровоснабжения и регенерации тканей пародонта (массаж десен, электрофорез витаминов С, В, 1 – 2 % раствор фторида натрия и т. п.). При осложнениях воспалительного характера и образовании зубодесневых или костных карманов производится хирургическое лечение, как при пародонтите. Общее лечение проводится в соответствии с состоянием организма больного. При необходимости могут быть применены средства общего воздействия на организм, как при генерализованных гингивитах.
Идиопатические заболевания пародонта характеризуются лизисом тканей пародонта, в первую очередь кости альвеолы. К этой категории болезней относятся десмодонтоз и гистиоцитоз, объединяющие такие болезни, как эозинофильная гранулема, болезнь Хенда – Шулера – Крисчена, болезнь Леттерера – Зиве, а также синдром Папийона – Лефевра. Этиология и патогенез не известны.
Для идиопатических заболеваний характерно образование зубодесневых карманов с серозно-гнойными выделениями, подвижность зубов. При десмодонтозе отмечается симметричность поражения пародонта (область моляров и резцов). При остальных болезнях клиника сходна с клиникой пародонтита.
Лечение симптоматическое, в стадиях развития – хирургическое с удалением зубов в зоне поражения и с последующим ортопедическим лечением.
Пародонтомы. К этой группе заболеваний относятся все новообразования, исходящие из тканей пародонта, как доброкачественного, так и злокачественного характера. Чаще всего наблюдаются фиброматоз десен и эпулис (нарост на десне). Этиология и патогенез не известны. Для фиброматоза характерно бугристое разрастание слизистой оболочки десны по всему альвеолярному отростку. Болезнь медленно прогрессирует. Разрастания безболезненны. При рентгенологическом исследовании костная ткань обычно без изменений, возможен незначительный остеопороз. При эпулисе наблюдается разрастание десны, чаще межзубного сосочка, на ограниченном участке. Различают фиброзные, сосудистые и гигантоклеточные эпулисы. При рентгенографии обнаруживается очаговый остеопороз межзубной альвеолярной перегородки.
Лечение – хирургическое.
Профилактика заболеваний пародонта проводится в двух направлениях. Одно из них предусматривает предупреждение развития заболеваний пародонта и включает лечебно-оздоровительные мероприятия по профилактике и лечению общих заболеваний, борьбу с профессиональными вредностями и своевременную санацию зубов, которая должна обязательно заканчиваться тщательным удалением зубных отложений. Другое направление – предупреждение развития более тяжелых форм заболеваний пародонта и их возможных осложнений, т. е. своевременная диагностика и лечение ранних форм заболеваний пародонта.
Заболевания слизистой оболочки полости рта
Среди этой категории заболеваний особый интерес представляют язвенно-некротический стоматит (Венсана), сифилис, туберкулез и ВИЧ-инфекция полости рта. Для краткого описания клинических проявлений этих заболеваний нами с любезного разрешения профессора М. М. Царинского использованы некоторые его публикации.
При инфекционных заболеваниях, вызываемых некоторыми возбудителями, нередко наблюдаются изменения слизистой оболочки полости рта; иногда они являются первичными проявлениями этих заболеваний. К ним относятся: сифилис, туберкулез, ВИЧ-инфекция, лепра и гонорея. Микробиология этих заболеваний подробно изложена в соответствующих главах, но поскольку эти заболевания часто проявляются в полости рта, врачу-стоматологу важно уметь их своевременно диагностировать и осуществлять необходимые профилактические и лечебные меры.
Язвенно-некротический стоматит (Венсана). Этиология и патогенез этого заболевания полностью не раскрыты. Предполагается, что в его этиологии важную роль могут играть фузобактерии, бактероиды, спирохеты и другие микроорганизмы, в особенности их ассоциации. Болезнь возникает при ослаблении защитных сил организма (переохлаждение, гиповитаминозы, недостаточность секреторных IgAs на слизистой рта, различные стрессовые состояния и т. д.).
Заболевание протекает в форме острого и хронического воспаления. По тяжести течения процесса различают легкую, средней тяжести и тяжелую формы. В диагностике заболевания значительную роль играют дополнительные методы обследования: общий анализ крови, а также цитологические и бактериологические исследования. Лечение носит комплексный характер и включает общие и местные воздействия. При легкой и средней тяжести заболевания ведущая роль отводится местному лечению: активное удаление под анестезией местных некротических налетов слизистой, орошение раствором 1 % хлорамина, обработка ферментами, присыпание новарсенолом. Общее лечение сводится к назначению внутрь витаминов C и D. При тяжелой форме течения болезни применяют антибиотики. Выздоровление наступает через 3 – 5 дней при легкой и через 2 – 3 нед. при тяжелой форме болезни.
Сифилис – хроническое инфекционное заболевание всего организма, вызываемое бледной трепонемой. Основной путь заражения – половой, но возможно заражение через рот.
Первичный период длится 6 – 7 нед.; элементы поражения – твердые шанкры, которые чаще локализуются на языке, красной кайме губ, но могут быть и на других участках ротовой полости. Шанкры чаще единичные, могут быть нетипичными – иметь вид ссадины, эрозии или трещины. Поражения миндалин, как правило, односторонние, регионарные лимфатические узлы увеличены, плотны, безболезненны. В случае присоединения вторичной инфекции шанкр становится болезненным. Диагноз сифилиса ставится на основании обнаружения на поверхности шанкра и в пунктате регионарных лимфатических узлов бледной трепонемы. Серологические реакции становятся положительными через 4 – 5 нед. после заражения.
Вторичный сифилис часто проявляется только в полости рта. Различают вторичный свежий и вторичный рецидивный сифилис. Субъективные ощущения отсутствуют. Формы проявления – розеола, папула, пустула. Локализация – чаще зев, мягкое нёбо, нёбные дужки, слизистая щек, языка. В углах рта могут быть трещины, расположенные на инфильтрированном основании. Сифилитические папулы беловатого цвета с воспалительным ободком и четкими контурами. Они могут эрозироваться, на их поверхности появляется большое количество бледных трепонем. Диагноз сифилиса ставится на основании обнаружения бледных трепонем и положительных серологических реакций. Продолжительность вторичного сифилиса – от 4 – 6 нед. до 6 мес. Даже без специального лечения по истечении этого срока изменения в полости рта исчезают.
Третичный сифилис в полости рта проявляется в виде гумм, бугоркового сифилиса, склерозирующего глоссита. При расположении гумм на твердом нёбе имеют место некроз и секвестрация кости с последующим образованием дефекта. Гумму следует дифференцировать от раковой и туберкулезной язв. Бугорковый сифилис обычно локализуется на губах. Бугорки безболезненные, имеют синюшно-красный цвет, быстро распадаются с образованием язв с плотными краями. Регионарные лимфатические узлы не всегда изменены, серологические реакции часто отрицательны. В случае подозрения на сифилис больной должен быть обследован врачом-венерологом, который назначает соответствующее лечение с использованием противосифилитических средств. При изъязвлениях в полости рта используют противовоспалительную терапию и кератопластику, припудривание язв осарсолом, миарсенолом и т. п.
Туберкулез полости рта. Чаще наблюдается в виде вторичных туберкулезных поражений, вызываемых микобактерией туберкулеза. При туберкулезной волчанке в основном поражается кожа лица, однако процесс может захватывать губы и слизистую полости рта. Наиболее частая локализация в полости рта – десна верхней челюсти, верхняя губа, твердое нёбо, язык. Основной патологический элемент – туберкулезный бугорок размером 1 – 3 мм, мягкой консистенции. При разрушении бугорка в его центре образуется язва. Бугорки располагаются группами. При расположении их на губах образуются кровянистые корки, болезненные трещины. Регионарные лимфатические узлы увеличены, уплотнены и болезненны при пальпации. Микобактерии туберкулеза в язвах обнаруживаются не всегда. Туберкулез слизистой полости рта возникает в результате аутоинфекции из первичного легочного очага. Туберкулезная язва локализуется в местах наибольшего травмирования (слизистая щек, мягкого нёба). Язва быстро разрастается, она неглубокая, с неровными краями, болезненна. Окружающая слизистая отечна. Лимфатические узлы увеличены и болезненны.
Лечение проводится под контролем врача-специалиста. Местное лечение включает санацию полости рта. Лечение туберкулеза симптоматическое, с использованием для местного воздействия специфических противотуберкулезных химиопрепаратов и антибиотиков.
Поражения ротовой полости при ВИЧ-инфекции. Подробно микробиология, патогенез, клиника и причины иммунодефицита при ВИЧ-инфекции изложены в главе 57. Как известно, ВИЧ-инфекция характеризуется сложными проявлениями, отягощенными присоединением оппортунистических инфекций. При ВИЧ-инфекции возможны поражения и ротовой полости различного происхождения. Согласно литературным данным, при ВИЧ-инфекции обнаруживаются следующие поражения ротовой полости.
1. Поражения, вызываемые грибами рода Candida (налеты типа «молочницы»), встречаются у 75 % больных ВИЧ-инфекцией и у 35 % бессимптомных лиц с сероположительной реакцией (возможно, вирусоносители).
2. Бактериальные инфекции в виде некротизирующего гингивита, тяжелых форм пародонтита, изъязвлений в полости рта, вызванных различными видами бактерий.
3. Вирусные заболевания, вызванные вирусом простого герпеса или Herpes zoster.
4. Так называемая «волосатая» лейкоплакия и инфекция, вызванная вирусом папилломы человека.
5. Опухолевые поражения в виде саркомы Капоши, рака языка, лимфом.
6. Поражения невыясненной этиологии: афтозные стоматиты, сухость слизистой, двусторонние опухоли околоушных слюнных желез.
Все лица, у которых выявлены в ротовой полости указанные поражения, подлежат тщательному эпидемиологическому, клиническому и серологическому обследованию с целью выявления у них возможного заболевания СПИД или ВИЧ-инфекции (вирусоносительства). Больные СПИДом подлежат специальному лечению, а вирусоносители берутся под контроль.
Поскольку ВИЧ легко проникает в организм с остатками крови больного (носителя) через мельчайшие повреждения кожи и слизистых оболочек, исследование полости рта (как и другие лечебно-диагностические приемы – взятие крови, удаление зубов, введение крови и т. п.) у таких больных следует проводить с соблюдением строжайших мер, исключающих возможность заражения этим вирусом.
К ВОПРОСУ О ФИЛОСОФИИ ЖИЗНИ
О роли двух систем информации – генетической и умственной – в возникновении и развитии жизни на Земле
Изучение структуры и функции на молекулярно-биологическом уровне плазмид, вирусов и бактерий, в особенности механизмов их самовоспроизведения, неизбежно привели авторов данного учебника к необходимости рассмотреть многие очень сложные вопросы для того, чтобы понять следующее. Как возникла жизнь, как шло ее развитие, что предопределило возникновение миллионов различных видов живых существ, что объединило их всех в единую систему живой природы, наконец, как возник человек – разумное существо Homo sapiens – и чем он коренным образом отличается от высших животных, в том числе и от человекообразных обезьян?
В результате длительных размышлений была написана монография «Роль генетической и умственной систем информации в возникновении и развитии жизни на Земле» (Нальчик: Эльбрус, 2009), в которой и постарались найти ответы на перечисленные выше и другие вопросы, связанные с проблемами жизни.
В учебнике дается следующая характеристика гену: «Ген является единственным носителем и хранителем жизни». Поскольку наукой признано, что творцом жизни служит белок, структура и функции которого предопределяются соответствующим геном, за основу своего понимания указанных вопросов приняли положение о том, что каждый вид, точнее, каждое живое существо есть продукт реализации той генетической информации, которая заложена в его геноме (наборе генов). Поэтому жизнь могла возникнуть только в результате одновременного самозарождения первородных генов, первородных белков и генетического кода, так как для синтеза белка требуется ген, а для синтеза гена – белок. В связи с этим А. И. Коротяевым и была предложена аминокодоновая гипотеза самозарождения жизни. Эта гипотеза легла в основу понимания дальнейшей эволюции, вплоть до появления уникальной структурной единицы живой материи – клетки.
Что касается вопроса о происхождении человека, то и в этом случае необходимо подойти к нему с генетических позиций. Ни в коем случае не отрицая роли труда в происхождении и развитии человека, убеждаемся в том, что главную роль в появлении предка человека и его дальнейшей эволюции в сторону Homo sapiens сыграли соответствующие генетические предпосылки. Прежде всего, появление в геноме нашего предка таких генов, которые изменили не только внешний облик человека, но и способствовали возникновению у него двух главных аппаратов – мышления и голосового. С помощью аппарата мышления у человека появилась возможность мыслить словами, а голосовой аппарат позволил человеку свои мысли материализовать, т. е. превратить слово в уникальную кодовую единицу и таким образом создать новую систему информации, свойственную только человеку. Умственная информация, накапливаемая с помощью единого для всего человечества словесного кода, не только дополняет генетическую систему, но и породила новую форму жизни – общественную, социальную, с присущими только ей законами своего развития.
Таким образом, необходимо признать, что человек является не только продуктом развития генетической информации, но и продуктом реализации его умственной информации, которая и управляет его поведением, как в природе, так и в обществе.
Все обсуждаемые в монографии вопросы нашли свое коренное обобщение в виде общего заключения. Поэтому познакомим читателя со всеми главными положениями монографии в виде самостоятельной главы с несколько измененным названием. Прежде чем приступить к обсуждению вопросов, связанных с возникновением жизни на нашей планете – Земле, необходимо остановиться, прежде всего, на признании того бесспорного положения, что мир по своей природе материален, что Вселенная возникла и существует как объективная реальность, состоящая из определенных химических частиц и химических элементов. Материя едина, но она представляет неделимое единство трех главных начал: материи (структуры), энергии и сознания. Это обусловлено тем, что для возникновения структуры необходима энергия. Каждая структура – это единство материи и той энергии, которая затрачена на формирование данной структуры, причем структура обладает наибольшей стабильностью, когда она имеет минимум свободной энергии. Это основной закон термодинамики, так как на создание любой другой структуры необходима затрата энергии извне. Вместе с тем все материальные структуры образуют единую материальную сферу, и поэтому они взаимодействуют между собой, т. е. они способны воспринимать сигналы от других структур и адекватно на них реагировать, говоря иными словами, между ними происходит своеобразный обмен информацией; это и есть изначальная форма сознания, присущего всей материи.
Каждая структура обладает своими, присущими только ей свойствами, которые определяют особенности, саму физическую и химическую природу данной структуры; вместе с тем, каждая структура в свою очередь состоит из своих субструктур, которые также определяют свойства каждой структуры, а совокупность всех свойств структуры определяет функции каждой структуры. Каждая структура имеет только те свойства, такие функции, которые неразрывно связаны с особенностями ее структуры. Нет функции вне структуры, любая структура обладает только ей присущими функциями. Из этого положения вытекает очень важное заключение, которое позволяет утверждать, что эволюция живой материи, ее самозарождение и развитие могло происходить и происходило по принципу – любое изменение структуры влекло за собой и одновременное изменение ее свойств и функций, усложнение структуры, ее совершенствование неизбежно влекло за собой и изменение функций и, конечно, требовало затраты энергии. Это основа основ эволюции.
Все изменения структуры и соответствующих функций происходили как бы случайно, но в этой случайности реализовывалась закономерность: как только возникали условия для изменения данной структуры, эта случайность порождала закономерность, влекла за собой неизбежно определенные эволюционные изменения. С этих позиций можно считать, что жизнь в Солнечной системе зародилась именно на нашей планете случайно, потому что именно на Земле сложились для этого наиболее благоприятные условия, но то, что она возникла в этих условиях на Земле – это уже закономерность.
Существовали и существуют мнения о том, что жизнь могла возникнуть и на других планетах. Существует предположение и о возможности наличия жизни на Марсе. Только впервые в 2008 г. появились сообщения о том, что американский исследовательский аппарат обнаружил на Марсе лед, т. е. воду. Поскольку наличие воды является одним из главных условий возникновения жизни, появилась уверенность и в том, что на Марсе может действительно существовать в какой-то форме и жизнь.
Итак, чтобы жизнь возникла, для этого необходимо наличие определенных условий, прежде всего воды и тех главных химических соединений, из которых синтезируются те новые биологические структуры, которые создают жизнь, формируя основные системы жизнеобеспечения. Жизнь создана не одной какой-либо структурой, а их совокупностью. Они и составляют главные системы жизнеобеспечения. Бурное развитие естественных наук за последние 200 лет, в первую очередь, молекулярной биологии и молекулярной генетики, позволили с достаточной долей надежности установить, что сущность биологической жизни состоит в непрерывном обмене веществ живого существа с внешней средой, который и обеспечивает его всем необходимым для функционирования всех его систем жизнеобеспечения, и, следовательно, автономного существования данного вида живого организма и его самовоспроизводства, т. е. размножения.
Обмен веществ, или метаболизм, включает в себя функции всех систем жизнеобеспечения, благодаря чему и происходит как синтез самих этих систем, а соответственно, и воспроизводство данного организма, так и энергии, необходимой для этого. Какие же системы жизнеобеспечения должны были возникнуть и действительно возникли для того, чтобы произошло самозарождение жизни и ее последующее непрерывное, но уже специализированное системами жизнеобеспечения самовозрождение и долголетнее развитие. Можно выделить следующие системы жизнеобеспечения, все они являются жизненно необходимыми, все они обязательно необходимы для осуществления и развития жизни. Во-первых, это системы генов и белков и системы их биосинтеза. Их возникновение имело решающее значение, так как только белок оказался способным, благодаря своим особым свойствам, превращать химические реакции в биохимические, т. е. в реакции саморегулируемые, требующие меньшей затраты энергии и протекающие с гораздо более высокой скоростью. Благодаря каталитическим свойствам белка все биохимические реакции, необходимые для создания систем жизнеобеспечения, превратились в единый саморегулируемый процесс обмена веществ. Однако структуру белка, а стало быть, и его свойства определяет только ген с помощью своего особого генетического кода.
К вопросу о самозарождении первородных генов, белков и генетического кода как главной предпосылки зарождения жизни вернемся после краткой характеристики остальных систем жизнеобеспечения.
Следует еще раз подчеркнуть, что возникновение первородных генов, первородных белков и генетического кода, а также систем биосинтеза самих белков и самих генов – главные условия самозарождения жизни. Во-вторых, не менее важным условием самозарождения жизни стало возникновение системы мобилизации энергии, вначале в анаэробной (лишенной кислорода) атмосфере, а затем и с участием кислорода. Формирование системы мобилизации энергии лучше всего охарактеризовано в теории А. И. Опарина. К этой теории следует только добавить, что создание системы мобилизации энергии связано с появлением биологической мембраны, из которой затем возникли мезосомы и митохондрии. Четвертой системой (по счету, а не по значению) служит система биологических мембран, которые стали необходимы не только для того, чтобы осуществить выделение жизнеобеспечивающих систем в обособленные структуры, но и для обеспечения непрерывной двусторонней связи этих систем для пассивного и активного обмена источниками питания и энергии и выделения своих продуктов обмена. Кроме того, мембраны необходимы были и для возникновения системы мобилизации энергии (переноса электронов) и для зарождения системы восприятия информации из внешней среды в геном клетки. Такие системы информации имеются уже у бактерий. Наконец, биологические мембраны нужны были и для компартментализации будущей клетки.
Пятой системой жизнеобеспечения стала система координации (саморегуляции) всей генетической информации, которая формировалась также в ходе самозарождения жизни и нашла свое выражение в виде организации единой системы регуляции работы оформившихся самостоятельных функциональных единиц генома (хромосомы) – оперонов. Саморегуляция оперонов позволяет включать и выключать их работу только тогда, когда возникает необходимость в синтезе соответствующих белков. Генетическая регуляция (регуляция работы генов) позволила объединить все процессы жизнеобеспечения в единый процесс функционирования возникшей универсальной структурной единицы живой материи – клетки, т. е. превратить ее в самостоятельно существующий цельный пока еще одноклеточный организм.
Шестой системой жизнеобеспечения следует считать систему, управляющую размножением клетки, ее систему самовозрождения, основанного на совокупной деятельности всех систем жизнеобеспечения, управляемых геномом клетки. Простейшая форма размножения нашла свое выражение в виде удвоения биомассы клетки, удвоения (или даже увеличения в 4 раза) количества копий ее генов в результате редупликации бактериальной хромосомы и формирования межклеточной перегородки (с обязательным участием биологической мембраны). Вследствие этого из родительской клетки образуются две дочерние клетки, каждая из которых обладает точно таким же геномом, как и их родительская клетка, т. е. образуются две новые дочерние клетки, ничем не отличающиеся от своей родительской клетки. Однако уже на уровне бактериальной клетки возник и первичный половой процесс, который осуществляется с помощью плазмид.
Такова самая общая картина процесса самозарождения жизни, точнее, его самого первого этапа – самозарождения жизни в виде самостоятельного, хотя и одноклеточного организма, способного себя самовоспроизводить с помощью систем жизнеобеспечения. Так произошло самозарождение и самоутверждение жизни. Теперь уже эволюция живой материи пошла более ускоренным темпом, так как живая материя создала свои собственные системы жизнеобеспечения и самовозрождения.
В данной работе А. И. Коротяевым предложена новая, ранее никем не обсуждавшаяся аминокодоновая гипотеза, которая дает новое понимание механизма одновременного и взаимообусловленного возникновения первородных генов и первородных белков и одновременного формирования генетического кода с помощью основных исходных структур, состоящих их аминокислоты и соответствующего кодона. Для их формирования природа использовала трехбуквенный код из четырех исходных азотистых оснований и 20 так называемых протеиногенных аминокислот, т. е. тех аминокислот, из которых и синтезируются все белки у всех живых существ. Самым трудным вопросом при этом был для нас вопрос о том, по какому принципу кодоны и аминокислоты соединялись в этом комплексе, чтобы возникла уникальная исходная структура – аминокодон. Мы отдали предпочтение тому принципу, который природа использовала уже в результате создания белка, т. е. принципу комплементарности физико-химической структуры между соответствующей аминокислотой и ее кодоном (или его синонимами). Такое стереохимическое соответствие между аминокислотой и ее кодоном (и его синонимами) ныне полностью подтверждается расчетами А. В. Керимбекова, который, используя для этих целей круговую таблицу генетического кода, полностью подтвердил наличие соответствия между каждой из 20 аминокислот со своим кодоном и его синонимами, если они имеются для данной аминокислоты. Более того, В. А. Гусев предложил новую гипотезу, которая предполагает, что «генетический код не является продуктом ни химической, ни предбиологической эволюций – химические структуры 4 нуклеотидов, 20 канонических аминокислот и отображение множества триплетов на множестве аминокислот детерминированы, так же как детерминирован набор элементарных частиц и химических элементов самим актом рождения Вселенной».
Но если это так, то следует согласиться и с тем, что самозарождение первородных генов и первородных белков, т. е. самозарождение жизни, также детерминировано генетическим кодом, теми физико-химическими свойствами четырех азотистых оснований и 20 стандартных аминокислот, которые используются для синтеза белка.
Из этого заключения само собой напрашивается предположение о том, что если на какой-либо планете в космосе существует жизнь, то она могла возникнуть и развиваться по такому же сценарию, как и на Земле. Главными предпосылками для ее самозарождения должны были стать три главных события: самопроизвольное (детерминированное свойствами химических элементов материи) одновременное возникновение генетического кода, первородных генов и первородных белков при наличии, конечно, соответствующих благоприятных для этого условий, а также последующего формирования всех остальных систем жизнеобеспечения. Никакая эволюция живой природы невозможна без закрепления и наследования имеющихся и вновь приобретаемых полезных признаков. Это аксиома эволюции живой природы.
Поскольку вся материя содержит одни и те же химические элементы, то это и должно предопределять аналогичные или сходные пути и механизмы самозарождения и развития жизни на любой планете. Весьма возможно, что в зависимости от физико-химических и климатических условий на других планетах химический синтез аминокислот и нуклеотидов мог привести к появлению каких-либо других вариантов этих важнейших для возникновения жизни химических соединений. Этого исключить нельзя. Однако и в этом случае детерминированность генетического кода должна с неизбежностью привести к возникновению первородных генов и первородных белков, но обладающих уже иной специфичностью. Это означает, что на данной планете возникнут иные живые организмы, в чем-то отличающиеся от организмов, живущих на Земле, но именно живые существа, в том числе и такие, которые обладают и сознанием. Поскольку обязательным атрибутом материи служит ее способность воспринимать и отражать сигналы (информацию) из внешней среды, то эволюция таких организмов неизбежно должна была привести к возникновению у них специализированных органов мышления, т. е. к возникновению разумных существ типа Homo sapiens. Если на Марсе есть вода, как это уже окончательно установлено, то там, возможно, есть и простейшие живые существа типа вирусов и бактерий. Если это предположение подтвердится, оно будет свидетельствовать в пользу теории единой генеральной линии самозарождения и развития живой природы во Вселенной. В то же время нельзя исключить и того, что изучение структуры и свойств живых существ, обитающих на Марсе, может привести к каким-то новым открытиям.
Выяснение роли генетической системы информации в самозарождении и эволюции жизни на Земле позволяет сделать однозначное заключение о том, что возникновение и развитие жизни на любой планете в космосе невозможно без одновременного самозарождения генетического кода, первородных генов и первородных белков. Без генов нет белков, а без белков нет генов, или, возможно, аналогичных им на других планетах соответствующих структур, а без генов, или, возможно, аналогичных им на других планетах структур, нет наследственности, а без наследственности нет и не может быть эволюции живой природы.
Самым убедительным доказательством в пользу такого заключения служит тот неопровержимый факт, что жизнь на Земле представлена огромным количеством видов растительных и животных организмов. Но ведь организм каждого вида есть не что иное, как продукт реализации той генетической информации, которая содержится в его геноме. Поэтому ген и служит главным носителем и хранителем жизни, а его продукт – белок – творцом жизни. Следует признать, что возникновение и развитие жизни на любой планете в космосе возможно только в результате возникновения и реализации генетической информации. Несмотря на огромное разнообразие видов живых существ, жизнь представляет собой единую совокупность организмов. Их единство обусловлено исключительно универсальностью генетического кода. Единство всех живых существо заключается в единстве биологических структур и их функций, т. е. в единстве тех биологических процессов, которые реализуют самую жизнь.
Итак, на вопрос о том, как самозародилась жизнь на Земле и шло ее дальнейшее развитие, в настоящее время можно дать следующее краткое объяснение. Решающее значение для самозарождения жизни и дальнейшего ее развития имело возникновение генетического кода и обусловленного им одновременного и взаимосвязанного возникновения первородных генов и первородных белков посредством образования цепочек из аминокодонов. Аминокодон – структура, состоящая из аминокислоты, соединенной со своим кодоном. Из цепочек аминокислот формируются полипептидные цепи (белки), а из цепочек кодонов (триплетов) – полинуклеотиды (гены). Ген стал главным конструктором (архитектором) жизни, а белок – ее главным творцом. Благодаря взаимодействию генов с белками возникли биологические системы синтеза ДНК (генов) и белка и всех остальных систем жизнеобеспечения, которые при организующей роли генов, соединившихся в единую хромосому, соединились в единую целостную систему жизнеобеспечения и сформировали универсальную структурную единицу живой материи – клетку. Дальнейшая эволюция жизни вначале на уровне одноклеточных, а затем и многоклеточных организмов шла путем усложнения структуры, а стало быть, и функции живых организмов при одновременном наращивании объема генома каждого вновь образующегося организма за счет включения в его состав тех новых генов, которые определяли новые приобретенные структуры и их новые функции. Следовательно, жизнь каждого живущего на Земле организма, его эмбриональное и постэмбриональное развитие запрограммировано генетической информацией в его же собственном геноме. Поэтому каждое живое существо может рассматриваться как продукт реализации его генетической информации, а сам этот процесс реализуется и находит свое проявление в конкретном способе жизни данного организма.
В настоящее время еще невозможно детально объяснить, как происходил сам процесс наращивания генов. Ведь чем сложнее организм, тем больше он имеет генов. Как они возникают и включаются в состав того или иного генома? Дело ведь в том, что возникшая в ходе самозарождения жизни биологическая система синтеза генов (ДНК) не может «печатать» (синтезировать) новые гены. Она способна лишь копировать уже имеющиеся в хромосоме гены с помощью матричного механизма. Поскольку никакой другой механизм синтеза новых генов не известен, то остается предполагать, что синтез первородных генов (и первородных белков) происходил и происходит в течение всей эволюции жизни. Как известно, мутации не увеличивают количества новых генов, а лишь изменяют структуру генов или вообще приводят к их гибели. Что же касается различных типов рекомбинаций, то они не всегда могут привести к включению новых генов в хромосому, так как все организмы, от бактерий до человека, обладают механизмами самозащиты генома. К их числу относятся так называемые системы ограничения и модификации. Системы ограничения распознают чужеродную ДНК и разрушают ее, а системы модификации специфически метят «свою» ДНК и защищают ее от действия системы ограничения. Кроме того, клетки могут обладать факторами, которые подавляют репродукцию чужеродного генома (например, интерфероны подавляют различные вирусы в клетках). Наконец, особые мелкие молекулы РНК (РНК-интерференс) играют важную цензорную роль у всех организмов. Такие РНК-и также контролируют поток генетической информации в клетках и блокируют реализацию чужеродной информации. Пока можно только предполагать, что образующиеся новые гены (возможно, что именно первородные гены) каким-то образом модифицируются, как собственные гены, и поэтому включаются в состав генома данной клетки. Однако это всего лишь предположения. Истинные механизмы процесса наращивания генома в ходе эволюции живой природы предстоит еще подробно изучить и понять. Известно, что природа всегда находила самые простые решения даже для самых сложных проблем.
Вторая половина данной работы посвящена еще одному важному вопросу, а именно, как возник человек, как возникло такое разумное существо, как Homo sapiens. После опубликования Ч. Дарвином теории естественного отбора фактически сразу же сложилось убеждение в том, что человек имеет животное происхождение. А поскольку наибольшее внешне сходство с человеком имеют человекообразные обезьяны, то была высказана мысль о том, что человек произошел от обезьян. Опубликованная в 70-х гг. XIX в. работа Ф. Энгельса «Роль труда в процессе превращения обезьяны в человека» получила поэтому всеобщее признание. Эта формула приобрела еще более краткое звучание – «труд превратил обезьяну в человека». Но сейчас эта формула уже не является абсолютно правильной. Конечно, роль труда в эволюции человека трудно переоценить. Но ведь труд, как и отдых, жизненно необходим для каждого живого существа. Труд необходим для того, чтобы обеспечить любое живое существо источниками питания и энергии, т. е. для обеспечения того непрерывного обмена веществ, который абсолютно необходим для проявления самой жизни любого организма. Это обстоятельство хорошо понимал и сам Ф. Энгельс. Именно ему принадлежат слова: «Жизнь – это способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней средой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка». Человеку даже в состоянии покоя требуется не менее 65 – 75 ккал/ч энергии только для поддержания собственного обмена веществ. Любые повышения трудовой нагрузки требуют увеличения траты энергии, трата энергии и накопление продуктов обмена веществ вызывают состояние утомления, а оно – необходимость в отдыхе. Поэтому чередование труда и отдыха (лучшая форма которого – естественный сон) служит нормальным физиологическим состоянием любого млекопитающего животного. Поэтому труд и отдых – одни из главных условий реализации самой жизни. Как говорит мудрая русская народная поговорка: «Без труда не поймаешь и рыбку из пруда». Но форма и объем труда определяются потребностями только самого данного животного. Превращение обезьяны в человека связано не только с трудом. Ф. Энгельс и К. Маркс считали, что, освободив свои руки от ходьбы для лазания по деревьям, обезьяны тем самым начали свою эволюцию в сторону постепенного формирования разумного существа. Однако такого превращения предков обезьян в разумное существо так и не произошло ни с одним из видов человекоподобных обезьян. Дело здесь не столько в труде, сколько в том, что для такого превращения нашего изначального предка в человека необходимы были, прежде всего, генетические предпосылки. Как, когда и какие именно предпосылки сложились, наука еще не смогла детально установить, но в чем они нашли свое отражение, сейчас уже известно. Ф. Энгельса и К. Маркса нельзя упрекнуть в том, что они ничего не знали об этих генетических предпосылках, так как, хотя дискретные единицы наследственности и обе нуклеиновые кислоты (ДНК и РНК) были уже обнаружены в 60-х гг. XIX в., о самих генах и о том, как они реализуют свои свойства, до 50-х гг. ХХ в. не было известно.
Только с открытием структуры гена и генетического кода стало понятно, какую огромную роль они сыграли и играют совместно с белком в самозарождении и эволюции жизни на Земле.
С появлением у животных органов чувств они стали воспринимать информацию из внешней среды с их помощью. У животных возникло чувственное сознание: они стали воспринимать, осознавать внешний мир и определять свое поведение в нем в соответствии с той информацией, которую они получают с помощью своих органов чувств. Многие животные способны даже издавать звуки, однако эти звуки отражают всего лишь их эмоциональное состояние, не более того. У животных нет голосового аппарата, способного произносить осмысленные звуки. Поэтому они не могут мыслить абстрактно, с помощью понятий (слов), следовательно, у них и нет аппарата мышления.
Главные генетические предпосылки, определившие направление эволюции нашего предка в сторону Homo sapiens, заключались, прежде всего, в том, что у человека начал формироваться особый аппарат мышления, который отсутствует у всех без исключения животных, в том числе и у человекоподобных обезьян. Такой аппарат мышления формировался из особых нервных клеток памяти, способных мыслить с помощью слова. Но для этого необходима была еще одна чрезвычайно важная генетическая предпосылка – а именно, возникновение генов, кодирующих особый голосовой аппарат, т. е. аппарат, способный произносить членораздельные звуки, а с их помощью и слова – главную кодовую единицу новой системы информации, умственной, или интеллектуальной информации, т. е. рассудочного сознания. Рассудочное сознание (умственная информация) присуща только человеку. Только у человека голосовые связки имеют мускульное оформление, с помощью которого человек может изменять силу, высоту и тембр своего голоса, управлять им, создавать слова, понятия, имеющие вполне определенное смысловое значение. Совершенно очевидно, что для эволюции предка человека в сторону формирования разумного существа нужны были также и какие-то другие генетические предпосылки, которые привели к изменению внешнего облика человека, но несомненно, что формирование аппарата мышления и создание слова, с помощью которого человек стал мыслить, материализация слова были самыми главными из них.
Рассудочное сознание не просто дополнило чувственное сознание. Благодаря своим специфическим законам саморегуляции (о которых мы еще знаем очень мало), оно приобрело верховное, главенствующее значение, именно оно и стало высшей формой саморегуляции поведения человека в природе и обществе, так как только рассудочное сознание формируется на основе наиболее достоверных знаний. Для формирования такой высшей формы сознания требовалась и новая форма его реализации, т. е. для ее формирования потребовалась абсолютно новая форма кодирования такой информации. У человека существует только один механизм мышления – с помощью слова, через посредство слова. Оно и стало основной кодирующей единицей совершенно новой системы информации – умственной, или интеллектуальной. Разумеется, такая система информации возникла не сразу, для ее формирования потребовалось немало времени, прежде всего, для создания словарного фонда и грамматики языка.
Специальная наука, занимающаяся изучением языка, речи – языкознание, – давно дала слову определение как средству общения. Однако такое определение не раскрывает самого главного, а именно, в чем суть такого способа общения. О роли и значении слова высказывались многие выдающиеся ученые, писатели и философы. Например, И. Гёте словами Мефистофеля говорил:
Коль скоро недочет в понятиях случится,
Их можно словом заменить.
Очень хорошо оценил значение слова русский ученый И. П. Павлов. Он не только признал, что слова «произносимые, слышимые и видимые» материализуют мысль, а что человек использует слова не только для взаимного общения, но и «наедине с собой». Это означает, что человек может мыслить только с помощью слов.
Однако наиболее меткое, точное и правильное определение роли и значения слова сделал гений литературы философ Л. Н. Толстой. Он назвал слова «орудием разума». Из этого определения следует, что разум человека реализуется через слово, но, в свою очередь, он и формироваться может-таки только словом. Иного толкования роли слова и быть не может.
До второй половины XX в. значение слова для развития человека просто не с чем было сравнивать. Только после того, как была открыта истинная роль генетического кода в эволюции живой природы, стало понятно, что слово в эволюции человека играет такую же роль в развитии его умственной информации, какую играл и играет генетический код в самозарождении и развитии биологической жизни. Однако словесный код сыграл решающую роль в самозарождении и дальнейшем развитии новой, общественной (социальной) формы жизни. Она, как и биологическая форма жизни, также зародилась и развивалась постепенно, породила свои особые законы эволюции, и в соответствии с ними пережила уже различные этапы своего развития, которые в нашей работе не рассматриваются. Подобно генетическому коду, который является единым и универсальным для всей живой природы, словесный код также является универсальным и единым по своей сущности для всего человечества, хотя ему присуща своеобразная национальная самобытность в своем звуковом и графическом оформлении, но он един для всех наций по своему содержанию. Как нет высших и низших наций, так нет и высших и низших форм словесного кода.
Главная особенность словесного кода заключается в многообразии тех букв, которые используются разными нациями для его создания и использования. Вместе с этим, словесному коду, точнее, самому слову, принадлежит еще одна удивительная особенность, которая только лишний раз подчеркивает исключительную роль слова в возникновении и развитии умственной информации и в самозарождении и дальнейшей эволюции социальной жизни. Слово есть способ материализации мысли, сознания. Мысль сама по себе бестелесна, в такой форме она не может быть действенна, ее нельзя просто реализовать, она недоступна для использования, более того, она бесполезна. Только мысль материализованная могла стать и действительно стала орудием разума, того самого рассудочного сознания, которое присуще только человеку, которое формирует человека как индивидуальную неповторимую личность с его сложным внутренним духовным миром. Сложность духовной жизни, внутренний мир человека определяются и зависят от сочетания чувственного и рассудочного сознания. Именно в этой сфере рождаются понятия добра и зла, любви и ненависти, правды и лжи, словом, тех форм поведения человека, которые называют моральными и аморальными, нравственными и безнравственными и т. п. Отчего возникают такие отклонения, нарушения правил поведения человека, как, например, преступления? Как известно, значительная часть правонарушений и даже преступлений совершаются людьми, находящимися в состоянии алкогольного или наркотического опьянения, в состоянии аффекта, когда чувства выходят из-под контроля разума, или психически больными.
Все это свидетельствует о том, насколько сложен и своеобразен внутренний мир человека, сколь важную роль играет умственная информация, рассудочное сознание в жизни человека, в эволюции социальной жизни. Все это позволяет сделать вывод о том, что человек является не только продуктом реализации генетической информации, но и продуктом развития и реализации умственной информации. Умственная информация дополнила генетическую информацию, соединилась с ней и породила новую форму жизни – социальную. По всей вероятности, человек как продукт реализации генетической информации вряд ли претерпит какие-либо дальнейшие эволюционные изменения. Благодаря нормальной, здоровой жизни его внешний облик может стать еще более совершенным, но в принципе мало изменившимся. Главное направление эволюции современного человека состоит в дальнейшем развитии его умственной информации, горизонты этой эволюции безграничны.
Умственная информация, в отличие от генетической, по наследству не передается. Человек рождается с готовым аппаратом мышления, но он еще не содержит никакой умственной информации до тех пор, пока ребенок не научится говорить, а затем читать и писать, т. е. пока он полностью не овладеет словесным кодом. Только после этого начинает формироваться его умственная информация, но уже на основе добытых человечеством самых последних научных знаний. Поэтому умственная информация каждого нового поколения людей будет становиться все более полной и более совершенной.
В эволюции человека играл, играет и, безусловно, будет играть важную роль и труд, но труд осмысленный, высокопроизводительный, основанный на достижениях науки и техники, на глубоких знаниях закономерностей развития природы, т. е. труд, управляемый умственной информацией человека.
На вопрос о том, как возник человек с его рассудочным сознанием, в настоящее время можно ответить таким образом.
Предок человека начал свою эволюцию в сторону Homo sapiens только после того, как у него для этого возникли необходимые генетические предпосылки, которые привели не только к изменению внешнего облика человека, но и обусловили возникновение аппарата мышления и голосового аппарата. Тогда в геноме предка человека появились соответствующие гены, одни из которых обусловили появление нервных клеток памяти, способных мыслить абстрактно, т. е. с помощью слов, а другие – обусловили образование голосового аппарата, голосовых связок, позволяющих человеку произносить членораздельные звуки, а с их помощью создавать новую кодовую единицу – слово. Слово – не просто способ общения, слово есть основной способ материализации мысли, способ превращения бестелесной мысли в мысль, доступную для обмена информацией между людьми, для формирования аппарата мышления и создания новой, чисто человеческой формы информации – умственной, или интеллектуальной. Превращение индивидуальной мысли в коллективную мысль, в конечном счете, привело к возникновению и дальнейшему развитию новой формы жизни – социальной с присущими ей законами. Поскольку умственная информация по наследству не передается, а формируется аппаратом мышления с помощью словесного кода у каждого нового поколения людей заново, она и будет оказывать решающее влияние на дальнейшую эволюцию человеческого общества.
Материализация мысли словом сделала умственную информацию столь же могущественной силой, как и генетическая информация. Объединившись, эти две системы информации и сотворили человека – самое разумное существо живой природы, а вместе с человеком и социальную форму жизни, эволюция которой в немалой степени определяется развитием и совершенствованием именно умственной информации.
АДФ – аденозиндифосфат
АЕ – антитоксическая единица
АКДС – адсорбированная коклюшно-дифтерийно-столбнячная вакцина
АМФ – аденозинмонофосфат
цАМФ – циклический аденозинмонофосфат
АНКМ – аппарат непрерывного культивирования микроорганизмов
АОК – антителообразующие клетки
АТФ – аденозинтрифосфат
АТФаза – аденозинтрифосфатаза
БГКП – бактерии группы кишечной палочки
БКЯ – болезнь Крейтцфельда – Якоба
БОЕ – бляшкообразующая единица
ВАПП – вакцино-ассоциированный паралитический полиомиелит
ВИЧ – вирус иммунодефицита человека
ВОЗ – Всемирная организация здравоохранения
ВПГЧ – вирусы парагриппа человека
ГВЧ – герпесвирусы человека
ГЛПС – геморрагическая лихорадка с почечным синдромом
ГМФ – гуанозинмонофосфат
цГМФ – циклический гуанозинмонофосфат
Г+Ц – мольпроцентное содержание гуанина и цитозина в ДНК
ГЧЗ – гиперчувствительность замедленная
ГЧН – гиперчувствительность немедленная
ДАП – диаминопимелиновая кислота
ДИЧ – дефектные интерферирующие частицы
ДНК – дезоксирибонуклеиновая кислота
кДНК – комплементарная ДНК
ДНКаза – дезоксирибонуклеаза
ЖБВ – живая брузеллезная вакцина
ИЛ-1, ИЛ-2 и т. д. – интерлейкин-1, интерлейкин-2 и т. д.
ИКД – иксодовые клещевые боррелиозы
ИПВ – инактивированная полиомиелитная вакцина
ИФМ (ИФА) – иммуноферментный метод (анализ)
к. б. (килобаза) – тысяча пар оснований
КГЛ – Крымская геморрагическая лихорадка
кД (кДа) – килодальтон
КОЕ – колониеобразующая единица
КС – клеточная стенка
ЛАГ – латекс-агглютинация
ЛПС – липополисахарид
ЛХМ – лимфоцитарный хориоменингит
МД – мегадальтон
МЕ – международная единица
ММСП – международные медико-санитарные правила
МСЛЗ – международная служба по ликвидации заболеваний
м. м. (мол. м.) – молекулярная масса
МПА – мясо-пептонный агар
МПБ – мясо-пептонный бульон
НАД – никотинамидадениндинуклеотид
НАДФ – никотинамидадениндинуклеотидфосфат
НК – нуклеиновая кислота
НП – нуклеотидная последовательность
НФБ – некультивируемые формы бактерий
ОКЗ – острые кишечные заболевания
ОКС – острые кишечные заболевания
о. п. – олигонуклеотидные последовательности
ОПВ – оральная поливакцина
п. н. – пара нуклеотидов
Пн-выбор – полинуклеотидный выбор
ПСПЭ – подострый склерозирующий панэнцефалит
ПЦР (ЦПР) – полимеразная цепная реакция
РАГА – реакция агрегат-гемагглютинации
РИМ – радиоиммунный метод
РИФ – реакция иммунофлуоресценции
РН – реакция нейтрализации
РНАг – реакция нейтрализации антигена
РНАт – реакция нейтрализации антитела
РНК – рибонуклеиновая кислота
РНКи – рибонуклеиновая кислота-интерференс
аа-тРНК – аминоацил-транспортная РНК
вРНК – вирионная РНК
кРНК – комплементарная РНК
мРНК – матричная (информационная) РНК
рРНК – рибосомальная РНК
тРНК – транспортная РНК
РОПГА – реакция обратной пассивной гемагглютинации
РПГА – реакция пассивной (непрямой) гемагглютинации
РПИ – расширенная программа иммунизации
РСК – реакция связывания комплемента
РТГА – реакция торможения (задержки) гемагглютинации
РЭС – ретикулоэндотелиальная система
СВК – синдром врожденной краснухи
СМФ – система мононуклеарных фагоцитов
СПИД – синдром приобретенного иммунодефицита
ССТ3 – система секреции 3-го типа
СТФ – сывороточный тимусный фактор
СТШ – синдром токсического шока
ТКР – Т-клеточный рецептор
ТЛЭ – термолабильный энтеротоксин
ТОРС – тяжелый острый респираторный синдром
ТСЭ – термостабильный энтеротоксин
т. п. н. – тысяча пар нуклеотидов
ФИМ – фактор, ингибирующий миграцию лейкоцитов
ФКП – фекальные кишечные палочки
ФНО – фактор некроза опухолей
ЦД – цитопатическое действие
ЦМ – цитоплазматическая мембрана
ЦНС – центральная нервная система
ADP – аденозиндифосфат
ATP – аденозинтрифосфат
CLTD – цитолетальный разрыхляющий токсин
CNF – цитотоксический некротический фактор
CTAXB – холерный токсин (холероген)
EAST – (термо)стабильный токсин энтероагрегативной E. coli
G-белки – мембранные белки клетки
Ig – иммуноглобулин
IgA – иммуноглобулин класса А
IgAs (IgAc) – секреторный иммуноглобулин класса А
IgD – иммуноглобулин класса D
IgE – иммуноглобулин класса Е
IgG – иммуноглобулин класса G
IgM – иммуноглобулин класса М
IL-1, IL-2 и т. д. – интерлейкин-1, интерлейкин-2 и т. д.
LT – (термо)лабильный токсин
МНС – (Major Histocompatibility Complex) – главная система гистосовместимости
MLVA – анализ многолокусных вариантов
NAD – никотинамидадениндинуклеотид
NK – природные, или естественные, клетки-киллеры
ST – термостабильный токсин
STX – токсин Шига (N-гликозидаза)
VNTR – variable number of tandem repeats – вариабельное число тандемных повторов
Основные сведения о руководителях кафедр микробиологии медицинских вузов Российской Федерации
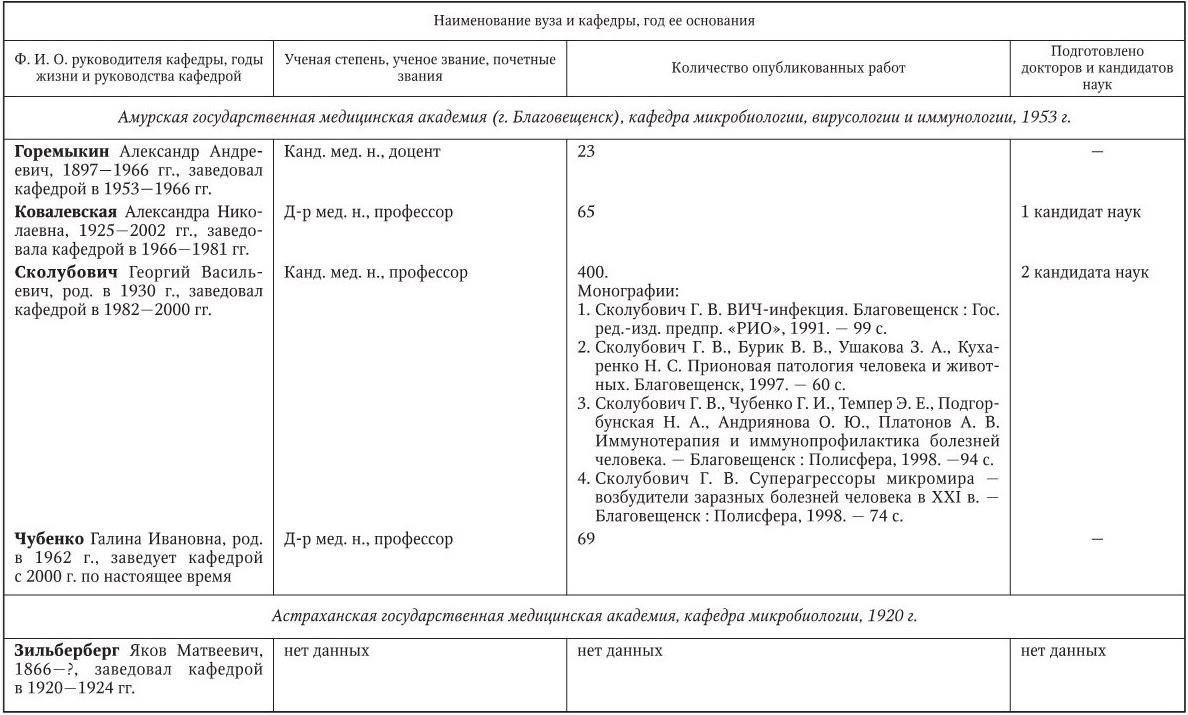
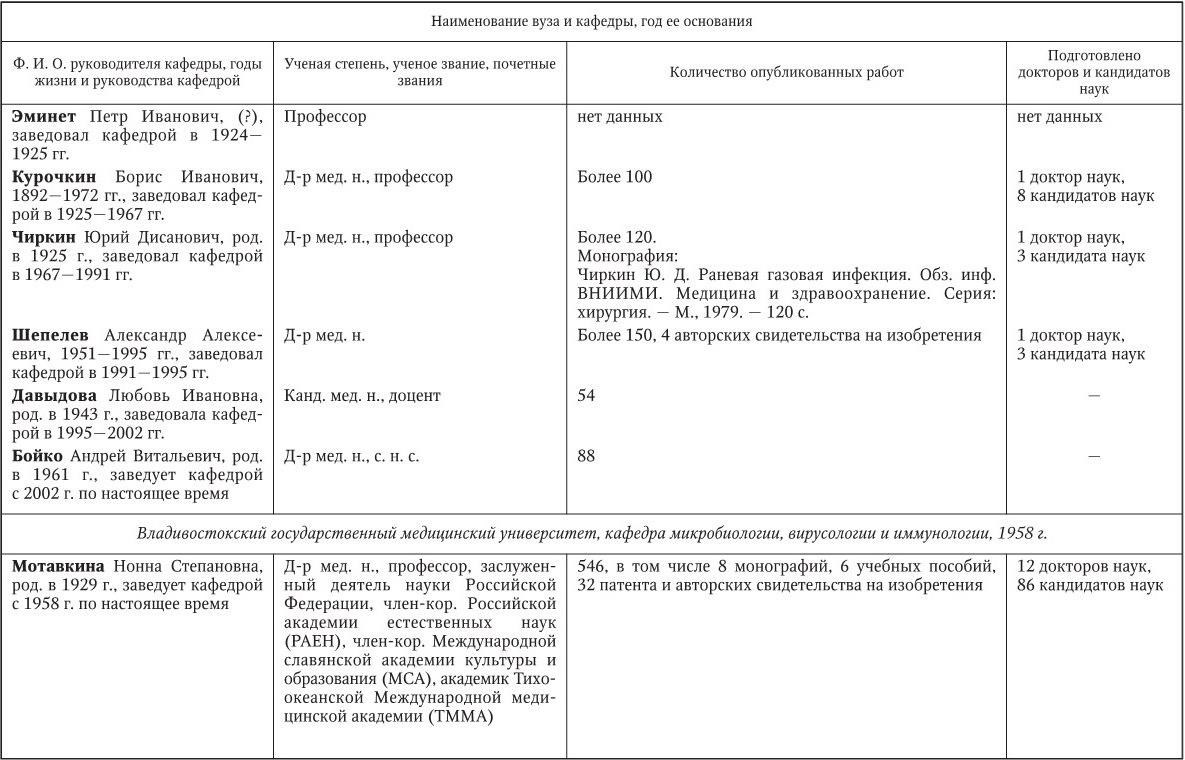
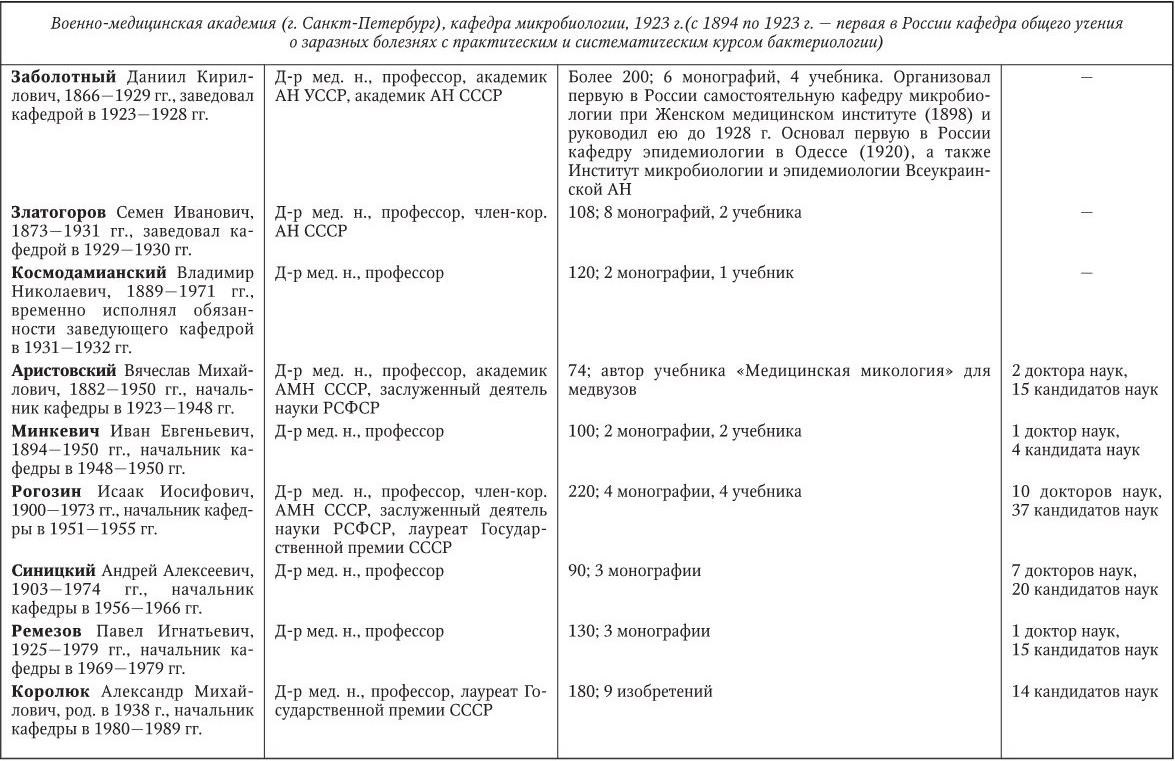
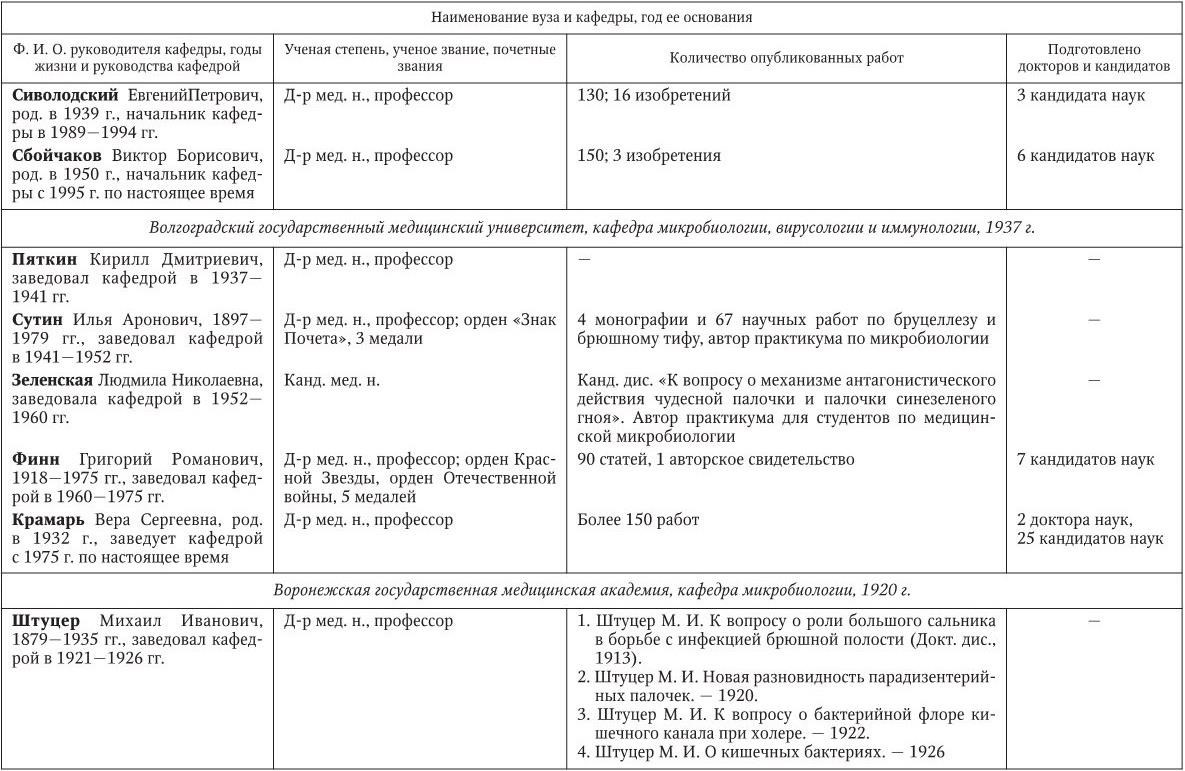
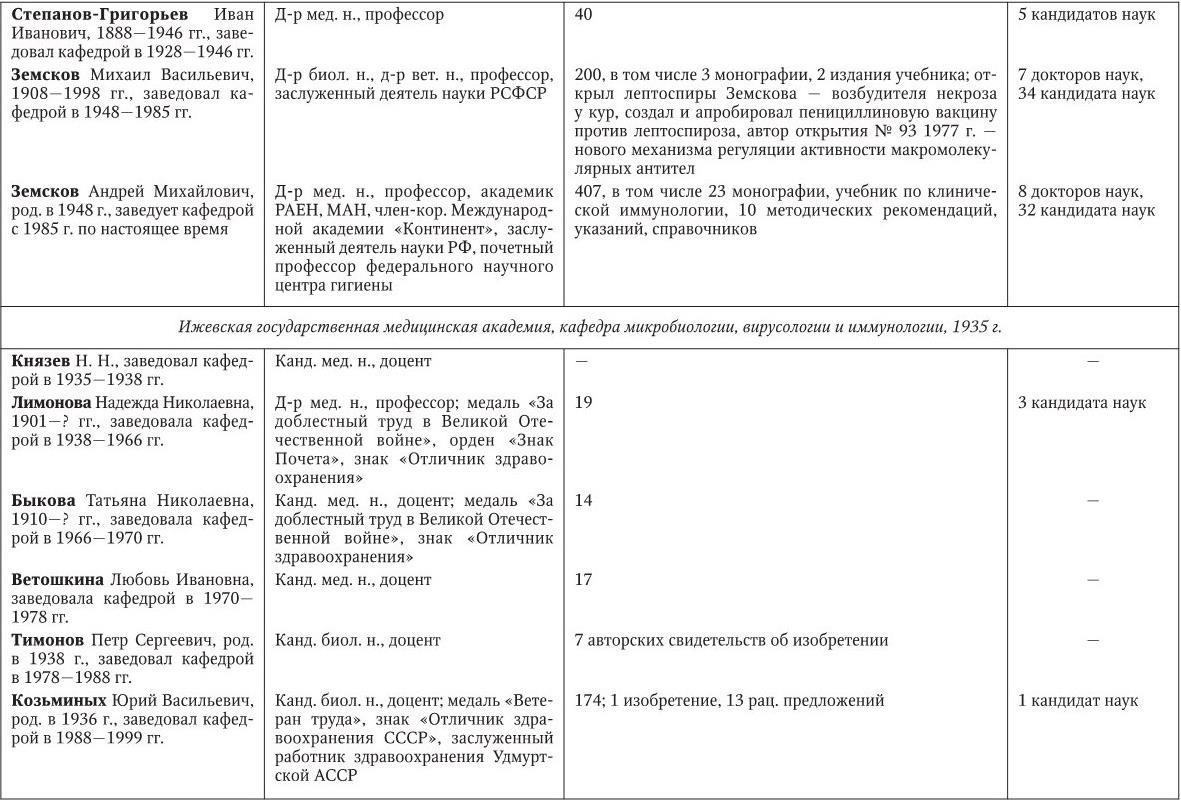
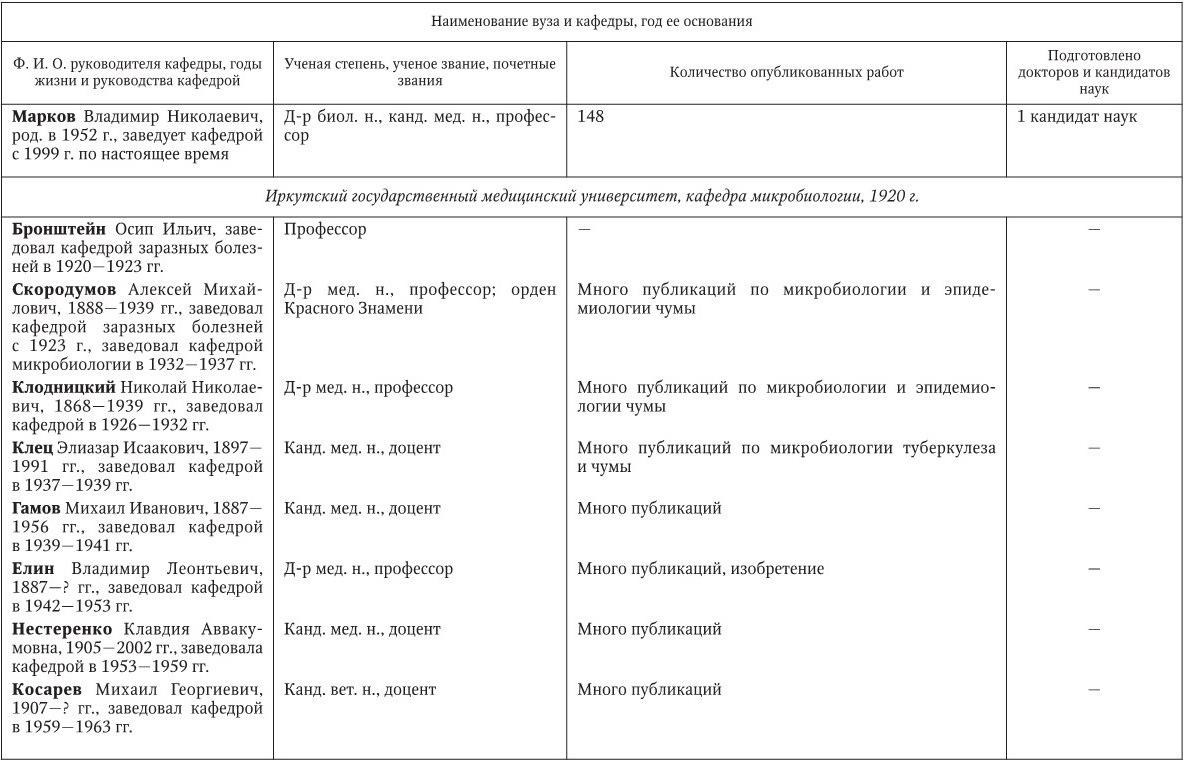
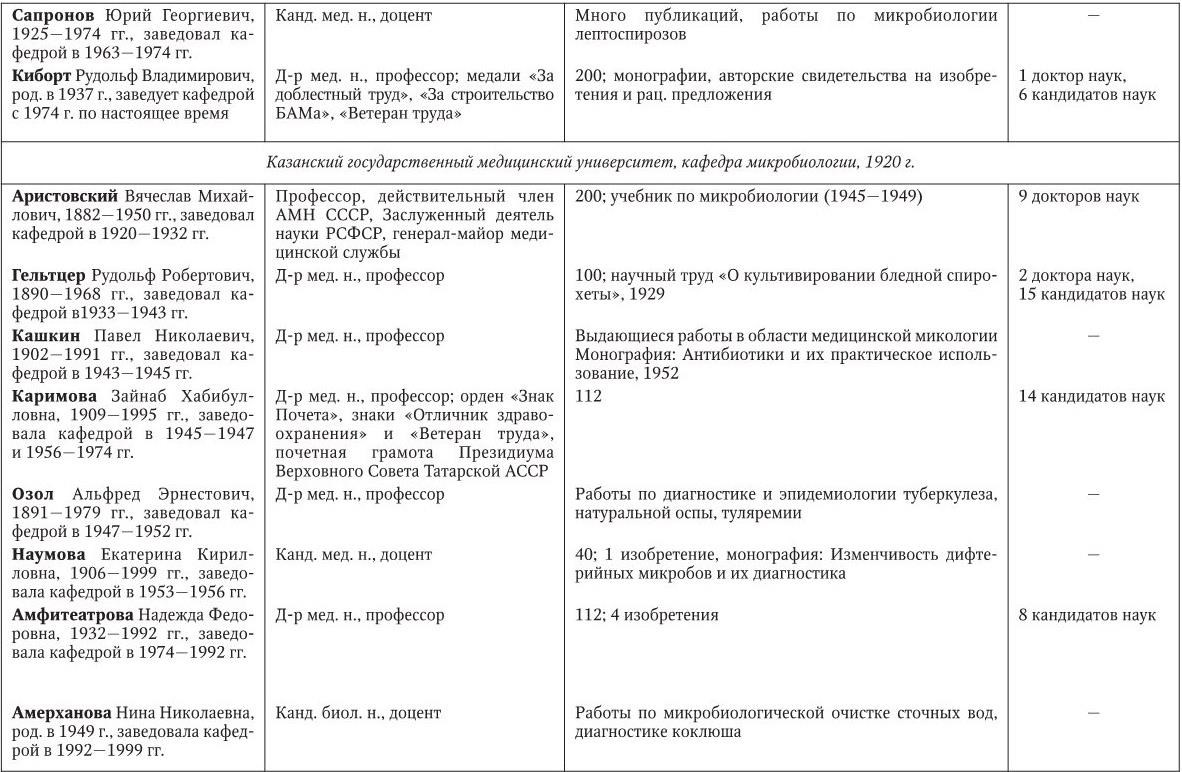
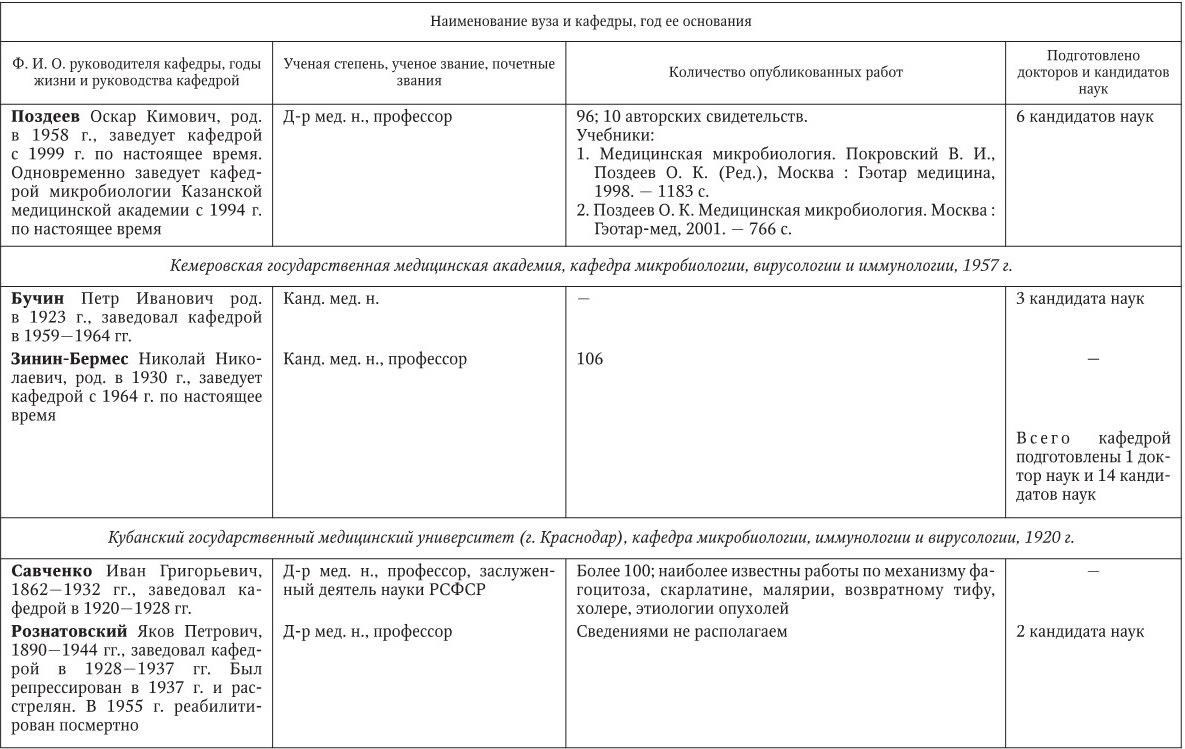

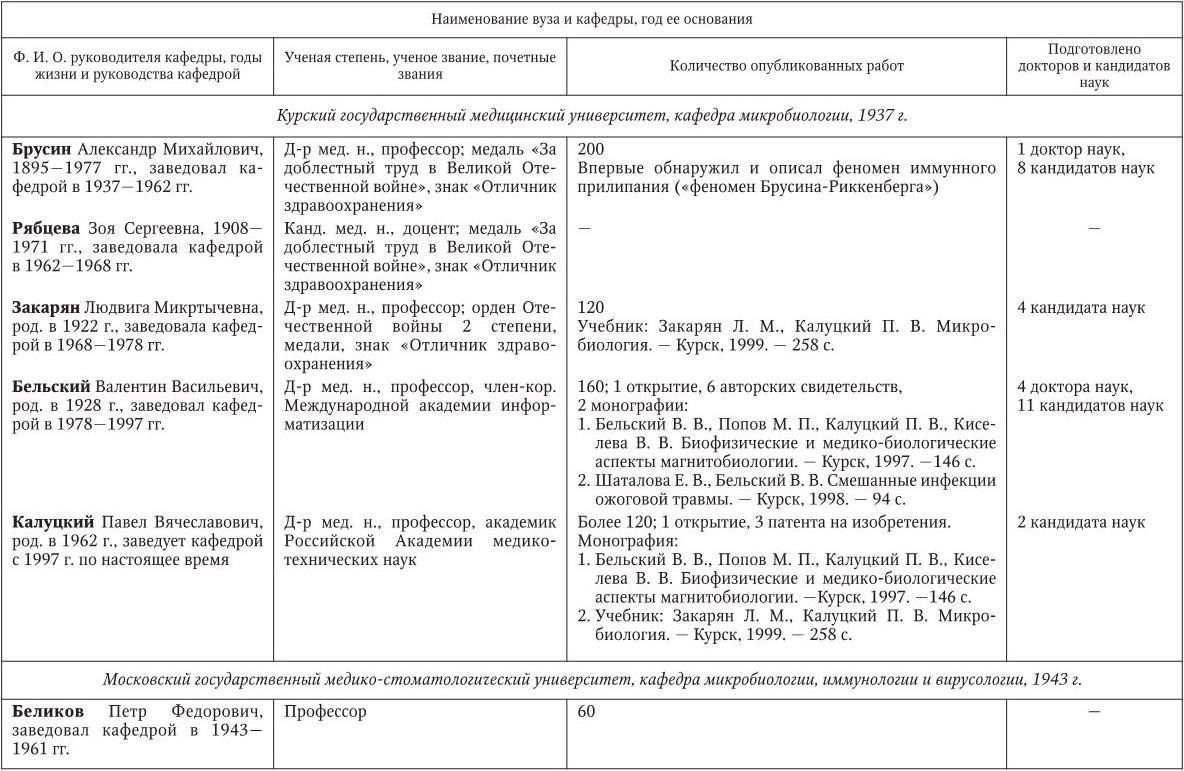
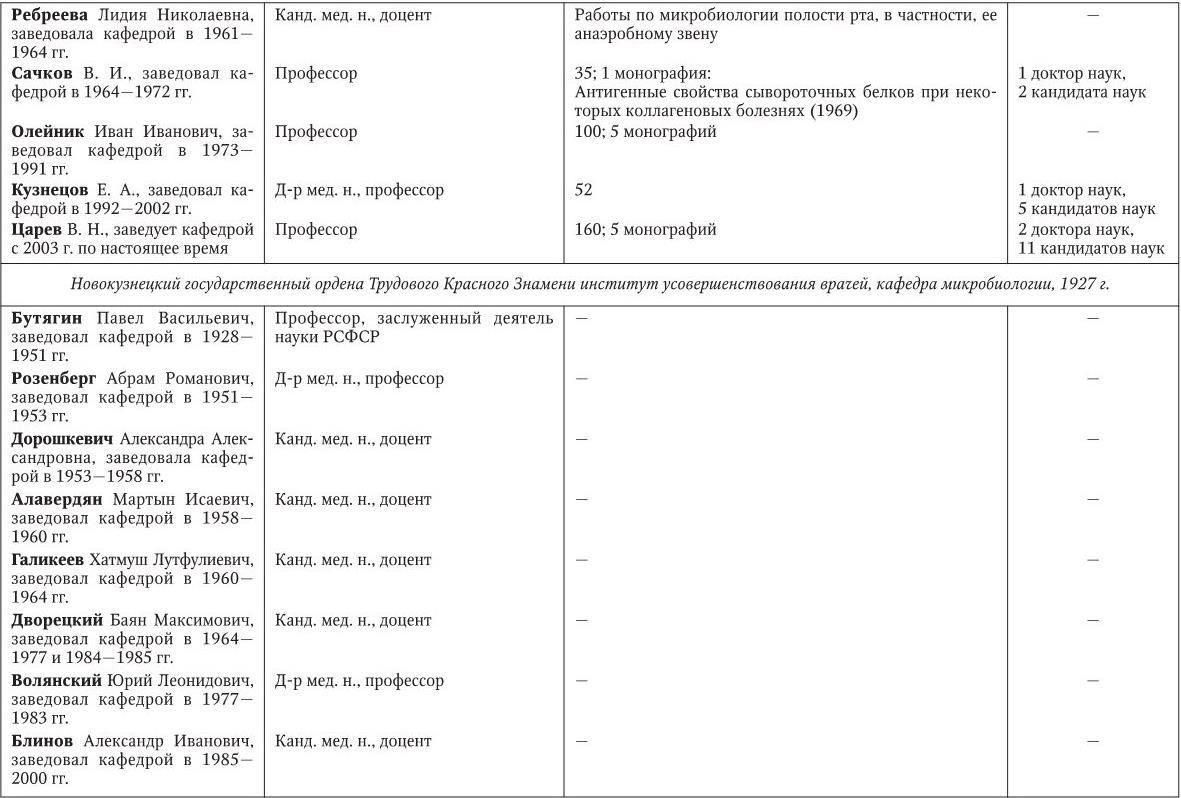
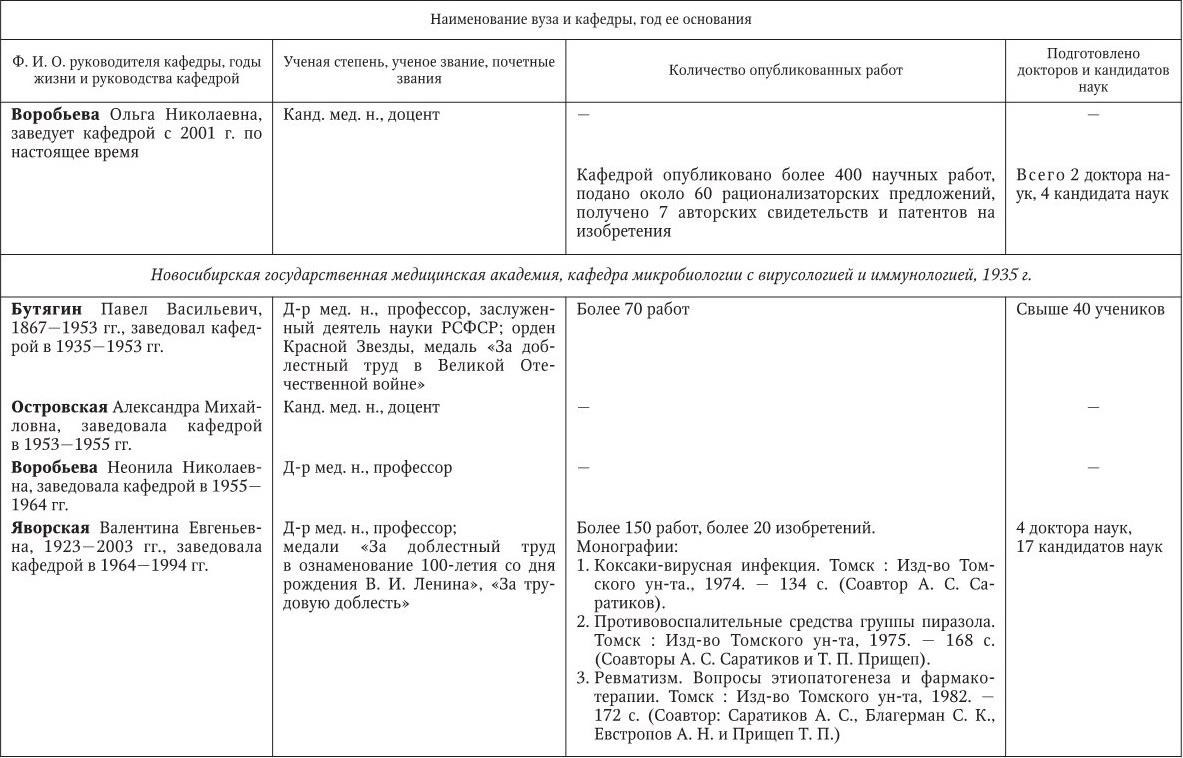
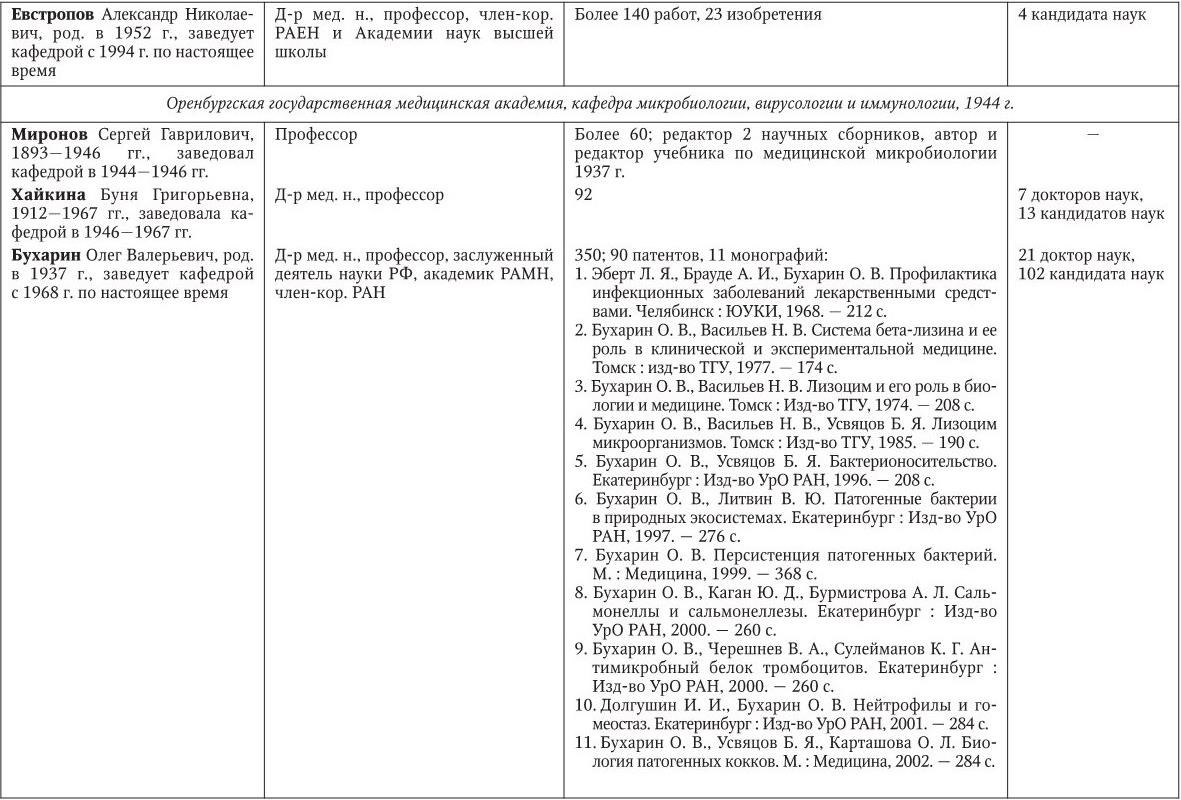
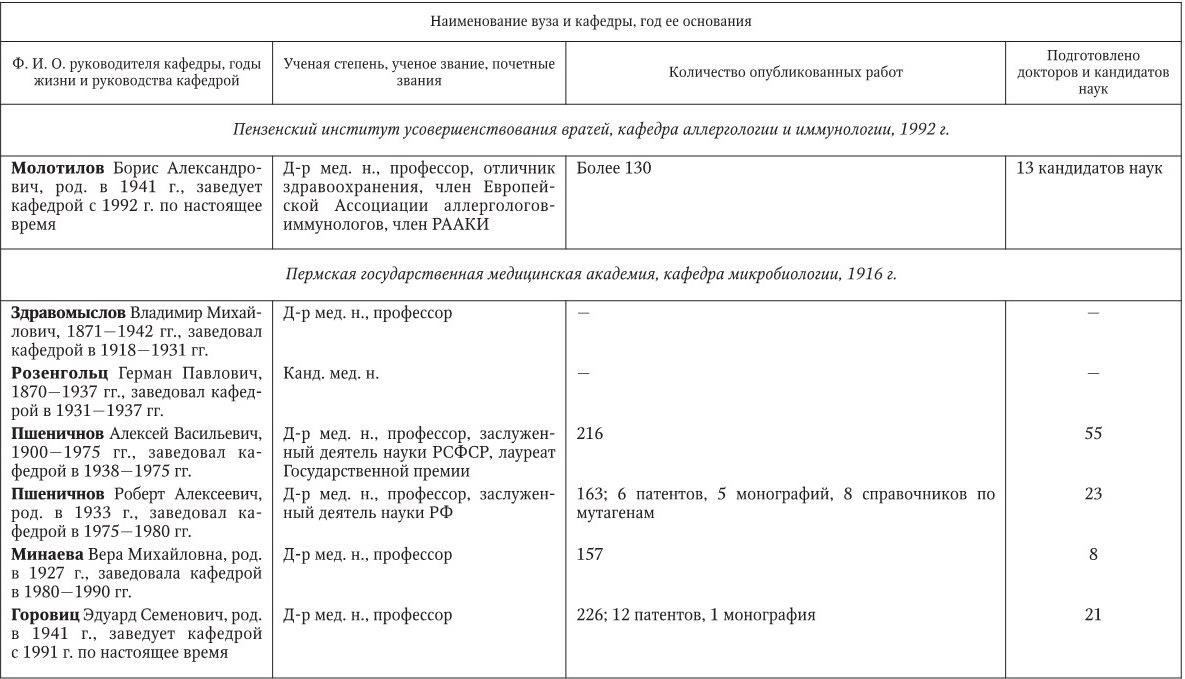

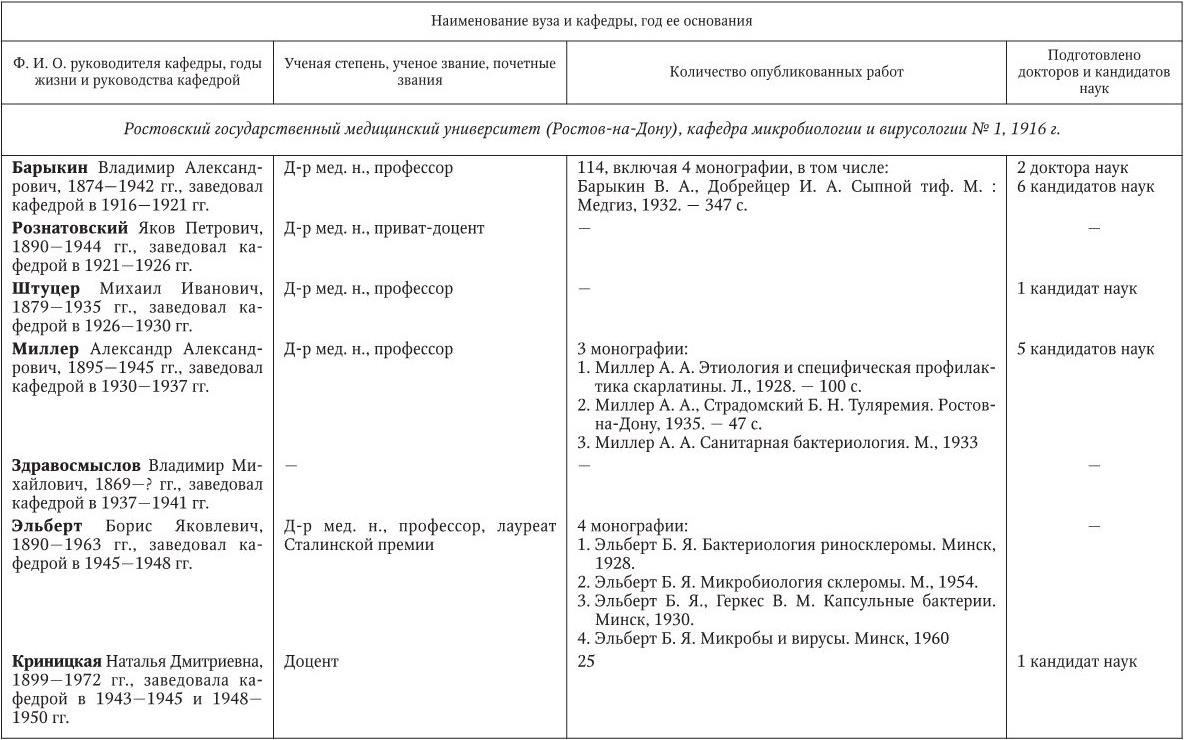




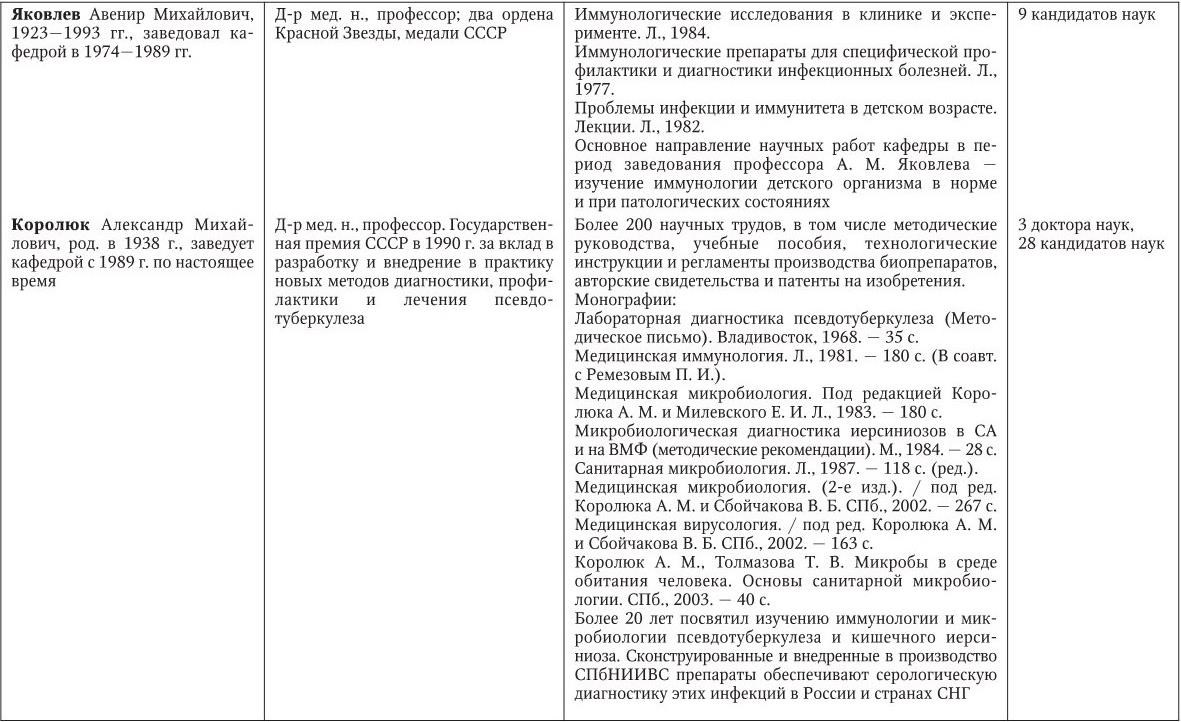
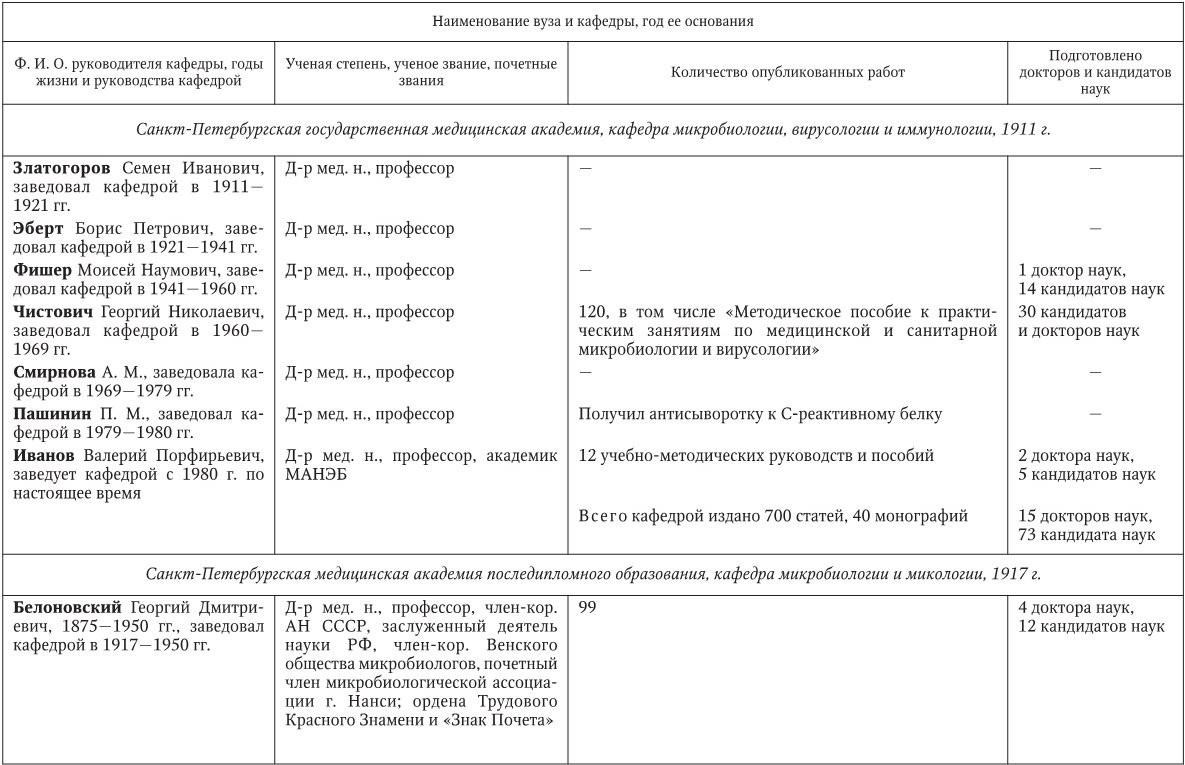
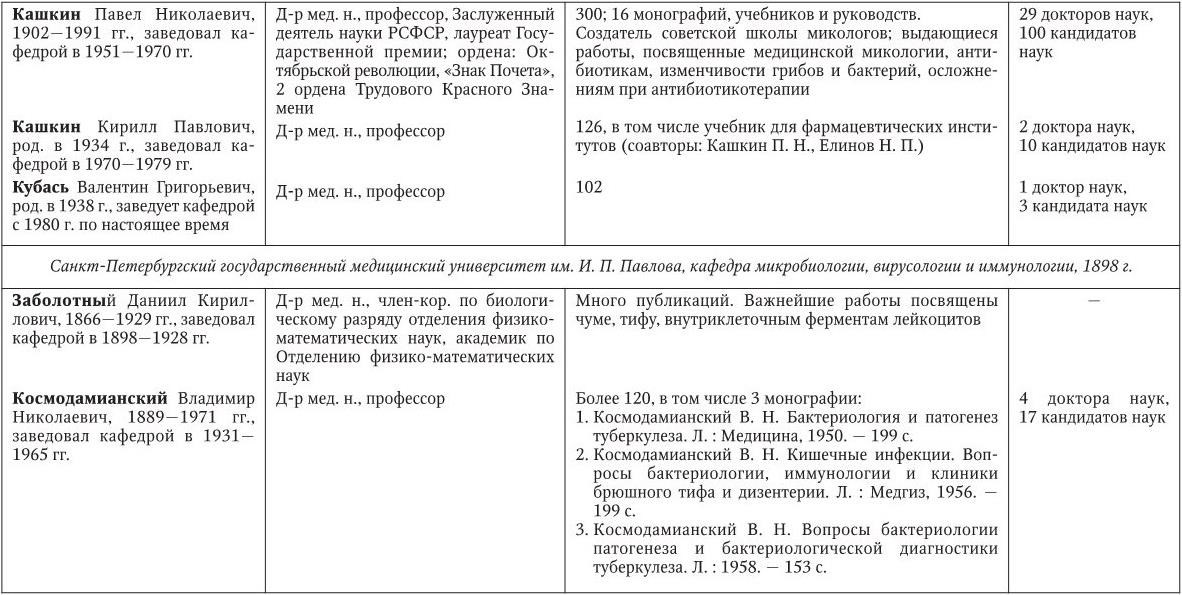
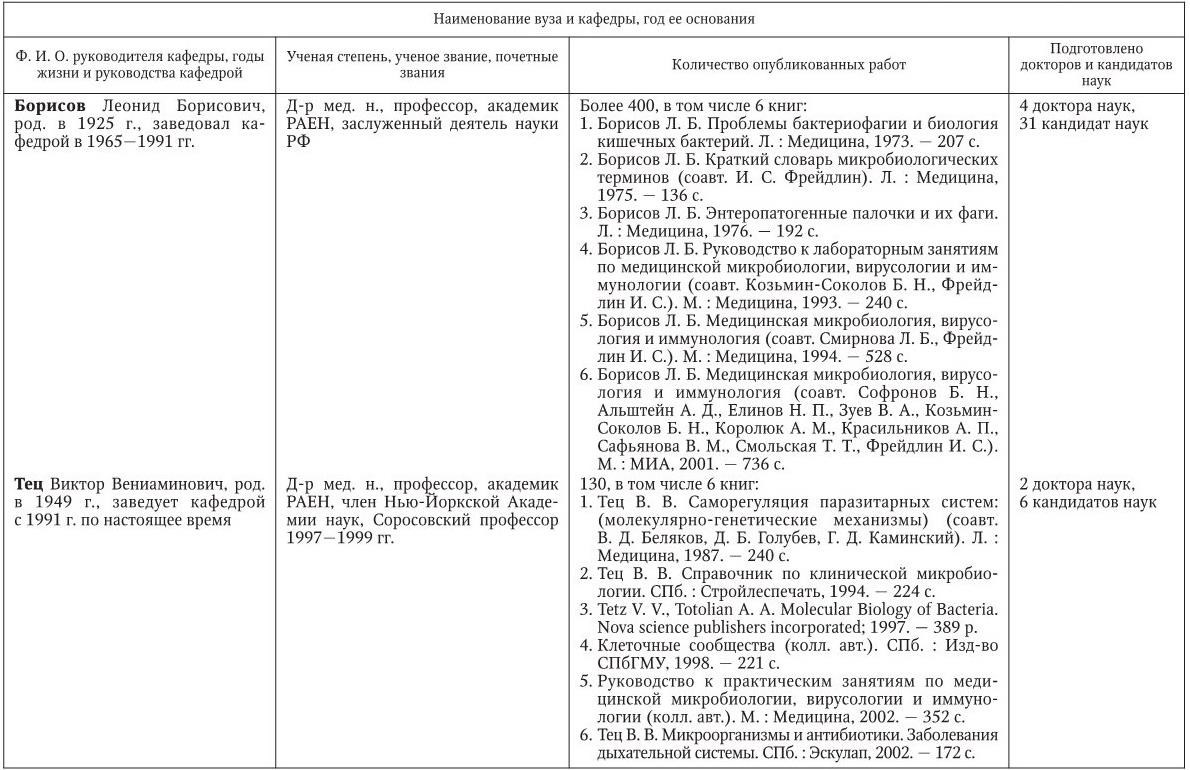
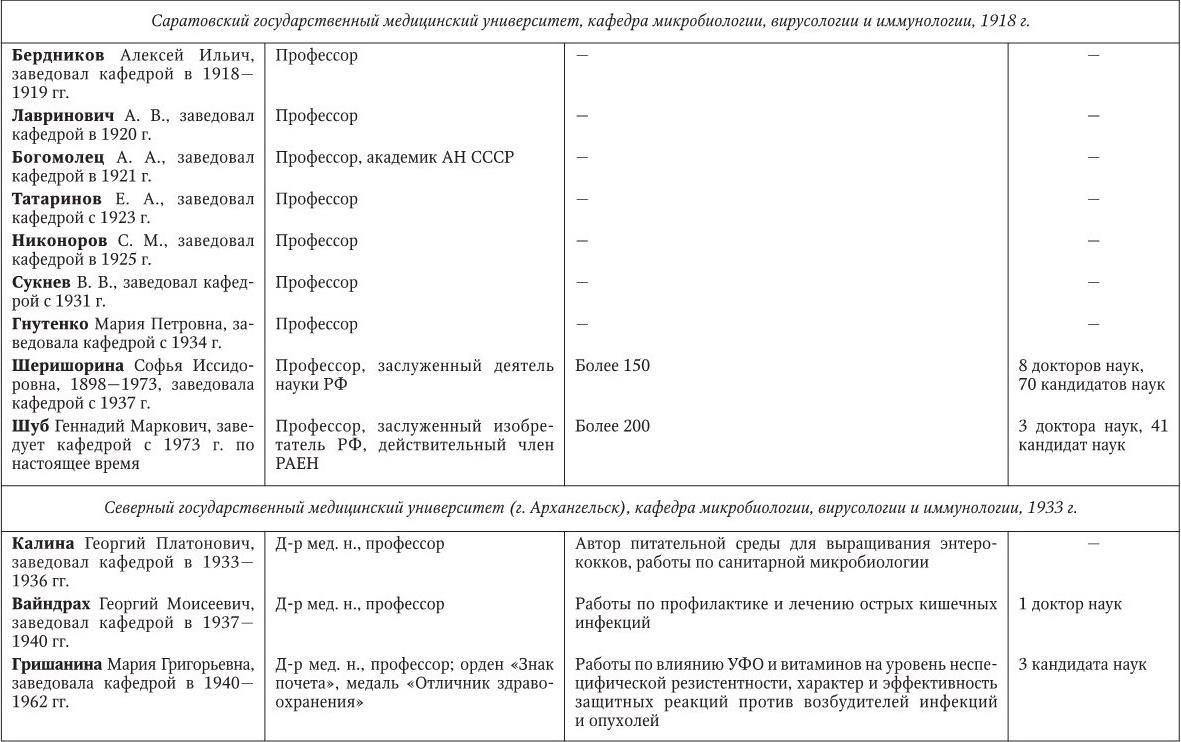
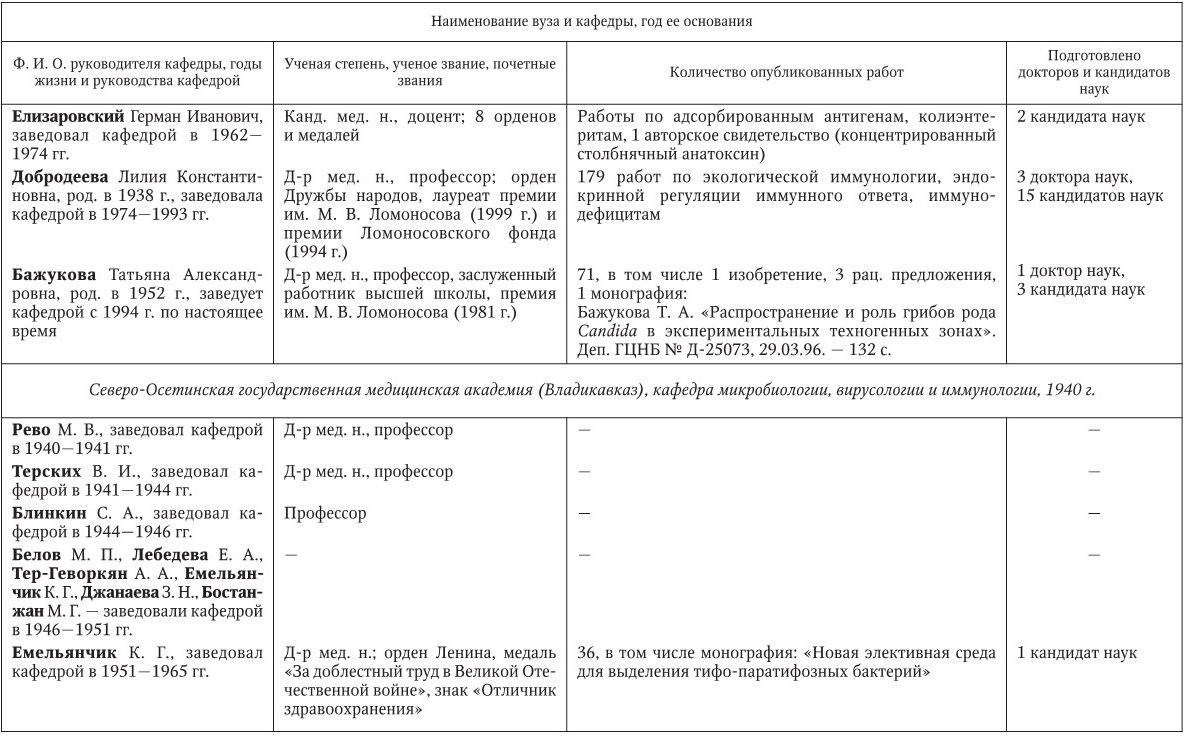
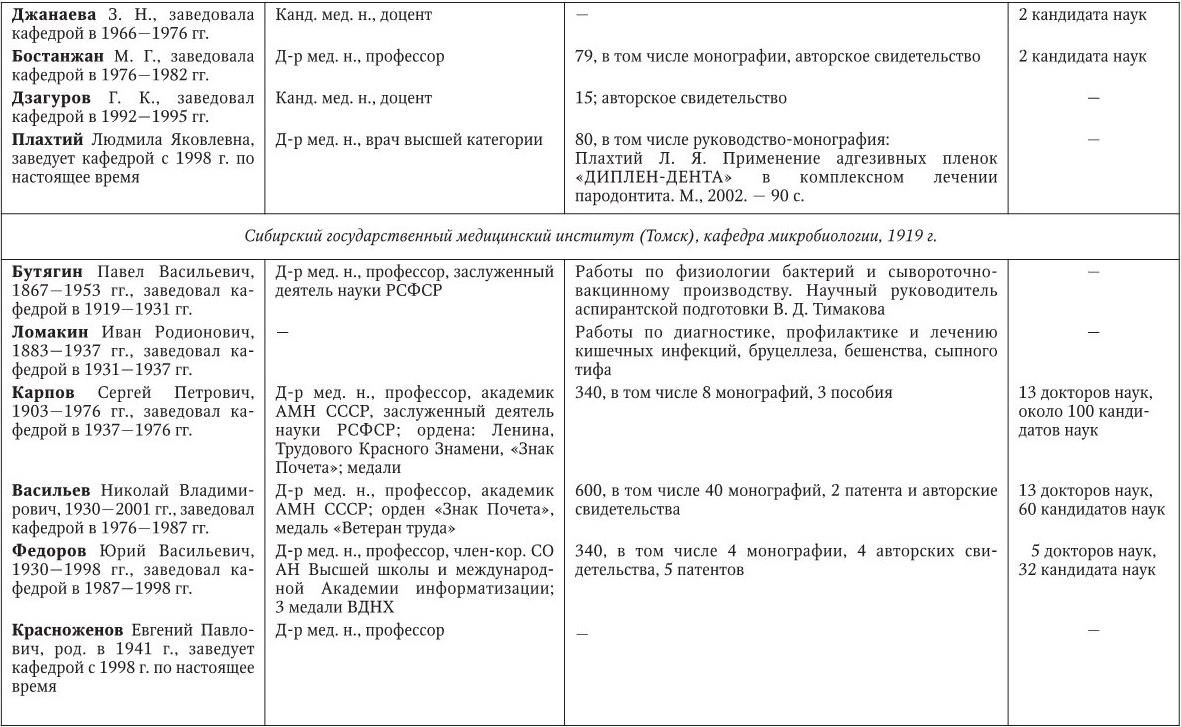
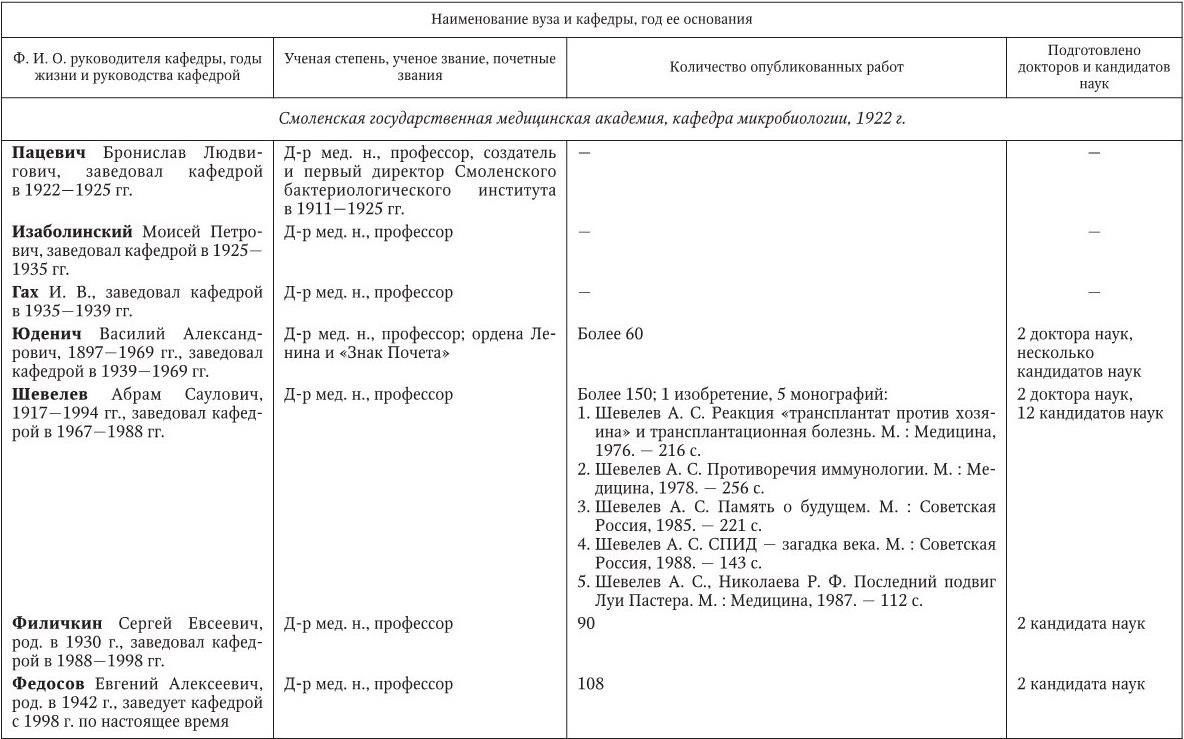
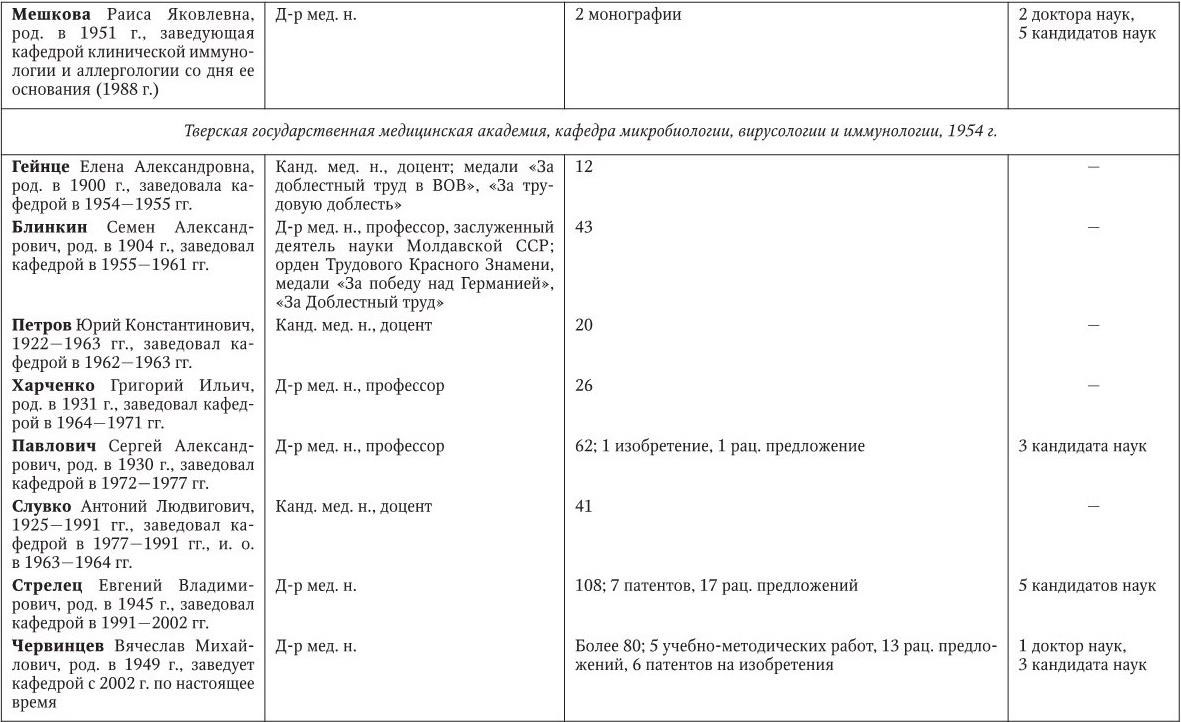
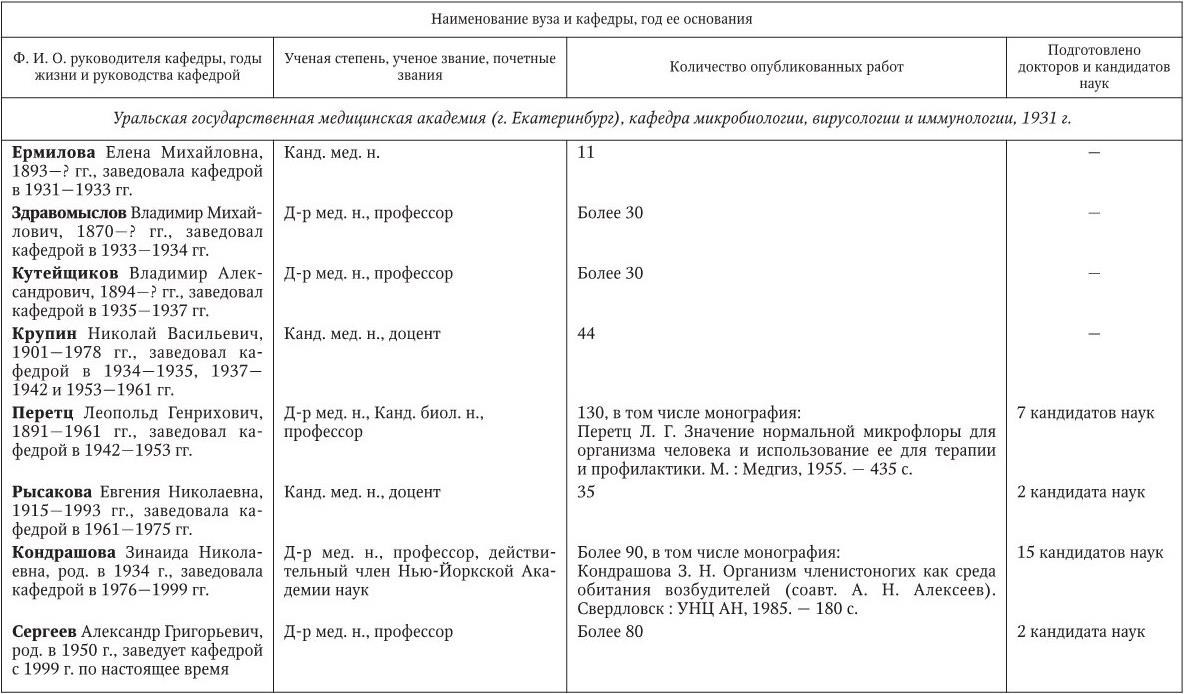
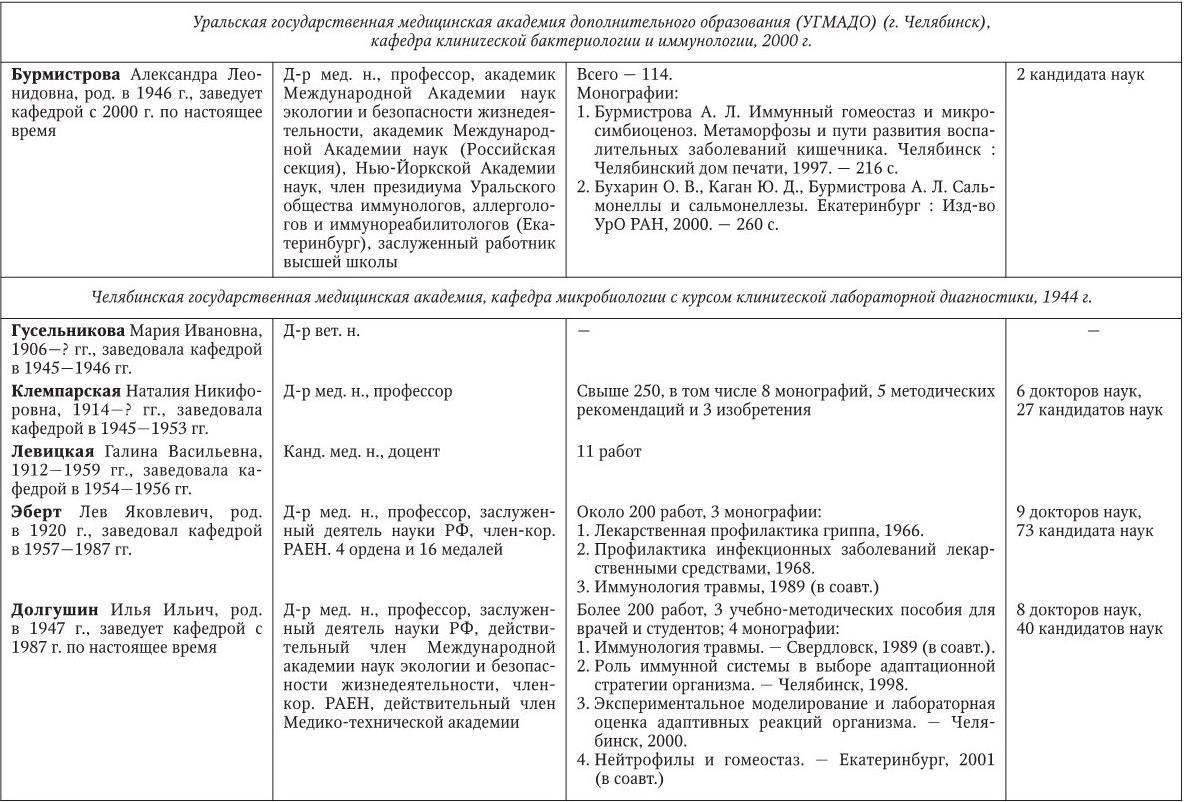
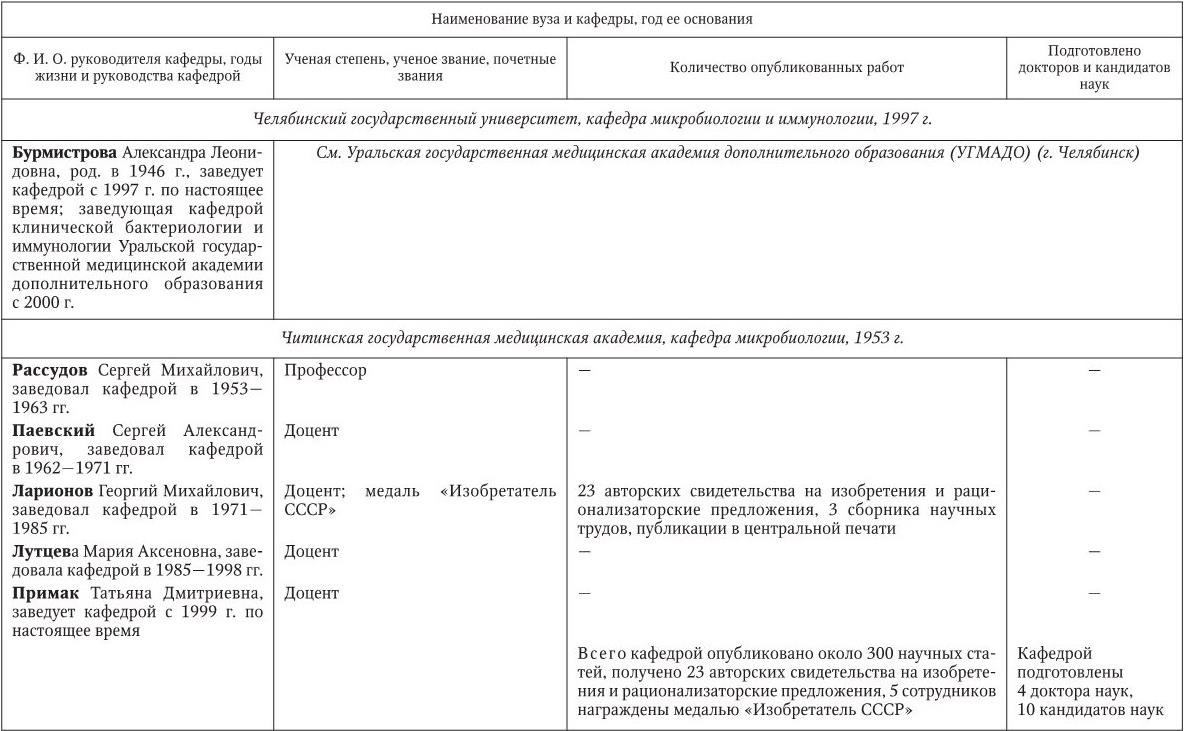

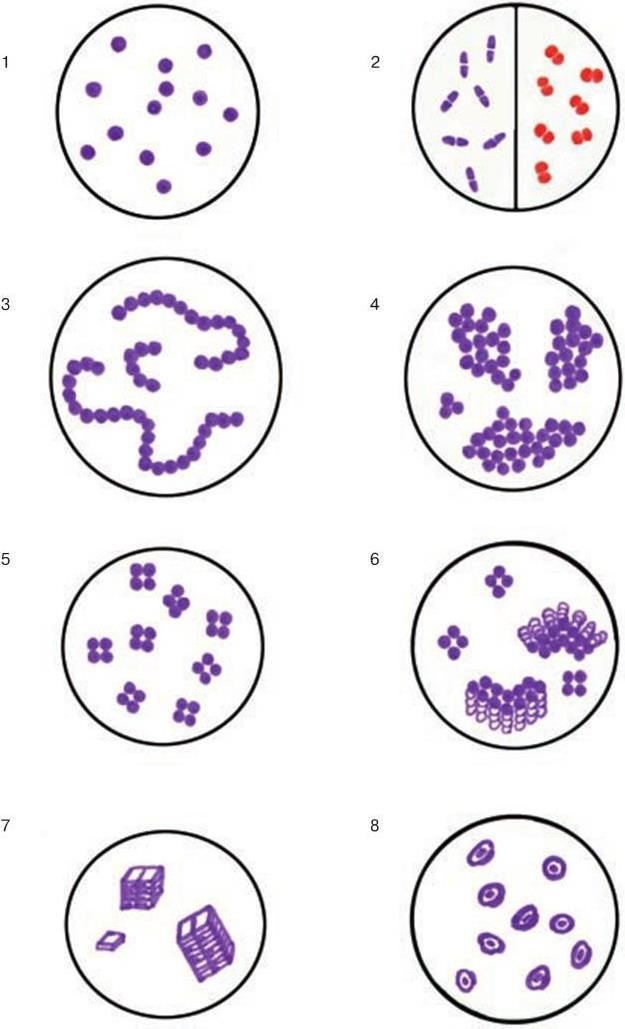
Рис. 1. Морфология бактерий:
1 – микрококки; 2 – диплококки; 3 – стрептококки; 4 – стафилококки; 5 – тетракокки; 6 – сарцины; 7 – квадратные бактерии; 8 – тарелкообразные бактерии
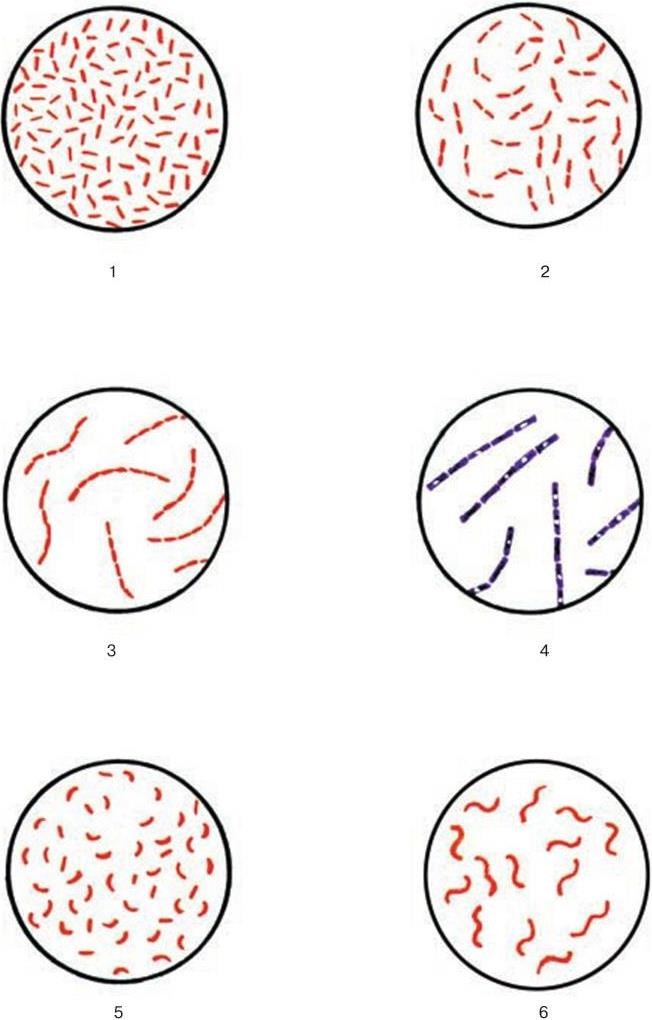
Рис. 2. Морфология бактерий:
1 – монобактерии; 2 – диплобактерии; 3 – стрептобактерии; 4 – стрептобациллы; 5 – вибрионы; 6 – спириллы
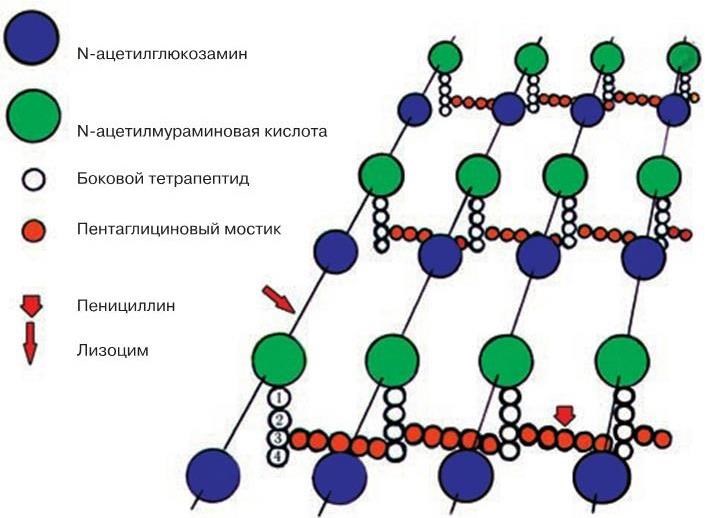
Рис. 4. Структура пептидогликана.
Стрелками указаны участки молекулы, атакуемые лизоцимом и пенициллином

Рис. 10. Капсулы бактерий.
Klebsiella pneumoniae. Окраска по методу Бурри–Гинса
Рис. 79. Методы обнаружения вирусов:
1 – реакция гемадсорбции; 2 – бляшкообразование
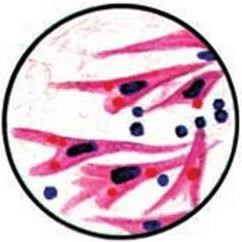
Рис. 89. Тельца Бабеша–Негри при бешенстве
Рис. 90. Вирус оспы:
1 – внутриклеточные включения (тельца Гварниери); 2 – тельца Пашена (вирус оспы, окрашенный специальным методом)
Рис. 92. Стафилококки и стрептококки:
а – мазки из гноя; б – мазки из чистых культур
Рис. 93. Рост стрептококков на кровяном агаре:
а – β-гемолиз; б – α-гемолиз
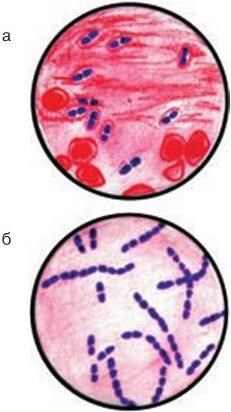
Рис. 94. Streptococcus pneumoniae:
а – мазок из мокроты больного; б – мазок из чистой бульонной культуры
Рис. 95. Yersinia pestis:
1 – в мазке из бубона; 2 – инволюционные формы; 3 – колонии Y. pestis; 4 – образование Y. pestis цепочек в бульоне
Рис. 96. Brucella melitensis (1) и Francisella tularensis (2) в чистых культурах
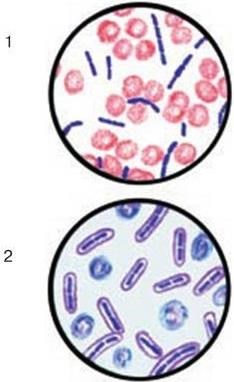
Рис. 97. Возбудитель сибирской язвы (Bacillus anthracis):
1 – в крови; 2 – образование капсул, мазок из селезенки
Рис. 99. Рост на среде Эндо:
а – Escherichia. coli; б – Salmonella typhi
Рис. 100. Брюшной тиф:
1 – поражение лимфатического аппарата тонкого кишечника; 2 – S. typhi – мазок из чистой культуры
Рис. 101. Vibrio cholerae:
1 – мазок из испражнений больного; 2 – локализация вибриона на слизистой тонкого кишечника
Рис 102. Возбудитель дифтерии:
1 – инволюционные формы; 2 – окраска по Нейссеру; 3 – окраска метиленовой синей; 4 – почки и надпочечники морской свинки: а – при дифтерийной интоксикации; б – нормальные

Рис. 104. Haemophilus influenzae. Мазок из мокроты больного. Окраска фуксином
Рис. 105. Clostridium tetani. Окраска спор по способу Меллера
Рис. 107. Mycobacterium tuberculosis:
1 – препарат-мазок (окраска по методу Циля – Нильсена); 2 – рост на плотной среде; 3 – рост на жидкой среде
Рис. 108. Mycobacterium leprae. Окраска по методу Циля–Нильсена
Рис. 109. Риккетсии:
1 – кокковидные; 2 – палочковидные; 3 – нитевидные и их дробление; 4 – размножение в цитоплазме эукариотических клеток
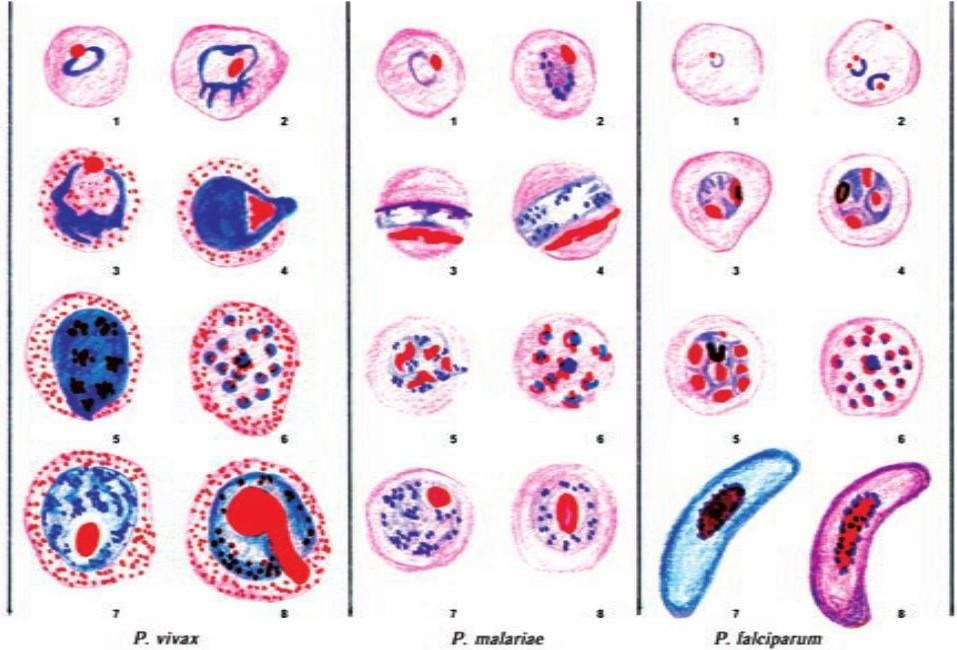
Рис. 117. Эритроцитарные формы плазмодиев человека.
P. vivax: 1 – юный шизонт (перстень); 2, 3, 4 – амебовидные шизонты; 5 – делящиеся шизонты; 6 – мерозоиты; 7 – женский гаметоцит; 8 – мужской гаметоцит.
P. malariae: 1 – юный шизонт (перстень); 2 – амебовидный шизонт; 3, 4 – лентовидные шизонты; 5 – делящийся шизонт; 6 – мерозоиты; 7 – женский гаметоцит; 8 – мужской гаметоцит.
P. falciparum: 1, 2 – юные шизонты (перстень); 3, 4 – амебовидные шизонты; 5 – делящийся шизонт; 6 – мерозоиты; 7 – женский гаметоцит; 8 – мужской гаметоцит
Рис. 119. Пространственная структура транскрипционного комплекса (по А. Л. Гнатту [и др.], 2001):
А. Распределение электронной плотности в молекулах нуклеиновых кислот. Слева – участок двухцепочечной ДНК В-формы из 16 пар оснований. Справа – гибрид между ДНК и РНК.
В. Сравнение свободной РНК-полимеразы (вверху) и транскрипционного комплекса (внизу). «Зажим» (показан оранжевым цветом) соединяет нити ДНК (одна нить зеленая, другая – синяя) и РНК (красная), которые связаны в щели над активным центром. Остальная часть белка РНК-полимеразы показана серым.
С. Транскрипционный комплекс. Части рибонуклеопротеидного блока 2 (Rpb2) с одной стороны щели не показаны, чтобы лучше были видны нуклеиновые кислоты. Основания упорядоченных нуклеотидов изображены в виде цилиндров, отходящих перпендикулярно оси цепи. Тонкая зеленая спираль представляет собой вспомогательный рабочий белок, который постоянно разделяет нити ДНК и сдвигает ее для копирования
1
Символы: + положительный признак; – отрицательный признак; D – различен у различных организмов.
2
ГВЧ – герпесвирусы человека.